Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1069-1084
Эффекты острого стресса у мышей, различающихся чувствительностью 5-НТ1А-рецепторов к хронической активации с помощью 8-OH-DPAT
Е. М. Кондаурова 1, *, Е. В. Антонов 1, Е. Ю. Баженова 1, Д. В. Базовкина 1, В. С. Науменко 1
1 Институт цитологии и генетики Сибирского отделения Российской академии наук
Новосибирск
Новосибирск, Россия
* E-mail: kond_em@bionet.nsc.ru
Поступила в редакцию 13.05.2020
После доработки 25.06.2020
Принята к публикации 05.07.2020
Аннотация
Недавно были созданы рекомбинантные линии мышей B6.CBA-D13Mit76C (B6-M76C) и B6.CBA-D13Mit76B (B6-M76B), различающихся чувствительностью 5-HT1A рецептора к хронической активации агонистом 8-OH-DPAT (8-гидрокси-2-(ди-н-пропиламино)тетралин). 5-HT1A рецептор является ключевым регулятором серотониновой (5-НТ) системы мозга, которая участвует в регуляции реакции на стресс. В данной работе было обнаружено, что острый эмоциональный стресс (40-минутное обездвижение) увеличивает экспрессию гена c-fos, являющего маркером реакции на стресс, в мозге мышей обеих линий. Вызванное стрессом увеличение экспрессии c-fos в стриатуме, гипоталамусе и коре мышей B6-M76C было более выраженным. Реакция на эмоциональный стресс привела к увеличению соотношения метаболита серотонина – 5-ГИУК (5-гидроксиинодолуксусная кислота) к 5-HT в среднем мозге и гиппокампе у обеих линий. Выявлено повышенное соотношение 5-ГИУК/5-HT в гипоталамусе B6-M76C и коре B6-M76B мышей после стресса. При этом реакция на стресс привела к снижению уровня норадреналина в гиппокампе и гипоталамусе у B6-M76C мышей. Уровни дофамина, норадреналина, адреналина и соотношения дофамин/норадреналин в надпочечниках возросли в ответ на стреcсирующее воздействие только у мышей B6-M76C. Настоящее исследование показало, что у мышей линии B6-M76C симпатоадреналовая система более чувствительна к действию острого стресса. Реакция на стресс у B6-M76C мышей приводит к увеличению содержания норадреналина и адреналина в ткани надпочечника. Повышение отношения дофамин/норадреналин в надпочечнике может свидетельствовать о более быстром превращении промежуточных продуктов биосинтеза катехоламинов (дофамин) в норадреналин и далее в адреналин вследствие ускорения биосинтетического процесса в ответ на стресс у мышей B6-M76C. Кроме того, была показана повышенная чувствительность нейронов гипоталамуса к действию стресса у животных линии B6-M76C. Таким образом, мыши B6-M76C представляют значительный интерес для изучения гипоталамо-гипофизарно-надпочечниковой системы с гиперактивным ответом на стресс, и могут способствовать выявлению новых биомаркеров заболеваний, связанных со стрессом.
Стресс – совокупность всех неспецифических реакций организма [1], возникающих в ответ на действие стрессора, которым является всякое достаточно сильное (не обязательно экстремальное) воздействие – тепло, холод, болевые раздражения, эмоциональное воздействие и другие. Психоэмоциональный стресс является одним из основных факторов риска множества заболеваний. Центральная нервная система и нейроэндокринные регуляторные контуры (симпатоадреналовая система и гипоталамо-гипофизарно-надпочечниковая система (ГГНС)) реализуют реакцию организма на стресс. Симпатоадреналовая система обеспечивает быстрый ответ организма на стрессирующие обстоятельства. В свою очередь, активация ГГНС является одним из наиболее ярких проявлений реакции организма на продолжительное воздействие стресса. Именно ГГНС отводится особая роль, так как при длительном воздействии стрессорной ситуации относительно стойкий адаптивный эффект может трансформироваться в повреждающий [2]. Влияние стресса на ГГНС приводит к повышенной секреции глюкокортикоидов надпочечниками [3, 4]. Реакция на стресс со стороны симпатоадреналовой системы – повышение уровня катехоламинов – дофамина (ДА), норадреналина (НА), адреналина (А). Стресс вызывает высвобождение катехоламинов из надпочечников, симпатической нервной системы и катехоламинергических нейронов в мозге [5, 6]. Реакция на стресс сопровождается увеличением экспрессии гена быстрого ответа c-fos в нейронах головного мозга, который используется в качестве маркера нейрональной активности после воздействия стрессовых стимулов [7]. Известно, что стрессовая реакция, а также связанное с ней поведение находятся под контролем нейротрансмиттеров мозга. В связи с этим особое внимание привлекают классические нейромедиаторы – норадреналин и серотонин (5-HT).
Норадренергическая система действует как система возбуждения и оповещения, усиливая сенсомоторные функции и обостряя реакции на важные внешние раздражители [8, 9]. Норадренергическая система находится во взаимодействии с ГГНС, что определяет ее важную интегративную функцию в преодолении стресса и адаптации к нему [10, 11]. Неспособность надлежащим образом инициировать или регулировать реакцию на стресс была предложена в качестве критического фактора в патофизиологии различных расстройств, связанных со стрессом [10, 12]. Нарушения регуляции норадренергической нейротрансмиссии вовлечены в связанные со стрессом психические заболевания, такие как депрессия, посттравматическое стрессовое расстройство и другие тревожные расстройства [13–15].
Серотониновая система мозга принимает участие во многих формах поведения [16], нейроэндокринной регуляции [17] и реакции на стресс [18–20]. Нейрохимические и электрофизиологические исследования показали, что нервная возбудимость 5-НТ системы чувствительна к действию стресса. Последствиями такой чувствительности могут являться однократная спайковая активность 5-НТ нейронов и изменения активности рецепторов, локализованных на этих нейронах. Стресс также оказывает влияние на синтез, внутриклеточный перенос, деградацию и обратный захват моноаминов, таким образом воздействуя на процессы нейротрансмиссии [21]. Острое воздействие стресса отражается на активности 5-HT системы мозга. 5-HT система играет важную роль в центральной регуляции нейроэндокринной реакции на стресс. Серотонин, действующий через различные типы рецепторов, является мощным активатором ГГНС. Так, хорошо известно прямое синаптическое взаимодействие серотонинергических аксонов с нейронами, вырабатывающими кортикотропин-рилизинг-гормон, в гипоталамусе [22–24]. Среди многочисленных подтипов 5-НТ рецепторов – 5-НТ1А рецептор, связанный с Gi белком, является одним из наиболее изучаемых в связи с исследованиями основ болезней настроения [21]. Эти рецепторы могут локализоваться как пост-, так и пресинаптически. Активность 5-НТ нейронов дорсального ядра шва негативно регулируется этими рецепторами, которые локализуются в соматодендритных компартментах (пресинаптические аутоингибирующие рецепторы) 5-НТ нейронов [25–27]. Предполагается, что снижение активности 5-HT1A рецепторов является важным фактором патогенеза тревожных и депрессивных расстройств [28, 29]. Линия мышей с нарушенной активностью 5-HT1A ауторецепторов (но не постсинаптических рецепторов) продемонстрировали изменения в стрессовых реакциях, поведенческом отчаянии и ответе на антидепрессанты, но без различий в тревожном поведении [30].
Предварительное введение антагониста 5-HT1A рецепторов перед воздействием на крыс однократным стрессом уменьшало уровень кортикотропин-рилизинг-гормона. 5-HT1A рецепторы также влияют на функционирование отрицательной обратной связи в ГГНС, снижая уровни экспрессии гена и белка глюкокортикоидного рецептора [31].
В одном из исследований [32] было показано, что крысы линии, выведенной путем отбора на отсутствие агрессии по отношению к человеку (ручные крысы) [33], демонстрируют сниженную реакцию на стресс со стороны ГГНС в отличие от линии крыс, которых отбирали на усиление агрессии по отношению к человеку (агрессивные крысы). При этом значительное снижение плотности 5-HT1A рецептора было показано в гипоталамусе, фронтальной коре и амигдале агрессивных крыс по сравнению с ручными крысами. Эти изменения сопровождались значительным снижением экспрессии гена 5-HT1A рецептора в среднем мозге, где локализованы тела серотонинергических нейронов [34].
У мышей рекомбинантной линии B6-M76C (см. раздел методы исследований) наблюдается сниженный катаболизм 5-HT в гиппокампе и повышенная экспрессия гена 5-HT1A рецептора по сравнению с мышами B6-M76B [35].
Однократное введение агониста 5-HT1A рецептора 8-OH-DPAT приводило к дозозависимой гипотермии и снижению двигательной активности как у мышей линии B6-M76C, так и у мышей линии B6-M76B. Острая инфузия 8-OH-DPAT на фоне умеренного хронического введения этого препарата снижала температуру тела у мышей линии B6-M76B, но не у мышей B6-M76C. Иными словами, хронические введение 8-OH-DPAT купирует гипотермический эффект однократного введения 8-OH-DPAT только у мышей линии B6-M76C [35]. Известно, что стимуляция центральных постсинаптических 5-HT1A рецепторов увеличивает, в частности, синтез оксида азота на периферии, что обуславливает расширение поверхностных сосудов и, следовательно, повышение теплоотдачи [36]. Это дает основания полагать, что хроническая активация постсинаптических 5-HT1A рецепторов у мышей линии B6-M76C привела к их более эффективной десенсибилизации по сравнению с мышами линии B6-M76B.
Хроническое введение 8-OH-DPAT вызывало значительное увеличение показателей двигательной активности только у мышей B6-M76B. Мыши линии B6-M76C, в свою очередь, не продемонстрировали изменений в показателях двигательной активности в ответ на продолжительное введение 8-OH-DPAT. Поскольку пресинаптические 5-HT1A рецепторы важны для регуляции двигательной активности [37], наши данные позволили предположить, что чувствительность пресинаптических 5-HT1A рецепторов снижена у мышей линии B6-M76C [35].
Кроме того, мыши линии B6-M76C характеризовались уменьшенным объемом всего мозга и уменьшенными размерами стриатума, мозжечка и гипофиза по сравнению с мышами B6-M76B [38]. Известно, что изменения объема гипофиза связаны с повышенной уязвимостью к психическим расстройствам [39]. Также мыши линии B6-M76C показали пониженную экспрессию гена Bdnf (brain derived neurotropic factor) в гипоталамусе и повышенную экспрессию гена Arc (аctivity-regulated cytoskeleton-associated protein) в стриатуме после действия стресса по сравнению с контрольной группой [38]. Эти гены считаются генами раннего реагирования, играют важную роль в активности нервной системы и тесно связаны с поведенчески-индуцированной пластичностью нейронов [40, 41]. Однако концентрация кортикостерона в плазме крови достоверно не отличалась у мышей линий B6-M76B и B6-M76C ни в покое, ни при стрессе [38].
Целью настоящего исследования было изучение реакции на эмоциональный стресс у мышей линий B6-M76C и B6-M76B. Для этого необходимо было определить ответ нейронов на стресс посредством оценки уровня экспрессии гена c-fos в среднем мозге, гиппокампе, стриатуме, гипоталамусе и префронтальной коре головного мозга. Затем мы сравнили содержание НА, А и ДА в ткани надпочечников в покое и при стрессе у мышей обеих линий. Было вычислено соотношение ДА/НА с целью оценить активность фермента дофамин-бета-гидроксилазы (DβH) в мозговом веществе надпочечников у исследуемых линий. Было измерено содержание НА, 5-НТ и 5-ГИУК, а также вычислен индекс катаболизма серотонина – отношение 5-ГИУК/5-HT в среднем мозге, гиппокампе, стриатуме, гипоталамусе и префронтальной коре у мышей данных линий.
МЕТОДЫ ИССЛЕДОВАНИЯ
Создание линий. На основе генома мышей линии C57BL/6 (B6) были созданы новые рекомбинантные линии мышей: линия B6.CBA-D13Mit76C (B6-M76C) была получена рекомбинантным переносом дистального фрагмента хромосомы 13 (102.73–110.56 Мпн) из генома склонной к каталепсии линии CBA в геном линии B6. Данный фрагмент содержит ген, кодирующий 5-HT1A рецептор. Линия B6.CBA-D13Mit76B (B6-M76B) является контрольной и содержит в геноме фрагмент хромосомы 13 (102.73–110.56 Мпн) от линии B6, устойчивой к каталепсии [42–44]. Самцы, выведенные ранее в лаборатории нейрогеномики поведения (Новосибирск, Россия), склонной к каталепсии рекомбинантной линии AKR.CBA-D13Mit76С, содержащей фрагмент, полученный из CBA на геноме линии AKR [44], и самки инбредной линии B6 были скрещены для получения гибридов первого поколения (F1). Последние использовались для создания рекомбинантных линий, использованных в данной работе. Рекомбинантные линии B6-M76C и B6-M76B были получены путем восьми последовательных обратных скрещиваний гибридов F1 с линией B6. Перенос полученного от CBA линии фрагмента хромосомы 13 в геном B6 контролировали с использованием трех полиморфных микросателлитных маркеров D13Mit287 (102.73 Мпн), D13Mit76 (110.56 Мпн) и D13Mit78 (118.83 Мпн). Гетерозиготные бэккроссы восьмого поколения были скрещены между собой для получения линий B6-M76C и B6-M76B, содержащих соответственно CBA- и B6 аллели маркеров D13Mit287 и D13Mit76, и AKR- и B6-аллели маркеров D13Mit78 в геноме B6 соответственно [35].
Животные. Исследования проводили на взрослых (10–12 нед.) самцах мышей линий B6-M76C и B6-M76B. Животных содержали в группах по 7–8 особей на клетку размером 40 × 25 × 15 см в стандартных условиях (20–22°С, доступ к корму и воде ad libitum, 12-часовой цикл свет/темнота). За два дня до экспериментов мышей взвешивали (около 23 г) и рассаживали в отдельные клетки для устранения группового эффекта.
В эксперименте мышей каждого генотипа разделяли на две группы (контроль и стресс) (n = 6–10 на группу). Мыши экспериментальной группы подвергались эмоциональному стрессу (помещение в тубус для рестрикции) в течение 40 мин. Мышей мгновенно декапитировали после воздействия стресса. Структуры головного мозга (префронтальная кора, гиппокамп, стриатум, средний мозг и гипоталамус) были выделены для измерения влияния стресса и генотипа на экспрессию гена c-fos, уровень моноаминов и норадреналина. Образцы надпочечников были выделены для измерения уровня катехоламинов. Все выделенные структуры мозга и надпочечники были немедленно заморожены в жидком азоте и затем перенесены в морозильную камеру на –80°С, где хранились до проведения измерения уровня катехоламинов (НА, А и ДА) в надпочечниках, 5-НТ, 5-ГИУК, НА и экспрессии гена c-fos в мозге.
Все экспериментальные процедуры соответствовали Директиве National Institute of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80023, 1996) для экспериментов на животных и были одобрены комиссией по биоэтике ФИЦ ИЦиГ СО РАН.
Эмоциональный стресс. Для индукции эмоционального стресса мышей помещали на 40 мин в небольшую цилиндрическую металлическую тубу (8.5 × 5 см) с 48-ю вентиляционными отверстиями диаметром 0.4 см. Ограничительное устройство позволяло мышам вытягивать лапы, но не двигаться внутри.
Выделение общей РНК. Общую РНК экстрагировали тризолом по протоколу производителя (Bio Rad, США). Осадок РНК растворялся в воде, обработанной диэтилпирокарбонатом с добавлением ДНК-азы по протоколу производителя (RNase free DNase, Promega, США, 1000 о.е./мл). Оптическая плотность РНК была измерена на спектрофотометре (Nanodrop, США). РНК разводилась водой до концентрации 0.125 мкг/мкл и хранилась при –80°С. Присутствие примесей геномной ДНК в препаратах РНК определяли в соответствии с протоколом, описанным ранее [45, 46].
Реакция обратной транскрипции. Общая РНК (8 мкл, или 1 мкг) была смешана со 180 нг статистического праймера длиной 6 нуклеотидов (конечная концентрация праймера составила 5 мкМ) и 2.25 мкМ стерильного 1М KCl в объеме 16 мкл, денатурирована при 94°C в течение 5 мин на амплификаторе БИС М-120 (БИС-Н, Россия), затем добавлялось 15 мкл смеси, содержащей обратную транскриптазу MuMLV (Биосан, Россия) (2000 ед.), 0.5 М Tris-HCl (pH 8.3, 0.63 мкл), смесь трифосфатов 4мM (3.63 мкл), дитиотреитол 0.1 М (2.25 мкл), 0.1 М MnCl2 (0.3 мкл) и 8 мкл воды, обработанной диэтилпирокарбонатом. Полученная смесь (конечным объемом 31 мкл) была инкубирована при 41°C в течение 60 мин. Синтезированная кДНК хранилась при температуре –20°C [47].
Полимеразная цепная реакция в реальном времени (real-time PCR). Праймеры, используемые для амплификации кДНК исследуемых генов (табл. 1), разработаны на основе последовательностей, опубликованных в базе данных EMBL Nucleotide database, и синтезированы в компании Биосан (Новосибирск, Россия). 1 мкл кДНК смешивали с 2.5 мкл ПЦР-буфера (содержит интеркалирующий краситель SYBR green I и референсный краситель ROX), 2.5 мкл 2.5 мМ dNTP, 2.5 мкл 25 мМ MgCl2, 2.5 мкл смеси праймеров (прямого и обратного), 0.2 мкл Taq ДНК-полимеразы и стерильной воды до конечного объема 20 мкл. При приготовлении реакционной смеси были использованы наборы реагентов Синтол (Москва, Россия). ПЦР была проведена на амплификаторе LightCycler 480 System (Roche, Швейцария) в соответствии со следующим протоколом: 3 мин 94°C, 1 цикл; 10 с при 94°C, 30 с при соответствующей температуре отжига (табл. 1), 30 с при 72°C, 40 циклов. Серия разведений геномной ДНК с концентрацией 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32, 64 нг/мкл амплифицировалась одновременно в отдельных пробирках и использовалась как внешний экзогенный стандарт для построения калибровочной кривой. Калибровочная кривая в координатах Ct (значение порогового цикла) – logP (десятичный логарифм количества стандарта ДНК) была построена автоматически программным обеспечением LightCycler 480 System. Экспрессия генов представлена как отношение количества кДНК исследуемых генов к 100 копиям кДНК rPol2 (ген, кодирующий ДНК-зависимую-РНК-полимеразу II), выполняющей функцию внутреннего стандарта [45–47].
Таблица 1.
Последовательности праймеров, температуры отжига и длина продукта ПЦР Table 1. The primer sequences, annealing temperatures and PCR-product length
| Ген (Gene) |
Последовательность праймера Gene Sequence |
Температура отжига, °C Annealing temperature, °C |
Длина продукта, пн Product length, bp |
|---|---|---|---|
| c-fos | F5'-aaagagaaggaaaaactggag-3' R5'-cggaaacaagaagtcatcaa-3' |
58 | 264 |
| rPol2 | F5'-tgtgacaactccatacaatgc-3' R5'-ctctcttagtgaatttgcgtact-3' |
60 | 194 |
Экстракция тканей. Структуры головного мозга и надпочечников гомогенизировали в гомогенизаторе Potter-Elvehjem в 200 мкл 0.6 М HClO4 (Sigma-Aldrich, США), содержащего 200 нг/мл изопротеренола (Sigma-Aldrich, США) в качестве внутреннего стандарта. Гомогенат центрифугировали при 12000 g в течение 15 мин при 4°C для осаждения белка. Супернатанты разбавляли в два раза сверхчистой водой и фильтровали с использованием центрифужной пробирки с 0.22 мкм ацетатцеллюлозным фильтром (Spin-X®, США). Осадок хранили при –20°С до количественного определения белка по методу Брэдфорда [48]. Двадцать мкл отфильтрованного супернатанта вводили в петлю системы высокоэффективной жидкостной хроматографии (ВЭЖХ).
Протокол ВЭЖХ. Уровни НА, 5-HT, 5-ГИУК были проанализированы в структурах головного мозга, уровни А, НА, ДА определялись в тканях надпочечников. Анализ биогенных аминов был выполнен с использованием системы ВЭЖХ, содержащей следующие компоненты: электрохимический детектор (750 мВ, DECADE IITM; Antec, Нидерланды), проточный элемент из стеклоуглерода (ячейка VT-03, 3 мм GC sb; Antec, Нидерланды), системный контроллер CBM-20A, блок подачи растворителя LC-20AD, автоматический пробоотборник SIL-20A и дегазатор DGU-20A5R (Shimadzu Corporation, США). Хроматографическое разделение веществ осуществляли в изократическом режиме элюирования при скорости потока 0.6 мл/мин на колонке C18 (размер частиц 5 мкм, L × ID 75 × 4.6 мм, Luna, Penomenex, США), защищенной предколонкой C8 (Penomenex, США). Подвижная фаза состояла из 90% буфера, содержащего 50 мМ дигидроортофосфата калия (Sigma Aldrich, США), 1.4 мМ натриевой соли октансульфоновой кислоты (Chimmed, Россия) и 0.05 мМ этилендиаминтетрауксусной кислоты (Sigma Aldrich, США) рН 3.9, и 10% метанола (Chimmed, Россия). Температура колонки стабилизировалась при 40°С. Количества (нг) веществ рассчитывали относительно известного количества внутреннего стандарта. Содержание веществ выражали в нг исследуемого вещества на мг общего белка, определенного по методу Бредфорда.
Статистический анализ. Все значения были представлены как среднее значение ± ± стандартная ошибка среднего (m ± SEM) и сравнивались двухфакторным анализом ANOVA (факторы – генотип и стресс) (B6-M76B против B6-M76C) и (интактные против стрессированных), затем следовал post-hoc анализ по Фишеру. Статистическая значимость была установлена на уровне р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
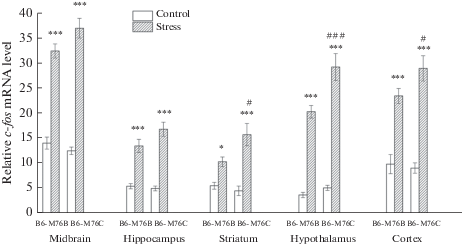
Экспрессия гена c-fos. Острый стресс привел к значительному увеличению экспрессии гена c-fos во всех исследованных структурах мозга (рис. 1). Мы обнаружили влияние взаимодействия генотип × стресс на экспрессию гена c-fos в среднем мозге (F1.26 = 4.73, p < 0.05, эффект стресса F1.26 = 216.41, p < 0.001). В гиппокампе был выявлен только эффект стресса (F1.25 = 77.58, р < 0.001). В стриатуме наблюдалось влияние взаимодействия генотип × стресс (F1.23 = 4.27, р = 0.05) и влияние стресса (F1.23 = 26.38, р < 0.001) на экспрессию гена c-fos. Реакция на острый стресс привела к увеличению экспрессии гена c-fos в мозге мышей обеих линий по сравнению с соответствующими контрольными группами, однако у мышей B6-M76C после воздействия стресса была обнаружена более высокая экспрессия гена c-fos по сравнению с мышами B6-M76B (p < 0.05) (рис. 1). В гипоталамусе был найден эффект взаимодействия генотип × стресс (F1.24 = 4.80, р < 0.05), стресса (F1.24 = 141.67, р < 0.001) и генотипа (F1.24 = 9.15, р < 0.001). Мыши B6-M76C продемонстрировали более высокую экспрессию гена c-fos по сравнению с мышами B6-M76B (p < 0.001) после воздействия острого стресса (рис. 1). Не было обнаружено какого-либо эффекта взаимодействия генотип × стресс (F1.26 = 2.83, р = 0.10) в префронтальной коре, но было выявлено влияние стресса (F1.26 = 80.39, p < 0.001). Вызванное стрессом увеличение экспрессии гена c-fos в префронтальной коре мышей B6-M76C было выше по сравнению с мышами B6-M76B (p < 0.05) (рис. 1).
Рис. 1.
Экспрессия гена c-fos в структурах мозга контрольных и стрессированных мышей линий B-6‑M76C и B6-M76B. Экспрессия гена представлена в виде количества копий кДНК относительно 100 копий кДНК rPol2, n ≥ 8 для каждой группы. Все значения представлены как среднее ± ошибка среднего. *** р < 0.001; * р < 0.05 по сравнению с контрольными мышами той же линии; ### р < 0,001; # р < 0.05 по сравнению с мышами линии B6-M76B, подвергнутыми стрессу. Fig 1. c-fos gene expression in the brain structures of control and stressed B6-M76C and B6-M76B mice. Gene expression is presented as the number of cDNA copies with respect to 100 cDNA copies of rPol2 , n ≥ 8 for each group. All values are presented as mean ± SEM. *** p < 0.001; * p < 0.05 compared to control not stressed mice of the same line, ### p < 0.001; # p < 0.05 compared B6-M76B stressed mice.
Уровни А, НА, ДА в надпочечниках. Острый стресс значительно повлиял на функционирование надпочечников. Уровни ДА (эффект взаимодействия генотип × × стресс F1.26 = 6.89, р < 0.05), НА (эффект генотипа F1.26 = 6.89, p < 0.05), А (эффект генотипа F1.26 = 8.82, р < 0.01) в надпочечниках увеличились после стресса только у мышей B6-M76C по сравнению с соответствующей контрольной группой. Также было выявлено влияние стресса на соотношение ДА/НА (F1.26 = 7.51, p < 0.01), косвенно отражающее активность дофамин-бета-гидроксилазы, превращающей ДА в НА. Острый стресс привел к увеличению отношения ДА/НА у мышей B6-M76C, но не у мышей B6-M76B (табл. 2).
Таблица 2.
Уровни катехоламинов в ткани надпочечника Table 2. The levels of catecholamines in the adrenal gland tissue)
| Нг/мг ткани ng/mg of tissue |
B6-M76B контроль B6-M76B control |
B6-M76B стресс B6-M76B stress |
B6-M76C контроль B6-M76C control |
B6-M76C стресс B6-M76C stress |
|---|---|---|---|---|
| Норадреналин (НА) Norepinephrine (NE) |
754.62 ± 60.82 | 799.97 ± 33.33 | 881.29 ± 69.13 | 1140.69 ± 185.06* |
| Адреналин (А) Epinephrine (E) |
1224.22 ± 114.71 | 1124.95 ± 60.81 | 1140.98 ± 64.88 | 1981.53 ± 310.54* |
| Дофамин (ДА) Dopamine (DA) |
24.62 ± 1.57 | 29.83 ± 0.1.62 | 27.84 ± 1.99 | 54.34 ± 7.04*** |
| ДА/НА DA/NE |
0.033 ± 0.003 | 0.038 ± 0.002 | 0.032 ± 0.003 | 0.051 ± 0.007** |
Все значения представлены как среднее ± ошибка среднего. *** р < 0.001; **p < 0.01; * p < 0.05 по сравнению с контрольными мышами без стресса той же линии, n ≥ 8 для каждой группы. All values are presented as mean ± SEM. *** p < 0.001; **p < 0.01; * p < 0.05 compared to control not stressed mice of the same line, n ≥ 8 for each group.
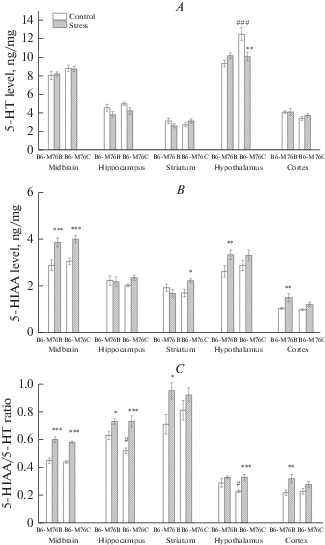
Уровни НА, 5-HT, 5-ГИУК, соотношение 5-ГИУК/5-HT в структурах мозга. Острый стресс привел к значительным генотип-зависимым изменениям в уровнях моноаминов и их метаболитов в структурах мозга мышей. Реакция на воздействие стресса сопровождалась более выраженным снижением уровня НА в гиппокампе мышей B6-M76C по сравнению с мышами B6-M76B (эффект стресса F1.30 = 10.44, р < 0.01). Также острый стресс привел к снижению НА в гипоталамусе (эффект взаимодействия генотип × стресс F1.30 = 5.54, p < 0.05). Следует отметить, что у мышей B6-M76C обнаружили повышенный базальный уровень НА (р < 0.05) в гипоталамусе по сравнению с мышами B6-M76B (рис. 2). Реакция на стресс вызвала повышение уровня 5-ГИУК у мышей обеих линий (эффект стресса F1.32 = 28.32, р < 0.001), но не изменила уровень 5-HT в среднем мозге (рис. 3A, B). Также острая реакция на стресс привела к достоверному увеличению отношения 5-ГИУК/5-HT у мышей обеих линий (эффект стресса F1.32 = 85.45, p < 0.001, рис. 3C). Интересно отметить, что в гиппокампе контрольных мышей линии B6-M76C соотношение 5-ГИУК/5-HT было ниже по сравнению с таковым у контрольных мышей линии B6-M76B (р < 0.05).
Рис. 2.
Уровень НА в структурах мозга мышей контрольной и стрессированных мышей линий B6-M76C и B6-M76B. Уровень НА представлен в нг/мг, n ≥ 8 для каждой группы. Все значения представлены как среднее ± ошибка среднего. ** р < 0.01 по сравнению с контрольными мышами той же линии; # p < 0.05 по сравнению с мышами линии B6-M76B без стресса. Fig 2. Level of NE in the brain structures of mice of control and stressed B6-M76C and B6-M76B mice. Level of NE is presented in ng/mg, n ≥ 8 for each group. All values are presented as mean ± SEM. ** p < 0.01 compared to control not stressed mice of the same line; # p < 0.05 compared to B6-M76B not stressed mice.
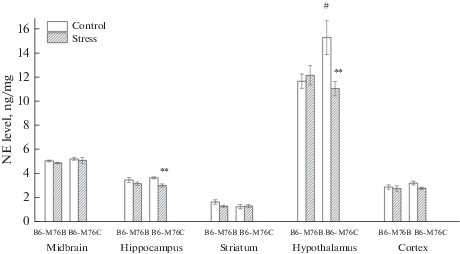
Рис. 3.
Уровень 5-HT (A), 5-ГИУК (B) и соотношение 5-ГИУК/5-HT (C) в структурах мозга контрольных и стрессированных мышей B6-M76C и B6-M76B. Уровни 5-HT и 5-ГИУК представлены в нг/мг, n ≥ 8 для каждой группы. Все значения представлены как среднее ± ошибка среднего. *** р < 0.001; ** р < 001; * р < 0.05 по сравнению с контрольными мышами той же линии; ### p < 0.001 по сравнению с мышами линии B6-M76B без стресса. Fig 3. Level of 5-HT (A), 5-HIAA (B), and ratio 5-HIAA/5-HT (C) in the brain structures of mice of control and stressed B6-M76C and B6-M76B mice. Level of 5-HT and 5HIAA are presented in ng/mg, n ≥ 8 for each group. All values are presented as mean ± SEM. *** p < 0.001; ** p < 0.01; * p < 0.05 compared to control not stressed mice of the same line; ### p < 0.001 compared to B6-M76B not stressed mice.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
О наличии связи между стрессом и множеством психических, нервных и соматических заболеваний известно давно. Центральное место в процессе изучения механизмов такой связи занимают исследования генетического контроля и регуляции функций нейроэндокринных контуров, обеспечивающих реакцию организма на стресс. Самыми значимыми системами в формировании ответа на стресс являются симпатоадреналовая система и ГГНС. Мы обратили пристальное внимание на надпочечниковую железу, потому что она является эффекторным звеном для обеих этих систем.
Активация симпатоадреналовой и ГГНС систем в ответ на стрессовые факторы является важным этапом адаптации организма к изменяющейся среде. Быстрый ответ на стресс в виде реакции типа “бороться или бежать” обеспечивает симпатоадреналовая система [49]. Избыточная секреция катехоламинов в кровоток в ходе такой реакции сама по себе является повреждающей для кровеносных сосудов, органов, критически зависящих от кровоснабжения, в частности, головного мозга. В то же время наличие сверхчувствительности катехоламинов к стрессу может расцениваться в качестве предиктора ряда неврологических и психических заболеваний [50]. Гипоталамо-гипофизарно-надпочечниковая система обеспечивает адаптацию организма к изменениям внешней и внутренней среды [51]. Глюкокортикоиды – это один из конечных продуктов функционирования ГГНС, регулирующие физиологические процессы и способствующие выживанию в экстремальных (стрессирующих) условиях. В то же время избыточная реакция на стресс со стороны ГГНС зачастую провоцирует развитие различных заболеваний [52]. Активность ГГНС инициируется дискретными сигналами секреторных нервных окончаний, локализованных в средних парвоцеллюлярных и паравентрикулярных ядрах гипоталамуса [53]. Основными нейромедиаторами, принимающими участие в передаче сигнала в гипоталамических ядрах, включенных в организацию стрессовой реакции, являются ацетилхолин, ДА, НА и 5-НТ. Роль последнего как стимулятора секреции кортикотропин-рилизинг-фактора, впервые была показана в работах Науменко [54].
Итак, рассматривая реакцию на стресс, мы имеем дело с каскадом взаимосвязанных процессов, инициированных моноаминергическими нейронами мозга и перерастающих в эндокринный ответ [5, 6].
Известно, что снижение уровня НА в гипоталамусе мышей является более последовательным [55, 56], быстрым [57, 58] и более выраженным, чем в других областях мозга [59–61] после воздействия стресса. В нашем исследовании мы выявили повышенный уровень НА в гипоталамусе и его значительное снижение после острого стресса у мышей B6-M76C по сравнению с мышами B6-M76B. Таким образом, повышенная восприимчивость к стрессу у мышей B6-M76C, наблюдаемая в наших предыдущих исследованиях [35, 38], может быть связана и с норадренергической системой мозга. Возможно, реакция на стресс у мышей B6-M76C приводит к усиленному нейроэндокринному ответу, что, в свою очередь, в дальнейшем может значительно повышать риски возникновения нервно-психических расстройств, связанных со стрессом [62].
Вызванное стрессом увеличение метаболизма 5-НТ в гипоталамусе было выявлено только у мышей B6-M76C. Наши данные хорошо согласуются с предыдущими исследованиями, которые показали, что реакция на стресс увеличивает 5-НТ и 5-ГИУК в вентромедиальном и дорсомедиальном ядрах гипоталамуса [63, 64]. Известно, что оба ядра вовлечены в механизмы регуляции поведения [65, 66]. Следует отметить, что интактные мыши B6-M76C отличаются от интактных мышей B-6‑M76B повышенным уровнем 5-HT и сниженным соотношением 5-ГИУК/5-HT в гипоталамусе. Кроме того, интактные мыши B6-M76C имеют более низкое соотношение 5-ГИУК/5-HT в гиппокампе по сравнению с мышами B6-M76B. Реакция на острый стресс привела к увеличению отношения 5-ГИУК/5-HT в гиппокампе и среднем мозге у обеих линий, но у мышей B6-M76C произошли более существенные изменения в метаболизме 5-HT. Ранее нами было предположено, что мыши B6-M76C отличаются повышенной чувствительностью постсинаптических и пониженной чувствительностью пресинаптических 5-HT1A рецепторов по сравнению с мышами линии B6-M76B [35]. 5-HT1A рецептор в ядрах шва действует как соматодендритный ауторецептор, ингибируя активность нейронов и выход серотонина в синаптическую щель [67, 68]. Также 5-HT1A рецепторы локализованы постсинаптически в амигдале, гиппокампе, гипоталамусе, перегородке и других структурах мозга [67, 69]. 5-HT1A рецепторы играют важную роль в модулировании основных эмоциональных процессов. Более того, множество данных свидетельствует о том, что функция как пре- так и постсинаптических 5-HT1A рецепторов изменяется у пациентов с тревожностью и депрессией по сравнению со здоровыми людьми [28, 70]. Это указывает на то, что функционирование 5-HT1A рецепторов может служить как некоторый фактор уязвимости для эмоциональной психопатологии [28, 70]. Гиппокамп и гипоталамус – это структуры, в которых постсинаптические 5-HT1A рецепторы являются доминирующими рецепторами. Показано, что острая реакция на стресс у крыс вызывает либо увеличение, либо уменьшение связывания антагониста [125I]-4-(2'-метоксифенил)-1-[2'-(н-2"-пиридинил)п-иодобензамидо]этилпиперазина и агониста [3H]-8-гидрокси-2-(ди-н-пропиламино)тетралина 5-HT1A рецептора в гиппокампе и/или префронтальной коре в зависимости от стрессора и субрегиона [71]. Можно предположить, что изменение чувствительности постсинаптических 5-HT1A рецепторов привело к ослаблению метаболизма 5-HT и усилению реакции на острый стресс у мышей B6-M76C, наблюдаемые в гипоталамусе и гиппокампе.
Мыши обеих линий показали повышение экспрессии гена c-fos во всех исследованных областях мозга после воздействия стресса по сравнению с соответствующими контрольными группами. Однако у мышей B6-M76C, подвергавшихся стрессу, наблюдалась повышенная экспрессия гена c-fos в префронтальной коре, гипоталамусе и стриатуме по сравнению с мышами линии B6-M76B экспериментальной группы. Ген c-fos является геном раннего реагирования и играет важную роль в регуляции нервной системы в ответ на стресс [7]. Индукция c-fos является характеристикой острой активации во многих областях мозга [72]. Таким образом, мыши B6-M76C более восприимчивы к острому стрессу, что согласуется с нашими предыдущими результатами и нейроанатомическими данными, полученными на этих животных [35, 38].
Хорошо известное увеличение высвобождения катехоламинов в ответ на стимуляцию симпатических нервов происходит в результате активации симпатических нейронов, которая в более общих реакциях связана с выделением адреналина [73]. Одним из основных стресс-индуцированных реакций адрено-медуллярной системы является примерно трехкратное увеличение экспрессии тирозингидроксилазы и удвоение концентрации дофамин-бета-гидроксилазы [74]. В настоящем исследовании содержание ДА в надпочечниках мышей B6-M76C было в 2 раза выше, чем у B6-M76B мышей в условиях стресса. Реакция на стресс увеличила отношение ДА/НА, являющееся косвенным маркером активности DβH, у мышей B6-M76C, но не у животных линии B6-M76B. Эти результаты, совместно с данными о вызванном стрессом увеличении уровней ДА, НА и А у мышей B6-M76C, позволяют предположить повышенную экспрессию тирозингидроксилазы и DβH в надпочечниках мышей линии B6-M76C.
Другим ответом на стресс является увеличение экспрессии гена, кодирующего фермент PNMT (фенилэтаноламин-N-метилтрансфераза). Увеличение уровня глюкокортикоидов и нервных импульсов из-за стресса стимулирует PNMT более интенсивно преобразовывать НА в А [75]. Мы показали, что уровень А в надпочечниках был значительно выше у B6-M76C, чем у мышей B6-M76B после воздействия стресса. Это может указывать на повышенную активность фермента PNMT у мышей B6-M76C.
Учитывая все данные, полученные в этом исследовании, можно предположить более высокую симпатическую иннервацию надпочечников у мышей B6-M76C по сравнению с мышами линии B6-M76B, что отражается в их более высокой реактивности на острый стресс.
Список литературы
Селье Г. На уровне целого организма. М. Наука. 1972. [Selye G. At the level of the whole organism. M. Science. 1972. (In Russ)].
Меерсон Ф.З. Адаптация, стресс и профилактика. М. Наука. 1981. [Meerson F.Z. Adaptation, stress and prevention. M. Science. 1981. (In Russ)].
Pacak K., Palkovits M. Stressor specificity of central neuroendocrine responses: implications for stress-related disorders. Endocr. Rev. 22(4): 502–548. 2001.
Zamora-Gonzalez E.O., Santerre A., Palomera-Avalos V., Morales-Villagran A. A chronic combinatory stress model that activates the HPA axis and avoids habituation in BALB/C mice. J. Neurosci. Methods. 213(1): 70–75. 2013.
Kvetnansky R., Pacak K., Sabban E.L., Kopin I.J., Goldstein D.S. Stressor specificity of peripheral catecholaminergic activation. Adv. Pharmacol. 42: 556–560. 1998.
Pacak K., Baffi J.S., Kvetnansky R., Goldstein D.S., Palkovits M. Stressor-specific activation of catecholaminergic systems: implications for stress-related hypothalamic-pituitary-adrenocortical responses. Adv. Pharmacol. 42: 561–564. 1998.
Seo J.H., Kim T.W., Kim C.J., Sung Y.H., Lee S.J. Treadmill exercise during pregnancy ameliorates posttraumatic stress disorderinduced anxietylike responses in maternal rats. Mol. Med. Rep. 7(2): 389–395. 2013.
Robbins T.W., Everitt B.J. Central norepinephrine neurons and behavior. In: Psychopharmacology: The Fourth Generation of Progress. Eds. Bloom F.E., Kupfer D.J. New York. Raven Press. 363–372 1995.
Aston-Jones G., Rajkowski J., Cohen J. Role of locus coeruleus in attention and behavioral flexibility. Biol. Psychiatry. 46(9): 1309–1320. 1999.
Johnson E.O., Kamilaris T.C., Chrousos G.P., Gold P.W. Mechanisms of stress: a dynamic overview of hormonal and behavioral homeostasis. Neurosci. Biobehav. Rev. 16(2): 115–130. 1992.
Koob G.F. Corticotropin-releasing factor, norepinephrine, and stress. Biol. Psychiatry. 46(9): 1167–1180. 1999.
Gold P.W., Chrousos G.P. The endocrinology of melancholic and atypical depression: relation to neurocircuitry and somatic consequences. Proc. Assoc. Am. Physicians. 111(1): 22–34. 1999.
Southwick S.M., Krystal J.H., Morgan C.A., Johnson D., Nagy L.M., Nicolaou A., Heninger G.R., Charney D.S. Abnormal noradrenergic function in posttraumatic stress disorder. Arch. Gen. Psychiatry. 50(4): 266–274. 1993.
Schatzberg A.F., Schildkraut J.J. Recent studies on norepinephrine systems in mood disorders. In: Psychopharmacology: The Fourth Generation of Progress. Eds. Bloom F.E., Kupfer D.J. New York. Raven Press. 911–920 1995.
Sullivan G.M., Coplan J.D., Kent J.M., Gorman J.M. The noradrenergic system in pathological anxiety: a focus on panic with relevance to generalized anxiety and phobias. Biol. Psychiatry. 46(9): 1205–1218. 1999.
Jacobs B.L., Fornal C.A. Serotonin and behavior. A general hypothesis. In: Psychopharmacology: The fourth generation of progress. Eds. Bloom F.E., Kupfer D.J. New York. Raven Press. 461–469. 1995.
Науменко Е.В., Попова Н.К. Серотонин и мелатонин в регуляции эндокринной системы. Н. Наука. 1975. [Naumenko E.V., Popova N.K. Serotonin and melatonin in the regulation of the endocrine system. N. Science. 1975. (In Russ)].
Jiang D.G., Jin S.L., Li G.Y., Li Q.Q., Li Z.R., Ma H.X., Zhuo C.J., Jiang R.H., Ye M.J. Serotonin regulates brain-derived neurotrophic factor expression in select brain regions during acute psychological stress. Neural Regen. Res. 11(9): 1471–1479. 2016.
Yamaguchi N., Nakajima N., Okada S., Yuri K. Effects of aging on stress-related responses of serotonergic neurons in the dorsal raphe nucleus of male rats. Neurobiol. Stress. 3. 43–51. 2016.
Stamper C.E., Hassell J.E., Jr., Kapitz A.J., Renner K.J., Orchinik M., Lowry C.A. Activation of 5-HT1A receptors in the rat dorsomedial hypothalamus inhibits stress-induced activation of the hypothalamic-pituitary-adrenal axis. Stress. 20(2): 223–230. 2017.
Holmes A. Genetic variation in cortico-amygdala serotonin function and risk for stress-related disease. Neurosci. Biobehav. Rev. 32(7): 1293–1314. 2008.
Liposits Z., Phelix C., Paull W.K. Synaptic interaction of serotonergic axons and corticotropin releasing factor (CRF) synthesizing neurons in the hypothalamic paraventricular nucleus of the rat. A light and electron microscopic immunocytochemical study. Histochemistry. 86(6): 541–549. 1987.
Chaouloff F. Physiopharmacological interactions between stress hormones and central serotonergic systems. Brain Res. Brain Res. Rev. 18(1): 1–32. 1993.
Carrasco G.A., Van de Kar L.D. Neuroendocrine pharmacology of stress. Eur. J. Pharmacol. 463(1–3): 235–272. 2003.
Pazos A., Probst A., Palacios J.M. Serotonin receptors in the human brain–III. Autoradiographic mapping of serotonin-1 receptors. Neuroscience. 21(1): 97–122. 1987.
Hall H., Lundkvist C., Halldin C., Farde L., Pike V.W., McCarron J.A., Fletcher A., Cliffe I.A., Barf T., Wikstrom H., Sedvall G. Autoradiographic localization of 5-HT1A receptors in the post-mortem human brain using [3H]WAY-100635 and [11C]way-100635. Brain Res. 745(1–2): 96–108. 1997.
Popova N.K., Naumenko V.S. 5-HT1A receptor as a key player in the brain 5-HT system. Rev. Neurosci. 24(2): 191–204. 2013.
Neumeister A., Young T., Stastny J. Implications of genetic research on the role of the serotonin in depression: emphasis on the serotonin type 1A receptor and the serotonin transporter. Psychopharmacology (Berl). 174(4): 512–524. 2004.
Nash J.R., Sargent P.A., Rabiner E.A., Hood S.D., Argyropoulos S.V., Potokar J.P., Grasby P.M., Nutt D.J. Serotonin 5-HT1A receptor binding in people with panic disorder: positron emission tomography study. Br. J. Psychiatry. 193(3): 229–234. 2008.
Richardson-Jones J.W., Craige C.P., Guiard B.P., Stephen A., Metzger K.L., Kung H.F., Gardier A.M., Dranovsky A., David D.J., Beck S.G., Hen R., Leonardo E.D. 5-HT1A autoreceptor levels determine vulnerability to stress and response to antidepressants. Neuron. 65(1): 40–52. 2010.
Wang H.T., Han F., Shi Y.X. Activity of the 5-HT1A receptor is involved in the alteration of glucocorticoid receptor in hippocampus and corticotropin-releasing factor in hypothalamus in SPS rats. Int. J. Mol. Med. 24(2): 227–231. 2009.
Plyusnina I.Z., Oskina I.N., Tibeikina M.A., Popova N.K. Cross-fostering effects on weight, exploratory activity, acoustic startle reflex and corticosterone stress response in Norway gray rats selected for elimination and for enhancement of aggressiveness towards human. Behav. Genet. 39(2): 202–212. 2009.
Dygalo N.N., Shishkina G.T., Borodin P.M., Naumenko E.V. Role of the brain neurochemical systems in altering the reactivity of the hypophyseal-adrenal system in the gray rat selected for behavior. Zh. Evol. Biokhim. Fiziol. 21(4): 342–347. 1985.
Popova N.K., Naumenko V.S., Plyusnina I.Z., Kulikov A.V. Reduction in 5-HT1A receptor density, 5-HT1A mRNA expression, and functional correlates for 5-HT1A receptors in genetically defined aggressive rats. J. Neurosci. Res. 80(2): 286–292. 2005.
Kulikova E.A., Bazovkina D.V., Akulov A.E., Tsybko A.S., Fursenko D.V., Kulikov A.V., Naumenko V.S., Ponimaskin E., Kondaurova E.M. Alterations in pharmacological and behavioural responses in recombinant mouse line with an increased predisposition to catalepsy: role of the 5-HT1A receptor. Br. J. Pharmacol. 173(13): 2147–2161. 2016.
Rea M.A. Photic entrainment of circadian rhythms in rodents. Chronobiol. Int. 15(5): 395–423. 1998.
Faccidomo S., Bannai M., Miczek K.A. Escalated aggression after alcohol drinking in male mice: dorsal raphe and prefrontal cortex serotonin and 5-HT(1B) receptors. Neuropsychopharmacology. 33(12): 2888–2899. 2008.
Kulikova E.A., Bazovkina D.V., Antonov Y.V., Akulov A.E., Kulikov A.V., Kondaurova E.M. Alteration of the brain morphology and the response to the acute stress in the recombinant mouse lines with different predisposition to catalepsy. Neurosci. Res. 117. 14–21. 2017.
Garner B., Pariante C.M., Wood S.J., Velakoulis D., Phillips L., Soulsby B., Brewer W.J., Smith D.J., Dazzan P., Berger G.E., Yung A.R., van den Buuse M., Murray R., McGorry P.D., Pantelis C. Pituitary volume predicts future transition to psychosis in individuals at ultra-high risk of developing psychosis. Biol. Psychiatry. 58(5): 417–423. 2005.
Hendrickx A., Pierrot N., Tasiaux B., Schakman O., Kienlen-Campard P., De Smet C., Octave J. N. Epigenetic regulations of immediate early genes expression involved in memory formation by the amyloid precursor protein of Alzheimer disease. PLoS One. 9(6): e99467. 2014.
Gao P., Limpens J.H., Spijker S., Vanderschuren L.J., Voorn P. Stable immediate early gene expression patterns in medial prefrontal cortex and striatum after long-term cocaine self-administration. Addict. Biol. 22(2): 354–368. 2017.
Куликов А.И., Базовкина Д.В. Проверка гипотез о сцеплении в гибридологическом анализе альтернативных поведенческих признаков с неполной пенетрантностью. Генетика 39(8): 1066–1072. 2003. [Kulikov A.V., Bazovkina D.V. Testing linkage hypothesis in hybrid analysis of alternatively distributed behavioral traits with incomplete penetrance. Genetika. 39(8): 1066–1072. 2003. (In Russ)].
Kondaurova E.M., Bazovkina D.V., Kulikov A.V., Popova N.K. Selective breeding for catalepsy changes the distribution of microsatellite D13Mit76 alleles linked to the 5-HT serotonin receptor gene in mice. Genes Brain Behav. 5(8): 596–601. 2006.
Kulikov A.V., Bazovkina D.V., Kondaurova E.M., Popova N.K. Genetic structure of hereditary catalepsy in mice. Genes Brain Behav. 7(4): 506–512. 2008.
Naumenko V.S., Kulikov A.V. Quantitative assay of 5-HT(1A) serotonin receptor gene expression in the brain. Mol. Biol. (Mosk.). 40(1): 37–44. 2006.
Naumenko V.S., Osipova D.V., Kostina E.V., Kulikov A.V. Utilization of a two-standard system in real-time PCR for quantification of gene expression in the brain. J. Neurosci. Methods. 170(2): 197–203. 2008.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikhonova M.A., Popova N.K. Quantitative R-T‑PCR assay of 5-HT1A and 5-HT2A serotonin receptor mRNAs using genomic DNA as an external standard. J. Neurosci. Methods. 141(1): 97–101. 2005.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72 (248–254). 1976.
Cannon W.J. The emergency function of the adrenal medulla in pain and the major emotions. Am. J. Physiol. 33. 356–372. 1914.
Maes M., Meltzer H.Y., Suy E., Minner B., Calabrese J., Cosyns P. Sleep disorders and anxiety as symptom profiles of sympathoadrenal system hyperactivity in major depression. J. Affect. Disord. 27(3): 197–207. 1993.
Joseph D.N., Whirledge S. Stress and the HPA Axis: Balancing Homeostasis and Fertility. Int. J. Mol. Sci. 18(10): 2017.
Kaushik R.M., Mahajan S.K., Rajesh V., Kaushik R. Stress profile in essential hypertension. Hypertens. Res. 27(9): 619–624. 2004.
Whitnall M.H. Regulation of the hypothalamic corticotropin-releasing hormone neurosecretory system. Prog. Neurobiol. 40(5): 573–629. 1993.
Науменко Е.В. Центральная регуляция гипофизарно-надпочечникового комплекса. Ленинград. Наука. 1971. [Naumenko E.V. Central regulation of the pituitary-adrenal complex. Leningrad. The science. 1971. (In Russ)].
Shanks N., Griffiths J., Anisman H. Norepinephrine and serotonin alterations following chronic stressor exposure: mouse strain differences. Pharmacol. Biochem. Behav. 49(1): 57–65. 1994.
Shanks N., Griffiths J., Anisman H. Central catecholamine alterations induced by stressor exposure: analyses in recombinant inbred strains of mice. Behav. Brain Res. 63(1): 25–33. 1994.
Nakagawa R., Tanaka M., Kohno Y., Noda Y., Nagasaki N. Regional responses of rat brain noradrenergic neurones to acute intense stress. Pharmacol. Biochem. Behav. 14(5): 729–732. 1981.
Tanaka M., Kohno Y., Nakagawa R., Ida Y., Takeda S., Nagasaki N. Time-related differences in noradrenaline turnover in rat brain regions by stress. Pharmacol. Biochem. Behav. 16(2): 315–319. 1982.
Irwin J., Ahluwalia P., Anisman H. Sensitization of norepinephrine activity following acute and chronic footshock. Brain Res. 379(1): 98–103. 1986.
Adell A., Garcia-Marquez C., Armario A., Gelpi E. Chronic stress increases serotonin and noradrenaline in rat brain and sensitizes their responses to a further acute stress. J. Neurochem. 50(6): 1678–1681. 1988.
Pol O., Campmany L., Gil M., Armario A. Behavioral and neurochemical changes in response to acute stressors: influence of previous chronic exposure to immobilization. Pharmacol. Biochem. Behav. 42(3): 407–412. 1992.
Morilak D.A., Barrera G., Echevarria D.J., Garcia A.S., Hernandez A., Ma S., Petre C.O. Role of brain norepinephrine in the behavioral response to stress. Prog. Neuropsychopharmacol. Biol. Psychiatry. 29(8): 1214–1224. 2005.
Culman J., Kvetnansky R., Torda T., Murgas K. Serotonin concentration in individual hypothalamic nuclei of rats exposed to acute immobilization stress. Neuroscience. 5(8): 1503–1506. 1980.
Lowry C.A., Plant A., Shanks N., Ingram C.D., Lightman S.L. Anatomical and functional evidence for a stress-responsive, monoamine-accumulating area in the dorsomedial hypothalamus of adult rat brain. Horm. Behav. 43(1): 254–262. 2003.
Canteras N.S., Simerly R.B., Swanson L.W. Organization of projections from the ventromedial nucleus of the hypothalamus: a Phaseolus vulgaris-leucoagglutinin study in the rat. J. Comp. Neurol. 348(1): 41–79. 1994.
Bernardis L.L., Bellinger L.L. The dorsomedial hypothalamic nucleus revisited: 1998 update. Proc. Soc. Exp. Biol Med. 218(4): 284–306. 1998.
Zifa E., Fillion G. 5-Hydroxytryptamine receptors. Pharmacol. Rev. 44(3): 401–458. 1992.
Aghajanian G. Electrophysiology of serotonin receptor subtypes and signal transduction pathways. In: Psychopharmacology: The Fourth Generation of Progress. Eds. Bloom F.R., Kupfer D.J. New York. Raven Press. 1451–1459. 1995.
Barnes N.M., Sharp T. A review of central 5-HT receptors and their function. Neuropharmacology. 38(8): 1083–1152. 1999.
Garcia-Garcia A.L., Newman-Tancredi A., Leonardo E.D. 5-HT(1A) [corrected] receptors in mood and anxiety: recent insights into autoreceptor versus heteroreceptor function. Psychopharmacology (Berl). 231(4): 623–636. 2014.
Raghupathi R.K., McGonigle P. Differential effects of three acute stressors on the serotonin 5-HT1A receptor system in rat brain. Neuroendocrinology. 65(4): 246–258. 1997.
Paikovits M. Stress related central neuronal regulatory circuits. In: Stress: Neuronal Endocrine and Molecular studies. Ed. McCarty R. Londin. Taylor and Fransis. 1–11. 2002.
Bell C. Dopamine release from sympathetic nerve terminals. Prog. Neurobiol. 30(2–3): 193–208. 1988.
Kopin I.J., Eisenhofer G., Goldstein D. Adrenergic response following recognition of stress. In: Molecular Biology of Stress, UCLA symposia on molecular and cellular biology. Eds. Bregnitz S., Zinder O. New York. Alan R Liss, Inc. 123–132 1989.
Wurtman R.J. Stress and the adrenocortical control of epinephrine synthesis. Metabolism. 51(6 Suppl 1): 11–14. 2002
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


