Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1163-1169
Способ создания нейрофизиологической модели простой нервной системы, обладающей реверберацией
С. С. Сергеева 1, *, О. С. Сотников 1, Н. М. Парамонова 2, 3
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Военно-медицинская академия им. С.М. Кирова
Санкт-Петербург, Россия
* E-mail: sveta.serga@yandex.ru
Поступила в редакцию 05.02.2020
После доработки 30.05.2020
Принята к публикации 30.05.2020
Аннотация
Впервые показано, что 60-минутное воздействие 0.4%-ного раствора проназы на нервный ганглий брюшного мозга медицинской пиявки вызывает разрушение глиальных оболочек, сближение нейритов и образование щелевых мембранных контактов между нервными отростками в нейропиле. Действие проназы приводит к созданию экспериментальной модели простой нервной системы, нервные клетки которой обладают частотной реверберационной активностью. Показано, что основой для возникновения реверберации возбуждения в нервной системе могут служить плотные мембранные контакты – электрические синапсы.
В настоящее время электрические синапсы между нейронами выявлены почти в каждой структуре мозга млекопитающих [см. обзоры 1–3]. Тем не менее, их функциональная роль и физиологическое значение, в том числе при их интеграции с химическими синапсами, остаются до сих пор непонятыми [4, 5]. Появление более простого объекта (по типу простых нервных систем) для исследования функционального вклада электрических синапсов в интегративные процессы, несомненно, будет полезным. Показано, что протеазы не изменяют амплитудные и кинетические характеристики нервных клеток [6]. Их действие, в первую очередь, вызывает разрушение глиальных клеток и оболочек, что в специальных условиях может привести к формированию межклеточных плотных и щелевых контактов между отдельными нейронами [7]. Известно, что нейроны пиявки в культуре ткани при отсутствии глии способны образовывать электрические синапсы, не наблюдаемые в норме [8], а наличие экспрессии иннексинов Hm-inx в нейронах предполагает такую возможность [9–11]. Нейроны, соединенные в мозге возникшими de novo щелевыми контактами – электрическими синапсами, несомненно, должны обладать особой электрической активностью. Графическая модель продемонстрировала, что трех электрических синапсов достаточно для того, чтобы получить эффект реверберации [12].
Целью настоящего исследования явилось доказательство того, что с помощью мягкого воздействия проназы на нервный ганглий брюшной нервной цепочки медицинской пиявки можно, разрушив глиальное окружение нейронов, сформировать нервную сеть, клетки которой будут обладать импульсной активностью реверберационного типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования
Обьектом исследования служил нервный ганглий медицинской пиявки Hirudo medicinalis. Животные были специально выращены на “КНМ Биофабрика”, Санкт-Петербург. Пиявок наркотизировали в холодной воде, вскрывали с брюшной стороны, извлекали второй от головного ганглий и помещали его в пластиковую камеру, заполненную раствором Рингера для пиявки: (мМ) 130 NaCl, 4 KCl, 1.8 CaCl2, 48 глюкоза, pH 7.4. У ганглия вскрывали соединительнотканную оболочку и прикалывали его на резиновой подложке. Для разрушения соединительнотканных и глиальных оболочек, окружающих нервные клетки, в течение 10–60 мин действовали на ганглий раствором проназы (использовали лиофилизированную проназу из Streptomyces grisens, Serva). Затем препарат отмывали от проназы физиологическим раствором.
В ряде экспериментов (n = 6) ганглии брали на электронномикроскопическое исследование. Для электрофизиологических экпериментов нервные клетки в ганглии (n = 10) подкрашивали 0.01%-ным раствором нейтрального красного, в результате чего на поверхности ганглия становились видны два крупных нейрона Ретциуса (НР). Одна из этих клеток служила объектом для электрофизиологического исследования.
Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациям этического комитета Института физиологии им. И.П. Павлова, протокол № 26/12 от 26 декабря 2019 г. на разрешение публикации данного исследования.
Методика электронномикроскопического исследования
Для электронномикроскопического исследования нервные ганглии фиксировали в течение 1 ч в 2.5%-ном растворе глютарового альдегида (glutaraldehyde, Acros Organics, США), затем в 1%-ном растворе охлажденной четырехокиси осмия (osmium tetroxide, Sigma-Aldrich, Германия). После дегидратации в растворах этилового спирта восходящей концентрации заливали в смесь аралдитов. Ультратонкие срезы готовили на ультратоме LKB-5 (Швеция) и окрашивали методом тройного контрастирования по Рейнгольдсу. Просмотр и фотосъемку проводили на электронном микроскопе FEI Tecnai G2 Spirit BioTWIN (Нидерланды) при напряжении 80 кВ. Негативы сканировали в просвечивающем режиме с помощью сканера ИМАХ Astra 4000 V.
Методика электрофизиологического исследования
Импульсную активность НР изучали внеклеточным методом. Экстраклеточный отводящий золотой микроэлектрод в стеклянной изоляции подводили к одному из нейронов под контролем микроскопа МБС-10. Регистрировали частоту спонтанной импульсной активности, амплитуду и длительность спайка. Электрический ответ НР визуально анализировали на осциллографах: С1-93 (Россия), цифровом осциллографе GDS-806S (GW Instek, Тайвань), записывали и сохраняли на компьютере. Для анализа электрической активности использовали программу-приложение к цифровому осциллографу GDS-806S Free Capture V2.05 и оригинальное программное обеспечение. Статистическую обработку результатов проводили с использованием программного обеспечения Microsoft Office Excel 2003. Вычисляли среднее арифметическое, ошибку среднего арифметического, используя однофакторный дисперсионный анализ, определяли достоверность различия (р).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Электронномикроскопические данные
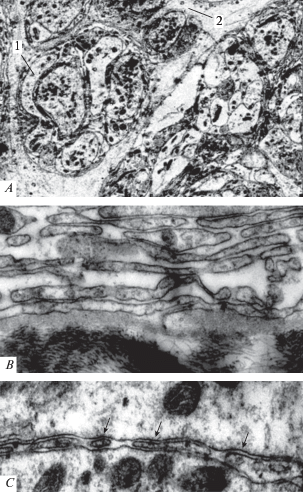
В ганглии пиявки в норме глиоциты окружают отдельные волокна и целые пучки волокон (рис. 1A). После обработки мозга пиявки проназой глия диссоциирует на отдельные ретрагирующие фрагменты, контактирующие друг с другом. Но между отдельными нейритами встречались еще отдельные участки отростков леммоцитов с признаками диссоциации (рис. 1B). Наружные слои глиоцитов при действии проназы ампутированы на множество профильных овальных, очевидно ретрагирующих слоев. В отдельных межнейрональных щелях внутри ганглиев попадаются эллипсоидные овоиды, препятствующие контакту нервных волокон (рис. 1C).
Рис. 1.
Отростки глиальных клеток мозга пиявки в норме и после действия проназы. A – нейриты, покрытые глиальной оболочкой (в норме); B – глиальные отростки наружной оболочки ганглия после воздействия проназы; C – овальные фрагменты ретрагирующих глиальных отростков (стрелки), после их диссоциации и ретракции при обработке проназой; 1 – глия, покрывающая отдельные нейриты и пучки нервных отростков; 2 – глиоцит. Электронная микроскопия. Увеличение 10 000. Fig. 1. The processes of glial leech brain cells are normal and after pronase action. A – neurites coated with a glial membrane (normal); B – glial processes of the outer shell of the ganglion after exposure to pronase; C – oval fragments of retracting glial processes (arrows), after their dissociation and retraction when treated with pronase; 1 – glia, covering individual neurites and bundles of nerve processes; 2 – gliocyte. Electron microscopy. SW 10.000.
На рис. 2A, B представлен общий вид щелевых контактов мозга пиявки после удаления глии. Внутри ганглия встречается большое количество парных щелевых контактов. В суженной части межклеточной щели они обычно образуют небольшую белковую агрегацию, а между парой мембран, формирующих щелевой контакт, часто отмечается небольшое расширение межклеточной щели. Встречаются и множественные, серийные контакты в форме цепочки между одной парой нейритов. Так как они располагаются в местах ранее очевидно заполненных глиальными отростками или элементами соединительной ткани, то можно предполагать, что эти новые образования возникли в результате увеличения межмембранной адгезии и околомембранной агрегации местных белков.
Таким образом, впервые экспериментально удалось получить электрические синапсы, также впервые выявлен эффект действия проназы на нервную ткань.
Электрофизиологические данные
Регистрировали спонтанную импульсную активность НР. Затем, раствор Рингера в камере заменяли на раствор, содержащий проназу. После определенного времени действия проназы ганглий перфузировали раствором Рингера, удаляя проназу, и вновь регистрировали спонтанную импульсную активность НР.
Исследовали действие 0.2-, 0.4- и 0.8%-ных растворов проназы в течение 10, 20, 40 и 60 мин на электрическую активность НР. Выявлено, что для получения отличной от нормы электрической активности НР, а именно феномена реверберации возбуждения, необходимо было инкубировать препарат в 0.2%-ном растворе проназы в течение 2.5–3-х часов. Раствор проназы при концентрации 0.8% в течение 10 мин не оказывал влияние на импульсную активность НР. 20-минутная инкубация вызывала увеличение импульсной активности НР, затем происходило резкое, плохо контролируемое разрушение структуры ганглия.
Рис. 2.
Межклеточные щелевые контакты после действия 0.4%-ного раствора проназы. A – контакт с изменяющимися размерами межклеточной щели; B – плотный агрегат сближающихся мембран щелевого контакта; C – парные щелевые контакты; 1 –область соединения коннексонов двух сближенных мембран электрического синапса; 2 – межклеточная щель; 3 – внутренние слои мембран контактирующих волокон; 4 – билипидная мембрана одного из контактирующих волокон; 5 – сужение межклеточной щели в области формирующихся щелевых контактов; Н1, Н2 – нейроплазма смежных волокон. Электронная микроскопия. Увеличение: A – 45 000, B – 58 000, C – 62 000. Fig. 2 . Intercellular gap junctions after the action of 0.4% pronase. A – contact with varying sizes of the intercellular cleft; B – dense aggregate that brings together the gap junction membranes; C – paired slotted contacts; 1 – the junction of the connexons of two adjacent membranes of the electrical synapse; 2 – intercellular cleft; 3 – the inner layers of the membranes of the contacting fibers; 4 – bilipid membrane of one of the contacting fibers; 5 – narrowing of the intercellular cleft in the area of the forming gap junctions; H1, H2 – neuroplasma of adjacent fibers. Electron microscopy. SW: A – 45 000, B – 58 000, C – 62 000.

В результате экспериментов выявлено, что концентрация проназы равная 0.4% в течение 60 мин вызывала стойкую, стабильную перестройку импульсной активности НР. Эта концентрация проназы и время ее воздействия на ганглий в дальнейшем использовалась как в электронномикроскопических, так и в электрофизиологических экспериментах. После действия проназы вместо одиночных спонтанных спайков НР начинает генерировать пачки импульсов, состоящие из 3–7 спайков (рис. 3C, D).
Рис. 3.
Импульсная активность нейрона Ретциуса. A – частота спонтанной импульсной активности нейрона Ретциуса в норме; B – частота спонтанной пачечной импульсной активности нейрона Ретциуса после действия проназы; C – спонтанный спайк нейрона Ретциуса в нормальном физиологическом растворе; D – спонтанный реверберационный спайк нейрона после действия проназы; E – реверберационный спайк нейрона в растворе с ионами Mg2+ после действия проназы. Fig. 3. The impulse activity of a Retzius neuron. A – the frequency of spontaneous impulse activity of the Retzius neuron is normal; B – the frequency of spontaneous burst impulse activity of the Retzius neuron after pronase action; C – spontaneous spike of the Retzius neuron in normal saline; D – spontaneous reverberation spike of a neuron after pronase action; E – reverberation spike of a neuron in solution with Mg2+ ions after pronase action.
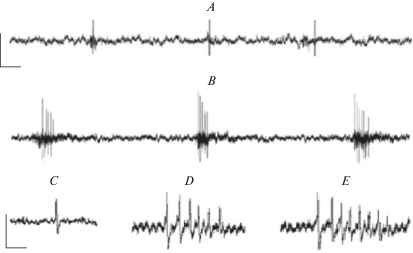
Частота спонтанной импульсной активности пачек спайков после действия проназы статистически не отличается от частоты одиночных спонтанных импульсов в физиологическом растворе до воздействия проназы (0.26 ± 0.008 имп/с и 0.25 ± ± 0.09 пачка/с соответственно) (рис. 3A, B).
Для того, чтобы выявить возможное участие химических синапсов в формировании НР спонтанной реверберационной импульсной активности, в конце эксперимента в камеру с ганглием добавляли физиологический раствор, в котором ионы Са2+ заменяли на ионы Mg2+. Выявлено, что в норме (без проназы) характер и частота спонтанной импульсной активности НР в физиологическом растворе с ионами Mg2+ достоверно не изменялась. В препаратах, полученных в результате действия проназы, в растворе с ионами Mg2+ реверберация сохранялась, но количество импульсов в пачке было всегда выше (рис. 3D).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Электронномикроскопические исследования показали, что в результате действия проназы получена экспериментальная безглиальная модель нервной системы – ганглий, нервные клетки в котором соединены щелевыми контактами, являющимися электрическими синапсами. Эксперименты с ионами Mg2+ демонстрируют, что в формировании пачечной активности НР химические синапсы не принимают непосредственного участия. Важно отметить, что НР в препарате, полученном в результате действия проназы, сохраняют свои электрические свойства в течение 5–6 ч, что не отличает их от НР в препарате брюшной нервной цепочки, обычно используемого нами в длительных опытах.
Таким образом, модель “электрической нервной системы” на основе нервного ганглия пиявки, клетки в котором связаны преимущественно электрическими синапсами, может быть в дальнейшем полезной для изучения функциональной роли электрических синапсов в формировании сложных нейрофизиологических процессов.
ВЫВОДЫ
1. Проназа, вызывая разрушение глиальных оболочек в нервном ганглии пиявки, способствует формированию нервной сети, клетки в которой связаны щелевыми мембранными контактами.
2. Созданная экспериментальная модель простой нервной системы показывает, что основой для возникновения реакции реверберации в нервной системе могут служить электрические синапсы (gap junction).
Список литературы
Nagy J.I., Dermietzel R., Hertzberg E.L. (Eds). Gap Junctions and Connexins in the Mammalian Central Nervous System. JAI Press. Greenwich. 323–396. 2000.
Nagy J.I., Rash J.E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochim. Biophys. Acta–Biomebranes. 1860(1):102–123. 2018.
Connors B.W., Long M.A. Electrical synapses in the mammalian brain. Annu. Rev. Neurosci. 27: 393–418. 2004.
Pereda A.E. Electrical synapses and their functional interactions with chemical synapses. Nat. Rev. Neurosci. 15(4): 250–263. 2014.
Jabeen S., Thirumalai V.J. The interplay between electrical and chemical synaptogenesis. Neurophysiology. 120(4): 1914–1922. 2018.
Lun'ko O.O., Isaiev D.S., Maxymiuk O.P., Kryshtal’ O.O., Isaieva O.V. The effect of enzymatic treatment using proteases on properties of persistent sodium current in CA1 pyramidal neurons of rat hippocampus. Fiziol. Zh. 60(3): 75–79. 2014. [Article in Ukraine].
Sotnikov O.S., Lukovnikova M.V., Vasyagina N.Y., Laktionova A.A., Paramonova N.M. Neuron changes in a mollusk in response to proteolytic enzymes. Neurosci. Behav. Physiol. 40(7): 773–778. 2010.
De-Miguel F.F. Steps in the formation of neurites and synapses studied in cultured leech neurons. Braz. J. Med. Biol. Res. 33(5): 487–497. 2000.
Dykes I.M., Freeman F.M., Bacon J.P., Davies J.A. Molecular Basis of Gap Junctional Communication in the CNS of the Leech Hirudo medicinalis. J. Neurosci. 24(4): 886–894. 2004.
Baker M.W., Macagno E.R. RNAi of the receptor tyrosine phosphatase HmLAR2 in a single cell of an intact leech embryo leads to growth-cone collapse. Curr. Biol. 10(17): 1071–1074. 2000.
Firme C.P., Natan R.G., Yazdani N., Macagno E.R., Baker M.W. Ectopic expression of select innexins in individual central neurons couples them to pre-existing neuronal or glial networks that express the same innexin. J. Neurosci. 32(41): 14265–14270. 2012.
Сотников О. С. Объединенная нейронно-ретикулярная теория. CПб. Наука. 239. 2019. [Sotnikov O.S. United neuron-retikular theory. SPb. Nauka. 239. 2019. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


