Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1144-1162
Влияние реальной микрогравитации на мышечную архитектуру и функцию скелетной мышцы человека
Ю. А. Коряк *
Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: yurikoryak@mail.ru
Поступила в редакцию 23.04.2020
После доработки 22.06.2020
Принята к публикации 05.07.2020
Аннотация
Исследовали влияние продолжительной микрогравитации на архитектуру и сократительные свойства трехглавой мышцы голени (ТМГ) у трех космонавтов. Определяли максимальную произвольную силу (МПС), максимальную силу (Ро), время одиночного сокращения (ВОС), время полурасслабления (1/2 ПР), время развития напряжения и рассчитывали силовой дефицит (Рд). Ультразвуковые изображения (УЗИ) медиальной (МИМ), латеральной (ЛИМ) икроножных и камбаловидной (КМ) мышц определяли при изменении положения угла голеностопного сустава в диапазоне от –15° (тыльное сгибание) до +30° (подошвенное сгибание) и в положении коленного сустава с углом 180°. В каждом положении были получены продольные УЗИ с определением длины (Lв) и угла наклона волокон (Θв) относительно апоневроза. После микрогравитации МПС и Ро ТМГ уменьшились на 26% и 18% соответственно, а Рд увеличился на 30%. ВОС и 1/2 ПР уменьшились на ~5 и ~10% соответственно. Скорость развития произвольного сокращения ТМГ снизилась, но электрически вызванного сокращения не изменилась. При положении голеностопного сустава –15° Lв МИМ, ЛИМ и КМ уменьшалась с 45, 53 и 39 мм до 27, 43 и 27 мм, а при положении +30° – с 26, 33 и 27 до 18, 25 и 17 мм соответственно. При этом Θв изменялся на 9°, 8°, 5° и на 11°, 10° и 8° соответственно. МИМ имела самые большие изменения Θв в пределах от 31° до 45°. Изменения в функциях ТМГ предполагают, что невесомость изменяет не только периферические процессы, но также изменяет и координационные механизмы управления мышечным аппаратом. Различные Lв и Θв мышц и их изменения могли быть связаны с различиями в способностях генерации силы этих мышц и упругих характеристик сухожилий и апоневрозов.
Гравитационная нагрузка, по-видимому, необходима для сохранения сократительной функции скелетных мышц у человека [1–3]. Уменьшение нагрузки сопровождается снижением сократительных функций и размера (массы) скелетных мышц [1, 4, 5]. Следует отметить, что наибольшему воздействию в этом случае подвергается группа антигравитационных мышц – разгибателей колена и стопы [6–10]. Среди них подошвенный сгибатель стопы является наиболее затронутым [6, 7, 9–11], вероятно, из-за большей механической загруженности в нормальных гравитационных условиях.
Трехглавая мышца голени (ТМГ), являясь основным синергистом плантарной флексии, имеет первостепенное значение при локомоции и в контроле позы [12], поскольку активация ТМГ приводит к разгибанию стопы, что предохраняет переднее смещение центра подошвенного давления в пределах зоны опоры [12]. Следовательно, ТМГ играет важную роль не только в регулировании положения тела, в зависимости от положения центра массы, для поддержания постурального баланса, но и предопределяет переход из положения стоя до ходьбы или бега [13]. В этом контексте, с сугубо биомеханической точки зрения, любое изменение в силе подошвенного давления внутри зоны опоры или в ее передачи может привести к неблагоприятным изменениям в постуральном балансе и к увеличению риска падения [14]. Более того, медиальная (МИМ) и латеральная (ЛИМ) икроножные и камбаловидная (КМ) мышцы, образующие ТМГ, в целом, имеют разную внутреннюю архитектуру (длину мышц, длину и угол наклона волокон) [15].
Наиболее известный феномен воздействия разгрузки мышечного аппарата – это бóльшая потеря силы мышцы по сравнению с ее размером [6, 16], что прямо указывает на существование других факторов кроме атрофии, которые вносят вклад в “слабость” мышц. Размер мышцы у человека традиционно оценивается в терминах площади поперечного сечения, и для оценки размера мышц используют метод магнитно-резонансной и компьютерной томографии [17–19], которые являются “золотым стандартом”. Однако эти методы крайне дорогостоящие. В связи с этим одним из доступных и неинвазивных методов, позволяющих визуализировать структуру мышцы в условиях in vivo и определять изменения архитектуры мышц, может быть ультразвуковая эхография [19–21].
Действительно, с развитием ультразвуковой технологии, совершенствования ультразвукового оборудования и разработкой В-режима ультразвукового сканирования появилась возможность визуализации изображения мышц с количественной и качественной информацией об особенностях ее строения, т.е. появился альтернативный метод в реальном времени визуализировать мышцу и исследовать ее архитектуру [16, 19, 21]. В настоящее время метод B-режима ультразвукового сканирования мышц нашел широкое применение в различных областях и используется в клинике, в спортивной медицине и в возрастной физиологии [22–25].
Большинство скелетных мышц у человека являются перистыми [26–30], т.е. волокна которых размещаются под некоторым углом относительно оси действия мышцы. Угол наклона волокон один из важных архитектурных параметров мышцы, который влияет на способность мышцы генерировать силу [27–30]. Угол наклона волокна представляет собой вектор силы, действующий через волокна мышцы в горизонтальном и перпендикулярном направлениях к сухожилию, и, таким образом, влияет на передачу силы от волокон к кости [30].
Для перистой мышцы увеличенный угол наклона – это результат, во-первых, уменьшения длины волокон мышцы, что ставит под угрозу скорость укорочения и диапазон возвратно-поступательного движения, а во-вторых, позволяет большему количеству сократительного материала быть расположенным в волокне, это увеличивает способность мышцы генерировать силу [29, 31, 32]. Поэтому максимальная сила, продуцируемая при данной длине волокна мышцы в направлении волокон в перистой мышце, будет больше максимальной силы, произведенной в направлении волокон мышцей с параллельными волокнами с той же самой анатомической площадью и объемом. Следует отметить, что архитектура мышц исследована, главным образом, в опытах либо с неупотреблением (disuse), либо в условиях опорной разгрузки (постельный режим, “сухая” водная иммерсия) мышечного аппарата, моделирующей микрогравитацию [2, 16, 31], но полностью отсутствуют данные о влиянии реальной микрогравитации.
Вследствие этого цель данного исследования состояла, во-первых, в количественном описании отношений между суставным углом и мышечной архитектурой (длиной и углом наклона волокон МИМ, ЛИМ и КМ у человека в условиях in vivo), и, во-вторых, в количественной оценке степени изменения функциональных характеристик ТМГ у человека после продолжительного пребывания в условиях реальной микрогравитации. Было высказано предположение, что существенные структурные изменения в архитектуре (длине и угла наклона волокон) и сократительных функциях антигравитационных мышц связаны из-за уменьшения физической активности.
МЕТОДЫ ИССЛЕДОВАНИЯ
Протокол эксперимента был одобрен комитетом по биомедицинской этике Федерального государственного бюджетного учреждения науки “Государственный научный центр РФ – Институт медико-биологических проблем РАН” и медицинским советом Государственного бюджетного учреждения “Научно-исследовательский испытательный центр подготовки космонавтов им. Ю.А. Гагарина” и выполнен в соответствии с Хельсинкской декларацией [33].
Обследуемые
В исследовании приняли участие мужчины-космонавты (n = 3), члены основных экипажей продолжительных космических полетов на Международной космической станции. Длительность космических полетов составляла 175.0 ± 3 сут.
Ознакомление
Участники эксперимента были подробно проинформированы о целях и методах выполняемых исследований, ознакомлены с их процедурами, рисками и после этого подписали информированное согласие на участие в исследовании.
Экспериментальный дизайн
Космонавты были проинформированы об экспериментальных процедурах за 50–60 дней до полета. Каждый космонавт выполнил две серии экспериментов за 30 дней до космического полета (сбор исходных данных) и через 3–5 дней после космического полета.
Ультразвуковое сканирование
Мышечная архитектура in vivo была исследована с помощью двумерного (2-D) УЗИ с использованием В-режима ультразвуковой системы Edge (модель Edge, SonoSite, Inc., США) электронным линейным датчиком 7.5 МГц и апертурой 60 мм. УЗИ 2-D обычно используется при исследовании мышечной архитектуры [например, 25, 34, 35, 36, 37] и включает прямое измерение угла наклона и длину мышечных волокон (пучков), а также толщину мышцы.
Мышечная архитектура измерялась в условиях in vivo в состоянии покоя. Измерения проводились на медицинской кровати в положении обследуемого лежа на животе под углом –6° с анатомическим положением голеностопного сустава, 0.5 длины голени “свисали” с края кровати. Стопа правой конечности обследуемого относительно жестко крепилась к специальной платформе устройства, закрепленного на медицинской кровати, позволяющей пассивно изменять угол в голеностопном суставе в диапазоне от –15° (подошвенное сгибание) до +30° (подошвенное разгибание). Визуализация МИМ, ЛИМ и КМ осуществлялась в реальном времени в условиях in vivo с использованием В-режима ультразвуковой системы Edge. Для лучшего акустического контакта и для того, чтобы не травмировать кожную поверхность мышцы, сканирующую поверхность датчика покрывали водорастворимым гелем, датчик ориентировали вдоль средне-сагиттальной плоскости мышцы. Датчик был выровнен в плоскости направления мышечного пучка так, чтобы можно было рассматривать всю видимую часть пучков в окне сканирования. Качество УЗИ мышечного пучка достигалось регулировкой усиления по глубине и яркости ультразвукового сигнала. По УЗИ оценивали длину и угол наклона волокон мышц.
УЗИ были получены на уровнях, соответствующих 30% (МИМ и ЛИМ) и 50% (КМ) расстояний между подколенной складкой и центром боковой лодыжки при нейтральном положении голеностопного сустава [38]. Каждый уровень соответствовал максимальной анатомической площади поперечного сечения соответствующей мышцы [39]. На этих уровнях помещался светоотражающий маркер (шириной ~1.2 мм), прикрепленный к коже. Ультразвуковой датчик помещался над маркером, который образовывал линию в окне УЗИ и являлся индикатором того, что датчик во время измерений длины и угла наклона мышечных волокон не смещался. Полученные УЗИ записывались на жесткий диск с формированием файла для дальнейшего анализа.
Визуализация мышц с измерением длины мышечных волокон ( Lв) и угла их наклона (Θв) выполнялась после предварительного 20-минутного отдыха на специальной медицинской кровати для уравновешивания жидкостной среды организма [40]. Во время измерений космонавта инструктировали: – “полностью расслабить мышцы конечности”.
Длина мышечного волокна (Lв) определялась как линия между местом прикрепления волокна у поверхностного апоневроза до места вхождения в глубокие слои апоневроза мышцы [29, 31] (рис. 1). Визуализируя по ультрасонограмме пучки по их длине от поверхностного к глубокому апоневрозу, можно проверить правильность сканирования пучка [41], в противном случае длина пучка может быть оценена слишком завышенной, а угол пучка недооценен [29]. Длину пучка оценивали либо путем непосредственного измерения в видимой части окна, либо путем непосредственного измерения в видимой части окна, а затем в невидимой части. При этом ошибка линейной экстраполяции не превышает 2–7% [42].
Рис. 1.
Сагиттальные ультразвуковые изображения медиальной икроножной мышцы (MИМ; MG). Ультразвуковой датчик располагался над мышцей на уровне 30%-ного расстояния между подколенной складкой и центром боковой лодыжки. Длину волокна измеряли вдоль ультразвуковой сигнальной линии, проведенной параллельно волокну между глубоким и поверхностным апоневрозами. Угол наклона измеряли как угол, образованный линией, проведенной параллельно мышечному волокну между глубоким и поверхностным апоневрозами. Желтая линия, наложенная на ультразвуковое изображение, показывает путь волокна между поверхностным и глубоким апоневрозами. Представлен угол (Θв) наклона и длина (Lв) волокна между глубоким и поверхностным апоневрозами. Верхняя панель – до полета; нижняя панель – после полета. Fig. 1. Sagittal ultrasound images of the medialis gastrocnemius (MG) head. The ultrasound transducer was placed over the muscle at the level of 30% of the distance between the popliteal fold and the center of the lateral malleolus. The fiber length was measured along an ultrasound signal line drawn parallel to a fiber between the deep and superficial aponeuroses. The pennation angle was measured as an angle of the line drawn parallel to a fiber between the deep and superficial aponeuroses. A yellow line superimposed on the ultrasound image shows the path of a fiber between the superficial and deep aponeuroses. Θf, pennation angle; Lf fiber length; SF, subcutaneous fat; MG, medialis gastrocnemius. Top panel − pre space flight; lower panel − pre space flight.

Угол наклона мышечного волокон (Θв) определялся как угол, создаваемый линией, проведенной от точки прикрепления волокна у поверхностного слоя апоневроза к месту вхождения волокна в глубокие слои апоневроза и фасцией, отделяющей мышцы [29, 31] (рис. 1).
У каждого обследуемого измерялись параметры трех мышечных пучков. Полученные данные усреднялись и анализировались. Коэффициент вариации трех измерений находился в диапазоне 0–2%. УЗИ (Θв и Lв) обрабатывались с использованием пакета программ (Edge, Sono Site, Inc., США).
Толщина мышцы ( ТМ ) определялась по формуле:
где Lв и Θв – каждой мышцы определялись ультразвуком.Тендометрическая установка
Экспериментальная установка для регистрации электрически вызванных (непроизвольных) и произвольных сокращений (при волевом участии самого испытуемого) отдельной мышцы (например, ТМГ) у человека в условиях in situ была детально описана ранее [43]. Коротко, обследуемый удобно располагался на специальном стуле в стандартной позиции: угол в тазобедренном, коленном и голеностопном суставах составлял ~90° (рис. 2). Относительно жесткая фиксация бедренного, коленного и голеностопного суставов конечности обеспечивала изометрический режим сокращения мышцы. Позиция стула и фиксирующих устройств суставов конечности при проведении обследования для каждого космонавта подбиралась индивидуально и воспроизводилась при выполнении обследования после завершения космического полета. Все тестирующие процедуры выполнялись на правой конечности космонавта.
Рис. 2.
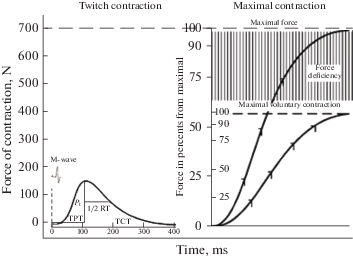
Экспериментальная установка (левая панель, верх) и схема принципа метода тендометрии (левая панель, внизу); пример тендограммы развития изометрического одиночного сокращения, электрически вызванного тетанического и произвольного сокращения отдельной мышцы (правая панель) с последующей схемой расчета параметров механических ответов мышечного сокращения. Fig. 2. Experimental set-up and scheme the principle of tendometry method. Examples measurements of mechanical response parameters in isometric twitch contraction curve (left panel) and in electrically evoked tetanic tension and voluntary muscle tension development (right panel). TPT, a time-to-peak; 1/2 RT, a half-relaxation time; TCT, a total contraction time; Pt, a twitch force.
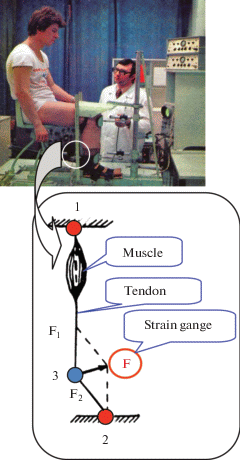
Рис. 2.
Окончание
Динамометр, представляющий собой стальное кольцо с вмонтированными в него тензодатчиками, плотно прижимался к Ахиллову сухожилию мышцы. Степень давления датчика была постоянной для всех космонавтов и составляла 5 кг. Механическая деформация динамометра при сокращении мышцы преобразовывалась в электрический сигнал и после усиления усилителем (тип АНЧ-7м; СССР) регистрировался на светолучевом осциллографе (тип К-115, СССР).
Протокол испытаний сократительных функций ТМГ был идентичным у всех испытуемых.
Силовые свойства
Механические параметры произвольных и электрически вызванных сокращений ТМГ оценивали методом тендометрии с использованием тендометрического динамометра индивидуального выпуска [43].
Изометрические одиночные сокращения ТМГ вызывали электрическим раздражением n. tiblalls, используя прямоугольные импульсы длительностью 1 мс супрамаксимальной силы от универсального нейро-мышечного электростимулятора (тип ЭСУ-1, СССР) через изолирующую приставку. При тетанической стимуляции n. tiblalls использовали частоту 150 имп/с [44, 45].
При выполнении произвольного изометрического сокращения ТМГ космонавта инструктировали, как реагировать на звуковой сигнал “сократить максимально сильно”. Космонавту сообщалась величина развиваемой произвольной силы (рис. 2) и разрешался зрительный контроль развиваемого усилия по стрелке динамометра. Каждый космонавт выполнял от 3 до 4 попыток с интервалом отдыха не менее 1 мин, и наибольшая величина принималась за показатель максимальной произвольной силы (МПС).
Скоростно-силовые свойства
При произвольном сокращении ТМГ космонавта тщательно инструктировали, как реагировать на звуковой сигнал — “сократить мышцу максимально быстро и сильно”. Регистрируемое произвольное сокращение принимали как “взрывное” баллистическое сокращение (рис. 2). По тендограмме развития “взрывного” сокращения оценивали время нарастания изометрического напряжения, или иначе относительные градиенты, до 25-, 50- и 75- и 90%-ных уровней от МПС [44, 45]. Точность измерения составляла 2 мс.
Силовые свойства
Максимальная сила (Ро) сокращения ТМГ (рис. 2) определялась по тендограмме вызванного сокращения в ответ на электрическое тетаническое (частота 150 имп/с) раздражение n. tibialis [44, 45]. Общая длительность электрически вызванного сокращения мышцы составляла не более ~0.5 С.
Степень совершенства центрально-нервных координационных механизмов управления произвольным (мышечным) движением определяли по величине силового дефицита (Рд), рассчитываемой по разнице между Ро и МПС, и выраженной в процентах от величины Ро [44, 45].
Скоростные свойства
Скоростные свойства ТМГ определяли по тендограмме развития изометрической Рос в ответ на одиночный электрический импульс, приложенный к n. tibialis (рис. 2). Рассчитывали время от момента нанесения электрического стимула до пика Рос (время одиночного сокращения – ВОС) и время от пика Рос до половины расслабления (время 1/2 ПР) сокращения. Точность измерения составляла 2 мс.
Скоростно-силовые свойства
По тендограмме развития электрически вызванного сокращения при стимуляции n. tibialis с частотой 150 имп/с [44, 45] определяли время нарастания тетанического напряжения до 25-, 50- и 75- и 90%-ных уровней от МПС (рис. 2). Точность измерения составляла 2 мс.
Стимуляция
Для стимуляции n. tibialis использовали универсальный нейро-мышечный стимулятор (тип ЭСУ-1, СССР) с изолирующей приставкой. Для раздражения n. tibialis использовали монополярный электрод — активный (катод; ∅ 1 см) устанавливали в подколенной ямке (место наименьшего сопротивления), а пассивный (анод; Ag/AgCl пластина размером 6 × 4 см) на нижней трети передней поверхности бедра. Положение стимулирующих электродов подбирали так, чтобы при некоторой минимальной силе раздражения регистрировать наибольший электромиографический ответ (М-ответ) m. soleus. В дальнейшем силу раздражения увеличивали в 1.5–2 раза, что позволяло получить супрамаксимальную силу раздражения, т.е. сила на 30–40% больше той минимальной силы, при которой впервые достигал максимальный М-ответ.
Регистрация электромиограммы
Электромиограмму регистрировали поверхностными биполярными Ag/AgCl электродами (Ø 8 мм с межэлектродным расстоянием 25 мм и площадью 50 мм2), которые помещали по средней линии брюшка m. soleus на уровне ниже 2 см медиальной и латеральной головок икроножной мышцы. Большой земляной электрод (Ag/AgCl пластина размером 7.5 × 6.5 см) помещали в проксимальной части голени между отводящими и раздражающим электродами. Для лучшего электрического контакта с кожей Ag/AgCl электроды заполнялись электродным гелем. Дополнительно для уменьшения межэлектродного импеданса до 5 kΩ поверхность кожи в месте установки Ag/AgCl электродов тщательно обрабатывалась, включая бритье волос, шлифовку кожи абразивной пастой и очистку кожи раствором спирта с эфиром в пропорции 1 : 4 [46]. Для усиления электромиографического сигнала использовали усилитель (тип УБП-1-02, СССР) с выносным катодным повторителем. Усиленный сигнал при стимуляции n. tibialis контролировали на экране запоминающего осциллоскопа (тип С8-9А, СССР) и синхронно регистрировали на светолучевом осциллографе (тип К-115, СССР).
Статистика
После проверки нормальности распределения данных с использованием теста Шапиро–Вилка параметрические статистические тесты выполнялись с использованием программного обеспечения. Данные представлены в виде средних значений ± стандартной ошибки среднего значения. Для определения значимой разницы между средними значениями воспользовались нормированным отклонением t Стьюдента–Фишера, уровень p < 0.05 был выбран для обозначения статистической значимости. Различия в архитектуре мышц до и после космического полета были проверены с использованием двустороннего дисперсионного анализа. Для оценки воспроизводимости измерений длины и угла наклона пучков (волокон) между тремя сериями был рассчитан коэффициент вариации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Длина волокон до полета. Степень изменения Lв во всех мышцах зависела от положения угла в голеностопном суставе (рис. 3) и была существенной для МИМ и ЛИМ. Так, при увеличении угла в голеностопном суставе с –15° до +30° Lв МИМ уменьшалась с 45.2 ± 1.2 до 26.1 ± 2.1 мм (р < 0.01), ЛИМ – с 53.1 ± 0.5 до 33.2 ± 1.3 мм (p < 0.01) и КМ – с 39.2 ± 1.2 до 27.2 ± 2.0 мм (р < 0.01), что соответствует относительным изменениям 42.3, 37 и 30.6% соответственно.
Рис. 3.
Изменение длины (Lв) и угла (Θв) наклона волокон МИМ (MG), ЛИМ (LG) и КМ (SOL), как функция угла в голеностопном суставе под влиянием продолжительного космического полета. * p < 0.05; **p < 0.01. Fig. 3. Changes in the fiber length (Lf) and pennation angle (Θf) as functions of the ankle joint angle in the MG, LG, and SOL as a result of a long-term SF. MG – medialis gastrocnemius; LG – lateralis gastrocnemius; SOL – soleus * p < 0.05; ** p < 0.01.

Угол наклона волокон до полета. Влияние положения угла в голеностопном суставе на Θв было существенным во всех мышцах (рис. 3) и изменение в МИМ было более существенным по сравнению с ЛИМ и КМ. Так, при изменении положения угла в голеностопном суставе с –15° до +30° Θв МИМ увеличивался на 44.9% (с 31.2° ± ± 2.1° до 45.2° ± 2.0°; р < 0.01), ЛИМ — на 31.8% (с 21.4° ± 2.1° до 28.2° ± 1.6°; р < 0.05) и КМ — на 34.8% (с 24.7° ± 1.4° до 33.3° ± 2.2°; р < 0.01).
Толщина мышцы до полета. При изменении положения угла в голеностопном суставе с –15° до +30° толщина МИМ уменьшалась с 14.5 до 11.2 мм, ЛИМ – с 10.5 до 10.4 мм и КМ – с 14.5 до 14.2 мм, что соответствует относительным изменениям на 22.8, 0.9 и 2.1% соответственно.
Длина волокон после полета. Степень изменения Lв во всех мышцах зависела от положения угла голеностопного сустава (рис. 3). Так, после космического полета при изменении положения угла голеностопного сустава с –15° до +30° Lв МИМ уменьшилась с 26.9 ± 1.7 до 17.8 ± 1.9 мм (р < 0.01), ЛИМ —с 42.7 ± 0.4 до 25.2 ± 2.4 мм (р < 0.01) и КМ – с 27.2 ± 2.3 до 17.2 ± 1.8 мм (р < 0.01), что соответствует относительным изменениям на 33.8, 41 и 36.8% соответственно.
Угол наклона волокон после полета. Влияние положения угла в голеностопном суставе на Θв было существенным во всех мышцах (рис. 3). Так, при изменении положения угла в голеностопном суставе с –15° до +30° Θв МИМ увеличился с 22.4° ± 1.8° до 34.2° ± 2.7° (р < 0.01), ЛИМ – с 13.4° ± 1.4° до 18.3° ± 2.3° и КМ — с 19.5° ± 1.3° до 25.8° ± 1.7° (р < 0.01), что соответствует относительным изменениям на 61.6, 35.6 и 32.3% соответственно.
Толщина мышцы после полета. При изменении положения угла в голеностопном суставе с –15° до +30° толщина МИМ уменьшалась на 42.9% (с 11.9 до 6.8 мм), ЛИМ – на 46.8% (с 7.7 до 4.1 мм) и КМ – на 46.2% (с 9.1 до 4.9 мм).
Силовые свойства. После продолжительного космического полета сила сокращения ТМГ снижалась (p < 0.05). При этом изометрическая Рос уменьшилась в среднем на 7.4%; а МПС – на 25.8% и Ро – на 17.7% (рис. 4).
Рис. 4.
Изменение силы одиночного сокращения (Pос; Pt), максимальной произвольной силы (МПС; MVC), максимальной электрически вызванной тетанической силы сокращения (Ро; частота 150 имп/с) (верхняя панель) и силового дефицита (Pd) ТМГ (нижняя панель) под влиянием продолжительного космического полета. * p < 0.05; ** p < 0.01. Fig. 4. The effect of a long-duration space flight on the maximal twitch response of force (Pt), maximal voluntary contraction (MVC), and evoked electrical tetanic stimulation at a frequency of 150 impulses × s–1 (Pо) (top pa-nel) and force deficiency (Pd) (bottom panel) of the triceps surae muscle. MG – medialis gastrocnemius; LG – lateralis gastrocnemius; SOL – soleus * p < 0.05; **p < 0.01.
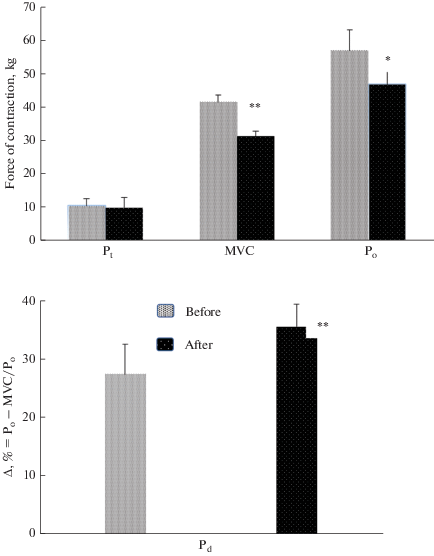
Величина Рд, составлявшая в фоновых исследованиях в среднем 27.4 ± 5.0%, после космического полета увеличилась (p < 0.05), достигнув в среднем 35.5 ± 3.8% (рис. 4).
Скоростные свойства. Анализ изменения времени развития Рос после космического полета обнаружил незначительное уменьшение ВОС на 4% и 1/2 ПР – на 9.9%.
Скоростно‑силовые свойства. Снижение МПС (на 25.8%) после космического полета сопровождалось существенным замедлением (p < 0.05) времени (обратная величина скорости) развития произвольного изометрического сокращения мышцы во время выполнения “взрывного” произвольного сокращения (рис. 5, верхняя панель). Так, после космического полета время достижения относительного 25-, 50- и 75%-ного уровня от МПС существенно (р < 0.05) увеличилось в среднем на 13.9, 20 и 16.7% соответственно.
Рис. 5.
Изменение скорости развития “взрывного” произвольного сокращения (верхняя панель) и электрически вызванного тетанического (частота 150 имп/с) сокращения ТМГ (нижняя панель) под влиянием продолжительного космического полета. * p < 0.05; ** p < 0.01. Fig. 5. Average curves showing the development of force while executing explosive voluntary contraction (top panel) and as a result of electrical stimulation at 150 impulses × s–1 (lower panel). **p < 0.05 **p < 0.01.

При этом анализ данных электрически вызванных сокращений ТМГ не обнаружил существенных различий в скорости развития изометрического напряжения мышцы (рис. 5, нижняя панель).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании мы определяли влияние продолжительного пребывания в условиях реальной микрогравитации на сократительные функции и архитектуру (длину и угол наклона волокон) ТМГ у человека в условиях in vivo и попытались связать изменения между функцией и архитектурой мышцы. Архитектура мышцы вместе с ее внутренними свойствами, такими как состав волокон, затрагивает функциональные характеристики мышцы (например, максимальную силу и скорость укорочения) [47, 48].
Это первое исследование, с количественной оценкой степени изменений внутренней архитектуры разных головок ТМГ (МИМ, ЛИМ и КМ) у человека в условиях in vivo в покое и после продолжительного космического полета. Настоящее исследование показало существенное реконструирование архитектуры и функций ТМГ, вызванное длительным пребыванием в условиях микрогравитации, и является первым исследованием, где одновременно использовали определение угла наклона и длину мышечных волокон (ультразвуковая визуализация) как главных детерминантов механической генерации мышцы. Настоящее исследование об изменении внутренней архитектуры мышцы можно рассматривать как уникальное, так как продолжительность разгрузки составила 180 сут., а многие предыдущие сообщения базировались лишь на исследованиях, полученных в модельных условиях [2, 16, 31, 49].
Основным результатом настоящего исследования было снижение величины МПС (–26%) ТМГ после 180-суточного пребывания в условиях реальной микрогравитации. Изменение в функциях мышцы под воздействием внешних условий может быть обусловлено либо изменениями в сократительных процессах, либо в нервной (моторной) команде. Действительно, на показатель МПС влияют такие факторы как связь сила‑длина волокон мышцы, геометрическое расположение мышцы относительно ее сустава и архитектурные характеристики мышцы. Однако, поскольку большинство мышц у человека перистые, то правильная интерпретация функциональных перестроек вследствие разгрузки мышечного аппарата должна учитывать изменения во внутренней организации мышцы, известной как архитектура мышцы [28–30]. На изменение в способности генерировать силу мышц больше влияют различия в их внутренней архитектуре, чем в составе волокон [50, 51].
Попытки определить архитектуру мышц у человека ранее предпринимались, и в основном они базировались на исследованиях образцов бальзамированных препаратов [52]. Однако данные относительно архитектуры бальзамированных мышц человека не отражают истинных размеров волокон в условиях in vivo или in situ. Действительно, используя магнитно-резонансную томографию [41] и ультразвуковую визуализацию [23, 25] в исследовании степени изменения в условиях in vivo геометрических показателей, т.е. длины и угла наклона волокна [24, 35], было показано, что геометрия волокон сильно изменчива. Кроме того, угол наклона изменяется обратно пропорционально как функция длины волокна мышцы и пропорционально как функция изометрической силы, произведенной мышцей так, чтобы объем волокна мышцы сохранялся постоянным при различных длинах и сократительных фазах. Различия углов наклона для мышц человека между состоянием покоя и максимальными изометрическими сокращениями при данном суставном угле составляет порядка 120–170% [53, 54]. Поэтому отказ учитывать влияние сокращения мышцы на угол наклона волокон может быть источником серьезной ошибки [55], что указывает на важность анализа изменений особенностей механики сокращения перистых мышц и разработке неинвазивных методов определения архитектуры мышц у человека.
Поэтому глубокое понимание мышечной архитектуры действительно имеет фундаментальное значение при интерпретации вызванных разгрузкой изменений в функции мышц, учитывая ее ключевую роль в качестве детерминанта механических свойств мышц [26–28], и важно для повышения эффективности кинематики движения человека. Уменьшение длины волокна и увеличение угла наклона с увеличением длины мышцы можно рассматривать как фактор при объяснении “слабости” мышечной ткани [56]. В настоящем исследовании уменьшение длины волокон при пассивном подошвенном сгибании от –15° до +30° предполагает, что волокна мышцы стали прогрессивно “слабыми” с увеличивающимися углами в голеностопном суставе. Интересно, что после космического полета длина и угол наклона волокон уменьшались, но в большей степени изменилась длина волокон.
Лишь с развитием ультразвуковой технологии, совершенствования ультразвукового оборудования и разработкой В-режима ультразвукового сканирования появился альтернативный метод для получения количественной и качественной информации в реальном времени о мышечной архитектуре (длина и угол наклона волокон) живых мышц человека в условиях in vivo [20, 22–25]. В настоящем исследовании, используя эту технику, нами впервые предпринята попытка определить степень изменения архитектурных характеристик разных головок ТМГ у человека после продолжительного космического полета.
МИМ характеризуется более короткими длинами волокон и большими углами, что позволяет упаковать больше волокон и, следовательно, имеет больший потенциал в генерации силы. Наоборот, ЛИМ имеет самые большие длины волокон в ТМГ, соответственно, число саркомеров в мышце будет наибольшим, обеспечивая высокий скоростной потенциал [57, 58]. Эти результаты подтверждаются данными о том, что физиологическая площадь поперечного сечения МИМ в 2.5 раза больше, чем ЛИМ, тогда как различие в объеме мышцы только в 1.7 раза [39]. Максимальная скорость сокращения мышцы зависит от композиции (типа) волокон [59]. Однако, поскольку состав волокон МИМ и ЛИМ аналогичен [60], то различия в максимальной скорости укорочения и максимальной силе преимущественно определяется их архитектурными свойствами.
Пребывание в условиях микрогравитации привело к заметному уменьшению длины и угла наклона волокон и толщины КМ. Кроме того, “флексорное” положение космонавта в условиях реальной микрогравитации [61] создавало голеностопному суставу немного подошвенно-согнутое положение, что, возможно, усиливало наблюдаемый эффект и, возможно, внесло вклад в уменьшение длины волокон.
После космического полета, уменьшение длины и угла наклона мышечных волокон предполагает потерю не только последовательно, но и параллельно расположенных саркомеров соответственно. Это наблюдение согласуется с предыдущими результатами в условиях неупотребления мышцы [3]. Потеря включенных последовательно расположенных саркомеров подразумевает, что рабочий диапазон каждого саркомера становится слишком большим. Когда рабочий диапазон каждого саркомера становится больше 3.65 мк, то актин и миозин не могут взаимодействовать [62]. Функциональным последствием уменьшения длины волокон мышцы будет снижение количества образований поперечных мостиков и, как следствие этого, уменьшение МПС.
Изменение числа последовательно расположенных саркомеров может затронуть и угол наклона волокон, при котором волокна мышцы укорачиваются во время сокращения [3]. Наблюдаемый меньший угол наклона мышечных волокон после космического полета, по-видимому, частично компенсирует потерю силы из-за более эффективной передачи силы к сухожилию, несмотря на снижение жесткости МСК, как ранее было показано у космонавтов после космического полета и у испытуемых после пребывания в условиях, моделирующих микрогравитацию [2, 63, 64]. Уменьшение жесткости МСК после космического полета может означать, что для генерации продукции любого уровня мышечной силы, деформация сухожилия будет значительно большей после космического полета. Уменьшенная жесткость сухожилия приведет к изменению отношения длина–напряжение от оптимальной длины в зоне этого отношения, что вызовет уменьшение активного напряжения для этих саркомеров, вследствие этого сила сокращения мышцы в целом будет снижена. Это указывает на то, что адаптационные изменения, происходящие в мышце и МСК, к условиям разгрузки мышечного аппарата при продолжительной микрогравитации, компенсируют друг друга, чтобы поддержать постоянным функциональный диапазон мышцы.
Данные, полученные в настоящем исследовании, показывают, что архитектура разных головок ТМГ значительно отличается, отражая, возможно, их функциональные свойства. Результаты свидетельствуют о том, что мышцы с различными функциональными свойствами могут по-разному отвечать на разгрузку, это должно быть принято во внимание в программах реабилитации после любого вида разгрузки. Эти выводы имеют важное клиническое значение для восстановления опорно-двигательного аппарата после разгрузки на Земле и в условиях микрогравитации. Рекомендуется, чтобы сухожилию, помимо мышц, уделялось большее внимание во время реабилитации, которая предпочтительно должна начинаться в течение первых двух недель после возвращения на Землю.
ЗАКЛЮЧЕНИЕ
Результаты, представленные в настоящем исследовании, во-первых, указывают, на то, что метод ультрасонографии можно использовать для оценки степени изменения архитектуры мышц в условиях in vivo и, во-вторых, дают представление о функционировании мышечных волокон человека в условиях in vivo, а также о взаимодействии между ними. Продолжительное пребывание в условиях реальной микрогравитации приводит к изменению внутренней архитектуры ТМГ (угла наклона и длины мышечного волокна) и снижению сократительных функций мышцы. Архитектура разных головок ТМГ значительно отличается, отражая, возможно, их функциональные роли. Изменение длины и угла наклона волокон между мышцами, как в исходном состоянии, так и особенно после пребывания в условиях продолжительной микрогравитации, могут быть связаны с различиями в способности продуцировать силу мышцы и упругих, эластических характеристик сухожилий и апоневрозов.
Результаты данного исследования ясно показывают, что архитектура мышечных волокон в условиях покоя значительно отличается от архитектуры мышц после пребывания в условиях продолжительной микрогравитации. До настоящего времени данные архитектуры мышц были получены, главным образом, на фрагментах бальзамированных мышц. Однако данные, полученные при исследовании бальзамированных мышц человека, могут внести неточные, а в некоторых случаях даже ошибочные результаты.
Таким образом, метод ультразвукового сканирования мышц является высокоинформативным и доступным методом оценки архитектуры скелетных мышц человека in vivo после пребывания в условиях продолжительной микрогравитации и может быть использован в комплексе с другими методами для оценки функционального состояния мышц и для изучения механизмов, ответственных за изменения функций под влиянием различных факторов.
Список литературы
Gopalakrishnan R., Gencenc K.O., Rice A.J., Lee S.M.C., Evans H.J., Maender C.C., Ilaslan H., Cavanagh P.R. Muscle volume, strength, endurance, and exercise loads during 6-month missions in space. Aviat. Space Environ. Med. 81: 91–102. 2010.
Kubo K., Akima H., Kouzaki M., Ito M., Kawakami Y., Kanehisa H., Fukunaga T. Changes in the elastic properties of tendon structures following 20 days bed rest in humans. Eur. J. App. Physiol. 83: 463–468. 2000.
Narici M.V., Cerretelli P. Changes in human skeletal muscle architecture induced by disuse atrophy. J. Physiol. 506: 59. 1998.
Berg H.E., Larsson L., Tesch P.A. Lower limb skeletal muscle function after 6 weeks of bed rest. J. Appl. Physiol. 82: 182–188. 1997.
Koryak Yu.A. Influence of simulated microgravity on mechanical properties in the human triceps surae muscle in vivo. I: Effect of 120 days of bed‑rest without physical training on human muscle musculo‑tendinous stiffness and contractile properties in young women. Eur. J. Appl. Physiol. 114: 1025–1036. 2014.
Akima H., Kubo K., Imai M., Kanehisa H., Suzuki Y., Gunji A., Fukunaga T. Inactivity and muscle: effect of resistance training during bed rest on muscle size in the lower limb. Acta Physiol. Scand. 172: 269–278. 2001.
Григорьева Л.Г., Козловская И.Б. Влияние невесомости и гипокинезии на скоростно-силовые свойства мышц человека. Космич. биол. и авиакосмич. мед. 21(1): 27–30. 1987 [Grigor’eva L.S., Kozlovskaya I.B. Effect of microgravity and hypokinesia on the strength-velocity properties of human muscles. Kosm. Biol. Aviakosm. Med. 21. 27–30. 1987. (In Russ)].
Akima H., Foley J.M., Prior B.M., Dudley G.A., Meyer R.A. Vastus lateralis fatigue alters recruitment of musculus quadriceps femoris in humans. J. Appl. Physiol. 92: 679–684. 2002.
Kozlovskaya I.B. In: Neurophysiological effects caused by short-and long-term exposures to microgravity. Aerospace Sci. Ed.Yajima K. Tokyo. Nihon Univer. 145–150. 1991.
LeBlanc A., Gogia P., Schneider V., Krebs J., Schonfeld E., Rvans H. Calf muscle area and strength changes after five weeks of horizontal bed rest. Am. J. Sp. Med. 16: 624–629. 1988.
Alkner B.A., Tesch P.A. Efficacy of a gravity-independent resistance exercise device as a countermeasure to muscle atrophy during 29-day bed rest. Acta Physiol. Scand. 181: 345–357. 2004.
Loram I.D., Maganaris C.N., Lakie M. Paradoxical muscle movement in human standing. J. Physiol. 556: 683–689. 2004.
Stapley P., Pozzo T., Grishin A., Papaxanthis C. Investigating centre of mass stabilisation as the goal of posture and movement coordination during human whole body reaching. Biol. Cybern. 82: 161–172. 2000.
Sarabon N., Stefan L., Jan C., Milan S., Helmut K. Strength training in elderly people improves static balance: a randomized controlled trial. Eur. J. Transl. Myol. Basic Appl. Myol. 23: 85–89. 2013.
Friedrich J.A., Brand R.A. Muscle fiber architecture in the human lower limb. J. Biotech. 23: 91–95. 1990.
Kawakami Y., Akima H., Kubo K., Muraoka Y., Hasegawa H., Kouzaki M., Imai M., Suzuki Y., Gunji A., Kanehisa H., Fukunaga T. Changes in muscle size, architecture, and neural activation after 20 days of bed rest with and without resistance exercise. Eur. J. Appl. Physiol. 84: 7–12. 2001.
Rugg S.G., Gregor R.J., Mandelbaum B.R., Chiu L. In vivo moment arm calculations at the ankle using magnetic resonance imaging (MRI). J. Biomech. 23: 495–501. 1990.
Kawakami Y., Nakazawa K., Fujimoto T., Nozaki D., Miyashita M., Fukunaga T. Specific tension of elbow flexor and extensor muscles based on magnetic resonance imaging. Eur. J. Appl. Physiol. 68: 139–147. 1994.
Anderson D.E., Bean J.F., Holt N.E., Keel J.C., Bouxsein M.L. Computed tomography-based muscle attenuation and electrical impedance myography as indicators of trunk muscle strength independent of muscle size in older adults. Am. J. Phys. Med. Rehabil. 93: 553–561. 2014.
Hiraoka A., Aibiki T., Okudaira T., Toshimori A., Kawamura T., Nakahara H., Suga Y., Azemoto N., Miyata H., Miyamoto Y., Ninomiya T., Hirooka M., Abe M., Matsuura B., Hiasa Y., Michitaka K. Muscle atrophy as pre-sarcopenia in Japanese patients with chronic liver disease: computed tomography is useful for evaluation. J. Gastroenterol. 50: 1206–1213. 2015.
Rutherford O.M., Jones D.A. Measurement of fibre pennation using ultrasound in the human quadriceps in vivo. Eur. J. Appl. Physiol. 65: 433–437. 1992.
Kuno S., Fukunaga T. Measurement of muscle fibre displacement during contraction by real-time ultrasonography in humans. Eur. J. Appl. Physiol. 70: 45–48. 1995.
Narici M.V., Hoppeler H., Kayser B., Landoni L., Classen H., Gavardi C., Conti M., Ceretelli P. Human quadriceps cross-sectional area, torque and neural activation during 6 months strength training. Acta Physiol. Scand. 157: 175–186. 1996.
Kawakami Y., Abe T., Fukunaga T. Muscle-fiber pennation angles are greater in hypertrophied than in normal muscles. J. Appl. Physiol. 74: 2740–2744. 1993.
Kawakami Y., Abe T., Kuno S.Y., Fukunaga T. Training-induced changes in muscle architecture and specific tension. Eur. J. Appl. Physiol. 72: 37–43. 1995.
Gans C., Bock W.J. The functional significance of muscle architecture – a theoretical analysis Ergeb. Anat, Entwicklungsgesch. 38: 115–142. 1965.
Gans C. Fiber architecture and muscle function. Exerc. Sport Sci. Rev. 10: 160–207. 1982.
Gans C., Gaunt A.S. Muscle architecture in relation to function. J. Biomech. 24. 53–65. 1991.
Fukunaga T., Ichinose Y., Ito M., Kawakami Y., Fukashiro S. Determination of fascicle length and pennation in a contracting human muscle in vivo. J. Appl. Physiol. 82: 354–358. 1997.
Muhl Z.F. Active length-tension relation and the effect of muscle pennation on fiber lengthening. J. Morphol. 173: 285–292. 1982.
Коряк Ю.А., Кузьмина М.М., Бережинский И.В., Коваленко В.М. Продолжительная электромиостимуляционная тренировка мышц у человека в условиях механической разгрузки двигательного аппарата и ее влияние на архитектуру и функцию трехглавой мышцы голени. Фундамент. исслед. 3: 69–87. 2010. [Koryak Yu.A., Kuz’mina M.M., Berezhinsky I.V., Kovalenko V.М. Long-term electromyostimulation training of muscles in a man in the conditions of mechanical unloading of the muscular apparatus and its influence on the architecture and function of the human triceps surae muscle. Fundament. Res. 3: 69–87. 2010. (In Russ)].
Maganaris C.N., Baltzopoulos V., Sargeant A.J. Changes in Achilles tendon moment arm from rest to maximum isometric plantarflexion: in vivo observations in man. J. Physiol. 510: 977–985. 1998.
Хельсинкская Декларация Всемирной медицинской ассоциации. 1964. [WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects. 1964].
Aagaard P., Andersen J.L., Dyhre-Poulsen P., Leffers A.M., Wagner A., Magnusson S.P., Halkjaer-Kristensen J., Simonsen E.B. A mechanism for increased contractile strength of human pennate muscle in response to strength training: changes in muscle architecture. J. Physiol. 534(2): 613–623. 2001.
Blazevich A.J., Gill N.D., Bronks R., Newton R.U. Training-specific muscle architecture adaptation after 5-wk concurrent training in athletes. Med. Sci. Sports Exerc. 35: 2013–2022. 2003.
Kanehisa H., Muraoka Y., Kawakami Y., Fukunaga T. Fascicle arrangements of vastus lateralis and gastrocnemius muscles in highly trained soccer players and swimmers of both genders. Int. J. Sports Med. 24: 90–95. 2003.
Kubo K., Kanehisa H., Azuma K., Ishizu M., Kuno S.Y., Okada M., Fukunaga T. Muscle architectural characteristics in young and elderly men and women. Int. J. Sports Med. 24: 125–130. 2003.
Kawakami Y., Ichinose Y., Fukunaga T. Architectural and functional features of human triceps surae muscles during contraction. J. Appl. Physiol. 85: 398–404. 1998.
Fukunaga T. Roy R.R., Shellock F.G., Hodgson J.A., Day M.K., Lee P.L., Kwong-Fu H., Edgerton V.R. Physiological cross-sectional area of human leg muscles based on magnetic resonance imaging. J. Orthop. Res. 10: 926–934. 1992.
Berg H.E., Tedner B., Tesch P.A. Changes in lower limb muscle cross-sectional area and tissue fluid volume after transition from standing to supine. Acta Physiol. Scand. 148: 379–385. 1993.
Scott S.J., Engstrom C.M., Loeb G.E. Morphometry of human thigh muscles: determination of fascicle architecture by magnetic resonance imaging. J. Anat. 182: 249–257. 1993.
Finni T., Hodgson J.A., Lai A.M., Edgerton V.R., Sinha S. Nonuniform strain of human soleus aponeurosis-tendon complex during submaximal voluntary contractions in vivo. J. Appl. Physiol. 95: 829–837. 2003.
Коц Я.М., Абсалямов Т.М., Зорин В.П., Коряк Ю.А., Кузнецова С.П., Син Л.Д. Модификация тендометрического метода измерения силы сокращения отдельных мышц у человека. Физиология человека. 2: 1045–1048. 1976. [Kots Ya.M., Absalyamov T.M., Zorin V.P., Koryak Yu.A., Kuznetsov S.P., Sin L.D. Modification of the tendometric method to measure the force contraction for individual human muscles. Human Physiology. 2: 1045–1048. 1976. (In Russ)].
Коряк Ю.А. Адаптация скелетных мышц к изменению нагрузки. Экспериментальное исследование. LAP LAMBERT Acad. Publisahid. GmbH & Co. KG Germany. 2011. [Koryak Yu.A. Adaptation of the skeletal muscles to the load change. Ed. House Acad. Natural History 2012. (In Russ)].
Коряк Ю.А. Нервно-мышечная адаптация к кратковременным и продолжительным космическим полетам человека. ИМБП РАН. Российский сегмент. М. (Григорьев А.И., Ушаков И.Б., ред.) 2: 93–123. 2011. [Koryak Yu.A. Neuromuscular adaptation to short-term and long-duration space flights. ISS, RAS IBMP. Russia segment. М (Grigor’ev A.I., Ushakov I.B., eds.): 93–123. 2011. (In Russ)].
Водолазский Л.А., Мойкин Ю.В. Методика изучения рабочих движений в производственных условиях. Методы физиол. исследований труд. процессов. М. Наука. 1960. [Vodolazsky L.A., Moikin Yu.V. Methds for studying work movements in a production environment. Methods of physiological studies of work processes. M. Nauka. 1960. (In Russ)].
Powell P., Roy R.R., Kanim P., Bello M.A., Edgerton V.R. Predictability of skeletal muscle tension from architectural determinations in guinea pig hind-limbs. J. Appl. Physiol. 57: 1715–1721. 1984.
De Boer M.D., Maganaris C.N., Seynnes O.R., Rennie M.J., Narici M.V. Time course of muscular, neural and tendinous adaptations to 23 day unilateral lower-limb suspension in young men. J. Physiol. 583:1079–1091. 2007.
Reeves N.D., Maganaris C.N., Ferretti G., Narici M.V. Influence of 90-day simulated microgravity on human tendon mechanical properties and the effect of resistive countermeasures. J. Appl. Physiol. 98: 2278–2286. 2005.
Bodine S.C., Roy R.R., Meadows D.A., Zernicke R.F., Sacks R.D., Fonrnier M, Edgerton V.R. Architectural, histochemical, and contractile characteristics of a unique biarticular muscle: the cat semitendinosus. J. Neurophysiol. 48: 192–201. 1982.
Burkholder T.J., Fingado B., Baron S., Lieber R.L. Relationship between muscle fiber types and sizes and muscle architectural properties in the mouse hindlimb. J. Morphol. 221: 177–190. 1994.
Friedrich J.A., Brand R.A. Muscle fiber architecture in the human lower limb. J. Biotech. 23: 91–95. 1990.
Herbert R.T., Gandevia S.C. Changes in pennation with joint angle and muscl torque: In vivo measurements in human brachialis muscle. J. Physiol. 482: 523–532. 1995.
Narici M.V., Binzoni T., Hiltbrand E., Fasel J., Terrier F., Cerretelli P. In vivo human gastrocnemius architecture with joint angle at rest and during graded isometric contraction. J. Physiol. 496: 287–297. 1996.
Maganaris C.N., Baltzopoulos V., Sargeant A.J. In vivo measurements of the triceps surae architecture in man: implications for muscle function. J. Physiol 512: 604–613. 1998.
Alexander R.McN. Animal Mechanics. Lecturer in Zoology at the University College of North Wates, Bangor. London. Sidgwick & Jackson. 1976.
Huijing P.A. Architecture of the human gastrocnemius muscle and some functional consequences. Acta Anat. 123: 101–107. 1985.
Wickiewicz T.L., Roy R.R., Powell P.L., Edgerton V.R. Muscle architecture of the human lower limb. Clin. Orthop. 179: 275–283. 1983.
Spector S.A., Gardiner P.F., Zernicke R.F., Roy R.R., Edgerton V.R. Muscle architecture and force-velocity characteristics of cat soleus and medial gastrocnemius: implications for motor control. J. Neurophysiol. 44: 951–960. 1980.
Johnson M.A., Polgar J., Weightman D., Appleton D. Data oп the distribution of fibre types in thirty-six human muscles: an autopsy study. J. Neurol. Sci. 18: 111-129. 1973.
Clément G., Gurfinkel V.S., Lestienne F. Mechanisms of posture maintenance in weightlessness. Vestibular and Visual Control on Posture and Locomotor Equilibrum (Black I, ed.). Karger. Basel. Switzerland: 158–163. 1985.
Gordon A.M., Huxley A.F., Jullian F.J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. J. Physiol.184. 170–192.1966.
Koryak Yu.A. Influence of long-term space flight on mechanical properties of the human triceps surae muscle: electromechanical delay and musculo-tendinous stiffness. J. Skeletal Muscle. 1(1): 1–10. 2017.
Koryak Yu.A. Influence of simulated microgravity on mechanical properties in the human triceps surae muscle in vivo. II: Effect of 120 days of bed-rest with physical training on human muscle musculo-tendinous stiffness and contractile properties in young women. Central Eur. J. Sport Med. 11: 125–143. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


