Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1085-1097
Изменение характера поведения и активности гипофизарно-адренокортикальной системы крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс–рестресс” перед спариванием
Н. Э. Ордян 1, *, С. Г. Пивина 1, В. К. Акулова 1, Г. И. Холова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: neo@infran.ru
Поступила в редакцию 18.05.2020
После доработки 19.06.2020
Принята к публикации 05.07.2020
Аннотация
В работе изучено влияние стрессирования самцов крыс в парадигме “стресс–рестресс”, являющейся моделью посттравматического стрессового расстройства (ПТСР) на поведенческий фенотип и активность гипофизарно-адренокортикальной системы (ГАС) их половозрелых потомков обоего пола. Показано, что только часть самцов формируют ПТСР-подобное состояние, характеризующееся сниженным базальным уровнем кортикостерона. Потомки этих самцов имели низкую массу тела в неонатальный период развития, а во взрослом возрасте характеризовались сниженной двигательной активностью и повышенной депрессивностью поведения. Базальная и стрессорная активность ГАС этих животных была снижена, а чувствительность изученной гормональной оси к сигналам отрицательной обратной связи усилена. Поведенческие изменения были наиболее выражены у потомков-самцов, тогда как у потомков-самок последствия ПТСР-подобного состояния отцов выявлены только в отношении уровня тревожности и активности ГАС. Потомки самцов, не сформировавших ПТСР-подобное состояние, имели наименьшие изменения в поведении и активности ГАС. Высказано предположение, что выраженность действия стресса отца на потомков определяется индивидуальной стресс-устойчивостью самцов-отцов.
В настоящее время возрастает количество экспериментальных и эпидемиологических данных, указывающих на влияние отцовского стресса на поведение потомков. На лабораторных грызунах было установлено, что независимо от периода онтогенеза (стресс в ювенильном возрасте или у половозрелых животных), когда предъявлялись стрессорные воздействия самцам, у потомков проявляется увеличение депрессивно-подобного и тревожного поведения. Так, Franklin с соавт. показали, что длительный отъем от матери с 1-го по 14-й дни жизни у самцов формирует депрессивно-подобный фенотип, который проявляется у их потомков первого и даже второго поколения [1]. В исследованиях других авторов, проведенных на половозрелых мышах, получены сходные данные, но с использованием парадигмы “стресс социальных поражений” [2]. Отметим, что в этих исследованиях в качестве стрессорных воздействий самцам предъявлялись стрессоры, которые у крыс и мышей формируют депрессивно-подобное состояние, проявляющееся не только в усилении депрессивно-подобного поведения, но и в повышенной секреции глюкокортикоидов – характерный клинический симптом больных депрессией [3, 4].
В эпидемиологических исследованиях была обнаружена связь между стрессом отца и физиологическими особенностями их детей. Показано, что в семьях больных посттравматическим стрессовым расстройством (ПТСР), этиология которого связана с сильным психотравматизирующим стрессорным воздействием, наблюдается усиление ПТСР-подобных симптомов у их потомков, которые сами по себе воздействию травматического стресса не подвергались [5, 6]. Развитие ПТСР, хотя и связано с сильным стрессорным воздействием, в отличие от депрессии характеризуется иным профилем активности гипофизарно-адренокортикальной системы (ГАС), заключающимся не только в снижении базальной активности, но и в повышенной чувствительности к сигналам отрицательной обратной связи [7]. Такое состояние отцов перед зачатием может специфическим образом проявляться у их потомков. Однако экспериментальных исследований влияния ПТСР отца на физиологические функции потомков не проводили.
В связи с этим в настоящем исследовании изучено влияние ПТСР-подобного состояния самцов крыс перед спариванием на поведенческий фенотип и характер активности ГАС их потомков обоего пола. Для формирования у самцов признаков ПТСР использовали парадигму “стресс–рестресс”, в которой сниженный уровень кортикостерона и повышенная тревожность сохраняются длительно [8].
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты выполнены на половозрелых самцах крыс линии Вистар массой 240–250 г из ЦКП “Биоколлекция” Института физиологии им. И.П. Павлова РАН и их потомстве обоего пола 75-дневного возраста массой 230–240 г. Животных содержали в стандартных условиях вивария без ограничения доступа к воде и пище (гранулированный корм) и 12-часовом световом режиме. Все манипуляции с животными были проведены в соответствии с принципами Базельской декларации и рекомендациями Комиссии по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Парадигму “стресс–рестресс” использовали в качестве модели ПТСР. Самцов (n = 10) подвергали комбинированному стрессорному воздействию с последующим рестрессом на 7-е сутки после комбинированного стресса по методике, описанной ранее [8]. Животные подвергались комбинированному стрессу, состоящему из двухчасовой иммобилизации, 20-минутного плавания и эфирного стресса до потери сознания. Триггером для развития патологического состояния являлся повторный стресс (“рестресс”), заключавшийся в иммобилизационном стрессе в течение 30 мин, проведенном на 7-е сутки после комбинированного стресса. Контрольных самцов (n = 10) оставляли интактными.
С целью контроля развития у самцов ПТСР-подобного состояния на 10-е сутки после рестресса у контрольных и стрессированных самцов осуществляли забор крови из хвостовой вены для определения уровня кортикостерона.
Через 38–40 сут после рестресса самцов обеих групп поодиночке подсаживали к двум регулярно циклирующим самкам, находящимся в стадии проэструс–эструс. Наступление беременности контролировали по наличию сперматозоидов в вагинальном мазке. В случае, если беременность не наступала, самцов оставляли с самками еще на один эстральный цикл. Самок, у которых в вагинальном мазке обнаруживали сперматозоиды, сразу отсаживали от самцов и до 17-го дня беременности содержали в группах по 6 животных, а далее по одной особи в клетке. На следующий день после родов число крысят в пометах выравнивали до 8 животных с равным соотношением полов. Пометы с преобладанием крысят одного пола или с малым количеством животных из исследования исключали.
Полученное потомство содержали совместно с самками до 30-дневного возраста, а затем в группах по 6–7 животных в соответствии с полом. С целью контроля соматического развития потомков стрессированных и интактных самцов взвешивали на 5-й, 10-й, 15-й и 20-й дни жизни. Дальнейшие эксперименты выполнены на половозрелых потомках обоего пола.
Поведение самцов и самок – потомков контрольных и стрессированных отцов –изучали с использованием различных тестов, позволяющих оценить уровень тревожности (тест приподнятый крестообразный лабиринт), ориентировочно-исследовательскую активность (тест открытое поле) и депрессивность поведения (тест вынужденное плавание). Все тесты выполняли на одних и тех же животных, последовательность тестов определялась их стрессогенностью. До начала тестирования всех животных ежедневно брали в руки на протяжении 8 дней (хендлирование). У самок хендлирование совмещали с взятием влагалищных мазков с целью определения стадии эстрального цикла. Для поведенческих тестов брали только регулярно циклирующих самок. Тестирование самок начинали в стадию диэструс.
В первый день выполняли тест приподнятый крестообразный лабиринт, как наименее стрессогенный. Каждое животное помещали в центр лабиринта, состоящего из двух закрытых и двух открытых рукавов (НПК Открытая наука, Россия). Открытые рукава имели дополнительное освещение 150 лк. В течение 5 мин регистрировали время нахождения животных в открытых или закрытых рукавах. Уровень тревожности рассчитывали как обратно пропорциональное время пребывания крысы в открытых рукавах.
На второй день крыс тестировали в открытом поле, которое представляло собой четырехугольную камеру размером 90 × 90 × 50 см, пол которой был расчерчен на 30 квадратов размером 15 × 15 см каждый. Освещенность камеры составляла 300 лк. В этом тесте в течение 5 мин регистрировали следующие параметры: число пересеченных квадратов, число вертикальных стоек без упора, продолжительность груминга и замирания.
Тест вынужденное плавание выполняли через 7 сут после теста открытое поле. В этом тесте крыс индивидуально помещали в стеклянные цилиндры (55 × 20 см), заполненные водой на уровне 30 см, температура воды поддерживалась на постоянном уровне 23–25°С. Время неподвижности регистрировали в течение 5 мин.
Поведение животных фиксировали с помощью видеокамеры (СANON, Япония), расположенной над соответствующей установкой, с последующим просмотром видео и анализом параметров поведения на персональном компьютере.
Поведенческие тесты проводили в 11.00–15.00 ч. В каждой экспериментальной группе животных участвовало 8 самцов и самок.
Отдельную группу животных – потомков стрессированных и контрольных самцов – использовали для изучения активности ГАС, которую оценивали по уровню кортикостерона в покое (базальный уровень) и по динамике изменения уровня этого гормона в ответ на 30-минутную иммобилизацию. Каждую крысу помещали в пластиковый пенал и в течение не более 3 мин из хвостовой вены отбирали пробы крови (0 мин, базальная активность). Далее через 30 мин повторяли отбор крови (30 мин, стрессорная активность ГАС). Затем крысу из пенала извлекали, помещали в домашнюю клетку, а через 180 мин кровь из хвостовой вены отбирали вновь (торможение ГАС после стрессорной активации). Полученные пробы крови центрифугировали (1000 g, 20 мин, 4°С) и далее плазму хранили при температуре –20°С до момента определения содержания в ней кортикостерона.
Уровень кортикостерона в плазме крови определяли методом иммуноферментного анализа, используя стандартные наборы производства ХЕМА (Россия) и анализатор Multickan FS (Thermo Fisher Scientific, Финляндия). Оценку активности ГАС проводили с 11-00 до 14-00 ч. Каждая группа контрольных и подопытных крыс состояла из 6 животных соответствующего пола.
Статистическую обработку результатов поведенческих тестов проводили с использованием пакета программ STATISTICA 8.0. Уровень кортикостерона в крови самцов-отцов оценивали с применением U-критерия Манна–Уитни. Влияние стресса отца на массу тела потомков в разные дни жизни оценивали с помощью однофакторного анализа ANOVA. Результаты поведенческих тестов анализировали с использованием однофакторного и двухфакторного анализа ANOVA (экспериментальная группа × пол животного). Характер активности ГАС оценивали с помощью двухфакторного анализа ANOVA (экспериментальная группа × уровень кортикостерона в зависимости от времени начала стрессирования). При выявлении различий проводили последующие парные post-hoc сравнения (тест Тьюки). Равенство дисперсий анализировали с применением критерия Ливиня, который показал однородность дисперсий для всех выборок (p > 0.05). Для проверки гипотезы нормальности распределения данных в выборках использовали критерий Шапиро–Уилка. В качестве критерия статистически значимого различия принимали p < 0.05. Результаты представлены в виде среднего арифметического ± стандартная ошибка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования показали, что только у части самцов-отцов (n = 6), подвергнутых стрессированию, наблюдается сниженный уровень кортикостерона в крови (65 ± 8.1 нмоль/л, p < 0.05) на 10-е сутки после рестресса, тогда как у 4 самцов уровень кортикостерона (187 ± 21.2 нмоль/л) не отличался от контрольных, не стрессированных животных (192 ± 22.3 нмоль/л).
Результаты исследования соматического развития крысят – потомков контрольных и стрессированных отцов – представлены в табл. 1. Однофакторный дисперсионный анализ соматического развития крысят выявил эффект отца (группы животных) на массу тела потомков-самцов на 5-й (F2,56 = 41.3, p < 0.0001) и на 10-й дни жизни (F2,47 = 3.4, p = 0.038). При этом животные, родившиеся от отцов в ПТСР-подобном состоянии (низкий уровень кортикостерона), отличались сниженной массой тела на 5-й и 10-й дни жизни как от потомков контрольных самцов, так и от потомков отцов с нормальным уровнем кортикостерона после стрессирования. Сходное влияние отца на массу тела было обнаружено и у потомков самок на 5-й (F2,55 = 16.5, p < 0.0001) и на 10-й дни жизни (F2,55 = 6.1, p = 0.004). Самки – потомки отцов с низким уровнем кортикостерона после стрессирования имели статистически значимо более низкую массу тела, чем самки, родившиеся от контрольных или стрессированных самцов с нормальным уровнем кортикостерона на 5-й и 10-й дни жизни.
Таблица 1.
Эффекты стресса отцов на массу их потомков – самцов и самок Table 1. Effects of paternal stress on body weight of male and female offspring
| Группа самцов-отцов Father group | Масса тела крысят потомков-самцов (г) Body weight of male offspring (g) |
|||
|---|---|---|---|---|
| 5 дней жизни 5 day of life |
10 дней жизни 10 day of life |
15 дней жизни 15 day of life |
20 дней жизни 20 day of life |
|
| Травматический стресс и рестресс (группа 1) Traumatic stress and restress (group 1) |
11.3 ± 0.19** | 21.4 ± 0.4* | 32.13 ± 0.3 | 41 ± 2.5 |
| Травматический стресс
и рестресс (группа 2) Traumatic stress and restress (group 2) |
13.9 ± 0.2 | 22.9 ± 0.5 | 32.9 ± 0.3 | 43.5 ± 1.9 |
| Контрольная группа Control group |
13.2 ± 0.2 | 22.8 ± 0.4 | 33 ± 0.7 | 44 ± 1.5 |
| Масса тела крысят потомков-самок (г) Body weight of female offspring (g) |
||||
| Травматический стресс
и рестресс (группа 1) Traumatic stress and restress (group 1) |
11.2 ± 0.2** | 20.6 ± 0.6** | 29.8 ± 1.4 (p = 0.05) |
39.0 ± 1.6 |
| Травматический стресс
и рестресс (группа 2) Traumatic stress and restress (group 2) |
12.4 ± 0.1 | 22.8 ± 0.2 | 31.4 ± 0.3 | 41.0 ± 0.9 |
| Контрольная группа Control group |
12.5 ± 0.2 | 21.7 ± 0.5 | 31.9 ± 0.6 | 41 ± 1.4 |
В связи с этим в дальнейших исследованиях мы анализировали поведение потомков стрессированных отцов, разделив их на группу 1 (низкая масса тела) и группу 2 (нормальная масса тела).
Однофакторный дисперсионный анализ ориентировочно-исследовательского поведения в тесте открытое поле выявил значимое влияние отца на локомоторную активность (F2,23 = 5.7, p = 0.009) и продолжительность замирания (F2,23 = 3.9, p = 0.03) потомков-самцов (рис. 1). Потомки-самцы с низкой массой тела в раннем неонатальном периоде имели сниженную локомоторную активность по сравнению с потомками контрольных самцов, а также увеличенное время замирания. Потомки самцов с нормальным уровнем кортикостерона демонстрировали лишь тенденцию к снижению времени замирания (p = 0.06) по сравнению с потомками контрольных самцов.
Рис. 1.
Эффекты стресса отца на поведение потомков-самцов, различающихся массой тела в неонатальный период развития, в тесте открытое поле (А–D), в тесте приподнятый крестообразный лабиринт (E, F) и тесте вынужденное плавание (G). А – локомоторная активность (число пересеченных квадратов); В – число вертикальных стоек; С – продолжительность замирания; D – продолжительность реакции груминга; E – время пребывания животных в закрытых рукавах лабиринта; F – время пребывания животных в открытых рукавах лабиринта; G – время неподвижности. Светлые столбики – потомки контрольных самцов, темные столбики – потомки стрессированных самцов с низкой массой в неонатальный период, столбики со штриховкой – потомки стрессированных самцов с нормальной массой тела в неонатальный период. Различия между потомками контрольных и стрессированных самцов: * p < 0.05, ** p < 0.01, # p = 0.06. Fig. 1. Effects of paternal stress onbehavior of male offspring differing in body weight in the neonatal period of development in the open field (А–D), the elevated plus maze (E, F), and the forced swim test (G). A – locomotor activity (number of crossed squares), B – number of rearing, C – duration of freezing reaction, D – duration of grooming reaction, E – time spent in closed arms, F – time spent in open arms, G – time of immobility. Open bars – the offspring of control males, black bars – the offspring of stressedmaleswith low weight in the neonatal period, shadedblack bars – the offspring of stressed males with normal weight in the neonatal period. Significant differences between male offspring of control and stressed males:* p < 0.05, ** p < 0.01, # p = 0.06.
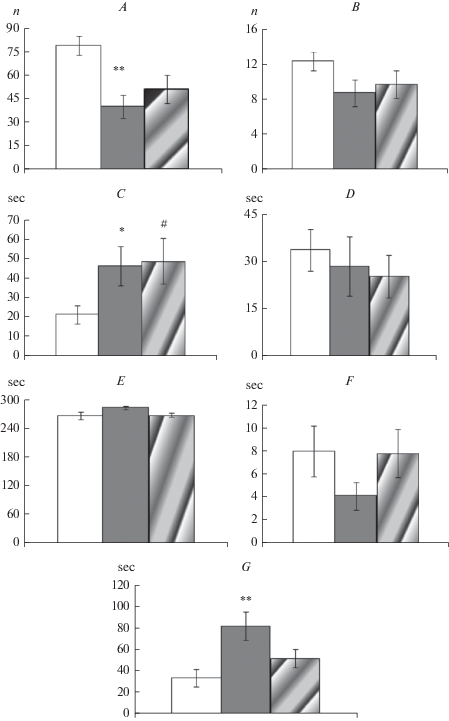
Выявлено также влияние фактора отец на время неподвижности в тесте вынужденное плавание (F2,23 = 7.8, p = 0.002). Самцы, рожденные от отцов с низким уровнем кортикостерона, характеризовались большим временем неподвижности (рис. 1, G) по сравнению с потомками контрольных самцов.
В то же время у самок – потомков стрессированных отцов – существенных изменений поведенческих характеристик практически во всех использованных тестах не обнаружено (рис. 2). Однофакторный дисперсионный анализ показал значимое влияние фактора отец на время пребывания в открытых рукавах приподнятого крестообразного лабиринта (F2,23 = 3.4, p = 0.004), а также снижение времени пребывания крыс 1-й группы (низкая масса тела) в открытых рукавах приподнятого крестообразного лабиринта и соответственно увеличение уровня тревожности по сравнению с самками – потомками контрольных самцов.
Рис. 2.
Эффекты стресса отца на поведение потомков-самок, различающихся массой тела в неонатальный период развития, в тесте открытое поле (А–D), в тесте приподнятый крестообразный лабиринт (E, F) и тесте вынужденное плавание (G). А – число пересеченных квадратов; В – число вертикальных стоек; С – продолжительность замирания; D – продолжительность реакции груминга; E – время пребывания животных в закрытых рукавах лабиринта; F – время пребывания животных в открытых рукавах лабиринта; G – время неподвижности. Светлые столбики – потомки контрольных самцов, темные столбики – потомки стрессированных самцов с низкой массой тела в неонатальный период, столбики со штриховкой – потомки стрессированных самцов с нормальной массой тела в неонатальный период. * p < 0.05 – достоверные различия между потомками контрольных и стрессированных самцов. Fig. 2. Effects of paternal stress on behavior of female offspring differing in body weight in the neonatal period of development in the open field (А–D), the elevated plus maze (E, F), and the forced swim test (G). A – locomotor activity (number of crossed squares), B – number of rearing, C – duration of freezing reaction, D – duration of grooming reaction, E – time spent in closed arms, F – time spent in open arms, G – time of immobility. Open bars – the offspring of control males, black bars – the offspring of stressed males with low weight in the neonatal period, shadedblack bars – the offspring of stressed males with normal weight in the neonatal period. * p < 0.05 – significant differences between female offspring of control and stressed males.

Двухфакторный дисперсионный анализ поведения самцов и самок разных экспериментальных групп выявил взаимодействие факторов группа животных × пол животных на уровень тревожности – время пребывания в открытых рукавах (F2,47 = 4.02, p = 0.002) и время неподвижности в тесте вынужденное плавание (F2,47 = 6.2, p = 0.004), что свидетельствует о межполовых различиях в действии стресса отца на тревожное и депрессивно-подобное поведение потомков.
Двухфакторный дисперсионный анализ выявил статистически значимое влияние у самцов фактора группа животных (F2,35 = 8.4, p = 0.0006) и уровня кортикостерона в зависимости от времени начала стрессирования (F2,35 = 63.6, p < 0.0001) у потомков-самцов, взаимодействие этих факторов было статистически значимо (F4,35 = 5.7, p = 0.005). У потомков-самок также было обнаружено статистически значимое влияние фактора группа животных (F2,35 = 23.9, p < 0.0001) и уровня кортикостерона в зависимости от времени начала стрессирования (F2,35 = 53.2, p < 0.0001), а также взаимодействие этих факторов (F4,35 = 12.4, p < 0.0001).
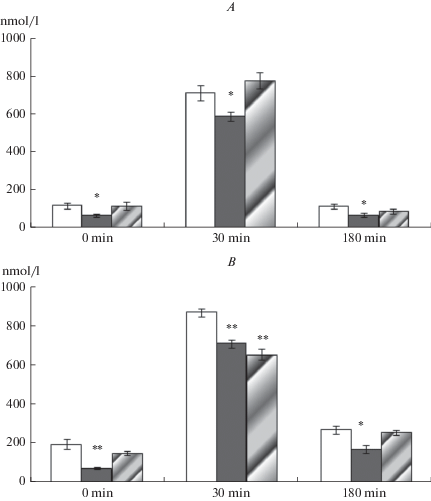
Сравнение уровня кортикостерона в каждой временной точке стрессорного ответа показало статистически значимое снижение базального уровня гормона у самцов и самок 1-й группы (низкая масса тела), более низкий уровень кортикостерона через 180 мин после начала иммобилизации по сравнению с контрольными крысами (рис. 3). Последние данные указывают на более быстрое торможение активности ГАС после стрессорной активации. У самцов 1-й группы и у самок обеих групп выявлено снижение стрессорного уровня кортикостерона в 30-минутной временной точке по сравнению с контрольными животными. Таким образом, стресс самцов перед спариванием оказывает влияние на базальную и стрессорную реактивность ГАС потомков обоего пола. У потомков, имевших низкую массу тела в неонатальном периоде развития, изменения активности ГАС более выражены.
Рис. 3.
Эффекты стресса отца на уровень кортикостерона (nmol/l) в плазме крови в ответ на 30-минутный иммобилизационный стресс у потомков-самцов (А) и самок (В) крыс, различающихся массой тела в неонатальный период развития. Светлые столбики – потомки контрольных самцов, темные столбики – потомки стрессированных самцов с низкой массой тела в неонатальный период, столбики со штриховкой – потомки стрессированных самцов с нормальной массой тела в неонатальный период. 0 min – базальный уровень кортикостерона; 30 min – иммобилизация; 180 min – уровень кортикостерона спустя 3 ч. Достоверные различия между потомками контрольных и стрессированных самцов: * p < 0.01, ** p < 0.001. Fig. 3. Effects of paternal stress on plasma corticosterone (nmol/l) response to an acute 30 min restraint stress in their male (A) and female (B) offspring differing in body weight in the neonatal period of development. Open bars – the offspring of control males, black bars – the offspring of stressedmaleswith low weight in the neonatal period, shadedblack bars – the offspring of stressed males with normal weight in the neonatal period. 0 min – basal level of corticosterone; 30 min – restraint; 180 min – level of corticosterone 3 hr later. Significant difference from the offspring of control males:* p < 0.01, ** p < 0.001.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследованиях, выполненных Cohen и Zohar на популяции крыс линии Спрэг–Доули, было показано, что только четверть животных проявляет максимальное или минимальное изменение в поведении в модели ПТСР, а у половины из протестированных крыс нарушения в поведении были выражены частично [9]. При использовании аналогичного подхода (разделение животных по выраженности поведенческих нарушений при моделировании ПТСР) был показан различный профиль экспрессии генов в мозге чувствительных и устойчивых к стрессу животных и, в частности, в отношении экспрессии гена глюкокортикоидных рецепторов у чувствительных крыс [10].
Помимо поведенческих проявлений ПТСР-подобного состояния надежным показателем его развития в модельных экспериментах служит снижение активности ГАС, поскольку это является диагностическим критерием ПТСР в клинике [7]. Основываясь на этих данных, мы оценили уровень кортикостерона у самцов-отцов, подвергнутых стрессированию в парадигме “стресс–рестресс”. Оказалось, что, действительно, только у части самцов наблюдалось снижение уровня кортикостерона в крови на 10-е сутки после рестресса, что расценено нами как ПТСР-подобное состояние. Примечательно, что именно потомки этих самцов имели сниженную массу тела в ранний неонатальный период развития.
В литературе имеются многочисленные указания на то, что низкая масса тела при рождении служит фактором риска развития в последующей жизни многих заболеваний, таких как метаболический синдром [11], сердечно-сосудистыезаболевания [12], синдром гиперактивности и дефицита внимания [13], а также депрессии [14]. В исследованиях на лабораторных животных были получены сходные результаты [15, 16].
Оценивая дифференцированно поведенческие и гормональные проявления стресса самцов-отцов у их потомков с низкой и нормальной массой тела при рождении, мы выявили, что у потомков с низкой массой поведенческие изменения были более выражены. Так, у потомков-самцов с низкой массой наблюдали снижение локомоторной активности и увеличение времени неподвижности в тесте открытое поле. Кроме того, у самцов с низкой массой возрастало время неподвижности в тесте вынужденное плавание и соответственно усиливалась депрессивность поведения. Следует отметить, что у самок-потомков стрессированных отцов независимо от массы тела при рождении поведенческие изменения были минимальны. Только у самок с низкой массой тела выявлено увеличение уровня тревожности в тесте приподнятый крестообразный лабиринт. Более выраженный эффект стрессирования отцов перед спариванием у потомков с низкой массой проявлялся и в отношении активности ГАС. Причем, эти эффекты были сходны у потомков-самцов и самок и заключались в снижении базальной и стрессорной активности системы, а также ускоренном ее торможении после стрессорной активации. Снижение стрессорной активности ГАС также выявлено у потомков-самок с нормальной массой тела.
Изменения в поведении и активности ГАС потомков стрессированных отцов были обнаружены и другими авторами. Однако результаты этих работ весьма противоречивы. Так, было показано, что хронический умеренный стресс самцов мышей как в период пубертата, так и в период половой зрелости снижает общий стрессорный выброс кортикостерона у потомков-самцов и самок, но не оказывает влияние на поведение [17]. В работе других авторов, напротив, было показано, что хронический стресс социальных поражений в течение 10 дней самцов мышей перед спариванием повышает базальный уровень кортикостерона у их потомков и формирует поведенческий фенотип, характеризующийся повышенной тревожностью и депрессивностью [2]. Хроническое стрессирование (вариант иммобилизационного стресса в течение 30 мин дважды в день) самцов крыс линии Лонг–Еванс в течение 27 дней перед спариванием повышало уровень тревожности у потомков в период пубертата и снижало его у взрослых крыс [18]. Моделирование стресса у самцов мышей путем хронического введения кортикостерона в течение 4 нед. повышало уровень тревожности у потомков, но только у самцов, в то время как у самок изменений в поведении этими авторами не обнаружено [19]. В исследованиях Yeshurun и соавт. [20], напротив, было показано преимущественное влияние хронического введения глюкокортикоидов самцам мышей перед спариванием на способность к пространственному обучению у потомков-самок, но не самцов. Такие различия в полученных данных, вероятно, определяются типами стрессорных воздействий на самцов-отцов и их длительностью.
Обращает на себя тот факт, что при наличии ПТСР-подобных симптомов у самцов-отцов (сниженный уровень кортикостерона) у их потомков обоего пола наблюдается снижение активности ГАС как в отношении базальной и стрессорной активности, так и в отношении более быстрого ее выключения после стрессорной активации. В клинических исследованиях было показано, что потомки отцов, болеющих ПТСР вследствие участия в войнах, имеют сниженный базальный уровень кортизола в вечернее время по сравнению с потомками здоровых отцов [21]. Эти данные, а также наши собственные результаты указывают на взаимосвязь заболевания ПТСР у отцов и риском развития у их потомков ПТСР, поскольку было показано, что сниженный базальный уровень активности ГАС и усиление ее чувствительности к сигналам отрицательной обратной связи является фактором риска развития ПТСР [6, 22].
Анализируя данные литературы и наши собственные результаты, мы пришли к заключению, что выраженность и направленность действия стресса отца на потомков, вероятнее всего, определяется не только силой стрессорного воздействия, но и индивидуальной стресс-устойчивостью животных. Действительно, при использовании достаточно мягкого стресса, к которому относится, например, хронический умеренный стресс, изменения поведенческого фенотипа потомков были наименьшими, несмотря на его значительную длительность [17]. В нашей работе сильный травматический стресс использовали однократно, и через 7 сут самцов стрессировали повторно (рестресс) для формирования у них ПТСР-подобного состояния на длительный срок и характерного для клинической картины ПТСР снижения базальной активности ГАС. Тем не менее, только у части самцов базальный уровень кортикостерона был снижен и только у потомков этих самцов изменения в поведении были наиболее значительными. Несмотря на то, что в работе мы использовали инбредных крыс линии Вистар, так же, как и в исследованиях Cohen и Zohar на популяции крыс линии Спрэг–Доули [9], была выявлена различная чувствительность этих животных к сильному стрессорному воздействию. Показано, что у линий крыс, различающихся выраженностью стрессорного ответа ГАС, частота проявлений поведенческих нарушений в модели ПТСР также различна [23]. Возможно, использованные нами в эксперименте животные также имеют отличия в стресс-реактивности ГАС, однако, подобное предположение нуждается в дальнейшей проверке.
Таким образом, в данной работе мы показали, что стрессирование самцов крыс в парадигме “стресс–рестресс”, являющейся моделью ПТСР, только часть самцов формируют ПТСР-подобное состояние, характеризующееся сниженным базальным уровнем кортикостерона. Потомки этих самцов имеют низкую массу тела в неонатальный период развития, а во взрослом возрасте проявляют сниженную двигательную активность и повышенную депрессивность поведения, а также пониженную базальную и стрессорную активность ГАС с усилением чувствительности этой гормональной оси к сигналам отрицательной обратной связи. Поведенческие изменения были наиболее выражены у потомков-самцов, тогда как у потомков-самок последствия ПТСР-подобного состояния отцов выявлены только в отношении уровня тревожности и активности ГАС. Потомки самцов, не сформировавших ПТСР-подобное состояние, имели наименьшие изменения в поведении и активности ГАС, причем как потомки-самцы, так и потомки-самки.
Список литературы
Franklin T.B., Russig H., Weiss I.C., Gräff J., Linder N., Michalon A., Vizi S., Mansui I.M. Epigenetic transmissionof the impact of early stress across generations. Biol. Psychiatry. 68: 408–415. 2010.
Dietz D.M., LaPlant Q., Watts E.L., Hodes G.E., Russo S.J., Feng J., Oosting R.S., Vialou S., Nestler E.J. Paternal transmission of stress-induced pathologies. Biol. Psychiatry. 70: 408–414. 2011.
Hollis F., Kabbai M. Social defeat as an animal model for depression. ILAR J. 55(2): 221–232. 2014.
Czén B., Fuchs E., Wiborg O., Simon M. Animal models of major depression and their clinical implications. Prog. Neuropsyhopharmacol. Biol. Psychiatry. 64: 293–310. 2016.
Yehuda R., Blair W., Labinsky E., Bierer L.M. Effects of parental PTSD on the cortisol response to dexamethasone administration in their adult offspring. Am. J. Psychiatry. 164(1): 163–166. 2007.
Lehrner A., Bierer L.M., Passarelli V., Pratchett L.C., Flory J.D., Bader H.N., Harris I.R., Bedi A., Daskalakis N.P., Makotkine I., Yehuda R. Maternal PTSD associates with greater glucocorticoid sensitivity in offspring of Holocaust survivors. Psychoneuroendocrinology. 40: 213–220. 2014.
Yehuda R. Status of glucocorticoid alterations in post-traumatic stress disorder. Ann. N.Y. Acad. Sci. 1179: 56–59. 2009.
Ordyan N.E., Smolenskiy I.V., Pivina S.G., Akulova V.K., Rakitskaya V.V. Characteristics of the Formation of the Anxious-Depressive State in an Experimental Model of Post-Traumatic Stress Disorder in Prenatally Stressed Male Rats. Neurosci. Behav. Physiol. 44 (6): 657–663. 2014.
Cohen H., Zohar J. An animal model of posttraumatic stress disorder: the use of cut-off behavioral criteria. Ann. N. Y. Acad. Sci. 1032: 167–178. 2004.
Daskalakis N.P., Cohen H., Cai G., Buxbaum J.D., Yehuda R. Expression profiling associates blood and brain glucocorticoid receptor signaling with trauma-related individual differences in both sexes. PNAS. 111(37): 13529–13534. 2014.
Gluckman P.D., Hanson M.A. The developmental origins of the metabolic syndrome. Trends Endocrinol. Metab. 15(4): 183–187. 2004.
Alexander B.T., Dasinger J.H., Intapad S. Fetal programming and cardiovascular pathology. Compar. Physiol. 5(2): 997–1025. 2015.
Franz A.P., Bolat G.U., Bolat H., Matijasevich A., Santos I.S., Silveira R.C., Procianoy R.S., Rohde L.A., Moreira-Maia C.R. Attention-deficit/hyperactivity disorder and very preterm/very low birth weight: a meta-analysis. Pediatrics. 141(1): e1645. 2018.
Loret de Mola C., de França G.V., QuevedoLde A., Horta B.L. Low birth weight, preterm birth and small for gestational age association with adult depression: systematic review and meta-analysis. Br. J. Psychiatry. 205(5): 340–347. 2014.
Green A.S., Rozance P.J., Limesand S.W. Consequences of a compromised intrauterine environment on islet function. Endocrinology. 205(3): 211–224. 2010.
Vuguin P.M. Animal models for small for gestational age and fetal programming of adult disease. Horm. Res. 68(3): 113–123. 2007.
Rodgers A.B., Morgan C.P., Bronson S.L., Revello S., Bale T.L. Paternal stress exposure alters sperm microRNA content and reprogramming offspring HPA axis stress regulation J. Neurosci. 33(21): 90003–9012. 2013.
Harker A., Carrol C., Raza S., Kolb B., Gibb R. Preconception paternal stress in rats alters brain and behavior of offspring. Neuroscience. 388: 474–485. 2018.
Short A.K., Fennell K.A.,Perreau V.M., Fox A., O’Bryan M.K., Kim J.H., Bredy T.W., Pang T.Y., Hannan A.J. Elevated paternal glucocorticoid exposure alters the small noncoding RNA profile in sperm and modifies anxiety and depressive phenotypes in the offspring. Transl. Psychiatry. 6: e837. 2016.
Yeshurun S., Rogers J., Short A.K., Renoir T., Pang T.Y., Hannana A.J. Elevated paternal glucocorticoid exposure modifies memory retention in female offspring. Psychoneuroendocrinology. 83: 9–18. 2017.
Yahyavi S.T., Zarghami M., Naghshvar F., Danesh A. Relationship of cortisol, norepinephrine, and epinephrine levels with war-induced posttraumatic stress disorder in fathers and their offspring. Rev. Brasil. Psiquiatria. 37: 93–98. 2015.
Yehuda R., Bierer L.M. Transgenerational transmission of cortisol and PNSD risk. Prog. Brain Res. 167: 121–135. 2008.
Cohen H., Zohar J., Gidron Y., Matar M.A., Belkind D., Loewenthal U., Kozlovsky N., Kaplan Z.Blunted HPA axis response to stress influences susceptibility to posttraumatic stress response in rats. Biol. Psychiatry. 59(12): 1208–1218. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


