Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 28-42
Особенности социального поведения мышей после длительного действия психоэмоционального и инфекционного факторов
Д. Ф. Августинович 1, 2, *, Н. П. Бондарь 1, 3
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Институт химии твердого тела и механохимии СО РАН
Новосибирск, Россия
3 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: avgust@bionet.nsc.ru
Поступила в редакцию 25.08.2020
После доработки 02.10.2020
Принята к публикации 19.10.2020
Аннотация
В работе исследовали поведение самцов мышей инбредной линии C57BL/6 после длительного влияния двух факторов – социального стресса и инфицирования описторхами, сочетание которых часто наблюдается у людей. Сравнивали мышей четырех групп: 1) испытавших длительный опыт поражений в межсамцовых конфронтациях (30 дней) (СС); 2) инфицированных гельминтами O. felineus (6 мес.) (OF); 3) подвергнутых воздействию обоих факторов (СС + OF); 4) не испытывающих воздействия факторов интактных особей (КОН). Поведение всех животных оценивали в тесте открытое поле с помещенным в него кубиком – пустым в первые 3 мин теста и содержащим незнакомого самца инбредной линии BALB/c во вторые 3 мин. Социальный стресс оказывал более выраженное влияние на оцениваемые параметры поведения в этом тесте, чем инфицирование мышей. Мыши СС активнее всех исследовали кубик с незнакомым самцом внутри: залезали на него гораздо чаще и имели более длительное среднее время нахождения возле кубика. Кроме того, в первые 3 мин теста у них были увеличены исследовательская активность (число пристеночных стоек), число и длительность грумингов. Инфицированные мыши OF не отличались по поведению от КОН как в первые, так и во вторые 3 мин теста. У мышей с сочетанным действием факторов (СС + OF) несоциальные формы поведения также не отличались от контрольных показателей, а реакция на незнакомого самца в кубике была слабее, чем у мышей СС. Сделан вывод о том, что длительный опыт поражений в межсамцовых конфронтациях оказывает более выраженное влияние на социальное и несоциальное поведение мышей по сравнению с хроническим инфицированием животных гельминтами O. felineus, причем сочетание двух факторов воздействия способствует снижению социального интереса у мышей.
Поведение лабораторных животных используют в качестве маркеров функционального состояния мозга. Ранее нами было показано, что длительный психоэмоциональный стресс у мышей линии C57BL/6 вызывает развитие тревожно-депрессивного поведения [1]. Другими исследователями показано, что стресс повторных социальных поражений обуславливает нейровоспаление, которое и способствует пролонгированному патологическому поведению у животных [2, 3]. При этом увеличивается число циркулирующих в крови моноцитов за счет усиления в костном мозге процессов гемопоэза [2, 4] и повышается уровень кортикостерона, а также синтез провоспалительных цитокинов – интерлейкина-6 (ИЛ-6), ИЛ-1β и фактора некроза опухоли альфа (ФНО-α) [5]. Считается, что психологический стресс, активируя симпатическую и гипоталамо-гипофизарно-надпочечниковую системы, обуславливает иммунологические и поведенческие ответы [3]. При этом методом магнитно-резонансной томографии у стрессированных животных установлена перманентная активация областей мозга, участвующих в регуляции тревожно-депрессивного состояния [6].
Однако функции мозга могут находиться под корректирующим влиянием других органов и систем в организме, на которые непосредственно направлено действие внешних факторов. В этой связи в последние годы растет интерес к исследованиям в рамках парадигмы “liver–brain interactions”, поскольку показано, что патологические нарушения в печени животных вызывают нейровоспаление в мозге [5, 7], проявляющееся на поведенческом уровне в виде так называемого болезненного поведения (sickness behavior), подразумевающего быструю утомляемость, повышенное беспокойство, потерю аппетита, нарушения сна и снижение социального интереса [8]. Более 40% людей больных циррозом печени страдают минимальной печеночной энцефалопатией (МПЭ) [9], которая выражается в виде психомоторной заторможенности, дефицита внимания, когнитивных нарушений и визуально-пространственной дискоординации [10]. Со временем МПЭ переходит в клиническую форму с более серьезными неврологическими нарушениями, приводящими к коме и смерти [7, 11]. Поэтому, моделируя патогенные “удары” по печени (“liver strike”), мы можем получать поведенческие изменения, обусловленные функциональными сдвигами в мозге.
Примером такого “удара” можно рассматривать описторхоз, который у млекопитающих возникает при заражении гельминтами семейства Opisthorchiidae ‒ Opisthorchis viverrini (O. viverrini) или Opisthorchis felineus (O. felineus). По данным продовольственной и сельскохозяйственной ООН и Всемирной организации здравоохранения печеночные сосальщики, куда входят представители этого семейства, занимают 8-е место по степени патогенности в общемировом списке из 24 паразитов пищевого происхождения, оказывающих существенные негативные социально-экономические последствия [12]. В Российской Федерации и особенно Западной Сибири широко представлен вид O. felineus [13]. При употреблении в пищу зараженной рыбы семейства карповых Cyprinidae у рыбоядных животных и человека развивается описторхоз, провоцирующий тяжелые осложнения в печени и поджелудочной железе (гнойный холангит, холецистит, хронический гепатит, стриктуры желчевыводящих путей, абсцесс печени, обтурационную желтуху, панкреатит) вплоть до холангиокарциномы [14–18]. Системное воспаление, возникающее при описторхозе, сопровождается повышением в крови про-воспалительных цитокинов [19], среди которых ИЛ-6, ИЛ-1β и ФНО-α вместе с моноцитами крови способны проникать в мозг и вызывать нейровоспаление [5, 8, 20]. Таким образом, описторхоз в настоящее время рассматривается как системное заболевание, провоцирующее нарушения в органах и системах, отдаленных от непосредственной локализации паразитов в печени [21, 22].
Можно ожидать, что сочетание двух факторов, длительного социального стресса и хронического инфицирования гельминтами, что часто происходит в жизни людей, будет повышать потенциал патологического влияния на мозг и проявляться в нарушении поведения. В этой связи очевидна актуальность моделирования описторхоза у животных. Ранее нами было показано, что у мышей инбредной линии C57BL/6 уже через 2 нед. после одновременного действия инфицирования описторхами и социального стресса изменяется поведение в приподнятом крестообразном лабиринте, свидетельствующее о развитии тревожности [23]. При этом динамика массы тела и относительная масса печени были в пределах нормы, но увеличивалась относительная масса селезенки – основного органа периферической иммунной системы, что может свидетельствовать о развитии воспаления в организме хозяина паразита. Поэтому целью настоящего исследование был анализ поведения мышей инбредной линии C57BL/6 после более длительного инфицирования гельминтами (6 мес.) в сочетании с 30-дневным социальным стрессом, который, как известно, способствует нейровоспалению, приводящему к поведенческим нарушениям [24]. В тесте открытое поле оценивали коммуникативность мышей по реакции на незнакомого самца, изолированного в перфорированный кубик, помещенный в поле, а также несоциальные формы поведения.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе были использованы самцы мышей инбредной линии C57BL/6 и аутбредной CD-1, массой тела 25‒30 г, в возрасте 2.5–3 мес., содержащиеся в стандартных условиях конвенционального вивария: нормированный световой режим 12 : 12 (свет/темнота), t = 24°С, при достаточном количестве гранулированного корма и воды. Все процедуры осуществляли в соответствии с принципами Хельсинской декларации, а также согласно решению биоэтической комиссии Института цитологии и генетики СО РАН (протокол № 26 от 13 марта 2015 г.).
Мыши C57BL/6 были разделены на 4 группы: КОН ‒ контрольные, которым однократно перорально вводили физиологический раствор и далее продолжали содержать сформированными иерархически группами в стандартных клетках размером 36 × 23 × 12 см до начала поведенческого тестирования; OF ‒ инфицированные метацеркариями гельминтов O. felineus (длительность заражения 6 мес.) и содержащиеся группами до поведенческого тестирования; СС ‒ содержащиеся 5 мес. группами, как и контрольные животные, а далее рассаженные с самцами CD-1 через прозрачную перфорированную перегородку посередине экспериментальной клетки 28 × 14 × 10 см для проведения межсамцовых конфронтаций в течение 30 дней; СС + OF ‒ мыши, испытавшие оба воздействия. Мыши из групп КОН и OF за 5 дней до поведенческого тестирования были рассажены индивидуально в экспериментальные клетки с целью нивелирования эффекта иерархических взаимодействий в группах [25]. Далее у мышей всех четырех групп производили видеозапись поведения животных в тесте открытое поле с кубиком.
Метацеркарии гельминтов O. felineus были выделены из естественно инфицированных язей, выловленных в реке Обь в окрестностях г. Новосибирска. Рыбный фарш подвергали ферментативной обработке (11.0 мл концентрированной HCl, 7 г пепсина на 1.0 л H2O) в течение ночи при 37°С, фильтровали и промывали несколько раз осадок физиологическим раствором. После выделения метацеркарии идентифицировали под световым микроскопом, отсчитывали для каждого животного 50 личинок, которые перорально вводили с помощью специальных зондов (Braintree Scientific, Inc., США).
Для инициации хронического социального стресса в работе была использована модель сенсорного контакта [26] с некоторыми модификациями. В каждой клетке 28 × 14 × 10 см в одной половине находился самец инбредной линии C57BL/6, в другой – самец аутбредной линии CD-1, используемый в качестве агрессивного партнера. Ежедневно во второй половине дня (15.00–17.00 ч) на 3 мин убирали перегородку между самцами, что провоцировало межсамцовые конфронтации. При этом следили, чтобы не было выраженных интенсивных атак со стороны агрессора, в противном случае самцов разделяли перегородкой. В конце каждой конфронтации мышей C57BL/6 пересаживали в соседнюю клетку за перегородку к другому агрессивному самцу CD-1. Самцы CD-1 в течение всего эксперимента оставались на своей территории. Поведение самцов C57BL/6 регистрировали в открытом поле через сутки после последней 30-й конфронтации.
Поведение животных записывали на видео с помощью веб-камеры Logitech HD 1080P. За 5 мин до поведенческого тестирования животных приносили в комнату, где было установлено поле размером 40 × 40 см из белого пластика, расчерченное на квадраты (4 х 4 см). Высота стенок была 40 см. Из того же материала был изготовлен маленький кубик, одна грань которого отсутствовала, а остальные 5 граней содержали отверстия диаметром 7 мм, в количестве 14 на каждой грани. Открытой гранью кубик был прижат к середине одной из сторон тестового поля. Каждое животное помещали всегда на фиксированное расстояние от кубика (20 см). В первые 3 мин тестирования мыши исследовали поле с кубиком. Далее под кубик на 3 мин сажали незнакомого самца линии BALB/c и вновь записывали поведение тестируемой мыши. После каждой мыши поле протирали разведенным в 3 раза этанолом (96%) и насухо вытирали бумажными салфетками, а кубики мыли водопроводной водой и высушивали. Верхний свет в комнате был выключен, над полем была установлена пластиковая полупрозрачная панель, над которой были помещены лампы дневного света. Освещенность на уровне поля с мышью была 320 лк. Выбор мышей линии BALB/c в качестве партнера был продиктован тем, что они используются для анализа социабельности в рамках парадигмы “social approach test” другими исследователями в качестве незнакомого социального стимула для самцов C57BL/6 [27–30]. Дальнейший анализ поведения осуществляли с помощью программного обеспечения Observer (Noldus Information Technology). При этом регистрировали число и длительность подходов и/или обращений к кубику, среднее время за один подход/обращение к кубику, число пересеченных мышью квадратов, число и длительность пристеночных стоек, число и длительность грумингов. Все параметры поведения мышей в первые 3 мин теста (без незнакомого самца в кубике) мы рассматривали как несоциальные.
Поведение мышей 4-х экспериментальных групп оценивали с помощью двухфакторного дисперсионного анализа с учетом фактора повторных измерений (Repeated measures ANOVA) в программе Statistica 6. В качестве факторов использовали “социальный стресс” (стресс, не стресс), “инфекция” (инфекция, не инфекция) и “повторные измерения” (показатели в первый и второй 3-минутный период тестирования). Последующее post hoc сравнение осуществляли с помощью критерия Tukey HSD. Статистически значимыми считались показатели при значениях p < 0.05 и на уровне тенденции при 0.05 < p < 0.1. Данные представлены как среднее ± SEM. Число животных в группах было: КОН – 15, OF – 22, СС – 19, СС + OF – 23.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При анализе поведения мышей в группах КОН и СС были выявлены особи, которые залезали на кубик в первые и вторые 3 мин тестирования (табл. 1). В группе КОН таких мышей было 15.8% (первые 3 мин) и 21.1% (вторые 3 мин), а в группе СС ‒ 45% (первые 3 мин) и 35% (вторые 3 мин). При этом взбиравшиеся на кубик животные вели себя по-разному: некоторые делали несколько попыток вскарабкаться на кубик, но в большинстве случаев мыши залезали один раз. Были особи, которые находились на кубике не более 20 с, но некоторые животные предпочитали сидеть на кубике и обнюхивать отверстия, особенно в случае, когда в кубике находился незнакомый самец. Обращает на себя внимание, что в группе CC таких животных в общей сложности было 13, что гораздо больше, чем в группе КОН. В группах OF и CC + OF залезающих на кубик животных не было, что говорит об ингибирующем влиянии инфицирования животных на их социабельность.
Таблица 1.
Поведенческая реакция мышей C57BL/6 на самца BALB/c, находящегося в кубике, расположенном в открытом поле Table 1. Behavioral reaction of C57BL/6 mice to a BALB/c male into a box placed in the open field
| Первые 3 мин (пустой кубик)/ First 3 min (empty box) |
Вторые 3 мин (самец BALB/c в кубике)/ Second 3 min (BALB/c male into box) |
|||
|---|---|---|---|---|
| число влезаний/ number of climbs |
суммарная длительность, с/ total duration, s |
число влезаний/ number of climbs |
суммарная длительность, с/ total duration,s | |
| Мыши КОН/CON mice | ||||
| 1 | Одно/one | 57 | Два/two | 67 |
| 2 | Два/two | 76 | Три/three | 63 |
| 3 | ‒ | ‒ | Одно/one | 122 |
| 4 | Одно/one | 75 | Одно/one | 43 |
| Мыши СС/SS mice | ||||
| 1 | Одно/one | 63 | ‒ | ‒ |
| 2 | Одно/one | 31 | Одно/one | 53 |
| 3 | ‒ | ‒ | Одно/one | 60 |
| 4 | Одно/one | 18 | Два/two | 95 |
| 5 | ‒ | ‒ | Одно/ one | 43 |
| 6 | ‒ | ‒ | Одно/one | 50 |
| 7 | Одно/one | 14 | ‒ | ‒ |
| 8 | Одно/one | 14 | ‒ | ‒ |
| 9 | Одно/one | 140 | Одно/one | 84 |
| 10 | Одно/one | 62 | ‒ | ‒ |
| 11 | Одно/one | 20 | ‒ | ‒ |
| 12 | Одно/one | 55 | ‒ | ‒ |
| 13 | ‒ | ‒ | Одно/one | 45 |
Дальнейшее сравнение животных 4-х экспериментальных групп выявило влияние факторов воздействия и их взаимодействие на поведение мышей возле кубика (табл. 2). Фактор “социальный стресс” определял число подходов/обращений к кубику: этот показатель был заметно повышен в первые 3 мин теста у мышей, испытывающих данное воздействие, особенно у мышей СС. Установлено статистически значимое влияние факторов “инфекция” и “социальный стресс” на длительность нахождения возле кубика и среднее время за один подход/обращение к кубику. В обоих случаях было статистически значимое взаимодействие факторов. Эти показатели увеличились у мышей всех 4-групп во вторые 3 мин теста, когда под кубиком находился незнакомый самец (рис. 1, табл. 2), (фактор “повторные измерения”, p < 0.001 во всех группах). Обращает на себя внимание то, что максимальное значение среднего времени нахождения возле кубика за один подход как в первые, так и во вторые 3 мин теста были у мышей из группы СС. Поскольку мыши с сочетанным действием факторов не отличались от мышей групп КОН и OF, а также учитывая статистически значимое взаимодействие факторов, можно говорить о том, что инфекционный фактор оказывает противоположное социальному стрессу действие.
Таблица 2.
Влияние факторов воздействия и повторного тестирования на параметры поведения у мышей сравниваемых групп и взаимодействия факторов Table 2. Influence of exposure factors and retesting on behavior parameters in mice of the compared groups and interaction of factors
| Число подходов к кубику, Approaches to the box n |
Длительность возле кубика, с Duration near the box, s |
Среднее время возле кубика, с Average time near the box, s |
|
|---|---|---|---|
| Фактор “инфекция” (o) Factor “infection” (o) |
F(1,74) =1.79 p = 0.185 | F(1,74) = 10.56 p = 0.002 | F(1,74) = 6.88 p = 0.011 |
| Фактор “социальный стресс” (s) Factor “social stress” (s) |
F(1,74) = 3.02 p = 0.087 | F(1,74) = 16.43 p < 0.001 | F(1,74) = 30.78 p < 0.001 |
| Взаимодействие “o × s” Interaction “o × s” |
F(1,74) = 0.00 p = 0.986 | F(1,74) = 4.84 p = 0.031 | F(1,74) = 8.80 p = 0.004 |
| Фактор “повторные измерения” (t) Factor “repeated measures” (t) |
F(1,74) = 1.54 p = 0.219 | F(1,74) = 113.07 p < 0.001 | F(1,74) = 95.97 p < 0.001 |
| Взаимодействие “t × o” Interaction “t × o” |
F(1,74) =2.48 p = 0.120 | F(1,74) = 0.08 p = 0.780 | F(1,74) = 0.35 p = 0.554 |
| Взаимодействие “t × s” Interaction “t × s” |
F(1,74) = 38.54 p < 0.001 | F(1,74) = 0.63 p = 0.430 | F(1,74) = 2.83 p = 0.097 |
| Число пересеченных квадратов Crossed squares, n |
Число грумингов Groomings, n | Длительность грумингов, с Groomings, s | |
| Фактор “инфекция” (o) Factor “infection” (o) |
F(1,74) = 0.64 p = 0.428 | F(1,74) = 0.77 p = 0.384 | F(1,74) = 0.03 p = 0.852 |
| Фактор “социальный стресс” (s) Factor “social stress” (s) |
F(1,74) = 0.60 p = 0.440 | F(1,74) = 32.3 p < 0.001 | F(1,74) = 11.39 p = 0.001 |
| Взаимодействие “o × s” Interaction “o × s” |
F(1,74) = 0.20 p = 0.655 | F(1,74) = 2.10 p = 0.151 | F(1,74) = 2.31 p = 0.133 |
| Фактор “повторные измерения” Factor “repeated measures” |
F(1,74) = 94.64 p < 0.001 | F(1,74) = 1.79 p = 0.189 | F(1,74) = 0.00 p = 0.996 |
| Взаимодействие “t × o” Interaction “t × o” |
F(1,74) = 2.84 p = 0.096 | F(1,74) = 0.78 p = 0.380 | F(1,74) = 0.04 p = 0.842 |
| Взаимодействие “t × s” Interaction “t × s” |
F(1,74) = 46.82 p < 0.001 | F(1,74) = 0.43 p = 0.516 | F(1,74) = 5.10 p = 0.027 |
| Число стоек, Rearings, n |
Длительность стоек, с Rearings, s |
||
| Фактор “инфекция” (o) Factor “infection” (o) |
F(1,74) = 0.03 p =0.862 | F(1,74) = 1.22 p = 0.274 | |
| Фактор “социальный стресс” (s) Factor “social stress” (s) |
F(1,74) = 4.57 p = 0.036 | F(1,74) = 0.49 p = 0.487 | |
| Взаимодействие “o × s” Interaction “o × s” |
F(1,74) = 4.08 p = 0.047 | F(1,74) = 0.80 p = 0.374 | |
| Фактор “повторные измерения” Factor “repeated measures” |
F(1,74) = 8.49 p = 0.005 | F(1,74) = 0.91 p = 0.344 | |
| Взаимодействие “t × o” Interaction “t × o” |
F(1,74) = 3.98 p = 0.050 | F(1,74) = 2.86 p = 0.095 | |
| Взаимодействие “t × s” Interaction “t × s” |
F(1,74) = 37.18 p < 0.001 | F(1,74) = 39.71 p < 0.001 |
Рис. 1.
Параметры поведения мышей экспериментальных групп в тесте “открытое поле с кубиком”. tp < 0.05; ttp < 0.01; tttp < 0.001 – по сравнению с аналогичными показателями в первые 3 мин; *p < 0.05; **p < 0.01; ***p < 0.001 – по сравнению с КОН в соответствующий период; оp < 0.05; ооp < 0.01; оооp < 0.001 – по сравнению с OF; n – число, s – секунды. Fig. 1. Behaviors of mice in test “Open field with box”. tp < 0.05; ttp < 0.01; tttp < 0.001 – in comparison with similar parameters in the first 3 min; *p < 0.05; **p < 0.01; ***p < 0.001 – in comparison with CON in the corresponding time period; оp < 0.05; ооp < 0.01; оооp < 0.001 – in comparison with OF; n – number, s – seconds.
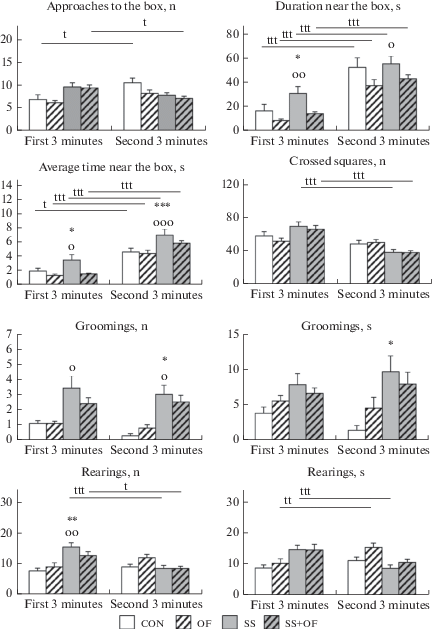
Двигательная активность мышей определялась по числу пересеченных квадратов поля. Статистически значимого влияния факторов “инфекция” и “социальный стресс”, а также их взаимодействия на этот показатель не установлено (табл. 2). В первые 3 мин у мышей СС этот показатель был несколько увеличен по сравнению с мышами OF (рис. 1). Во вторые 3 мин теста число пересеченных квадратов снижалось у мышей с социальным стрессом (СС и СС + OF) по сравнению с первыми 3 мин, поэтому мыши всех сравниваемых групп не различались между собой по двигательной активности (рис. 1). Установлено статистически значимое влияние фактора “повторные измерения”, а также взаимодействие факторов “социальный стресс” и “повторные измерения” (табл. 2). Маловероятно, что это снижение обусловлено ингибированием двигательной активности у мышей СС и СС + OF, скорее всего, оно связано с тем, что мыши с социальным стрессом предпочитали находиться возле кубика с незнакомым самцом, а не бегать по тестовой арене, это еще раз подчеркивает повышение их социального интереса.
Фактор “социальный стресс” определял число и длительность грумингов у мышей (табл. 2). В первые 3 мин теста у мышей СС число грумингов было увеличено статистически значимо по сравнению с OF, и, на уровне тенденции, по сравнению с КОН (рис. 1). По длительности грумингов мыши сравниваемых групп не различались в первые 3 мин теста. Во вторые 3 мин теста у мышей СС число грумингов было по-прежнему выше, чем у мышей КОН, и еще более увеличивалось по сравнению с мышами OF. Кроме того, у мышей СС увеличивалась длительность грумингов по сравнению с контрольными значениями. У мышей с сочетанным действием двух факторов (СС + OF) при повторном тестировании число и длительность грумингов были несколько выше, чем у мышей КОН, но не отличались от показателей у мышей СС.
Исследовательская активность определялась по числу и длительности пристеночных стоек. Установлено статистически значимое влияние фактора “социальный стресс” и взаимодействие двух используемых факторов воздействия на число стоек, а также влияние фактора “повторные измерения” (табл. 2). У контрольных животных эти показатели были одинаковы в оба периода тестирования. У мышей OF длительность стоек увеличилась во вторые 3 мин теста. У мышей с социальным стрессом (СС и СС + OF) число и длительность стоек снижались во вторые 3 мин теста, что вероятно объясняется сменой мотивации у этих животных, вызванной присутствием незнакомого самца в кубике. Межгрупповые сравнения показали, что мыши после социального стресса (СС) чаще вставали на задние лапы, чем контрольные и инфицированные особи в первые 3 мин теста (рис. 1). Во вторые 3 мин этот показатель у мышей СС и СС + OF снижался до контрольных значений. По длительности стоек животные сравниваемых групп не различались как в первые, так и во вторые 3 мин теста.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Тест открытое поле, предложенный первоначально в 1934 г. Hall [31] для оценки эмоциональности у крыс, в настоящее время претерпел множество модификаций и широко используется для исследования различных показателей у грызунов, при этом процедура тестирования может быть разной – однократное или повторное тестирование, длительность теста варьирует от 2 мин до нескольких часов. Считается, что при первой экспозиции животных в условиях открытого пространства проявляются поведенческие ответы, опосредованные тревожностью, в то время как при повторных исследованиях – привыкание животных [32]. При втором тестировании животным предъявляют новые стимулы, в качестве которых могут быть использованы другие животные, что позволяет оценивать социабельность/коммуникативность первых [33]. При этом исследуют реакцию тестируемых мышей на незнакомого самца, помещенного под перфорированный цилиндр или проволочный колпак. Таким образом, испытуемые животные взаимодействуют с интрудером без физического контакта, а социальный интерес оценивается по предпочтению нахождения рядом с незнакомой мышью.
Многочисленными исследованиями показано, что стресс социальных поражений снижает социабельность мышей. Ранее в наших работах также было установлено уменьшение коммуникативности в тесте Перегородка у мышей, испытавших в течение 20‒30 дней социальные поражения в межсамцовых конфронтациях [1, 34]. Существуют единичные данные, свидетельствующие о повышении социабельности у мышей после разной продолжительности стресса социальных поражений [35]. Они получены у нокаутных PACAP−/− мышей с делецией локуса гена PrP/PACAP, кодирующего нейропептид, активирующий аденилатциклазу гипофиза [36]. В тесте социальных взаимодействий мыши PACAP−/− проявляли явное предпочтение в отношении доминирующего самца спустя 14 дней после стресса социальных поражений. Исследователи полагают, что устойчивость мышей к негативному действию стресса социальных поражений связана с повышенным уровнем кортикостерона в течение двух недель стресса [35].
В наших экспериментах также был установлен возросший интерес к незнакомому самцу у мышей СС, испытавших 30 дней социального стресса, при оценке реакции на незнакомого самца, помещенного в перфорированный кубик. Эта группа мышей заметно отличалась от мышей КОН и OF. Следует подчеркнуть их активное исходное поведение в незнакомых условиях теста (первые 3 мин), когда они охотнее контрольных мышей исследовали пустой кубик и чаще залезали на него. Залезание на кубик полностью отсутствовало у мышей OF и СС + OF. Некоторые мыши СС находились на кубике больше минуты. Кроме того, мыши СС проявляли не только интерес к кубику, но и чаще других мышей вставали на задние лапы возле стенок тестовой арены, что отражает их повышенную исследовательскую активность. Создавалось впечатление, что мыши, испытавшие стресс социальных поражений, находятся в состоянии эмоционального возбуждения (arousal).
Во вторые 3 мин теста, когда под кубик помещали незнакомого самца, мыши СС, в отличие от мышей OF и СС + OF, по-прежнему не боялись залезать на кубик и охотно обнюхивали его, находясь сверху. И таких животных была почти половина, в то время, как у мышей КОН ‒ четверть. В то же время инфицированные мыши обеих групп не залезали ни на пустой кубик, ни на кубик с незнакомым самцом. Можно сделать вывод о том, что инфекционный фактор снижает активность мышей и их стремление к социальным контактам. Аналогичное снижение социального интереса у мышей и крыс отмечают и другие исследователи при влиянии инфекционных факторов, например, после введения эндотоксина – липополисахарида, что проявляется в виде снижения обнюхивания или закапывания бокса, содержащего незнакомого самца [37, 38]. В настоящее время пока сложно ответить на вопрос, с чем связана повышенная активность и сохранение социабельности у мышей СС даже после длительного стресса социальных поражений в предварительных межсамцовых конфронтациях. Механизмы, лежащие в основе такого поведения, нуждаются в дальнейших исследованиях. Но учитывая данные Lehmann с соавт. [35], можно предположить, что скорее всего, происходят нарушения в регуляции активности гипоталамо-гипофизарно-надпочечниковой системы.
Помимо социального, мыши сравниваемых групп различались и по несоциальному поведению. При этом фактор “социальный стресс” оказывал выраженное влияние на мышей, а фактор “инфекция” препятствовал этим изменениям. Это наглядно видно из табл. 3. В первые 3 мин теста инфицированные мыши (OF и СС + OF) не отличались от контрольных сородичей по всем исследуемым показателям. В отличие от них у мышей СС была выявлена разница от КОН по 5-ти из 8-ми оцениваемых показателей. Присутствие незнакомого самца в кубике по-прежнему не сказывалось на поведении мышей OF и несколько повышало груминг у мышей СС + OF. Мыши СС во вторые 3 мин теста отличались по поведению от мышей КОН по меньшему числу параметров (3 из 8-ми), но эти изменения были более выраженные, чем в первые 3 мин теста. При этом существенное повышение среднего времени за один подход к кубику с незнакомым самцом свидетельствует о их повышенной социабельности по сравнению с остальными мышами.
Таблица 3.
Отличия поведения мышей OF, СС и СС + OF от КОН в тесте открытого поля с кубиком Table 3. Differences in the behavior of OF, SS and SS + OF mice from CON ones in the open field test with a box
| Поведенческие параметры Behavioral parameters |
Первые 3 мин First 3 min |
Вторые 3 мин Second 3 min |
||||
|---|---|---|---|---|---|---|
| OF OF |
СС SS |
СС + OF SS + OF |
OF OF |
СС SS |
СС + OF SS + OF |
|
| Число подходов к кубику Approaches to the box, n |
(↑) | |||||
| Длительность возле кубика, с Duration near the box, s |
↑ | |||||
| Среднее время возле кубика, с Average time near the box, s |
↑ | ↑↑↑ | ||||
| Число пересеченных квадратов Crossed squares, n |
||||||
| Число грумингов Groomings, n |
(↑) | ↑ | (↑) | |||
| Длительность грумингов, с Groomings, s |
↑ | (↑) | ||||
| Число стоек Rearings, n |
↑↑ | |||||
| Длительность стоек, с Rearings, s |
||||||
Стрелка вверх указывает на повышение показателя относительно данного параметра у мышей КОН; изменения градуированы от значений на уровне тенденции (стрелка в скобках) до максимальных (три стрелки); n – число, c – секунды. Up-arrows indicate an increase in comparison to the same parameter in CON mice; changes are graduated from values at the trend level (arrow in brackets) to maximum (three arrows); n – number, s – seconds.
Сниженное число стоек у мышей СС во вторые 3 мин теста объясняется сменой мотивации: они перестают исследовать тестовую арену, больше интересуются незнакомым самцом в кубике. Кроме того, обращает на себя внимание усиление груминга у мышей после длительного социального стресса, особенно у мышей СС во вторые 3 мин теста. Этот показатель расценивается исследователями как смещенная активность, которая усиливается при помещении животных в незнакомые условия острого стресса [39]. В наших условиях эксперимента усиливающееся проявление этого паттерна поведения было у мышей СС, что также может быть отражением их повышенной стресс-реакции на незнакомый социальный стимул. Причем, по-видимому, инфекционный фактор может несколько снизить это эмоциональное возбуждение, учитывая более низкие показатели груминга у мышей СС + OF.
Ранее мы показали уменьшение коммуникативности, оцениваемой в тесте перегородка у мышей C57BL/6 в возрасте 3‒4 мес. после длительных межсамцовых конфронтаций [1]. Одновременно с этим у них развивался поведенческий дефицит в других тестах, в том числе, в приподнятом крестообразном лабиринте и тесте принудительного плавания, а также был повышен базовый уровень кортикостерона в крови [34, 40]. Все это позволило говорить о формировании у мышей тревожно-депрессивного состояния. В настоящем эксперименте были исследованы более взрослые мыши (8‒9 мес.). Возможно, наблюдаемый возбуждающий эффект стресса социальных поражений у этих мышей объясняется иными механизмами регуляции в ЦНС по сравнению с более молодыми особями. Эти различия могут быть связаны с разным участием гипоталамо-гипофизарно-надпочечниковой системы, контролирующей уровни глюкокортикоидов в крови. Во всяком случае, показано, что социальные поражения у ювенильных мышей (35-дневного возраста) способствуют повышению уровня кортикостерона в крови, сохраняющееся в течение 4-х недель после прекращения стресса, но это не наблюдалось у более взрослых мышей (70-дневный возраст) [41]. Кроме того, существенное влияние может оказывать микроглия мозга. Так, показано, что с возрастом происходит активация микроглии в гиппокампе животных, детектируемая по увеличению экспрессии маркеров микроглии (Iba-1, CD11b и MHCII) [42]. И эта возрастная активация микроглии сопровождается увеличением базального уровня кортикостерона и активацией глюкокортикоидных рецепторов в этой структуре мозга [43]. Причем, хронический стресс оказывал аналогичное действие: в 9-ти из 15-ти стресс-чувствительных областях мозга, в том числе, и в гиппокампе, хронический рестрикционный стресс обуславливал переход микроглии из покоящегося состояние в активированное [44]. Поэтому наблюдаемое нами неадекватное поведение у мышей СС, указывающее на их стремление к социальным контактам, несмотря на имеющийся 30-дневный опыт поражений в межсамцовых конфронтациях, может быть следствием этих нарушений в мозге. Дальнейшее исследование с привлечением молекулярных и иммуногистохимических методов позволит установить причину повышенной возбудимости у мышей после хронического социального стресса.
Возможно и другое объяснение повышенной возбудимости у мышей СС. Не исключено, что длительные межсамцовые конфронтации у мышей инбредной линии C57BL/6 способствуют развитию состояния, аналогичного биполярному аффективному расстройству у людей, когда периоды депрессии сменяются маниакальными эпизодами. В более раннем возрасте (3‒4 мес.) социальный стресс способствовал проявлению тревожно-депрессивных форм поведения [1, 40], а в более зрелом возрасте (9‒10 мес.) этот же стресс вызывает маниакально-подобное возбуждение. Аналогичные результаты были получены у мышей C57BL/6J при использовании комбинированного хронического стресса (чередование социальной изоляции, нарушения циркадных ритмов, изменения повседневных привычек) [45]. После трех недель стресса у мышей развивалась гиперактивность, психомоторное возбуждение и другие поведенческие изменения, аналогичные симптомам, наблюдаемым у пациентов при маниакальной стадии биполярного расстройств.
Представляется важным тот факт, что у животных с сочетанным действием двух факторов (СС + OF) изменения паттернов поведении в открытом поле менее выражены, чем у мышей СС. Следует учесть, что инфицирование было в течение 6 мес., и оно предшествовало социальному стрессу. Паразитам выгодно как можно дольше находиться в печени хозяина, за счет которого они существуют. Поэтому любые функциональные сдвиги в его организме, вызванные дополнительными внешними неблагоприятными факторами, будут “корректироваться” паразитами, в том числе, нейроиммуноэндокринные нарушения, вызванные социальным стрессом и определяющие поведение животных. Не исключено, что если бы социальный стресс предшествовал инфицированию гельминтами, были получены другие результаты. Так, у разных авторов, использующих разные патогены (бактерии, вирусы) и разное сочетание инфекционных факторов с социальными, показано, что не всегда идет обострение негативного действия одного фактора другим. Например, у мышей C57BL/6 стресс повторных социальных поражений, происходивший за 14 ч до введения липополисахарида ‒ основного компонента клеточной стенки Escherichia coli, усилил избегание социальных контактов, но не влиял на тревожное поведение, оцениваемое в открытом поле, хотя каждый фактор по-отдельности вызывал анксиогенный эффект [46]. Авторы высказали предположение, что тестирование в открытом поле могло быть недостаточно чувствительным, чтобы обнаружить эффекты взаимодействия между стрессом и липополисахаридом. В другой работе кроме животных, у которых социальный стресс предшествовал вирусной инфекции, были мыши, у которых инфицирование вирусами производили в первый день социального стресса [47]. Такой протокол эксперимента по-разному сказывался на поведении мышей в открытом поле: социальный стресс, предшествующий инфицированию, оказывал более негативные последствия на активность мышей в этом тесте, чем одномоментное сочетание двух воздействий.
Суммируя полученные нами данные, можно сказать, что поведение мышей, испытывающих длительное действие разных по природе факторов, в большей степени определяется социальным стрессом, чем O. felineus-инфицированием. Несмотря на то, что животные испытали 30-дневный стресс социальных поражений в межсамцовых конфронтациях, у них повышался интерес к незнакомым самцам и были увеличены некоторые параметры исследовательской и смещенной активности в открытом поле. Они чаще, чем контрольные мыши залезали на расположенный на тестовой арене перфорированный кубик с незнакомым интактным самцом и имели самое высокое среднее время нахождения возле него. Кроме того, при тестировании в первые 3 мин теста у них были увеличены число пристеночных стоек, а также число и длительность грумингов. Несмотря на то, что у мышей остальных групп (КОН, OF, СС + OF) также возрастал социальный интерес во вторые 3 мин теста, они не различались по среднему времени нахождения возле кубика с самцом, и этот показатель у всех был ниже, чем у мышей СС. По-видимому, предварительное инфицирование мышей может несколько снижать социальный интерес у мышей. Кроме того, гельминтизация не сказалась на несоциальных формах поведения у мышей OF и СС + OF, что видно при анализе поведения мышей в первые 3 мин теста.
Список литературы
Августинович Д.Ф., Алексеенко О.В., Бакштановская И.В., Корякина Л.А., Липина Т.В., Тендитник М.В., Бондарь Н.П., Коваленко И.Л., Кудрявцева Н.Н. Динамические изменения серотонергической и дофаминергической активности мозга в процессе развития тревожной депрессии: экспериментальное исследование. Успехи физиол. наук. 35(4): 19‒40. 2004. [Avgustinovich D.F., Alekseenko O.V., Bakshtanovskaia I.V., Koriakina L.A., Lipina T.V., Tenditnik M.V., Bondar’ N.P., Kovalenko I.L., Kudriavtseva N.N. Dynamic changes of brain serotonergic and dopaminergic activities during development of anxious depression: experimental study. Usp. Physiol. Nauk. 35(4): 19‒40. 2004. (In Russ)].
Weber M.D., Godbout J.P., Sheridan J.F. Repeated social defeat, neuroinflammation, and behavior: monocytes carry the signal. Neuropsychopharmacology. 42(1): 46‒61. 2017.
Niraula A., Wang Y., Godbout J.P., Sheridan J.F. Corticosterone production during repeated social defeat causes monocyte mobilization from the bone marrow, glucocorticoid resistance, and neurovascular adhesion molecule expression. J. Neurosci. 38(9): 2328‒2340. 2018.
Reader B.F., Jarrett B.L., McKim D.B., Wohleb E.S., Godbout J.P., Sheridan J.F. Peripheral and central effects of repeated social defeat stress: monocyte trafficking, microglial activation, and anxiety. Neuroscience. 289: 429‒442. 2015.
D'Mello C., Swain M.G. Liver-brain inflammation axis. Am. J. Physiol. Gastrointest. Liver Physiol. 301(5): G749–G761. 2011.
Laine M.A., Sokolowska E., Dudek M., Callan S.A., Hyytiä P., Hovatta I. Brain activation induced by chronic psychosocial stress in mice. Sci. Rep. 7(1): 15061: 1‒11. 2017.
Montoliu C., Llansola M., Felipo V. Neuroinflammation and neurological alterations in chronic liver diseases. Neuroimmunol. Neuroinflammat. 2(3): 138‒144. 2015.
D’Mello C., Swain M.G. Liver-brain interactions in inflammatory liver diseases: implications for fatigue and mood disorders. Brain Behav. Immun. 35: 9‒20. 2014.
Hernandez-Rabaza V., Agusti A., Cabrera-Pastor A., Fustero S., Delgado O., Taoro-Gonzalez L., Montoliu C., Llansola M., Felipo V. Sildenafil reduces neuroinflammation and restores spatial learning in rats with hepatic encephalopathy: underlying mechanisms. J. Neuroinflammat. 12(195): 1‒12. 2015.
Felipo V., Ordoño J.F., Urios A., El Mlili N., Giménez-Garzó C., Aguado C., González-Lopez O., Giner-Duran R., Serra M.A., Wassel A., Rodrigo J.M., Salazar J., Montoliu C. Patients with minimal hepatic encephalopathy show impaired mismatch negativity correlating with reduced performance in attention tests. Hepatology. 55(2): 530‒539. 2012.
Felipo V. Hepatic encephalopathy: effects of liver failure on brain function. Nat. Rev. Neurosci. 14: 851‒858. 2013.
Food and Agriculture Organization of the United Nations and World Health Organization. 2014. Multicriteria-based ranking for risk management of food-borne parasites. Microbiological Risk Assessment Series (MRA) 23. http://www.fao.org/publications/card/en/c/ee07c6ae-b86c-4d5f-915c-94c93ded7d9e/
Yurlova N.I., Yadrenkina E.N., Rastyazhenko N.M., Serbina E.A., Glupov V.V. Opisthorchiasis in Western Siberia: Epidemiology and distribution in human, fish, snail, and animal populations. Parasitol. Int. 66(4): 355‒364. 2017.
Бронштейн А.М., Лучшев В.И. Трематодозы печени: описторхоз, клонорхоз. Рос мед. журн. 6(3): 140‒148. 1998. [Bronstein A.M., Luchshev V.I. Liver trematoda: opisthorchiasis, clonorchiasis. Ross. Med. J. 6(3): 140‒148. 1998. (In Russ)].
Бражникова Н.А., Толкаева М.В. Особенности клиники, диагностики и лечения описторхозных абсцессов печени. Анналы хирург. гепатол. 5(1): 37‒42. 2000. [Brazhnikova N.A., Tolkaeva M.V. Peculiarities of clinic, diagnostics and treatment of the opisthorchiasis liver abscesses. Ann. Surg. Hepatol. 5(1): 37‒42. 2000. (In Russ)].
Бражникова Н.А., Толкаева М.В. Рак печени, желчных путей и поджелудочной железы при хроническом описторхозе. Бюлл. сибирск. мед. 2: 71–76. 2002. [Brazhnikova N.A., Tolkaeva M.V. Cancer of the liver, biliary tract and pancreas in chronic opisthorchiasis. Bull. Sibirsk. Med. 2: 71–76. 2002. (In Russ)].
Бакштановская И.В., Степанова Т.Ф. Анализ комплекса биохимических показателей функций печени при хроническом описторхозе. Мед. паразитол. и паразитарн. болезни. 4: 18‒21. 2005. [Bakshtanovskaia I.V., Stepanova T.F. An analysis of complex of biochemical parameters of liver functions in chronic opisthorchiasis. Med. Parazitol. (Mosk.) 4: 18‒21. 2005. (In Russ)].
Sripa B., Kaewkes S., Sithithaworn P., Mairiang E., Laha T., Smout M., Pairojkul C., Bhudhisawasdi V., Tesana S., Thinkamrop B., Bethony J.M., Loukas A., Brindley P.J. Liver fluke induces cholangiocarcinoma. PLoS Med. 4(7): e201: 1148‒1155. 2007.
Sripa B., Mairiang E., Thinkhamrop B., Laha T., Kaewkes S., Sithithaworn P., Tessana S., Loukas A., Brindley P.J., Bethony J.M. Advanced periductal fibrosis from infection with the carcinogenic human liver fluke Opisthorchis viverrini correlates with elevated levels of interleukin-6. Hepatology. 50: 1273‒1281. 2009.
Milewski K., Oria M. What we know: the inflammatory basis of hepatic encephalopathy. Metab. Brain Dis. 31(6): 1239‒1247. 2016.
Степанова Т.Ф., Бакштановская И.В., Скичко С.И. Показатели тиреоидного статуса у больных острым и суперинвазионным описторхозом. Фундамент исследования. 6: 103‒104. 2004. [Stepanova T.F., Bakshtanovskaia I.V., Skichko S.I. Parameters of thyroid status in patients with acute and superinvasion opisthorchiasis. Fundament. Issledovania. 6: 103‒104. 2004. (In Russ)].
Ахмедов В.А., Критевич М.А. Хронический описторхоз как полиорганная патология. Вестник НГУ. Серия: Биология, клин. мед. 7(1): 118‒121. 2009. [Akhmedov V.A., Kritevich M.A. Chronic opisthorchiasis is a multiple-organ pathology. Vestnik NGU. Seriya: Biologiya, Clin. Med. 7(1): 118‒121. 2009. (In Russ)].
Avgustinovich D.F., Marenina M.K., Zhanaeva S.Y., Tenditnik M.V., Katokhin A.V., Pavlov K.S., Sivkov A.Y., Vishnivetskaya G.B., Lvova M.N., Tolstikova T.G., Mordvinov V.A. Combined effects of social stress and liver fluke infection in a mouse model. Brain Behav. Immun. 53: 262‒272. 2016.
Wohleb E.S., McKim D.B., Sheridan J.F., Godbout J.P. Monocyte trafficking to the brain with stress and inflammation: a novel axis of immune-to-brain communication that influences mood and behavior, Front. Neurosci. 8: Article 447: 1‒17. 2015. https://doi.org/10.3389/fnins.2014.00447
Августинович Д.Ф., Коваленко И.Л., Бондарь Н.П. Выбор “контроля” в экспериментальных исследованиях социальных взаимодействий у мышей. Рос. физиол. журн. им. И.М. Сеченова. 91(12): 1454‒1468. 2005. [Avgustinovich D.F., Kovalenko I.L., Bondar’ N.P. Choice of “control” in experimental researches of animal social interactions in mice. Russ. J. Physiol. 91(12): 1454‒1468. 2005. (In Russ)].
Kudryavtseva N.N. The sensory contact model for the study of aggressive and submissive behaviors in male mice. Aggress. Behav. 17(5): 285‒291. 1991.
Hartmann J., Wagner K.V., Dedic N., Marinescu D., Scharf S.H., Wang X.D., Deussing J.M., Hausch F., Rein T., Schmidt U., Holsboer F., Müller M.B., Schmidt M.V. Fkbp52 heterozygosity alters behavioral, endocrine and neurogenetic parameters under basal and chronic stress conditions in mice. Psychoneuroendocrinology. 37(12): 2009‒2021. 2012.
Benson A.D., Burket J.A., Deutsch S.I. Balb/c mice treated with D-cycloserine arouse increased social interest in conspecifics. Brain Res. Bull. 99: 95‒99. 2013.
Masana M., Su Y.A., Liebl C., Wang X.D., Jansen L., Westerholz S., Wagner K.V., Labermaier C., Scharf S.H., Santarelli S., Hartmann J., Schmidt M.V., Rein T., Müller M.B. The stress-inducible actin-interacting protein DRR1 shapes social behavior. Psychoneuroendocrinology. 48: 98‒110. 2014.
Arakawa H. Analysis of social process in two inbred strains of male mice: A predominance of contact-based investigation in BALB/c mice. Neuroscience. 369: 124‒138. 2018.
Hall C.S. Emotional behavior in the rat. I. Defecation and urination as measures of individual differences in emotionality. J. Compar. Psychol. 18(3): 385–403. 1934.
Choleris E., Thomas A.W., Kavaliers M., Prato F.S. A detailed ethological analysis of the mouse open field test: effects of diazepam, chlordiazepoxide and an extremely low frequency pulsed magnetic field. Neurosci. Biobehav. Rev. 25: 235‒260. 2001.
Iñiguez S.D., Aubry A., Riggs L.M., Alipio J.B., Zanca R.M., Flores-Ramirez F.J., Hernandez M.A., Nieto S.J., Musheyev D., Serrano P.A. Social defeat stress induces depression-like behavior and alters spine morphology in the hippocampus of adolescent male C57BL/6 mice. Neurobiol. Stress. 5: 54‒64. 2016.
Bondar N., Bryzgalov L., Ershov N., Gusev F., Reshetnikov V., Avgustinovich D., Tenditnik M., Rogaev E., Merkulova T. Molecular Adaptations to Social Defeat Stress and Induced Depression in Mice. Mol. Neurobiol. 55(4): 3394‒3407. 2018.
Lehmann M.L., Mustafa T., Eiden A.M., Herkenham M., Eiden L.E. PACAP-deficient mice show attenuated corticosterone secretion and fail to develop depressive behavior during chronic social defeat stress. Psychoneuroendocrinology. 38(5): 702‒715. 2013.
Hamelink C., Tjurmina O., Damadzic R., Young W.S., Weihe E., Lee H.W., Eiden L.E. Pituitary adenylate cyclase-activating polypeptide is a sympathoadrenal neurotransmitterinvolved in catecholamine regulation and glucohomeostasis. Proc. Natl. Acad. Sci. USA. 99(1): 461‒466. 2002.
Fishkin R.J., Winslow J.T. Endotoxin-induced reduction of social investigation by mice: interaction with amphetamine and anti-inflammatory drugs. Psychopharmacology (Berl). 132(4): 335‒341. 1997.
Arakawa H., Cruz S., Deak T. From models to mechanisms: odorant communication as a key determinant of social behavior in rodents during illness-associated states. Neurosci. Biobehav. Rev. 35(9): 1916‒1928. 2011.
Kalueff A.V., Tuohimaa P. Grooming analysis algorithm for neurobehavioural stress research. Brain Res. Brain Res Protoc. 13(3): 151‒158. 2004.
Kudryavtseva N.N., Avgustinovich D.F. Behavioral and physiological markers of experimental depression induced by social conflicts (DISC). Aggress. Behav. 24: 271‒286. 1998.
Mouri A., Ukai M., Uchida M., Hasegawa S., Taniguchi M., Ito T., Hida H., Yoshimi A., Yamada K., Kunimoto S., Ozaki N., Nabeshima T., Noda Y. Juvenile social defeat stress exposure persistently impairs social behaviors and neurogenesis. Neuropharmacology. 133: 23‒37. 2018.
Frank M.G., Barrientos R.M., Watkins L.R., Maier S.F. Aging sensitizes rapidly isolated hippocampal microglia to LPS ex vivo. J. Neuroimmunol. 226(1–2): 181‒184. 2010.
Barrientos R.M., Thompson V.M., Kitt V.V., Amat J., Hale M.W., Frank M.G., Crysdale N.Y., Stamper C.E., Hennessey P.A., Watkins L.R., Spencer R.L., Lowry C.A., Maier S.F. Greater glucocorticoid receptor activation in hippocampus of aged rats sensitizes microglia. Neurobiol. Agin-g. 36(3): 1483‒1495. 2015.
Tynan R.J., Naicker S., Hinwood M., Nalivaiko E., Buller K.M., Pow D.V., Day T.A., Walker F.R. Chronic stress alters the density and morphology of microglia in a subset of stress-responsive brain regions. Brain Behav. Immun. 24(7): 1058‒1068. 2010.
Boulle F., Massart R., Stragier E., Païzanis E., Zaidan L., Marday S., Gabriel C., Mocaer E., Mongeau R., Lanfumey L. Hippocampal and behavioral dysfunctions in a mouse model of environmental stress: normalization by agomelatine. Transl. Psychiatry. 4(11): e485. 2014.
Wohleb E.S., Fenn A.M., Pacenta A.M., Powell N.D., Sheridan J.F., Godbout J.P. 2012. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37(9): 1491‒1505. 2012.
Johnson R.R., Prentice T.W., Bridegam P., Young C.R., Steelman A.J., Welsh T.H., Welsh C.J., Meagher M.W. Social stress alters the severity and onset of the chronic phase of Theiler’s virus infection. J. Neuroimmunol. 175(1–2): 39‒51. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


