Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 16-27
Эффект озона на кислородтранспортную функцию и прооксидантно-антиоксидантный баланс крови в условиях воздействия на NO-генерирующую систему в опытах in vitro
В. В. Зинчук 1, *, Е. С. Билецкая 1, И. Э. Гуляй 1
1 Гродненский государственный медицинский университет
Гродно, Беларусь
* E-mail: zinchuk@grsmu.by
Поступила в редакцию 23.06.2020
После доработки 17.09.2020
Принята к публикации 19.10.2020
Аннотация
Озон обладает широким спектром физиологических эффектов, в частности, улучшает реологические свойства крови, оказывает влияние на кислородзависимые процессы. Цель данного исследования – изучить эффект озона на кислородтранспортную функцию и прооксидантно-антиоксидантный баланс крови в условиях воздействия на NO-генерирующую систему в опытах in vitro. Для исследования использовалась концентрация озона 6 мг/л и препараты, влияющие на синтез монооксида азота в эритроцитах (нитроглицерин, L-аргинин и L-NAME). Применение нитроглицерина приводило к усилению эффекта озона на кислородтранспортную функцию (проявляющегося ростом РО2, SO2, Р50 реал.) и росту концентрации газотрансмиттеров NO и H2S. При добавлении L-аргинина, L-NAME и их комбинации к образцам крови изменения исследуемых параметров не отмечались. В условиях модификации образования монооксида азота в наших опытах показатели перекисного окисления липидов (малоновый диальдегид, диеновые конъюгаты) и антиоксидантной защиты (каталаза, ретинол, α-токоферол) существенно не изменились.
В клинической практике широко применяются методы терапии, основанные на использовании озона. Данный газ обладает широким спектром действия, в частности, иммунокоррегирующим, антигипоксическим и антиоксидантным [1]. Озон увеличивает содержание кислорода в артериальной и венозной крови, улучшает ее реологические свойства и кислородзависимые процессы [2]. Ранее нами было показано, что инкубация крови с озонированным физиологическим раствором в диапазоне концентраций от 2 до 10 мг/л обусловливает изменение кислородтранспортной функции крови (КТФ), проявляющееся в увеличении РО2, SO2 и уменьшении сродства гемоглобина к кислороду (СГК), выраженность которых усиливается с увеличением концентрации озона и сопровождается ростом концентрации нитрат/нитритов и сероводорода в плазме крови [3].
Монооксид азота (NO) через изменение различных механизмов формирования функционального статуса эритроцитов обеспечивает адаптацию организма к гипоксии [4]. Инкубация суспензии эритроцитов с нитроглицерином (5 нг/мл) в Na-фосфатном буфере в течение 24 ч приводит к повышению сродства гемоглобина к кислороду, что указывает на возможность влияния нитроглицерина на данный параметр [5]. Также показано, что при инкубировании крови с S-нитрозоцистеином отмечается снижение Р50 станд. c 33.2 до 30.3 мм рт. ст. [6]. Однако участие NO в реализации эффектов озона на кислородсвязывающие свойства и прооксидантно-антиоксидантный баланс крови недостаточно изучено.
Исходя из вышеизложенного, цель настоящей работы – изучить эффект озона на КТФ и прооксидантно-антиоксидантный баланс крови в условиях воздействия на NO-генерирующую систему в опытах in vitro.
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты in vitro выполнялись на образцах крови, забранных от белых крыс-самцов массой 250–300 г (n = 15), предварительно содержавшихся в стандартных условиях вивария. В условиях адекватного наркоза (50 мг/кг тиопентала натрия, интраперитонеально) проводили забор смешанной венозной крови из правого предсердия в объеме 8 мл в предварительно подготовленный шприц с гепарином, из расчета 50 ЕД на 1 мл крови. Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями комитета по биомедицинской этике и деонтологии учреждения образования Гродненский государственный медицинский университет.
Образцы крови были разделены на 6 экспериментальных групп: контрольная (1-я) и опытные (2-я–6-я). В опытные группы к 3 мл крови добавляли 1 мл озонированного изотонического раствора хлорида натрия (в 1-ю – без озонирования) и 0.1 мл растворов, содержащих препараты, влияющие на синтез монооксида азота (во 2‑ю группу – изотонический раствор хлорида натрия): 3-ю – нитроглицерин в конечной концентрации 0.05 ммоль/л (SchwarzPharma AG), 4-ю – L-аргинин 3 ммоль/л (Sigma-Aldrich), 5-ю – N(ω)-nitro-L-arginine methyl ester 1.25 ммоль/л (L-NAME, Sigma-Aldrich), 6-ю – комбинацию L-NAME и L-аргинин, после чего пробы перемешивали. Время инкубации составило 60 мин. Изотонический раствор хлорида натрия барботировался озоно-кислородной смесью, создававшейся озонотерапевтической установкой УОТА-60-01-Медозон (Россия), в которой осуществлялся контроль концентрации озона.
После добавления озона на газоанализаторе Stat Profile pHOx plus L в крови при 37°С определяли показатели КТФ: парциальное давление кислорода (РО2), степень оксигенации (SO2) и кислотно-основного состояния: парциальное давление углекислого газа (РСО2), стандартный бикарбонат (SBC), реальный/стандартный недостаток (избыток) буферных оснований (АВЕ/SBE), гидрокарбонат (${\text{HCO}}_{3}^{ - }$), концентрация водородных ионов (рН), общая углекислота плазмы крови (ТСО2). Сродство гемоглобина к кислороду (СГК) оценивали спектрофотометрическим методом по показателю Р50 реал. (РО2 крови при 50%-ном насыщении ее кислородом). По формулам Severinghaus [7] рассчитывали значение Р50 станд. и положение кривой диссоциации оксигемоглобина. Затем кровь центрифугировали в течение 10 мин при 3000 об./мин, отбирали плазму, а эритроциты трижды отмывали изотоническим раствором хлорида натрия.
Содержание малонового диальдегида в эритроцитах определяли по взаимодействию с 2'-тиобарбитуровой кислотой, которая при высокой температуре в кислой среде реагирует с малоновым диальдегидом с образованием окрашенного триметилового комплекса с максимумом поглощения при длине волны 535 нм на спектрофотометре PV1251C СОЛАР (Беларусь) [8]. Уровень диеновых конъюгатов определяли по интенсивности поглощения липидным экстрактом монохроматического светового потока в области спектра 232–234 нм, характерного для конъюгированных диеновых структур гидроперекисей липидов на спектрофлуориметре СМ 2203 СОЛАР (Беларусь) [9]. Для определения активности каталазы в гемолизатах использовали метод Королюк, основанный на спектрофотометрической регистрации количества окрашенного продукта реакции Н2О2 с молибденовокислым аммонием [10]. Концентрацию α-токоферола и ретинола регистрировали по методу Taylor на спектрофлуориметре СМ 2203 СОЛАР (Беларусь) [11]. Продукцию эндогенного NO оценивали по суммарному содержанию нитрат/нитритов (${{{\text{NO}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{NO}}_{3}^{ - }} {{\text{NO}}_{2}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{2}^{ - }}}$) в плазме крови спектрофотометрическим методом с реактивом Грисса при длине волны 540 нм [12]. Уровень эндогенного сероводорода (H2S) в плазме крови определяли спектрофотометрическим методом, основанном на реакции между сульфид-анионом и раствором N,N-диметил-парафенилендиамина солянокислого в присутствии хлорного железа при длине волны 670 нм [13]. Концентрацию газотрансмиттеров рассчитывали по калибровочным графикам, и результаты выражали в мкмоль/л.
Все показатели проверяли на соответствие признака закону нормального распределения с использованием критерия Шапиро–Уилка. С учетом этого были использованы методы непараметрической статистики с применением программы Statistica 10.0. Сравнение трех и более независимых групп проводили с помощью рангового дисперсионного анализа Крускала–Уоллиса. Достоверность полученных данных с учетом размеров малой выборки, множественных сравнений оценивалась с использованием U-критерия Манна–Уитни. Результаты представлены как медиана (Ме), 25-й и 75-й квартили. Величина p рассчитана с учетом поправки Бонферрони–Холма. Уровень статистической значимости принимали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В табл. 1 представлены данные о характере изменения КТФ крови под воздействием озона в условиях воздействия на NO-генерирующую систему в опытах in vitro. Инкубация крови с озонированным изотоническим раствором хлорида натрия обусловливает изменение ее КТФ, проявляющееся в росте таких показателей, как РО2 – на 21.5% (p < 0.05); SO2 – на 6.9% (p < 0.05) в сравнении с контролем.
Таблица 1.
Эффект озона на кислородтранспортную функцию крови в условиях воздействия на NO-генерирующую систему в опытах in vitro Table 1. The effect of ozone on the oxygen transport function of blood under conditions of changes in the formation of nitrogen monoxide in vitro experiments
| Показатель Parameter |
Контроль Control |
Озон Ozone |
Озон + Нитроглицерин Ozone + Nitroglycerin |
Озон + L-аргинин Ozone + L-arginine |
Озон + L-NAME Ozone + L-NAME |
Озон + L-NAME + L-аргинин Ozone + L-NAME + L-arginine |
|---|---|---|---|---|---|---|
| n | 10 | 10 | 10 | 10 | 10 | 10 |
| SO2, % | 31.6 [26.3; 32.2 ] |
33.8 [32.4; 34.7 ] * |
38.6 [33.9; 41.8 ] *# |
31.6 [31; 33.8 ] |
30.5 [27.9; 30.9 ]# |
32.6 [31.1; 33.4 ] |
| PO2, мм рт. ст. mmHg |
19.5 [17.8; 19.6 ] | 23.7 [22.3; 24.6 ]* |
29.5 [26.8; 30.1 ]*# |
21.7 [20.7; 21.9 ]*# |
21.9 [21.8; 22.4 ]* |
21.4 [20.9; 21.8 ]*# |
| рН, ед units |
7.412 [7.410; 7.413] | 7.432 [7.428; 7.437]* |
7.441 [7.439; 7.467] * |
7.436 [7.406; 7.478] * |
7.411 [7.401; 7.431] |
7.446 [7.432; 7.469] * |
| РСО2, мм рт. ст. mm Hg |
34.3 [32.8; 35.7 ] |
28.3 [27.9;30.1 ]* |
29.5 [24; 30.8 ]* |
26.2 [22.3; 32.3 ] |
31.2 [30.5; 32.5 ]* |
28.3 [26; 2.32 ]* |
| ${\text{HCO}}_{3}^{ - }$, ммоль/л mmol/L |
21.8 [21; 22.5 ] |
19.9 [19.1; 20.3 ]* |
19.6 [17.6; 20.2 ]* |
20.5 [19.2; 20.6 ] |
19.9 [19.5; 20.5 ]* |
20.2 [19.5; 21.1 ] |
| ТСO2, ммоль/л mmol/L |
22.9 [22; 23.6 ] |
20.8 [20; 21.7 ]* |
20.7 [18.4; 21.1 ]* |
21.3 [20.1; 21.6 ] |
20.8 [20.6; 21.5 ]* |
21 [20.; 22.1 ] |
| ABE, ммоль/л mmol/L |
–3.3 [–3.9; –2.5] |
–4.7 [–5.4; –4.1]* |
–5.7 [–6.5; –4.1]* |
–4.05 [–4.6; –2.1] |
–4.9 [–5.6; –4.3] |
–3.7 [–4.4; –2.8] |
| SBE, ммоль/л mmol/L |
–1.9 [–2.5; –1.3] |
–3.2 [–3.9; –2.7]* |
–3.8 [–4.6; –2.7]* |
–2.7 [–3.13; –0.6] |
–3.4 [–4.1; –2.9] |
–2.1 [–2.9; –1.4] |
| SBC, ммоль/л mmol/L |
21.9 [21.3; 22.3 ] |
20.9 [20.4; 21.4 ] |
20.5 [19.8; 21.3 ] |
21.4 [20.9; 23.1 ] |
20.8 [20.3; 21.2 ] |
21.9 [21.2; 22.4 ] |
| Р50 реал.,, мм рт. ст. mm Hg |
26.7 [26.5; 26.9 ] |
30.8 [29.3;32.8 ]* |
35.1 [34.3; 36.2 ] *# |
28.3 [27.4; 29.2 ]*# |
29.5 [26.5; 30.3 ] |
28.7 [28.2; 29.1 ]*# |
| Р50 станд., мм рт. ст. mm Hg) |
26.6 [26.4; 26.7 ] |
31.8 [29.7; 33.8 ]* |
36.5 [35.5; 36.9 ] *# |
30.3 [28.6; 32.7 ]* |
29.9 [26.5; 30.9 ] |
29.4 [28.5; 30.7 ]* |
Показатель СГК Р50 реал. под воздействием озона возрастает на 15.4% (p < 0.05), что свидетельствует о сдвиге кривой диссоциации оксигемоглобина вправо (рис. 1). Схожая динамика изменений была и по показателю Р50 станд. Также в этой группе наблюдался сдвиг реакции крови в щелочную сторону, что подтверждается ростом значения рН по сравнению с контролем.
Рис. 1.
Эффект озона на положение кривой диссоциации оксигемоглобина при реальных значениях рН и РСО2. Обозначения: ◻ – контроль; ◼ – озон; ▲ – озон + нитроглицерин. Fig. 1. The effect of ozone on the position of the oxyhemoglobin dissociation curve at real pH and РСО2 values. Designation: ◻ – control; ◼ – ozone; ▲ – ozone + nitroglycerin.
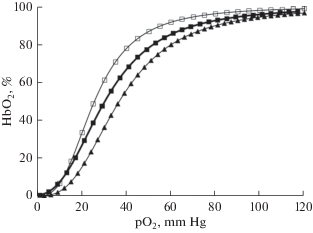
В остальных группах (3–6) исследования были проведены в условиях воздействия на NO-генерирующую систему в опытах in vitro. Выявлено, что введение нитроглицерина приводит к усилению эффекта озона на КТФ крови. При этом отмечалось увеличение РО2 на 24.5% (р < 0.05), SO2 на 14.2% (р < 0.05), показателя Р50 реал. на 13.9% (р < 0.05) и соответственно фиксировалась большая степень сдвига кривой диссоциации оксигемоглобина вправо (рис. 1) по сравнению с группой, получавшей только озон. При добавлении L-аргинина, L-NAME и их комбинации изменения данных параметров, а также кислотно-основного состояния крови (РСО2, SBC, АВЕ/SBE, ${\text{HCO}}_{3}^{ - }$, рН, ТСО2) не наблюдалось.
В табл. 2 представлены данные о характере изменения показателей процессов перекисного окисления липидов и состояния системы антиоксидантной защиты. Инкубация крови с озонированным изотоническим раствором хлорида натрия приводила к увеличению содержания диеновых коньюгатов, малонового диальдегида и активности каталазы в эритроцитарной массе. В условиях воздействия на NO-генерирующую систему в наших опытах показатели перекисного окисления липидов (малоновый диальдегидМДА, ДК) существенно не изменялись. При добавлении нитроглицерина и L-аргинина в присутствии озона происходило повышение концентрации ретинола и α-токоферола, а в остальных группах подобная тенденция не наблюдалась.
Таблица 2.
Эффект озона на концентрацию газотрансмиттеров и показатели прооксидантно-антиоксидантного баланса крови в условиях воздействия на NO-генерирующую систему в опытах in vitro Table 2. Effect of ozone on the concentration of gas transmitters and indicators of the prooxidant-antioxidant balance of the blood under conditions of changes in the formation of nitrogen monoxide in vitro experiments
| Показатель Parameter |
Контроль Control |
Озон Ozone |
Озон + Нитроглицерин Ozone + Nitroglycerin |
Озон + L-аргинин Ozone + L-arginine |
Озон + L-NAME Ozone + L-NAM |
Озон + L- NAME + + L-аргинин Ozone + L- NAME + L-arginine |
|---|---|---|---|---|---|---|
| n | 10 | 10 | 10 | 10 | 10 | 10 |
| МДА, мкмоль/л MDA, μmol /L |
4.79 [4.25;5.77] | 15.71 [14.80; 15.78]* |
12.63 10.48; 15.87]* |
14.31 [13.43; 15.57 ] * |
14.70 [13.63, 15.27 ] * |
15.46 [14.14; 16.92]* |
| ДК, ЕД/мл DK, U/ml |
18.08 [17.34; 18.56 ] |
22.25 [19.37; 23.47 ] * |
20.545 [20.31; 21.45 ] * |
22.43 [21.83; 24.31]* |
22.38 [18.73; 24.17]* |
22.10 [19.68; 22.81]* |
| Каталаза, ммоль Н2О2/мин/г Hb Catalase, mmol H2O2/min/g Hb |
10.53 [10.25; 10,88] |
14.89 [14.18; 16.57 ] * |
16.04 [15.93; 16.77]* |
14.34 [13.72; 15.92]* |
12.65 [11.81;13.51]*# |
12.33 [11.02; 12.85]# |
| Ретинол, мкмоль/л Retinol, μmol /L |
0.85 [0.81; 0.87] |
0.93 [0.87; 0.96] |
1.14 [1.08; 1.7]* |
1.04 [0.96; 1.14]* |
0.88 [0.85; 1.02] |
0.95 [0.78; 1.04] |
| α-токоферол, мкмоль/л α-tocopherol, μmol /L |
8.26 [8.02; 8.44] |
13.57 [11.18; 14.76] |
19.10 [17.36; 20.96]* |
16.62 [15.00; 19.49]* |
11.75 [10.48; 13.06] |
12.01 [9.62; 13.56 ] |
МДА – малоновый диальдегид, ДК – диеновые коньюгаты. Данные представлены, как медиана [25-ый квартиль – 75-ый квартиль]. *– p < 0.05 достоверные изменения в сравнении с контрольной группой; # – p < 0.05 с озоном. MDA – malonic dialdehyde, DK – diene conjugates. Results are presented as median [25th quartile – 75th quartile]. *– p < 0.05 достоверные изменения в сравнении с контрольной группой; # – p < 0.05 с озоном. *– p < 0.05 changes in comparison with the control; # – p < 0.05 with ozone.
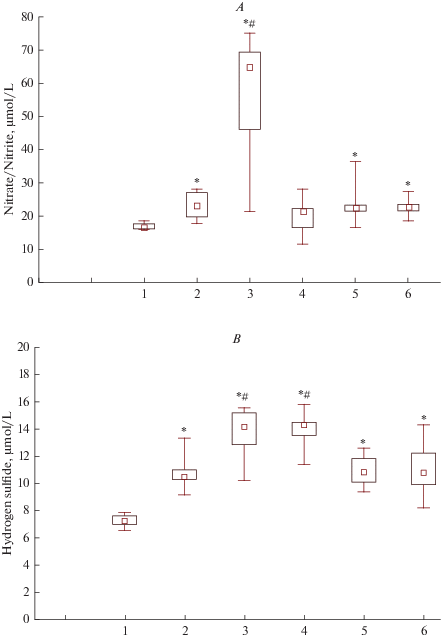
Суммарное содержание ${{{\text{NO}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{NO}}_{3}^{ - }} {{\text{NO}}_{2}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{2}^{ - }}}$ в плазме крови (рис. 2) под действием озона возрастала (на 39.2%, р < 0.05). При добавлении нитроглицерина в этих условиях концентрация ${{{\text{NO}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{NO}}_{3}^{ - }} {{\text{NO}}_{2}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{2}^{ - }}}$ существенно увеличивалась (на 183.5%, р < 0.05 по сравнению с группой, в которую вводили только озон). Уровень газотрансмиттера H2S (рис. 2) под действием озона возрастал (на 44.8%, р < 0.05). При добавлении нитроглицерина или L-аргинина этот показатель также повышался (на 35.3% и на 41.6%, р < 0.05 по сравнению с группой, в которую вводили только озон). Добавление L-NAME или его комбинации с L-аргинином в условиях действия озона не приводило к увеличению содержания данных газотрансмиттеров по сравнению с группой, в которую вводили только озон.
Рис. 2.
Концентрация нитрат/нитритов (А) и сероводорода (B) в плазме крови в условиях воздействия на NO-генерирующую систему в опытах in vitro. 1 – контроль, 2 – озон, 3 – озон + нитроглицерин, 4 – озон + L-аргинин, 5 – озон + L-NAME, 6 – озон + L-NAME + L-аргинин. * – p < 0.05 изменения в сравнении с контрольной группой; # – p < 0.05 с группой, содержащей только озон. Fig. 2. The concentration of nitrate/nitrite (A) and hydrogen sulfide (B) in blood plasma in the formation of nitrogen monoxide in vitro experiments. 1 – control, 2 – ozone, 3 – ozone + nitroglycerin, 4 – ozone + L-arginine, 5 – ozone + L-NAME, 6 – ozone + L- NAME + L-arginine. * – p < 0.05 changes in comparison with the control group; # - p < 0.05 with a group containing only ozone.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работах некоторых исследователей при введении озонированного изотонического раствора на различных моделях наблюдалось увеличение показателей КТФ [14, 27]. Полученные нами данные свидетельствуют о том, что при инкубации крови с озоном происходит увеличение РО2 и SO2. Также в проведенном нами исследовании установлено уменьшение СГК. Согласно полученным результатам, в данном эффекте озона имеет значение рост концентрации 2,3-дифосфоглицерата в эритроцитах [15] и увеличение образования монооксида азота, исходя из роста его концентрации.
В этом аспекте важно отметить, что нитроглицерин, согласно нашим результатам, усиливает эффект озона на СГК, а также на РО2 и SO2, что предполагает участие NO-зависимых механизмов внутриэритроцитарной системы в формировании кислородсвязывающих свойств крови. Озон может оказывать влияние на синтез монооксида азота различными путями, в частности, за счет усиления экспрессии белков теплового шока [16]. Ранее нами было показано, что изменение генерации NO может модифицировать кислородсвязывающие свойства крови, в частности, добавление L-аргинина или нитроглицерина при действии магнитного поля приводит к уменьшению СГК, которое отсутствует при введении ингибитора фермента NO-синтазы (L-NAME) [17]. Результаты нашего исследования демонстрируют, что нитроглицерин как непосредственный донор монооксида азота усиливает эффект озона на КТФ крови. Добавление L-аргинина (исходного субстрата синтеза NO) не оказывает аналогичного влияния. Данный факт, вероятно, обусловлен тем, что механизмы синтеза NO не успевают реализоваться за время проводимого эксперимента (60 мин). Монооксид азота, наряду с рН и 2,3-дифосфоглицератом, может быть модулятором кислородсвязывающих свойств гемоглобина и изменять СГК через NO-зависимые внутриэритроцитарные механизмы [18, 19].
Выявленный нами эффект озона на СГК реализуется как непосредственно через воздействие на экспрессию NO-синтазы в эритроцитах, так и через модификацию функциональных свойств гемоглобина. Следует отметить, что при действии озона отмечается рост концентрации газотрансмиттера H2S, который усиливается при добавлении нитроглицерина. NO, CO и H2S участвуют в защите организма от окислительного стресса, вызванного активными формами кислорода, азота [19], и выполняют роль аллостерического эффектора функциональных свойств гемоглобина, который изменяет его сродство к кислороду, влияя на транспорт О2 [21]. Рост газотрансмиттеров (NO и H2S), отмечаемый в наших опытах, вносит вклад в изменение КТФ крови. Повышение уровня сероводорода при добавлении нитроглицерина и L-аргинина в условиях действия озона (донора кислорода) связано с тем, что образующиеся вследствие реакции NO с кислородом оксиды (NO2 и N2O3) [22], могут взаимодействовать с гемоглобином и основаниями Шиффа с образованием нитрованных аминокислот, в частности, метионина [23], из которого посредством реакции транссульфурирования в эритроцитах образуется L-цистеин [24], предшественник синтеза H2S. Вследствие этого увеличивается синтез сероводорода. Озон уменьшает СГК, реализуя свое действие через участие NO и H2S (повышение концентрации нитрат/нитритов и сероводорода). Изменения функциональной активности форменных элементов под действием озона обусловлены перестройкой внутриклеточной организации. Известно, что эритроциты имеют структуры, обеспечивающие синтез газотрансмиттеров (NO и H2S) непосредственно в данных клетках [25]. Действие озона изменяет конформацию макромолекул, липопротеидных комплексов мембран эритроцитов, модифицируя их функциональные свойства, в частности, через NO-ергические механизмы и через сероводород/цистеин/цистиновый путь. Сероводород, уровень которого повышается в наших опытах, может связываться с метгемоглобином, образуя сульфгемоглобин [26], который совместно с NO-производными гемоглобина может изменять положение кривой диссоциации оксигемоглобина. Газотрансмиттеры вносят вклад в модификацию СГК, что достигается через разные механизмы: образование дериватов гемоглобина (нитрозогемоглобин, нитрозилгемоглобин, метгемоглобин, сульфгемоглобин), модуляторов внутриэритроцитарной системы формирования КТФ крови. Участие NO-зависимых механизмов внутриэритроцитарной системы в изменении кислородсвязывающих свойств крови при действии озона подтверждается результатами наших исследований, в которых показано уменьшение СГК при введении нитроглицерина и отсутствие сдвига кривой диссоциации оксигемоглобина при введении ингибитора фермента NO-синтазы (L-NAME) в этих условиях.
Низкие концентрации озона не вызывают интенсификации процесса липопероксидации, а при высоких дозах интенсивность образования диеновых коньюгатов, малонового диальдегида и оснований Шиффа существенно возрастает [27]. Под влиянием озона происходит активация свободнорадикального окисления, а затем по принципу положительной обратной связи активизируются механизмы антиоксидантной защиты [28, 29]. Высокие дозы озона в экспериментах на крысах вызывают повреждение легких, однако после введения L-аргинина отмечается ингибирование активности миелопероксидазы базофильных гранул нейтрофилов, а при добавлении L-NAME данный эффект отсутствует [30]. Внутрибрюшинное введение озона (концентрация 1 мг/кг) в условиях ишемического повреждения тонкой кишки приводит к росту активности супероксиддисмутазы, каталазы, глутатионпероксидазы, а также общей антиоксидантной активности [31]. Доноры монооксида азота в опытах in vitro активируют систему антиоксидантной защиты [32]. В наших опытах наблюдалось повышение концентрации ретинола и α-токоферола при добавлении нитроглицерина и L-аргинина в присутствии озона, возможно, за счет их высвобождения из эритроцитарной мембраны вследствие ее окислительного повреждения (в частности, под действием пероксинитрита) [33, 34]. Эффект L-NAME и его комбинации с L-аргинином на параметры прооксидантно-антиоксидантного баланса не отмечается.
Таким образом, результаты проведенных нами исследований свидетельствуют о том, что инкубация крови с озоном и нитроглицерином приводит к усилению эффекта данного газа на КТФ крови (рост РО2, SO2), что сопровождается уменьшением СГК. При использовании ингибитора фермента NO-синтазы L-NAME, L-аргинина и их комбинации подобный эффект не отмечается. Увеличение уровня нитрат/нитритов и сероводорода при действии озона в условиях введения нитроглицерина отражает участие данных газотрансмиттеров в модификации КТФ крови. В условиях воздействия на NO-генерирующую систему в эритроцитах в наших опытах показатели перекисного окисления липидов (малоновый диальдегид, диеновые коньюгаты) существенно не изменяются. При добавлении нитроглицерина и L-аргинина в присутствии озона наблюдается повышение концентрации ретинола и α-токоферола.
Список литературы
Лебедь С.Л., Бояринов Г.А., Фраерман А.П. Применение озонированного физиологического раствора в послеоперационном периоде у больных с новообразованиями головного мозга. Биорадикалы и антиоксиданты. 5(1): 30–39. 2018. [Lebed’ S.L., Boyarinov G.A., Fraerman A.P. The use of ozonized saline in the postoperative period in patients with neoplasms of the brain. Bioradicals and antioxidants. 5(1): 30–39. 2018. (In Russ)].
Чекман И.С., Сыровая А.О., Макаров В.А., Макаров В.В., Шаповал Е.В. Озон и озонотерапия: Монография. Харьков. Цифрова друкарня № 1. 2013. [Chekman I.S., Syrovaya A.O., Makarov V.A., Makarov V.V., Shapoval E.V. Ozone and ozone therapy: Monograph. Kharkiv. Digital typography No. 1. 2013. (In Russ)].
Зинчук В.В., Билецкая Е.С. Кислородзависимые механизмы физиологического действия озона (обзор). Журн. мед.-биол. исследований. 7(2): 216–227. 2019. [Zinchuk V.V., Biletskaya E.S. Oxygen-dependent mechanisms of the physiological action of ozone (Review). J. Med. Biol. Res. 7(2): 216–227. (In Russ)].
Zhao Y., Wang X., Noviana M., Hou M. Nitric oxide in red blood cell adaptation to hypoxia. Acta Biochim. Biophys. Sin. 50(7): 621–634. 2018.
Калаева Е.А., Артюхов В.Г., Путинцева О.В. Влияние нитроглицерина на спектральные и кислородсвязывающие характеристики внутриэритроцитарного гемоглобина. Экспер. и клин. фармакол. 79(9): 12–17. 2016. [Kalaeva E.A., Artyukhov V.G., Putintseva O.V. The influence of nitroglycerin on spectral and oxygen-binding characteristics of human intracellular hemoglobin. Eksp. Klin. Farmakol. 79(9): 12–17. 2016. (In Russ)].
Stepuro T.L., Zinchuk V.V. Nitric oxide effect on the hemoglobin-oxygen affinity. J. Physiol. Pharmacol. 57(1): 29–38. 2006.
Saveringhaus J.W. Blood gas calculator. J. Appl. Physiol. 21(5): 1108–1116. 1966.
Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике. Минск. 2002. [Kamyshnikov V.S. Handbook of clinical and biochemical laboratory diagnostics. Minsk. 2002. (In Russ)].
Гаврилов В.Б., Мишкорудная М.И. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови. Лаб. дело. (3): 33–36. 1983. [Gavrilov V.B., Mishkorudnaya M.I. Spectrophotometric determination of the content of lipid hydroperoxides in blood plasma. Lab. Delo. (3): 33–36. 1983. (In Russ)].
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарева В.Е. Метод определения активности каталазы. Лаб. дело. (1): 16–19. 1988. [Korolyuk M.A., Ivanova L.I., Mayorova I.G., Tokareva V.E. Method for determination of catalase activity. Lab. Delo. (1): 16–19. 1988. (In Russ)].
Taylor S.L., Lamden M.P., Tappel A.L. Sensitive fluorometric method for tissue tocopherol analysis. Lipids. 11(7): 530–538. 1976.
Bryan N.S., Grisham M.B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radic. Biol. Med. 43(5): 645–657. 2007.
Norris E.J., Culberson C.R., Narasimhan S., Clemens M.G. The liver as central regulator of hydrogen sulfide. Shock. 36(3): 242– 250. 2011.
Kuroda K., Yamashita M., Murahata Y., Azuma K., Osaki T., Tsuka T., Ito N., Imagawa T., Okamoto Y. Use of ozonated water as a new therapeutic approach to solve current concerns around antitumor treatment. Exp. Ther. Med. 16(3): 1597–1602. 2018.
Clavo B., Santana-Rodrнguez N., Llontop P., Gutiйrrez D., Suбrez G., Lypez L., Rovira G., Martнnez-Sбnchez G., Gonzбlez E., Jorge I.J., Perera C., Blanco J., Rodrнguez-Esparragyn F. Ozone Therapy as Adjuvant for Cancer Treatment: Is Further Research Warranted? Evid base Compl. Alternative Med. 2018: 1–11. 2018. https://doi.org/10.1155/2018/7931849
Seyam O., Smith N.L., Reid I., Gandhi J., Jiang W., Khan S.A. Clinical utility of ozone therapy for musculoskeletal disorders. Med. Gas. Res. 8(3): 103–110. 2018.
Зинчук В.В., Лепеев В.О., Гуляй И.Э. Участие газотрансмиттеров в модификации кислородтранспортной функции крови при действии магнитного поля. Рос. физиол. журн. им И.М. Сеченова. 102(10): 1176–1184. 2016. [Zinchuk V.V., Lepeev V.O., Gulyai I.E. The participation of gas transmitters in the modification of the oxygen transport function of blood under the action of a magnetic field. Russ. J. Physiol. 102 (10): 1176–1184. 2016. (In Russ)].
Zinchuk V., Zhadko D. Association of endothelial nitric oxide synthase gene G894T polymorphism with blood oxygen transport. Nitric Oxide. 84: 45–49. 2019.
Lo Faro M., Fox B., Whatmore J., Winyard P., Whiteman M. Hydrogen sulfide and nitric oxide interactions in inflammation. Nitric Oxide. 41: 38–47. 2014.
Shefa U., Yeo S.G., Kim M.S., Song I.O., Jung J., Jeong N.Y., Huh Y. Role of Gasotransmitters in Oxidative Stresses, Neuroinflammation, and Neuronal Repair. Biomed. Res. Internat. 2017: 1–15. 2017. https://doi.org/10.1155/2017/1689341
Сукманский О.И, Реутов В.П. Газотрансмиттеры: физиологическая роль и участие в патогенезе заболеваний. Успехи физиол. наук. 47(3): 30–58. 2016. [Sukmansky O.I., Reutov V.P. Gas transmitters: physiological role and participation in the pathogenesis of diseases. Usp. Fiziol. Nauk. 47 (3): 30–58. 2016. (In Russ)].
Hughes M.N. Chemistry of nitric oxide and related species. Methods in Enzymology. 436: 3–19. 2007.
Herold S., Rehmann F.-J.K. Kinetics of the reactions of nitrogen monoxide and nitrite with ferryl hemoglobin. Free Radic. Biol. Med. 34: 531–545. 2003.
Reisz J.A., Nemkov T., Dzieciatkowska M. Methylation of protein aspartates and deamidated asparagines as a function of blood bank storage and oxidative stress in human red blood cells. Transfusion. 58(12): 2978–2991. 2018. https://doi.org/10.1111/trf.14936
Kolluru G.K, Prasai P.K., Kaskas A.M., Letchuman V., Pattillo C.B. Oxygen tension, H2S, and NO bioavailability: is there an interaction? J. Appl. Physiol. 120(2): 263–270. 2016. https://doi.org/10.1152/japplphysiol.00365.2015
Van Leeuwen S.R., Baranoski G.V., Kimmel B.W. Three-wavelength method for the optical differentiation of methemoglobin and sulfhemoglobin in oxygenated blood. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2017: 4570–4573. 2017. https://doi.org/10.1109/EMBC.2017.8037873
Перетягин С.П., Конторщикова К.Н., Мартусевич А.А. Оценка эффекта различных доз озона на процессы липопероксидации и кислородообеспечение крови in vitro. Мед. альманах. 21(2): 101–104. 2012. [Peretyagin S.P., Kontorshchikova K.N., Martusevich A.A. Evaluation of the effect of various doses of ozone on the processes of lipid peroxidation and oxygen supply of blood in vitro. Med. alman. 21 (2): 101–104. 2012. (In Russ)].
Мурзалиев А.Д., Жолдошбеков Е.Ж., Авасов Б.А. Опыт использования озонотерапии в урологии. Вестник Смоленской гос. мед. акад. 17(1): 94–98. 2018. [Murzaliev A.D., Zholdoshbekov E.Zh., Avasov B.A. Experience in the use of ozone therapy in urology. Bull. Smolensk State Med. Acad. 17 (1): 94–98. 2018. (In Russ)].
Катюхин Л.Н. Влияние курсового лечения инъекциями озонированного физиологического раствора на реологические свойства эритроцитов у больных с комплексной патологией. Физиология человека. 100(6): 100–105. 2016. [Katyukhin L.N. Effect of course treatment with injections of ozonized physiological saline on the rheological properties of red blood cells in patients with complex pathology. Human physiology. 100(6): 100–105. 2016. (In Russ)].
Zhang S., Li J., Li Y., Liu Y., Guo H., Xu X. Nitric Oxide Synthase Activity Correlates with OGG1 in Ozone-Induced Lung Injury Animal Models. Front. Physiol. 8: 249. 2017. https://doi.org/10.3389/fphys.2017.00249
Onal O., Yetisir F., Sarer E., Zeybek D., Onal O., Yurekli B., Celik T., Sirma A., Kılıc M. Prophylactic Ozone Administration Reduces Intestinal Mucosa Injury Induced by Intestinal Ischemia-Reperfusion in the Rat. Mediat. Inflamm. 2015: 1–8. 2015. https://doi.org/10.1155/2015/792016
Мартусевич А.К., Соловьева А.Г., Перетягин С.П., Ванин А.Ф. Сравнительный анализ действия свободного и депонированного NО на состояние про- и антиоксидантных систем крови. Биофизика. 60(2): 348–354. 2015. [Martusevich A.K., Solovyova A.G., Peretyagin S.P., Vanin A.F. Comparative analysis of the effect of free and deposited NO on the state of pro- and antioxidant blood systems. Biophysics. 60 (2): 348–354. 2015. (In Russ)].
Белых И.А., Воловельская Е.Л., Зинченко В.Д. Влияние малых доз озона на гипертонический лизис эритроцитов. Проблемы криобиологии. 17(3): 237–242. 2007. [Belykh I.A., Volovelskaya E.L., Zinchenko V.D. Influence of small doses of ozone on hypertensive lysis of erythrocytes. Cryobiol. problems. 17 (3): 237–242. 2007. (In Russ)].
Ahmad R., Hussain A., Ahsan H. Peroxynitrite: cellular pathology and implications in autoimmunity. J. Immunoassay Immunochem. 40 (2): 123–138. 2019. https://doi.org/10.1080/15321819.2019.1583109
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


