Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 4-15
Влияние интерлейкинов на сокращения мышцы трахеи и бронхов крысы
В. М. Кирилина 1, О. Е. Смирнова 1, Л. Е. Блажевич 1, *, А. И. Кривченко 2
1 Петрозаводский государственный университет
Республика Карелия, Петрозаводск, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: lyu15041988@yandex.ru
Поступила в редакцию 14.05.2020
После доработки 12.10.2020
Принята к публикации 14.10.2020
Аннотация
В статье рассмотрена роль интерлейкинов ИЛ-1β, ИЛ-4, ИЛ-8 и ИЛ-13 в сократительной активности гладкой мускулатуры трахеи и бронхов крысы. Исследования проводились на изолированных препаратах с применением электрической стимуляции постганглионарных нервов (частота – 30 стим./с, длительность – 0.5 мс, амплитуда – 20 В, продолжительность стимуляции – 10 с). Были сформированы две группы животных: контрольная (получала внутрибрюшинную инъекцию физиологического раствора) и экспериментальная с вызванной бронхиальной астмой (получала внутрибрюшинную инъекцию овальбумина с его повторным введением через 14 дней). Далее проводилась оценка сокращения мышцы трахеи и бронхов после повторного введения овальбумина и после перфузии растворами интерлейкинов. В результате исследования выяснено, что ИЛ-4, ИЛ-8, ИЛ-13 приводят к выраженному увеличению сократительных ответов гладкой мышцы трахеи и бронхов как в контрольной группе, так и в группе животных с овальбумин-индуцированной бронхиальной астмой. ИЛ-1β приводит к релаксационному эффекту на мышцу трахеи и бронхов в условиях физиологической нормы и патологии, что может быть рассмотрено как компенсаторный механизм, поддерживающий функцию внешнего дыхания.
В данной статье рассматривается влияние интерлейкинов ИЛ-1β, ИЛ-4, ИЛ-8 и ИЛ-13 на сокращение мышцы трахеи и бронхов крысы. Выбор этих интерлейкинов обусловнен их большим значением в патогенезе бронхиальной астмы.
Интерлейкин-1β (ИЛ-1β)
ИЛ-1β – провоспалительный цитокин, характеризующийся сложными иммунными эффектами и высвобождающийся из макрофагов, моноцитов и тучных клеток [1]. В протекании патологического процесса при бронхиальной астме этому провоспалительному цитокину принадлежит определенная роль. ИЛ-1β может быть обнаружен в сыворотке крови в отличие от ИЛ-1α, который секретируется из дендритных клеток только при активации стимула. Считается, что ИЛ-1β является основным посредником, обеспечивающим связь между воспалительной реакцией, снижением функциональных резервов кардиореспираторной системы и гипоксемией. В настоящее время показано, что повышенный уровень ИЛ-1β в плазме крови нарушает регуляцию дыхания, снижает устойчивость к острой гипоксии, возможность спонтанного возобновления дыхания после гипоксического апноэ [2]. При биопсии трахеи и бронхов пациентов с бронхиальной астмой было обнаружено повышенное содержание ИЛ-1β в ткани. При обследовании образцов респираторного тракта человека после наступления летального исхода в просветах трахеи и бронхов обнаруживается большое количество слизистых образований, в формировании которых может принимать участие ИЛ-1β [3].
Hofstetter и Herlenius в своих исследовниях показали, что внутрибрюшинная инъекция ИЛ-1β новорожденным мышам приводит к снижению дыхательного объема и развитию гипоксии по сравнению с контрольной группой животных. Кроме того, у таких животных наблюдалось снижение частоты дыхания и нарушение способности к компенсаторному механизму нормализации концентрации кислорода в крови [4]. Похожие результаты были получены недавно в работе, проведенной на крысах. Эти исследования доказали негативное влияние ИЛ-1β на регуляцию дыхательной системы, что проявлялось понижением устойчивости к острой гипоксии [2].
Блокада ИЛ-1β может ослабить воспаление дыхательных путей у недоношенных крысят [5], стимулировать легочные C-волокна у крыс и кроликов [6]. Возбуждение С-волокон ИЛ-1β может приводить к увеличению сократительной активности трахеи и бронхов животного. Активности семейству ИЛ-1 (в том числе и ИЛ-1β) противодействует ИЛ-4 путем индукции экспрессии и активности рецептора-ловушки (ИЛ-1R2), а также высвобождения в его растворимой форме [7].
Интерлейкин-4 (ИЛ-4)
Che Xiao-wen и Zhang Ying указывают на существенную роль провоспалительного цитокина ИЛ-4 в патогенезе астмы на ранних стадиях и сообщают о том, что положительный эффект в лечении бронхиальной астмы может быть достигнут путем подавления синтеза этого интерлейкина. Также показано, что ИЛ-4 повышает гиперреактивность дыхательных путей у пациентов с астмой [8]. Liu и Xin в своих исследованиях обнаружили, что уровень ИЛ-4 в крови и в бронхоальвеолярной жидкости у пациентов с астмой достоверно превышает нормальные значения и корррелирует с уровнем IgE [9]. ИЛ-4 стимулирует продукцию IgE, который, связываясь с Fcε-рецепторами тучных клеток, приводит к их активации с выбросом провоспалительных медиаторов (гистамина, лейкотриенов, простагландинов и цитокинов, которые являются известными триггерами обострения астмы), способствующих развитию выраженного сокращения гладкой мускулатуры трахеи и бронхов [10].
Блокаторы рецепторов ИЛ-4 приводят к уменьшению обострения бронхиальной астмы у пациентов и к улучшению функций внешнего дыхания [11]. По мнению Чучалина, ИЛ-4 является терапевтической мишенью для моноклональных антител при лечении бронхиальной астмы. Биологическое ингибирование ИЛ-4 моноклональными антителами приводит к снижению уровня IgE в сыворотке крови и снижению сократительной активности трахео-бронхиальных мышц [12]. У сенсибилизированных крыс воздействие овальбумином вызывало значительное увеличение экспрессии ИЛ-4 [13–15].
Интерлейкин-8 (ИЛ-8)
ИЛ-8 продуцируется фибробластами, тучными клетками, моноцитами и макрофагами [16]. ИЛ-8 также принимает участие в патофизиологических механизмах развития бронхиальной астмы. В бронхоальвеолярной жидкости и мокроте человека с бронхиальной астмой обнаружена повышенная продукция ИЛ-8 железистыми клетками, нейтрофилами, макрофагами, эпителиальными и тучными клетками дыхательных путей [17]. ИЛ-8 стимулирует пролифирацию и миграцию гладко-мышечных клеток [18]. Ингаляция ИЛ-8 провоцирует бронхоконстрикцию у морских свинок в условиях in vivo. ИЛ-8 участвует в механизмах развития гиперреактивности гладкой мускулатуры трахеи и бронхов и увеличивет уровень внутриклеточного кальция, что приводит к увеличению внутримышечного сокращения [19]. ИЛ-8 значительно повышает бронхиальную гиперреактивность и сократительную активность гладких мышц респираторного тракта у пациентов с муковисцидозом [20]. У новорожденных крыс гипероксическое воздействие индуцировало экспрессию нейтрофильного хемоаттрактанта-1, гомолога ИЛ-8, в альвеолярных макрофагах и эпителиальных клетках [21]. ИЛ-8 играет значительную роль в патогенезе хронических заболеваний легких у недоношенных крысят [5].
Интерлейкин-13 (ИЛ-13)
ИЛ-13 секретируется Т-хелперами 1-го типа, Т-хелперами 2-го типа, естественными киллерами, гладкомышечными клетками, эозинофилами, базофилами, тучными клетками [22]. ИЛ-13 приводит к увеличению продукции IgE, что в дальнейшем является причиной повышенной сократительной активности гладкой мускулатуры трахеи и бронхов, развитию аллергической реакции [23]. ИЛ-13 участвует в гиперсекреции слизи в респираторном тракте, развитии воспалительных секреций и гиперреактивности [24]. ИЛ-13 может играть ключевую роль в патогенезе астмы. ИЛ-13 также индуцирует гиперреактивность трахеи и бронхов мышей и выраженное мышечное сокращение [25]. При блокаде рецепторов ИЛ-13 уменьшалась бронхиальная гиперреактивность у мышей [26], а в модели бронхиальной астмы у этих животных отмечался повышенный уровень этого интерлейкина в бронхоальвеолярной жидкости [27]. Активность ИЛ-13 напоминает активность ИЛ-4. ИЛ-13 может активировать клеточные линии моноцитов и ингибировать выработку воспалительных цитокинов (ИЛ-1α, ИЛ-1β, ИЛ-6, ИЛ-8, G-CSF и IFN-α). Существует два вида рецепторов для ИЛ-13: ИЛ-13R1 и ИЛ-13R2. Сочетание генетических полиморфизмов в гене ИЛ-13 и гене ИЛ-4 коррелирует с уровнем антител IgE и развитием астмы у детей. Антагонисты ИЛ-13 могут быть полезны при лечении астмы и аллергии (возможно, наряду с антагонистами ИЛ-4) [28].
Таким образом, ИЛ-1β, ИЛ-4, ИЛ-8 и ИЛ-13 могут быть рассмотрены как цитокины, играющие значительную роль в патогенезе бронхиальной астмы. Исследования непосредственного влияния этих цитокинов на сокращение гладкой мышцы трахеи и бронхов в условиях нормы и экспериментальной модели патологии могут быть особенно актуальны. Также большое значение в экспериментах на изолированных препаратах имеет электрическая стимуляция постганглионарных нервов, что максимально приближает исследуемую систему к естественным физиологическим условиям. Поэтому целью настоящего исследования явилось изучение влияния ИЛ-1β, ИЛ-4, ИЛ-8 и ИЛ-13 на сокращение гладкой мышцы, трахеи и бронхов крысы с применением электрической стимуляции постганглионарных нервов в условиях физиологической нормы и экспериментальной модели бронхиальной астмы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Процедура с животными
Было исследовано 20 крыс линии Вистар обоего пола массой тела 190–270 г. Различий в сократительных реакциях мышц самцов и самок не было, так как самки были взяты для опытов в период диэструса. Животные содержались в виварии, который отвечал всем требованиям, предъявляемым к условиям содержания животных. С целью получения образцов респираторного тракта производилась декапитация. Такой подход обеспечивал быструю эвтаназию животного (рекомендации по эвтаназии экспериментальных животных Европейской комиссия [29]). Далее животное закреплялось на столе для вскрытия. После этого вскрывали грудную клетку и затем производили операцию с извлечением дыхательных путей животного. Паренхиматозную ткань легких удаляли механически деревянным шпателем [30]. Дыхательные пути промывали в растворе Кребса–Хензелайта, а затем готовили препараты трахеи и бронхов. Каждый препарат представлял собой образец трахеи или бронхов длиной 0.4–0.6 и шириной 0.5–0.7 см. Образцы трахеи и бронхов брались из области бифуркаций, поскольку в этих участках присутствуют интрамуральные ганглии. Линия разреза трахеи и бронхов проходила через хрящевые полукольца. Гладкая мышца оставалась нетронутой. Препараты трахеи и бронхов помещали в камеру с раствором Кребса–Хензелейта, где один край препарата фиксировали иглами, а второй устанавливали крючками-держателями, прикрепленными к электромеханическому датчику, регистрирующему величину сократительной реакции (измеряемой в мн).
Оборудование
В экспериментах использовался физиологический комплекс, поддерживающий нормальное протекание физиологических процессов в изолированных препаратах. Комплекс включал в себя специальные камеры для помещения в них препаратов трахеи и бронхов, ультратермостат, аэратор, насос перистальтический (ML0146/C-V, Multi Chamber Organ Baths, Panlab, Германия), электромеханические датчики (Grass FT-03 force displacement transducer, Astro Med, West Warwick, RI, США), электростимулятор (direct-current stimulator, Grass S44, Quincy, MA, США), персональный компьютер, специальное программное обеспечение (Chart v 4.2 software, Power Lab, AD Instruments, Colorado Springs, CO, США).
Электрофизиологические эксперименты
Во всех экспериментах применялась стимуляция электрическим полем. Для этого в камеры с препаратами были помещены два серебряных электрода. Во время работы применялась электростимуляция постганглионарных нервных волокон (частота стимулов – 30 Гц, длительность – 0.5 мс, амплитуда – 20 В, длительность стимуляции – 10 с). Электростимуляция моделировала естественную проводимость электрических импульсов через постганглионарное звено рефлекторной цепи. В экспериментах изучалась сократительная реакция гладкой мускулатуры трахеи и бронхов крысы при использовании электростимуляции и фармакологических средств. Сначала проводилась электростимуляция препаратов трахеи и бронхов, а затем регистрировались сократительные реакции мышц. Эти ответы были приняты за базовый уровень (или 100%). После этого добавляли фармакологические вещества и регистрировали сократительные реакции мышц. Таким образом, регистрировались реакции трахеальной и бронхиальной мускулатуры с учетом электростимуляции и фармакологических препаратов. Величина сократительных реакций на применение препарата в значительной степени зависела от исходного тонуса гладкой мускулатуры, а также от контрольных сократительных реакций вследствие применения электростимуляции на фоне физиологического раствора. Несмотря на то, что все животные были одного возраста и выборка была однородной, вариабельность исходного тонуса и контрольных реакций (измеренных в мн) таких органов, как трахея и бронхи, была достаточно высокой, и этот факт определил учет сокращения в процентах (подсчитанных в процентах от базового уровня активности, взятого за 100%). Методы электростимуляции постганглионарных нервов взяты из методов исследования, предложенных Фединым [31].
Статистический анализ
Статистический анализ проводился с помощью статистического пакета SPSS, версия 10.0 (SPSS Inc., Chicago, Illinois, США). Сравнение между группами контрольных и экспериментальных результатов проводили с использованием независимых t-тестов Стьюдента (t-критерий Стьюдента). Значение p < 0.05 считалось статистически значимым. Данные были выражены в виде среднего значения и стандартного отклонения.
Фармакологическая процедура
Перфузию проводили раствором Кребса–Хензелейта следующего состава: (ммоль/л в виде перфузии, Sigma-Aldrich, Германия) хлорид натрия 118; хлорид калия 4.8; сульфат магния 1.18; дигидрофосфат калия 1.2; хлорид кальция 2.5; бикарбонат натрия 25.0; глюкоза 5.5. В камерах с препаратами поддерживали необходимый уровень кислорода, температуру (37°С) и pН (6.9–7.1). Приток свежего раствора Кребса–Хензелейта обеспечивался регулярно, как и отток использованного [31].
В ходе экспериментов экзогенно в камеры с препаратами вводили растворы следующих веществ: интерлейкин-1β, интерлейкин-8, интерлейкин-4 (вышеперечисленные интерлейкины использовались в концентрации 150 нг/мл) и интерлейкин-13 (в концентрации 100 нг/мл). Использованные интерлейкины приобретены у фирмы Sigma-Aldrich, США. Интерлейкины поступали в камеры с препаратами при помощи перфузии в течение 120 мин, после чего производилась регистрация сократительной активности.
Процедура сенсибилизации животных
Крысы были сенсибилизированы однократным внутрибрюшинным введением 0.23 нмоль овальбумина (Sigma-Aldrich, Германия), смешанного с 120 мкмоль гидроксида алюминия (Sigma-Aldrich, Германия) в качестве адъюванта. Через 14 дней проводилась аппликация овальбумина (1.17 нмоль/мл) в камеру с экспериментальными препаратами. Первичное введение овальбумина способствует развитию сенсибилизации организма животного. Повторная аппликация овальбумина приводила к дегрануляции тучных клеток в экспериментальных препаратах и могла рассматриваться как модель экспериментальной бронхиальной астмы у животных. Несенсибилизированной группе вводили физиологический раствор внутрибрюшинно в качестве контроля [32].
Схема эксперимента
Были сформированы две группы животных: контрольная (получала физиологический раствор) и экспериментальная, с вызванной бронхиальной астмой (получала инъекцию овальбумина с его повторным введением в камеры с препаратами через 14 дней). Далее проводилась оценка сокращения мышцы трахеи и бронхов после повторного введения овальбумина и после перфузии растворами интерлейкинов.
Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями Европейской комиссии по эвтаназии экспериментальных животных [29].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
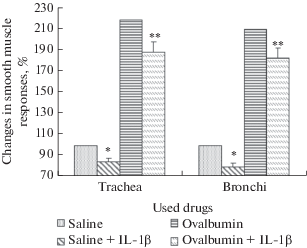
В контрольной группе животных ИЛ-1β вызывал уменьшение сократительных ответов до 84.1 ± 3.8% в препаратах трахеи и до 79.2 ± 4.1% в препаратах бронхов (рис. 1). В экспериментальной модели бронхиальной астмы сократительные ответы достигали 218.3 ± 8.9% в препаратах трахеи и 210.1 ± 7.5% в препаратах бронхов. При поступлении в камеры с препаратами ИЛ-1β сократительные ответы понижались в препаратах трахеи до 188.1 ± 5.2%, в препаратах бронхов – до 182.5 ± 4.9% (р < 0.05).
Рис. 1.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-1β на фоне физиологического раствора (контрольная группа) и на фоне овальбумина (экспериментальная группа). * – достоверное (р < 0.05) отличие от контрольных значений; ** – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина. ИЛ-1β приводит к снижению сократительных ответов трахеи и бронхов крысы как в контрольной (на фоне физиологического раствора), так и в экспериментальной группе (в модели экспериментальной бронхиальной астмы, развившейся на фоне влияния овальбумина). Fig. 1. Contractile responses of smooth muscle of the trachea and bronchi as a result of the influence of IL-1β against the background of physiological saline (control group) and against the background of ovalbumin (experimental group). * – significant (p < 0.05) difference from control values; ** – significant (p < 0.05) difference from the response values on the background of ovalbumin. IL-1β leads to a decrease in contractile responses of rat trachea and bronchi both in the control group (against the background of physiological saline) and in the experimental group (in the model of experimental bronchial asthma that developed against the background of the influence of ovalbumin).
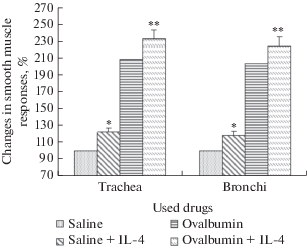
На фоне физиологического раствора ИЛ-4 приводил к повышению сократительных ответов гладкой мышцы трахеи до 122.2 ± 4.1% и мышцы бронхов до 118.4 ± 3.8% (рис. 2). В экспериментальной модели бронхиальной астмы на фоне применения электрической стимуляции постганглионарных нервов ответы трахеи достигали 208.5 ± 5.4%, ответы бронхов – 203.3 ± 4.8%. Введение раствора ИЛ-4 приводило к увеличению сократительных ответов трахеи до 232.6 ± 5.2%, бронхов – до 124.1 ± 4.4% (р < 0.05).
Рис. 2.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-4 на фоне физиологического раствора (контрольная группа) и на фоне овальбумина (экспериментальная группа). * – достоверное (р < 0.05) отличие от контрольных значений; ** – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина. ИЛ-4 приводит к увеличению сократительных ответов трахеи и бронхов крысы как в контрольной (на фоне физиологического раствора), так и в экспериментальной группе (в модели экспериментальной бронхиальной астмы, развившейся на фоне влияния овальбумина). Fig. 2. Contractile responses of smooth muscle of the trachea and bronchi as a result of the effect of IL-4 on the background of physiological saline (control group) and on the background of ovalbumin (experimental group). * – significant (p < 0.05) difference from control values; ** – significant (p < 0.05) difference from the response values on the background of ovalbumin. IL-4 leads to an increase in contractile responses of rat trachea and bronchi both in the control group (against the background of physiological saline) and in the experimental group (in the model of experimental bronchial asthma that developed against the background of the influence of ovalbumin).
На фоне физиологического раствора ИЛ-8 способствовал возрастанию сокращений мышцы трахеи до 160.3 ± 7.8%, бронхов до 150.2 ± 6.9% (рис. 3). Сенсибилизация животных овальбумином с повторным его введением приводила к увеличению сократительных ответов мышцы трахеи до 221.1 ± 5.2%, бронхов – до 214.1 ± 4.1%. Поступление ИЛ-8 в камеру с препаратами способствовало увеличению сокращению трахеи до 245.4 ± 5.3%, бронхов – до 223.1 ± 4.8% (р < 0.05).
Рис. 3.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-8 на фоне физиологического раствора (контрольная группа) и на фоне овальбумина (экспериментальная группа). * – достоверное (р < 0.05) отличие от контрольных значений; ** – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина. ИЛ-8 приводит к увеличению сократительных ответов трахеи и бронхов крысы как в контрольной (на фоне физиологического раствора), так и в экспериментальной группе (в модели экспериментальной бронхиальной астмы, развившейся на фоне влияния овальбумина). Fig. 3. Contractile responses of smooth muscle of the trachea and bronchi as a result of the influence of IL-8 on the background of physiological saline (control group of animals) and on the background of ovalbumin (experimental group of animals). * – significant (p < 0.05) difference from control values; ** – significant (p < 0.05) difference from the response values on the background of ovalbumin. IL-8 leads to an increase in contractile responses of rat trachea and bronchi both in the control group (against the background of physiological saline) and in the experimental group (in the model of experimental bronchial asthma that developed against the background of the influence of ovalbumin).

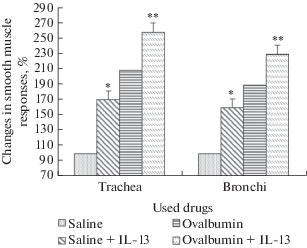
В препаратах контрольной группы животных ИЛ-13 вызывал увеличение сократительных ответов до 170.2 ± 7.2% в препаратах трахеи и до 160.3 ± 6.8% в препаратах бронхов (рис. 4). В экспериментальной модели бронхиальной астмы сократительные ответы достигали 209.2 ± 9.2% в препаратах трахеи и 190.1 ± 8.4% в препаратах бронхов. При поступлении в камеры с препаратами ИЛ-13 сократительные ответы возрастали в препаратах трахеи до 258.4 ± 5.4%, в препаратах бронхов – до 230.2 ± 4.1% (р < 0.05).
Рис. 4.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-13 на фоне физиологического раствора (контрольная группа) и на фоне овальбумина (экспериментальная группа). * – достоверное (р < 0.05) отличие от контрольных значений; ** – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина. ИЛ-13 приводит к увеличению сократительных ответов трахеи и бронхов крысы как в контрольной (на фоне физиологического раствора), так и в экспериментальной группе (в модели экспериментальной бронхиальной астмы, развившейся на фоне влияния овальбумина). Fig. 4. Contractile responses of smooth muscle of the trachea and bronchi as a result of the influence of IL-13 on the background of physiological saline (control group) and on the background of ovalbumin (experimental group). * – significant (p < 0.05) difference from control values; ** – significant (p < 0.05) difference from the response values on the background of ovalbumin. IL-13 leads to an increase in contractile responses of rat trachea and bronchi both in the control group (against the background of physiological saline) and in the experimental group (in the model of experimental bronchial asthma that developed against the background of the influence of ovalbumin).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение ИЛ-1β приводило к достоверному понижению сократительных ответов мышцы трахеи и бронхов крысы на фоне физиологического раствора у контрольной группы животных. В экспериментальной группе на фоне сенсибилизации овальбумином ИЛ-1β оказывал аналогичный эффект и приводил к достоверному снижению ответов трахеи и бронхов. Однако понижение ответов у крыс с аллергией значительно превышало нормальные значения, полученные на фоне физиологического раствора. Найденные результаты могут свидетельствовать о релаксационном эффекте ИЛ-1β как в условиях нормы, так и в условиях экспериментальной модели бонхиальной астмы. Эти данные могут подтверждать результаты экспериментов, опубликованных Дониной и соавт. В этом исследовании при внутривенном введении раствора ИЛ-1β взрослым крысам было получено значительное увеличение дыхательного объема и минутного объема дыхания, что невозможно без улучшения состояния вентиляционной функции дыхательных путей [33]. Тем не менее, в литературе имеются сведения о провоспалительной роли данного цитокина в патогенезе астмы. У пациентов с бронхиальной астмой увеличена секреция этого интерлейкина, с чем связывают обильную продукцию слизи и местную воспалительную реакцию [24]. Возможно предположить, что повышенная подукция ИЛ-1β наблюдается при развитии бронхиальной астмы, но на гладкую мускулатуру респираторных путей данный интерлейкин оказывает релаксационный эффект. Этот эффект можно рассматривать как компенсаторный механизм, нацеленный на улучшение функции внешнего дыхания.
Перфузия раствором ИЛ-4 приводила к увеличению сократительных ответов гладкой мышцы трахеи и бронхов крыс как в условиях нормы, так и при патологии. Такой эффект может быть обусловлен наличием рецепторов к ИЛ-4 на структурах респираторного тракта – гладкой мышцы, нейронах интрамурального ганглия, С-волокнах, тучных клетках. Учитывая более выраженную сократительную реакцию в ответ на перфузию раствора ИЛ-4 у животных с аллергией, можно предположить увеличение экспрессии рецепторов ИЛ-4 по сравнению с контрольной группой. Эти результаты могут найти подтверждение в исследованиях Gounni и соавт. [34]. Можно предположить активацию этих стуктур ИЛ-4 с проявлением констрикторного эффекта. Полученные результаты свидетельствует о местном влиянии ИЛ-4 на структуры респираторного тракта и подтверждают его значение в качестве терапевтической мишени при лечении бронхиальной астмы.
ИЛ-8 приводил к выраженному сокращению трахеи и бронхов гладкой мускулатуры крысы как на фоне физиологического раствора, так и после повторного введения овальбумина. Полученные результаты можно связать с прямым воздействием ИЛ-8 на гладкую мышцу с последующим запуском Са2+-опосредованной сократительной реакции [20]. Также нельзя исключать возможность присутствия рецепторов ИЛ-8 на других структурах респираторного тракта, прямое воздействие на которые могло привести к увеличению сокращения.
Эффект ИЛ-13 на гладкую мыщцу трахеи и бронхи крысы был аналогичен эффектам ИЛ-4 и ИЛ-8. Выраженные увеличения сократительных ответов наблюдались как в препаратах трахеи, так и в препаратах бронхов в норме и при патологии. В сравнении с ответами мышцы на ИЛ-8 и ИЛ-4, сократительные ответы на ИЛ-13 были самыми выраженными, что может указывать на ведущее значение этого интерлейкина в патогенезе бронхиальной астмы in situ. Эти данные подтверждаются данными Hanan и соавт. в эспериментах на мышах [25].
Таким образом, изученные интерлейкины играют существенную роль в механизмах развития бронхиальной астмы в исследованиях in situ. ИЛ-4, ИЛ-8 и ИЛ-13 вызывают увеличение сократительных ответов гладкой мышцы трахеи и бронхов крыс при экспериментальных условиях с применением постганглионарной стимуляции. Исследованные интерлейкины вызывают увеличение сократительной реакции как условиях нормы, так и при моделировании бронхиальной астмы. Наибольший вклад в сокращении мышцы оказывает ИЛ-13 – ответы на этот интерлейкин мышцы трахеи и бронхов в условиях стимуляции постганглионарных нервов были самыми выраженными.
ИЛ-1β, в отличие от ИЛ-4, ИЛ-8 и ИЛ-13, приводил к релаксационному эффекту на гладкую мышцу при условии стимуляции нервов электрическим полем. Несмотря на то, что на уровне целого организма ИЛ-1β вызывает генерализованную воспалительную реакцию, усугубляющую протекание бронхиальной астмы, in situ ИЛ-1β оказывает релаксационный эффект на гладкую мышцу, что может быть рассмотрено как компенсаторный механизм, поддерживающий фунцию внешнего дыхания.
Список литературы
Трулев А.С., Кудрявцев И.В., Назаров П.Г. Факторы острой фазы воспаления как модуляторы взаимодействия тучных клеток и фибробластов. Бюлл. восточно-сибирского научн. центра Сибирск. Отделения Рос.акад. мед. наук. 85: 319–322. 2012. [Trulev A.S., Kudryavtsev I.V., Nazarov P.G. Factors of the acute phase of inflammation as modulators of the interaction of mast cells and fibroblasts. Bull. East Siberian Scient. Center Siberian Branch Russ. Acad. Med. Sci. 85: 319–322. 2012. (In Russ)].
Донина Ж.А., Баранова Е.В., Александрова Н.П. Влияние провоспалительного цитокина интерлейкина 1-β на резистентность организма к острой гипоксии. Рос. физиол. журн. им. И.М. Сеченова. 102: 1333–1342. 2016. [Donina Zh.A., Baranova E.V., Aleksandrova N.P. The effect of pro-inf lammatory cytokine interleukin 1-β on the body’s resistance to acute hypoxia. Russ J. Physiol. 102: 1333–1342. 2016. (In Russ)].
Liu Y.C., Khawaja A.M., Rogers D.F. Pathophysiology of airway mucus secretion in asthma. In: Asthma, basic mechanisms and clinical management. Barnes P.J., Rodger I.W., Thomson N.C. (Eds.) London. Acad. Press. 19: 205–207. 1998.
Hofstetter A.O., Herlenius E. Interleukin-1β depresses hypoxic gasping and autoresuscitation in neonatal DBA/1lacJ mice. Respir. Physiol. Neurobiol. 146: 135–146. 2005.
Roger T., Out T., Mukaida N., Matsushima K., Jansen H., Lutter R. The increased activity of AP-1 and NF-kappaB and the stability of interleukin 8 (IL-8) transcripts are involved in superduction of IL-8 mRNA in lung epithelial cells. Biochem. J. 330: 429–435. 1998.
Gu Q., Lee L.Y., Pulmonary chemoreflex sensitivity is enhanced by intratracheal instillation of interleukin-1b in anesthetized rats. Respir. Crit. Care Med. J. 169: 26-32. 2004.
Moxley G., Meulenbelt I., Chapman K., van Diujn C.M., Eline Slagboom P., Neale M.C., Smith A.J.P., Carr A.J., Loughlin J. Interleukin-1 region meta-analysis with osteoarthritis phenotypes. Osteoarthritis Cartil. J. 18: 200–210. 2010.
Che Xiao-wen Y., Zhang H., Wang W. Effect of ligustrazine injection on levels of interleukin-4 and interferon-γ in patients with bronchial asthma. Chin. J. Integrat. Med. 14: 217–220. 2008.
Liu X.J., Xin Z.L. A study on using IL-4 and IFN-gamma to regulate IgE synthesis in bronchial asthma patients in vitro. Chin. J. Tubercul. Respir. Dis. 19: 186–189. 1996.
Stone K.D., Prussin C., Metcalfe D.D. IgE, mast cells, basophils, and eosinophils. Allergy Clin. Immunol. J. 125: 73–80. 2010.
Wenzel S., Ford L., Pearlman D., Spector S., Sher L., Skobieranda F., Wang L., Kirkesseli S., Rocklin R., Bock B., Hamilton J., Ming J.E., Radin A., Stahl N., Yancopoulos G.D., Graham N., Pirozzi G. Dupilumab in persistent asthma with elevated eosinophil levels. N. Engl. Med. J. 368: 2455–2466. 2013.
Чучалин А.Г. Бронхиальная астма: новые перспективы в терапии. Казанск. мед. журн. 92: 676–684. 2011. [Chuchalin A.G. Bronchial asthma: new perspectives in therapia. Kazan. Med. J. 92: 676–684. 2011. (In Russ)].
Ahmadi M., Rahbarghazi R., Shahbazfar A., Baghban H., Keyhanmaneshet R. Bone marrow mesenchymal stem cells modified pathological changes and immunological responses in ovalbumin-induced asthmatic rats possibly by the modulation of miRNA155 and miRNA133. Gen. Physiol. Biophys. J. 37: 263–274. 2018.
Guo H.W., Chen-Xia Y., Guang-Han H., Jun D., Xin H., Yi L., Keller E.T., Jian Z., Jia-Gang D. Mangiferin attenuates Th1/Th2 cytokine imbalance in an ovalbumin-induced asthmatic mouse model. PLoS J. 9: 78–94. 2014.
Ahmadi M., Shahbazfar A., Rahbarghazi R., Baghban H., Keyhanmaneshet R. Monitoring IL-13 expression in relation to miRNA-155 and miRNA-133 changes following intra-tracheal administration of mesenchymal stem cells and conditioned media in ovalbumin-sensitized rats. Thai. Vet. Med. J. 48: 347–355. 2018.
Ha H., Debnath B., Neamati N. Role of the CXCL8-CXCR1/2 axis in cancer and inflammatory diseases. Theranostics. J. 7: 43–88. 2017.
Tabary O., Zahm J.M., Hinnrasky J., Couetil J.P., Cornillet P., Guenounou M., Gaillard D., Puchelle E., Jacquot J. Selective up-regulation of chemokine IL-8 expression in cystic fibrosis bronchial gland cells in vivo and in vitro. Am. Pathol. J. 153: 921–930. 1998.
Yue T.L., McKenna P.J., Gu J.L., Feuerstein G.Z. Interleukin-8 is chemotactic for vascular smooth muscle cells. Eur. Pharmacol. J. 240: 81-84. 1993.
Fujimura M., Myou S., Nomura M., Mizuguchi M., Matsuda T., Harada A., Mukaida N., Matsushima K., Nonomura A. Interleukin-8 inhalation directly provokes bronchoconstriction in guinea pigs. Allergy J. 54: 386–391.1999.
Govindaraju V., Michoud M.C., Ferraro P., Arkinson J., Safka K., Valderrama-Carvajal H., Valderrama-Carvajal J., Martin G. The effects of interleukin-8 on airway smooth muscle contraction in cystic fibrosis. Respirat. Res. J. 9: 76–86. 2008.
Coalson J.J., Winter V.T., Siler-Khodr T., Yoder B.A. Neonatal chronic lung disease in extremely immature baboons. Am. Resp. Crit. Care Med. J. 160: 1333–1346. 1999.
Nakajima H.L., Takatsu K. Role of cytokines in allergic airway inflammation. Int. Arch. Allergy Immunol. J. 142: 265–273. 2007.
Brusselle G.G., Maes T., Bracke K.R. Bedside to bench: eosinophilic airway inflammation in nonallergic asthma. Nat. Med. J. 19: 977–979. 2013.
Amin K., Janson C., Boman G., Venge P. The extracellular deposition of mast cell products is increased in hypertrophic airways smooth muscles in allergic asthma but not in nonallergic asthma. Allergy J. 60: 1241–1247. 2005.
Farghaly H.S.M., Blagbrough I.S., Medina-Tato D.A., Watson M.L. Department of Pharmacy and Pharmacology. United Kingdom J. 17: 87–98. 2008.
Eum S.Y., Maghni K., Tolloczko B., Eidelman D.H., Martin J.G. IL-13 may mediate allergen-induced hyperresponsiveness independently of IL-5 or eotaxin by effects on airway smooth muscle. Am. Physiol. Lung. Cell Mol. Physiol. J. 288: 576–584. 2005.
Duan W., Aguinaldo A.M., Leung B.P., Vlahos C.J., Wong W.S. An anti-inflammatory role for a phosphoinositide 3-kinase inhibitor LY294002 in a mouse asthma model. Int. Immunopharmacol. J. 5: 495–502. 2005.
Smyth D.J., Plagnol V., Walker N.M., Cooper J.D., Downes K., Yang J.H.M., Howson J.M.M., Stevens H., McManus R., Wijmenga C., Heap G.A., Dubois P.C., Clayton D.G., Hunt K.A., van Heel D.A., Todd J.A. Shared and distinct genetic variants in type 1 diabetes and celiac disease. N. Engl. Med. J. 359: 27–67. 2008.
Close B., Banister K., Baumans V., Warwick C. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Lab. Animals J. 31: 1–32. 1997.
Hatziefthimiou A., Karetsi E., Pratzoudis E., Gourgoulianis K., Molyydas P. Resting tension on airway smooth muscle: the involvement of epithelium. Respir. Physiol. Neurobiol. J. 145: 201–208. 2005.
Федин А.Н., Алиева Е.В., Ноздрачев А.Д. Реакции гладкой мышцы трахеи на гистамин. Рос. физиол. журн. им. И.М. Сеченова. 83: 102–108. 1997. [Fedin A.N., Alieva E.V., Nozdrachev A.D. Reactions of the smooth muscle of the trachea to histamine. Russ. J. Physiol. 83: 102–108. 1997. (In Russ)].
Masakazu Y., Osamu S., Kenji N., Tetsuji M., Koji S. Propofol Attenuates Ovalbumin-Induced Smooth Muscle Contraction of the Sensitized Rat Trachea: Inhibition of Serotonergic and Cholinergic Signaling. Anesthesia & Analgesia J. 3: 594–600. 2006.
Донина Ж.А., Е.В. Баранова, Александрова Н.П. Ингибирование гиперпродукции оксида азота в условиях прогрессивно нарастающей гипоксии на фоне действия ИЛ-1β снижает выживаемость крыс после острой гипоксии. Рос. физиол. журн. им. И.М. Сеченова. 105: 1514–1525. 2019. [Donina Zh.A., Baranova E.V., Aleksandrova N.P. Inhibition of hyperproduction of nitric oxide under conditions of progressively increasing hypoxia against the background of the action of IL-1β reduces the survival of rats after acute hypoxia. Russ. J. Physiol. 105: 1514–1525. 2019. (In Russ)].
Gounni A.S., Wellemans V., Yang J., Bellesort F., Kassiri K., Gangloff S., Guenounou M., Halayko A.J., Lamkhioued Q.H., Lamkhioued B. Human Airway Smooth Muscle Cells Express the High Affinity Receptor for IgE (FcεRI): A Critical Role of FcεRI in Human Airway Smooth Muscle Cell Function. Immunol. J. 175: 2613–2621. 2005.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


