Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 70-84
Регуляция тонуса артерий у крыс, длительно получавших высокосолевую диету
Г. И. Лобов 1, Г. Т. Иванова 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: ivanovagt@infran.ru
Поступила в редакцию 20.10.2020
После доработки 10.11.2020
Принята к публикации 15.11.2020
Аннотация
Диета с высоким содержанием соли приводит к ослаблению дилатации сосудов в ответ на действие различных вазоконстрикторов, однако вовлеченные сосудистые механизмы недостаточно изучены. Группу самцов крыс Вистар в возрасте 3 мес. переводили на 3 мес. на диету с содержанием 8% NaCl (HS), вторая группа получала рацион со стандартным содержанием соли, составлявшем 0.34% (NS). По окончании эксперимента проводили эвтаназию крыс и извлекали брюшную аорту и верхнюю брыжеечную артерию (ВБА). Сегменты сосудов помещали в миограф и измеряли ацетилхолин (AХ)-индуцируемую релаксацию предварительно сокращенных фенилэфрином сегментов сосудов. Диета с высоким содержанием соли приводила к ослаблению релаксации ВБА в бескальциевом растворе. В ответ на AХ и нитропруссид натрия наблюдалась выраженная релаксация сосудистых сегментов, при этом AХ-индуцируемая релаксация сосудов HS-крыс имела меньшую амплитуду. Блокаторы К+-каналов (тетраэтиламмоний, TRAM-34 и апамин) приводили к ослаблению AХ-индуцируемой релаксации ВБА, но не аорты. В ВБА HS-крыс уменьшение релаксации при действии блокаторов К+-каналов было более выраженным. Ингибирование продукции эндогенного сероводорода также приводило к ослаблению релаксации сегментов ВБА на AХ. В ВБА HS-крыс ослабление AХ-индуцируемой релаксации на фоне пропаргилглицина было большим по сравнению с NS-крысами. Полученные данные показывают, что длительная высокосолевая диета приводит к уменьшению агонист-индуцируемой релаксации сегментов аорты и ВБА. Ослабление релаксации сегментов аорты и ВБА происходит вследствие снижения продукции эндотелием оксида азота. В ВБА HS-крыс уменьшение NO-опосредованной релаксации частично компенсируется возрастанием роли EDHF в АХ-индуцируемой релаксации. Результаты также показывают, что одним из EDHF в ВБА крыс является сероводород, роль которого в релаксации ВБА возрастает у HS-крыс.
Эпидемиологические данные свидетельствуют о наличии связи между употреблением большого количества соли и развитием артериальной гипертензии у людей [1]. Чрезмерное потребление натрия (по определению Всемирной организацией здравоохранения это более 5 г натрия в день) довольно часто приводит к увеличению артериального давления (АД) и формированию стойкой артертальной гипертензии. Зависимость АД от количества хлористого натрия в пищевом рационе была показана и у некоторых животных, например, Dahl-сольчувствительных крыс, однако для крыс линии Вистар такая зависимость не характерна [2, 3].
Артериальная гипертензия, спровоцированная высокосолевой диетой, является мощным предрасполагающим фактором для развития инсульта, ишемической болезни сердца и сердечной недостаточности [4, 5]. Вместе с тем, в исследованиях in vivo и in vitro было показано, что чрезмерное потребление соли может вызывать анатомическое ремоделирование и функциональные нарушения в мелких и крупных артериях, а также воспалительные изменения в эндотелии микрососудов даже у нормотензивных субъектов, существенно повышая риск развития различных сердечно-сосудистых заболеваний и инсульта [5, 6]. Установлено, что у здоровых молодых людей кратковременная (7 дней) высокосолевая диета независимо от величины АД, изменений состава тела или задержки жидкости ухудшает реактивность микрососудов, влияя на эндотелийзависимую вазодилатацию [7]. Также следует учитывать влияние солевой нагрузки на физические характеристики сосудов, в частности, их жесткость [8, 9], которая определяется соотношением баланса коллагена и эластина в сосудистой стенке. Показано, что высокосолевая нагрузка приводит к увеличению синтеза коллагена и снижению содержания эластина, тем самым провоцируя развитие фиброза, увеличивающего жесткость сосудов, что, в свою очередь, может усиливать эндотелиальную дисфункцию [10, 11].
Эндотелий сосудов является важным компонентом сосудистой стенки для поддержания ее гомеостаза, включая регуляцию тонуса сосудов. Эндотелиальные клетки при физической (напряжение сдвига) и химической стимуляции (нейротрансмиттеры, гормоны, цитокины) выделяют несколько факторов, часть которых обладает вазоконстрикторным эффектом, а другая часть способствует дилатации сосудов [12]. В многочисленных исследованиях установлено, что синтезируемые эндотелием вазодилататоры представляют собой оксид азота (NO), сосудорасширяющие простагландины (PG), в частности, простациклин (PGI2), и гиперполяризующий фактор, продуцируемый эндотелием (EDHF) [13].
Полагают, что в основе многочисленных патофизиологических состояний, включая сердечно-сосудистые, почечные и метаболические заболевания, лежит дисбаланс между количеством вазоконстрикторов и вазодилататоров, продуцируемых эндотелием, при этом чаще встречается дефицит вазодилататоров [14]. В ряде работ показано, что важнейшим проявлением эндотелиальной дисфункции в мелких и крупных артериях у крыс и мышей, получавших высокосолевую диету, является снижение уровня (биодоступности) NO [15]. Также в некоторых работах были получены доказательства того, что высокое содержание соли в рационе сопровождается нарушением эндотелий-зависимой дилатации артерий, опосредованной метаболитами арахидоновой кислоты [16]. Что касается роли эндотелиальной гиперполяризации в регуляции сосудистого тонуса у животных, содержавшихся на высокосолевой диете, то необходимо отметить, что этот механизм изучен слабо и полученные данные неоднозначны [17]. Félétou и Vanhoutte полагают, что EDHF-опосредованные ответы могут выступать в роли вазодилататорного резерва при гипертонии и некоторых других видах патологии и компенсировать (хотя бы временно или частично) эндотелиальную дисфункцию при нарушении синтеза (биодоступности) NO [18].
И, наконец, необходимо отметить, что к настоящему времени практически нет работ по изучению роли сероводорода (H2S) в регуляции сосудистого тонуса у животных, находящихся на высокосолевой диете. Между тем, в исследованиях последних лет показано, что H2S оказывает множество полезных эффектов на стенку кровеносных сосудов, включая подавление окислительного стресса, ингибирование воспаления и усиление вазодилатации [19].
Общая цель настоящего исследования состояла в том, чтобы оценить влияние долгосрочной высокосолевой диеты (8% NaCl, 3 мес.) на эндотелий-зависимую дилатацию изолированных сосудов (аорты и верхней брыжеечной артерии) крыс Вистар. Конкретные цели исследования состояли в том, чтобы определить влияние высокосолевой диеты на отдельные механизмы ацетилхолин-индуцируемой эндотелий-зависимой вазодилатации (опосредованные NO, PGI2 и эндотелиальной гиперполяризацией), а также реализуемые с участием H2S.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на взрослых самцах крыс стока Вистар (Центр коллективного пользования “Биоколлекция” Института физиологии им. И.П. Павлова РАН). Возраст животных в начале эксперимента – 3 мес., масса 230–260 г. Крысы содержались в стандартных условиях вивария, получая питьевую воду и корм ad libitum. В исследовании использовалось 20 крыс, которые случайным образом были распределены на 2 группы, рацион животных различался по количеству NaCl. Первая группа получала в течение 12 нед. высоконатриевый рацион, содержащий 8% NaCl в комбикорме (high salt, HS). Вторая группа (normal salt, NS) получала стандартный рацион (0.34% NaCl). Высокосолевой рацион создавали на основе стандартного комбикорма путем орошения гранул насыщенным раствором поваренной соли с дальнейшим его высушиванием. По содержанию белков, жиров, углеводов, а также питательной ценности рацион двух групп не отличался. Исследование проводилось в соответствии с принципами Базельской декларации и было одобрено этической комиссией Института физиологии им. И.П. Павлова РАН.
Эвтаназию животных осуществляли обескровливанием под наркозом (золетил 8 мг/кг). После вскрытия брюшной полости вырезали сегменты брюшной аорты и верхней брыжеечной артерии (ВБА) длиной 7–8 мм. Затем, после тщательного удаления жира и окружающей соединительной ткани, из аорты и ВБА вырезали кольцевые сегменты длиной 2 мм (19 сегментов из аорты HS-крыс, 22 – из аорты NS-крыс, 21 – из ВБА HS-крыс, 24 – из ВБА NS-крыс). Подготовленные сосудистые сегменты до исследования хранили в холодильнике в сатурированном газовой смесью (95% О2 и 5% СО2) физиологическом растворе на льду.
В начале эксперимента сосудистые сегменты размещали в камере миографа, через которую непрерывно протекал физиологический солевой раствор (состав в мМ: NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5), сатурированный газовой смесью (95% О2 и 5% СО2). Температуру раствора поддерживали на уровне 37.0 ± 0.1°С, рН раствора – 7.4 ± 0.02. Сегмент сосуда размещали между двумя титановыми проволочками и с помощью микроманипулятора растягивали до развития пассивного напряжения 20 мН, позволяя им достичь напряжения покоя в течение 30 мин. Такое растяжение было оптимальным для развития воспроизводимого максимального сокращения в растворе, содержащем 100 мМ KCl (эквимолярное количество NaCl заменяли на KCl) [20]. Сокращение, вызванное гиперкалиевым раствором, использовали в качестве эталона для оценки сократительной способности сегментов аорты и ВБА. Силу сокращений сосудистых сегментов измеряли с помощью датчика силы FORT-10 (WPI, США), работающего в изометрическом режиме. Информация от датчика поступала в блок Labmaster (усилитель + аналого-цифровой преобразователь, Институт физиологии им. И.П.Павлова РАН, РФ) и затем в компьютер. Первичная обработка данных осуществлялась программой Labmaster и Microsoft Excel.
После определения эталонной сократительной реакции сосудистых сегментов в растворе, содержащем 100 мМ KCl, сосуды на протяжении 30 мин омывали физиологическим раствором. Наличие неповрежденного эндотелия в сосудистых препаратах подтверждали, наблюдая реакцию релаксации сосудистых сегментов, предварительно сокращенных фенилэфрином, на ацетилхолин [21]. У части препаратов эндотелий удаляли механически. С целью оценки влияния высокосолевой диеты на тонус покоя и ремоделирование стенки аорты и ВБА, cилу сокращений сосудистых сегментов измеряли после 20-минутной перфузии бескальциевым солевым раствором, содержащем 2 мМ EGTA.
В дальнейшем схема проведения эксперимента была такова: после измерения напряжения сегментов аорты и ВБА в гиперкалиевом и бескальциевом растворах сосудистые сегменты промывали на протяжении 30 мин физиологическим раствором. Затем в омывающий раствор вводили фенилэфрин, phenylephrine hydrochloride (PHE, 10–5 М) и после выхода сократительной реакции на плато для определения эндотелий-зависимой релаксации в раствор добавляли ацетилхолин, acetylcholine chloride, (ACh) в различных концентрациях и оценивали величину релаксации. Для идентификации продуцируемых эндотелием вазодилататоров использовали различные ингибиторы и блокаторы: ингибитор эндотелиальной NO-синтазы – L-N5-(1-Iminoethyl) ornithine, dihydrochloride (L-NIO, 10–5 М); ингибитор циоклооксигеназы – диклофенак, diclofenac sodium salt (DF, 5 × 10–6 М); неспецифический блокатор К+-каналов – тетраэтиламмония хлорид, tetraethylammonium chloride (TEA, 10–3 М); блокатор Са2+-активируемых К+-каналов промежуточной проводимости – TRAM-34 (10–5 М); блокатор Са2+-активируемых К+-каналов малой проводимости – апамин (Apa, 10–6 М); ингибитор цистатионин-γ-лиазы – пропаргилглицин, DL-propargylglycine (PPG, 10–4 М). Для связывания остаточного Ca2+ в бескальциевом растворе добавляли ЭГТА (Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid, 2 × 10–3 М).
Все химические вещества были приобретены у Sigma-Aldrich (США). Ингибиторы и блокаторы добавляли в физиологический раствор за 20 мин до применения PHE. Реактивы непосредственно перед экспериментами растворяли в дистиллированной воде в концентрации 10 мМ, затем необходимое количество добавляли в физиологический раствор. Диклофенак и TRAM-34 предварительно растворяли в метаноле (20 мг/мл), и необходимое количество добавляли в физиологический раствор непосредственно перед экспериментом.
Статистическую обработку полученных результатов проводили с помощью Microsoft Excel и Stat-Soft STATISTICA 6.1.478. Нормальность распределения полученных данных определялась посредством расчетов W-критерия Шапиро–Уилка. Полученные данные представлены в виде средних значений с их стандартной ошибкой (M ± SE). Для установления достоверности различий использовали t-критерий Стьюдента. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В конце экспериментального периода масса крыс, получавших высокосолевую диету составила 370 ± 32 г (n = 10), масса крыс, получавших обычный рацион – 393 ± 21 г (n = 10). Систолическое артериальное давление, измеренное в хвостовой артерии манжеточным методом, было: у HS-крыс – 130 ± 10 мм рт. ст., у NS-животных – 129 ± 11 мм рт. ст. Как видно из представленных данных, 3-месячная диета с высоким содержанием соли не оказывала влияния на массу тела и систолическое артериальное давление.
Гиперкалиевый раствор (100 мМ К+) приводил к мощному тоническому сокращению сосудистых сегментов. Сила сокращений сосудистых сегментов от HS-крыс в гиперкалиевом растворе не отличались от силы сокращений соответствующих сосудов NS-животных. Применение бескальциевого раствора показало, что сегменты ВБА HS-крыс сохраняют большее остаточное напряжение по сравнению с ВБА NS-крыс. Сила сокращений сегментов аорты HS-крыс в бескальциевом растворе также была больше по сравнению с NS-крысами, но эта разница оказалась недостоверной (табл. 1). Эти данные свидетельствуют о нарушении механизмов релаксации в сосудах HS-крыс.
Таблица 1.
Сила сокращений сосудистых сегментов крыс, содержавшихся на высокосолевой и стандартной диете в физиологическом, гиперкалиевом (100 мМ) и бескальциевом растворах Table 1. Contraction force of vascular segments of rats kept on a high-salt and standard diet in physiological, hyperpotassium (100 mM) and calcium-free solutions
| Группа Group | Сосуд Vessel | Напряжение
покоя, мН Rest tension |
Максимальное
напряжение
(К+ 100 мМ), мН Maximum tension |
Напряжение в бескальциевом
растворе, мН Tension in a calcium-free solutions |
|---|---|---|---|---|
| NS | Aорта Aorta |
12.7 ± 0.9 | 25.9 ± 1.4 | 9.3 ± 0.7 |
| ВБА SMA |
10.5 ± 0.7 | 28.9 ± 1.6 | 6.8 ± 0.5 | |
| HS | Аорта Aorta |
13.5 ± 1.1 | 28.04 ± 1.6 | 10.4 ± 0.9 |
| ВБА SMA |
11.4 ± 0.8 | 30.4 ± 1.7 | 8.6 ± 0.8* |
После оценки сократительных ответов сосудистых сегментов мы перешли к исследованию их способности к агонист-индуцируемой релаксации. На первом этапе изучали эндотелий-независимые реакции сегментов аорты и ВБА NS- и HS-крыс. После установления стабильного сокращения под действием PHE в раствор добавляли нитропруссид натрия (NP, 10–5 М) [20]. Под действием NP развивалась выраженная релаксация сосудистых сегментов. Релаксация аорты и ВБА NS-крыс на NP была несколько большей по сравнению с соответствующими сосудистыми сегментами HS-крыс, однако анализ показал, что различия были статистически недостоверными (не показано).
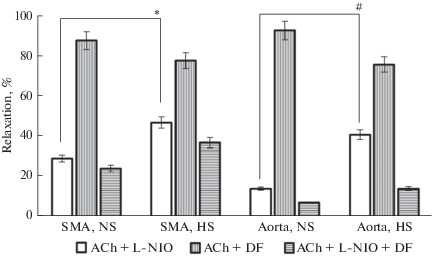
На следующем этапе исследовали эндотелий-зависимую релаксацию сосудистых сегментов. В омывающий раствор вводили AХ в нарастающих концентрациях (10–9–10–5 М). AХ вызывал дозозависимое расслабление предконтрактированных сосудов обеих групп крыс. Усредненные данные этой серии опытов представлены на рис. 1. В этих экспериментах релаксация сегментов аорты и ВБА HS-крыс на AХ в концентрациях ≥10–7 М были слабее по сравнению с релаксацией сосудистых сегментов NS-крыс. Денудированные сосуды не реагировали на введение в раствор AХ в концентрациях 10–9–10–6 М, при этом AХ в концентрации 10–5 М вызывал сокращение небольшой амплитуды (не показано). Необходимо отметить, что релаксация сегментов аорты и ВБА HS-крыс на AХ в максимальной концентрации была достоверно меньше по сравнению с релаксацией этих сосудов на NP.
Рис. 1.
AХ-индуцируемая релаксация предварительно сокращенных PHE (10–5 М) сегментов аорты и верхней брыжеечной артерии (SMA) HS- и NS-крыс. Результаты представлены в % от величины PHE-стимулируемого сокращения в виде среднего значения ± SE. Различия между соответствующими сосудами HS- и NS-крыс достоверны: * – р < 0.05. Fig. 1. ACh-induced relaxation of pre-contracted PHE (10–5 M) segments of the aorta and superior mesenteric artery (SMA) of HS and NS rats. Results are presented as % of PHE-stimulated contraction as mean ± SE. The differences between the corresponding vessels of HS- and NS-rats are significant: * – p < 0.05.

В дальнейшем исследовали механизмы эндотелий-зависимой дилатации сегментов аорты и ВБА HS- и NS-крыс. С этой целью после предварительного сокращения сосудистых сегментов фенилэфрином в раствор вводили AХ и оценивали величину дилатации. Затем после 30-минутного омывания сосудистых сегментов физиологическим раствором вводили ингибитор эндотелиальной NO-синтазы (L‑NIO) и диклофенак по отдельности или вместе. Через 20 мин вызывали сокращение сосудистых сегментов фенилэфрином и на этом фоне добавляли AХ. На фоне действия ингибиторов релаксация сосудистых сегментов была значительно меньше по сравнению с эффектом AХ в физиологическом растворе. Данные этих опытов показывают, что основным вазодилататором в исследуемых сосудах NS‑крыс является NO (в сегментах аорты NO обеспечивал до 86% AХ-индуцируемой вазорелаксации). Высокосолевая диета ослабляла способность эндотелия к производству NO, в сегментах аорты HS-крыс на долю NO приходилось менее 60% от величины AХ-индуцируемой релаксации. В сегментах ВБА NS-крыс доля не NO-опосредованной релаксации составляла 29%, а в ВБА HS-крыс она возрастала до 47%. Результаты данной серии опытов представлены на рис. 2.
Рис. 2.
Релаксация предварительно сокращенных фенилэфрином сегментов аорты и ВБА крыс, получавших высокосолевую диету (HS) и контрольной группы (NS), на AХ на фоне действия ингибитора эндотелиальной NO-синтазы (L-NIO) и диклофенака (DF). Результаты представлены в % от величины AХ-индуцируемой релаксации в виде среднего значения ± SE. Различия между соответствующими сосудами HS- и NS-крыс достоверны: # – р< 0.01, * – р < 0.05. Fig. 2. Relaxation of the segments of the aorta and SMA, previously contracted by phenylephrine, in rats fed a high-salt diet (HS) and control group (NS) on ACh in the presence of an endothelial NO-synthase inhibitor (L-NIO) and diclofenac (DF). Results are presented in % of ACh-induced relaxation as mean ± SE. The differences between the corresponding vessels of HS and NS rats are significant: # – p < 0.01, * – p < 0.05.
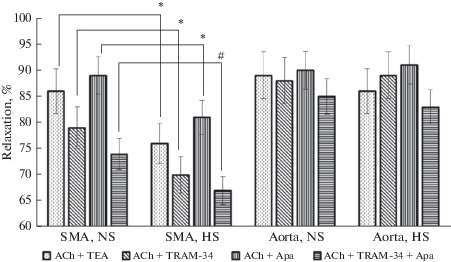
Учитывая важную роль эндотелиальной гиперполяризации в дилатации различных артерий у разных животных и роль Са2+-активируемых К+-каналов в этом процессе [21], в следующей серии опытов мы использовали различные блокаторы К+-каналов: тетраэтиламмоний как неспецифический блокатор различных К+-каналов, TRAM-34 – блокатор Са2+-активируемых К+-каналов промежуточной проводимости и апамин – блокатор Са2+-активируемых К+-каналов малой проводимости. Блокаторы вводили в физиологический раствор за 20 мин до предконтрактирования и последующей AХ-индуцируемой вазорелаксации. При исследовании сегментов аорты HS- и NS-крыс было установлено, что все применяемые нами блокаторы К+-каналов вызывают небольшое уменьшение релаксации сегментов аорты на AХ. В сегментах ВБА NS-крыс, в отличие от аорты, тетраэтиламмоний, TRAM-34 и апамин приводили к выраженному уменьшению релаксации на AХ. Максимальное уменьшение AХ-индуцируемой релаксации сегментов ВБА наблюдалось при применении комбинации блокаторов: TRAM-34 + апамин. В сегментах ВБА HS-крыс снижение AХ-индуцируемой релаксации при применении блокаторов К+-каналов было более выраженным по сравнению с реакциями ВБА NS-крыс (рис. 3).
Рис. 3.
Релаксация предварительно сокращенных фенилэфрином сегментов аорты и ВБА крыс, получавших высокосолевую диету (HS) и контрольной группы (NS), на ацетилхолин (ACh) на фоне действия блокаторов K+-каналов: тетраэтиламмония (TEA), TRAM-34 и апамина (Apa). Результаты представлены в % от величины ACh-индуцируемой релаксации в виде среднего значения ± SE. Различия между величинами релаксации ВБА HS- и NS-крыс достоверны: # – р < 0.01, * – р < 0.05. Fig. 3. Relaxation of the segments of the aorta and SMA, previously contracted by phenylephrine, of rats fed a high-salt diet (HS) and control group (NS) on ACh against the background of the action of K+-channel blockers: tetraethylammonium (TEA), TRAM-34 and apamine (Apa). Results are presented in % of ACh-induced relaxation as mean ± SE. The differences between the values of the relaxation of HS- and NS-rats are significant: # – p < 0.01, * – p < 0.05.
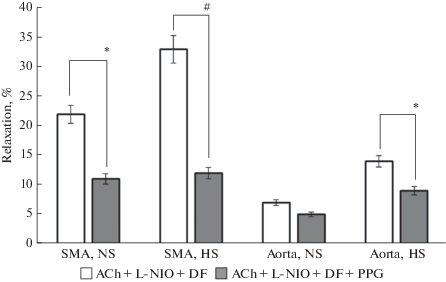
В последние годы при исследовании механизмов дилатации артерий различных сосудистых регионов значительное внимание уделяется сероводороду (H2S), который принято считать третьим газотрансмиттером [22]. В заключительной серии опытов мы исследовали роль эндогенного H2S в AХ-индуцируемой релаксации сегментов аорты и ВБА HS- и NS-крыс. С этой целью первоначально оценивали величину релаксации сосудистых сегментов на AХ в физиологическом растворе, затем в растворе, содержащем ингибиторы эндотелиальной NO-синтазы и циклооксигеназы. Поскольку доминирующим ферментом, синтезирующим H2S в сердечно-сосудистой системе, является цистатионин-γ-лиаза (CSE) [23, 24], в последующем в этот раствор добавляли ингибитор CSE – пропаргилглицин. Введение PPG в раствор, содержащий L-NIO и диклофенак, приводило к достоверному снижению AХ-индуцируемой релаксации. В сегментах ВБА действие PPG сопровождалось более выраженным уменьшением вазорелаксации по сравнению с аортой, в ВБА HS-крыс ингибирующий эффект PPG был достоверно больше по сравнению с ВБА NS-крыс (рис. 4). Эти данные позволяют предположить, что вазорелаксация, вызванная AХ в сегментах аорты и ВБА, опосредуется не только NO и PGI2, а в ее развитии принимает участие также H2S.
Рис. 4.
Релаксация предварительно сокращенных фенилэфрином сегментов аорты и ВБА крыс, получавших высокосолевую диету (HS) и контрольной группы (NS), на ACh на фоне действия ингибитора эндотелиальной NO-синтазы (L-NIO), ингибитора циоклооксигеназы диклофенака (DF) и ингибитора цистатионин-γ-лиазы – пропаргилглицина (PPG). Результаты представлены в % от величины ACh-индуцируемой релаксации в виде среднего значения ± SE. Различия между соответствующими сосудами HS- и NS-крыс достоверны: # – р < 0.01, * – р < 0.05. Fig. 4. Relaxation of the segments of the aorta and SMA, previously contracted with phenylephrine, of rats fed a high-salt diet (HS) and control group (NS) on ACh against the background of the action of an endothelial NO synthase inhibitor (L-NIO), a cyoclooxygenase inhibitor diclofenac (DF) and a cystathionine inhibitor γ-lyase – propargylglycine (PPG). Results are presented in % of ACh-induced relaxation as mean ± SE. The differences between the corresponding vessels of HS- and NS-rats are significant: # – p < 0.01, * – p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последние 20 лет получено множество данных, доказывающих, что потребление пищи с высоким содержанием соли тесно связано с повышенным риском развития сердечно-сосудистых заболеваний независимо от эффекта на артериальное давление [25]. В это же время стало ясным, что у людей высокосолевая диета приводит к функциональному дефициту эндотелия сосудов, который проявляется в ослаблении реакций сосудов на различные вазомоторные раздражители [26]. В экспериментах на животных также было установлено, что высокосолевая диета оказывает негативное влияние на сосуды, при этом, как правило, нарушается процесс вазодилатации [27]. В этих работах при исследовании функционального состояния артерий животных, получавших рацион с избыточным количеством соли, были получены значительно отличающиеся результаты [28–30]. Мы полагаем, что это связано как с разницей объектов исследований (тип артерии, ее локализация и размер, вид животного), так и с многообразием примененных методических приемов и протоколов. Значительно варьировала также продолжительность высокосолевой диеты.
В отличие от других работ на крысах, в которых продолжительность высокосолевой диеты составляла от 3 дней до 4 нед. [28, 31], в нашем исследовании крысы содержались на высокосолевом рационе на протяжении 12 нед., что, по нашему мнению, должно было привести к выраженным изменениям в регуляции сосудистого тонуса. Поскольку в большинстве подобных работ при исследовании артерий как in vivo, так и in vitro было выявлено нарушение механизмов эндотелий-зависимой вазодилатации, в нашей работе также основное внимание было уделено этой проблеме.
По завершении 12-недельной диеты с 8%-ным содержанием NaCl была определена масса животных и измерено систолическое артериальное давление. Сравнение данных HS- и NS-крыс показало, что высокосолевая диета не оказывала значимого влияния на массу тела животных и систолическое артериальное давление.
При исследовании максимальной силы сокращений сегментов аорты и ВБА HS- и NS-крыс были выявлены минимальные различия, что косвенным образом могло указывать на отсутствие или слабое ремоделирование сосудистой стенки у HS-крыс. Однако действие бескальциевого раствора продемонстрировало снижение способности стенки сосудов HS-крыс к расслаблению. Максимальные различия между реакциями сосудов HS- и NS-крыс в бескальциевом растворе наблюдались при исследовании сегментов ВБА. Дилататорный эффект AХ на сегменты ВБА HS-крыс также был меньше по сравнению с ВБА NS-крыс. Ранее ремоделирование и снижение реактивности при действии агонистов было выявлено в мелких артериях и артериолах крыс при 4-недельном содержании их на высокосолевой диете [29]. В нашем исследовании сниженный ответ сегментов ВБА при действии бескальциевого раствора может указывать на ремоделирование крупных артерий мышечного типа у крыс, длительное время содержавшихся на высокосолевой диете.
Общепризнано, что важнейшим продуцируемым эндотелием вазодилататором является NO [32]. В нашей работе первоначально было проведено исследование с применением экзогенного NO, т.е. оценивалась эндотелий-независимая релаксация сегментов аорты и ВБА. Добавление в омывающий раствор нитропруссида (источник экзогенного NO) показало отсутствие достоверных различий между аналогичными сосудами HS- и NS-крыс. Эти результаты достаточно важны, поскольку свидетельствуют о том, что длительная высокосолевая диета не приводит к нарушению в сосудистых гладкомышечных клетках внутриклеточных сигнальных механизмов, активируемых NO, то есть сохраняется нормальная реактивность гладкомышечных клеток на воздействие NO.
На начальном этапе исследования эндотелий-зависимой релаксации сегментов аорты и ВБА были построены кривые доза–эффект при применении AХ в концентрациях 10–9–10–5 М. Было показано, что при применении AХ в концентрациях ≥10–7 М релаксация сегментов аорты NS крыс составляла более 75%, а ВБА NS-крыс – более 85% от величины PHE-стимулируемого сокращения в этих сосудах. Различия в реакциях сосудистых сегментов HS- и NS-крыс при действии AХ в концентрациях ≥10–7 М были достоверными. Анализ данных, полученных при действии нитропруссида и AХ на сосудистые сегменты HS- и NS-крыс, показал, что длительная высокосолевая диета приводит к нарушению продукции эндотелием вазодилататоров в артериях различного типа: как в коллекторных (аорта), так и в артериях распределения (ВБА).
Известно, что в сосудистой стенке в физиологических условиях NO продуцируется эндотелиальными клетками посредством активации эндотелиальной NO-синтазы (eNOS). Патогенные факторы (а длительное воздействие высокосолевой диеты можно считать таковым) приводят к экспрессии генов, кодирующих синтез индуцибельной NO-синтазы (iNOS) в различных клетках, в том числе, и в гладкомышечных клетках сосудистой стенки [33]. Задачей нашей работы было исследование эндотелий-зависимой регуляции тонуса сосудов, поэтому в нашей работе в качестве ингибитора мы использовали L-NIO, который является селективным ингибитором еNOS. Добавление в физиологический раствор L-NIO приводило к значительному уменьшению релаксации сосудистых сегментов на AХ. Максимальное уменьшение релаксации наблюдалось в сегментах аорты NS-крыс, это свидетельствует о том, что в данном сосуде в физиологических условиях основным эндотелиальным вазодилататором является NO. Сегменты аорты HS-крыс на фоне действия L-NIO демонстрировали меньшее снижение амплитуды AХ-индуцируемой релаксации. Сравнение этих данных указывает на то, что повреждающее действие высокосолевой диеты на эндотелий аорты заключается, в частности, в нарушении функции еNOS.
В сегментах ВБА NS-крыс L-NIO оказывал значительно меньший ингибиторный эффект по сравнению с аортой, что свидетельствует о меньшей роли NO в качестве эндотелиального вазодилататора в этих сосудах. Значительная амплитуда AХ-индуцируемой релаксации на фоне действия L-NIO указывает также на то, что в физиологических условиях эндотелий ВБА наряду с NO продуцирует и другие вазодилататоры. В сегментах ВБА HS-крыс амплитуда релаксации на AХ на фоне действия L-NIO уменьшалась, что подтверждает повреждающее действие высокосолевой диеты на еNOS в этих сосудах.
Поскольку в некоторых сосудах важную роль в вазодилатации выполняют продуцируемые эндотелием простагландины [34], мы провели исследование влияния ингибитора циклооксигеназы – диклофенака на AХ-индуцируемую релаксацию сегментов аорты и ВБА. Диклофенак практически не оказывал влияния на релаксацию аорты и ВБА NS-крыс, что указывает на незначительную роль простаноидов в релаксации этих сосудов в физиологических условиях. Высокосолевая диета изменяла способность эндотелия к синтезу вазодилатирующих простаноидов. У HS-крыс на фоне действия диклофенака наблюдалось достоверное снижение AХ-индуцируемой релаксации сегментов аорты и ВБА, при этом эффект диклофенака был более выражен в ВБА. Эти данные показывают, что длительная высокосолевая диета приводит к активации циклооксигеназы в сосудистой стенке. Поскольку диклофенак ингибирует циклооксигеназу-1 и циклооксигеназу-2, логично предположить, что высокосолевая диета способствует экспрессии генов, ответственных за синтез циклооксигеназы-2 и появлению этого фермента в сосудистой стенке [35], это способствует образованию значимого количества простаноидов, которые принимают участие в процессах вазодилатации.
Поскольку на фоне совместного применения ингибиторов NO-синтазы и циклооксигеназы не наблюдалось полного ингибирования AХ-индуцируемой релаксации сегментов ВБА NS- и HS-крыс, дальнейшее исследование было посвящено изучению возможной роли фактора эндотелиальной гиперполяризации (EDHF) в процессе вазорелаксации. Химическая природа EDHF до настоящего времени не определена. Полагают, что несколько веществ могут выполнять функцию EDHF: эпоксиэйкозатриеновая кислота, пероксид водорода, K+, сероводород [36]. Несмотря на то, что химическая природа EDHF неизвестна, механизм его действия в большей или меньшей степени понятен: эндотелиальная гиперполяризация развивается преимущественно за счет открывания Са2+-чувствительных К+-каналов, что приводит к выходу из клеток К+ и развитию гиперполяризации с последующим расслаблением гладкомышечных клеток [37]. В нашем исследовании мы применяли три блокатора К+-каналов: тетраэтиламмоний – неспецифический блокатор К+-каналов различного типа, TRAM-34 – селективный блокатор Са2+-чувствительных К+-каналов промежуточной проводимости и апамин – селективный блокатор Са2+-чувствительных К+-каналов малой проводимости. Применение каждого из указанных блокаторов не приводило к значимым изменениям амплитуды AХ-индуцируемой релаксации сегментов аорты NS- и HS-крыс, что позволяет сделать заключение об отсутствии или крайне слабой эффективности EDHF-опосредованного механизма релаксации в этих сосудах.
В ВБА NS-крыс все три блокатора приводили к уменьшению амплитуды AХ-индуцируемой релаксации. Максимальный эффект оказывала комбинация блокаторов TRAM-34 + апамин. Наиболее интересными оказались данные, полученные при исследовании сегментов сосудов HS-крыс. В ВБА HS-крыс ингибирующий эффект каждого из применяемых нами блокаторов К+-каналов был выражен значительно сильнее по сравнению с сосудами NS-крыс. Достоверное уменьшение релаксации сегментов ВБА HS-крыс, вызываемой AХ, наблюдалось при применении каждого из блокаторов, максимальный ингибирующий эффект также выявлялся при применении комбинации блокаторов TRAM-34 + апамин. Данные, полученные в этой серии экспериментов, позволяют сделать вывод о наличии в эндотелии ВБА крыс Са2+-чувствительных К+-каналов промежуточной и малой проводимости. Другими словами, в этих сосудах достаточно эффективно функционирует EDHF-опосредованный механизм вазодилатации. Традиционно считается, что EDHF-опосредованный механизм вазодилатации эффективно работает лишь в мелких артериях и артериолах [38], более того, имеются данные, что его эффективность в этих сосудах даже более значима, чем NO-опосредованный механизм [39]. В нескольких работах также было показано участие Са2+-чувствительных К+-каналов промежуточной и малой проводимости в агонист-индуцируемой вазорелаксации ВБА крыс [40, 41]. В нашем исследовании получены данные, не только доказывающие наличие Са2+-чувствительных К+-каналов промежуточной и малой проводимости в ВБА крыс, но и существенное возрастание их роли в процессах релаксации ВБА у крыс, содержавшихся на высокосолевой диете.
В последнее десятилетие при исследовании механизмов вазодилатации большое внимание уделяется третьему газотрансмиттеру – H2S [42]. Мы провели серию экспериментов с целью определения возможной роли H2S в AХ-индуцируемой релаксации аорты и ВБА крыс. Известно, что в стенке различных артерий обнаружены разные H2S-продуцирующие ферменты, в т.ч. цистатионин-γ-лиаза (CSE), цистотионин-β-синтаза и 3-меркаптопируватсульфуртрансфераза. В связи с тем, что CSE присутствует в стенке большинства изученных сосудов [23, 24], в наших опытах в качестве ингибитора синтеза H2S мы использовали пропаргилглицин (PPG), добавляя его в раствор, уже содержащий ингибиторы NO-синтазы и циклооксигеназы. Добавление PPG приводило к ослаблению релаксации ВБА NS-крыс. В сегментах ВБА HS-крыс уменьшение амплитуды релаксации было значительно большим по сравнению с ВБА NS-крыс. На релаксацию сегментов аорты NS- и HS-крыс PPG оказывал слабое влияние. Сопоставляя полученные данные с результатами применения блокаторов Са2+-чувствительных К+-каналов (амплитуда ослабления релаксации, ее увеличение у HS-крыс), мы полагаем, что в ВБА крыс Вистар в качестве EDHF (или одного из EDHF) выступает H2S.
Результаты этого исследования демонстрируют, что длительная высокосолевая диета приводит у крыс к ограничению способности ВБА расслабляться, а также к изменениям реакций артерий на вазодилататоры. Высокосолевая диета вызывает ослабление AХ-индуцированной NO-опосредованной релаксации аорты и ВБА крыс, в наибольшей степени это выражено в аорте (рис. 2). В ВБА диета с высоким содержанием соли, ограничивая продукцию эндотелием NO, приводит к возрастанию эффективности EDHF-опосредованного механизма релаксации. По-видимому, подобные изменения эндотелий-зависимой вазодилатации в ВБА крыс являются типичными в артериях мышечного типа при разных видах сосудистой патологии. Хорошо известно, что при патологических состояниях, приводящих к нарушению функции сосудов и сопровождающихся дефицитом NO, компенсаторно возрастает роль EDHF-опосредованного механизма вазодилатации [18, 43]. Результаты данного исследования также показывают, что в ВБА крыс функцию EDHF выполняет H2S, производство которого возрастает при длительном содержании животных на высокосолевой диете.
Список литературы
Elijovich F., Weinberger M.H., Anderson C.A., Appel L.J., Bursztyn M., Cook N.R., Dart R.A., Newton-Cheh C.H., Sacks F.M., Laffer C.L. Salt sensitivity of blood pressure: A scientific statement from the American Heart Association. American Heart Association Professional and Public Education Committee of the Council on Hypertension; Council on Functional Genomics and Translational Biology; and Stroke Council. Hypertension. 68(3): e7–e46. 2016.https://doi.org/10.1161/HYP.0000000000000047
Swenson S.J., Speth R.C., Porter J.P. Effect of a perinatal high-salt diet on blood pressure control mechanisms in young Sprague-Dawley rats. Am. J. Physiol. Regul. Integr. Compar. Physiol. 286(4): R764-70. 2004.https://doi.org/10.1152/ajpregu.00492.2003
Bagrov A.Y., Agalakova N.I., Kashkin V.A., Fedorova O.V. Endogenous cardiotonic steroids and differential patterns of sodium pump inhibition in NaCl-loaded salt-sensitive and normotensive rats. Am. J. Hypertens. 22: 559–563. 2009.
Rust P., Ekmekcioglu C. Impact of Salt Intake on the Pathogenesis and Treatment of Hypertension. Adv. Exp. Med. Biol. 956: 61–84. 2017.https://doi.org/10.1007/5584_2016_147
Marketou M.E., Maragkoudakis S., Anastasiou I., Nakou H., Plataki M., Vardas P.E., Parthenakis F.I. Salt-induced effects on microvascular function: A critical factor in hypertension mediated organ damage. J. Clin. Hypertens. 21: 749–757. 2019.https://doi.org/10.1111/jch.13535
Strazzullo P., D’Elia L., Kandala N.B., Cappuccio F.P. Salt intake, stroke, and cardiovascular disease: meta-analysis of prospective studies. Br. Med. J. 24. 339: b4567. 2009. https://doi.org/10.1136/bmj.b4567
Barić L., Drenjančević I., Matić A., Stupin M., Kolar L., Mihaljević Z., Lenasi H., Šerić V., Stupin A. Seven-Day Salt Loading Impairs Microvascular Endothelium-Dependent Vasodilation without Changes in Blood Pressure, Body Composition and Fluid Status in Healthy Young Humans. Kidney Blood Press Res. 44(4): 835–847. 2019.https://doi.org/10.1159/000501747
Gates P.E., Tanaka H., Hiatt W.R., Seals D.R. Dietary sodium restriction rapidly improves large elastic artery compliance in older adults with systolic hypertension. Hypertension.44: 35–41 2004.
Bagrov A.Y., Lakatta E.G. The dietary sodium-blood pressure plot “stiffens”. Hypertension. 44: 22–24. 2004.
Zieman S.J., Melenovsky V., Kass D.A. Mechanisms, pathophysiology, and therapy of arterial stiffness. Arteriosclerosis, Thrombosis and Vasc. Biol. 25: 932–943. 2005.
Johnson C.P., Baugh R., Wilson C.F., Burns J. Age related changes in the tunica media of the vertebral artery: implications for the assessment of vessels injured by trauma. J. Clin. Pathol. 54: 139–145. 2001.
Vanhoutte P.M., Shimokawa H., Feletou M., Tang E.H. Endothelial dysfunction and vascular disease—a 30th anniversary update. Acta Physiol. 219: 22–96. 2017.
Zhao Y., Vanhoutte P.M., Leung S.W. Vascular nitric oxide: beyond eNOS. J. Pharmacol. Sci. 129: 83–94. 2015.
Ravarotto V., Simioni F., Pagnin E., Davis P.A., Calo L.A. Oxidative stress–chronic kidney disease–cardiovascular disease: a vicious circle. Life Sci. 210: 125–131. 2018. https://doi.org/10.1016/j.lfs.2018.08.067
Nurkiewicz T.R., Boegehold M.A.High salt intake reduces endothelium-dependent dilation of mouse arterioles via superoxide anion generated from nitric oxide synthase. Am. J. Physiol. Regul. Integr. Compar. Physiol. 292(4): R1550-R1556. 2007.https://doi.org/10.1152/ajpregu.00703.2006
Zhu J., Huang T., Lombard J.H. Effect of high-salt diet on vascular relaxation and oxidative stress in mesenteric resistance arteries. J. Vasc. Res. 44(5): 382-390. 2007.https://doi.org/10.1159/000102955
Lenda D.M., Sauls B.A., Boegehold M.A. Reactive oxygen species may contribute to reduced endothelium-dependent dilation in rats fed high salt. Am. J. Physiol. 279: H7–H14. 2000.
Feletou M., Vanhoutte P.M. EDHF: an update. Clin. Sci. (Lond). 117: 139–155. 2009.https://doi.org/10.1042/CS20090096
Kanagy N.L., Szabo C., Papapetropoulos A. Vascular biology of hydrogen sulfide. Am. J. Physiol. Cell. Physiol. 312(5): C537-C549. 2017.https://doi.org/10.1152/ajpcell.00329.2016
Nyborg N.C., Baandrup U., Mikkelsen E.O., Mulvany M.J. Active, passive and myogenic characteristics of isolated rat intramural coronary resistance arteries. Pflugers Ugers Arch. 410: 664–670. 1987.
Garland C.J., Dora K.A. EDH: endothelium-dependent hyperpolarization and microvascular signaling. Acta Physiol. (Oxf). 219(1): 152–161. 2017.https://doi.org/10.1111/apha.12649
Wagner F., Asfar P., Calzia E., Radermacher P., Szabó C. Bench-to-bedside review: Hydrogen sulfide—the third gaseous transmitter: applications for critical care. Crit. Care. 13(3): 213. 2009.https://doi.org/10.1186/cc7700
Polhemus D.J., Lefer D.J. Emergence of hydrogen sulfide as an endogenous gaseous signaling molecule in cardiovascular disease. Circ. Res. 114: 730–737. 2014.
Kolluru G.K., Bir S.C., Yuan S., Shen X., Pardue S., Wang R., Kevil C.G. Cystathionine γ-lyase regulates arteriogenesis through NO-dependent monocyte recruitment. Cardiovasc. Res. 107(4): 590–600. 2015. https://doi.org/10.1093/cvr/cvv198
Tuomilehto J., Jousilahti P., Rastenyte D., Moltchanov V., Tanskanen A., Pietinen P., Nissinen A. Urinary sodium excretion and cardiovascular mortality in Finland: a prospective study. Lancet. 357: 848–851. 2001.
Takase H., Sugiura T., Kimura G., Ohte N., Dohi Y. Dietary Sodium Consumption Predicts Future Blood Pressure and Incident Hypertension in the Japanese Normotensive General Population. J. Am. Heart Assoc. 29. 4(8): e001959. 2015. https://doi.org/10.1161/JAHA.115.001959
Boegehold M.A. The effect of high salt intake on endothelial function: reduced vascular nitric oxide in the absence of hypertension. J. Vasc. Res. 50: 458–467. 2013. https://doi.org/10.1159/000355270
Cavka A., Jukic I., Ali M., Goslawski M., Bian J.T., Wang E., Drenjancevic I., Phillips S.A. Short-term high salt intake reduces brachial artery and microvascular function in the absence of changes in blood pressure. J. Hypertens. 34: 676–684. 2016. https://doi.org/10.1097/HJH.0000000000000852
Cordaillat M., Fort A., Virsolvy A., Elghozi J.L., Richard S., Jover B. Nitric oxide pathway counteracts enhanced contraction to membrane depolarization in aortic rings of rats on high-sodium diet. Am. J. Physiol. Regul. Integr. Compar. Physiol. 292(4): R1557–R1562. 2007.https://doi.org/10.1152/ajpregu.00624.2006
Allen L.A., Schmidt J.R., Thompson C.T., Carlson B.E., Beard D.A., Lombard J.H. High salt diet impairs cerebral blood flow regulation via salt-induced angiotensin II suppression. Microcirculation. 26(3): e12518. 2019. https://doi.org/10.1111/micc.12518
Liu Y., Rusch N.J., Lombard J.H. Loss of endothelium and receptor-mediated dilation in pial arterioles of rats fed a short-term high salt diet. Hypertension. 33(2): 686–688. 1999.https://doi.org/10.1161/01.hyp.33.2.686
Vanhoutte P.M., Shimokawa H., Feletou M., Tang E.H. Endothelial dysfunction and vascular disease – a 30th anniversary update. Acta Physiol. (Oxf). 219(1): 22–96. 2017. https://doi.org/10.1111/apha.12646
Persichini T., Cantoni O., Suzuki H., Colasanti M. Cross-talk between constitutive and inducible NO synthase: an update. Antioxid. Redox Signal. 8(5–6): 949–954. 2006.https://doi.org/10.1089/ars.2006.8.949
Cavka A., Cosic A., Jukic I., Jelakovic B., Lombard J.H., Phillips S.A., Seric V., Mihaljevic I., Drenjancevic I. The role of cyclo-oxygenase-1 in high-salt diet-induced microvascular dysfunction in humans. J. Physiol. 593(24): 5313–5324. 2015. https://doi.org/10.1113/JP271631
Kido M., Ando K., Onozato M.L., Tojo A., Yoshikawa M., Ogita. T, Fujita T. Protective effect of dietary potassium against vascular injury in salt-sensitive hypertension. Hypertension. 51(2): 225–31. 2008.https://doi.org/10.1161/HYPERTENSIONAHA.107.098251
Félétou M., Vanhoutte P.M. EDHF: an update. Clin. Sci. (Lond). 117(4): 139–155. 2009. https://doi.org/10.1042/CS20090096
Félétou M. Endothelium-Dependent Hyperpolarization and Endothelial Dysfunction. J. Cardiovasc. Pharmacol. 67(5): 73–87. 2016.https://doi.org/10.1097/FJC.0000000000000346
Garland C.J., Dora K.A. EDH: endothelium-dependent hyperpolarization and microvascular signalling. Acta Physiol. (Oxf). 219(1): 152–161. 2017. https://doi.org/10.1111/apha.12649
Coleman H.A., Tare M., Parkington H.C. Nonlinear effects of potassium channel blockers on endothelium-dependent hyperpolarization Acta Physiol. (Oxf). 219(1): 324–334. 2017.https://doi.org/10.1111/apha.12805
Ando M., Matsumoto T., Kobayashi S., Iguchi M., Taguchi K., Kobayashi T. Differential participation of calcium-activated potassium channel in endothelium-dependent hyperpolarization-type relaxation in superior mesenteric arteries of spontaneously hypertensive rats. Can. J. Physiol. Pharmacol. 96(8): 839–844. 2018.https://doi.org/10.1139/cjpp-2017-0557
Stankevicius E., Lopez-Valverde V., Rivera L., Hughes A.D., Mulvany M.J., Simonsen U.F. Combination of Ca2+ -activated K+ channel blockers inhibits acetylcholine-evoked nitric oxide release in rat superior mesenteric artery. Br. J. Pharmacol. 149(5): 560–572. 2006. https://doi.org/10.1038/sj.bjp.0706886
Cirino G., Vellecco V., Bucci M. Nitric oxide and hydrogen sulfide: the gasotransmitter paradigm of the vascular system. Br. J. Pharmacol. 174(22): 4021–4031. 2017. https://doi.org/10.1111/bph.13815
Bellien J., Thuillez C., Joannides R. Contribution of endothelium-derived hyperpolarizing factors to the regulation of vascular tone in humans. Fundam. Clin. Pharmacol. 22(4): 363–377. 2008.https://doi.org/10.1111/j.1472-8206.2008.00610.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


