Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 55-69
ИЭМ-1925, каналоблокатор глутаматных рецепторов, увеличивает латентный период и сокращает продолжительность эпилептического статуса у крыс в литий-пилокарпиновой модели эпилепсии
С. И. Ватаев 1, *, Н. Я. Лукомская 1, Л. Г. Магазаник 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: son-vat@yandex.ru
Поступила в редакцию 02.06.2020
После доработки 16.10.2020
Принята к публикации 19.10.2020
Аннотация
В хронических опытах на крысах Вистар и крысах Крушинского–Молодкиной с наследственной предрасположенностью к аудиогенным судорогам изучали влияние на электрическую активность мозга при развитии вызванного пилокарпином эпилептического статуса (ЭС) антагонистa глутаматных рецепторов ИЭМ-1925, воздействующего как на NMDA-, так и Са2+-проницаемые AMPA/каинатные рецепторы. Регистрировали электрограммы хвостатого ядра, гиппокампа, соматосенсорной, зрительной и слуховой коры. Выявили, что последовательность смены фаз ЭС, определяемых по паттернам электрограмм, не меняется под действием данного блокатора. Вместе с тем ИЭМ-1925 ослаблял у крыс поведенческие моторные судорожные проявления при ЭС, снижая интенсивность судорог с 8 до 4 баллов по шкале Pinel, Rovner [1978]. Кроме того, у крыс Крушинского–Молодкиной латентный период до появления эпилептиформной активности на ЭЭГ после введения пилокарпина увеличивался на фоне действия ИЭМ-1925 в дозе 10 мг/кг на 40% (в среднем с 12.8 ± 1.1 до 18.0 ± 2.1 мин), а у крыс Вистар – почти в 2 раза (с 22.5 ± 0.2 до 43.5 ± 3.7 мин). Средняя продолжительность ЭС при действии ИЭМ-1925 в дозе 10 мг/кг у крыс Крушинского–Молодкиной и Вистар была в 4.5–5 раз меньше, чем без применения блокатора. Полученные данные свидетельствуют о том, что сочетанная блокада NMDA- и Са2+-проницаемых AMPA/каинатных рецепторов глутамата хотя и не способна предотвратить развитие ЭС, вызванного пилокарпином, однако увеличивает латентный период начала статуса и существенно сокращает длительность как отдельных фаз, так и общую продолжительность ЭС.
Глутамат является основным возбуждающим медиатором в ЦНС [1–3]. Его действие реализуется посредством ионотропных рецепторов трех семейств, названных по их основному агонисту: NMDA (N-метил-D-аспартат), AMPA (альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота) и каинатные рецепторы [1, 4]. При развитии ряда патологических процессов в мозге, в частности, судорожных синдромов, глутамат играет роль нейротоксического агента [1, 2]. Способность блокаторов ионотропных глутаматных рецепторов предупреждать или купировать на различных экспериментальных моделях эпилептиформные проявления используется для исследования этиологии и патогенеза судорожных состояний, а также служит основанием для поиска среди веществ этого класса новых противосудорожных лекарственных средств [1, 5–8]. В результате исследований было установлено, что у грызунов неконкурентные селективные блокаторы NMDA-рецепторов проявляют высокое защитное действие против аудиогенных [5, 8–11] и пентилентетразоловых судорог [5, 12, 13]. Антагонисты АМРА и АМРА/каинатных рецепторов также подавляют пентилентетразоловые судороги [14–16], но в отношении аудиогенных припадков получены противоречивые результаты: наблюдали как явно выраженный противосудорожный эффект [15–18], так и полное отсутствие влияний на генерализованные аудиогенные клонико-тонические судорожные реакции [11, 19]. Блокаторы NMDA-рецепторов уменьшают количество и продолжительность спонтанных эпилептиформных разрядов у крыс линии WAG/Rij с генетической предрасположенностью к эпилепсии с абсансами [5, 20]. В исследованиях с использованием литий-пилокарпиновой модели эпилепсии у грызунов было выявлено, что блокатор NMDA-рецепторов дизоцилпин (МК-801) практически не устраняет пароксизмальную активность, но снижает интенсивность поведенческих судорожных реакций и уменьшает продолжительность эпилептического статуса (ЭС) [21–24]. Аналогичные данные были получены нами при изучении действия избирательных антагонистов NMDA-рецепторов мемантина и ИЭМ-1921 на электрическую активность мозга при развитии ЭС в литий-пилокарпиновой модели эпилепсии у различающихся по уровню судорожной готовности крыс Вистар и Крушинского–Молодкиной [25]. Сведения о влиянии антагонистов АМРА-рецепторов на судорожные состояния, вызванные в разных экспериментальных моделях, противоречивы [26, 27]. В последнее время появились обнадеживающие свидетельства способности неконкурентного антагониста АМРА-рецепторов перампанела ослаблять ЭС не только в экспериментальных моделях, в том числе и в пилокарпиновой [28, 29], но и в клинических исследованиях [30].
Целью настоящей работы было исследование влияния синтезированного в Институте экспериментальной медицины РАМН и подробно исследованного в Институте эволюционной физиологии и биохимии им. И.М. Сеченова РАН препарата ИЭМ-1925 [12, 31–34], неконкурентного блокатора активированных глутаматом открытых ионных как NMDA-, так и Са2+-проницаемых AMPA/каинатных рецепторов на проявления судорожной симптоматики и электрическую активность мозга при развитии вызванного пилокарпином ЭС от его начала до завершения.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполняли на крысах (самцы, масса 240–350 г) Вистар, полученных из питомника “Рапполово”, и Крушинского–Молодкиной из аутбредной популяции, содержащейся в виварии Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Предварительно животных проверяли на способность реагировать судорожными реакциями на звуковой стимул (синусоидальный тон частотой 8 кГц, интенсивность 90 дБ). Из популяции крыс Крушинского–Молодкиной отбирали наиболее возбудимых животных, реагировавших на звук полными генерализованными клонико-тоническими судорожными припадками, а из крыс Вистар – животных, нечувствительных к действию данного стимула.
Отобранным крысам под золетиловым (Zoletil 100; Vibrac, Франция) наркозом (70 мг/кг, в/м) вживляли по стереотаксическим координатам [35] электроды для хронической регистрации электрической активности хвостатого ядра, гиппокампа, соматосенсорной, слуховой и зрительной областей коры мозга. Координаты и методика имплантации электродов подробно описаны в нашей предыдущей работе [36]. Все оперативные вмешательства и последующие эксперименты выполняли в соответствии с Протоколом обращения с лабораторными животными Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, согласующегося с директивой Европарламента 2010/63/ЕС от 22.09.2010 г.
После операции каждую из крыс размещали в индивидуальной камере, снабженной электродинамическим датчиком для регистрации актограммы. Камеру помещали в объемный бокс, который обеспечивал электро-, свето- и звукоизоляцию от внешних источников. Животных содержали в условиях 12-часового цикла свет/темнота (свет с 09.00 до 21.00) при свободном доступе к пище и воде и адаптировали в течение 5–7 сут к условиям эксперимента, подключая ежедневно посредством легкого отводящего кабеля к компьютерному электроэнцефалографу.
По окончании периода адаптации крысам вводили в/м хлорид лития (127 мг/кг, Sigma-Aldrich). Спустя сутки животных подключали к электроэнцефалографу и помещали в камеру, давая крысам успокоиться. С помощью веб-камеры вели наблюдение и видеозапись поведения животных и одновременно осуществляли монополярную регистрацию в полосе 1–30 Гц электрограмм указанных структур мозга и актограммы с вводом данных при частоте дискретизации процессов 185 Гц. Через 1 ч крысам вводили в/м в дозах 5 или 10 мг/кг ИЭМ-1925 (ИЭМ РАМН) – блокатор глутамата смешанного типа, воздействующий как на NMDA-, так и Са2+-проницаемые AMPA/каинатные рецепторы, а также метилскополамин (1 мг/кг, Sigma), ингибирующий периферические мускариновые рецепторы. Еще через 1 ч животным вводили в/м раствор пилокарпина (Sigma): крысам Крушинского–Молодкиной в дозе 20 мг/кг, а крысам Вистар – 30 мг/кг. Непрерывная полиграфическая запись поведения, ЭЭГ и актограммы в ходе возникновения и развития ЭС позволяла проследить в течение 6–12 ч последовательную динамику проявлений поведенческой моторной судорожной активности и трансформации паттернов электрограмм структур мозга, а также выявить электрографические феномены, сопутствующие тем или иным видам судорог. Тип и интенсивность судорожных проявлений определяли, как описано ранее [25, 36], в баллах, используя классификацию Pinel и Rovner [37].
Эксперименты были выполнены на 29 животных. В исследованиях по влиянию ИЭМ-1925 в дозе 5 мг/кг на вызванные пилокарпином эпилептиформные реакции было использовано 4 крысы Вистар и 4 Крушинского–Молодкиной, а по влиянию ИЭМ-1925 в дозе 10 мг/кг – 10 крыс Вистар и 11 Крушинского–Молодкиной.
Для оценки достоверности различий при статистической обработке экспериментальных данных использовали t-критерий Стьюдента. Данные представлены в виде средних значений ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общая картина вызванного пилокарпином ЭС и последовательных трансформаций паттернов электрограмм в структурах мозга животных в процессе его развития от начала до завершения была подробно прослежена в нашем предыдущем исследовании [36]. Наблюдалась последовательная смена паттернов ЭЭГ, на основе которых можно было выделить шесть фаз ЭС: нормальная базовая ЭЭГ-активность (фаза 0), спорадические пароксизмальные проявления (фаза 1), ритмические пароксизмальные (иктальные) разряды переменной амплитуды и частоты следования (фаза 2), непрерывная ритмическая высокочастотная и высокоамплитудная пароксизмальная активность (фаза 3), высокочастотная пароксизмальная активность с периодическими высоковольтными эпилептиформными разрядами (фаза 4), периодические высоковольтные эпилептиформные разряды на фоне низкоамплитудной базовой электрической активности мозга (фаза 5). Введение 5 или 10 мг/кг ИЭМ-1925 за 2 ч до пилокарпина не изменяло общей картины ЭС. Однако под влиянием ИЭМ-1925 существенно изменялись латентные периоды возникновения и продолжительность отдельных фаз, а также сокращалась общая длительность статуса (табл. 1 и 2).
Таблица 1.
Латентные периоды (ЛП) начала фаз эпилептического статуса (ЭС) у крыс в литий-пилокарпиновой модели эпилепсии при действии только пилокарпина (контроль) и на фоне влияния антагонистов глутамата Table 1. Latent periods (LP) of phases of status epilepticus (SE) in rats in the lithium–pilocarpine model of epilepsy in controls and on the background of glutamate antagonists
| Эксперимент Experiment | Линия крыс Rat strain |
Средние значения ЛП фаз ЭС, мин Mean LP for SE phases, min |
||||
|---|---|---|---|---|---|---|
| фаза 1 phase 1 | фаза 2 phase 2 | фаза 3 phase 3 | фаза 4 phase 4 | фаза 5 phase 5 | ||
| Пилокарпин [36] Pilocarpine [36] | В W (n = 7) |
22.5 ± 0.7 | 32 ± 3 | 46 ± 3 | 84 ± 9 | 198 ± 17 |
| КМ (n = 7) |
12.8 ± 1.1 | 21 ± 2 | 35 ± 3 | 64 ± 9 | 184 ± 16 | |
| Мемантин + пилокарпин [25] Memantine + pilocarpine [25] |
В W (n = 7) |
14.3 ± 1.1* | 24 ± 3 | 41 ± 4 | 74 ± 10 | 221 ± 17 |
| КМ (n = 5) |
12.4 ± 1.6 | 21 ± 3 | 33 ± 4 | 61 ± 9 | 170 ± 13 | |
| ИЭМ-1921 + пилокарпин [25] IEM-1921 + pilocarpine [25] |
В W (n = 8) |
10.8 ± 1.1* | 25 ± 4 | 40 ± 6 | 83 ± 10 | 158 ± 16 |
| КМ (n = 5) |
13.4 ± 1.4 | 24 ± 3 | 40 ± 4 | 77 ± 10 | 172 ± 18 | |
| ИЭМ-1925 (5 мг/кг) + пилокарпин IEM-1925 (5 mg/kg) + pilocarpine |
В W (n = 4) |
20.5 ± 0.3 | 31 ± 5 | 45 ± 5 | 88 ± 15 | 207 ± 8 |
| КМ (n = 4) |
11.5 ± 1.0 | 22 ± 3 | 35 ± 6 | 58 ± 9 | 167 ± 6 | |
| ИЭМ-1925 (10 мг/кг) + пилокарпин IEM-1925 (10 mg/kg) + pilocarpine |
В W (n = 10) |
43.5 ± 3.7* | 51 ± 4* | 67 ± 6* | 91 ± 8 | 172 ± 15 |
| КМ (n = 11) |
18.0 ± 2.1* | 31 ± 3* | 50 ± 5* | 80 ± 7* | 145 ± 13 | |
* – достоверность отличий средних значений, полученных при изучении развития ЭС в отсутствие влияний антагонистов глутамата и на фоне их действия у крыс Вистар (В) и Крушинского–Молодкиной (КМ), p < 0.05. Представленные в таблице данные по действию только пилокарпина, а также по его действию на фоне влияния мемантина или ИЭМ-1921 получены в наших предыдущих исследованиях [36] и [25]. * – significant differences in mean values obtained in studies of the development of SE in the absence of the effects of glutamate antagonists and after administration of drugs to Wistar (W) and Krushinsky–Molodkina (KM) rats, p < 0.05. The data presented in the table on the action of pilocarpine alone, as well as on its action against the background of the effect of memantine or IEM-1921, were obtained in our previous studies [36] and [25].
Таблица 2.
Длительности отдельных фаз и общая продолжительность ЭС у крыс в литий-пилокарпиновой модели эпилепсии при действии только пилокарпина (контроль) и на фоне влияния антагонистов глутамата Table 2. Durations of individual phases and total duration of SE in rats in the lithium–pilocarpine model of epilepsy in controls and after administration of glutamate antagonists
| Эксперимент Experiment | Линия крыс Rat strain |
Средняя длительность фаз ЭС, мин Mean duration of SE phases, min |
Средняя длительность ЭС, ч Mean duration of SE, h |
|||||
|---|---|---|---|---|---|---|---|---|
| фаза 1 phase 1 | фаза 2 phase 2 | фаза 3 phase 3 | фаза 4 phase 4 | фаза 5 phase 5 | фаза 1 phase 1 | |||
| Пилокарпин [36] Pilocarpine [36] |
В W (n = 7) |
23 ± 1 | 10 ± 3 | 14 ± 2 | 38 ± 9 | 114 ± 11 | 986 ± 80 | 19.4 ± 1.3 |
| КМ (n = 7) |
13 ± 2 | 9 ± 2 | 14 ± 2 | 28 ± 8 | 120 ± 15 | 989 ± 98 | 19.5 ± 1.6 | |
| Мемантин + пилокарпин [25] Memantine + pilocarpine [25] |
В W (n = 7) |
14 ± 2 | 10 ± 4 | 17 ± 4 | 33 ± 10 | 147 ± 23 | 424 ± 72* | 10.5 ± 1.2* |
| КМ (n = 5) |
12 ± 2 | 8 ± 3 | 12 ± 4 | 28 ± 9 | 109 ± 15 | 342 ± 40* | 8.0 ± 0.7* | |
| ИЭМ-1921 + пилокарпин [25] IEM-1921 + pilocarpine [25] |
В W (n = 8) |
11 ± 2 | 14 ± 4 | 15 ± 4 | 44 ± 10 | 75 ± 16* | 128 ± 26* | 4.6 ± 0.4* |
| КМ (n = 5) |
13 ± 2 | 11 ± 2 | 15 ± 3 | 37 ± 10 | 96 ± 18 | 144 ± 26* | 5.0 ± 0.4* | |
| ИЭМ-1925 (5 мг/кг) + пилокарпин IEM-1925 (5 mg/kg) + pilocarpine |
В W (n = 4) |
20 ± 1 | 12 ± 3 | 14 ± 2 | 44 ± 4 | 120 ± 22 | 657 ± 30* | 14.3 ± 0.5* |
| КМ (n = 4) |
12 ± 1 | 8 ± 2 | 13 ± 4 | 24 ± 7 | 97 ± 13 | 181 ± 27* | 5.4 ± 0.8* | |
| ИЭМ-1925 (10 мг/кг) + пилокарпин IEM-1925 (10 mg/kg) + pilocarpine |
В W (n = 10) |
43 ± 4* | 8 ± 2 | 15 ± 4 | 24 ± 5 | 81 ± 14* | 96 ± 21* | 3.8 ± 0.5* |
| КМ (n = 11) |
18 ± 2* | 13 ± 3 | 19 ± 4 | 30 ± 6 | 64 ± 8* | 132 ± 29* | 4.3 ± 0.6* | |
* – достоверность отличий средних значений, полученных при изучении развития ЭС в отсутствие влияний антагонистов глутамата и на фоне их действия у крыс Вистар (В) и Крушинского–Молодкиной (КМ), p < 0.05. Представленные в таблице данные по действию только пилокарпина, а также по его действию на фоне влияния мемантина или ИЭМ-1921 получены в наших предыдущих исследованиях [36] и [25]. * – significant differences in mean values obtained in studies of the development of SE in the absence of the effects of glutamate antagonists and after administration of drugs to Wistar (W) and Krushinsky–Molodkina (KM) rats, p < 0.05. The data presented in the table on the action of pilocarpine alone, as well as on its action against the background of the effect of memantine or IEM-1921, were obtained in our previous studies [36] and [25].
Был проведен количественный анализ динамики изменений паттернов ЭЭГ и проявлений судорожной симптоматики в ходе формирования и развития вызванного пилокарпином эпилептического статуса у крыс, которым предварительно вводили ИЭМ-1925. Непосредственно после введения пилокарпина все крысы пребывали на протяжении от 10 до 50 мин в состоянии возбуждения без явно выраженных пароксизмальных проявлений на ЭЭГ (фаза 0). Паттерны электрограмм исследованных структур мозга животных в это время характеризовались доминированием в спектрах ЭЭГ колебаний тета-диапазона (рис. 1А) и соответствовали паттернам ЭЭГ активного бодрствования крыс в нормальных условиях при отсутствии влияний фармакологических агентов. В указанный период у крыс наблюдались лишь минимальные моторные судорожные проявления интенсивностью 1–2 балла по шкале Pinel и Rovner [37] в форме жевательных автоматизмов, подергиваний вибрисс и ушей, раскачивания головы в вертикальной плоскости. Эти двигательные акты еще не находили отражения в виде изменений ЭЭГ.
Рис. 1.
Паттерны электрограмм хвостатого ядра (1) соматосенсорной (2), зрительной (3) и слуховой (4) коры, гиппокампа (5), и актограммы (6) у крысы линии Крушинского–Молодкиной в фазах 0 (А), 1 (B) и 2 (C) вызванного пилокарпином на фоне действия ИЭМ-1925 эпилептического статуса. Калибровка: 100 мкВ; 2 с. Fig. 1. Electrogram patterns of the caudate nucleus (1), the somatosensory (2), visual (3) and auditory areas of the cortex (4), the hippocampus (5) and the actogram (6) in Krushinsky–Molodkina rat in phases 0 (A), 1 (B), and 2 (C) of pilocarpine-induced status epilepticus on the background of exposure to IEM-1925. Calibration: 100 мV, 2 s.
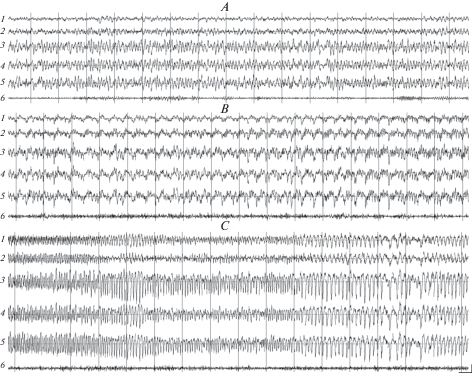
Спорадические эпилептиформные проявления на ЭЭГ в виде низкоамплитудных (около 100 мкВ) одиночных или сгруппированных острых волн и пик-волновых разрядов (рис. 1B), свидетельствующие о начале фазы 1 статуса, возникали у крыс Крушинского–Молодкиной на фоне влияния ИЭМ-1925 в дозе 5 мг/кг в среднем через 11.5 ± 1.0 мин, а при действии этого антагониста в дозе 10 мг/кг – через 18.0 ± 2.1 мин, что было примерно на 40% больше, чем временной интервал (12.8 ± 1.1 мин) до начала фазы 1 после введения пилокарпина без применения ИЭМ-1925 (табл. 1). У крыс Вистар на фоне влияния ИЭМ-1925 латентный период возникновения фазы 1 составлял при действии антагониста в дозе 5 мг/кг 20.5 ± 0.3 мин, а при действии в дозе 10 мг/кг – 43.5 ± 3.7 мин, т.е. был почти в 2 раза больше, чем временной интервал до появления эпилептиформной активности на ЭЭГ (22.5 ± 0.7 мин) в опытах, когда пилокарпин вводили в отсутствие данного блокатора (табл. 1).
Применение ИЭМ-1925 не влияло значимо на продолжительность фазы 1 у крыс обеих линий (табл. 2), а также на минимальные поведенческие судорожные проявления, которые ограничивались жевательными автоматизмами, клоническими сокращениями мышц морды и раскачиваниями головы в вертикальной плоскости. Интенсивность такого рода судорожных проявлений не превышала двух баллов.
Начало фазы 2 статуса характеризовалось появлением на ЭЭГ эпилептиформной активности типа множественных пиков и ритмических пароксизмальных комплексов, состоявших из чрезвычайно вариабельных по форме, амплитуде (от 100 до 500 мкВ) и частоте следования (от 1.5 до 15 Гц) острых пиков, острых волн и пик-волновых разрядов (рис. 1C). Иногда эпилептиформная активность прерывалась краткими эпизодами межприступного торможения. На поведенческом уровне у крыс в начале фазы 2 отмечалось усиление и учащение миоклонических подергиваний вибрисс и ушей, раскачиваний головы в вертикальной плоскости (интенсивность судорожных проявлений – 2 балла). Далее, на фоне появления на ЭЭГ высокоамплитудных пик-волновых разрядов, у животных возникала моторная активация в форме роющих движений, кратких эпизодов груминга, круговых пробежек. При этом отмечались клонические судороги в виде вздрагиваний всего тела и подергивания конечностей (интенсивность судорожных проявлений – 3 балла). Применение ИЭМ-1925 не влияло на продолжительность фазы 2 (табл. 2) и интенсивность судорожных проявлений по сравнению с опытами, в которых пилокарпин вводили в отсутствие блокатора.
При переходе в фазу 3 пароксизмальные комплексы на ЭЭГ сменялись непрерывной ритмической эпилептиформной активностью в виде высокоамплитудных (до 400 мкВ) спайкообразных пик-волновых разрядов, следующих с частотой от 1.5 до 6–10 Гц (рис. 2А). В начале фазы 3 у некоторых крыс на фоне появления высокоамплитудной эпилептиформной активности наблюдались краткие пробежки по камере, чередовавшиеся с продолжительными периодами покоя, когда животные застывали в одной позе, сидя с высоко поднятой мордой. Однако в большинстве случаев крысы как бы затаивались и лежали, припав ко дну камеры с вытянутой вперед мордой. Иногда у них возникали тонические спазмы мышц туловища с последующим переходом животных в вертикальные стойки, сопровождавшиеся быстрыми клоническими подергиваниями передних конечностей (поза “кенгуру”; интенсивность судорог – 4 балла). Стойки в позе “кенгуру” наблюдались у всех крыс, но количество этих стоек у разных животных варьировало от 1 до 10. Также варьировала от 20 с до 8 мин их продолжительность. Судорожных проявлений интенсивностью выше 4 баллов у крыс обеих линий в течение фазы 3 не отмечено. Длительности фазы 3 у крыс обеих линий как в условиях действия ИЭМ-1925, так и в отсутствие его влияний достоверно не различались (табл. 2).
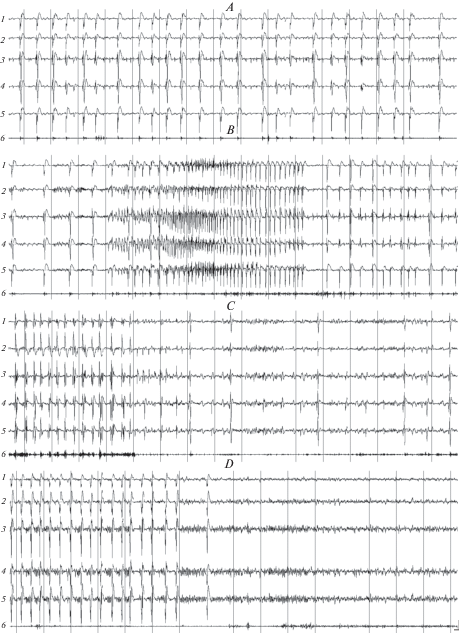
Рис. 2.
Паттерны электрограмм хвостатого ядра (1) соматосенсорной (2), зрительной (3) и слуховой (4) коры, гиппокампа (5), и актограммы (6) у крысы Вистар в начале фазы 3 вызванного пилокарпином на фоне действия ИЭМ-1925 эпилептического статуса (А) в конце фазы 3 на этапе перехода в фазу 4 (B), в середине фазы 4 (C) и в конце фазы на этапе перехода в фазу 5 (D). Калибровка: 100 мкВ; 1 с. Fig. 2. Electrogram patterns of the caudate nucleus (1), the somatosensory (2), visual (3) and auditory areas of the cortex (4), the hippocampus (5) and the actogram (6) in Wistar rat at the beginning of the development of phase 3 of pilocarpine-induced status epilepticus on the background of exposure to IEM-1925 (A), at the end of phase 3 at the stage of transition to phase 4 (B ), in the middle (C) and at the end of phase 4 at the stage of transition to phase 5 (D). Calibration: 100 мV, 1 s.

При переходе в фазу 4 наблюдалось появление на фоне высокочастотной пик-волновой пароксизмальной активности высокоамплитудных (до 500 мкВ) эпилептиформных разрядов (рис. 2B). В течение этой фазы уровень двигательной активности животных был очень низким. Как правило, крысы сидели или лежали на боку. При этом высокоамплитудные эпилептиформные разряды на ЭЭГ сопровождались интенсивными рывками тела и головы животного (интенсивность судорожных проявлений до трех баллов). В ходе развития фазы 4 отмечалось постепенное исчезновение на ЭЭГ высокочастотных острых волн и происходило формирование типичного для фазы 5 паттерна ритмических высокоамплитудных пик-волновых эпилептиформных разрядов на ЭЭГ (рис. 2C, 2D). Продолжительность фазы 4 на фоне влияния ИЭМ-1925 в дозе 5 мг/кг достоверно не отличалась от таковой в условиях, когда статус вызывался только пилокарпином. При действии же ИЭМ-1925 в дозе 10 мг/кг длительность фазы 4 сокращалась у крыс Вистар примерно на 40%, а у крыс Крушинского–Молодкиной – почти на 90% по сравнению с длительностью этой фазы при развитии статуса в отсутствие влияний блокатора (табл. 2).
Фаза 5 характеризовалась ритмическими высокоамплитудными пик-волновыми эпилептиформными разрядами на ЭЭГ на фоне очень низкой амплитуды основной базовой электрической активности мозга (рис. 3А). В течение этой фазы крысы сидели или лежали на боку. При этом эпилептиформные разряды на ЭЭГ сопровождались интенсивными рывками тела и головы животного (интенсивность судорожных проявлений до 3-х баллов). У некоторых крыс периодически возникали судорожные приступы в виде интенсивных конвульсий (рис. 3B). Как правило, эти приступы начинались с учащения пик-волновых разрядов на ЭЭГ. Слабые по силе судороги интенсивностью 3 балла проявлялись в виде тонического напряжения тела и конечностей крыс при явно выраженной ригидности хвоста. При более интенсивных судорогах силой 4 балла наблюдался тонический спазм мышц туловища и переход животных в вертикальную стойку, сопровождавшуюся клонусом передних конечностей (поза “кенгуру”). Стойки завершались на фоне последующего снижения частоты пик-волновых разрядов на ЭЭГ, но еще некоторое время у крыс отмечались клонические судорожные вздрагивания всего тела, четко проявлявшиеся на актограмме. Судорожных проявлений интенсивностью выше 4 баллов у крыс обеих линий не отмечено. На завершающем этапе фазы 5 наблюдалось снижение амплитуды и частоты пик-волновых эпилептиформных разрядов на ЭЭГ и постепенное восстановление амплитуды базовой электрической активности мозга крыс. Завершалась фаза 5 переходом от ритмической высокоамплитудной эпилептиформной активности к одиночным низкоамплитудным пик-волновым разрядам на ЭЭГ (рис. 3C) или резким, одномоментным полным исчезновением эпилептиформных ЭЭГ-проявлений (рис. 3D). На этом этапе поведение животных возвращалось к норме: они вставали, начинали перемещаться по камере, осуществлять груминг, прием пищи и воды. Паттерны электрограмм структур мозга крыс приходили в соответствие с паттернами нормального активного или спокойного бодрствования.
Рис. 3.
Паттерны электрограмм хвостатого ядра (1) соматосенсорной (2), зрительной (3) и слуховой (4) коры, гиппокампа (5), и актограммы (6) у крыс Крушинского–Молодкиной (А–C) и Вистар (D) в начале фазы 5 вызванного пилокарпином на фоне действия ИЭМ-1925 эпилептического статуса (А), в течение фазы 5 при возникновении у животного клонико-тонических судорог с переходом в вертикальную стойку в позе “кенгуру” (B) и в конце (C–D) фазы 5 при разных формах ее завершения. Калибровка: 100 мкВ; 1 с. Fig. 3. Electrogram patterns of the caudate nucleus (1) of the somatosensory (2), visual (3) and auditory (4) cortex, hippocampus (5), and actogram (6) in rats of Krushinsky–Molodkina (А–C) and Wistar (D) at the beginning of phase 5 of pilocarpine-induced status epilepticus on the background of exposure to IEM-1925 (А ), during phase 5 on occurrence of clonic-tonic convulsions with transfer to the “kangaroo” posture (B) and at the end (C–D) of phase 5 with different forms of its completion. Calibration: 100 мV, 1 s.
На фоне предварительного введения ИЭМ-1925 в дозе 5 мг/кг длительность фазы 5 (657 ± 30 мин) была у крыс Вистар на 50% меньше по сравнению с продолжительностью этой фазы (986 ± 80 мин) в условиях отсутствия влияний указанного антагониста, а у крыс Крушинского–Молодкиной она была в пять раз меньше (табл. 2). Длительность всего ЭС при действии ИЭМ-1925 в дозе 5 мг/кг сокращалась с 19 до 14.3 ± 0.5 и 5.4 ± 0.8 ч у крыс Вистар и Крушинского–Молодкиной соответственно. Еще более существенное воздействие оказывало введение ИЭМ-1925 в дозе 10 мг/кг. Средняя продолжительность фазы 5 уменьшалась у крыс Вистар более чем в 10 раз (до 96 ± 21 мин), а у Крушинского–Молодкиной - более чем в 7 раз (до 132 ± 29 мин), а общая продолжительность ЭС сокращалась в 5 (до 3.8 ± 0.5 ч) и 4.5 раза (до 4.3 ± 0.6 ч) соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о том, что ИЭМ-1925 – антагонист NMDA- и Са2+-проницаемых AMPA/каинатных рецепторов – не изменяет последовательность смены фаз ЭС, определяемых по паттернам электрограмм. Вместе с тем совместная блокада NMDA- и AMPA/каинатных рецепторов оказывает влияние на динамику возникновения, продолжительность отдельных фаз и общую длительность статуса. Так, на фоне действия ИЭМ-1925 в дозе 10 мг/кг латентные периоды первых пароксизмальных проявлений на ЭЭГ после инъекций пилокарпина увеличивались у крыс Крушинского–Молодкиной в среднем на 40%, а у крыс Вистар – почти в 2 раза по сравнению с латентным периодом начала ЭС у крыс, которым вводили только пилокарпин. Одним из возможных объяснений этих результатов может быть следующее. В литий-пилокарпиновой модели эпилепсии первичным звеном формирования очагов патологической пароксизмальной активности и возникновения эпилептиформных проявлений является холинергическая система мозга, активизация деятельности которой происходит под влиянием агониста М-холинорецепторов пилокарпина [7, 38, 39]. В качестве вторичного звена формирования ЭС выступает усиление активности возбуждающих глутаматергических нейронов стволового отдела мозга. Не исключено, что увеличение латентного периода до появления эпилептиформной активности на ЭЭГ после введения пилокарпина на фоне влияния ИЭМ-1925 является следствием блокады этим антагонистом именно AMPA-рецепторов, поскольку в проведенных нами ранее исследованиях с применением избирательных блокаторов только NMDA-рецепторов [25] было, наоборот, выявлено сокращение почти в 2 раза латентного периода начала ЭС у крыс Вистар при отсутствии эффекта у крыс Крушинского–Молодкиной (табл. 2). Тот факт, что у крыс Вистар период задержки начала ЭС на фоне влияния ИЭМ-1925 был существенно больше, чем у крыс Крушинского–Молодкиной, дает, на наш взгляд, основание предполагать более высокую долю вовлеченности AMPA/каинатных рецепторов в патологически измененную глутаматергическую синаптическую передачу в головном мозге крыс Вистар по сравнению с крысами Крушинского–Молодкиной.
Пролонгированное активирующее действие пилокарпина, поддерживающего высокий уровень глутаматергических возбуждающих влияний, создает условия для преодоления блокирующего эффекта ИЭМ-1925 и формирования в мозге после возникновения на ЭЭГ первых пароксизмальных проявлений генерализованной высокоамплитудной патологической эпилептиформной активности. В отсутствие влияния ИЭМ-1925 такого рода генерализация электрической активности мозга приводила к повышению двигательной активности животных и возникновению судорожных проявлений разной степени интенсивности – от одиночных клонических судорог до продолжительных генерализованных клонико-тонических конвульсивных припадков силой 8 баллов [36]. На фоне действия ИЭМ-1925, причем как в дозе 5, так и 10 мг/кг, у крыс наблюдалось снижение двигательной активности, затаивание и судорожные проявления интенсивностью не более 4-х баллов. Эти данные указывают на то, что ИЭМ-1925 может существенно ослаблять ЭС.
Предварительное введение крысам ИЭМ-1925 существенно уменьшало общую продолжительность ЭС. Наиболее выраженный эффект оказывало применение ИЭМ-1925 в дозе 10 мг/кг, приводившее к сокращению длительности ЭС в 5 раз у крыс Вистар и в 4.5 раза у крыс Крушинского–Молодкиной. Аналогичные данные (сокращение длительности ЭС от 2 до 4 раз) были получены нами ранее [25] при изучении влияния избирательных блокаторов NMDA-рецепторов мемантина и ИЭМ-1921 на развитие ЭС (табл. 2). Вполне вероятно, что сочетанная блокада NMDA- и AMPA/каинатных рецепторов глутамата может быть более эффективной для сокращения продолжительности ЭС у крыс в литий-пилокарпиновой модели эпилепсии.
Таким образом, ИЭМ-1925 – антагонист глутаматных рецепторов смешанного типа, воздействующий как на NMDA-, так и Са2+-проницаемые AMPA/каинатные рецепторы, не предотвращает развитие вызванного пилокарпином генерализованного ЭС и формирующуюся в процессе его развития эпилептиформную ЭЭГ-активность, но способен существенно уменьшить продолжительность ЭС. Это позволяет предполагать, что подобная сочетанная неконкурентная блокада глутаматных рецепторов NMDA- и AMPA-типов может быть использована при создании дополнительной линии противоэпилептических средств наряду с перампанелом, в особенности, когда проявляется фармакорезистентность к классическим средствам 1-ой (фенобарбитал, кармазепам, вальпроат) и 2-ой линий (диазепам, клоназепам).
Список литературы
Meldrum B.S. Glutamate as a neurotransmitter in the brain: review of physiology and pathology. J. Nutr. 130 (4S Suppl): 1007S–10015S. 2000.
Platt S.R. The role of glutamate in central nervous system health and disease – a review. Vet. J. 173 (2): 278–286. 2007.
Zhou Y., Danbolt N.C. Glutamate as a neurotransmitter in the healthy brain. J. Neural. Transm. (Vienna). 121(8): 799–817. 2014.
Traynelis S.F., Wollmuth L.P., McBain C.J., Menniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J., Dingledine R. Glutamate receptor ion channels: structure, regulation, and function. Pharmacol. Rev. 62(3): 405–496. 2010.
Parsons C.G., Danysz W., Quack G. Memantine is a clinically well tolerated N-methyl-D-aspartate (NMDA) receptor antagonist – a review of preclinical data. Neuropharmacology. 38(6): 735–767. 1999.
Rogawski M.A., Donevan S.D. AMPA receptors in epilepsy and as targets for antiepileptic drugs. Adv. Neurol. 79: 947–963. 1999.
Leite J.P., Garcia-Cairasco N., Cavalheiro E.A. New insights from the use of pilocarpine and kainate models. Epilepsy Res. 50(1–2): 93–103. 2002.
Faingold C.L. Emergent properties of CNS neuronal networks as targets for pharmacology: application to anticonvulsant drug action. Prog. Neurobiol. 72(1): 55–85. 2004.
Faingold C.L., Randall M.E., Naritoku D.K., Boersma Anderson C.A. Noncompetitive and competitive NMDA antagonists exert anticonvulsant effects by actions on different sites within the neuronal network for audiogenic seizures. Exp. Neurol. 119 (2): 198–204. 1993.
Ватаев С.И., Жабко Е.П., Лукомская Н.Я., Оганесян Г.А., Магазаник Л.Г. Влияние мемантина на судорожные реакции и организацию сна у крыс линии Крушинского–Молодкиной с наследственной предрасположенностью к аудиогенным судорогам. Рос. физиол. журн. им. И.М. Сеченова. 95(8): 802–812. 2009. [Vataev S.I., Zhabko E.P., Lukomskaya N.Y., Oganesyan G.A., Magazanik L.G. The effects of memantine on convulsive reactions and sleep–waking cicle in Krushinskii–Molodkina strain rats with an inherited predisposition to audiogenic convulsions. Russ. J. Physiol. 95(8): 802–812. 2009. (In Russ). Vataev S.I., Zhabko E.P., Lukomskaya N.Ya., Oganesyan G.A., Magazanik L.G. Effects of memantine on convulsive reactions and the organization of sleep in Krushinskii–Molodkina rats with an inherited predisposition to audiogenic convulsions. Neurosci. Behav. Physiol. 40(8): 913–919. 2010. (In Engl)].
Лукомская Н.Я., Ватаев С.И., Жабко Е.П., Магазаник Л.Г. Влияние блокаторов каналов ионотропных глутаматных рецепторов на аудиогенные судорожные реакции крыс линии Крушинского–Молодкиной. Рос. физиол. журн. им. И.М. Сеченова. 98(4): 449–460. 2012. [Lukomskaya N.Y., Vataev S.I., Zhabko E.P., Magazanik L.G. Effects of ionotropic glutamate receptor channel blockers on the development of audiogenic seizures in Krushinskii–Molodkina rats. Russ. J. Physiol. 98(4): 449–460. 2012. (In Russ). Lukomskaya N.Ya., Vataev S.I., Zhabko E.P., Magazanik L.G. Effects of ionotropic glutamate channel blockers on audiogenic seizure reactions in Krushinskii–Molodkina rats. Neurosci. Behav. Physiol. 44(1): 79–86. 2014. (In Engl)].
Лукомская Н.Я., Рукояткина Н.И., Горбунова Л.В., Гмиро Е.В., Магазаник Л.Г. Исследование роли NMDA и AMPA глутаматных рецепторов в механизме коразоловых судорог у мышей. Рос. физиол. журн. им. И.М. Сеченова. 89(3): 292–301. 2003. [Lukomskaya N.Y., Rukojatkina N.I., Gorbunova L.V., Gmiro V.E., Magazanik L.G. Study of NMDA and AMPA glutamate receptor involvement in the genesis of clonic and tonic convulsions induced by pentylenetetrazole in mice. Russ. J. Physiol. 89(3): 292–301. 2003. (In Russ)].
Ким К.Х., Зайцев А.В., Лаврентьева В.В., Жабко Е.П., Ватаев С.И., Лукомская Н.Я., Магазаник Л.Г. Влияние блокаторов ионотропных глутаматных рецепторов на вызванные пентилентетразолом судороги у крыс линии Крушинского–Молодкиной. Рос. физиол. журн. им. И.М. Сеченова. 98(12): 1520–1529. 2012. [Kim K.Kh., Zaitsev A.V. Lavrentieva V.V., Zhabko E.P., Vataev S.I., Lukomskaya N.Y., Magazanik L.G. The effect of ionotropic glutamate receptor antagonist on pentylenetetrazole-indused seizures in Krushinskii–Molodkina rats. Russ. J. Physiol. 98(12): 1520–1529. 2012. (In Russ). Kim K.Kh., Zaitsev A.V., Lavrent’eva V.V., Zhabko E.P., Vataev S.I., Lukomskaya N.Ya., Magazanik L.G. Effects of ionotropic glutamate receptor blockers on pentylenetetrazole-induced seizures in Krushinskii–Molodkina rats. Neurosci. Behav. Physiol. 44(8): 945–950. 2014. (In Engl)].
Yamaguchi S., Donevan S.D., Rogawski M.A. Anticonvulsant activity of AMPA/kainate antagonists: comparison of GYKI 52466 and NBOX in maximal electroshock and chemoconvulsant seizure models. Epilepsy Res. 15(3): 179–184. 1993.
De Sarro G., Ferreri G., Gareri P., Russo E., De Sarro A., Gitto R., Chimirri A. Comparative anticonvulsant activity of some 2,3-benzodiazepine derivatives in rodents. Pharmacol. Biochem. Behav. 74(3): 595–602. 2003.
Rogawski M.A. AMPA receptors as a molecular target in epilepsy therapy. Acta Neurol. Scand. Suppl. 197: 9–18. 2013.
Yasuda S., Ishida N., Higashiyama A., Morinobu S., Kato N. Characterization of audiogenic-like seizures in naive rats evoked by activation of AMPA and NMDA receptors in the inferior colliculus. Exp. Neurol. 164(2): 396–406. 2000.
Ferreri G., Chimirri A., Russo E., Gitto R., Gareri P., De Sarro A., De Sarro G. Comparative anticonvulsant activity of N-acetyl-1-aryl-6,7-dimethoxy-1,2,3,4-tetrahydroisoquinoline derivatives in rodents. Pharmacol. Biochem. Behav. 77(1): 85–94. 2004.
Higashiyama A., Ishida N., Nishimura T., Yasuda S., Kuroda Y., McEwen B.S., Kato N. NMDA receptors in the inferior colliculus are critically involved in audiogenic seizures in the adult rats with neonatal hypothyroidism. Exp. Neurol. 153(1): 94–101. 1998.
Filakovszky J., Kantor S., Halasz P., Bagdy G. 8-OH-DPAT and MK-801 affect epileptic activity independently of vigilance. Neurochem. Int. 38(7): 551–556. 2001.
Ormandy G.C., Jope R.S., Snead O.C. 3rd. Anticonvulsant actions of MK-801 on the lithium–pilocarpine model of status epilepticus in rats. Exp. Neurol. 106(2): 172–180. 1989.
Walton N.Y., Treiman D.M. Motor and electroencephalographic response of refractory experimental status epilepticus in rats to treatment with MK-801, diazepam, or MK-801 plus diazepam. Brain Res. 553(1): 97–104. 1991.
Starr M.S., Starr B.S. The new competitive NMDA receptor antagonist CGP 40116 inhibits pilocarpine-induced limbic motor seizures and unconditioned motor behaviour in the mouse. Pharmacol. Biochem. Behav. 47(1): 127–131. 1994.
Lee M.G., Chou J.Y., Lee K.H., Choi B.J., Kim S.K., Kim C.Y. MK-801 augments pilocarpine-induced electrographic seizure but protects against brain damage in rats. Prog. Neuropsychopharmacol. Biol. Psychiatry. 21(2): 331–344. 1997.
Ватаев С.И., Зайцев А.В., Лукомская Н.Я., Магазаник Л.Г. Каналоблокаторы NMDA-рецепторов мемантин и ИЭМ-1921 сокращают продолжительность эпилептического статуса у крыс Вистар и Крушинского–Молодкиной в литий–пилокарпиновой модели. Рос. физиол. журн. им. И.М. Сеченова. 105(1): 62–75. 2019. [Vataev S.I., Zaitsev A.V., Lukomskaya N.Y., Magazanik L.G. Memantine and IEM–1921, uncompetitive antagonists of NMDA receptors, reduce the duration of status epilepticus in Wistar and Krushinsky–Molodkina rats in a lithium–pilocarpine model. Russ. J. Physiol. 105(1): 62–75. 2019. (In Russ). Vataev S.I., Zaitsev A.V., Lukomskaya N.Ya., Magazanik L.G. The NMDA receptor channel blockers memantine and IEM–1921 decrease the duration of status epilepticus in Wistar and Krushinskii–Molodkina rats in a lithium–pilocarpine model. Neurosci. Behav. Physiol. 50(3): 374–383. 2020. (In Engl)].
Jakus R., Graf M., Ando R.D., Balogh B., Gacsalyi I., Levay G., Kantor S., Bagdy G., Effect of two non-competitive AMPA receptor antagonists GYKI 52466 and GYKI 53405 on vigilance, behavior and spikewave discharges in a genetic rat model of absence epilepsy. Brain Res. 22(2): 236–244. 2004.
Citraro R., Russo E., Gratteri S., Di Paola E.D., Ibbadu G.F., Curinga C., Gitto R., Chimirri A., Donato G., De Sarro G. Effects of non-competitive AMPA receptor antagonists injected into some brain areas of WAG/Rij rats, an animal model of generalized absence epilepsy. Neuropharmacology. 51(6): 1058–1067. 2006.
Hanada T., Ido K., Kosasa T. Effect of perampanel, a novel AMPA antagonist, on benzodiazepine-resistant status epilepticus in a lithium–pilocarpine rat model. Pharmacol. Res. Perspect. 2(5): e00063. 2014.
Leo A., Giovannini G., Russo E., Meletti S. The role of AMPA receptors and their antagonists in status epilepticus. Epilepsia. 59(6): 1098–1108. 2018.
Potschka H., Trinka E. Perampanel: Does it have broad-spectrum potential? Epilepsia. 60(1): 22–36. 2019.
Лукомская Н.Я., Рукояткина Н.И., Горбунова Л.В., Гмиро Е.В., Большаков К.В., Магазаник Л.Г. Сопоставление противосудорожной активности органических моно- и дикатионов с их способностью ингибировать NMDA и AMPA глутаматные рецепторы. Рос. физиол. журн. им. И.М. Сеченова. 88(9): 1161–1171. 2002. [Lukomskaya N.Y., Rukojatkina N.I., Gorbunova L.V., Gmiro V.E., Bolshakov K.V., Magazanik L.G. Comparison of anticonvulsant activity of organic mono- and dications, and their potency to inhibit NMDA and AMPA glutamate receptors. Russ. J. Physiol. 88(9): 1161–1171. 2002. (In Russ)].
Bolshakov K.V., Tikhonov D.B., Gmiro V.E., Magazanik L.G. Different arrangement of hydrophobic and nucleophilic components of channel binding sites in N-methyl-D-aspartate and AMPA receptors of rat brain is revealed by channel blockade. Neurosci. Lett. 291(2): 101–104. 2000.
Bolshakov K.V., Kim K.Kh., Potapjeva N.N., Gmiro V.E., Tikhonov D.B., Usherwood P.N., Mellor I.R., Magazanik L.G. Design of antagonists for NMDA and AMPA receptors. Neuropharmacology. 49(2): 144–155. 2005.
Zaitsev A.V., Kim K.K., Fedorova I.M., Dorofeeva N.A., Magazanik L.G., Tikhonov D.B. Specific mechanism of use-dependent channel block of calcium-permeable AMPA receptors provides activity-dependent inhibition of glutamatergic neurotransmission. J. Physiol. 589(7): 1587–601. 2011.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Compact 3 rd. ed. CD–ROM. San Diego. Acad. Press. 1997.
Ватаев С.И., Зайцев А.В., Ким К.Х., Лукомская Н.Я., Магазаник Л.Г. Изменения электрической активности мозга при формировании эпилептического статуса на литий-пилокарпиновой модели у крыс, различающихся по уровню судорожной готовности. Рос. физиол. журн. им. И.М. Сеченова. 102(6): 633–646. 2016. [Vataev S.I., Zaitsev A.V., Kim K.K., Lukomskaya N.Y., Magazanik L.G. Changes in brain electrical activity patterns in rats with different susceptibility to seizures in lithium–pilocarpine model of status epilepticus. Russ. J. Physiol. 102(6): 633–646. 2016. (In Russ). Vataev S.I., Zaitsev A.V., Kim K.K., Lukomskaya N.Ya., Magazanik L.G. Changes in brain electrical activity on formation of status epilepticus in a lithium-pilocarpine model in rats with different levels of convulsive readiness. Neurosci. Behav. Physiol. 47(9): 1019–1028. 2017. (In Engl)].
Pinel J.P., Rovner L.I. Experimental epileptogenesis: kindling-induced epilepsy in rats. Exp. Neurol. 58(2): 190–202. 1978.
Costa M.S., Rocha J.B.T., Perosa S.R., Cavalheiro E.A., Naffah-Mazzacoratti M.G. Pilocarpine induced status epilepticus increases glutamate release in rat hippocampal synaptosomes. Neurosci. Lett. 356(1): 41–44. 2004.
Scorza F.A, Arida R.M., Naffah-Mazzacoratti M.G., Scerni D.A., Calderazzo L., Cavalheiro E.A. The pilocarpine model of epilepsy: what have we learned? Ann. Acad. Bras. Cienc. 81(3): 345–365. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


