Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 98-118
Содержание моноаминов в симметричных зонах переднего мозга при длительном изменении тиреоидного статуса
С. Н. Прошин 1, *, И. В. Карпова 2, Р. И. Глушаков 3, Е. Р. Бычков 2, П. Д. Шабанов 2
1 Медицинский университет РЕАВИЗ
Санкт-Петербург, Россия
2 Институт экспериментальной медицины
Санкт-Петербург, Россия
3 Санкт-Петербургский государственный педиатрический медицинский университет
Санкт-Петербург, Россия
* E-mail: psnjsn@rambler.ru
Поступила в редакцию 05.06.2020
После доработки 08.11.2020
Принята к публикации 07.12.2020
Аннотация
У самцов мышей линии С3Н-А исследовали влияние длительного (44 нед.) тироксинового гипер- и пропилтиоурацилового гипотиреоза на гормональный статус и содержание моноаминов и их метаболитов в симметричных зонах переднего мозга. Уровень гормонов в сыворотке крови определяли методами энзим-связанного иммуносорбентного анализа, а содержание моноаминов и их метаболитов в головном мозге – методом высокоэффективной жидкостной хроматографии. Экспериментальный гипер- и гипотиреоз не вызывал противоположных изменений содержания моноаминов. Так, при любом изменении тиреоидного статуса в гиппокампе и обонятельном бугорке возрастал уровень серотонина. При этом содержание норадреналина в стриатуме снижалось, а в обонятельном бугорке – повышалось. Уровень дофамина в стриатуме и в обонятельном бугорке у животных обеих экспериментальных групп возрастал, однако у гипотиреоидных мышей данный эффект наблюдался билатерально, а у гипертиреоидных – унилатерально: только в левом стриатуме и правом обонятельном бугорке. Кроме этих изменений, при экспериментальном гипертиреозе происходило снижение уровня дофамина в коре больших полушарий, а при гипотиреозе – повышение содержания серотонина в правом стриатуме и коре правого полушария. Большинство параметров моноаминергических систем коррелировало не с содержанием тироксина, а с уровнями тиреотропина и пролактина в крови. При этом корреляций между содержанием тиреотропина и пролактина с уровнем тироксина выявлено не было, хотя содержание тиреотропина и пролактина коррелировало между собой. Можно предположить, что ведущую роль в механизмах влияния длительного изменения тиреоидного статуса на моноаминергические системы головного мозга играет не тироксин, а тиреотропный гормон.
Тиреоидные гормоны являются единственными из известных на сегодняшний день биологически активных веществ, содержащих йод [1, 2]. В организме взрослых млекопитающих они осуществляют регуляцию метаболизма, действуя почти на все органы и ткани [3]. Ведущая роль в механизмах регуляции секреции тиреоидных гормонов принадлежит таницитам, которые выстилают дно третьего желудочка головного мозга и посылают свои длинные проекции в гиполатамус [4]. Уровень тиреоидных гормонов регулируется гипоталамо-гипофизарной системой с участием механизмов отрицательной обратной связи [5]. Особенностью этой регуляции является то, что гипоталамические нейроны, выделяющие тиреолиберин, экспрессируют мембранные рецепторы, чувствительные к тироксину (Т4). При действии на эти рецепторы, секреция тиреолиберина угнетается [6]. Однако на периферические органы тиреоидные гормоны действуют в основном через внутриклеточные рецепторы, влияющие на экспрессию тех или иных генов. Внутриклеточные рецепторы более чувствительны к другой форме гормона – трийодтиронину (Т3), который образуется из Т4 с участием фермента дейодиназы [2].
Таким образом, если одна форма гормона (Т3) необходима для его периферических эффектов, то другая (Т4) – важна для реализации эффектов отрицательной обратной связи [1].
Широкое распространение заболеваний щитовидной железы приводит к частым назначениям фармакологических препаратов, направленных на изменение тиреоидного статуса. При этом основной целью терапии является нормализация уровня гормонов в периферической крови. При гипотиреозе наиболее часто используемым препаратом является L-тироксин, который в организме пациента постепенно преобразуется в активную форму гормона (Т3). При гипертиреозе часто применяется его антагонист – пропилтиоурацил (ПТУ), ингибирующий дейодиназу и тем самым снижающий интенсивность перехода Т4 в Т3, а следовательно, избыточный эффект тиреоидных гормонов [7].
Как гипотиреоз, так и избыточный синтез тиреоидных гормонов являются состояниями, которые могут привести к нарушению психики, включая расстройства мышления, изменения личности, неврозы и психозы. В клинической практике регистрация начала дисфункции щитовидной железы зачастую совпадает с развитием депрессии. Анализ клинических наблюдений и экспериментальных исследований, выполненных при использовании разных методов и моделей, подтверждает положение о том, что изменение тиреоидного статуса и развитие депрессии взаимосвязано между собой [8]. Согласно современным представлениям, в основе патогенеза развития депрессий лежит дисфункция центральных моноаминергических систем [9]. Известно, что дисбаланс тиреоидных гормонов влияет на моноаминергические системы. Так, например, перинатально или неонатально вызванный гипотиреоидизм снижает активность моноаминоксидазы (МАО) в целом головном мозге, но не влияет на активность МАО в отдельно взятых участках мозга [10]. Ранее предпринимались попытки оценить реакцию нейромедиаторных систем ЦНС на острое изменение уровня тиреоидных гормонов [11]. Однако вопрос о реакции моноаминергических систем на длительное медикаментозное изменение тиреоидного статуса остается открытым.
В связи с этим на самцах мышей линии С3Н-А мы предприняли исследование влияния длительно измененного тиреоидного статуса на уровень моноаминов в различных структурах переднего мозга.
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проводили на 19 самцах мышей линии С3Н-А массой 27–31 г, выращенных в питомнике Рапполово (Ленинградская область). В начале исследования возраст лабораторных животных составлял 40 ± 10 сут, масса – 20–22 г. После получения из питомника до начала эксперимента животные проходили 18-суточный акклиматизационный период, на протяжении которого дважды в день оценивали поведение и общее состояние каждого животного. Эксперимент проводили в течение 44 недель по методике, предложенной ранее [12]. Перед началом исследования животные были распределены случайным образом по трем клеткам, соответствующим экспериментальным группам: первая – эутиреоидная, или контрольная (10 мышей), вторая – гипертиреоидная (5 мышей) и третья – гипотиреоидная (4 мыши). Клетки с животными были размещены в одной комнате. Температура воздуха в помещении составляла 19–22°С, относительная влажность – 50–70%. Температуру и влажность воздуха регистрировали ежедневно. На протяжении эксперимента мыши содержались на стандартном пищевом рационе. Это исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями этического комитета Института экспериментальной медицины.
Мыши первой (эутиреоидной) группы не получали препаратов, изменяющих тиреоидный статус, и служили контролем.
На лабораторных животных второй группы воспроизведена модель экспериментального гипертиреоза посредством хронического внутрибрюшинного введения L-тироксина (РУП Белмедпрепараты, Минск, Республика Беларусь) в дозе 200 мкг на 100 г массы тела. Необходимое количество L-тироксина (Т4) разводили в 0.2 мл физиологического раствора и вводили через день на протяжении всего эксперимента (44 нед.). В дни введения препарата для расчета его дозы животных взвешивали на электронных весах ВЛР-500 (Россия) с пределом взвешивания 200 г и точностью ±0.1 г.
На лабораторных животных третьей (гипотиреоидной) группы воспроизведена модель экспериментального пропилтиоурацилового гипотиреоза путем замены воды в автопоилке на 0.5%-ный раствор пропилтиоурацила (Merck, Дармштадт, Германия). Количество выпитого раствора контролировали путем регулярного взвешивания автопоилки. Таким образом, в среднем каждое животное получало примерно 1.9–2.2 мг ПТУ на 100 г массы тела в сутки. Животные первой (контрольной, эутиреоидной) и второй (гипертиреоидной) группы получали чистую воду из автопоилок ad libitum.
Для корректности эксперимента лабораторным животным первой и третьей групп на протяжении всего эксперимента внутрибрюшинно вводили 0.2 мл физиологического раствора в том же режиме, что и мышам второй группы.
По окончании эксперимента (44 нед. хронического фармакологического воздействия) мышей декапитировали, собирали кровь и извлекали головной мозг.
Пробы крови отстаивали при комнатной температуре около двух часов, а затем для уплотнения сгустка центрифугировали при 1000 g в течение 10 мин при 10°C. Очищенную сыворотку делили на три порции (по количеству веществ, подлежащих определению) и хранили при −70°C до последующего анализа. Содержание Т4, ТТГ и пролактина (ПЛ) в сыворотке крови определяли методами энзим-связанного иммуносорбентного анализа, для чего использовали стандартные наборы реактивов: ТироидИФА-тироксин, ТироидИФА-ТТГ и ИФА-пролактин (ООО Алкор Био, Санкт-Петербург, Россия) [13]. Из правой и левой половин мозга на льду выделяли определенные морфологические структуры, взвешивали на торсионных весах и помещали в 0.1 М раствор соляной кислоты: стриатум – в 50 мкл, гиппокамп и обонятельный бугорок – в 100 мкл, кору больших полушарий – в 150 мкл. Пробы гомогенизировали с помощью механического гомогенизатора-блендера (10 000 об./мин), центрифугировали в течение 10 мин при 15 000 g. Надосадочную жидкость собирали в пробирки и хранили до анализа при –90°С. Содержание норадреналина (НА), дофамина (ДА), серотонина (5-ГТ) и их метаболитов – диоксифенилуксусной (ДОФУК), гомованилиновой (ГВК) и 5-гидроксииндолуксусной (5-ГИУК) кислот определяли методом обращеннофазной высокоэффективной жидкостной хроматографии на хроматографе Beckman Coulter (США) с электрохимическим детектором LC-4С BAS (США). Хроматографическая система включала инжектор Rheodyne 7125 с петлей на 20 мкл для нанесения образцов и колонку 250.0 × 4.6 мм с сорбентом Sphere Clone 5 u ODS(2) (Phenomenex, США). Определение концентраций исследуемых веществ проводили при потенциале +0.70 В. Подвижная фаза включала 5.5 мМ цитратно-фосфатного буфера с 0.7 мМ октансульфоновой кислоты, 0.5 мМ ЭДТА и 8% ацетонитрила (рН 3.0). Скорость элюции подвижной фазы составляла 1 мл/мин, время анализа одной пробы – около 20 мин.
Полученные результаты обрабатывали методами непараметрической статистики с применением стандартного статистического пакета GraphPad PRISM 6.0. Достоверность различий между группами оценивали по критерию Манна–Уитни. Для сравнения данных, полученных от одноименных структур левой и правой сторон мозга, применяли парный критерий Вилкоксона (в группе эутиреоидных мышей) или параметрический парный критерий Стьюдента (в группах гипер- и гипотиреоидных мышей). Взаимодействия между измеренными параметрами оценивали путем расчета коэффициентов корреляции Спирмена. Статистически значимыми считали корреляции с р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты сравнения уровней гормонов у контрольных мышей и животных с экспериментально измененным тиреоидным статусам представлены на рис. 1–3. Сравнение уровней Т4 у трех групп животных подтвердило адекватность примененной физиологической модели: у мышей, хронически получавших L-тироксин, уровень соответствующего гормона был наибольшим, а у получавших ПТУ – наименьшим, причем различия между группами были достоверны на 95%-ном уровне значимости (рис. 1).
Рис. 1.
Уровень тироксина в крови у самцов мышей линии С3Н-А. Control – контрольные (эутиреоидные, n = 10), Т4 – получавшие тироксин (гипертиреоидные, n = 5), PTU – получавшие пропилтиоурацил (гипотиреоидные, n = 4). ** – p < 0.01, *** – p < 0.001, достоверные отличия от соответствующего показателя той же стороны мозга у животных контрольной группы (отличия от контроля); &&&& – p < 0.0001, достоверные различия между соответствующими показателями той же стороны мозга у животных разных экспериментальных групп (отличия от группы, получавших Т4). Fig. 1. The level of T4 in blood in С3Н-А male mice. Control – control (euthyroid group, n = 10), Т4 – treated with thyroxine (hyperthyroid group, n = 5), PTU – treated with propylthiouracil (hypothyroid group, n = 4). ** – p < 0.01, *** – p < 0.001, significant differences from the corresponding values in animals of the control group, the difference from the control; &&&& – p < 0.0001, significant differences between similar values of the same side of the brain in animals of different experimental groups. The difference from the group treated with T4.
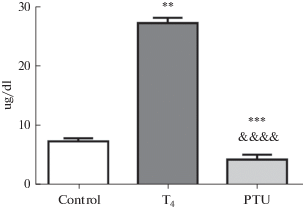
Рис. 2.
Уровень ТТГ в крови у самцов мышей линии С3Н-А. Control – контрольные (эутиреоидные, n = 10), Т4 – получавшие тироксин (гипертиреоидные, n = 5), PTU – получавшие пропилтиоурацил (гипотиреоидные, n =4). * – p < 0.05, достоверные отличия от соответствующего показателя у животных контрольной группы (отличия от контроля). Fig. 2. The level of TSH in blood in С3Н-А male mice. Control – control (euthyroid group, n = 10), Т4 – treated with thyroxine (hyperthyroid group, n = 5), PTU – treated with propylthiouracil (hypothyroid group, n = 4). * – p < 0.05, significant differences from the corresponding values in animals of the control group, the difference from the control.
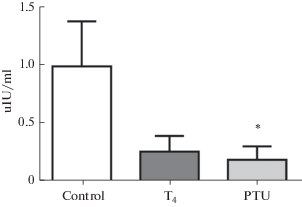
Рис. 3.
Уровень пролактина в крови у самцов мышей линии С3Н-А. Control – контрольные (эутиреоидные, n = 10), Т4 – получавшие тироксин (гипертиреоидные, n = 5), PTU – получавшие пропилтиоурацил (гипотиреоидные, n = 4). * – p < 0.05, достоверные отличия от соответствующего показателя у животных контрольной группы (отличия от контроля). Fig. 3. The level of prolactin in blood in С3Н-А male mice. Control – control (euthyroid group, n = 10), Т4 – treated with thyroxine (hyperthyroid group, n = 5), PTU – treated with propylthiouracil (hypothyroid group, n = 4). * – p < 0.05, significant differences from the corresponding values in animals of the control group, the difference from the control.

Вместе с тем, содержание ТТГ достоверно снижалось только у гипотиреоидных мышей (р < 0.05), в то время как у гипертиреоидных была отмечена только соответствующая тенденция (p = 0.0727, рис. 2).Снижение уровня этого гормона у гипертиреоидных животных (получавших Т4) было вполне предсказуемо, т.к. известно, что тироксин тормозит выработку ТТГ по механизму отрицательной обратной связи. Падение уровня ТТГ у животных с экспериментальным гипотиреозом на первый взгляд кажется неожиданным. Однако известно, что в основе механизма действия ПТУ лежит его способность блокировать дейодиназу – фермент, катализирующий переход Т4 в его активную форму – Т3 [1, 2]. Поэтому, возможно, у животных, получавших этот препарат, периферическое действие тиреоидных гормонов (которое, в основном, осуществляется за счет Т3) было ослаблено, а регуляторное влияние на аденогипофиз (которое во многом осуществляется за счет Т4) оставалось достаточно выраженным. Тот факт, что у мышей этой группы уровень Т4 был также снижен (см. рис. 1), позволяет предположить, что для успешного ингибирования выброса ТТГ важно не столько высокое содержание Т4, сколько определенное соотношение между уровнями Т4 и Т3.
Экспериментальное изменение тиреоидного статуса оказывало аналогичное влияние на содержание ПЛ: уровень этого гормона снижался у мышей обеих экспериментальных групп (р < 0.05, рис. 3).
Сходные закономерности, полученные при изучении влияния измененного тиреоидного статуса на содержание двух гипоталамических гормонов (ТТГ и ПЛ) подтверждаются данными корреляционного анализа. Была обнаружена значимая положительная корреляция (r = 0.729; р = 0.001) между уровнями этих гормонов.
Результаты исследования содержания моноаминов и их метаболитов в тех структурах переднего мозга, где были отмечены достоверные различия между группами, представлены в табл. 1–4.
Таблица 1.
Содержание моноаминов и их метаболитов в коре больших полушарий при длительном экспериментальном изменении тиреоидного статуса у самцов мышей линии С3Н-А Table 1. The contents of monoamines and their metabolites in the cerebral cortex after a long-term experimental change in thyroid status in male C3H-A mice
| Контроль Control (n = 10) |
Т4 (n = 5) |
ПТУ PTU (n = 4) |
||||
|---|---|---|---|---|---|---|
| левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
|
| НА (нг/мг ткани) NA (ng/mg of tissue) |
0.16 ± 0.03 | 0.12 ± 0.01 | 0.15 ± 0.02 | 0.13 ± 0.03 | 0.17 ± 0.03 | 0.16 ± 0.03 |
| ДА (нг/мг ткани) DA (ng/mg of tissue) |
0.26 ± 0.06 | 0.18 ± 0.02 | 0.03 ± 0.01* | 0.03 ± 0.01** | 0.23 ± 0.08 | 0.11 ± 0.05 |
| ДОФУК (нг/мг ткани) DOPAC (ng/mg of tissue) |
0.29 ± 0.04 | 0.25 ± 0.04 | 0.21 ± 0.03 | 0.11 ± 0.02*## | 0.11 ± 0.03 **& | 0.11 ± 0.07 |
| ДОФУК/ДА (усл. ед.) DOPAC/DA (arb. unit) |
1.12 ± 0.10 | 1.35 ± 0.09 | 6.92 ± 2.93* | 3.83 ± 1.04*# | 1.16 ± 0.33 | 1.31 ± 0.55 |
| 5-ГТ (нг/мг ткани) 5-HT (ng/mg of tissue) |
0.08 ± 0.01 | 0.08 ± 0.02 | 0.10 ± 0.02 | 0.09 ± 0.02 | 0.18 ± 0.02* | 0.14 ± 0.02 |
| 5-ГИУК (нг/мг ткани) 5-HIAA (ng/mg of tissue) |
0.27 ± 0.03 | 0.27 ± 0.02 | 0.31 ± 0.01 | 0.31 ± 0.02 | 0.24 ± 0.01& | 0.22 ± 0.01& |
| 5-ГИУК/5-ГТ (усл. ед.) 5-HIAA/5-HT (arb. unit) |
3.38 ± 0.50 | 3.52 ± 0.36 | 3.38 ± 0.51 | 4.33 ± 0.85 | 1.44 ± 0.24*& | 1.62 ± 0.17** |
##p < 0.01 – достоверные различия между аналогичными показателями левой и правой сторон мозга (асимметрия), оцененные по парному t-критерию Стьюдента. *p < 0.05; **p < 0.01 – достоверные отличия от соответствующего показателя той же стороны мозга у животных контрольной группы (отличия от контроля); &p < 0.05 – достоверные различия между показателями той же стороны мозга у животных разных экспериментальных групп (отличия от группы, получавших Т4), оцененные по непарному критерию Манна–Уитни. ##p < 0.01 – significant differences between the corresponding values of the left and right sides of the brain (asymmetry), estimated by the Student’s paired t-test. *p < 0.05; **p < 0.01 – significant differences from the corresponding value of the same side of the brain in animals of the control group (differences from the control); &p < 0.05 – significant differences between values of the same side of the brain measured in animals of different experimental groups (differences from the group of mice treated with T4), evaluated by the unpaired Mann–Whitney criterion.
Таблица 2.
Содержание моноаминов и их метаболитов в гиппокампе при длительном экспериментальном изменении тиреоидного статуса у самцов мышей линии С3Н-А Table 2. The contents of monoamines and their metabolites in the hippocampus with a long-term experimental change in thyroid status in male C3H-A mice
| Контроль Control (n = 10) |
Т4 (n = 5) |
ПТУ PTU (n = 4) |
||||
|---|---|---|---|---|---|---|
| левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
|
| НА (нг/мг ткани) NA (ng/mg of tissue) |
0.53 ± 0.04 | 0.56 ± 0.06 | 0.49 ± 0.04 | 0.45 ± 0.06 | 0.32 ± 0.10 | 0.38 ± 0.14 |
| ДОФУК (нг/мг ткани) DOPAC (ng/mg of tissue) |
0.17 ± 0.02 | 0.17 ± 0.04 | 0.03 ± 0.03 * | 0.02 ± 0.01 *** | 0.05 ± 0.03 * | 0.03 ± 0.02 * |
| 5-ГТ (нг/мг ткани) 5-HT (ng/mg of tissue) |
0.25 ± 0.02 | 0.26 ± 0.03 | 0.55 ± 0.05 *** | 0.57 ± 0.03 *** | 0.43 ± 0.07 ** | 0.52 ± 0.10 * |
| 5-ГИУК (нг/мг ткани) 5-HIAA (ng/mg of tissue) |
0.40 ± 0.03 | 0.43 ± 0.03 | 0.81 ± 0.07 *** | 0.70 ± 0.07 *** | 0.40 ± 0.11 & | 0.47 ± 0.14 |
| 5-ГИУК/5-ГТ (усл. ед.) 5-HIAA /5-HT (arb. unit) |
1.59 ± 0.08 | 1.69 ± 0.07 | 1.53 ± 0.21 | 1.22 ± 0.11 ** | 0.93 ± 0.22 * | 0.85 ± 0.11 *** & |
* p < 0.05; **p < 0.01; ***p < 0.001 – достоверные отличия от соответствующего показателя той же стороны мозга у животных контрольной группы (отличия от контроля); &p < 0.05 – достоверные различия между показателями той же стороны мозга у животных разных экспериментальных групп (отличия от группы, получавших Т4), оцененные по непарному критерию Манна–Уитни. *p < 0.05; **p < 0.01; ***p < 0.001 significant differences from the corresponding value of the same part of the brain in animals of the control group (difference from control); &p < 0.05 – significant differences between values of the same side of the brain measured in animals of different experimental groups (differences from the group of mice treated with T4), evaluated by unpaired Mann–Whitney test.
Таблица 3.
Содержание моноаминов и их метаболитов в обонятельном бугорке при длительном экспериментальном изменении тиреоидного статуса у самцов мышей линии С3Н-А Table 3. The contents of monoamines and their metabolites in the tuberculum olfactorium with a long-term experimental change in thyroid status in male C3H-A mice
| Контроль Control (n = 10) |
Т4 (n = 5) |
ПТУ PTU (n = 4) |
||||
|---|---|---|---|---|---|---|
| левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
|
| НА (нг/мг ткани) NA (ng/mg of tissue) |
0.27 ± 0.02 | 0.34 ± 0.03## | 0.77 ± 0.09 *** | 0.90 ± 0.08 *** | 0.64 ± 0.10 *** | 1.12 ± 0.07 #*** |
| ДА (нг/мг ткани) DA (ng/mg of tissue) |
0.96 ± 0.05 | 1.10 ± 0.10 | 1.14 ± 0.31 | 1.81 ± 0.16 # ** | 2.29 ± 0.12*** && | 2.29 ± 0.29*** |
| ДОФУК (нг/мг ткани) DOPAC (ng/mg of tissue) |
0.31 ± 0.02 | 0.36 ± 0.03 | 0.50 ± 0.11 | 0.63 ± 0.02 *** | 0.58 ± 0.08 ** | 0.81 ± 0.05# *** && |
| ГВК (нг/мг ткани) HVA (ng/mg of tissue) |
0.08 ± 0.01 | 0.12 ± 0.02 | 0.17 ± 0.03 ** | 0.17 ± 0.03 | 0.17 ± 0.01*** | 0.19 ± 0.02* |
| ДОФУК/ДА (усл. ед.) DOPAC/DA (arb. unit) |
0.33 ± 0.03 | 0.35 ± 0.03 | 0.67 ± 0.24 | 0.36 ± 0.03 | 0.25 ± 0.03&& | 0.36 ± 0.02# |
| ГВК/ДА (усл. ед.) HVA/DA (arb. unit) |
0.085 ± 0.012 | 0.102 ± 0.014 | 0.118 ± 0.003 | 0.093 ± 0.007 | 0.075 ± 0.004& | 0.087 ± 0.007 |
| 5-ГТ (нг/мг ткани) 5-HT (ng/mg of tissue) |
0.23 ± 0.03 | 0.24 ± 0.04 | 0.59 ± 0.06*** | 0.81 ± 0.04*** | 0.90 ± 0.09** | 1.12 ± 0.17** |
| 5-ГИУК (нг/мг ткани) 5-HIAA (ng/mg of tissue) |
0.20 ± 0.01 | 0.25 ± 0.02 | 0.52 ± 0.04*** | 0.55 ± 0.06** | 0.35 ± 0.06*& | 0.56 ± 0.04 # *** |
| 5-ГИУК/5-ГТ (усл. ед.) 5-HIAA /5-HT (arb. unit) |
0.96 ± 0.09 | 1.16 ± 0.12 | 0.91 ± 0.09 | 0.67 ± 0.06* | 0.41 ± 0.10*& | 0.55 ± 0.08* |
#p < 0.05 – достоверные различия между аналогичными показателями левой и правой сторон мозга (асимметрия), оцененные по парному t-критерию Стьюдента; ##p < 0.01 – достоверные различия между аналогичными показателями левой и правой сторон мозга (асимметрия), оцененные по парному критерию Вилкоксона; *p < 0.05; **p < 0.01; ***p < 0.001 – достоверные отличия от соответствующего показателя той же стороны мозга у животных контрольной группы (отличия от контроля); &p < 0.05; &&p < 0.01 – достоверные различия между показателями той же стороны мозга у животных разных экспериментальных групп (отличия от группы, получавших Т4), оцененные по непарному критерию Манна–Уитни. #p < 0.05 – significant differences between the corresponding values of the left and right sides of the brain (asymmetry), estimated by the Student’s paired t-test; ##p < 0.01 – significant differences between the corresponding values of the left and right sides of the brain (asymmetry), estimated by paired Wilcoxon test.; *p < 0.05; **p < 0.01; ***p < 0.001 significant differences from the corresponding figure of the same part of the brain in animals of the control group (difference from control); &p < 0.05; &&p < 0.01 – significant differences between values of the same side of the brain in animals of different experimental groups (differences from the group of mice treated with T4), evaluated by the unpaired Mann–Whitney test.
Таблица 4.
Содержание моноаминов и их метаболитов в стриатуме при длительном экспериментальном изменении тиреоидного статуса у самцов мышей линии С3Н-А Table 4. The contents of monoamines and their metabolites in the striatum with a long-term experimental change in thyroid status in male C3H-A mice
| Контроль Control (n = 10) |
Т4 (n = 5) |
ПТУ PTU (n = 4) |
||||
|---|---|---|---|---|---|---|
| левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
левая сторона left hemisphere |
правая сторона right hemisphere |
|
| НА (нг/мг ткани) NA (ng/mg of tissue) |
0.62 ± 0.10 | 0.74 ± 0.09 | 0.24 ± 0.03** | 0.23 ± 0.03 *** | 0.10 ± 0.01***& | 0.12 ± 0.01***& |
| ДА (нг/мг ткани) DA (ng/mg of tissue) |
2.54 ± 0.27 | 2.86 ± 0.32 | 4.70 ± 1.44 | 4.27 ± 0.91 | 7.44 ± 1.20 *** | 8.20 ± 1.73*** |
| ДОФУК (нг/мг ткани) DOPAC (ng/mg of tissue) |
1.06 ± 0.08 | 1.23 ± 0.12 | 1.79 ± 0.19** | 1.65 ± 0.19 | 1.52 ± 0.14 * | 1.50 ± 0.22 |
| ГВК (нг/мг ткани) HVA (ng/mg of tissue) |
0.41 ± 0.05 | 0.41 ± 0.04 | 0.42 ± 0.04 | 0.41 ± 0.04 | 0.37 ± 0.02 | 0.38 ± 0.05 |
| ДОФУК/ДА (усл. ед.) DOPAC/DA (arb. unit) |
0.47 ± 0.04 | 0.45 ± 0.04 | 0.38 ± 0.07 | 0.43 ± 0.06 | 0.22 ± 0.02 *** | 0.19 ± 0.02 ***& |
| ГВК/ДА (усл. ед.) HVA/DA (arb. unit) |
0.21 ± 0.04 | 0.20 ± 0.05 | 0.13 ± 0.04 | 0.11 ± 0.01 | 0.052 ± 0.007**& | 0.049 ± 0.004***& |
| 5-ГТ (нг/мг ткани) 5-HT (ng/mg of tissue) |
0.30 ± 0.05 | 0.27 ± 0.04 | 0.28 ± 0.10 | 0.25 ± 0.05 | 0.52 ± 0.10 | 0.56 ± 0.03**& |
| 5-ГИУК (нг/мг ткани) 5-HIAA (ng/mg of tissue) |
0.37 ± 0.04 | 0.54 ± 0.06 ## | 0.73 ± 0.05*** | 0.70 ± 0.04 | 0.66 ± 0.02 ** | 0.66 ± 0.08 |
| 5-ГИУК/5-ГТ (усл. ед.) 5-HIAA /5-HT (arb. unit) |
2.06 ± 0.47 | 2.72 ± 0.55 | 2.70 ± 0.61 | 2.52 ± 0.16 | 1.50 ± 0.41 | 1.18 ± 0.11*& |
##p < 0.01 – достоверные различия между аналогичными показателями левой и правой сторон мозга (асимметрия), оцененные по парному t-критерию Стьюдента; *p < 0.05; **p < 0.01; ***p < 0.001 – достоверные отличия от соответствующего показателя той же стороны мозга у животных контрольной группы (отличия от контроля); &p < 0.05 – достоверные различия между показателями той же стороны мозга у животных разных экспериментальных групп (отличия от группы, получавших Т4), оцененные по непарному критерию Манна–Уитни. ##p < 0.01 – significant differences between the corresponding values of the left and right sides of the brain (asymmetry), estimated by the Student’s paired t-test; *p < 0.05; **p < 0.01; ***p < 0.001 significant differences from the corresponding values of the same part of the brain in animals of the control group (difference from control); &p < 0.05 – significant differences between values of the same side of the brain in animals of different experimental groups (differences from the group of mice treated with T4), evaluated by unpaired Mann–Whitney test.
В коре больших полушарий различий по содержанию НА в симметричных структурах выявлено не было. Содержание ДА отличалось от контроля только у гипертиреоидных мышей: уровень этого медиатора был ниже, чем у эутиреоидных в коре как левого (p < 0.05), так и правого полушария (р < 0.01), что сопровождалось правосторонним снижением ДОФУК, возрастанием соотношения ДОФУК/ДА и появлением левосторонней асимметрии по этому показателю (p < 0.05, табл. 1). У гипотиреоидных животных уровень ДОФУК достоверно снижался только в коре левого полушария (p < 0.01, табл. 1). Cодержание 5-ГТ в коре правого полушария у гипотиреоидных мышей было выше, чем аналогичный показатель контрольной группы (p < 0.05), при этом соотношение ГИУК/СЕР в коре снижалось билатерально (p < 0.05 – слева и p < 0.01 – справа, табл. 1).
Как хронический гипер-, так и хронический гипотиреоз сопровождались значительным угнетением ДА-ергической системы гиппокампа: содержание ДА у животных с измененным тиреоидным статусом оказывалось ниже предела обнаружения детектора (в табл. не показано), а уровень его метаболита – ДОФУК в гиппокампе у животных обеих экспериментальных групп был ниже, чем у мышей контрольной группы (табл. 2). Содержание 5-ГТ в гиппокампе у животных обеих экспериментальных групп оказывалось выше, чем у эутиреоидных, а уровень 5-ГИУК (метаболита 5-ГТ) был повышен только у мышей гипертиреоидной группы (табл. 2). Соотношение 5-ГИУК/5-ГТ у гипертиреоидных мышей значимо снижалось только в правом гиппокампе, а у гипотиреоидных – билатерально.
В обонятельном бугорке у мышей эутиреоидной группы была отмечена асимметрия с преобладанием НА справа (p < 0.01). У животных обеих экспериментальных групп уровень этого медиатора был выше, чем у эутиреоидных мышей, причем у гипертиреоидных мышей содержание НА становилось симметричным, а у гипотиреоидных – сохранялась асимметрия, характерная для контрольных животных (p < 0.05, табл. 3). Содержание ДА в обонятельном бугорке при изменении тиреоидного статуса повышалось, причем при гипертиреозе – только справа (что приводило к возникновению асимметрии), а при гипотиреозе – билатерально (табл. 3). Уровень метаболитов ДА в обонятельном бугорке у животных обеих экспериментальных групп также возрастал, причем содержание ДОФУК у гипертиреоидных мышей повышалось только справа, а ГВК – только слева (табл. 3). Соотношение ДОФУК/ДА в левом обонятельном бугорке у гипотиреоидных животных было значимо ниже, чем у гипертиреоидных (p < 0.01), хотя от данного показателя у контрольной группы не отличалось, при этом у гипотиреоидных мышей соотношение ДОФУК/ДА в правом обонятельном бугорке оказывалось выше, чем в левом (табл. 3). Содержание 5-ГТ и его метаболита – 5-ГИУК билатерально повышалось у животных обеих экспериментальных групп (табл. 3). Уровень 5-ГИУК у гипертиреоидных мышей оставался симметричным, а у гипотиреоидных – возникала правосторонняя асимметрия по данному показателю (р < 0.05, табл. 3). Соотношение 5-ГИУК/5-ГТ у гипертиреоидных мышей снижалось только в правом обонятельном бугорке, а у гипотиреоидных – билатерально (табл. 3).
В стриатуме как у гипер-, так и у гипотиреоидных животных было отмечено билатеральное снижение содержания НА по сравнению с контролем (табл. 4). Содержание ДА в стриатуме у мышей обеих экспериментальных групп повышалось, однако статистически достоверно – только при гипотиреозе (табл. 4). Уровень ДОФУК у животных обеих экспериментальных групп был повышен в правом стриатуме. При этом показатель внутриклеточного обмена ДА (ДОФУК/ДА) у гипертиреоидных мышей оставался неизменным, в то время как у гипотиреоидных – снижался (p < 0.001, табл. 4). Животные гипотиреоидной группы также характеризовались билатеральным снижением соотношения ГВК/ДА – косвенного показателя интенсивности выброса ДА (p < 0.01 – слева и p < 0.001 – справа, табл. 4). Содержание 5-ГТ в стриатуме у гипертиреоидных мышей не менялось, а у гипотиреоидных – увеличивалось только в правом стриатуме, становясь выше, чем у животных как контрольной (p < 0.01), так и гипотиреоидной (p < 0.05) группы (табл. 4). Содержание 5-ГИУК (метаболита 5-ГТ) в правом стриатуме у эутиреоидных мышей было выше, чем в левом (p < 0.05), при этом как при гипер-, так и при гипотиреозе этот показатель в левом стриатуме достоверно возрастал (р < 0.001 и р < 0.01 соответственно), и асимметрия исчезала. В результате описанных изменений соотношение 5-ГИУК/5-ГТ в правом стриатуме у гипотиреоидных мышей оказывалось ниже, чем у контрольных и гипертиреоидных животных (p < 0.05, табл. 4). Таким образом, индуцированный гипотиреоз оказывал более сильное влияние на содержание моноаминов в стриатуме, чем индуцированный гипертиреоз.
Данные корреляционного анализа, касающиеся содержания моноаминов и их метаболитов, а также показателей обмена медиаторов (отношений метаболитов к соответствующим моноаминам) представлены в табл. 5.
Таблица 5.
Корреляции между содержанием гормонов в крови и показателями обмена моноаминов в симметричных структурах переднего мозга мышей линии С3Н-А Table 5. Correlations between the hormones contents in the blood and the monoamine metabolism parameters in symmetrical forebrain areas in C3H-A mice
| Гормоны крови Blood hormones |
||||||
|---|---|---|---|---|---|---|
| Т4 | ТТГ TSH |
ПЛ PL |
||||
| корреляции с показателем correlations with the parameter |
левой стороны мозга left hemisphere |
правой стороны мозга right hemisphere |
левой стороны мозга left hemisphere |
правой стороны мозга right hemisphere |
левой стороны мозга left hemisphere |
правойстороны мозга right hemisphere |
| Кора больших полушарий Cerebral cortex |
||||||
| ДА DA |
0.56 | 0.61 | ||||
| ДОФУК/ДА DOPAC/DA |
0.55 | –0.76 | ||||
| 5-ГИУК 5-HIAA |
0.57 | 0.60 | ||||
| 5-ГИУК/ГТ 5-HIAA/5-HT |
0.60 | |||||
| Гиппокамп Hippocampus |
||||||
| 5-ГТ 5-HT |
–0.60 | –0.60 | –0.82 | –0.76 | ||
| 5-ГИУК 5-HIAA |
0.63 | 0.63 | –0.68 | –0.63 | ||
| 5-ГИУК/5-ГТ 5-HIAA/5-HT |
0.51 | |||||
| Обонятельный бугорок Tuberculum olfactorium |
||||||
| НА NA |
–0.63 | –0.61 | –0.55 | –0.57 | ||
| ДА DA |
–0.64 | –0.54 | ||||
| ДОФУК DOPAC |
–0.66 | –0.52 | ||||
| ДОФУК/ДА DOPAC/DA |
0.58 | |||||
| ГВК | –0.61 | –0.59 | ||||
| ГВК/ДА | 0.66 | |||||
| 5-ГТ 5-HT |
–0.67 | –0.62 | –0.67 | –0.51 | ||
| 5-ГИУК 5-HIAA |
0.48 | –0.52 | –0.51 | |||
| 5-ГИУК/ГТ 5-HIAA/5-HT |
0.51 | 0.57 | ||||
| Стриатум Striatum |
||||||
| НА NA |
0.56 | 0.64 | 0.52 | |||
| 5-ГТ 5-HT |
–0.52 | |||||
| 5-ГИУК 5-HIAA |
–0.51 | |||||
| 5-ГИУК/ГТ 5-HIAA/5-HT |
0.61 | |||||
Не было выявлено ни одной значимой корреляции между уровнями Т4 в крови и НА в различных структурах головного мозга. С содержанием Т4 в крови коррелировали только три параметра состояния ДА-ергической системы и 6 параметров серотонинергической системы.
Параметры ДА-ергической системы, которые коррелировали с содержанием Т4 в крови, относились к категории расчетных показателей обмена ДА: соотношения ДОФУК/ДА в правой коре, а также – ДОФУК/ДА и ГВК/ДА в левом обонятельном бугорке (табл. 5).
С содержанием Т4 в крови коррелировали, в основном, параметры серотонинергической системы (табл. 5). В частности, с уровнем Т4 отрицательно коррелировало содержание 5-ГТ в правом стриатуме (табл. 5), что соответствовало возрастанию этого параметра у мышей под воздействием ПТУ. В остальных структурах переднего мозга были отмечены положительные корреляции между уровнем Т4 и содержанием 5-ГИУК (метаболита 5-ГТ). Данная закономерность была зарегистрирована билатерально в коре больших полушарий и гиппокампе и только слева – в обонятельном бугорке (табл. 5). Положительные корреляции Т4 и показателя обмена серотонина – 5-ГИУК/5-ГТ были выявлены только с правой стороны – в коре и в стриатуме (табл. 5).
В отличие от корреляций с уровнем Т4, довольно большое количество измеренных показателей моноаминергических систем переднего мозга коррелировало с содержанием ТТГ и ПЛ в крови. Было зарегистрировано 13 статистически значимых корреляций с ТТГ и 15 – с ПЛ (табл. 5). Поскольку сами уровни ТТГ и ПЛ положительно коррелировали между собой, то и структура корреляций этих гормонов с содержанием моноаминов и их метаболитов была сходной и включала большое количество отрицательных корреляций (табл. 5).
Содержание ДА в правой коре положительно коррелировало с уровнями ТТГ и ПЛ, что в целом не было характерно для всей корреляционной структуры (табл. 5). Соотношение ДОФУК/ДА в правой коре отрицательно коррелировало с уровнем ТТГ (но не ПЛ!) в крови (табл. 5). Вместе с тем, как было описано выше, данный показатель положительно коррелировал с уровнем Т4. Важно отметить, что соответствующие корреляционные зависимости проявлялись исключительно унилатерально: статистически значимых корреляций между соотношением ДОФУК/ДА в левой коре и уровнями гормонов выявлено не было.
В гиппокампе были выявлены отрицательные корреляции уровней ТТГ и ПЛ с содержанием 5-ГТ и справа, и слева (табл. 5). При этом с уровнем ПЛ отрицательно коррелировало еще и содержание 5-ГИУК с обеих сторон.
В стриатуме с уровнем ТТГ положительно коррелировало содержание НА справа и слева, а с уровнем ПЛ – только справа (табл. 5). Кроме того, в правом стриатуме была выявлена отрицательная корреляция содержания 5-ГТ с уровнем ПЛ (табл. 5).
Больше всего корреляционных зависимостей между уровнями ТТГ и ПЛ, с одной стороны, и параметрами моноаминергических систем, – с другой, было выявлено в обонятельном бугорке (табл. 5). При этом все обнаруженные корреляции были отрицательными. В целом, структура корреляций содержания моноаминов и их метаболитов с ТТГ и ПЛ была сходной. С уровнем ТТГ в крови отрицательно коррелировали содержание ДА и ГВК – слева, ДОФУК и 5-ГИУК – справа и НА – билатерально. С уровнем ПЛ – содержание ДА, ГВК и 5-ГИУК слева, ДОФУК – справа и НА – билатерально. Однако параметры, связанные с интенсивностью обмена медиаторов (отношения метаболитов к соответствующим медиаторам) коррелировали только с уровнем ТТГ, но не ПЛ (табл. 5). Кроме уже описанной отрицательной корреляции ДОФУК/ДА в правой коре, с уровнем ТТГ положительно коррелировали соотношения 5-ГИУК/5-ГТ в правом гиппокампе и – левом обонятельном бугорке.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Планируя эксперимент, мы ожидали, что, по крайней мере, в некоторых случаях индуцированный гипер- и гипотиреоз будут приводить к противоположно направленным изменениям в состоянии моноаминергических систем. Наши ожидания были связаны с двумя обстоятельствами. Во-первых, тиреоидные гормоны, так же как и катехоламины, являются производными аминокислоты тирозина [14], поэтому одной из причин возможных изменений могло бы стать влияние применяемых препаратов на интенсивность тирозинового обмена, в частности, хроническое введение Т4 могло бы привести к тому, что для производства тиреоидных гормонов потребовалось бы меньше субстрата, и системы синтеза катехоламинов могли бы оказаться в условиях избытка тирозина или, по крайней мере, – в условиях возможности неограниченного поступления этой аминокислоты в нейроны. Таким образом, если бы ключевым обстоятельством связи системы тиреоидных гормонов и катехоламинергических систем было бы их метаболическое единство на основе использования одного и того же субстрата, мы увидели бы не только противоположные, но и существенные изменения показателей катехоламинергических систем, но – не серотонинергической. Во-вторых, поскольку модели тироксинового гипертиреоза и пропилтиоурацилового гипотиреоза являются классическими для интенсификации или подавления обмена веществ в организме [15], мы полагали, что их хроническое воздействие увеличит (в случае Т4) или уменьшит (в случае ПТУ) разницу по Р О2 и Р СО2 в крови, протекающей по левой и правой сонной артериям, что приведет к появлению или усилению асимметрии воздействия на каротидные хеморецепторные зоны у мышей, получавших Т4, и ее ослаблению – под действием ПТУ. Поскольку наши исследования моноаминергических систем в условиях гипоксии с гиперкапнией показали их асимметричный ответ [16], мы предполагали, что применение Т4 усилит проявление асимметрии моноаминергических систем, а ПТУ – ослабит.
Вопреки вышеизложенным предположениям, нами не было выявлено ни одного случая противоположно направленных изменений состояния центральных моноаминергических систем при индуцированном гипер- и гипотиреозе. Из 24 эффектов, описанных выше, 12 параметров изменялись синергично, 5 – только под действием Т4 и 7 – только под действием ПТУ. Поскольку применяемые воздействия приводили не только к изменению содержания Т4 в крови (рис. 1), но также – к снижению ТТГ (рис. 2) и ПЛ (рис. 3), мы предприняли изучение корреляций между показателями состояния моноаминергических систем в симметричных структурах переднего мозга и уровнями исследованных гормонов в крови.
Поскольку именно катехоламины, подобно Т4, являются производными тирозина, нас, прежде всего, интересовали корреляции содержания данного гормона с параметрами НА- и ДА-ергических систем. Вопреки нашим ожиданиям, показатели катехоламинергических систем слабо коррелировали с уровнем Т4. В частности, содержание НА не коррелировало с уровнем Т4. А из параметров ДА-ергической системы с содержанием Т4 в крови коррелировали только три показателя: соотношение ДОФУК/ДА в правой коре, а также – ДОФУК/ДА и ГВК/ДА в левом обонятельном бугорке (табл. 5). Унилатеральность описанных закономерностей позволяет считать, что их причины, скорее всего, связаны не с особенностями обмена тирозина в мозге, а с ответом ДА-ергических систем на модуляцию афферентных сигналов, поступающих в ЦНС, которое возникает при общем изменении интенсивности метаболизма.
Поскольку существуют генетически предопределенные анатомические различия в строении правой и левой стороны организма (в частности, асимметричное строение и расположение внутренних органов) [17], афферентация, поступающая в мозг от висцеральных органов, асимметрична. При этом данная асимметричная афферентация является постоянно действующим фактором, оказывающим влияние на активность моноаминергических ядер ствола мозга. В частности, в основе асимметричной реакции мозга на этот сигнал может лежать различная интенсивность эфферентной импульсации от левых и правых периферических хеморецептивных зон: от левой – слабее (сосуды короче), от правой – сильнее (сосуды длиннее). Возможно именно этим объясняется обнаруженная нами ранее асимметричная реакция моноаминергических систем правой и левой стороны мозга на гипоксию с гиперкапнией [16]. Можно предположить, что чем выше уровень метаболизма, тем интенсивнее будет снижение уровня кислорода в крови, омывающей правый каротидный синус, по сравнению с левым. Соответственно при снижении уровня метаболизма разница между правым и левым каротидным синусом будет меньше. Поэтому Т4, способствующий повышению потребления кислорода, может усиливать асимметрию афферентной импульсации, поступающей в ствол мозга от левой и правой синокаротидных зон, а ПТУ, снижающий потребление кислорода – ослаблять. Кроме того, возможно, изменение уровня метаболизма влияет на интенсивность поступления информации от внутренних органов (особенно связанных с процессами пищеварения). Поскольку эти органы асимметричны, то и импульсация, поступающая от них в левый и правый отделы ствола мозга, может способствовать асимметричной активности, а, следовательно, различного уровня выработки медиаторов в его моноаминергических структурах. Это предположение позволяет объяснить важное наблюдение о том, что данные по асимметрии моноаминов, связанные с функционированием лимбических систем, более стабильны и лучше воспроизводимы в различных исследованиях [18]. Если это так, то можно ожидать, что повышение уровня метаболизма будет способствовать “асимметризации” импульсации от висцеральных органов, а снижение – делать ее более симметричной. Иными словами, под действием Т4 асимметрия будет появляться или усиливаться, под действием ПТУ – ослабляться или исчезать (а может быть – меняться на противоположную – в тех системах, которые в норме “компенсируют” постоянно действующую “висцерогенную” асимметрию).
Изменения моноаминергических систем в коре больших полушарий, обнаруженные в настоящей работе, вполне согласуются с этим предположением. Так, под действием Т4 в коре больших полушарий происходит правостороннее снижение уровня ДОФУК, что сопровождается появлением асимметрии с преобладанием ДОФУК с левой стороны (табл. 1). Вместе с тем, в обонятельном бугорке (табл. 3) по этому показателю возникала правосторонняя асимметрия под действием ПТУ, а не Т4, как можно было бы ожидать. Аналогичная правосторонняя асимметрия в обонятельном бугорке возникла под действием ПТУ и по другим параметрам: соотношению ДОФУК/ДА и содержание 5-ГИУК. При исследовании влияния уровня Т4 на состояние другой катехоламинергической системы – НА-ергической – в обонятельном бугорке было обнаружено, что под влиянием Т4 исходная правосторонняя асимметрия исчезала, но сохранялась под действием ПТУ, причем уровень НА возрастал как при гипер-, так и при гипотиреозе (табл. 3). Таким образом, на кору больших полушарий асимметризующее влияние оказывал хронический гипертиреоз, а на обонятельный бугорок – гипотиреоз.
В литературе нам не удалось найти экспериментальные данные о длительном воздействии измененного тиреоидного статуса на активность катехоламинергических структур ЦНС. Вместе с тем, последствия острого или непродолжительного изменения уровня тиреоидных гормонов активно изучались на лабораторных грызунах. Так, было выявлено, что у крыс-самцов наблюдается снижение концентрации ДА в промежуточном мозге на 29 и 40% через 22 или 37 сут. после тиреоидэктомии соответственно [19]. Nakahara с соавт. обнаружили значительное снижение активности тирозингидроксилазы в медиальной палисадной зоне через 21 сут. после тиреоидэктомии [20]. При этом некоторое повышение активности данного фермента отмечалось в субэпендимальном слое и латеральной палисадной зоне. Также было показано, что тиреоидэктомия повышает скорость обмена ДА в срединном возвышении [14]. Повышение концентрации метаболитов моноаминов (ГВК и ДОФУК) у молодых гипертиреоидных крыс в головном мозге отмечали Bliss и Ailion. У взрослых гипертиреоидных крыс снижение уровня тирозина на 23% не сопровождалось увеличением эндогенного уровня ДА [21]. Rastogi с соавт. выявили, что введение Т3 (10 мкг/кг массы тела, дважды в день в течение 30 сут.) увеличивает транспорт тирозина в головной мозг, а также повышает концентрацию этой аминокислоты в головном мозге молодых и взрослых крыс [22]. Изменение тиреоидного статуса влияет на поведенческие ответы агонистов и антагонистов ДА, например, на апоморфин. Обнаружено, что гипотиреоидизм у взрослых крыс-самцов ассоциирован с несущественным снижением плотности α1- и β2-адренергических рецепторов в коре мозга. Frazer с соавт. изучали эффекты введения Т3 (15 мкг/кг) в течение пяти суток на систему цАМФ во фронтальной коре, предварительно простимулированную введением НА. Выраженное аддитивное действие гормона на данный показатель проявлялось при введении Т4 (50 мкг/кг) и трициклического антидепрессанта (3 мг/кг), который, с одной стороны, стимулировал адренергическую активность, а с другой – тормозил обратный захват НА [23]. Существенное различие между контрольной группой крыс и группой животных, получавших Т4, было зарегистрировано через 7 сут. после начала введения препарата [24]. Эффект Т4 был обратимым, поскольку отмена введения препарата приводила к полному восстановлению норадренергической чувствительности. При изучении влияния повторного введения Т4 на связывающую способность β-адренергических рецепторов в некоторых областях переднего (неокортекс) и заднего (мозжечок) мозга у крыс было показано, что введение Т4 в дозе 375 мкг/кг (в течение 7 сут.) сопровождалось повышением плотности β-адренергических рецепторов в переднем мозге и снижением связывающей способности этих рецепторов в области заднего мозга [25]. Таким образом, данные литературы подтверждают, что гипертиреоидное состояние избирательно влияет на НА-ергическую систему в разных регионах головного мозга.
Вместе с тем, по данным нашего исследования, содержание НА в структурах переднего мозга не коррелировало с уровнем Т4. Это позволяет предположить, что воздействие этого гормона на НА-ергическую передачу в области неокортекса, скорее всего, обусловлено его постсинаптическим влиянием.
Важно отметить, что с содержанием Т4 в крови коррелировали, в основном, параметры серотонинергической системы. При этом статистически значимые корреляционные зависимости не обязательно сопровождались достоверными различиями параметров серотонинергической системы у мышей трех экспериментальных групп. Так, несмотря на положительные корреляции с Т4, содержание 5-ГИУК в коре больших полушарий и соотношение ГИУК/5-ГТ в правом стриатуме не изменялись ни под действием Т4, ни под действием ПТУ. Однако остальные показатели, продемонстрировавшие корреляцию с уровнем Т4 при экспериментальном изменении тиреоидного статуса, все-таки показали достоверные отличия от контроля. В частности, содержание 5-ГТ в правом стриатуме, которое отрицательно коррелировало с уровнем Т4 в крови (табл. 5), возрастало под действием ПТУ (табл. 4). Содержание 5-ГИУК в гиппокампе, которое положительно коррелировало с уровнем Т4 (табл. 5), достоверно возрастало при экспериментальном гипертиреозе (табл. 2), а аналогичный показатель в левом обонятельном бугорке увеличивался как при гипер-, так и при гипотиреозе, но при гипертиреозе – в большей степени (табл. 3).
В гиппокампе были выявлены отрицательные корреляции уровней ТТГ и ПЛ с содержанием 5-ГТ (табл. 5). При этом с уровнем ПЛ отрицательно коррелировало еще и содержание 5-ГИУК (табл. 5). Поскольку 5-ГИУК является внутриклеточным метаболитом 5-ГТ, который образуется под действием фермента, локализованного в цитоплазме, а не в везикулах [26], логично предположить, что его образование может быть стимулировано усилением синаптического выброса 5-ГТ с последующим обратным захватом этого медиатора. Таким образом, несмотря на наличие рецепторов к ТТГ на телах моноаминергических нейронов ствола мозга [27], синаптический выброс 5-ГТ в гиппокампе, по-видимому, в большей мере контролируется ПЛ, чем ТТГ.
Таким образом, при анализе корреляционных связей между уровнями гормонов и параметрами моноаминергических систем можно отметить преобладание корреляций с показателями серотонинергической системы, большинство из которых – отрицательные. Важно отметить, что, за редким исключением, корреляционные зависимости проявлялись только с одной стороны мозга (табл. 5).
Давно известно, что серотонинергическая система непосредственно вовлекается в адаптационные процессы, связанные с изменением тиреоидного статуса. Обнаружено, что при экспериментальном гипертиреозе может происходить как повышение [28], так и снижение плотности серотониновых рецепторов, причем количество рецепторов 5-HT1A увеличивается, а рецепторов подтипа 5-HT2А – уменьшается [29]. На фоне измененного тиреоидного статуса изменяется и содержание моноаминов в мозге животных: острое или ежедневное введение Т4 в дозе 100 мкг/кг в течение 3-х или 7-ми суток повышает концентрацию 5-ГТ во фронтальной коре, но не в гиппокампе [29]. Эти данные не совпадают с результатами нашей работы, согласно которым концентрация 5-ГТ в коре под влиянием Т4 не изменялась, а под действием ПТУ – увеличивалась, в то время как уровень 5-ГТ в гиппокампе возрастал как у гипер-, так и у гипотиреоидных мышей. По нашему мнению, данное несоответствие может быть вызвано тем, что, во-первых, мы анализировали не префронтальную, а тотальную кору, во-вторых, в нашем исследовании мы применяли не Т3, а Т4 (его предшественник и основной регулятор секреции гипофизарного ТТГ) и, наконец, в-третьих, сроки введения препаратов в нашей работе (44 недели) были гораздо более длительными, чем в цитируемом исследовании (3 и 7 сут.). Сопоставляя результаты двух исследований, можно предположить, что при экспериментальном воздействии на тиреоидный статус животных, изменения содержания 5-ГТ в гиппокампе развиваются значительно позже, чем соответствующие изменения в новой коре. Необходимо отметить, что по данным литературы, следствием как однократного, так и хронического введения Т3 является значимое снижение плотности серотониновых рецепторов подтипа 5-HT2А, которое с определенной временной задержкой всегда регистрировалось во фронтальной коре [29]. Считается, что снижение плотности серотониновых рецепторов типа 5-HT2А может выводить из-под тормозного контроля нейроны, на которых расположены соответствующие рецепторы, и, тем самым, вызывать поведенческую активацию или приводить к анксиолитическим эффектам при типичном гипертиреоидизме [30, 31]. Так, например, заметное повышение поведенческой гиперактивности, вызванное введением антагонистов 5-ГТ, наблюдается у гипертиреоидных животных. Обнаружено, что ежедневное введение Т3 потенцирует синдром подергивания головой, вызванный введением предшественника 5-ГТ – 5-гидрокситриптофана [32]. Принимая во внимание наши данные об отрицательной корреляции между уровнем Т4 и содержанием 5-ГТ в правом стритуме, можно предположить, что в основе механизма двигательных нарушений, развивающихся при гипертиреозе, лежит специфическое влияние на те проекции серотонинергических нейронов, которые имеют отношение к регуляции движений.
Вместе с тем, регистрируемые изменения показателей серотонинергической системы у гипо- и гипертиреоидных мышей не позволяют сделать вывод об однозначной зависимости метаболизма 5-ГТ от тиреоидного статуса, поскольку положительные корреляции между 5-ГИУК/5-ГТ и содержанием Т4 в крови были отмечены только в правой коре и в правом стриатуме (табл. 5). Можно осторожно предположить, что такое унилатеральное влияние тиреоидного статуса на серотонинергические системы связано с тем, что данный эффект опосредован изменениями афферентной импульсации, поступающей в ствол мозга от асимметрично расположенных внутренних органов [17], на состоянии которых интенсивность обмена веществ сказывается в первую очередь.
Результаты настоящего исследования показали, что для большинства показателей обмена моноаминов в структурах переднего мозга характерны корреляции не с уровнем Т4, а с содержанием ТТГ и ПЛ в крови. Поскольку классическое снижение секреции ТТГ по механизму отрицательной обратной связи опосредовано не только рецепторами к Т3, но и рецепторами к Т4 [1], не исключено, что эффекты длительного введения Т4 или ПТУ (препятствующего конвертации Т4 в Т3) обусловлены не прямым действием Т4 на моноаминергические системы, а его способностью регулировать секрецию ТТГ. Рецепторы к ТТГ обнаружены в различных областях головного мозга, в том числе и в тех, где расположены тела моноаминергических нейронов или в которые проецируются их аксоны [33]. Поэтому можно предположить, что в основе механизма влияния тиреоидного статуса на состояние моноаминергических систем лежит не собственно воздействие Т4 на изучаемые процессы, а чувствительность моноаминергических нейронов к ТТГ.
Список литературы
Ortiga-Carvalho T.M., Chiamolera M.I., Pazos-Moura C.C., Wondisford F.E. Hypothalamus-Pituitary-Thyroid Axis. Compar. Physiol. 6(3): 1387–1428. 2016.
Paragliola R.M., Corsello A., Concolino P., Ianni F., Papi G., Pontecorvi A., Corsello S.M. Iodothyronine deiodinases and reduced sensitivity to thyroid hormones. Front. Biosci. (Landmark Ed). 25: 201–228. 2019.
Prezioso G., Giannini C., Chiarelli F. Effect of thyroid hormones on neurons and neurodevelopment. Horm. Res. Pediatr. 90: 73–81. 2018.
Rodríguez-Rodríguez A., Lazcano I., Sánchez-Jaramillo E., Uribe R.M., Jaimes-Hoy L., Joseph-Bravo P., Charli J.L. Tanycytes and the control of thyrotropin-releasing hormone flux into portal capillaries. Front. Endocrinol. (Lausanne). 10: 401–411. 2019.
Taylor P.N., Eligar V., Muller I., Scholz A., Dayan C., Okosieme O. Combination thyroid hormone replacement: known and unknowns. Front. Endocrinol. (Lausanne). 10: 706–710. 2019. https://doi.org/10.3389/fendo.2019.00706
Aranda A., Alonso-Merino E., Zambrano A. Receptors of thyroid hormones. Pediatr. Endocrinol. Rev. 11: 2–13. 2013.
Глушаков Р.И., Власьева О.В., Соболев И.В., Прошин С.Н., Тапильская Н.И. Стратегия фармакологической коррекции длительно протекающих негеномных эффектов тиреоидных гормонов. Обзоры по клин. фармакол. и лекарств. терапии. 13: 48–49. 2015. [Glushakov R.I., Vlas’eva O.V., Sobolev I.V., Proshin S.N., Tapil’skaya N.I. Strategy for pharmacological correction of the long-lasting non-genomic effects of thyroid hormones. Rev. Clin. Pharm. Drug Ther. 13: 48–49. 2017. (In Russ)].
Feng G., Kang C., Yuan J., Zhang Y., Wei Y., Xu L., Zhou F., Fan X., Yang J. Neuroendocrine abnormalities associated with untreated first episode patients with major depressive disorder and bipolar disorder. Psychoneuroendocrinology. 107: 119–123. 2019.
Perez-Caballero L., Torres-Sanchez S., Romero-López-Alberca C., González-Saiz F., Mico J.A., Berrocoso E. Monoaminergic system and depression. Cell. Tissue Res. 377: 107–113. 2019.
Gripois D., Fernandez C. Effects of thyroid hormones on the evolution of monoamine oxidase activity in the brain and heart of the developing rat. Enzyme. 22: 378–384. 1977.
Mendoza A., Hollenberg A.N. New insights into thyroid hormone action. Pharmacol. Ther. 173: 135–145. 2017.
Прошин С.Н., Глушаков Р.И., Карпова И.В., Козырко Е.В., Лебедев А.А., Михеев В.В. Динамика проявления экспериментально измененного тиреоидного статуса у самок мышей линии С3Н-А. Рос. физиол. журн. им. И.М. Сеченова. 100(4): 473–486. 2014. [Proshin S.N., Glushakov R.I., Karpova I.V., Kozyrko E.V., Lebedev A.A., Mikheev V.V. The time course of experimentally altered thyroid status manifestations in female C3H-A mice. Russ. J. Physiol. 100(4): 473–486. 2014. (In Russ)].
Proshin S., Bagaturiya G., Karpova I., Kurbanov R., Glushakov R. Unequal Hormonal Response of Male and Female C3H-A Mice to the Thyroid and Antithiroid Agent Treatements. Georgian Med. News. 11(284): 128–132. 2018.
Kizer J.S., Humm J., Nicholson G. The effects of castration, thyroidectomy and haloperidol upon the turnover rates of dopamine and norepinephrine and the kinetic properties of tyrosine hydroxylase in discrete hypothalamic nuclei of the male rat. Brain Res. 146: 95–107. 1978.
Mullur R., Liu Y.Y., Brent G.A. Thyroid hormone regulation of metabolism. Physiol. Rev. 94(2): 355–382. 2014.
Карпова И.В., Михеев В.В., Марышева В.В., Курицына Н.А., Бычков Е.Р., Шабанов П.Д. Динамика изменений состояния моноаминергических систем головного мозга мышей под влиянием острой гипоксии с гиперкапнией. Биомед. химия. 65(6): 485–497. 2019. [Karpova I.V., Mikheev V.V., Marysheva V.V., Kuritsyna N.A., Bychkov E.R., Shabanov P.D. Dynamics of changes in the state of monoaminergic systems of the brain of mice under the influence of acute hypoxia with hypercapnia. Biomed. Chem. 65(6): 485–497. 2019. (In Russ)].
Blum M., Ott T. Animal left–right asymmetry. Current Biol. 28(7): R301–R304. 2018.
Molochnikov I., Cohen D. Hemispheric differences in the mesostriatal dopaminergic system. Front. Syst. Neurosci. 8: 110. 2014.
Leret M.L., Fraile A. Influence of thyroidectomy on brain catecholamines during the postnatal period. Compar. Biochem. Physiol. 83: 117–121. 1986.
Nakahara T., Matsumoto T., Hirano M. Effects of DN-1417, a thyrotropin releasing hormone analog, on dopaminergic neurons in rat brain. Peptides. 6: 1093–1099. 1985.
Bliss E.L., Ailion J. Relationship of stress and activity to brain dopamine and homovanillic acid. Lif. Sci. 10: 1161–1169. 1971.
Rastogi R.B., Singhal R.L., Lapierre Y.D. Thyrotropin releasing hormone potentiates the effects of imipramine on brain serotonergic system. Brain Res. Bull. 7: 449–451. 1981.
Frazer A., Pandey G., Mendels J., Neeley S., Kane M., Hess M.E. The effect of tri-iodothyronine in combination with impramine on [3H]-cyclic AMP production in slices of rat cerebral cortex. Neuropharmacology. 13(12): 1311–1340. 1974.
Schultz J. Psychoactive drug effects on a system which generates cyclic AMP in brain. Nature. 261: 417–418. 1976.
Perumal A.S., Halbreich U., Barkai A.I. Modification of beta-adrenergic receptor binding in rat brain following thyroxine administration. Neurosci. Lett. 48: 217–221. 1984.
Stahl S.M. Stahl’s essential psychopharmacology: neuroscientific basis and practical application. 4th Edition. Cambridge. Cambridge Univer. Press. 2013.
Heuer H., Schäfer M.K., O’Donnell D., Walker P., Bauer K. Expression of Thyrotropin-Releasing Hormone Receptor 2 (TRH-R2) in the Central Nervous System of Rats. J. Compar. Neurol. 428(2): 319–336. 2000.
Tejani-Butt S.M., Yang J., Kaviani A. Time course of altered thyroid states on 5-HT1A receptors and 5-HT uptake sites in rat brain: an autoradiographic analysis. Neuroendocrinology. 57: 1011–1018. 1993.
Sandrini M., Vitale G., Vergoni A.V. Effects of acute and chronic treatment with triiodothyronine on serotonin levels and serotonergic receptor subtypes in the rat in the rat brain. Life Sci. 58: 1551–1559. 1996.
Arnt J., Hyttel J. Facilitation of 8-OHDPAT-induced forepaw treading of rats by the 5-HT2 agonist. Eur. J. Pharmacol. 161(1): 45–51. 1989.
Tunnicliff G. Molecular basis of buspirone’s anxiolytic action. Pharmacol. Toxicol. 69: 149–156. 1991.
Brochet D., Martin P., Soubrie P., Simon P. Effects of triiodothyronine on the 5-hydroxy-tryptophan-induced head twitch and its potentiation by antidepressants in mice. Eur. J. Pharmacol. 112: 411–414. 1985.
Heuer H., Schäfer M.K., Bauer K. Thyrotropin-releasing hormone (TRH), a signal peptide of the central nervous system. Acta Med. Austriaca. 26(4): 119–122. 1999.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


