Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 1, стр. 119-132
Анализ парадоксальных нейрофизиологических реакций на разных этапах восприятия отрицательных эмоциональных стимулов у больных шизофренией
В. Б. Стрелец 1, Г. И. Родионов 1, М. К. Нурбеков 2, В. Л. Ушаков 3, А. Ю. Архипов 1, *
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
3 НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: arhip76@bk.ru
Поступила в редакцию 14.11.2020
После доработки 28.11.2020
Принята к публикации 07.12.2020
Аннотация
Статья посвящена исследованию активации мозга на нейтральные и эмоционально значимые (угрожающие) стимулы методом вызванных потенциалов мозга у здоровых и больных параноидной шизофренией. Показано, что угрожающие стимулы, как более значимые, вызывают большую активацию (укорочение латентности и увеличение амплитуды) в затылочных и задневисочных областях на эти стимулы по сравнению с нейтральными у обеих групп испытуемых при внутригрупповом исследовании. Через 200 мс это имело место в правом, через 300 мс – в левом, а через 400 мс – снова в правом. При этом у больных, начиная с волны Р200, в ответ на значимые стимулы отмечался эффект, который с точки зрения физиологии является парадоксальным. Так, через 200 мс после предъявления стимула в левой нижнелобной области наблюдалось увеличение и амплитуды, и латентности волны Р200, и уменьшение обоих этих параметров в правой лобной и центральной областях по средней линии. Через 300 мс после стимула парадоксальные эффекты в виде увеличения обоих параметров отмечались в левой префронтальной и правой нижнелобной и уменьшения – в левой нижнелобной и центральной областях по средней линии. Через 400 мс парадоксальные эффекты наблюдались в левой префронтальной и правой нижнелобной области в виде увеличения обоих параметров, и в правой префронтальной области в виде их уменьшения. Межгрупповое сравнение, показавшее, что у больных имеет место либо увеличение, либо уменьшение по сравнению с нормой обоих параметров всех компонентов вызванных потенциалов, начиная с волны Р200, то есть патологическое состояние передних мозговых областей в ответ на данную категорию стимулов, что может быть обусловлено несколькими альтернативными факторами. Это может быть объяснено нарушением нейронных связей из-за патологического процесса абберантного прунинга у больных шизофренией.
Шизофрения характеризуется нарушением практически всех психических функций: восприятия, внимания, памяти, мышления, а также моторных функций и выраженным нарушением поведения. При параноидной шизофрении особенно актуально нарушение аффективного восприятия. Эмоциональные реакции представляют собой наиболее древнюю форму взаимодействия живых существ с окружающей действительностью [1]. По мере прогресса в развитии человека и усложнения его отношений с внешней средой развивается когнитивная функция, причем между ними существует неразрывная связь. В данном эволюционном процессе неизбежно присутствуют исключения, выходящие из рамок нормальной психической деятельности, обусловленные некоторыми “сбоями” функций мозга. Одним из таких побочных эффектов эволюционного развития является шизофрения, основными проявлениями которой являются нарушение эмоциональной и дефицит когнитивной сфер. Начало данного заболевания, как правило, проявляется в продуктивных симптомах – возникновение бреда и галлюцинаций, которые являются синдромами первого ранга [2, 3] и составляют классический вариант данного типа патологии [4].
Являясь неотделимой частью быстро развивающейся когнитивной функции, эмоциональная функция в ряде случаев оказывается недостаточной для полноценного развития психической деятельности, что наблюдается при шизофрении. Фундаментальной основой данной патологии является комплексное нарушение биологических механизмов деятельности мозга на разных уровнях: молекулярно-генетическом, физиологическом и поведенческом, что выражается в дисфункции нейромедиаторов, нарушении вызванной биоэлектрической активности мозга и психопатологических показателей. Описаны многочисленные биохимические и молекулярно-генетические нарушения при шизофрении. Прежде всего это отклонения в дофаминергической системе [5], которая играет важную роль в различных мозговых функциях: контроль и модуляция движений [6], когнитивные функции [7], а также мотивационное и эмоциональной поведение [8]. Известно, что уровень дофамина в восходящих дофаминовых проекциях мезолимбической системы (черная субстанция, вентральный стриатум) повышен, важное значение имеет прилежащее ядро, интегрирующее сигналы из лимбической системы, т.к. она получает возбудительные глутаматергические проекции от префронтальной коры, билатеральной миндалины и гиппокампа [9] (возвратные связи). Продуктивные симптомы могут возникать не только из-за нарушений функций дофамина в мезолимбических структурах D2-рецепторов, но и в связи с нарушениями D1-рецепторов в префронтальной коре [10]. Данные нарушения могут быть вторичными по отношению к синаптическим связям в коре. Важное значение имеет прунинг – элиминация синапсов в лобной коре в пубертатный период [11]. У больных прунинг происходит то в больших, то в меньших объемах чем у здоровых. Таким образом, имеет место либо увеличение, либо уменьшение синаптических связей у больных по сравнению с нормой. Предположительно уменьшение синаптических связей приводит к возникновению негативных симптомов, а увеличение – к позитивным, в результате чего создается следующая картина: хотя синапсов больше, они функционально недостаточны для нормального проведения и обработки информации [12]. Соответственно, наблюдаемый патологический обмен нейромедиаторов приводит к таким продуктивным симптомам, как бред и псевдогаллюцинации.
Также установлено, что глутамато-дофаминовое и дофамино-глутаматовое взаимодействие и их связь с ГАМК-ергическими системами могут быть релевантны к патофизиологии шизофрении. Дофаминовая нейротрансмиссия поражает префронтальные пирамидные нейроны через модуляцию ГАМК-интернейронов [13]. Многочисленные работы, свидетельствуют также о нарушении при данном заболевании биоэлектрической активности мозга, в основе которого лежит дисбаланс нейромедиаторных систем и, как следствие этого, нарушение передачи информации в мозге [14–16]. Таким образом, при шизофрении на всех уровнях ЦНС имеют место патологические особенности, которые в конечном счете могут приводить к нарушениям психической деятельности.
Применение вызванных потенциалов (ВП) мозга открыло новую главу как в исследованиях механизмов здорового мозга, так и в исследовании его нарушений при шизофрении. Компоненты ВП отражают разные этапы процесса восприятия внешних и внутренних раздражителей. Происходит последовательная оценка физических свойств стимулов, что отражается в ранних компонентах ВП, затем оценивается их значимость по прошлому опыту, причем значимость включает эмоциональную и смысловую составляющие [17].
С физическими параметрами стимулов закономерно связаны изменения активации мозговых структур, обусловливающие параметры (амплитуду и латентность) ранних сенсорных компонентов ВП (до 100 мс) [18]. Промежуточные между ранними и поздними компонентами ВП (100–200 мс) отражают автоматическую “ориентировочную” реакцию на стимул, отличающийся от фоновых по своей интенсивности или частоте предъявления или являющийся неожиданным и необыкновенно ярким (salient) [19]. Биоэлектрическую реакцию мозга на подобные стимулы называют “негативностью рассогласования”; она также связана с автоматическими изменениями уровня активации корковых структур [20]. На позднем этапе восприятия (принятие перцептивного решения) высокая активация возникает на стимулы, к которым привлекается внимание, то есть, когда они становятся “релевантными” [21]. Существует две системы обработки информации “top-down” и “bottom-up” [22]. Первая система обработки информации “задается” психологической инструкцией, вторая система основана на последовательном анализе поступающей информации.
Целью данной работы явился анализ физиологических реакций мозговых структур на внешние раздражители разной значимости у больных шизофренией, относящихся к четко очерченной группе в состоянии психоза, с бредом и псевдогаллюцинациями. Для этого использовался метод исследования ВП, развивающихся в мозге на предъявление нейтральных и отрицательных эмоциональных стимулов в виде картин из международной системы IAPS (International Affective Picture System).
Мы исследовали больных с параноидным синдромом, а именно, с преобладанием бреда и галлюцинаций, находящихся вне терапии нейролептиками. Анализ ВП мозга на сложные стимулы (эмоционально-отрицательные картины) позволяет оценить у них состояние эмоционально-когнитивной сферы, высказать предположения о механизмах галлюцинаторно-параноидного синдрома и определить его биологические маркеры.
На те же стимулы, которые применялись для исследования ВП, проводился сравнительный нейровизуализационный анализ активации различных мозговых структур методом функциональной магнитно-резонансной томографии (фМРТ) в норме и при шизофрении [23].
МЕТОДЫ ИССЛЕДОВАНИЯ
Испытуемые. Исследование проводилось на базе Психиатрической больницы Клиника Роса (отделение острых психозов). В группу больных вошли 39 человек (21 мужчина и 18 женщин), страдающих шизофренией в психотическом периоде с галлюцинаторно-параноидным синдромом, в возрасте от 18 до 37 лет. Диагноз ставился врачами-психиатрами отделения острых психозов по Международной классификации МКБ‑10 категория F20.0. Общая сумма баллов выраженности психопатологических симптомов, определялась по шкале PANSS, и у пациентов она составляла 97.1 ± 3.1. Все пациенты были с первым психотическим приступом и не получали нейролептического антипсихотического лечения.
В качестве контрольной группы было исследовано 32 здоровых испытуемых (18 мужчин и 14 женщин) в возрасте от 20 до 35 лет. В исследование отбирались как в группу контроля, так и в группу больных шизофренией, соматически здоровые правши со 100%-ным или скорректированным до 100% зрением. Статистически значимых различий по полу, возрасту и уровню образования между исследованными группами обнаружено не было (р > 0.01).
Проведенные исследования следуют принципам Хельсинской декларации и одобрены Этическим комитетом Института высшей нервной деятельности и нейрофизиологии РАН. Все испытуемые давали письменное согласие на участие в исследовании. Исследование проводилось в имплицитной ситуации.
Стимулы и методика предъявления. Мы выбрали в качестве стимульного материала равное количество нейтральных и угрожающих изображений системы IAPS, адаптированных для российской выборки. Всего предъявлялось 120 стимулов, 60 из которых были нейтральными, и 60 – эмоционально значимыми. Порядок предъявления стимулов – псевдослучайный. Время предъявления стимула составляло 1000 мс, межстимульный интервал определялся в псевдослучайной последовательности от 1.5 до 3 с.
Процедура записи. В обеих группах – больные и контроль – испытуемым предъявляли стимулы на экране 14-дюймового монитора на расстоянии 0.75 м от испытуемого, сидящего в кресле перед компьютером в затемненной комнате. Весь эксперимент проводился при пассивном восприятии стимулов, то есть в имплицитной ситуации.
Запись вызванных потенциалов. Электроэнцефалограмма (ЭЭГ) регистрировалась с использованием 24-канального усилителя фирмы МБН (Россия) от 19 отведений (модифицированная схема постановки электродов 10–20%) с Ag/AgCl электродами. В качестве референтного отведения использовался объединенный ушной электрод, заземляющий электрод располагался в центре лба. Частота квантования 200 Гц, импеданс – ниже 10 кОм. Фильтры низких частот были установлены на 70 Гц, фильтры высоких частот – на 0.5 Гц, режекторный фильтр 50 Гц.
Обработка и анализ данных. Проводилось удаление окулографических артефактов и исключение эпох с миографическими, двигательными и иными артефактами. Предстимульный интервал составлял 300 мс, постстимульный – 700 мс. После усреднения вызванных потенциалов по группам испытуемых и выделения интересующих компонент, в индивидуальных потенциалах с шагом 5 мс находили экстремумы максимальной пиковой амплитуды, наиболее приближенные по латентности к максимальному по амплитуде экстремуму ВП в интервалах от 100 до 200 мс, от 170 до 250 мс и от 270 до 340 мс. Таким способом выделялись ранние (Р100 и N170), промежуточные или среднелатентные (Р200) и поздние (Р300 и N400) компоненты ВП.
Далее проводился статистический анализ пиковой латентности и амплитуды компонентов P300 и N400 от всех отведений с помощью программы STATISTICA 8.0. Для проверки экспериментальной гипотезы о наличии межгрупповых различий использовали критерий Манна–Уитни, для анализа внутригрупповых различий (для двух экспериментальных условий) – критерий Вилкоксона. Анализировались только достоверные различия (при p < 0.05) в двух экспериментальных ситуациях – при внутригрупповом сравнении (эксперимент 1) и при межгрупповом сравнении (эксперимент 2). Анализировались только те отведения, в которых статистически значимыми были оба параметра ВП латентность и амплитуда.
Снижение латентности и увеличение амплитуды компонентов в данной области рассматривалось как показатель усиленной активации на более значимые (угрожающие) стимулы по сравнению с менее значимыми (нейтральными), противоположные изменения параметров – как показатель сниженной активации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Внутригрупповое сравнение
Ранние компоненты ВП (Р100, N170).
А. Здоровые испытуемые. У здоровых испытуемых значимые отличия между латентностью волны Р100 на нейтральные и угрожающие стимулы не обнаружены; различия в амплитуде данного компонента на эти стимулы также отсутствует. Значимых отличий между компонентом N170 на стимулы двух категорий значимости у здоровых не выявлено ни по одному из параметров. Реакция отсутствует в имплицитной ситуации.
Б. Больные шизофренией. У больных шизофренией латентность компонента Р100 в правой теменной области (Р4) на угрожающие стимулы больше, а амплитуда меньше, чем на нейтральные, что указывает на торможение на значимые стимулы.
Значимых отличий между компонентом N170 на стимулы двух категорий у больных шизофренией, так же как у здоровых, не выявлено ни по одному из параметров.
Промежуточный между ранними и поздними, среднелатентный компонент Р200.
А. Здоровые испытуемые. Латентность компонента Р200 на угрожающие стимулы была короче, чем на нейтральные в правой нижневисочной (Т6) и правой затылочной (О2) областях. Амплитуда этого компонента была выше в тех же областях: правой нижневисочной (Т6) и правой затылочной (О2), что указывает на процесс активации в данных областях.
Б. Больные шизофренией. Латентность на угрожающие стимулы была короче, чем на нейтральные, в следующих областях: правая лобная (F4), правая затылочная (О2), правая нижневисочная (Т6), средняя центральная (Сz). В левой передне-височной области (F7), напротив, наблюдалось увеличение латентности на угрожающие стимулы.
Амплитуда компонента Р200 у больных шизофренией была больше на угрожающие стимулы, чем на нейтральные, в правой нижневисочной (Т6) и правой затылочной (О2) областях. У больных, так же как у здоровых, наблюдалась активация правой височной и затылочной областей. Но в левой передне-височной (F7) области у больных наряду с увеличением латентности наблюдалось также увеличение амплитуды волны Р200 на угрожающие стимулы, а в правой лобной (F4) и средней центральной (Сz) областях, напротив, обнаружено уменьшение амплитуды и латентности на угрожающие стимулы. Таким образом, в F7, F4, Cz в ответ на угрожающие стимулы наблюдался парадоксальный эффект.
Поздние компоненты ВП (Р300, N400).
А. Здоровые испытуемые. Латентность компонента Р300 была меньше на угрожающие стимулы, чем на нейтральные, в левой нижне-височной (Т5) и левой затылочной (О1) областях. Амплитуда компонента Р300 на угрожающие стимулы была больше, чем на нейтральные, в левой нижне-височной и левой затылочной областях, то есть, в тех же областях, в которых имела место более короткая латентность, то есть наблюдалась активация левой нижне-височной и левой затылочной областей на значимые стимулы.
Латентность компонента N400 у здоровых была меньше, а амплитуда больше в правой нижне-височной (Т6) и правой затылочной (О2) областях, это свидетельствовало об активации правых нижнее-височной и затылочной областей в ответ на значимые стимулы.
Б. Больные шизофренией. Латентность компонента Р300 у больных так же, как у здоровых была меньше, а амплитуда больше на угрожающие, чем нанейтральные стимулы, в левой нижне-височной (Т5) и левой затылочной (О1) областях. Это свидетельствовало о том, что как и в норме, наблюдалась активация левой височной и левой затылочной областей в ответ на угрожающие стимулы.
Латентность компонента N400 у больных была меньше, а амплитуда больше в правой нижне-височной (Т6) и правой затылочной (О2) областях в ответ на угрожающие стимулы по сравнению с нейтральными, то есть как и в норме происходила активация правых височной и затылочной областей при действии угрожающих стимулов.
Таким образом, средние и поздние компоненты ВП (Р200, Р300 и N400) как у здоровых, так и у больных шизофренией обнаружили изменения параметров, свидетельствующие о наличии у обеих групп более высокого уровня активации в ответ на угрожающие стимулы по сравнению с нейтральными сначала в правых, затем в левых и потом снова в правых височной и затылочной областях (рис. 1–2).
Рис. 1.
Левая затылочная область (О1) у здоровых испытуемых, повышение активации на угрожающие стимулы (увеличение амплитуды и укорочение латентности). Сплошная линия – угрожающие стимулы, пунктирная линия – нейтральные стимулы. Fig. 1. Left occipital region (O1) in healthy subjects, increased activation to threatening stimuli (increased amplitude and shortened latency). Solid line – threatening stimuli, dotted line – neutral stimuli).
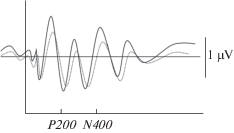
Рис. 2.
Правая затылочная область (О2) у больных шизофренией, повышение активации на угрожающие стимулы (увеличение амплитуды и укорочение латентности). Сплошная линия – угрожающие стимулы, пунктирная линия – нейтральные стимулы. Fig. 2. Right occipital region (O2) in patients with schizophrenia, increased activation to threatening stimuli (increased amplitude and shortened latency). Solid line – threatening stimuli, dotted line – neutral stimuli.
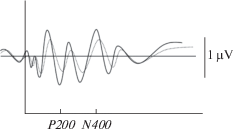
Однако у больных отмечались парадоксальные с точки зрения физиологии эффекты: на волне Р200 в левой лобной (F3), на компонентах Р300 и N400 – левой префронтальной (Fp1) и правой лобно-височной (F8) областях в виде увеличения на более значимый стимул обоих параметров ВП (амплитуды и латентности). В правой лобной (F4), центральной по средней линии Cz (на волне Р200), правой лобной (F7) и центральной по средней линии (Cz) (на компоненте Р300) и правой префронтальной (Fp2) (на компоненте N400) Парадоксальный эффект отмечался в виде уменьшения обоих параметров на более значимый стимул (рис. 3–4).
Рис. 3.
Левая префронтальная область (Fp1) у больных шизофренией, парадоксальный эффект с увеличением обоих параметров ВП (латентности и амплитуды). Сплошная линия – угрожающие стимулы, пунктирная линия – нейтральные стимулы. Fig. 3. Left prefrontal area (Fp1) in patients with schizophrenia, paradox effect with an increase in both EP parameters (latency and amplitude). Solid line – threatening stimuli, dotted line – neutral stimuli.
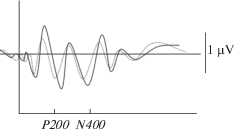
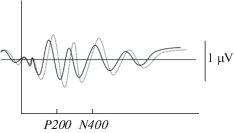
Рис. 4.
Центральная теменная область (Cz) у больных шизофренией, парадоксальный эффект с уменьшением обоих параметров ВП (латентности и амплитуды). Сплошная линия – угрожающие стимулы, пунктирная линия – нейтральные стимулы. Fig. 4. Central parietal region (Cz) in schizophrenic patients, a paradox effect with a decrease in both EP parameters (latency and amplitude). Solid line – threatening stimuli, dotted line – neutral stimuli.
Межгрупповое сравнение
Ранние компоненты ВП (Р100, N170).
У больных шизофренией в ответ на угрожающие стимулы и латентность и амплитуда компонента N170 в лобных областях были больше, чем у здоровых, то есть наблюдалось парадоксальное состояние нейронных сетей на угрожающие стимулы.
Средний компонент Р200.
У больных шизофренией в ответ на нейтральные стимулы и латентность и амплитуда волны Р200 в правой и центральной теменных областях (Р4, Рz), а также правой центральной (С4) были меньше, а в правой лобной (F4) больше, чем у здоровых что свидетельствовало о парадоксальном состоянии нейронных сетей при действии нейтральных стимулов.
При этом в левой височной и левой нижне-височной областях (Т3, Т5) у больных отмечались более короткая латентность и более высокая, чем у здоровых амплитуда на нейтральные стимулы, что свидетельствует о повышенной по сравнению с нормой активации при действии нейтральных стимулов через 200 мс после стимула.
В ответ на угрожающие стимулы у больных оба параметра в центральных левой и по средней линии (C3, Cz) областях были меньше, а в лобных левой и центральной (F7, Fz) больше, чем у здоровых (парадоксальное состояние нейронных сетей через 200 мс на угрожающие стимулы).
Поздние компоненты ВП (Р300, N400).
У больных шизофренией на волне Р300 оба параметра ВП при действии нейтральных стимулов были больше, чем у здоровых в левой префронтальной области (Fp1) и меньше, чем у здоровых в левых передне-височной (F7), и центральных левой (С3), и по средней линии (Сz) областях, то есть имело место парадоксальное состояние нейронных сетей через 300 мс после начала стимуляции.
На угрожающие стимулы на волне Р300 наблюдалось увеличение обоих параметров стимулов в следующих областях: правых префронтальной (Fр2) и верхне-височной (F8), центральных левой (С3) и по средней линии (Cz), то есть выявлялось парадоксальное состояние нейронных сетей через 300 мс после начала стимуляции.
На волне N400 в ответ на нейтральные стимулы и латентность и амплитуда у больных были больше, чем у здоровых, в левой (Fр1), правой верхне-височной (F8) и теменной области по средней линии (Pz), а в правых префронтальной (Fр2) и височной областях оба эти параметра были меньше, что свидетельствовало о парадоксальном состоянии нейронных сетей при нейтральных стимулах через 400 мс.
Через 400 мс после начала стимуляции оба параметра этой волны в ответ на угрожающий стимул у больных были больше, чем у здоровых в левой префронтальной (Fр1) и правой височной (Т6) областях, и меньше, чем в норме – в правой префронтальной области (Fр2) что свидетельствовало о парадоксальном состоянии нейронных сетей при действии угрожающих стимулов через 400 мс.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашем исследовании показано, что угрожающие стимулы, как более значимые, вызывали большую активацию (укорочение латентности и увеличение амплитуды) в затылочных и задневисочных областях по сравнению с нейтральными у обеих групп испытуемых.
При внутригрупповом исследовании и у больных и у здоровых на значимые, отрицательные эмоциональные стимулы наблюдалась более выраженная активация височной и затылочной областей. Через 200 мс это имело место в правом, через 300 мс – в левом, а через 400 мс – снова в правом полушарии. Более высокая активация связана с более быстрой обработкой информации в нервных структурах и большим числом нейронов, участвующих в данной реакции [24].
При этом у больных, начиная с волны Р200, в ответ на значимые стимулы отмечался эффект, который с точки зрения физиологии является парадоксальным. Так, через 200 мс после предъявления стимула в F7 было увеличение и амплитуды и латентности волны Р200 и уменьшение обоих этих параметров в F4, F7 и Cz. Через 300 мс после стимула парадоксальные эффекты в виде увеличения обоих параметров отмечались в Fp1 и F8 и уменьшения – в F7 и Cz. Через 400 мспарадоксальные эффекты наблюдались в Fp1 и F8 в виде увеличения обоих параметров и в Fp2 в виде их уменьшения.
Таким образом, как в норме, так и у больных с первым эпизодом психоза с галлюцинаторно-параноидным синдромом в имплицитной ситуации отрицательные эмоциональные стимулы как более значимые вызывали повышенную (по сравнению с нейтральными стимулами) активацию височных и затылочных областей попеременно правого и левого полушарий. Это свидетельствует о сохранности при шизофрении основных механизмов мозговой оценки значимости раздражителей.
Однако наряду с этим, парадоксальные в физиологическом аспекте эффекты указывают на наличие у них патологического механизма, который обусловливает, с одной стороны, более медленную обработку информации (увеличение латентности), а с другой стороны – участие в реакции на данный раздражитель большего числа нейронов (увеличение амплитуды). Таким образом, сочетаются как бы обе противоположные характеристики состояния мозга – и возбуждение и торможение. Тот же самый смысл имеет и обратное сочетание – более быстрая обработка информации (уменьшение латентности) и понижение числа нейронов, участвующих в реакции (уменьшение амплитуды), которое также имеет место у больных. Представляет интерес, что все эти парадоксальные эффекты происходят в передних областях мозга, (преимущественно в лобных и префронтальных), ответственных за формирование бредовых переживаний [25]. Фронтальные области получают информацию от височных проекций, и роль “височного входа” очень велика при восприятии стимулов всех модальностей, так как он “фильтрует” все поступающие сигналы [26].
В то же время в обработке этой информации принимают участие и другие области коры и подкорковые структуры, а также корково-подкорковые связи. Особенно велика роль функции подкорковых, в частности, лимбических структур в эмоциональной сфере. MacLean считал, что эмоции определяются связями между филогенетически более старыми и новыми структурами мозга. В частности, по его мнению, в гиппокампе имеет место ассоциация висцеральных ощущений с восприятием физических характеристик внешнего стимула [27]. Сейчас описанные MacLean и Papez мозговые системы дополнены другими коррелятами эмоциональной переработки стимулов, но полностью подтверждены взгляды этих авторов на лимбическую систему как центр определения наиболее неожиданных и ярких (salient) стимулов в окружающей среде [28]. Особо важную роль в регуляции эмоций играет миндалина, которая получает информацию от всех сенсорных модальностей и участвует также в восприятии, памяти и познавательной деятельности [29, 30].
При шизофрении выявлено множество фактов, свидетельствующих о нарушении эмоциональной и когнитивной переработки стимулов. Методом фМРТ у больных не было выявлено нейронных коррелятов повышения активации левой миндалины, которое имело место у здоровых, хотя и те и другие испытывали схожие психологические реакции в ответ на предъявление лиц с грустным и счастливым выражением [31]. Целый ряд работ позволяет считать отсутствие адекватной активации миндалин эндотипическим признаком шизофрении с преобладанием параноидного синдрома [32, 33]. Однако в отдельных работах разницы в распознавании нейтральных и эмоциональных лиц у здоровых и больных шизофренией не обнаружено [34]. Причины расхождений могут быть разнообразными – малые выборки, гендерные различия, различия в медикаментозной терапии и разная степень привыкания к стимулам, что также оказывает влияние на выраженность активации. Однако в настоящее время доказано, что наибольшую роль в нарушении эмоциональной регуляции играет состояние префронтальной и орбито-фронтальной коры, тормозящее влияние которой определяет адекватные эмоциональные реакции.
ВП мозга из всех современных методов позволяют более точно получить сведения о физиологических механизмах восприятия в норме и его нарушении при патологии мозга [35]. В частности, это связано с тем, что псевдогаллюцинации, имеющиеся при шизофрении, по сути, и есть нарушение процесса восприятия, а ВП мозга представляют собой восприятие на физиологическом уровне.
Причина нарушений активации мозговых структур, возможно, кроется в дисбалансе этого процесса, проявляющемся при межгрупповом сопоставлении полученных данных.
При межгрупповом сравнении получены следующие результаты.
Самые ранние компоненты ВП не обнаруживают значимых отклонений от нормы в параметрах ВП, поскольку исследование проведено в имплицитной ситуации и не связано с влиянием инструкции. Из ранних компонентов ВП у здоровых и больных различия наблюдались только по компоненту N170 в ответ на угрожающие стимулы: и латентность и амплитуда этого компонента у больных были больше, чем в норме, в лобных областях (F7, F8). Это можно характеризовать как парадоксальное состояние мозговых структур, участвующих в реакции лобных областей на данном периоде восприятия, которое имеет место при шизофрении.
У больных шизофренией латентность волны Р200 при действии нейтральных стимулов в Т3 и Т5 была меньше, а амплитуда больше, чем у здоровых, то есть при шизофрении имеет место патологическая активация височных областей левого полушария. Патологическое состояние височного входа в кору очень характерно для шизофрении [36].
Кроме того, на волне Р200 парадоксальное состояние мозговых структур у больных шизофренией наблюдается при действии нейтральных стимулов в F4, где и латентность и амплитуда данного компонента были больше, чем у здоровых, и в С4, Р3 и Рz, где оба параметра были меньше, чем у здоровых. В ответ на угрожающие стимулы парадоксальное состояние мозговых структур при шизофрении отмечается в F7 и Fz, где параметры волны Р200 были больше, чем в норме, и в C3 и Cz, где оба параметра ВП у больных были меньше.
Тот факт, что компонент Р200 в ответ на нейтральные стимулы у больных имеет и большую латентность и большую амплитуду, чем у здоровых в правой лобной области (F4), свидетельствует о том, что в этой области проведение информации у больных замедлено по сравнению с нормой, но в реакции участвует больше нейронов – то есть в этой области отмечается парадоксальное состояние, при котором обработка информации производится медленнее, чем в норме, но в реакции участвует больше нейронов, чем в норме. Тот факт, что у больных отмечается более низкое по сравнению с нормой значение обоих параметров компонента Р200 в правых центральной и теменной, а также в теменной по средней линии областях, свидетельствует о более быстром у них проведении информации, которое, однако, осуществляется при участии в реакции меньшего, чем в норме, числа нейронов.
Волна Р200 является очень важным компонентом ВП, на котором происходит синтез информации о физических параметрах стимула и его значимости в прошлом опыте субъекта [18]. Таким образом, на этом этапе при шизофрении имеют место как нарушения оценки параметров стимулов, так и его значимости. Важнейшим последствием такой неадекватной оценки является неполноценная физиологическая основа возникновения субъективного ощущения, которое также формируется на данном этапе. Для его преодоления, по-видимому, и необходима дополнительная по сравнению с нормой активация височного входа на фоновые стимулы, которая способствует правильному распознаванию стимулов разной значимости, так как на этом этапе осуществляется реакция узнавания.
Изменение активации на нейтральные стимулы у больных шизофренией обнаруживается через 200 мс после предъявления стимулов. Во-первых, на волне Р200 отмечается повышенная по сравнению с нормой активация височных областей левого полушария (Т3, Т5). Таким образом, при шизофрении уже в этот временной период требуется более высокая активация для прохождения “височного входа” в кору даже для нейтральных стимулов, что соответствует представлению о нарушении его функции [36]. Известно также, что многие проявления неадекватной реакции на значимые стимулы у больных могут быть связаны именно с нарушением этой реакции на незначимые “фоновые” стимулы [37]. Во-вторых, волна Р200 в лобной области (F4) обнаруживает парадоксальный эффект в виде увеличения и латентности и амплитуды, а в правых центральной и теменной (С4, Р4), а также в теменной по средней линии (Сz) – уменьшение этих параметров.
У волны Р300 в Fp1 оба параметра – и латентность и амплитуда в ответ на нейтральные стимулы при шизофрении были больше, а в С3, F7 и Cz – меньше, чем в норме. На угрожающие стимулы в Fp2, F3, F8 и C4 оба эти параметра у больных были больше, чем у здоровых.
Латентность и амплитуда волны N400 при действии нейтральных стимулов у больных шизофренией в Fp1, F8 и Р4 были больше, а в Fp2 и Т6 – меньше, чем у здоровых. При угрожающих стимулах в Fp1 и Т6 оба эти параметра у больных были больше, а в Fp2 – меньше, чем в норме.
Полученные данные указывают на наличие при шизофрении парадоксального состояния мозговых структур в передних областях, то есть, на этапе восприятия, выраженном волной Р200, с одной стороны, обработка информации является более быстрой, чем в норме, а с другой – число клеток, участвующих в реакции, у больных меньше, чем в норме.
Это парадоксальное состояние мозговых структур, по-видимому, и обусловливает парадоксальные эффекты патологической активации на значимые и незначимые стимулы, обнаруживающуюся при внутригрупповом сравнении.
На более поздних этапах восприятия (Р300, N400) эта дополнительная активация уже не требуется. Однако парадоксальное по сравнению с нормой состояние мозговых структур в реакции на нейтральные стимулы продолжается, поскольку на волне Р300 имеет место увеличение обоих параметров стимула в левой префронтальной (Fp1) и уменьшение их в левых лобной и центральной и центральной по средней линии областях (F7, C3, Cz). Продолжает сохраняться патологическое состояние и на волне N400: на нейтральные стимулы в виде увеличения обоих параметров стимулов в левой префронтальной, правых лобной и теменной областях (Fp1, F8, P4) и уменьшения их в правых префронтальной и височной (Fp2, T6) областях.
На угрожающие стимулы патологическое состояние на волне Р300 остается в виде увеличения по сравнению с нормой обоих параметров этой волны в правой префронтальной, левой лобной (Fp2, P3), правых центральной (С4) и верхне-височной (F8) областях, а на волне N400 – в виде увеличения обоих параметров в левой префронтальной (Fp1) и правой височной (Т6) областях и уменьшения их в правой префронтальной (Fp2) области.
Р300 отражает процесс принятия перцептивного решения; в данной имплицитной ситуации у обеих групп сохраняется активация сенсорных областей как проекционных зон зрительного анализатора и “височного входа” в кору левого и попеременно полушария, что сочетается у больных с наличием парадоксальных эффектов в передних областях коры.
И, наконец, на волне N400, по-видимому, происходит проверка правильности восприятия “конгруэнтности” [38] путем одинаковой активации сенсорных областей и “височного входа” правого полушария, но с “подключением” у больных парадоксальных эффектов в передних областях обоих полушарий.
В нашем раннем исследовании фМРТ [23] этим же больным предъявлялись такие же угрожающие и нейтральные стимулы что и для ВП. Полученные результаты указывают на то, что у здоровых префронтальная кора участвовала в дифференцировании двух типов стимулов уже на ранних этапах их предъявлении, и в дальнейшем на значимые стимулы реакция осуществлялась темпоро-париетально-окципитальными областями. У больных дифференцирование на раннем этапе осуществлялось без участия префронтальной коры, в результате чего на заключительном этапе опознание значимых стимулов осуществлялось с участием этой структуры, что требовало энергетических затрат, ресурсы которых ограничены. Кроме того было выявлено, что у больных активировалось больше структур лимбической системы, и их уровень активации был выше по сравнению с нормой, тогда как тормозная функция префронтальной коры была снижена.
ВЫВОДЫ
1. В ответ на эмоционально-отрицательные стимулы, как более значимые, наблюдалась активация в затылочных и задневисочных областях у больных шизофренией и здоровых испытуемых.
2. У больных при внутригрупповом сравнении обнаружено одновременное увеличение латентности и амплитуды ВП на значимые стимулы по сравнению с нейтральными в лобных областях, что не является конгруэнтным как для процесса возбуждения, так и для торможения.
3. При межгрупповом сравнении у больных выявлено повышение по сравнению со здоровыми обоих параметров компонентов ВП в лобных областях в ответ на значимые стимулы.
4. Как при внутригрупповом, так и при межгрупповом сравнении у больных шизофренией было обнаружено одновременное уменьшение и латентности и амплитуды ВП в центральных и височных областях коры мозга.
5. Выявленные у больных шизофренией парадоксальные проявления в виде одновременного увеличения или уменьшения обоих параметров компонентов ВП связаны с обнаруженными нами при исследовании фМРТ [23] изменениями в виде увеличения активации структур лимбической системы и снижения тормозной функции префронтальной коры.
Список литературы
Darwin Charles. The Expression of the Emotions in Man and Animals. London. John Murray. 1872.
Тиганов А.С. Руководство по психиатрии. Т. 1. М. Медицина. 1999. [Tiganov A.S. Psychiatric Guide. Vol. 1. Moscow. Medicine. 1999. (In Russ)].
Ясперс К. Общая психопатология. М. Практика. 1997. [Jaspers K. General psychopathology. Moscow. Practice. 1997. (In Russ)].
Bleuler E. Dementia Praecox or the Group of Schizophrenias. Leipzig und Wien. Franz Deuticke. 1911.
Oliver D., Howes Shitij Kapur. The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway. Schizophr. Bull. 35(3): 549–562. 2009.
Gepshtein S., Xiaoyan L., Snider J., Plank M., Lee D., Poizner H. Dopamine Function and the Efficiency of Human Movement. J. Cognitive Neurosci. 26(3): 645–657. 2014.
Pillon B., Czernecki V., Dubois B. Dopamine and cognitive function. Current Opin. Neurol. 16(2): S17–S22. 2003.
Chiew K.S., Braver T.S. Positive affect versus reward: emotional and motivational influences on cognitive control. Front. Psychol. 2: 279. 2011.
Gigg J., Tan A.M., Finch D.M. Glutamatergic hippocampal formation projections to prefrontal cortex in the rat are regulated by GABAergic inhibition and show convergence with glutamatergic projections from the limbic thalamus. Hippocampus. 4(2): 189–198. 1994.
Okubo Y., Suhara T., Suzuki K., Kobayashi K., Inoue O., Terasaki O., Someya Y., Sassa T., Sudo Y., Matsushima E., Iyo M., Tateno Y., Toru M. Decreased prefrontal dopamine D1 receptors in schizophrenia revealed by PET. Nature. 385(6617): 634–636. 1997.
McAllister A.K. Dynamic aspects of CNS synapse formation. Annu. Rev. Neurosci. 30: 425–450. 2007.
Faludi G., Mirnics K. Synaptic changes in the brain of subjects with schizophrenia. Int. J. Dev. Neurosci. 29(3): 305–309. 2011.
Heinz A., Schlagenhauf F. Dopaminergic dysfunction in schizophrenia: salience attribution revisited. Schizophr. Bull. 36: 472–485. 2010.
Ford J.M. Studying Auditory Verbal Hallucinations Using the RDoC framework. Psychophysiology. 53(3): 298–304. 2016.
Стрелец В.Б., Архипов А.Ю. Влияние угрожающих стимулов на компонент вызванных потенциалов Р200 у больных параноидной шизофренией. Физиология человека. 41(5): 66–73. 2015. [Strelets V.B., Arkhipov A.Yu. Influence of threatening stimuli on the P200 component of evoked potentials in patients with paranoid schizophrenia. Human Physiology. 41(5): 66–73. 2015. (In Russ)].
Sanfratello L., Houck J.M., Calhoun V.D. Relationship between MEG global dynamic functional network connectivity measures and symptoms in schizophrenia. Schizophr. Res. 2019.
Clementz B.A, Geyer M.A, Braff D.L. P50 suppression among schizophrenia and normal comparison subjects: A methodological analysis. Biol. Psychaitry. 41: 1035–1044. 1997.
Иваницкий А.М., Стрелец В.Б., Корсаков И.А. Информационные процессы мозга и психическая деятельность. Наука. 1984. [Ivanitsky A.M., Strelets V.B., Korsakov I.A. Informational processes of the brain and mental activity. Nauka. 1984. (In Russ)].
Hillyard S.A., Vogel E.K., Luck S.J. Sensory gain control (amplification) as a mechanism of selective attention: Electrophysiological and neuroimaging evidence. Philosoph. Transact. Royal Soc.: Biol. Sci. 353: 1257–1270. 1998.
Näätänen R., Pakarinen S., Rinne T., Takegata R. The mismatch negativity (MMN): towards the optimal paradigm. Clin. Neurophysiol. 115: 140–144. 2007.
Polich J. Clinical application of the P300 event-related potential. Phys. Med. Rehab. Clinics. 15: 133–161. 2004.
Ochsner K.N., Ray R.R., Hughes B., McRae K., Cooper J.C., Weber J., Gabrieli J.D., Gross J.J. Bottom-up and top-down processes in emotion generation common and distinct neural mechanisms. Psychol. Sci. 20(11): 1322–1331. 2009.
Arkhipov A.Y., Maslennikova A.V., Ushakov V.L., Strelets V.B. FMRI on affective stimuli in patients with paranoid schizophrenia. Curr. Trends Biomed. Eng. & Biosci. 7(4): 555718. 2017.
Woodman G.F. A Brief Introduction to the Use of Event-Related Potentials (ERPs) in Studies of Perception and Attention. Atten. Percept. Psychophys. 72 (8): 2031–2046. 2010.
Gonzalez-Burgos G., Cho R.Y., Lewis D.A. Alterations in cortical network oscillations and parvalbumin neurons in schizophrenia. Biol. Psychiatry. 77(12): 1031–1040. 2015.
Burwell R.D. The parahippocampal region: corticocortical connectivity. Ann. N.Y. Acad. Sci. 911: 25–42. 2000.
MacLean P.D. Some psychiatric implications of physiological studies on frontotemporal portion of limbic system (visceral brain). Electroencephal. Clin. Neurophysiol. 4: 407–418. 1957.
Дягтерев В.П., Перцов С.С. Нейрофизиология. Москва. ГЭОТАР-Медиа. 2018. [Dyagterev V.P., Pertsov S.S. Neurophysiology. Moscow. GEOTAR-Media.2018. (In Russ)].
LeDoux J. The emotional brain, fear, and the amygdala. Cell. Mol. Neurobiol. 23(4–5): 727–738. 2003.
Симонов П.В. Эмоциональный мозг. Москва. Наука. 1981. [Simonov P.V. The emotional brain. Moscow. Nauka. 1981. (In Russ)].
Weiss U., Salloum J.B., Schneider F. Correspondence of emotional self-rating with facial expression. Psychiatry Res. 86(2): 175–184. 1999.
Kosaka H., Omori M., Murata T., Iidaka T., Yamada H., Okada T., Takahashi T., Sadato N., Itoh H., Yonekura Y., Wada Y. Differential amygdala response during facial recognition in patients with schizophrenia: an fMRI study. Schizophr. Res. 57: 87–95. 2002.
Fernandez-Egea E., Parellada E., Lomena F., Falcon C., Pavia J., Mane A., Horga G., Bernardo M. FDG PET study of amygdalar activity during facial emotion recognition in schizophrenia. Eur. Arch. Psychiatry Clin. Neurosci. 260: 69–76. 2010.
Holt D.J., Boeke E.A., Coombs G. 3rd, DeCross S.N., Cassidy B.S., Stufflebeam S., Rauch S.L., Tootell R.B. Abnormalities in personal space and parietal-frontal function in schizophrenia. Neuroimage Clin. 9: 233–243. 2015.
Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. Таганрог. ТРТУ. 1997. [Gnezditsky V.V. Evoked brain potentials in clinical practice. Taganrog. TRTU. 1997. (In Russ)].
Horn D., Ruppin E. Compensatory mechanisms in an attractor neural network model of schizophrenia. Neural. Comput. 7(1): 182–205. 1996.
Horton H.K., Silverstein S.M. Visual context processing deficits in schizophrenia: effects of deafness and disorganization. Schizophr. Bull. 37(4): 716–726. 2011.
Kutas M., Federmeier K.D. N400. Scholarpedia. 4: 7790. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


