Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1194-1208
Индуктор шаперонов U133 устраняет ангедонию и препятствует развитию нейродегенерации в моноаминергических эмоциогенных структурах головного мозга в модели доклинической стадии болезни Паркинсона у пожилых крыс
И. В. Екимова 1, *, М. Б. Пази 1, **, С. Г. Полоник 2, Д. В. Белан 1, Ю. Ф. Пастухов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова
Дальневосточного отделения Российской академии наук
Владивосток, Россия
* E-mail: irina-ekimova@mail.ru
** E-mail: pazi.mari@mail.ru
Поступила в редакцию 12.03.2021
После доработки 07.04.2021
Принята к публикации 08.04.2021
Аннотация
Болезнь Паркинсона (БП) – нейродегенеративное заболевание преимущественно пожилых людей, которое до сих пор относится к числу неизлечимых. На сегодняшний день эффективные нейропротекторы, пригодные для лечения пациентов с БП, отсутствуют. Ранее нами показано, что проведение терапии с препаратом U133, индуцирующим синтез белков теплового шока Hsp70 и HSP40 в головном мозге, препятствует развитию нейродегенерации в нигростриатной системе и устраняет нарушения сна при моделировании БП у животных. В данном исследовании мы оценили антидепрессантные свойства превентивной терапии с U133, а также ее нейропротективные эффекты на моноаминергические эмоциогенные структуры головного мозга на модели доклинической стадии БП у пожилых крыс Вистар (20 мес.), созданной с помощью интраназального введения ингибитора протеасом лактацистина. В работе показано, что внутрибрюшинное введение U133 пожилым животным приводит к отставленному во времени (через 3–7 сут) повышению уровня Hsp70 (HSPA1) в вентральной области покрышки среднего мозга и голубом пятне. Проведение превентивной терапии с U133 устраняло признаки депрессивно-подобного поведения в виде симптома ангедонии, формирующегося в динамике доклинической стадии БП у пожилых крыс. Выяснено, что антидепрессант-подобный эффект индуктора шаперонов U133 обусловлен способностью шаперона Hsp70 ослаблять процесс нейродегенерации и нейровоспаления в дофаминергической мезолимбической системе вознаграждения и норадренергической системе голубого пятна. Полученные данные являются фундаментальным обоснованием для разработки новой молекулярной технологии превентивной терапии БП и ангедонии различного генеза на основе индукторов шаперонов.
ВВЕДЕНИЕ
Болезнь Паркинсона (БП) – мультисистемное хроническое прогрессирующее нейродегенеративнoe заболевание, которое занимает второе место по частоте встречаемости после болезни Альцгеймера. Вероятность наступления БП повышается в геометрической прогрессии с возрастом у лиц старше 65 лет [1]. Это может свидетельствовать о том, что старение, в комбинации с генетическими факторами и факторами окружающей среды, предрасполагает к развитию этого типа болезни [2]. В связи с увеличением продолжительности жизни прогнозируется, что в течение ближайших 20–30 лет число пациентов с БП возрастет почти 2 раза [3].
БП проявляется классической триадой моторных нарушений в виде симптомов гипокинезии, мышечной ригидности, тремора покоя. Эти симптомы лежат в основе диагностики БП и возникают в результате прогрессирующей гибели большей части дофамин (ДА)-ергических нейронов в черной субстанции, которые не восстановить, и полное излечение в этой стадии уже невозможно. У большинства пациентов моторные симптомы сочетаются с нарушением сна, эмоциональными расстройствами и когнитивным дефицитом, которые могут опережать на несколько лет и более моторные проявления заболевания [4–8]. Широкий спектр немоторных нарушений связан с развитием нейродегенеративного процесса в экстранигральных структурах головного мозга, который зарождается в продромальный (доклинический) период развития БП [9].
Одним из наиболее частых и клинически значимых нервно-психических нарушений при БП является депрессия, которая встречается в среднем у 35% пациентов [8, 10]. Считается, что ДА-ергическая система, и, в частности, рецепторы D2, играют немаловажную роль не только в фундаментальных механизмах проявления симптомов депрессии, но и в формировании временной структуры депрессивных состояний [11, 12]. Среди характерных симптомов депрессии при БП отмечена ангедония (потеря чувства удовольствия и стремления к получению удовольствия), которая выявляется в среднем у 45.7% случаев БП и может коррелировать с другими признаками депрессии (апатия, повышенная тревожность, снижение работоспособности) [8]. Возникновение симптомов ангедонии у части пациентов БП может предшествовать моторным проявлениям БП в клинической стадии; больные с депрессивным расстройством имеют примерно в 2 раза больший риск развития БП в течение последующих 4–6 лет, чем группа контроля [8, 13]. Патофизиологические изменения в головном мозге, лежащие в основе ангедонии при БП, до сих пор неясны. Предполагается, что решающую роль в ее развитии при БП играет дисфункция моноаминергических восходящих систем вследствие нейродегенерации ДА-ергических нейронов ключевого компонента “системы вознаграждения” вентральной области (ВО) покрышки среднего мозга, а также отчасти норадренергических (НА) нейронов голубого пятна ствола головного мозга [14–16].
Для борьбы с нейродегенеративными заболеваниями во всем мире активно разрабатываются принципы превентивной медицины, которые основаны как на доклиническом выявлении заболевания, так и на последующей нейропротективной терапии, способной реально предотвратить прогрессирование болезни и снизить инвалидность трудоспособного населения. Однако технологии доклинической идентификации и нейропротективной фармакотерапии БП еще не создано. С целью облегчения дифференциальной диагностики БП в сложных клинических случаях и для оценки степени нарушения функционального состояния ЦНС разрабатываются новые подходы для анализа свойств непроизвольных колебаний (тремора), возникающих при выполнении человеком определенной двигательной задачи [17], а также различные нейровизуализационные методы исследования. Отсутствие на сегодняшний день эффективных нейропротекторов, пригодных для лечения пациентов с БП, частично связано с тем, что доклинические испытания ряда соединений проводились на животных молодого и среднего возраста в моделях БП. Для ускорения поиска эффективных нейропротективных соединений, которые можно применить на доклинической стадии БП, разрабатываются адекватные модели у пожилых животных.
В настоящее время общепризнано, что молекулярной основой развития нейродегенерации при БП является нарушение укладки белка α-синуклеина, приводящее к накоплению в нейронах его токсичных олигомеров [18]. Это происходит в результате недостаточной активности молекулярных механизмов конформационного контроля со стороны системы шаперонов HSP70 и деградации аномальных белков с помощью убиквитин-протеасомной системы (УПС) [19, 20]. Ранее в лаборатории впервые созданы модели доклинической стадии БП у крыс Вистар среднего и пожилого возраста на основе ослабления активности УПС. В этих моделях выявлен ряд признаков нарушений сна, депрессивно-подобного поведения и когнитивного дефицита, сигнализирующих о начавшихся патологических изменениях в головном мозге [2, 21–25]. В настоящее время стресс-индуцируемый шаперон Heat Shock Proteins 70 kDa (Hsp70), препятствующий неправильной укладке белков, а также его фармакологические индукторы, рассматриваются как перспективная нейропротективная стратегия при БП и других нейродегенеративных заболеваниях [26]. Апробированные индукторы Hsp70 природного и синтетического происхождения (селастрол, куркумин, вальпроевая кислота, гелданамицин, аримокломол и др.), наряду с достоинствами, обладают рядом недостатков (побочные токсические эффекты, плохая растворимость и проходимость через гематоэнцефалический барьер и др.) [26]. Поэтому поиск безопасных индукторов Hsp70 для лечения нейродегенеративных заболеваний активно продолжается. Недавно в нашей лаборатории оценен нейропротективный потенциал нового индуктора шаперонов хиноидного соединения U133 на моделях БП у животных. Выяснено, что соединение U133, вызывающее повышение синтеза Hsp70 и HSP40, препятствует развитию α-синуклеиновой патологии и нейродегенерации в нигростриатной системе и устраняет нарушения сна при моделировании доклинической и клинической стадий БП у крыс среднего и пожилого возраста [27, 28]. Какие изменения происходят при этом в проявлении признаков ангедонии и нейродегенерации в моноаминергических эмоциогенных структурах головного мозга, незвестно.
Задача настоящего исследования – выяснить, способен ли индуктор шаперонов U133 препятствовать развитию нейродегенеративного процесса в ДА-ергической мезолимбической системе и НА-ергической системе голубого пятна и тем самым устранять депрессивно-подобное поведение, формирующееся в доклинической стадии БП у пожилых крыс.
Животные
Опыты проводились на крысах-самцах популяции Вистар пожилого возраста (20 мес.), массой тела 400–450 г. Животных содержали в стандартных условиях вивария Института эволюционной физиологии и биохимии РАН по 5 особей в клетке при температуре окружающей среды 24 ± 1°С и свободном доступе к воде и пище. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям, принятым биоэтическим комитетом по охране животных Института эволюционной физиологии и биохимии РАН.
В опытах использовали индуктор шаперонов хиноидное соединение U133 (ацетилированный трис-О-глюкозид эхинохрома), которое было синтезировано в Тихоокеанском институте биоорганической химии им. Г.Б. Елякова ДВО РАН путем глюкозилирования эхинохрома (2,3,5,7,8-пента-гидрокси-1,4-нафтохинона) – природного пигмента морских ежей [29, 30]. Для оценки Hsp70-индуцирующей активности соединения U133, его растворяли в 20 мкл диметилсульфоксида (DMSO), доводили до объема 0.2 мл 0.9%-ным раствором NaCl и вводили животным (n = 15) внутрибрюшинно (в/б) в дозе 5 мг/кг. Контрольным крысам (n = 15) вводили в/б 0.2 мл 0.9%-ный раствор NaCl с добавлением 20 мкл DMSO. Содержание Hsp70 исследовали в ВО покрышки среднего мозга и голубом пятне через 1, 3, 7, 9 и 12 сут после введения 0.9%-ного раствора NaCl + DMSO (контрольная группа) и U133 (экспериментальная группа). В эксперименте было проанализировано пять групп животных в разных временных точках (1, 3, 7, 9 и 12 сут). В каждой временной точке было по 3 животных для контрольной группы и 3 животных для экспериментальной.
Вестерн-блот
Изменение содержания Hsp70 в ВО покрышки среднего мозга и голубом пятне после введения U133 оценивали методом Вестерн-блот. Пробы тканей головного мозга лизировали с использованием High RIPA буфера и гомогенизировали. Белки разделяли с помощью электрофореза в полиакриламидном геле, затем переносили на PVDF-мембрану Immobilon-P (Millipore Corporation, США). Для предотвращения неспецифического связывания антител полоски мембран инкубировали в блокирующем растворе (PBS с добавлением 0.1% Tween-20 и 3% бычьего сывороточного альбумина) в течение 1 ч. Для иммуномечения применяли первичные моноклональные антитела мыши к индуцибельному белку Hsp70 (1 : 1000; Abcam, Великобритания). В качестве контроля нагрузки использовали GAPDH (моноклональные антитела мыши, 1 : 1000; Abcam, Великобритания). Визуализацию сигнала проводили с использованием протокола хемилюминесценции с применением реактива Novex ECL HRP Chemiluminescent Substrate Reagent Kit (Invitogen, США). Анализ количества белка осуществляли с помощью денситометрии с использованием программы ImageJ. Уровень белка интереса Hsp70 был скорректирован по фоновому сигналу и нормирован на сигнал GAPDH.
Создание модели доклинической стадии БП
Для создания пролонгированной модели доклинической стадии БП у пожилых крыс использовали ранее разработанный протокол интраназального введения специфического ингибитора ферментативной активности протеасом лактацистина (ЛЦ; Enzo, США) [23]. ЛЦ растворяли в апирогенном фосфатном буфере (рН 7.4; PBS) и вводили крысам (n = 8) интраназально в каждую ноздрю в дозе 100 мкг/8 мкл дважды с интервалом 7 дней. За два введения каждое животное получала 400 мкг ЛЦ. Контрольной группе животных (n = 8) вводили растворитель ЛЦ интраназально (8 мкл PBS) и растворитель U133 в/б (0.2 мл 0.9%-ного раствора NaCl с добавлением 20 мкл DMSO).
Проведение терапии с индуктором шаперонов U133
Соединение U133 вводили крысам (n = 8) в/б в дозе 5 мг/кг и объеме 0.2 мл 0.9%-ного раствора NaCl с добавлением 20 мкл DMSO трижды: через 4 ч после каждого введения ЛЦ, а также через 7 дней после последнего введения ЛЦ. Контрольной группе животных (n = 8) вводили 8 мкл PBS интраназально и в/б 0.2 мл 0.9%-ного раствора NaCl с добавлением 20 мкл DMSO.
Последующая оценка терапевтического эффекта соединения U133 проводилась в трех экспериментальных группах: 1. Контрольная группа (n = 8). 2. Группа животных в модели доклинической стадии БП (n = 8). 3. Группа животных в модели доклинической стадии БП, получавших терапию с U133 (n = 8).
Тест на предпочтение сахарозы
Для выявления симптома ангедонии был проведен тест на предпочтение сахарозы по стандартной методике [31] в модификации. Для определения базального уровня предпочтения сахарозы проводили фоновое тестирование за 2 дня до начала эксперимента. Экспериментальное тестирование проводили через 21 день после первого введения ЛЦ. Во время проведения теста животные содержались в одиночных клетках при температуре окружающей среды 24 ± 1°С и фотопериоде 12 : 12 ч. Во избежание стрессирования животных, предварительной депривации воды или пищи не проводили. Животным в течение 24 ч предоставляли свободный доступ к двум идентичным шариковым поилкам объемом 200 мл, одна из которых содержала питьевую воду, вторая – 2%-ный раствор сахарозы в питьевой воде. Перед тестированием и после его окончания объем жидкостей (водопроводной воды и раствора сахарозы в воде) в поилках измеряли с помощью мерной колбы на 200 мл. Предпочтение сахарозы рассчитывали по формуле:
Иммуногистохимическое исследование
После окончания теста на предпочтение сахарозы животных наркотизировали золетилом (Zoletil®; внутримышечно, 60 мг/кг) декапитировали и извлекали головной мозг. Головной мозг фиксировали в 4%-ном растворе параформальдегида при температуре 4°С в течение 5 дней, промывали в PBS и переносили в 20%-ный раствор сахарозы при температуре 4°С для криопротекции. Через 3–5 дней мозг замораживали в изопентане при температуре –45°С и хранили при –80°С. Чередующиеся серии фронтальных срезов вентрального стриатума и ВО покрышки среднего мозга (10 мкм) и голубого пятна (20 мкм) подготавливали на криостате Leica (Германия) в соответствии с атласом головного мозга крысы [32]. В работе использовали биотин-стрептавидиновый метод, описанный ранее [23, 27], с применением первичных кроличьих поликлональных антител против ТГ (1 : 700, Abcam, Великобритания), против Iba-1 (1 : 200, Abcam, Великобритания) и вторичных биотинилированных антител против иммуноглобулинов кролика (1 : 350, Vector Lab., США) и стрептавидин-пероксидазного комплекса (1 : 400, VectorLab, США). Специфичность иммуногистохимической реакции проверяли негативным контролем без первичных или вторичных антител.
Изображения изучаемых структур головного мозга в проходящем свете получали с помощью микроскопа Сarl Zeiss (Германия) со встроенной видеокамерой Imager 4.1, и программного обеспечения для захвата изображения AxioVision-4.7.2. (в jpg или tiff форматах). Подсчет количества иммунопозитивных к ТГ нейронов в ВО покрышки, их аксонов в вентральном стриатуме, НА-ергических нейронов в голубом пятне и Iba1-иммунопозитивных микроглиоцитов проводили визуальным методом с помощью программы PhotoM (http://www.t_lambda.chat.ru). По каждому животному анализировали 10–12 снимков ВО покрышки и голубого пятна на одном уровне исследуемых зон от каждого животного, разделенных примерно 70-ю мкм. На снимке стандартной площадью, захватываемой камерой светового микроскопа, обводили ТГ-иммунопозитивные нейроны с видимым ядром. Количество клеток приходилось на стандартную площадь ткани, захватываемой камерой светового микроскопа. Для голубого пятна площадь составила 365 мм2 (объектив ×20), вентральной области покрышки среднего мозга 1443 мм2 (объектив ×10).
Рис. 1.
Изменение содержания индуцибельного белка теплового шока Hsp70 в вентральной области покрышки среднего мозга (а) и голубом пятне (b) у пожилых крыс через 1, 3, 7, 9, 12 дней (Day 1, 3, 7, 9, 12) после внутрибрюшинного введения соединения U133.

Определение количества выживших ТГ-иммунореактивных терминалей в вентральном стриатуме выполнялось с помощью программы ImageJ (NIH, США). По каждому животному сделано 4–5 микрофотографий для каждой из четырех условно-выделенных областей вентрального стриатума стандартной площадью 92 мм2 (объектив ×40). Результаты по изменению количества ДА-ергических нейронов и их аксонов представлялись в виде среднего арифметического ±m.
Полуколичественный анализ оптической плотности ТГ-иммунореактивного вещества в нейронах ВО покрышки среднего мозга проводился с использованием программного обеспечения PhotoM. Иммунногистохимическую реакцию выполняли одновременно в контрольной и экспериментальной группах. От каждого животного анализировали по пять срезов на одном уровне исследуемых зон. На каждом снимке стандартной площадью 365 мм2 (объектив ×20) обводили ТГ-иммунопозитивные нейроны с видимым ядром. Оптическая плотность, отражающая содержание иммунопозитивного вещества, рассчитывалась как разница между интенсивно окрашенными нейронами, содержащими иммунореактивное вещество, и интенсивностью окраски фона (не содержащего иммунореактивного вещества) на том же срезе. Результаты были представлены в относительных единицах оптической плотности на мкм2.
Статистический анализ
Анализ всех полученных результатов осуществлялся с помощью программы Statistica 7.0. Нормальность распределения проверяли с помощью теста Колмогорова–Смирнова. Анализ данных, имеющих распределение, отличное от нормального, проводили с помощью непараметрического критерия Краскела–Уоллиса; в качестве post-hoc критерия применен ранговый критерий Ньюмана–Кейлса. Статистическую обработку данных, распределенных нормально, выполняли с помощью дисперсионного анализа ANOVA с последующим post-hoc анализом с помощью критерия Тьюки HSD. Различия результатов между группами считались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Системное введение соединения U133 повышает уровень Hsp70 в эмоциогенных структурах головного мозга
На первом этапе работы необходимо было оценить Hsp-70-индуцирующую активность соединения U133 в стареющем мозге у пожилых животных. Проведенное исследование показало, что после внутрибрюшинного введения U133 максимальное увеличение содержания белка Hsp70 в ВО покрышки среднего мозга и голубом пятне отмечалось на 7-е сутки после инъекции; прирост Hsp70 в ВО покрышки составил 121% (р ≤ 0.05), голубом пятне 33% (р ≤ 0.05) по сравнению с контролем. Повышенный уровень Hsp70 сохранялся в течение последующих 2–3 сут.
В верхней части рис. 1 представлены репрезентативные иммуноблоты вентральной области покрышки среднего мозга (VTA) и голубого пятна (Locus C.). На графике по вертикали – оптическая плотность Hsp70, % от контроля. ANOVA с последующим post-hoc анализом с помощью критерия Тьюки HSD. Достоверность различий в опыте относительно контроля * – p < 0.05.
Применение Hsp70-индуцирующей терапии с U133 устраняет признаки депрессивно-подобного поведения в модели доклинической стадии болезни Паркинсона у пожилых крыс
Проведенные ранее нами исследования показали, что модель доклинической стадии БП у пожилых крыс воссоздает у животных ранние нарушения сна (гиперсомния, фрагментации сна), которые поддаются коррекции при проведении терапии с препаратом U133 [28]. В многочисленных клинических исследованиях продемонстрирована тесная связь нарушений сна и развития депрессии, позволяющая говорить о наличии общих патофизиологических механизмов этих расстройств. Это позволило нам предположить, что терапия с индуктором шаперонов U133 может корректировать не только нарушения сна, но и признаки депрессивно-подобного поведения, характерные для модели доклинической стадии БП у пожилых животных. Проведенное исследование показало, что у животных в модели доклинической стадии БП на 21-й день после первого введения ЛЦ отмечается снижение предпочтения сладкого раствора сахарозы по сравнению с контрольными животными (рис. 2а). Более того, когда учитывалось общее потребление сахарозы, было выяснено, что модельные животные имели пониженное потребление сахарозы, судя по снижению объема выпитого подслащенного раствора (рис. 2b). При этом разницы в объеме потребляемой воды не наблюдалось по сравнению с контролем (рис. 2с). В совокупности полученные данные указывают на наличие у крыс в модели доклинической стадии БП ключевого депрессивного симптома ангедонии. Терапия с U133 устраняла гедонистический дефицит и животные предпочитали пить подслащенную воду так же охотно, как и нормальные крысы в контрольной группе, при этом возрастало количество потребляемой сахарозы при неизменном количестве потребляемой воды по сравнению с группой животных в модели БП, не получавших терапию (рис. 2).
Рис. 2.
Изменения в предпочтении раствора сахарозы (a), потреблении количества сахарозы (b) и воды (c) у крыс пожилого возраста в модели доклинической стадии болезни Паркинсона при проведении терапии с U133. Control – введение контрольного раствора, LC – модель болезни Паркинсона, LC + U133 – терапия с U133 в модели болезни Паркинсона. Применен непараметрический критерий Краскела–Уоллиса; в качестве post-hoc критерия – ранговый критерий Ньюмана–Кейлса. Значения достоверны в опыте относительно контроля * – p < 0.05; LC + U133 по сравнению с LC # – p < 0.05; ## – p < 0.01.

Терапия с U133 препятствует развитию нейродегенерации и ослабляет признаки нейровоспаления в моноаминергических эмоциогенных структурах головного мозга в модели доклинической стадии болезни Паркинсона у пожилых крыс
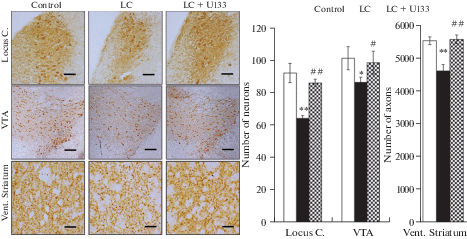
При проведении патоморфологического анализа, выполненного после окончания теста на предпочтение сахарозы, выяснено, что развитие признаков депрессивно-подобного поведения в модели доклинической стадии БП у пожилых крыс сопряжено с развитием нейродегенеративного и нейровоспалительного процессов в эмоциогенных структурах головного мозга. Количество ТГ-иммунопозитивных нейронов было уменьшено на 15% (p < 0.05) в ВО покрышки среднего мозга и на 30% (p < 0.01) в голубом пятне. Развитие процесса нейродегенерации в ВО покрышки сопровождалось уменьшением на 17% (p < 0.01) количества ДА-ергических аксонов в вентральном стриатуме, играющем ключевую роль в механизмах формирования удовольствия и вознаграждения у грызунов и человека [14]. Курсовое введение U133 препятствовало развитию нейродегенеративного процесса в эмоциогенных структурах головного мозга при моделировании у животных доклинической стадии БП (рис. 3).
Рис. 3.
Влияние терапии с U133 на процесс нейродегенерации в вентральной области покрышки (VTA) среднего мозга, вентральном стриатуме (Vent. Striatum) и голубом пятне (Locus С.) в модели доклинической стадии болезни Паркинсона у пожилых крыс. Световая микроскопия: ТГ-иммунореактивные нейроны (VTA, Locus С.) и аксоны (Vent. Striatum). Масштаб: 100 мкм – VTA, Locuc C., 200 мкм – Vent. Striatum. На графике по вертикали – количество ТГ-иммунореактивных нейронов и аксонов. Control – введение контрольного раствора, LC – модель доклинической стадии болезни Паркинсона, LC + U133 – проведение терапии с U133 в модели. Здесь и на рис. 4 и 5 проведен дисперсионный анализ ANOVA с последующим post-hoc анализом с помощью критерия Тьюки HSD. Значения достоверны в опыте относительно контроля * – p < 0.05; ** – p < 0.01; LC + U133 по сравнению с LC # – p < 0.05; ## – p < 0.01.
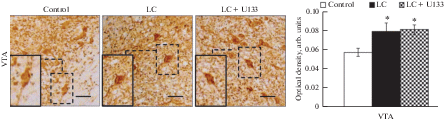
Для того, чтобы оценить влияние индуктора шаперонов U133 на компенсаторные процессы, направленные на поддержание уровня дофамина в мезолимбической системе, был проведен анализ содержания ТГ в нейронах ВО покрышки среднего мозга. У животных в модели доклинической стадии БП в ДА-ергических нейронах ВО покрышки верифицировано увеличение содержания ТГ на 38% (p < 0.05) по сравнению с контролем, что может свидетельствовать о компенсаторном повышении скорости синтеза дофамина в выживших нейронах. Проведение терапии с U133 не препятствовало развитию компенсаторных реакций, направленных на поддержание уровня дофамина в ВО покрышки у модельных животных; уровень ТГ в ВО оставался повышенным, как и у модельных животных, не получавших терапию с U133 (рис. 4).
Рис. 4.
Влияние терапии с U133 на содержание тирозингидроксилазы в нейронах вентральной области (VTA) покрышки среднего мозга у пожилых крыс в модели доклинической стадии болезни Паркинсона. Световая микроскопия: ТГ-иммунореактивные нейроны в VTA (масштаб 25 мкм). На графике по вертикали – оптическая плотность, условные единицы.
Control – введение контрольного раствора, LC – модель доклинической стадии болезни Паркинсона, LC + U133 – терапия с U133 в модели.
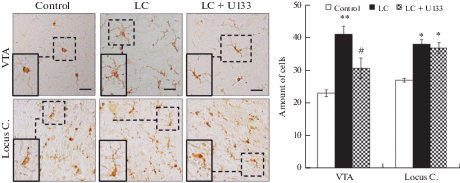
Характерным признаком БП является развитие хронического нейровоспаления (т.е. реактивный микроглиоз и инфильтрация лимфоцитов) в нигростриатной и экстранигральных структурах головного мозга, которое провоцируют олигомеры α-синуклеина, высвобождающиеся во внеклеточное пространство из пораженных нейронов [18]. В нашей работе выяснено, что в ЛЦ-индуцированной модели доклинической стадии БП у пожилых крыс увеличивается количество активированных микроглиоцитов в ВО покрышки на 59% (p < 0.05) и на 43% (p < 0.05) в голубом пятне по сравнению с контролем, что указывает на развитие реактивного микроглиоза. Применение терапии с U133 предотвращало развитие микроглиоза ВО покрышки и не оказывало заметного влияния на микроглиз в голубом пятне (рис. 5).
Рис. 5.
Изменение числа активированных микроглиоцитов в вентральной области покрышки (VTA) среднего мозга и голубом пятне (Locus C.) при проведении терапии с U133 в модели доклинической стадии болезни Паркинсона у пожилых крыс. Световая микроскопия: Iba1-иммунореактивные микроглиоциты в VTA и Locus C. Масштаб: 50 мкм. На графике по вертикали – количество Iba1-иммунореактивных микроглиоцитов. Control – введение контрольного раствора, LC – модель доклинической стадии болезни Паркинсона, LC + U133 – проведение терапии с U133 в модели.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спорадической формой БП страдают преимущественно пожилые люди (старше 65 лет). Разработка новой стратегии нейропротективной фармакотерапии БП этой возрастной категории – одна из самых сложных задач. Это обусловлено возрастными изменениями в нейрохимической композиции нейронов центральной и периферической нервной системы, симпатической иннервации периферических органов, сложностями, связанными с повышенной чувствительностью к лекарственным препаратам и развитием побочных эффектов при терапии [2, 33–35]. Кроме того, молекулярно-генетические изменения в стареющем мозге (снижение уровня и активности транскрипционного фактора HSF1, скорости транскрипции генов hsp70 и синтеза АТФ-зависимых шаперонов) снижают надежность регуляции клеточного протеостаза [2, 36, 37]. Поэтому при испытаниях новых терапевтических соединений и фармпрепаратов возрастные изменения должны учитываться при переносе результатов доклинических исследований на стареющего человека.
Недавно в лаборатории создана модель доклинической стадии БП у пожилых крыс [21–25], которая по своим патоморфологическим и нейрохимические признакам соответствует основным требованиям, предъявляемым к животным моделям. Cоздание такой модели обеспечило проведение мониторинга функционального состояния головного мозга, позволяющего выявить ранние нарушения сна и повышенный уровень тревожности.
Проведенное исследование показало, что у пожилых животных в модели доклинической стадии БП развиваются признаки депрессивно-подобного поведения в виде симптома ангедонии, о чем свидетельствует снижение желания у крыс получать удовольствие от подслащенной сахарозой воды по сравнению с контрольной группой, которые предпочитали пить подслащенную воду. Об этом указывает и пониженное потребление животными сахарозы при неизменной разнице в объеме потребляемой воды по сравнению с контрольной группой. Патоморфологический анализ эмоциогенных структур головного мозга на модели доклинической стадии БП позволил нам предположить, что патофизиологической основой симптома ангедонии является развитие нейродегенеративного и нейровоспалительного процессов в ДА-ергической системе ВО покрышки среднего мозга и НА-ергической системе голубого пятна, которые включены в механизмы формирования эмоционального поведения у грызунов и человека [15, 38]. Подтверждением этого может быть доказанная эффективность агониста дофаминовых рецепторов прамипексола и противовоспалительных препаратов (целекоксиб, миноциклин) не только и не столько в лечении депрессии в целом, сколько в устранении именно ангедонии различного генеза, в том числе и при БП [39, 40]. Выявленный в нашем исследовании симптом ангедонии может рассматриваться как ранний немоторный маркер БП у пожилых лиц, сигнализирующий о начавшейся дисфункции моноаминергических восходящих систем головного мозга.
Ранее нами показано, что системное введение U133 (5 мг/кг) крысам среднего возраста приводит через 1 сут к значимому возрастанию уровня Hsp70 в черной субстанции и стриатуме вследствие активации транскрипционного фактора HSF1 [27]. При введении такой же дозы U133 пожилым животным Hsp70-индуцирующий эффект соединения был отставлен во времени и максимальный прирост Hsp70 в ВО покрышки среднего мозга и голубом пятне наблюдался лишь к 7 суткам. Повышенный уровень Hsp70 сохранялся в течение 3-х последующих дней, что является подходящим для длительного применения этого индуктора с целью терапии. Причиной запаздывания синтеза Hsp70 может быть возрастное снижение скорости транскрипции индуцибельных генов белка теплового шока Hsp70 в головном мозге вследствие снижения уровня и активности HSF1, запускающего экспрессию гена hsp70. Ранее сообщалось, что возраст влияет на индуцируемую, но не базальную экспрессию генов белков теплового шока HSP70; выяснено, что скорость транскрипции hsp70 снижается почти на 60% в стареющих фибробластах человека [41] и на 66% в старых Т-лимфоцитах в сравнении с молодыми при действии теплового шока [36]. При этом отмечалось снижение уровня HSF1.
Проведенное исследование показало, что курсовое введение U133 препятствовало проявлению признаков ангедонии и сниженному потреблению сахарозы у пожилых крыс в модели доклинической стадии БП. Эти данные демонстрируют, что индуктор шаперонов U133 оказывает действие, подобное антидепрессанту. Антидепрессантный эффект индуктора белков теплового шока геранилгеранилацетона (тепренона) выявлен и другими исследователями в модели депрессии у мышей, вызванной стрессом социального поражения [42]. Коррекция депрессивно-подобного поведения с помощью Hsp70-индуцирующей терапии в модели доклинической стадии БП связана в первую очередь c нейропротективными свойствами шаперона Hsp70, которые эффективно проявляются в мезолимбической системе вознаграждения и НА-ергической системе голубого пятна. Об этом свидетельствует значительное уменьшение количества погибших нейронов и ослабление признаков хронического нейровоспаления, судя по уменьшению количества активированной микроглии, в этих эмоциогенных структурах. Запускаемый индуктором шаперонов U133 специализированный мультифакторный механизм мощной нейропротекции не препятствует развитию компенсаторных реакций, направленных на поддержание уровня дофамина в мезолимбической системе (судя по повышенному уровню ТГ в нейронах ВО покрышки) и способствует восстановлению функции восходящих моноаминергических путей. Мы недавно показали, что в основе этого механизма лежит способность Hsp70 напрямую взаимодействовать с агрегатами α-синуклеина и разбирать их, а также снижать содержание патогенной фосфорилированной (Ser129) формы α-синуклеина [24, 27]. Другими исследователями обнаружено, что Hsp70 ингибирует образование фибрилл α-синуклеина за счет избирательного связывания с префибриллами (олигомерами), что приводит к ослаблению их токсических свойств [43]. Кроме того, не менее важным механизмом нейропротекции Hsp70-индуцирующей терапии в нашей модели доклинической стадии БП может быть ее корректирующее влияние на нарушение сна, которое приводит к увеличению пропорции глубокого сна, во время которого повышается скорость синтеза белков и работа глимфатической системы головного мозга [28]. Этот физиологический механизм обеспечивает интенсификацию восстановительных процессов в нервных клетках и очистку мозга от амилоидных белков, что противодействует начавшейся нейродегенерации и дисфункции нервных сетей, вовлеченных в регуляцию интегративных функций мозга. Кроме того, дополнительный вклад в нейропротекцию вносят противовоспалительные свойства Hsp70, которые связаны с его модулирующим влиянием на TLR-2 (Toll-like receptor type-2), воспалительный сигналинг и систему белков транскрипционного фактора NF-κB [44, 45].
Таким образом, полученные данные демонстрирует, что проведение превентивной фармакотерапии с помощью индуктора шаперонов U133 на модели доклинической стадии БП у пожилых животных оказывает действие, подобное антидепрессантам, которое может быть опосредовано улучшением функционального состояния моноаминергических эмоциогенных структур головного мозга и ослаблением нейровоспаления. Полученные данные являются фундаментальным обоснованием для разработки новой молекулярной технологии превентивной терапии БП и ангедонии различного генеза на основе индукторов шаперонов.
Список литературы
Poewe W, Seppi K, Tanner CM, Halliday GM, Brundin P, Volkmann J, Schrag AE, Lang AE (2017) Parkinson disease. Nat Rev Dis Primers 3: 17013.https://doi.org/10.1038/nrdp
Chesnokova AY, Ekimova IV, Pastukhov YF (2019) Parkinson’s Disease and Aging. Adv Gerontol 9: 164–173. https://doi.org/10.1134/S2079057019020085
Dorsey ER, Constantinescu R, Thompson JP, Biglan KM, Holloway RG, Kieburtz K, Marshall FJ, Ravina BM, Schifitto G, Siderowf A, Tanner CM (2007) Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030. Neurology 68(5): 384–386. https://doi.org/10.1212/01.wnl.0000247740.47667.03
Пастухов ЮФ (2013) Изменения характеристик парадоксального сна – ранний признак болезни Паркинсона. Журн высш нервн деятельности им ИП Павлова 63(1): 75 [Pastukhov IuF (2013) Changes in the characteristics of paradoxical sleep are an early feature of Parkison’s disease. Zhurn Vyssh Nervn Deiatelnosti im IP Pavlova 63(1): 75–85 (In Russ)]. https://doi.org/10.7868/s0044467713010103
Stefani A, Högl B (2020) Sleep in Parkinson’s disease. Neuropsychopharmacology 45(1): 121–128. https://doi.org/10.1038/s41386-019-0448-y
Schrag A, Taddei RN (2017) Depression and Anxiety in Parkinson’s Disease. Int Rev Neurobiol 133: 623–655. https://doi.org/10.1016/bs.irn.2017.05.024
Shen CC, Tsai SJ, Perng CL, Kuo BI, Yang AC (2013) Risk of Parkinson disease after depression: a nationwide population-based study. Neurology 81(17): 1538–1544. https://doi.org/0.1212/WNL.0b013e3182a956ad
Szatmari S, Illigens B.M. W, Siepmann T, Pinter A, Takats A, Bereczki D (2017) Neuropsychiatric symptoms in untreated Parkinson’s disease. Neuropsychiatr Disease and Treatment 13: 815–826.https://doi.org/10.2147/NDT.S130997
Braak H, Ghebremedhin E, Rub U, Bratzke H, Del Tredici K (2004) Stages in the development of Parkinson’s disease related pathology. Cell Tissue Res 318: 121–134. https://doi.org/10.1007/s00441-004-0956-9
Cummings JL (1992) Depression and Parkinson’s disease: a review. Am J Psychiatry 149 (4): 443–454. https://doi.org/10.1176/ajp.149.4.443
Dunlop BW, Nemeroff CB (2007) The Role of Dopamine in the Pathophysiology of Depression. Arch Gen Psychiatry 64(3): 327–337. https://doi.org/10.1001/archpsyc.64.3.327
Chaika AV, Khusainov DR, Cheretaev IV (2018) Chronic Blockade of D2 Receptors and Behavior in Low-Depressivity Rats. Neurosci Behav Physiol 48: 564–570. https://doi.org/10.1007/s11055-018-0600-x
Shen CC, Tsai SJ, Perng CL, Kuo BI, Yang AC (2013) Risk of Parkinson disease after depression: a nationwide population-based study. Neurology 81(17): 1538–1544. https://doi.org/0.1212/WNL.0b013e3182a956ad
Uhl GR, Hedreen JC, Price DL (1985) Parkinson’s disease loss of neurons from the ventral tegmental area contralateral to therapeutic surgical lesions. Neurology 35(8): 1215. https://doi.org/10.1212/WNL.35.8.1215
Remy P, Doder M, Lees A, Turjanski N, Brooks D (2005) Depression in Parkinson’s disease: loss of dopamine and noradrenaline innervation in the limbic system. Brain 128: 1314–1322. https://doi.org/10.1093/brain/awh445
Politis M, Niccolini F (2015) Serotonin in Parkinson’s disease. Behav Brain Res 277: 136–145. https://doi.org/10.1016/j.bbr.2014.07.037
Dick O, Nozdrachev A (2016) Features of parkinsonian and essential tremor of the human hand. Hum Physiol 42: 271–278. https://doi.org/10.1134/S0362119716030063
Rocha EM, De Miranda B, Sanders LH (2018) Alpha-synuclein: Pathology, mitochondrial dysfunction and neuroinflammation in Parkinson’s disease. Neurobiol Dis 109(Pt B): 249–257. https://doi.org/10.1016/j.nbd.2017.04.004
Calamini B, Morimoto RI (2012) Protein homeostasis as a therapeutic target for diseases of protein conformation. Curr Top Med Chem 12(22): 2623–2640. https://doi.org/10.2174/1568026611212220014
Ciechanover A, Kwon YT (2015) Degradation of misfolded proteins in neurodegenerative diseases: therapeutic targets and strategies. Exp Mol Med 47(3): e147. https://doi.org/10.1038/emm.2014.117
Екимова ИВ, Газизова АР, Карпенко МН, Плаксина ДВ (2018). Признаки ангедонии и деструктивные изменения в вентральной области покрышки среднего мозга в модели доклинической стадии болезни Паркинсона в эксперименте. Журн неврол психиатрии им СС Корсакова 118(9): 61–67. [Ekimova IV, Gazizova AR, Karpenko MN, Plaksina DV (2018) Signs of anhedonia and destructive changes in the ventral tegmental area of the midbrain in the model of the preclinical Parkinson’s disease stage in experiment. Zhurn Nevrol Psikhiatrii im SS Korsakova. 118(9): 61–67 (In Russ)]. https://doi.org/10.17116/jnevro201811809161
Abdurasulova IN, Ekimova IV, Matsulevich AV, Gazizova AR, Klimenko VM, Pastukhov YF (2017) Impairment of non-associative learning in a rat experimental model of preclinical stage of Parkinson’s disease. Dokl Biol Sci 476(1): 188–190. https://doi.org/10.1134/S0012496617050039
Ekimova IV, Simonova VV, Guzeev MA, Lapshina KV, Chernyshev MV, Pastukhov YuF (2016) Changes in sleep characteristics of rat preclinical model of Parkinson’s disease based on attenuation of the ubiquitin—proteasome system activity in the brain. J Evol Biochem Phys 52: 463–474 https://doi.org/10.1134/S1234567816060057
Plaksina DV, Ekimova IV (2020) Age-related features of α-synuclein pathology in the brain on modeling the preclinical stage of Parkinson’s disease in rats. Neurosci Behav Physiol 50: 109–1114. https://doi.org/10.1007/s11055-019-00875-0
Екимова ИВ, Гузеев МА, Симонова ВВ, Пастухов ЮФ (2020) Возрастные особенности нарушений сна в моделях доклинической стадии болезни Паркинсона у крыс. Журн неврол психиатрии им СС Корсакова 120:26–33 [Ekimova IV, Guzeev MA, Simonova VV, Pastukhov YF (2020) Age-related differences in sleep disturbances in rat models of preclinical Parkinson’s disease. Zh Nevrol Psikhiatr Im SS Korsakova 120:26–33 (In Russ)]. https://doi.org/10.17116/jnevro202012009226
Friesen EL, De Snoo ML, Rajendran L, Kalia LV, Kalia SK. (2017) Chaperone-Based Therapies for Disease Modification in Parkinson’s Disease. Parkinsons Dis 2017: 5015307. https://doi.org/10.1155/2017/5015307
Ekimova IV, Plaksina DV, Pastukhov YF, Lapshina KV, Lazarev VF, Mikhaylova ER, Polonik SG, Pani B, Margulis BA, Guzhova IV, Nudler E (2018) New HSF1 inducer as a therapeutic agent in a rodent model of Parkinson’s disease. Exp Neurol 306: 199–208.https://doi.org/10.1016/j.expneurol.2018.04.012
Pastukhov YuF, Simonova VV, Shemyakova TS, Guzeev MA, Polonik SG, Ekimova IV (2020) U‑133, a chaperone inducer, eliminates sleep disturbances in a model of the preclinical stage of Parkinson’s disease in aged rats. Adv Gerontol 10(3): 254–259. https://doi.org/10.1134/S2079057020030133
Полоник С, Толкач А, Уварова Н (1994) Гликозилирование эхинохрома и родственных гидроксинафтазаринов ортоэфирным методом. Журн орган химии 30(2) 248–253 [Polonik S, Tolkach A, Uvarova N (1994) Glycosylation of echinochrome and related hydroxynaphthazarines by the orthoester method. Zhurn Organ Himii 30(2): 248–253 (In Russ)].
Mishchenko NP, Fedoreev SA, Bagirova VL (2003) Histochrome: a new original domestic drug. Pharmaceut Chem J 37: 48–52. https://doi.org/10.1023/A:1023659331010
Grønli J, Murison R, Fiske E, Bjorvatn B, Sørensen E, Portas CM, Ursin R (2005) Effects of chronic mild stress on sexual behavior, locomotor activity and consumption of sucrose and saccharine solutions. Physiol Behav 84 (4): 571–577. https://doi.org/10.1016/j.physbeh.2005.02.007
Paxinos G, Watson C (1986) The Rat Brain in Stereotaxic Coordinates. CA Acad San Diego.
Anisimov VN (2008) Evolution of concepts in gerontology and physiological mechanisms of aging. In: Molekulyarnye i fiziologicheskie mekhanizmy stareniya (Molecular and Physiological Mechanisms of Aging) St Petersburg Nauka vol 1, parts 1–3, 49–95, 269–378 (In Russ).
Porseva V, Korzina M, Spirichev A, Vishnyakova PA, Aryaeva D.A., Nozdrachev AD, Masliukov PM (2020) Changes in the Immunohistochemical Characteristics of Neurons in a Number of Hypothalamic Nuclei on Aging. Neurosci Behav Physiol 50: 645–649. https://doi.org/10.1007/s11055-020-00947-6
Emanuilov A, Konovalov V, Masliukov P, Polyakov E, Nozdrachev A (2018) Age-development changes of the sympathetic innervation of the rat stomach. Adv Gerontol 31(6): 937–942. https://doi.org/10.1134/S2079057019020097
Jurivich D, Choo M, Welk J, Qiu L, Han K, Zhou X (2005) Human aging alters the first phase of the molecular response to stress in T-cells. Exp Gerontol 40(12): 948–958. https://doi.org/10.1016/j.exger.2005.08.003
Labbadia J, Morimoto R (2015) The biology of proteostasis in aging and disease. Annu Rev Biochem 84: 435–464.https://doi.org/10.1146/annurev-biochem-060614-033955
Nestler E, Carlezon W (2006) The mesolimbic dopamine reward circuit in depression. Biol Psychiatry 59(12): 1151–1159. https://doi.org/10.1016/j.biopsych.2005.09.018
Lee Y, Subramaniapillai M, Brietzke E, Mansur R, Ho R, Yim S, McIntyre R (2018) Anti-cytokine agents for anhedonia: targeting inflammation and the immune system to treat dimensional disturbances in depression. Ther Adv Psychopharmacol 8(12): 337–348. https://doi.org/10.1177/2045125318791944
Yokochi M (2007) Mesolimbic and mesocortical pathways in Parkinson disease. Brain Nerve 59(9): 943–951. PMID: 17886476
Liu A, Lin Z, Choi H, Sorhage F, Li B (1989). Attenuated induction of heat shock gene expression in aging diploid fibroblasts. J Biol Chem 264 (20): 12037–12045. https://doi.org/10.1007/978-3-0348-9088-5_26
Hashikawa N, Utaka Y, Ogawa T, Tanoue R, Morita Y, Yamamoto S, Yamaguchi S, Kayano M, Zamami Y, Hashikawa-Hobara N (2017) HSP105 prevents depression-like behavior by increasing hippocampal brain-derived neurotrophic factor levels in mice. Sci Adv 3(5): e1603014. https://doi.org/10.1126/sciadv.1603014
Auluck P, Chan H, Trojanowski J, Lee V, Bonini N (2002) Chaperone suppression of alpha-synuclein toxicity in a Drosophila model for Parkinson’s disease. Science (New York) 295(5556): 865–868. https://doi.org/10.1126/science.1067389
Asea A, Rehli M, Kabingu E, Boch J, Bare O, Auron P, Stevenson M, Calderwood S (2002). Novel signal transduction pathway utilized by extracellular HSP70: role of toll-like receptor (TLR) 2 and TLR4. J Biol Chem 277(17): 15028–15034.https://doi.org/10.1074/jbc.M200497200
Guzhova I, Darieva Z, Melo A, Margulis B (1997). Major stress protein Hsp70 interacts with NF-kB regulatory complex in human T-lymphoma cells. Cell Stress Chaperones 2(2): 132–139. https://doi.org/10.1379/1466-1268(1997)002<0132:msphiw>2.3.co;2
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


