Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1209-1218
Нейрохимические особенности нейропептид-Y-ергических энтеральных нейронов подслизистого сплетения тонкой кишки в постнатальном онтогенезе
П. М. Маслюков 1, *, А. Ф. Будник 2, П. А. Вишнякова 1, А. В. Павлов 1
1 Ярославский государственный медицинский университет
Ярославль, Россия
2 Кабардино-Балкарский государственный университет им. Х.М. Бербекова
Нальчик, Россия
* E-mail: mpm@ysmu.ru
Поступила в редакцию 08.02.2021
После доработки 13.03.2021
Принята к публикации 14.03.2021
Аннотация
Нейропептид Y (NPY) выполняет разнообразные функции в нервной системе, включая регуляцию сосудистого тонуса и гастроинтестинальной секреции, оказывает прямое тормозящее влияние на моторику и секрецию кишечника. Колокализация NPY с ферментом синтеза ацетилхолина – холинацетилтрансферазой (ChAT), нейрональной NO-синтазой (nNOS), вазоактивным интестинальным пептидом (VIP) и кальций-связывающим белком кальбиндином (CB) выявлялась в нейронах подслизистого сплетения тонкой кишки крыс разного возраста (от момента рождения до наступления старости) при помощи иммуногистохимического метода двойного мечения антителами и флуоресцентной микроскопии. С момента рождения все NPY-иммунореактивные нейроны колокализуют ChAT. Большая часть NPY-содержащих нейронов также содержит VIP и CB. У старых крыс процент NPY-иммунореактивных нейронов, содержащих CB, VIP и ChAT, снижается. У юных крыс, от новорожденных до 20 суток жизни, а также у старых животных в NPY-позитивных нейронах выявляется nNOS. Таким образом, на ранних этапах онтогенеза и у старых крыс энтеральные NPY-иммунореактивные нейроны подслизистого сплетения метасимпатической нервной системы содержат более широкий спектр нейротрансмиттеров по сравнению с взрослыми животными.
Нейрохимический состав ганглиев метасимпатической нервной системы отличается значительной вариацией. Медиатор ацетилхолин, синтезируемый ферментом холинацетилтрансферазой (ChAT) содержится в большей части ганглионарных нейронов. Кроме ацетилхолина, нейроны интрамуральных ганглиев могут содержать другие нейротрансмиттеры, включая оксид азота (NO), серотонин, гистамин, а также нейропептиды: нейропептид Y (NPY), вазоактивный интестинальный полипептид (VIP) и другие [1–3].
NPY широко распространен в желудочно-кишечном тракте, выявляется в волокнах, направляющихся к слизистой и мышечной оболочке, а также к гладким мышцам сосудов [4–6]. NPY обнаруживается примерно в половине нейронов подслизистого нервного сплетения (ПС) и лишь в небольшой части нейронов межмышечного сплетения мыши и крысы [7, 8].
В интрамуральных узлах кишки грызунов большинство NPY-иммунореактивных (ИР) нейронов колокализуют ChAT [7, 9]. Нейроны, колокализующие ChAT, кальций-связывающий белок кальбиндин (CB), NPY, VIP считаются секретомоторными нейронами [1, 3, 9]. Согласно данным литературы, в периферических нейронах содержится так называемая периферическая изоформа ChAT (pChAT) [10].
NPY оказывает прямое тормозящее влияние на моторику и секрецию кишечника. Кроме этого, NPY способствует нейрогенезу и ангиогенезу [11–13]. Нейроны ПС регулируют транспорт ионов и воды через эпителий кишечника, а также секреторную функцию желез. Секреторные нарушения в виде гипер- или гипосекреции могут быть связаны с нарушением деятельности NPY-ергических нейронов ПС, преимущественно тонкой кишки.
В онтогенезе морфологические характеристики и химический состав нейронов автономной нервной системы изменяется [2, 14, 15]. Это касается изменения размеров нейронов, содержания кальций-связывающих белков, нейропептидов, медиаторов и ферментов их синтеза, в том числе экспрессии NPY и его рецепторов. Установлено, что доля нейронов, содержащих NPY в метасимпатических узлах ПС тонкой кишки увеличивается с момента рождения до 20–30 суток жизни, а затем снижается [8]. Тем не менее, изменения нейрохимического состава нейропептид Y-содержащих метасимпатических энтеральных нейронов остаются малоисследованными.
Целью настоящей работы явилось определение колокализации NPY с ферментами синтеза нейротрансмиттеров и нейротрансмиттерами в нейронах ПС тонкой кишки крыс в постнатальном онтогенезе от момента рождения и до наступления старости животных при помощи иммуногистохимических методов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на новорожденных, 10-, 20-, 30-суточных, 6-месячных, 2-летних крысах линии Вистар (по 5 в каждой возрастной группе). Животные содержались в стандартных условиях вивария в акриловых клетках с деревянной стружкой в акклиматизированном помещении (12/12 ч свет/темнота, при температуре 22 ± 3°C) на полнорационной сбалансированной диете со свободным доступом к пище и воде. Исследование проводилось с соблюдением “Правил проведения работ с использованием экспериментальных животных” (приказ № 775 от 12.08.1977 г. МЗ СССР), в соответствии с принципами Базельской декларации и рекомендациями этического комитета ЯГМУ (протокол N 41 от 22.10.2020). После введения летальной дозы уретана (3 г/кг, внутрибрюшинно), животных перфузировали транскардиально раствором стандартного фоcфатно-cолевого буфеpа (PBS; 0.01 М, pH 7.4) (БиолоТ, Россия), затем 4%-ным pаcтвоpом паpафоpмальдегида (Sigma, США) на PBS. После перфузии участки двенадцатиперстной кишки длиной по 0.5 см извлекались и помещались в ту же фиксирующую смесь, в которой производили перфузию, на 1–2 ч. Серии срезов толщиной 12 мкм изготовляли на криостате.
С целью выявления нейронов, содержащих NPY, ChAT, VIP, nNOS и CB применялось двойное мечение антителами. Срезы преинкубировали в течение 30 мин при комнатной температуре в PBS с добавлением 10% ослиной сыворотки (Jackson Immunoresearch, США), 1% тритона X-100, 0.1% бычьего сывороточного альбумина, 0.05% тимерозола. Затем срезы инкубировали с первичными антителами (табл. 1) в течение 24 ч при комнатной температуре. После кратковременной промывки в PBS срезы инкубировали с вторичными антителами в течение 2 ч. Вторичные антитела были конъюгированы с флуорохромами – флуоресцеин-изотиоцианатом (FITC), дающим зеленую флуоресценцию и индокарбоцианином (Cy3), дающим красную флуоресценцию (разведение 1 : 150, Jackson Immunoresearch, США). После этого срезы снова отмывали в PBS и заключали в среду для иммунофлуоресценции (VectaShield, Vector Laboratories, США).
Таблица 1.
Использованные первичные антитела
| Тип антител | Животное-донор | Разведение | Источник | Кат № |
|---|---|---|---|---|
| ChAT* | Коза | 1 : 100 | Millipore | AB144p |
| VIP | Кролик | 1 : 300 | Abcam | ab43841 |
| nNOS | Коза | 1 : 300 | Abcam | ab1376 |
| NPY | Кролик | 1 : 500 | Abcam | ab30914 |
| NPY | Овца | 1 : 500 | Abcam | ab6173 |
| CB | Кролик | 1 : 500 | Abcam | ab11426 |
Отрицательный контроль проводился с заменой первичных антител ослиной сывороткой.
Анализ препаратов проводили на флуоресцентном микроскопе Olympus BX43 (Токио, Япония) с соответствующим набором светофильтров и охлаждаемой цифровой CCD камерой Tucsen TCC 6.1ICE c программным обеспечением ISCapture 3.6 (Китай). Для определения процентного соотношения иммунопозитивных нейронов на цифровых изображениях гистологических препаратов использовали программу Image J (NIH, США, http://rsb.info.nih.gov/ij/). Анализу подлежали нервные клетки, срез которых прошел через ядро с ядрышком. Суммарное количество ИР нейронов, содержащих только красную, только зеленую, и колокализующих обе метки (желтый цвет при наложении изображений) принимали за 100%. Подсчет ИР нейронов проводили в случайно выбранных измеренных областях (площадь изображения составляла 0.12 мм2) при 200-кратном увеличении. Для каждого животного использовали 5 изображений на 5 срезах (по одному изображению на срез).
Математическая обработка данных проведена с использованием пакетов прикладных программ Sigma Plot (StatSoft, США). Все величины представлены как средняя арифметическая ± ошибка среднего (М ± m). Достоверность различий средних величин определяли с использованием однофакторного дисперсионного анализа (ANOVA) с коррекцией Бонферрони. Достоверными считали различия при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В ПС NPY-ИР нейроны выявлялись в большом количестве во всех возрастных группах (рис. 1–5). Все NPY-ИР нейроны (100%) с момента рождения до старости содержали фермент синтеза ацетилхолина – ChAT (рис. 1). При этом выявлялась часть ChAT-ИР NPY-негативных клеток, процент которых достоверно увеличивался с 20-е по 30-е сутки, а также у старых крыс (p < 0.05, рис. 2).
Рис. 1.
Микрофотографии нейронов, содержащих NPY (a, d), ChAT (b, e), а также колокализация NPY и ChAT (c, f) в интрамуральных ганглиях ПС двенадцатиперстной кишки 20-суточных (a–c) и двухлетних (d–f) крыс. ChAT(+)/NPY(-) нейроны указаны стрелками. Флуоресценция Сy3 (красный, ChAT), FITC (зеленый, NPY). Масштаб – 50 мкм.

Рис. 2.
Процентное содержание NPY-ИР нейронов, колокализующих ChAT (a), CB (b), VIP (c), nNOS (d) у крыс разного возраста. *p < 0.05 – различия достоверны по сравнению с 30-суточной крысой.
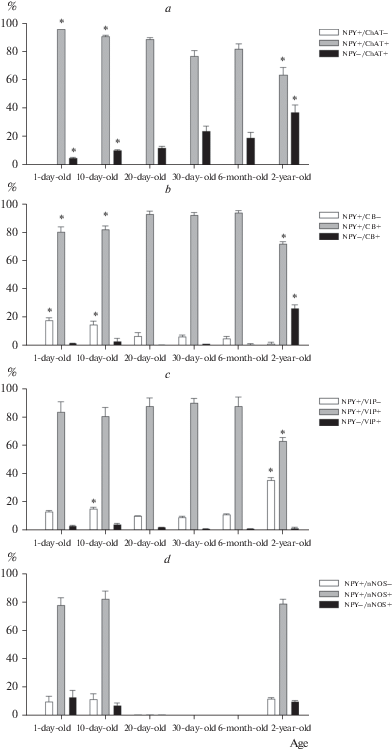
Рис. 3.
Микрофотографии нейронов, содержащих CB (a, d), NPY (b, e), а также колокализация CB и NPY (c, f) в интрамуральных ганглиях ПС двенадцатиперстной кишки 20-суточных (a–c), и двухлетних (d–f) крыс. CB(–)/NPY(+) нейроны (b, c) указаны стрелками, CB(+)/NPY(–) нейроны (d, f) – звездочкой. Флуоресценция Сy3 (красный, NPY), FITC (зеленый, CB). Масштаб – 50 мкм.

Рис. 4.
Микрофотографии нейронов, содержащих NPY (a, d), VIP (b, e), а также колокализация NPY и VIP (c, f) в интрамуральных ганглиях ПС двенадцатиперстной кишки 20-суточных (a–c), и двухлетних (d–f) крыс. NPY(+)/VIP(–) нейроны указаны стрелками. Флуоресценция Сy3 (красный, VIP), FITC (зеленый, NPY). Масштаб – 50 мкм.

Рис. 5.
Микрофотографии нейронов, содержащих NPY (a, d), nNOS (b, e), а также колокализация NPY и nNOS (c, f) в интрамуральных ганглиях ПС двенадцатиперстной кишки 10-суточных (a–c), и двухлетних (d–f) крыс. nNOS(+)/NPY(–) нейрон указан стрелкой. Флуоресценция Сy3 (красный, nNOS), FITC (зеленый, NPY). Масштаб – 50 мкм.

С момента рождения большая часть NPY-содержащих нейронов также содержала CB (рис. 3), VIP (рис. 4) и nNOS (рис. 5). Процент NPY-ИР нейронов, колокализующих CB, достоверно возрастал между 10-ми и 20-ми сутками жизни (p < 0.05, рис. 2), оставаясь постоянным до 6 месяцев, и уменьшался у старых крыс (p < 0.01). У старых крыс по сравнению с более молодыми также достоверно увеличивался процент CB-ИР нейронов, не содержащих NPY (p < 0.001).
Процент NPY-ИР нейронов, колокализующих VIP, достоверно не отличался у юных и взрослых крыс (p > 0.05, рис. 2), но снижался у старых крыс (p < 0.001). У старых животных относительно более молодых достоверно возрастала доля NPY-ИР VIP-негативных нейронов (p < 0.001).
У юных крыс от новорожденных до 20-х суток жизни, а также у старых животных в NPY-позитивных нейронах выявлялась nNOS. Следует отметить, что если у новорожденных и 10-суточных животных выявлялось значительное количество nNOS-ИР нейронов, то у 20-суточных отмечались лишь единичные клетки. Тем не менее, у старых крыс доля nNOS-ИР нейронов опять становится сопоставимой с новорожденными и 10-суточными, без достоверных различий между этими группами (p > 0.05, рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего исследования показывают, что NPY-ИР нейроны выявляются в узлах ПС в большом количестве с момента рождения. Данные нашего предыдущего исследования свидетельствуют, что процент NPY-ИР нейронов ПС тонкой кишки непостоянен в онтогенезе, а наибольший процент у крыс наблюдался в возрасте 20–30-ти суток [8].
NPY-ИР и иммунонегативные нейроны относятся к разным функциональным популяциям. ПС у морских свинок и мышей содержит четыре типа нейронов, включая секретомоторные и вазомоторные нейроны, а также собственные первичные афферентные нейроны [1, 3]. Нейроны, колокализующие ChAT, CB, NPY и VIP, считаются секретомоторными нейронами [9].
NPY оказывает прямое тормозящее влияние на моторику и секрецию кишечника. Ингибирующее влияние NPY на секреторную функцию кишки реализуется путем активации Y1-постсинаптических рецепторов энтероцитов и нейрональных пресинаптических Y2-рецепторов [4, 16]. Учитывая, что нейроны ПС участвуют в регуляции секреции, можно предположить, что в возрасте 20–30-ти суток происходит окончательное формирование секреторной функции тонкой кишки, связанное с переходом с молочного питания на самостоятельное. При этом NPY может играть особую роль в становлении функции тонкой кишки, действуя не только в качестве котрансмиттера, но и как трофический фактор. Кроме влияния на тонус сосудов, деятельность сердца, секреторную и моторную функцию желудочно-кишечного тракта, NPY стимулирует нейрогенез, а также оказывает трофические эффекты, в частности способствует ангиогенезу и гипертрофии миокарда [11–13]. В кишке NPY играет также важную роль в модулировании функций иммунных клеток и эпителиального барьера.
Мы впервые исследовали колокализацию NPY и ChAT с момента рождения до наступления старости у крыс. На протяжении постнатального онтогенеза все NPY-ИР нейроны содержит фермент синтеза ацетилхолина – ChAT, что соответствует данным литературы, полученным на взрослых животных [1, 3, 7]. Мы также обнаружили, что NPY-ИР холинергические нейроны в большинстве своем содержат VIP и CB у юных, взрослых и старых крыс.
Интересно, что один и тот же нейрон подслизистого сплетения содержит нейротрансмиттеры, стимулирующие секрецию (VIP) и тормозящие ее (NPY) [1]. Вероятно, выделение VIP или NPY зависит от характера стимуляции. Например, из симпатических терминалей при низкочастотной стимуляции выделяется норадреналин, а при высокочастотной – NPY [5]. Считается, что NPY оказывает провоспалительный эффект, а VIP – противовоспалительный [17]. Повышение процента NPY(+)/VIP(–) и уменьшение доли VIP-ИР нейронов может быть свидетельством того, что старение сопровождается повышением уровня воспалительных процессов во многих тканях, включая нервную систему и желудочно-кишечный тракт [18].
Мы обнаружили, что в раннем возрасте большая часть NPY-ИР нейронов транзиторно экспрессирует nNOS. При этом небольшая часть NPY-негативных нейронов у новорожденных и 10-суточных животных также колокализует nNOS. Тем не менее, nNOS в ПС выявляется лишь у единичных нейронов в возрасте старше 20-ти суток, но опять обнаруживается у старых животных. Согласно литературным данным, лишь 1% нейронов подслизистого сплетения тонкой кишки взрослой мыши содержат nNOS, однако в позднем эмбриональном и раннем постнатальном периоде nNOS обнаруживается в 50% нейронов ПС [19, 20]. Сходным образом холинергические нейроны симпатических узлов экспрессируют ChAT и фермент синтеза катехоламинов – тирозингидроксилазу, которая перестает выявляться с третьей недели жизни [21]. Также транзиторная экспрессия nNOS наблюдается в эмбриональном периоде в спинномозговых узлах, мозжечке, стволе мозга, коре больших полушарий и гиппокампе [22, 23]. Ряд авторов связывает такую транзиторную экспрессию с ролью NO в устранении избыточной синаптической иннервации, наблюдающейся в развивающейся нервной системе, и тонкой настройкой синаптического аппарата, сопровождающегося активацией одних синапсов и элиминацией малоактивных [23, 24]. Также NO увеличивает возбудимость нейронов за счет модуляции активности K+-каналов [24]. Увеличение экспрессии nNOS в старости также отмечается в нейронах ЦНС [25, 26]. Предполагается, что это может, с одной стороны, способствовать апоптозу, с другой – иметь антиапоптотическое значение.
Таким образом, на ранних этапах онтогенеза и в старости энтеральные нейроны метасимпатической нервной системы, в частности содержащие нейропептид Y, содержат более широкий спектр нейротрансмиттеров по сравнению со взрослыми животными. Впервые показано, что NPY-ергические нейроны подслизистого сплетения крыс, наряду с холинацетилтрансферазой, вазоинтестинальным пептидом и кальбиндином, у новорожденных и старых крыс также экспрессируют нейрональную NO-синтазу.
Список литературы
Furness JB (2006) The enteric nervous system. Oxford: Blackwell Publishing.
Masliukov PM, Budnik AF, Nozdrachev AD (2017) Neurochemical Features of Metasympathetic System Ganglia in the Course of Ontogenesis. Adv Gerontol 7(4): 281–289. https://doi.org/10.1134/S2079057017040087
Furness JB, Stebbing MJ (2018) The first brain: Species comparisons and evolutionary implications for the enteric and central nervous systems. Neurogastroenterol Motil 30(2): e13234. https://doi.org/10.1111/nmo.13234
Cox HM (2007) Neuropeptide Y receptors; antisecretory control of intestinal epithelial function. Auton Neurosci 133(1): 76–85. https://doi.org/10.1016/j.autneu.2006.10.005
Nozdrachev AD, Masliukov PM (2011) Neuropeptide Y and autonomic nervous system. Zh Evol Biokhim Fiziol 47: 105–112. https://doi.org/10.1134/S0022093011020010
Rytel L, Szymanska K, Gonkowski I, Wojtkiewicz J (2018) Neurochemical characterization of intramural nerve fibres in the porcine oesophagus. Anat Histol Embryol 47(6): 517–526. https://doi.org/10.1111/ahe.12391
Mongardi Fantaguzzi C, Thacker M, Chiocchetti R, Furness JB (2009) Identification of neuron types in the submucosal ganglia of the mouse ileum. Cell Tissue Res 336(2): 179–189. https://doi.org/10.1007/s00441-009-0773-2
Budnik AF, Aryaeva D, Vyshnyakova P, Masliukov PM (2020) Age related changes of neuropeptide Y-ergic system in the rat duodenum. Neuropeptides 80:101982. https://doi.org/10.1016/j.npep.2019.101982
Mann PT, Furness JB, Southwell BR (1999) Choline acetyltransferase immunoreactivity of putative intrinsic primary afferent neurons in the rat ileum. Cell Tissue Res 297: 241–248. https://doi.org/10.1007/s004410051352
Колос ЕА, Коржевский ДЭ (2016) Неоднородность реакции на холинацетилтрансферазу в холинергических нейронах. Нейрохимия 33(1): 56–62. [Kolos EA, Korzhevskii DA (2016) Heterogeneous choline acetyltransferase staining in cholinergic neurons. Neurochem J 10(1): 47–52 (In Russ).
Jia C, Hegg CC (2015) Effect of IP3R3 and NPY on age-related declines in olfactory stem cell proliferation. Neurobiol Aging 36(2): 1045–1056. https://doi.org/10.1016/j.neurobiolaging.2014.11.007
Saraf R, Mahmood F, Amir R, Matyal R (2016) Neuropeptide Y is an angiogenic factor in cardiovascular regeneration. Eur J Pharmacol 776: 64–70. https://doi.org/10.1016/j.ejphar.2016.02.033
Tan CMJ, Green P, Tapoulal N, Lewandowski AJ, Leeson P, Herring N (2018) The Role of Neuropeptide Y in Cardiovascular Health and Disease. Front Physiol 9: 1281. https://doi.org/10.3389/fphys.2018.01281
Foong JP (2016) Postnatal Development of the Mouse Enteric Nervous System. Adv Exp Med Biol 891: 135–143. https://doi.org/10.1007/978-3-319-27592-5_13
Masliukov PM, Moiseev K, Budnik AF, Nozdrachev AD, Timmermans JP (2017) Development of calbindin- and calretinin-immunopositive neurons in the enteric ganglia of rats. Cell Mol Neurobiol 37(7):1257–1267. https://doi.org/10.1007/s10571-016-0457-x
Tough IR, Forbes S, Tolhurst R, Ellis M, Herzog H, Bornstein JC, Cox HM (2011) Endogenous peptide YY and neuropeptide Y inhibit colonic ion transport, contractility and transit differentially via Y1 and Y2 receptors. Br J Pharmacol 164: 471–484. https://doi.org/10.1111/j.1476-5381.2011.01401.x
Chandrasekharan B, Nezami BG, Srinivasan S (2013) Emerging neuropeptide targets in inflammation: NPY and VIP. Am J Physiol Gastrointest Liver Physiol 304(11): G949–G957. https://doi.org/10.1152/ajpgi.00493.2012
Wyss-Coray T (2016) Ageing, neurodegeneration and brain rejuvenation. Nature 539(7628): 180–186. https://doi.org/10.1038/nature20411
Young HM, Ciampoli D (1998) Transient expression of neuronal nitric oxide synthase by neurons of the submucous plexus of the mouse small intestine. Cell Tissue Res 291: 395–401. https://doi.org/10.1007/s004410051009
Bergner AJ, Stamp LA, Gonsalvez DG, Allison MB, Olson DP, Myers MG Jr, Anderson CR, Young HM (2014) Birthdating of myenteric neuron subtypes in the small intestine of the mouse. J Comp Neurol 522(3): 514–527. https://doi.org/10.1002/cne.23423
Maslyukov PM, Shilkin VV, Timmermans JP (2006) Immunocytochemical characteristics of neurons in the stellate ganglion of the sympathetic trunk in mice during postnatal ontogenesis. Neurosci Behav Physiol 36(8): 851–855. https://doi.org/10.1007/s11055-006-0097-6
Bredt DS, Snyder SH (1994) Transient nitric oxide synthase neurons in embryonic cerebral cortical plate, sensory ganglia, and olfactory epithelium. Neuron 13: 301–313. https://doi.org/10.1016/0896-6273(94)90348-4
Portillo F, Moreno-López B (2020) Nitric oxide controls excitatory/inhibitory balance in the hypoglossal nucleus during early postnatal development. Brain Struct Funct 225(9): 2871–2884. https://doi.org/10.1007/s00429-020-02165-9
González-Forero D, Moreno-López B (2014) Retrograde response in axotomized motoneurons: nitric oxide as a key player in triggering reversion toward a dedifferentiated phenotype. Neuroscience 283: 138–165. https://doi.org/10.1016/j.neuroscience.2014.08.021
Dawson TM, Dawson VL (2018) Nitric oxide signaling in neurodegeneration and cell death. Adv Pharmacol 82: 57–83. https://doi.org/10.1016/bs.apha.2017.09.003
Moiseev KY, Vishnyakova PA, Porseva VV, Masliukov AP, Spirichev AA, Emanuilov AI, Masliukov PM (2020) Changes of nNOS expression in the tuberal hypothalamic nuclei during ageing. Nitric Oxide 100-101: 1–6. https://doi.org/10.1016/j.niox.2020.04.002
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


