Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1310-1320
Влияние пренатального стресса на репродуктивные функции самцов крыс
С. Г. Пивина 1, В. В. Ракицкая 1, В. К. Акулова 1, Г. И. Холова 1, Е. Д. Шигалугова 1, Н. Э. Ордян 1, *
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: neo@infran.ru
Поступила в редакцию 15.07.2021
После доработки 26.07.2021
Принята к публикации 26.07.2021
Аннотация
Глюкокортикоидные гормоны угнетают продукцию тестостерона клетками Лейдига, взаимодействуя с глюкокортикоидными рецепторами, локализованными в этих стероид-продуцирующих клетках. У взрослых пренатально стрессированных самцов наряду с повышенным уровнем кортикостерона в крови наблюдается и повышение уровня тестостерона, что может быть обусловлено снижением количества глюкокортикоидных рецепторов в клетках Лейдига. На проверку этой гипотезы направлено данное исследование. Уровень глюкокортикоидных рецепторов в клетках Лейдига определяли с использованием количественной иммуногистохимии. Кроме того, мы исследовали показатели сперматогенеза и качества спермы, а также репродуктивный потенциал, который анализировали по способности самцов оплодотворять самку и производить потомство. Исследования показали снижение числа сперматогенных клеток в спрематогенном эпителии семенных канальцев пренатально стрессированных самцов, несмотря на повышенный уровень тестостерона в крови. Морфометрические показатели семенных канальцев, такие как толщина и площадь сперматогенного эпителия у пренатально стрессированных самцов были увеличены, так же, как и количество клеток Сертоли и их площадь. Мы обнаружили статистически значимое увеличение числа аномальных и неподвижных сперматозоидов, выделенных из эпидидимиса пренатально стрессированных самцов. Количество клеток Лейдига в интерстициальной ткани семенников у этих самцов было снижено, но площадь их увеличена по сравнению с контрольными самцами. Уровень глюкокортикоидных рецепторов в клетках Лейдига пренатально стрессированных самцов был снижен. Тем не менее, выявленные изменения не повлияли на способность пренатально стрессированных самцов к оплодотворению самок и производству потомства. Сделано заключение, что увеличенный уровень тестостерона в крови пренатально стрессированных самцов на фоне повышения уровня глюкокортикоидных гормонов обусловлен снижением чувствительности клеток Лейдига к глюкокортикоидам.
В литературе имеются указания на изменение полового поведения взрослых самцов крыс, рожденных от матерей, которые подвергались стрессированию во время беременности. Эти изменения заключались в склонности к демонстрированию лордоза, который характерен для самок [1]. Следует отметить, что такой паттерн полового поведения пренатально стрессированных самцов был характерен для потомков матерей, которых стрессировали в последнюю треть гестации. Этиология атипичного полового поведения таких пренатально стрессированных самцов определяется снижением пика тестостерона, который в норме наблюдается на 18–19-й пренатальный день жизни, а также в течение первых часов после рождения [2, 3]. Отсутствие выброса тестостерона в эти “критические” дни пре- и постнатальной жизни снижает аногенитальное расстояние у новорожденных самцов, а также нарушает половую дифференцировку ряда структур мозга за счет снижения активности фермента ароматазы 450 [4, 5].
Интересно, что несмотря на снижение уровня тестостерона в “критические” периоды перинатального онтогенеза, у взрослых пренатально стрессированных самцов уровень тестостерона в крови оказывается повышенным, хотя такие животные демонстрируют уменьшение числа эякуляций и снижение чувствительности к тестостерону [6]. Повышенный уровень тестостерона у взрослых самцов крыс наблюдается и в случае введения беременным матерям с 14-го по 19-й день гестации синтетического глюкокортикоида дексаметазона [7]. При этом такие самцы имеют повышенный базальный уровень кортикостерона.
Как известно, глюкокортикоидные гормоны угнетают продукцию тестостерона клетками Лейдига, взаимодействуя с глюкокортикоидными рецепторами (ГР), локализованными в этих стероид-продуцирующих клетках, за счет снижения экспрессии генов, кодирующих ключевые ферменты биосинтеза тестостерона [8]. Усиление продукции тестостерона клетками Лейдига на фоне повышенного уровня кортикостерона у самцов с пренатальным стрессом может быть опосредовано снижением количества ГР в клетках Лейдига, однако этот вопрос изучен не был.
Помимо клеток Лейдига, ГР у взрослых крыс и мышей экспрессируются и в других клетках семенников, а именно в макрофагах, фибробластах, гладкомышечных клетках и эндотелиальных клетках кровеносных сосудов, а также в ряде сперматогенных клеток [9, 10]. В клетках Сертоли ГР обнаружены только у неполовозрелых животных [11].
Несмотря на то, что проблема влияния пренатального стресса на половые функции самцов имеет давнюю историю, начинающуюся с публикации Ward в 1972 г. [12], состояние репродуктивных органов, в частности семенников, а также показатели сперматогенеза взрослых пренатально стрессированных самцов изучены недостаточно. В связи с этим в данном исследовании был изучен гормональных профиль взрослых самцов крыс, рожденных от матерей, подвергавшихся иммобилизационному стрессу с 14-го по 19-й день гестации, состояние семенников, показатели сперматогенеза и качества спермы (число аномальных сперматозоидов), а также репродуктивный потенциал, который анализировали по способности этих самцов оплодотворить самку и произвести потомство. Кроме того, в клетках Лейдига была изучена экспрессия ГР иммуногистохимическим методом.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 10 половозрелых самках крыс линии Вистар массой 210–230 г из ЦКП “Биоколлекция” Института физиологии им. И.П. Павлова РАН, а также на их потомках - самцах массой 230–240 г в возрасте 3 мес. Животных содержали в стандартных условиях вивария при свободном доступе к воде и корму (гранулированный комбикорм) и со сменой темной и светлой фаз суток 12/12 ч. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Беременных самок разделяли на две группы, одну из которых (n = 5) с 14-го по 19-й день беременности подвергали ежедневному иммобилизационному стрессу в течение 1 ч (ограничение подвижности в узких пластиковых пеналах) в условиях повышенной освещенности 400 лк. Вторую группу самок (n = 5) оставляли интактными. Самок содержали в группах до 19-го дня беременности, а далее по одной особи в клетке. На 2-й день после родов пометы выравнивали до 8 крысят с равным соотношением полов. Крысят содержали с матерями до 30-го дня жизни, а далее по 6 особей в клетке.
Дальнейшие эксперименты выполняли на половозрелых самцах – потомках стрессированных или интактных матерей. С целью нивелирования влияния матери на потомство в эксперимент брали по 2 самца из каждого помета. Самцов предварительно взвешивали, на следующий день декапитировали, извлекали семенники, надпочечники и эпидидимусы. Туловищную кровь собирали, затем пробы крови центрифугировали (1000 g, 20 мин, 4°С) и далее плазму хранили при температуре –20°С до момента определения содержания в ней гормонов.
Правый семенник от каждого самца фиксировали в жидкости Буэна течение 24 ч при комнатной температуре. Далее осуществляли стандартную гистологическую обработку ткани семенников путем проводки через этиловые спирты возрастающей концентрации (70, 80, 96% по 1 ч) и бутанолы (1ч и ночь). Затем материал проводили через 4 порции ксилола по 15 мин и заливали в парафиновые блоки. При помощи микротома изготавливали серии чередующихся срезов семенных желез во фронтальной плоскости толщиной 5–7 мкм. Срезы окрашивали гематоксилином- эозином. Морфометрические исследования проводили с использованием светового микроскопа Olimpus (Япония), цифровой камеры vz-c50s (Videozavr, Россия) и компьютера IBM PC с программным обеспечением “Videotest Master Morphology” (Россия) при общем увеличении 10 × 10, 40 × 10, 100 × 10. Морфологические особенности строения семенных желез исследовали по следующим параметрам: площадь поперечного сечения извитого семенного канальца; толщина сперматогенного эпителия извитого семенного канальца; количество клеток Сертоли в сперматогенном эпителии извитого семенного канальца и их площадь; количество разных видов сперматогенных клеток (сперматогонии, сперматоциты и сперматиды) в сперматогенном эпителии извитого семенного канальца, количество сперматозоидов в просвете извитого семенного канальца, а также число и площадь клеток Лейдига в интерстициальной ткани. Измерения проводили в 20 поперечных срезах извитых семенных канальцев и окружающих их участках интерстициальной ткани, полученных от каждого самца. На основании количественных данных, полученных при цитологическом исследовании семенников, рассчитывали ряд показателей, характеризующих сперматогенез: 1) общий показатель сперматогенеза – отношение количества сперматид к количеству сперматогоний; 2) клеточный индекс Сертоли – отношение суммы всех сперматогенных клеток (сперматогонии, сперматоциты и сперматиды) к сумме клеток Сертоли в одном извитом канальце, величина которого положительно коррелирует со спермопродукцией [13, 14].
Эпидидимисы после извлечения немедленно помещали в сосуд с 1 мл питательной среды G-MOPS PLUS (Virtolife, Швеция) нагретый до 37°С. На эпидидимисы наносили продольный разрез и инкубировали в течение 10 мин при температуре 37°С, позволяя сперматозоидам свободно всплыть. Взвесь сперматозоидов разводили 1 : 10, наносили на предметное стекло и окрашивали 5%-ным раствором эозина. Шлифованным стеклом делали мазок, который высушивали и исследовали под световым микроскопом. К дегенеративным (патологическим) формам относили сперматозоиды с двумя головками, но с одной шейкой и одним хвостом, без шейки с одним или несколькими хвостами, сперматозоиды с неправильной формой головки. Подсчитывали не менее 400 сперматозоидов от каждого животного. Результаты представлены в виде % аномальных спермиев от общего числа подсчитанных сперматозоидов.
Подвижность сперматозоидов оценивали следующим образом: каплю разведенной 1 : 10 суспензии сперматозоидов, полученных из эпидидимиса, наносили на предметное стекло, помещали под объектив светового микроскопа с цифровой камерой и производили видеосъемку движения сперматозоидов в течение 10 мин. Сперматозоиды разделяли на 4 класса: 1 – неподвижные, 2 – дергающиеся, 3 – слабо двигающиеся и 4 – совершающие прогрессивные движения.
Левый семенник помещали в 4%-ный раствор параформальдегида в 0.1 М фосфатном буфере (pH 7.4) на 24 ч, затем разрезали на 4 части и дополнительно держали 48 ч в растворе параформальдегида при 4°С. Далее материал после стандартной обработки (промывка, обезвоживание, проведение через порции ксилола) заливали в парафин. Изготавливали серии срезов мозга во фронтальной плоскости толщиной 6 мкм. С помощью метода немеченых антител (авидин-биотинового) и иммунопероксидазной реакции проводили выявление иммунореактивного вещества. После стандартных процедур депарафинизации, регидратации и демаскировки антигена (кипячение срезов в 0.01 М цитратном буфере (pH 6.0) под давлением в течение 1 мин), срезы в течение ночи при 4°C инкубировали с первичными поликлональными антителами к ГР (Abcam, ab3578) в разведении 1 : 150. Далее на срезы наносили универсальную систему авидин-биотинового комплекса (rabbit specific HRP/DAB (АBC) detection IHP Kit, Abcam, ab64261) и оставляли инкубироваться 30 мин при комнатной температуре. После инкубации с АВС-комплексом стекла промывали в фосфатном буфере 3 раза по 5 мин. Далее визуализировали реакцию связывания антитела с антигеном диаминобензидином, входящим в состав кита. Количественную оценку иммунореактивности производили с использованием той же системы анализа изображения, что и в случае морфометрического анализа семенников. Оценивали среднюю оптическую плотность окраски в иммунопозитивных клетках Лейдига. Подсчет производился на 4 срезах от каждого животного, анализировали иммуногистохимическое окрашивание не менее 50 клеток Лейдига на каждом срезе. На основании оценки оптической плотности иммунопозитивные клетки разделяли на 3 класса: слабо- (0.05–0.1 ед. оптической плотности, 3-й класс), средне- (0.1–0.25 ед. оптической плотности, 2-й класс) и сильноиммунозитивные (0.25–0.5 ед. оптической плотности, 1-й класс) клетки.
Для оценки общей иммунореактивности (ОИр) использовали формулу:
Каждая группа пренатально стрессированных и контрольных самцов, подвергнутых декапитации, состояла из 5 животных.
В отдельной серии экспериментов оценивали репродуктивный потенциал самцов двух экспериментальных групп. С этой целью каждого самца подсаживали к двум рецептивным самкам, находящимся в стадии проэструс/эструс. На следующий день у самок брали вагинальный мазок для выявления в нем сперматозоидов. Если сперматозоиды обнаружены не были, то самцов оставляли с самками еще на один эстральный цикл с ежедневным забором вагинальных мазков. Фиксировали латентный период появления сперматозоидов в вагинальном мазке. Далее оплодотворенных самок оставляли в группах до 19-го дня беременности, а далее по одной особи в клетке. После родов на 2-й день производили подсчет числа самцов и самок в пометах. В данной серии экспериментов каждая группа самцов состояла из 5 животных.
Определение уровня гормонов в плазме крови проводили методом иммуноферментного анализа, используя стандартные наборы производства ХЕМА (Россия) для кортикостерона и тестостерона. Оценку реакции проводили на анализаторе Multickan FS (ThermoFisherScientific, Финляндия). Перед началом определения плазму размораживали. Дальнейшее определение уровней гормонов в плазме крови проводили согласно инструкции производителя.
Статистический анализ полученных данных проводи с использованием однофакторного ANOVA с последующим парными post-hoc (тест Тьюкки) сравнением отдельных групп. Расчеты осуществляли в пакете программ STATISTICA 12.0. В качестве критерия достоверности принимали p < 0.05. Результаты представлены в виде среднего арифметического ± стандартная ошибка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования показали, что пренатально стрессированные самцы существенно отличаются от контрольных крыс по большинству исследованных параметров. Выявлено увеличение массы тела и семенников у пренатально стрессированные животных, однако весовой индекс (отношение массы семенников к массе тела × 100%) у них был статистически значимо снижен по сравнению с контрольными самцами (табл. 1). При этом уровень тестостерона и кортикостерона у пренатально стрессированные самцов был повышен.
Таблица 1.
Показатели состояния пренатально стрессированных самцов крыс
| Показатель | Контрольные самцы (n = 5) |
Пренатально
стрессированные самцы (n = 5) |
| Масса животных, г | 297.5 ± 5.9 | 334 ± 11.1* |
| Масса надпочечников, г | 67.2 ± 3.7 | 64.2 ± 0.6 |
| Масса семенников, г | 3.2 ± 0.04 | 3.4 ± 0.07* |
| Весовой индекс семенников, % | 1.08 ± 0.02 | 1.01 ± 0.03* |
| Содержание кортикостерона в плазме крови, нмоль/л | 161 ± 22.6 | 251 ± 28.7* |
| Содержание тестостерона в плазме крови, нмоль/л | 10.0 ± 1.9 | 18.5 ± 2.5* |
Морфометрический анализ извитых семенных канальцев показал, что у пренатально стрессированных самцов увеличена площадь поперечного сечения и площадь сперматогенного эпителия извитого семенного канальца (табл. 2). Количество клеток Сертоли и их площадь также были увеличены у пренатально стрессированных самцов. При этом количество клеток Лейдига в интерстициальной ткани снижено, а их площадь увеличена по сравнению с контрольными животными. Обнаружено нарушение сперматогенеза вследствие пренатального стресса, о чем свидетельствовало снижение числа сперматоцитов и сперматид в сперматогенном эпителии, а также числа сперматозоидов в просвете извитого семенного канальца. Выявлено также снижение клеточного индекса Сертоли у пренатально стрессированных самцов. Тем не менее, общий показатель сперматогенеза у опытных и контрольных самцов не различался. Обнаружено также увеличение числа аномальных спермиев, выделенных из эпидидимиса пренатально стрессированных самцов. Кроме того, у этих самцов отмечено увеличение числа неподвижных сперматозоидов, хотя число подвижных сперматозоидов между пренатально стрессированными и контрольными самцами не различалось (рис. 1). Различий в латентном периоде оплодотворения самок (табл. 2), а также в числе крысят в пометах (рис. 2) между контрольными и пренатально стрессированными самцами обнаружено не было.
Таблица 2.
Морфометрические показатели извитых семенных канальцев (ИСК), показатели сперматогенеза и качества сперматозоидов
| Показатель | Контрольные самцы (n = 5) |
Пренатально стрессированные самцы (n =5 ) |
|---|---|---|
| Площадь поперечного сечения ИСК, мкм2 | 67815 ± 3210 | 74 864 ± 2774* |
| Площадь сперматогенного эпителия ИСК, мкм2 | 46 494 ± 2838 | 53 838 ± 2022* |
| Толщина сперматогенного эпителия ИСК, мкм | 39.2 ± 2.4 | 44.2 ± 1.9 |
| Количество клеток Сертоли в сперматогенном эпителии | 33.8 ± 1.4 | 45.9 ± 1.6*** |
| Площадь клеток Сертоли, мкм2 | 98 ± 5.9 | 112 ± 4.5* |
| Количество сперматогониев в сперматогенном эпителии | 58 ± 4.9 | 49.4 ± 4.3 |
| Количество сперматоцитов в сперматогенном эпителии | 49.8 ± 0.9 | 46.5 ± 0.9* |
| Количество сперматид в сперматогенном эпителии | 141.5 ± 2.7 | 111 ± 6.3* |
| Количество сперматозоидов в просвете извитого семенного канальца | 329 ± 22.9 | 264 ± 2* |
| Количество клеток Лейдига в интерстициальной ткани | 126 ± 5.0 | 111 ± 5.9* |
| Площадь клеток Лейдига, мкм2 | 36.8 ± 1.5 | 42.4 ± 1.4* |
| Общий показатель сперматогенеза | 2.5 ± 0.1 | 2.8 ± 0.2 |
| Клеточный индекс Сертоли | 7.7 ± 0.3 | 4.9 ± 0.2*** |
| Число аномальных спермиев, выделенных из эпидидимиса, % | 1.9 ± 0.3 | 3.9 ± 0.3** |
| Латентный период оплодотворения самок, сут | 1.9 ± 0.3 | 3 ± 0.7 |
Рис. 1.
Показатели подвижности сперматозоидов, выделенных из эпидидимиса пренатально стрессированных и контрольных самцов. Пустые столбики – контрольные крысы; темные столбики – пренатально стрессированные крысы. 1 – число неподвижных сперматозоидов, 2 – число дергающихся сперматозоидов, 3 – число слабо двигающихся сперматозоидов, 4 – число сперматозоидов, совершающих прогрессивные движения. * Достоверные отличия от контрольных крыс (p < 0.05).
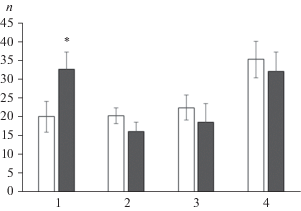
Рис. 2.
Число самцов и самок в пометах, рожденных от пренатально стрессированных и контрольных самцов. Пустые столбики – потомки контрольных самцов; темные столбики – потомки пренатально стрессированных крыс. 1 – самки, 2 – самцы.

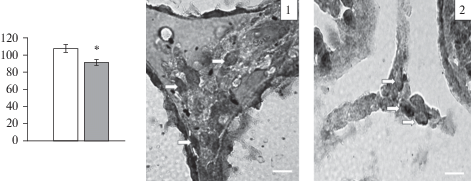
Анализ иммунореактивного вещества в клетках Лейдига показал снижение общей иммунореактивности к ГР клеток у пренатально стрессированных самцов (рис. 3). Следует отметить, что иммунопозитивные к ГР клетки были обнаружены и в сперматогенном эпителии семенного канальца (рис. 4). В связи с тем, что определение типа сперматогенных клеток был затруднен, в данном случае уровень экспрессии ГР не определяли.
Рис. 3.
Общая иммунореактивность к глюкокортикоидным рецепторам в клетках Лейдига пренатально стрессированных и контрольных животных. Пустые столбики – контрольные крысы; темные столбики – пренатально стрессированные крысы. * – Достоверные отличия от контрольных крыс (p < 0.01). 1 – контрольные самцы, 2 – пренатально стрессированные самцы. Стрелками обозначены клетки Лейдига. Масштаб – 20 мкм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования показали значительное изменение сперматогенеза у пренатально стрессированных самцов, несмотря на повышенный уровень тестостерона. Морфометрические показатели семенных канальцев, такие как площадь поперечного сечения, толщина и площадь сперматогенного эпителия у пренатально стрессированных самцов были увеличены так же, как и количество клеток Сертоли и их площадь. При этом у этих крыс мы обнаружили статистически значимое снижение количества сперматогенных клеток и сперматозоидов в семенных канальцах, увеличение числа аномальных и неподвижных сперматозоидов, выделенных из эпидидимиса. В соответствии с этим клеточный индекс Сертоли, как показатель продуктивности сперматогенеза, был снижен.
Следует отметить, что количество клеток Лейдига в интерстициальной ткани семенников у пренатально стрессированных самцов было снижено, но площадь их увеличена по сравнению с контрольными самцами. Экспрессия ГР в этих клетках пренатально стрессированных самцов также была снижена.
Хорошо известно, что стрессорные воздействия, приводящие к повышению уровня глюкокортикоидов, влияют на продукцию тестостерона клетками Лейдига [8, 16]. Глюкокортикоидные гормоны, взаимодействуя с классическими рецепторами, напрямую ингибируют транскрипцию генов, кодирующие ферменты биосинтеза тестостерона, такие как цитохром P450-зависимый фермент расщепления боковой цепи холестерина и цитохром P450-зависимая 17α-гидроксилаза/17,20-лиаза [17]. Ген регуляторного белка стероидогенеза (StAR) также подавляется глюкокортикоидами [18]. Кроме того, было показано, что снижение продукции тестостерона в условиях повышенного уровня глюкокортикоидов может быть опосредовано индукцией апоптоза в клетках Лейдига и соответственно уменьшением их количества [19, 20]. Помимо этого, глюкокортикоиды могут оказывать быстрое, негеномное действие на клетки Лейдига. Так, было показано, что введение кортикостерона мышам снижает продукцию тестостерона клетками Лейдига в течение 30 мин [21].
Помимо клеток Лейдига, ГР экспрессируются в сперматогониях. Было показано, что введение дексаметазона крысам индуцирует апоптоз в этих сперматогенных клетках. Совместное введение дексаметазона и антагониста ГР мефипристона устраняет проапоптотический эффект дексаметазона, что свидетельствует о вовлечении ГР в действие экзогенного глюкокортикоида [22]. Кроме того, было показано, что в условиях хронического стресса наблюдается ингибирование клеточного цикла в сперматогониях на G0/G1 фазе, что приводило к снижению числа сперматид в сперматогенном эпителии и сперматозоидов в эпидидимисе [16]. Интересно, что стресс в данном исследовании приводил к активации ГР, а введение антагониста ГР нормализовало число сперматозоидов у стрессированных крыс. Несмотря на то, что мы не выявили статистически значимого изменения числа сперматогониев в сперматогенном эпителии семенников пренатально стрессированных крыс, вероятно, снижение числа других сперматогенных клеток может быть обусловлено действием повышенного уровня кортикостерона на сперматогонии.
Следует отметить, что определенные нарушения сперматогенеза у пренатально стрессированных самцов не влияли на общий показатель сперматогенеза, оцениваемый по соотношению сперматогониев к сперматоцитам, что может быть обусловлено увеличением числа клеток Сертоли, поддерживающих процесс сперматогенеза [23]. Более того, увеличение числа аномальных и неподвижных сперматозоидов, выделенных из эпидидимиса пренатально стрессированных самцов, существенным образом не сказывалось на их оплодотворяющей способности. Хотя латентный период оплодотворения самок у пренатально стрессированных самцов был несколько увеличен, в конечном итоге эти самцы оплодотворили всех самок. Количество крысят в пометах контрольных и пренатально стрессированных самцов также не различалось. Вероятнее всего, это определяется тем, что сперматозоиды продуцируются с избытком, а наличие в сперме пренатально стрессированных самцов нормальных подвижных сперматозоидов оказывается достаточным для реализации их репродуктивных функций. Мы также предполагаем, что повышение уровня тестостерона у пренатально стрессированных самцов является компенсаторным, что позволяет поддерживать активность клеток Сертоли для обеспечения сперматогенеза. Тем не менее, повышенный уровень глюкокортикоидных гормонов в сочетании с увеличенной стрессорной реактивностью пренатально стрессированных самцов может иметь более негативные последствия на их репродуктивные способности в неблагоприятных условиях (стрессорные воздействия) по сравнению с интактными самцами, что будет исследовано в дальнейших экспериментах.
Список литературы
Ward IL, Ward OB, Winn RJ, Bielawski (1994) Male and female sexual behavior potential of male rats prenatally exposed to the influence of alcohol, stress, or both factors. Behav Neurosci 108: 1188–1195. https://doi.org/10.1037//0735-7044.108.6.1188
Ordyan N., Pivina SG (2005) Effects of prenatal stress on the activity of an enzyme involved in neurosteroid synthesis during the “critical period” of sexual differentiation of the brain in male rats. Neurosci Behav Physiol. 35: 931–935.
Ward IL, Ward OB, Affuso JD, Long III WD, French JA, Hendrick SE (2003) Fetal testosterone surge: specific modulations induced in male rats by maternal stress and/or alcohol consumption. Horm Behav 43: 531–539. https://doi.org/10.1016/s0018-506x(03)00061-8
Weisz J, Brown BL, Ward IL (1982) Maternal stress decreases steroid aromatase activity in brains of male and female rat fetuses. Neuroendocrinology 35: 374–379. https://doi.org/10.1159/000123410
Tobet S, Knoll JG, Hartshorn C, Aurand E, Stratton M, Kumar P, Searcy B, McClellan K (2009) Brain sex differences and hormone influences: a moving experience? J Nuroendocrinol 21: 387–392. https://doi.org/10.1111/j.1365-2826.2009.01834.x
Ward IL, Bennett AL, Ward OB, Shelton E, Hendricks SE, French JA (1999) Androgen threshold to activate copulation differs in male rats prenatally exposed to alcohol, stress, or both factors. Hormon Behav 36: 129–140. https://doi.org/10.1006/hbeh.1999.1534
Page KC, Sottas CM, Hardy MP (2001) Prenatal exposure to dexamethasone alters Leydig cell steroidogenic capacity in immature and adult rats. J Andrology 22: 973–980. https://doi.org/10.1002/j.1939-4640.2001.tb03438.x
Hu G.-X, Lian Q.-Q, Lin H, Latif SA, Morris DJ, Hardy MP, Gea R-S (2008) Rapid mechanisms of glucocorticoid signaling in the Leydig cell. Steroids. 73: 1018–1024. https://doi.org/10.1016/j.steroids.2007.12.020
Whirledge S, Cidlowski JA (2017) Glucocorticoids and Reproduction: Traffic Control on the Road to Reproduction. Trends Endocrinol Metab 28: 399–415. https://doi.org/10.1016/j.tem.2017.02.005
Smith LB, Walker WH (2014) The regulation of spermatogenesis by androgens. Semin Cell Dev Biol 30: 2–13. https://doi.org/10.1016/0018-506x(92)90005-g
Hazra R, Upton D, Jimenez M, Desai R, Handelsman DJ, Allan CM (2014) In vivo actions of the Sertoli cell glucocorticoid receptor. Endocrinology 155: 1120–1130. https://doi.org/10.1210/en.2013-1940
Ward IL (1972) Prenatal stress feminizes and demasculinizes the behavior of males. Science 175: 82–84. https://doi.org/10.1126/science.175.4017.82
Griswold MD (2018) 50 years of spermatogenesis: Sertoli cells and their interactions with germ cells. Biol Reprod 99: 87–100. https://doi.org/10.1093/biolre/ioy027
Michaelis M, Sobczak A, Ludwig C, Marvanová H, Langhammer M, Schön J, Weitze J (2020) Altered testicular cell type composition in males of two outbred mouse lines selected for high fertility. Andrology 8: 1419–1427. https://doi.org/10.1111/andr.12802
Boos A, Kohtes J, Janssen V, Mülling C, Stelljes A, Zerbe H, Hässig M, Thole HH (2006) Pregnancy effects on distribution of progesterone receptors, oestrogen receptor alpha, glucocorticoid receptors, Ki-67 antigen and apoptosis in the bovine interplacentomal uterine wall and foetal membranes. Anim Reprod Sci 91: 55–76. https://doi.org/10.1016/j.anireprosci.2005.03.012
Zou P, Wang X, Yang W, Liu C, Chen Q, Yang H, Zhou N, Zeng Y, Chen H, Zhang G, Liu J, Cao J, Ao L, Sun L (2019) Mechanisms of stress-induced spermatogenesis impairment in male rats following unpredictable chronic mild stress (uCMS). Int J Mol Sci 20: 4470. https://doi.org/10.3390/ijms20184470
Wang Y, Chen F, Ye L, Zirkin B, Chen H (2017) Steroidogenesis in Leydig Cells: Effects of Aging and Environmental Factors. Reproduction 154: R111–R122. https://doi.org/10.1530/REP-17-0064
Wang XJ, Walsh LP, Reinhart AJ, Stocco DM (2000) The role of arachidonic acid in steroidogenesis and steroidogenic acute regulatory (StAR) gene and protein expression. J Biol Chem 275: 20204–20209. https://doi.org/10.1074/jbc.M003113200
Yazawa H, Sasagawa I, Nakada T (2000) Apoptosis of testicular germ cells induced by exogenous glucocorticoid in rats. Hum Reprod 15: 1917–1920. https://doi.org/10.1093/humrep/15.9.1917
Gao HB, Tong MH, Hu YQ, You HY, Guo QS, Ge RS, Hardy MP (2003) Mechanisms of glucocorticoidinduced Leydig cell apoptosis. Mol Cell Endocrinol 199: 153–163. https://doi.org/10.1016/s0303-7207(02)00290-3
Dong Q, Salva A, Sottas CM, Niu E, Holmes M, Hardy MP (2004) Rapid glucocorticoid mediation of suppressed testosterone biosynthesis in male mice subjected to immobilization stress. J Andrology 25: 972–981. https://doi.org/10.1002/j.1939-4640.2004.tb03170.x
Ren L, Zhang Y, Xin Y, Chen G, Sun X, Chen Y, He B (2021) Dysfunction in Sertoli cells participates in glucocorticoid induced impairment of spermatogenesis. Mol Reprod Dev 88: 405–415. https://doi.org/10.1002/mrd.23515
Crisostomo L, Alves MG, Gorga A, Sousa M, Riera MF, Galardo MN, Meroni SB, Oliveira PF (2018) Molecular mechanisms and signaling pathways involved in the nutritional support of spermatogenesis by Sertoli cells. Methods Molecul Biol 1748: 129–155. https://doi.org/10.1007/978-1-4939-7698-0_11
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова