Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1289-1298
Реорганизация сети интернейронов, экспрессирующих парвальбумин, в неокортексе крыс после перинатальной гипоксии и возможность ее фармакологической коррекции
Л. И. Хожай 1, *, В. А. Отеллин 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 20.05.2021
После доработки 30.06.2021
Принята к публикации 05.07.2021
Аннотация
Известно, что популяция тормозных ГАМКеpгичеcкиx интернейpонов неодноpодна и cоcтоит из неcколькиx субпопуляций нейронов, имеющиx pазное функциональное назначение. Одной из них является субпопуляция нейронов, экспрессирующих кальций-cвязывающий белок паpвальбумин и влияющих на cинxpонную импульcную активноcть основных пирамидных нейpонов. Целью исследования было изучить реакцию интернейронов неокортекса, экспрессирующих парвальбумин, на воздействие гипоксии в неонатальный период и оценить нейропротективные свойства фенибута (гидрохлорида гамма-амино-бета-фенилмасляной кислоты), ноотропного препарата, производного ГАМК. Воздействие гипоксии осуществляли в камере с дыхательной смесью, содержащей 7.8% кислорода. Выявление нейронов, содержащих парвальбумин, проводили с использованием первичных кроличьих поликлональных антител к парвальбумину. Исследование сенсомоторной области неокортекса осуществляли на 10-е постнатальные сутки (П10). Показано, что к концу неонатального периода (П10) в неокортексе у контрольных животных присутствует значительная по численности субпопуляция нейронов, экспрессирующих парвальбумин, представленная двумя типами клеток. Наибольшая их локализация выявлена в верхних и средних слоях неокортекса (II–IV и слое V). После воздействия перинатальной гипоксии во всех слоях коры численность нейронов, экспрессирующих парвальбумин, значительно сокращалась: в слое II в 1.4 раза; в слоях III и IV в 2.4 раза; в глубоких слоях: в слое V в 1.9 раза; в слое VI в 1.4 (p < 0.05). Применение фенибута в терапевтической дозе сразу после воздействия гипоксии нивелировало эти нарушения. Во всех слоях неокортекса у животных, переживших воздействие гипоксии, число нейронов, экспрессирующих парвальбумин, увеличивалось и соответствовало контрольным значениям. Полученные данные свидетельствуют о том, что воздействие гипоксии снижает численность нейронов, экспрессирующих парвальбумин, и дают основание предполагать, что в неонатальный период после воздействия гипоксии фармакологический препарат фенибут может оказывать нейропротективное действие на клетки этой субпопуляции тормозных интернейронов.
ВВЕДЕНИЕ
Развитие и становление неокортекса у млекопитающих и человека является одним из важных и сложных процессов, происходящих в онтогенезе. В неокортексе человека формируются структурные и функциональные механизмы речи, мышления, сенсорных ответов и других когнитивных реакций. В состав коры головного мозга входят разные типы нейронов, каждый из которых обладает специфическими молекулярными и функциональными характеристиками [1].
Оcобый cтатуc имеют тормозные ГАМКеpгичеcкие интернейpоны, pегулирующие активноcть отдельныx популяций пирамидных нейpонов неокортекса. Известно, что большинство (приблизительно 70%) корковых нейронов являются пирамидными клетками, а 20–30% от общего количества неокортикальных нейронов представляют тормозные ГАМКергические интернейроны [1, 2] Популяция ГАМКеpгичеcкиx интернейpонов неодноpодна и cоcтоит из неcколькиx субпопуляций, имеющиx pазное функциональное назначение и pазличные молекуляpные меxанизмы pегуляции. Отдельные подтипы ГАМКеpгичеcкиx интернейpонов cодеpжат кальций-cвязывающие белки (паpвальбумин, кальбиндин и кальpетинин, т.е. белки, колокализующиеся с ГАМК) и являются главными буфеpами кальция в нейpонаx [1–7]. В настоящее время известно, что кальций-связывающий белок парвальбумин играет важную роль во многих физиологических процессах, влияет на пpоцеccы возбуждения и cинxpонную импульcную активноcть основных пирамидных нейpонов [5].
Известно, что повpеждение тоpмозныx меxанизмов ГАМКеpгичеcкой пеpедачи вызывает гипеpактивацию и гипеpcинxpонизацию нейpонов в cети [5], а наpушение функции интернейpонов, экспрессирующих парвальбумин, пpиводит к pазвитию нейpодегенеpативныx заболеваний, такиx как cиндpом Туpетта, болезнь Паpкинcона, шизофpения, эпилепcия, аутизм т.д. [8, 9].
Одним из значимых повреждающих факторов в неонатальный период является гипоксия/ишемия. Повреждения головного мозга после воздействия гипоксии в этот период относят к основным причинам детской смерти. Значительная часть новорожденных, перенесших тяжелую гипоксию/ишемию в неонатальный период, имеет психоневрологические расстройства различной степени тяжести с последующей инвалидизацией [10].
Установлено, что перинатальная гипоксия оказывает повреждающее действие на ГАМКергические интернейроны неокортекса, вызывая сокращение их численности, снижение экспрессии рецепторных белков к ГАМК. При этом, учитывая физиологическую важность субпопуляции ГАКМергических интернейронов, экспрессирующих парвальбумин, до сих пор неизвестно, какова их реакция на воздействие гипоксии в неонатальный период.
Несмотря на хорошо известный факт о том, что гипоксия в ранний период развития является мощным повреждающим фактором, в настоящее время отсутствуют средства для фармакологической коррекции последствий воздействия перинатальной гипоксии на мозг. Поэтому, поиск и разработка высокоэффективных средств для коррекции этих повреждений является одной из актуальных задач современной фармакологии.
Установлено, что некоторые препараты производные ГАМК в условиях гипоксии могут оказывать антигипоксическое действие и активировать ферменты антиоксидантной защиты [11, 12]. Одним из них является ноотропный препарат фенибут, синтезированный на основе ГАМК, действующим веществом которого является гидрохлорид гамма-амино-бета-фенилмасляной кислоты. В настоящее время неизвестно, существует ли возможность применения фенибута в неонатальный период для коррекции выявленных структурных нарушений в неокортексе после воздействия гипоксии.
В связи с этим, целью исследования было изучить реакцию интернейронов неокортекса, экспрессирующих парвальбумин, на воздействие гипоксии в неонатальный период у крыс и оценить нейропротективные свойства фенибута.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на лабораторных крысах линии Вистар из питомника Института физиологии им. И.П. Павлова РАН.
Соблюдение этических стандартов. Все процедуры с животными проводились в соответствии с “Правилами проведения работ с использованием экспериментальных животных” и при соблюдении требований Совета Европейского сообщества (86/609/ЕЕС) об использовании лабораторных животных. Протоколы опытов были утверждены Комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН. Настоящая статья не содержит результатов каких-либо исследований с участием людей в качестве объектов исследований.
Воздействие гипоксии. Воздействие общей острой гипоксии на новорожденных крыс осуществляли в специальной камере в течение 1 ч при содержании в дыхательной смеси: кислорода – 7.6–7.8%; углекислого газа – 0.15–0.21%; азота – 91.8%, при температуре 21.3–23°С и нормальном общем атмосферном давлении (760 мм рт. ст.). Воздействие гипоксии проводилось на 2-е постнатальные сутки (модель недоношенной беременности человека).
В работе использовали 3 группы животных: 1) крысы, подвергавшиеся в барокамере воздействию гипоксии; 2) крысы, подвергавшиеся воздействию гипоксии и получавшие фенибут; 3) контрольные животные того же возраста, получавшие инъекции физиологического раствора. Каждая группа содержала по 8–10 животных, отобранных из разных пометов. Исследовали сенсомоторную область неокортекса на 10-е постнатальные сутки ( П10), т.е. в конце неонатального периода. (Известно, что сенсомоторная область неокортекса получает и обрабатывает сигналы от чувствительных периферических рецепторов, проводит сигналы в таламические структуры и спинной мозг. Эта область неокортекса является местом инициации основного двигательного ответа и активации двигательного поведения).
Головной мозг извлекали и фиксировали в цинк-этанол-формальдегиде на фосфатно-солевом буфере (рН 7.4) в течение 24 ч, заливали в парафин по общепринятой методике и готовили серийные фронтальные срезы мозга толщиной 6–7 мкм на уровне брегмы –1.80–2.04 мм [13]. Затем срезы помещали на предметные стекла Super-Frost Plus Gold (Menzel-Glaser, Германия).
Применение фенибута. Для попытки фармакологической коррекции выявленных структурных нарушений в неокортексе было использовано лекарственное средство фенибут (бета-фенил гамма-аминомасляной кислоты гидрохлорид) отечественный препарат, синтезированный на основе ГАМК. Фенибут – ноотропный препарат, применяемый при тревожных состояниях, психопатических нарушениях, неврозах, патологической гиперактивности у детей и т.д. Фенибут вводили подкожно 1 раз в сутки в терапевтической дозе 15 мг/кг в течение 10 сут, т.е. в течение всего неонатального периода.
Иммуногистохимическое исследование. Иммуногистохимическую реакцию на парвальбумин проводили с использованием кроличьих поликлональных антител (Anti-Parvalbumin antibody (ab11427), Abcam, Великобритания) в разведении 1 : 100. После процедуры теплового демаскирования белков в цитратном буфере (рН 6.1, Dako, Дания) в течение 25 мин срезы инкубировали в первичных антителах при 4°С в течение 18 ч. В качестве вторичных антител использовали реактивы из набора EnVision + System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США). Срезы помещались во вторичные антитела на 40 мин при комнатной температуре. Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). После проведения иммуноцитохимической реакции часть срезов докрашивали гематоксилином Джилла и заключали в синтетическую заливочную среду Permaunt (Termo, США). При проведении иммуногистохимической реакции все процедуры были стандартизированы и осуществлялись одновременно для гистологических срезов, полученных от контрольных и подопытных животных. Специфичность иммунной реакции проверяли с помощью негативного контроля (без первичных антител).
Статистическая оценка результатов исследования. Подсчет иммуно-положительных клеток, имеющих иммунную окраску цитоплазмы и отростков, проводили на цифровых изображениях, полученных с гистологических препаратов фронтальных срезов мозга на условной единице площади равной 0.1 мм2, выбранной в центральной части каждого слоя, при увеличении объектива ×20. Численный анализ данных осуществляли на цифровых изображениях, полученных с 10–12 гистологических срезов мозга, взятого от 5–6 животных каждой исследуемой группы при помощи компьютерных программ ImageJ (NIH, США), Origin 5.0. Измерения размеров клеточных тел проводили на цифровых изображениях серийных срезов, полученных при помощи светового микроскопа Leica DME (Leica, Германия) и цифровой камеры Leica EC3 (Leica, Германия) при увеличении объектива ×100. Статистически обработанные данные представлены как средние значения ± стандартная ошибка среднего (М ± SEM). Для анализа и сравнения межгрупповых различий между средними значениями полученных показателей использовали t-критерий Стъюдента и oneway ANOVA. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование проведено на стадии П10 (поздний неонатальный период). У контрольных животных в верхних слоях неокортекса II, III–IV и слое V на условной единице площади присутствует большое число клеток, иммунопозитивных на парвальбумин, при этом в слое VI их число значительно ниже (табл. 1). Иммунопозитивные на парвальбумин нейроны отличаются по форме клеточного тела, они имеют или мультиполярную, или веретеновидную форму. Иммунопозитивные на парвальбумин нейроны по размеру клеточных тел представлены двумя группами: крупными клетками (у которых площадь клеточного тела в среднем составляла 1915.3 мкм2) и клетками меньшего размера и (у которых площадь клеточного тела в среднем составляла 1267.0 мкм2) (табл. 2) (рис. 1d).
Таблица 1.
Изменение на стадии П10 численности нейронов, экспрессирующих парвальбумин, в разных слоях неокортекса у крыс в контроле, после воздействия перинатальной гипоксии и воздействия гипоксии совместно с получением фенибута (число клеток на условной единице площади)
| Слои неокортекса | Контроль | Воздействие гипоксии | Воздействие гипоксии + фенибут |
|---|---|---|---|
| II | 26.4 ± 4.7 | 18.3 ± 3.2 | 20.8 ± 2.4 |
| III–IV | 29.6 ± 4.3 | 12.4 ± 5.1* | 24.6 ± 3.1* |
| V | 21.5 ± 3.6 | 11.6 ± 1.3# | 18.1 ± 1.9# |
| VI | 10.2 ± 2.7 | 7.5 ± 2.2 | 8.4 ± 1.8 |
Таблица 2.
Размеры клеточных тел нейронов, экспрессирующих парвальбумин, в неокортексе у крыс в контроле, после воздействия перинатальной гипоксии и воздействия гипоксии совместно с получением фенибута (в мкм2)
| Размер клеток | КП10 | ГП10 | ГП10 + фенибут |
|---|---|---|---|
| Площадь тела крупных клеток | 1970.2 ± 218.4 | 1874.8 ± 258.4 | 1901.3 ± 239.7 |
| Площадь тела мелких клеток | 1319.6 ± 176.2 | 1354.6 ± 162.6 | 1126.7 ± 204.4 |
Рис. 1.
Неокортекс крысы, сенсомоторная область на 10-е постнатальные сутки (П10); иммуногистохимическая реакция на парвальбумин, иммуноположительные клетки (стрелки). a – контроль; b – после воздействия перинатальной гипоксии; c – после воздействия гипоксии и применения фенибута; d – слой V, контроль, иммуноположительные нейроны большого размера (длинная стрелка) и меньшего размера (короткие стрелки); e – слой V, после воздействия перинатальной гипоксии, иммуноположительные нейроны (длинная стрелка); f – слой V, после воздействия перинатальной гипоксии и применения фенибута, иммуноположиельные нейроны большого размера (длинная стрелка) и меньшего размера (короткая стрелка). Увел.: (a, b, c) об. ×10; (e, d, f) об. ×100.
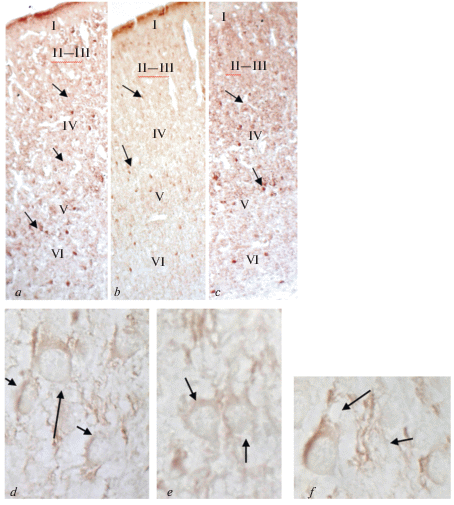
У крыс, подвергавшихся воздействию перинатальной гипоксии, к концу неонатального периода во всех слоях неокортекса число нейронов, иммунопозитивных на парвальбумин, значительно снижалось по сравнению с контрольными значениеми: в слое II в 1.4 раза; в слоях III–IV в 2.4 раза; в слое V в 1.9 раза; однако в слое VI число клеток не изменялось (при p < 0.05) (табл. 1) (рис. 1a, b). Следует отметить, что форма и размеры клеточных тел нейронов, иммунопозитивных на парвальбумин, соответствуют таковым у контрольных животных (табл. 2) (рис. 1d, e).
У крыс, подвергавшихся воздействию гипоксии и получавших фенибут, число иммуноположительных клеток резко возрастает по сравнению со значениями у животных, подвергавшихся гипоксии (рис. 1a–c). Значимое повышение численности интернейронов, иммунопозитивных на парвальбумин, имеет место в слоях III–IV и слое V (табл. 1). В слоях III–IV число клеток увеличивается почти в 2 раза, а в слое V в 1.6 раза по сравнению со значениями предыдущей серии экспрепиментов. В слое VI число клеток, иммунопозитивных на парвальбумин, почти соответствует его значению в предыдущей серии опытов. Форма и размеры клеточных тел нейронов, иммунопозитивных на парвальбумин, соответствуют таковым у контрольных животных и у крыс подвергавшихся воздействию перинатальной гипоксии (табл. 2) (рис. 1d, e).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Во всех слоях неокортекса млекопитающих, достигших половозрелого возраста, присутствуют тормозные ГАМКергические интернейроны, где они являются постоянным компонентом локальных тормозных межнейронных цепей [1]. Одна из субпопуляций ГАМКергических интернейронов, экспрессирующих кальций-связывающий белок парвальбумин, представляет главный подтип корковых ГАМКергических интернейронов, специализированных на обеспечение быстрого перисоматического торможения основных пирамидных нейронов [5].
Установлено, что во взрослом неокортексе парвальбумин экспрессируют 20–25% клеток от общего числа ГАМКергических интернейронов [14, 15]. Они представлены двумя типами клеток: корзинчатыми клетками (большими и малыми) и клетками-канделябрами. Большие и малые корзинчатые интернейроны имеют мультиполярную или веретеновидную форму клеточного тела и радиально расходящиеся дендриты. Их аксоны дают начало многим длинным горизонтально и вертикально ориентированным коллатералям. Установлено, что большие корзинчатые клетки являются основным источником горизонтального торможения в пределах слоя своей локализации. Их боковые аксональные коллатерали формируют перисоматическое торможение, образуя корзинки вокруг клеточных тел соседних нейронов, в том числе и ГАМКергических. Кроме того, это единственные тормозные интернейроны, имеющие контакты с возбуждающими таламическими волокнами [1]. Клетки-канделябры также имеют мультиполярную или овальную форму клеточного тела, обширно ветвящиеся аксональные претерминальные сегменты, которые формируют короткие вертикально ориентированные ряды терминальных коллатералей, иннервирующих только начальные сегменты аксонов пирамидальных клеток, эти клетки никогда не иннервируют другие интернейроны [1]. Показано, что во взрослом мозге эти интернейроны в бóльшем количестве встречаются в средних кортикальных слоях [14, 15]
Результаты исследования показали, что к концу неонатального периода (стадия П10) в неокортексе контрольных животных присутствует значительная по численности субпопуляция нейронов, экспрессирующих парвальбумин, представленная двумя типами клеток, отличающихся по размеру клеточных тел. Наибольшая их локализация оказалась в верхнем и средних слоях II, III–IV и слое V (табл. 1), что согласуется с наблюдениями, полученными при исследовании взрослого неокортекса [14, 15], и свидетельствует о том, что в неонатальном периоде уже существует субпопуляция нейронов, экспрессирующих парвальбумин, представленная двумя типами клеток, различающихся по размеру.
Полученные данные показали, что после воздействия перинатальной гипоксии во всех слоях коры численность нейронов, экспрессирующих парвальбумин, значительно сокращается, особенно в средних слоях III–IV и слое V: в слое II в 1.4 раза; в слоях III–IV в 2.4 раза; в глубоких слоях: в слое V в 1.9 раза; в слое VI в 1.4. При этом размер клеточных тел по сравнению с таковым в контроле не изменяется. Результаты показали, что применение в неонатальный период фенибута в терапевтической дозе нивелирует нарушения, вызванные воздействием гипоксии. Во всех слоях неокортекса число нейронов, экспрессирующих парвальбумин, почти соответствует контрольным значениям (различия значений в контроле и после воздействия гипоксии с применением фенибута не достоверны) (табл. 1). Эти данные дают основание предполагать, что фенибут оказывает нейропротективное действие на интернейроны, содержащие парвальбумин, хотя механизм этого эффекта пока неясен.
Молекулярные и структурные механизмы гипоксического повреждения клеток головного мозга млекопитающих изучались многими исследователями [16–18] и продолжают изучаться до сих пор. Согласно полученным данным работ, выполненных на различных экспериментальных моделях, центральное место в повреждении клеток головного мозга при развитии острой гипоксии любой этиологии принадлежит: 1) прогрессирующим нарушениям ионного гомеостаза, 2) глутаматергической сигнальной трансдукции и 3) окислительному стрессу [18–20]. Существующая в настоящее время гипотеза кальций-зависимого повреждения нервных клеток предполагает, что острая гипоксия мозга приводит к резкому увеличению диффузного нерегулируемого перемещения ионов калия из клетки в межклеточное пространство, а ионов натрия, кальция и хлора — в цитоплазму клетки по градиенту концентрации, вызывающего длительную деполяризацию мембраны нейронов [21]. Считается, что чрезмерный транспорт Ca2+ в клетку с участием NMDA- и АМРА-рецепторов является главным токсическим воздействеим глутамата, с участием которого также начинается целый каскад повреждающих процессов [22–24]. Также высокое содержание ионов кальция вызывает стимуляцию NO-синтазы и увеличение образования NO. Активация NADPH-оксидазы при действии гипоксии образует большое количество супероксидных радикалов, и в результате кальциевый стресс способствует развитию оксидативного и нитрозативного стресса. Конечно, существуют и другие факторы, повреждающее действие которых запускается при воздействии гипоксии. Что касается выявленных нейропротективных свойств фенибута, который является веществом, производным ГАМК, то в настоящее время можно лишь упомянуть о его антиоксидантном свойстве, показанном в ряде исследований [11, 12, 26 ] . Пока трудно определить этап, на котором фенибут может встраиваться в активированные гипоксией повреждающие процессы и оказывать протективное действие на ГАМКергические нейроны. Для этого необходимы дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
Результаты показали, что в неонатальный период в неокортексе крыс присутствует значительная субпопуляция нейронов, экспрессирующих парвальбумин. Наибольшая локализация этих клеток выявляется в верхнем и средних слоях. Воздействие острой перинатальной гипоксии приводит к резкому снижению численности нейронов, экспрессирующих парвальбумин, во всех слоях неокортекса. Применение фенибута в течение неонатального периода нивелирует повреждающее действие гипоксии и способствует сохранению численности этой субпопуляции нейронов.
Список литературы
Druga R (2009) Neocortical Inhibitory System (cortical interneurons/GABAergic neurons/calcium-binding proteins/neuropeptides). Folia Biol (Praha) 55: 201–217.
Jones EG (1975) Varieties and distribution of non-pyramidal cells in the somatic sensory cortex of the squirrel monkey. J Comp Neurol 160: 205–267.
Eggermann E, Jonas P (2011) How the 'slow' Ca2+ buffer parvalbumin affects transmitter release in nanodomain-coupling regimes. Nat Neurosci 15: 20–22. https://doi.org/10.1038/nn.3002
Turovsky EA, Turovskaya MV, Kononov AV, Zinchenko VP (2013) Shortterm episodes of hypoxia induce posthypoxic hyperexcitability and selective death of GABAergic hippocampal neurons. Exp Neurol 250 : 1–7. https://doi.org/10.1016/j.expneurol.2013.09.006
Зинченко ВП, Туpовcкая МВ, Теплов ИЮ, Беpежнов АВ, Туpовcкий ЕА (2016) Роль парвальбумин-содержащих интернейронов в регуляции спонтанной синхронной активности нейронов мозга в культуре. Биофизика 61: 102–111 [Zinchenko VP, Turovskaya MV, Teplov IY, Berezhnov AV, Turovsky EA (2016) The role of parvalbumin-containing interneurons in the regulation of spontaneous synchronous activity of brain neurons in vitro. Biophysics 61: 102–111. (In Russ)].
Kawaguchi Y, Kondo S (2002) Parvalbumin, somatostatin and cholecystokinin as chemical markers form specific GABAergic interneuron types in the rat frontal cortex. J Neurocytol 31: 277–287. https://doi.org/10.1023/a:1024126110356
Kawaguchi Y, Kubota Y (1993) Correlation of physiological subgroupings of nonpyramidal cells with parvalbumin and calbindin D28k-immunoractive neurons in layer V of rat frontal coztex. J Neurophysiol 70: 387–396. https://doi.org/10.1152/jn.1993.70.1.387
Houser C (1991) GABA neurons in seizure disorders: a review of immunocytochemical studies. Neurochem Rev 16: 295–308. https://doi.org/10.1007/BF00966093
Markram H, Toledo-Rodriguez M, Wang Y, Gupta A, Silberberg G, Wu C (2004) Interneurons of the neocortical inhibitory system. Nat Rev Neurosci 5: 793–807. https://doi.org/10.1038/nrn1519
Rees S, Harding R, Walker D (2011) The biological basis of injury and neuroprotection in the fetal and neonatal brain. Int J Dev Neurosci 29: 551–563. https://doi.org/10.1016/j.ijdevneu.2011.04.004
Тюренков ИН, Перфилова ВН, Попова ТА, Иванова ЛБ, Прокофьев ИИ, Гуляева ОВ, Штепа ЛИ (2013) Изменение оксидантного статуса у самок с экспериментальным гестозом под влиянием производных ГАМК. Бюлл экспер биол мед 155 : 340–344. [Tyurenkov IN, Perfilova VN, Popova TA, Ivanova LB, Prokofiev II, Gulyaeva OV, Shtepa LI (2013) Changes in oxidative status in females with experimental gestosis under the influence of GABA derivatives. Bull Exper Biol Med 155: 340–344.(In Russ)].
Попова А, Перфилова ВН, Жакупова ГА, Веровский ВЕ, Островский ОВ, Тюренков ИН (2016) Влияние сулодексида на функциональное состояние митохондрий плеценты cамок крыс с экспериментальной преэклампсией. Биомед химия 62 : 572–576. [Popova A, Perfilova VN, Zhakupova GA, Verovsky VE, Ostrovsky OV, Tyurenkov IN (2016) Influence of sulodexide on the functional state of mitochondria in the placenta of female rats with experimental preeclampsia. Biomed Chem 62: 572–576. (In Russ)].
Paxinos G, Watson C (1998) The Rat Brain in stereotaxic coordinates. London: Press.
Gabbott PL, Bacon SJ (1996) Local circuit neurons in the medial prefrontal cortex (areas 24a, b, c, 25 and 32) in the monkey: I. Cell morphology and morphometrics. Compar Neurol 364: 567–608. https://doi.org/10.1002/(SICI)1096-9861(19960122)364:4<567::AID-CNE1>3.0.CO;2-1
Zaitsev AV, Gonzalez-Burgos G, Povysheva NV, Kröner S, Lewis DA, Krimer LS (2005) Localization of calcium-binding proteins in physiologically and morphologically characterized interneurons of monkey dorsolateral prefrontal cortex. Cereb Cortex 15:1178–1186.https://doi.org/10.1093/cercor/bhh218
Lewén A, Matz P, Chan PHJ (2000) Free radical pathways in CNS injury.Neurotrauma 17: 871–890. https://doi.org/10.1089/neu.2000.17.871
White BC, Sullivan JM, DeGracia DJ, O’Neil BJ, Neumar RW, Grossman LI, Rafols JA, Krause GSJ (2000) Brain ischemia and reperfusion: molecular mechanisms of neuronal injury. Neurol Sci 179: 1–33. https://doi.org/10.1016/s0022-510x(00)00386-5
Heiss WD (2012) The ischemic penumbra: how does tissue injury evolve? Ann N Y Acad Sci 1268: 26–34. https://doi.org/10.1111/j.1749-6632.2012.06668.x
Shouman BO, Mesbah A, Aly H (2008) Iron metabolism and lipid peroxidation products in infants with hypoxic ischemic encephalopathy. J Perinato 28: 487–491. https://doi.org/10.1038/jp.2008.22
Fritz KI, Delivoria-Papadopoulos M (2006) Mechanisms of injury to the newborn brain. Clin Perinatol 33: 573–591. https://doi.org/10.1016/j.clp.2006.06.012
Thibault O, Gant JC, Landfield PW (2007) Expansion of the calcium hypothesis of brain aging and Alzheimer’s disease: minding the store. Aging Cell 6: 307–317. https://doi.org/10.1111/j.1474-9726.2007.00295.x
Verkhratsky A, Toescu ECJ (2003) Endoplasmic reticulum Ca2+ homeostasis and neuronal death. Cell Mol Med 7: 351–361. https://doi.org/10.1111/j.1582-4934.2003.tb00238.x
Tauskela JS, Morley P (2004) On the role of Ca2+ in cerebral ischemic preconditioning. Cell Calcium 36: 313–322. https://doi.org/10.1016/j.ceca.2004.02.008
Distefano G, Praticò AD (2010) Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Ital J Pediatr 16: 36–63. https://doi.org/10.1186/1824-7288-36-63
Tyurenkov IN, Perfilova VN, Sadikova NV (2014) Change of cardiac ino- and chronotropic functions in stressed animals with blockade of different NO-synthases. Vestn Ross Acad Med Nauk 1–2: 46–50.https://doi.org/10.15690/vramn.v69i1-2.941
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


