Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1408-1421
Влияние метформиновой терапии на стимуляцию агонистами рецептора лютеинизирующего гормона продукции тестостерона и сперматогенеза у диабетических крыс
А. А. Бахтюков 1, К. В. Деркач 1, А. М. Степочкина 1, В. Н. Сорокоумов 1, 2, Л. В. Баюнова 1, И. А. Лебедев 1, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 20.08.2021
После доработки 03.09.2021
Принята к публикации 03.09.2021
Аннотация
Восстановление функций мужской репродуктивной системы при сахарном диабете 2-го типа (СД2) представляет собой одну из актуальных проблем современной эндокринологии. Для этого могут быть использованы как препараты, улучшающие глюкозный гомеостаз и инсулиновую чувствительность, в первую очередь метформин, так и активаторы рецептора лютеинизирующего гормона (ЛГР) – хорионический гонадотропин человека (ХГЧ) и низкомолекулярные аллостерические агонисты ЛГР. Целью исследования было изучить влияние метформиновой терапии (4 нед., 120 мг/кг/сутки) на стимулирующие стероидогенез и сперматогенез эффекты, вызываемые пятидневным введением самцам крыс Вистар с СД2 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (ТП03), аллостерического ЛГР-агониста (15 мг/кг/сутки), и ХГЧ (20 МЕ/крысу/сутки). СД2 вызывали высокожировой диетой и инъекцией низкой дозы стрептозотоцина (25 мг/кг). Лечение метформином частично восстанавливало уровни тестостерона и нормализовало сперматогенез у крыс с СД2. В первый день лечение метформином усиливало стероидогенные эффекты ТП03 и ХГЧ, но в последующие дни его потенцирующий эффект не выявлялся. При пятидневной обработке диабетических крыс с помощью ТП03 и ХГЧ восстанавливалось число эпидидимальных сперматозоидов, в том числе с поступательным прямолинейным движением, снижалась доля дефектных форм сперматозоидов. Показатели сперматогенеза при лечении метформином или ЛГР-агонистами по отдельности были сопоставимы с таковыми при их совместном применении. Таким образом, метформиновая терапия усиливает продукцию тестостерона, индуцированную ТП03 и ХГЧ, в первый день обработки этими препаратами, но в дальнейшем стероидогенный и сперматогенный эффекты ЛГР-агонистов в группах диабетических крыс с лечением метформином и без такового существенно не различались.
Одним из осложнений сахарного диабета 2-го типа (СД2), который характеризуется инсулиновой резистентностью, нарушением глюкозного гомеостаза и липидного обмена, являются дисфункции репродуктивной системы и нарушение функциональной активности гипоталамо-гипофизарно-гонадной оси. У мужчин с СД2 развивается андрогенный дефицит и нарушается сперматогенез, что приводит к снижению фертильности и может стать причиной бесплодия [1–4]. Поиск эффективных подходов для восстановления функций мужской репродуктивной системы в условиях СД2 является одной из актуальных проблем современной эндокринологии, что обусловлено как высокими темпами роста заболеваемости СД2 в мире, так и общей тенденцией к снижению рождаемости, в том числе в связи с широким распространением мужского бесплодия.
Для нормализации репродуктивного потенциала у мужчин наиболее часто используют гонадотропины, в том числе хорионический гонадотропин человека (ХГЧ), мишенью которого в тестикулярных клетках является рецептор лютеинизирующего гормона (ЛГР) [5]. ХГЧ, как и ЛГ, с высоким сродством взаимодействует с внеклеточным доменом ЛГР, который относится к рецепторам, сопряженным с гетеротримерными G-белками. Результатом этого является изменение конформации трансмембранного домена ЛГР и активация зависимых от гонадотропинов внутриклеточных сигнальных путей [6]. Ключевую роль здесь играет цАМФ-зависимый путь, который включает Gs-белок, аденилатциклазу и протеинкиназу А и ведет к активации холестерин-транспортирующего белка StAR, катализирующего первую, скорость-лимитирующую стадию стероидогенеза, а также стероидогенных ферментов, осуществляющих синтез тестостерона и его прекурсоров в клетках Лейдига. Модулирующую роль в регуляции стероидогенеза играет и фосфоинозитидный путь, который запускается через посредство ЛГР-опосредуемой активации Gq/11-белков и фосфолипазы Сβ [7]. Синтезированный в клетках Лейдига тестостерон воздействует на клетки Сертоли и, тем самым, контролирует процесс созревания и функциональной активности сперматозоидов (СП). Однако длительная стимуляция ЛГР гонадотропинами и использование их высоких доз, необходимых для достижения значимого стероидогенного эффекта, вызывают активацию β-аррестинов, ответственных за интернализацию и даун-регуляцию ЛГР, а также запускают другие механизмы отрицательной обратной связи. Все это приводит к развитию резистентности клеток Лейдига к гонадотропинам, вследствие чего их отмена способна привести к андрогенной недостаточности и нарушению сперматогенеза [5]. В условиях диабетической патологии вследствие гипергликемии, воспаления и усиления окислительного стресса снижается экспрессия ЛГР в семенниках и нарушается структура его связывающих доменов, что вызывает снижение сродства рецептора к гонадотропинам и ослабляет их эффекты на стероидогенез и сперматогенез [8, 9].
Все вышесказанное указывает на необходимость разработки новых ЛГР-агонистов, более специфичных в отношении внутриклеточных сигнальных каскадов и способных более мягко в сравнении с ХГЧ и ЛГ стимулировать стероидогенные пути, не вызывая резистентности тестикулярных клеток к эндогенным гонадотропинам. Наибольший интерес здесь представляют тиенопиримидиновые производные (ТП), которые на протяжении последних лет разрабатываются нами [10–14] и другими авторами [15–17]. В отличие от гонадотропинов, они взаимодействуют с аллостерическим сайтом, расположенным в трансмембранном домене ЛГР, и не влияют на доступность внеклеточного сайта для гонадотропинов. Их преимуществами являются селективность в отношении цАМФ-зависимого пути, отвечающего за активацию стероидогенеза, отсутствие иммуногенности, а также сохранение активности при пероральном способе введении, поскольку ТП устойчивы к деградации в желудочно-кишечном тракте и хорошо всасываются энтероцитами [10, 11, 18]. Стероидогенные эффекты ТП сейчас интенсивно изучаются [12, 18], но их воздействие на сперматогенез как в норме, так и при СД остается мало изученным.
Препаратом первой линии при лечении СД2 является метформин, который, активируя АМФ-активируемую протеинкиназу (АМФК), основной энергетический сенсор клетки, не только восстанавливает метаболизм и инсулиновую чувствительность, но и улучшает функционирование мужской репродуктивной системы [19, 20]. Ранее нами было показано, что лечение самцов крыс и мышей с различными формами СД восстанавливает у них стероидогенез, улучшает морфологию семенных канальцев, повышает подвижность СП [9, 21, 22]. Основываясь на данных о том, что метформиновая терапия повышает чувствительность семенников диабетических крыс к однократному воздействию ХГЧ [9], мы предположили, что лечение метформином может потенцировать восстановление функций семенников у крыс с СД2 при их обработке ортостерическими (ХГЧ) и аллостерическими (ТП) агонистами ЛГР.
Целью работы было изучить влияние четырехнедельной метформиновой терапии на стимуляцию стероидогенеза и сперматогенеза у самцов крыс с СД2, вызываемую их обработкой с помощью 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (ТП03), разработанного нами аллостерического ЛГР-агониста, и гонадотропина (ХГЧ).
МЕТОДЫ ИССЛЕДОВАНИЯ
Для проведения экспериментов были взяты двухмесячные самцы крыс Вистар (масса тела 170–200 г), которых содержали в стандартных условиях со свободным доступом к корму и воде. Все эксперименты были выполнены в соответствии с требованиями Комитета по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
СД2 вызывали с помощью высокожировой диеты (1 кг смеси содержал 524 г свиного сала, 417 г творога, 50 г печени, 5.3 г L-метионина, 1.85 г дрожжей, 1.85 г NaCl) [23], которую животные получали на протяжении 9 недель, и последующей их обработки низкой дозой (25 мг/кг) стрептозотоцина (“Sigma”, США) с продолжением диеты еще в течение 6 нед. Контрольные животные (К, n = 18) вместо высокожировой диеты получали стандартный корм, а вместо стрептозотоцина им вводили 0.1 М натрий-цитратный буфер (pH 4.5), растворитель стрептозотоцина. В течение всего эксперимента осуществляли мониторинг массы тела и измеряли уровень глюкозы в крови (через 2 ч после еды), для чего использовали тест-полоски “One Touch Ultra” (США) и глюкометр “Life Scan Johnson & Johnson” (Дания). Степень гипергликемии оценивали по уровню гликированного гемоглобина (HbA1c), для чего использовали набор “Multi Test HbA1c System” (“Polymer Technology Systems, Inc.”, США).
Диабетические группы формировали через 2 недели после введения стрептозотоцина, перед началом метформиновой терапии, из крыс с уровнем глюкозы выше 7 мМ (120 мин после глюкозной нагрузки) и содержанием HbA1c выше 5.5%, основываясь на результатах глюкозотолерантного теста (ГТТ). При проведении ГТТ животным (после 12-часового голодания) внутрибрюшинно вводили раствор глюкозы из расчета 2 г глюкозы на 1 кг массы тела, и в течение 120 мин измеряли уровень глюкозы в крови. Диабетических крыс случайным образом распределяли на группы без лечения (Д, n = 18) и с лечением метформином (ДМ, n = 18). Лечение метформином (перорально, суточная доза 120 мг/кг) (“Sigma-Aldrich”, США) крыс группы ДМ осуществляли в течение 4 нед., в то время как группы Д и К вместо метформина в те же сроки и в том же объеме получали его растворитель – дистиллированную воду. Диабетических крыс при этом продолжали содержать на высокожировой диете. Через три недели после начала лечения с целью оценки терапевтического эффекта метформина в группах К, Д и ДМ повторно проводили ГТТ, измеряя уровень глюкозы в течение 120 мин, а через 120 мин оценивая уровень инсулина, который измеряли с помощью наборов “Rat Insulin ELISA kit” (“Mercodia AB”, Швеция).
За пять дней до окончания эксперимента каждую из групп контрольных, нелеченых диабетических и обработанных метформином диабетических крыс дополнительно разделили на три группы (К0/КТ/КГ, Д0/ДТ/ДГ и ДМ0/ДМТ/ДМГ), сформировав в общей сложности 9 групп (в каждой n = 6). Группы К0, Д0 и ДМ0 (n = 6) вместо препаратов получали диметилсульфоксид (ДМСО), растворитель ТП03. Группам КТ, ДТ и ДМТ ежедневно внутрибрюшинно вводили растворенное в ДМСО соединение ТП03 в суточной дозе 15 мг/кг. Группам КГ, ДГ и ДМГ (n =6) в течение 5 сут подкожно вводили ХГЧ (“Московский эндокринный завод”, Россия) в суточной дозе 20 МЕ/крысу. Согласно проведенным ранее исследованиям, ДМСО не оказывает существенного влияния на оцениваемые параметры и функциональное состояние животных [14]. Соединение ТП03 синтезировали, как описано ранее [11], характеризуя его с помощью высокоэффективной жидкостной хроматографии и масс-спектрометрии. В первый и пятый день обработки ЛГР-агонистами уровень тестостерона оценивали перед их введением (10.00) и через 60, 180 и 300 мин (11.00, 13.00, 15.00) после введения ТП03 и ХГЧ. Во второй–четвертый дни его оценивали через 180 мин после введения препаратов (в 13.00), когда, согласно нашим предварительным результатам, отмечается пик стероидогенного эффекта гонадотропина, а соответствующий эффект ТП03 начинает выходить на плато [12]. Для измерения концентрации тестостерона использовали коммерческий набор “Тестостерон-ИФА” (“Алкор-Био”, Россия).
По окончании эксперимента животных наркотизировали (ингаляция 4–5%-ным изофлюраном) и декапитировали, после чего оценивали у них показатели спермограммы, как описано ранее [24]. Для этого из каудальной части эпидидимиса извлекали 5 мг СП и помещали их в 195 мкл среды фертилизации “Quinn’s AdvantageTM Medium With HEPES” (“In Vitro Fertilization Inc., Cooper Surgical Company”, США). В этой среде СП инкубировали в течение 30 мин при 37°С. Затем в счетную камеру Маклера (глубина 10 мкм, “Sefi Medical Instruments”, Израиль) добавляли 10 мкл разбавленной семенной жидкости, подсчитывали количество клеток с помощью микроскопа MICMED-5 (увеличение ×400, “ЛОМО”, Россия), результаты представляли как количество клеток/г эпидидимиса яичка. Количество подвижных СП и функционально активных СП с поступательным движением рассчитывали как процент от общего количества СП, которое принимали за 100%. Морфологию СП изучали после окрашивания помещенного на предметное стекло мазка азуром и эозином с использованием набора реагентов “Спермо-Дифф-200” (ООО “Фирма Синтакон”, Россия). Количество морфологически дефектных форм, включающих СП с извитым хвостом или дефектами головки [25], рассчитывали на 100 СП в каждом препарате. Фотографии препаратов получали с помощью микроскопа “Axio Lab.A1 MAT” (“Carl Zeiss”, Германия) со встроенной телевизионной камерой (увеличение ×1000), используя программу Axio-Vision 4.8.
Статистический анализ данных проводили с помощью программы “Microsoft Office Excel 2007”. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения выборок с нормальным распределением использовали t-критерий Стьюдента. Достоверными считали отличия при уровне значимости p < 0.05. Данные представляли как M ± SD.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Длительная высокожировая диета и обработка крыс низкой дозой стрептозотоцина приводили к развитию СД2 с характерными для него гипергликемией и нарушенной толерантностью к глюкозе, на что указывают повышенные уровни постпрандиальной глюкозы, HbA1c и повышенные значения интегрированной площади под кривыми “концентрация глюкозы (мМ)–время (мин)” (AUC0–120) для глюкозы в ГТТ, а также с гиперинсулинемией, о чем свидетельствует повышенный уровень инсулина через 120 мин после глюкозной нагрузки (табл. 1). Лечение метформином в значительной степени нормализовало уровни глюкозы и инсулина и восстанавливало толерантность к глюкозе (табл. 1). У крыс с СД2 были снижены базовые уровни тестостерона, и лечение метформином их частично восстанавливало (табл. 1).
Таблица 1.
Масса тела, гликемические показатели, уровни инсулина и тестостерона у контрольных самцов крыс (К) и диабетических животных без лечения (Д) и с лечением метформином (ДМ)
| Показатель | К | Д | ДМ |
|---|---|---|---|
| Масса тела, г | 337 ± 29 | 376 ± 38* | 354 ± 34 |
| Тощаковая глюкоза, мМ (до ГТТ) | 4.3 ± 0.5 | 6.8 ± 0.9* | 5.4 ± 0.7*# |
| Постпрандиальная глюкоза, мМ (через 120 мин после ГТТ) | 5.2 ± 0.7 | 10.5 ± 2.0* | 6.9 ± 1.3*# |
| HbA1c, % | 4.5 ± 0.4 | 8.1 ± 1.5* | 5.7 ± 1.1*# |
| AUC0–120 (ГТТ), усл.ед.* | 985 ± 123 | 1448 ± 258* | 1209 ± 185*# |
| Постпрандиальный инсулин, нг/мл (через 120 мин после ГТТ) | 0.93 ± 0.23 | 1.46 ± 0.37* | 1.05 ± 0.31*# |
| Тестостерон, нМ | 13.0 ± 4.3 | 7.1 ± 2.8* | 10.6 ± 3.0# |
Пятидневное введение ТП03 и ХГЧ контрольным крысам повышало уровень тестостерона, причем в первые два дня более эффективным был ХГЧ, а в третий–пятый дни стероидогенные эффекты ТП03 и ХГЧ не различались (рис. 1, табл. 2), что согласуется с данными, полученными нами ранее при изучении ТП03 [11] и его структурного аналога ТП4/2 [14]. У крыс с СД2 как базовые, так и стимулированные ЛГР-агонистами уровни тестостерона были снижены, что иллюстрируют более низкие в сравнении с соответствующими контрольными группами значения AUC0–300 и AUC0–5, представляющими собой интегрированную площадь под кривой “концентрация тестостерона (нМ)–время обработки (минуты или дни)” (табл. 2). Как и в контроле, стероидогенный эффект ХГЧ, оцениваемый по значению AUC0–300 в группе ДГ, в первый день обработки значительно превосходил таковой ТП03 (табл. 2). В то же время на пятый день эффекты ХГЧ и ТП03 были сопоставимыми, и значение AUC0–300 в группе ДГ превышало таковое в группе ДТ лишь на 40% (рис. 1, табл. 2).
Рис. 1.
Динамика изменения уровня тестостерона на протяжении пятидневной обработки самцов контрольных крыс (a), диабетических животных без лечения метформином (b) и с лечением метформином (c) с помощью ТП03 (15 мг/кг) и ХГЧ (20 МЕ/крысу). Обозначения: С0 – контроль, CT – контроль + ТП03, CG – контроль + ХГЧ, D0 – диабет, DT – диабет + ТП03, DG – диабет + ХГЧ, DM0 – диабет + метформин, DMT – диабет + метформин + ТП03, DMG – диабет + метформин + ХГЧ. Уровень тестостерона определяли ежедневно через три часа после введения препарата. Данные представлены как M ± SD. n = 6.
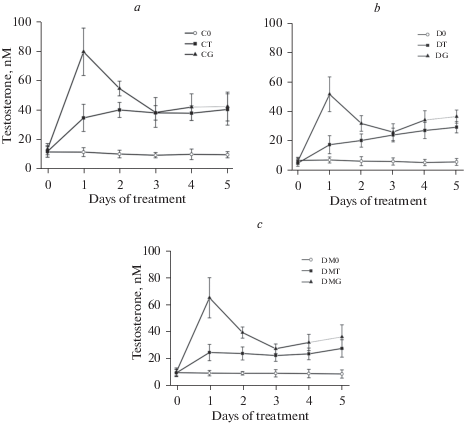
Таблица 2.
Значения AUC0–300, интегрированной площади под кривой “концентрация тестостерона (нМ)–время обработки (мин)”, для уровня тестостерона в первый и пятый дни обработки, а также значения AUC0–5, интегрированной площади под кривой “концентрация тестостерона (нМ)–время обработки (дни)”, для уровня тестостерона при пятидневной обработке с помощью ТП03 (15 мг/кг) и ХГЧ (20 МЕ/крысу) контрольных крыс и диабетических животных с лечением метформином и без такового
| Группа | Первый день, AUC0–300 (усл. ед.) | Пятый день, AUC0–300 (усл. ед.) | Пятидневная обработка, AUC0–5 (усл. ед.) |
|---|---|---|---|
| К0 | 58.0 ± 5.9 | 50.9 ± 5.7 | 52.2 ± 5.1 |
| КТ | 142.5 ± 12.4c | 155.8 ± 14.4 c | 177.4 ± 8.4 c |
| КГ | 325.8 ± 23.2c, d | 178.5 ± 14.7 c | 242.9 ± 15.7c, d |
| Д0 | 35.9 ± 3.3a | 30.5 ± 4.5 a | 33.6 ± 4.1a |
| ДТ | 73.4 ± 8.5c | 107.8 ± 4.9 c | 107.6 ± 7.7c |
| ДГ | 210.1 ± 13.7c, d | 151.4 ± 4.6c, d | 165.6 ± 8.2c, d |
| ДМ0 | 50.6 ± 4.3b | 48.4 ± 5.7b | 47.8 ± 4.0b |
| ДМТ | 113.0 ± 7.0c, e | 112.6 ± 8.6c | 117.6 ± 8.5c |
| ДМГ | 269.2 ± 19.1c, d,e | 149.8 ± 14.9c | 188.3 ± 5.1c, d, e |
a – различия между диабетическими группами (Д0, ДМ0) и контролем (К0); b – различия между группами Д0 и ДМ0; с – различия между группами без обработки (К0, Д0, ДМ0) и соответствующими группами с обработкой ТП03 (КТ, ДТ, ДМТ) или ХГЧ (КГ, ДГ, ДМГ); d – различия между группами КТ и КГ, ДТ и ДГ или ДМТ и ДМГ; e – различия между группами ДТ и ДМТ и между группами ДГ и ДМГ статистически значимы при p < 0.05. Данные представлены как M ± SD. n = 6.
Лечение диабетических крыс метформином приводило к повышению базового уровня тестостерона и усиливало стероидогенные эффекты ТП03 и ХГЧ в первый день обработки (рис. 1, табл. 2). Различия между AUC0–300 для групп ДТ и ДМТ и групп ДГ и ДМГ были статистически значимы (p < 0.05) (табл. 2). Со второго по пятый день эффекты ТП03 и ХГЧ у диабетических крыс с лечением метформином и без такового были сопоставимы (рис. 1). Так, различия в значениях AUC0–300 на пятый день обработки между группами ДТ и ДМТ и группами ДГ и ДМГ не были значимыми, а в случае AUC0–5 значимые различия сохранялись только между группами ДГ и ДМГ (табл. 2).
Далее изучали влияние СД2, лечения метформином и обработки ТП03 и ХГЧ на показатели сперматогенеза. При СД2 доля подвижных СП, в том числе их функционально активных форм с поступательным прямолинейным движением, была ниже, чем в контроле, в то время как доля дефектных форм СП была повышена (рис. 2). Отмечалась тенденция к снижению общего количества эпидидимальных СП, хотя различия между группами К0 и Д0 не были статистически значимыми. Лечение метформином повышало общее число и подвижность СП, причем доля СП с поступательным движением повышалась не только в сравнении с группой Д0, но и с контролем (рис. 2). Обработка контрольных крыс с помощью ТП03 и ХГЧ повышала долю СП с поступательным движением, а в случае ХГЧ также общее число СП. Доля СП с поступательным движением, рассчитанное с учетом общего числа СП, в группах КТ и КГ повышалось в сравнении с контролем без обработки препаратами на 43 и 85% соответственно. У диабетических крыс ТП03 и ХГЧ также повышали долю подвижных СП, в том числе с поступательным движением (рис. 2). Отмечалась тенденция к повышению общего числа СП в группе ДГ, но различия с группой Д0 не были статистически значимыми. В группах ДМТ и ДМГ общее число и доля подвижных СП в сравнении с группой ДМ0 не менялись (рис. 2). Полученные данные указывают на повышение фертильности спермы при обработке контрольных и диабетических крыс ТП03 и ХГЧ и диабетических крыс метформином, но также свидетельствуют об отсутствии усиления стимулирующего эффекта ЛГР-агонистов на сперматогенез у крыс, получавших метформиновую терапию.
Рис. 2.
Эффекты пятидневной обработки самцов крыс с СД2 с помощью ТП03 (15 мг/кг) и ХГЧ (20 МЕ/крысу) на количество сперматозоидов (a), долю подвижных сперматозоидов (b), долю сперматозоидов с поступательным прямолинейным движением (c) и долю сперматозоидов с морфологическими дефектами хвоста и головки (d), и влияние на этот эффект лечения метформином. Обозначения: С0 – контроль, CT – контроль + ТП03, CG – контроль + ХГЧ, D0 – диабет, DT – диабет + ТП03, DG – диабет + ХГЧ, DM0 – диабет + метформин, DMT – диабет + метформин + ТП03, DMG – диабет + метформин + ХГЧ. a – различия между диабетическими группами (D0, DM0) и контролем (С0); b – различия между группами D0 и DM0; с – различия между группами без обработки (С, D, DM) и соответствующими группами с обработкой ТП03 (CT, DT, DMT) или ХГЧ (CG, DG, DMG) статистически значимы при p < 0.05. Данные представлены как M ± SD. n = 6.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В условиях длительного СД2 отмечается нарушение как стероидогенеза, так и сперматогенеза, что приводит к репродуктивным дисфункциям и бесплодию, как это продемонстрировано на грызунах с СД2 [8, 9, 26–28], так и у пациентов с этой патологией [2, 29]. Полученные нами данные при изучении самцов крыс с СД2, индуцированным высокожировой диетой и низкой дозой стрептозотоцина, также указывают на негативное влияние гипергликемии, нарушенной толерантности к глюкозе, инсулиновой резистентности на андрогенный статус, число и подвижность СП, морфологию семенных канальцев [9].
Изучение стероидогенного эффекта ХГЧ, структурного и функционального гомолога ЛГ, который является мощным стимулятором продукции тестостерона клетками Лейдига [6], показало, что у диабетических крыс в сравнении с контрольными животными этот эффект снижался (рис. 1, табл. 2), в то время как стимулирующее влияние гонадотропина на сперматогенез при СД2 не претерпевало существенных изменений (рис. 2). При этом на третий–пятый дни стероидогенный эффект гонадотропина ослабевал как у контрольных, так и у диабетических крыс и становился сопоставимым с таковым ТП03, который, в отличие от ХГЧ, стимулирует активность ЛГР посредством связывания с аллостерическим сайтом, расположенным в трансмембранном домене рецептора [14, 16–18]. Важно отметить, что стероидогенный эффект ТП03, в отличие от ХГЧ, не ослабевал в ходе пятидневного введения, что может быть обусловлено как накоплением этого гидрофобного соединения в ткани семенников, так и особенностями его действия на ЛГР. Так, гонадотропины связываются с внеклеточным доменом ЛГР, который подвергается избыточному гликированию в условиях длительной гипергликемии и повреждению активными формами кислорода, в то время как аллостерический сайт, мишень ТП03, менее доступен для таких воздействий. Кроме того, будучи гидрофобным соединением, ТП03 способен связываться не только с расположенными в плазматической мембране ЛГР, но, проникая внутрь клетки, взаимодействовать с еще “незрелыми” формами рецептора [18, 30]. В случае СД2 это представляется особенно важным, так как сильно выраженные при диабетической патологии окислительный стресс, воспаление и стресс эндоплазматического ретикулума нарушают посттрансляционный процессинг ЛГР и их транслокацию в мембрану, что снижает число рецепторов на поверхности клеток-мишеней [9, 27].
Одним из наиболее широко и успешно используемых препаратов для лечения СД2 является метформин, который не только улучшает метаболические и гормональные показатели, но и частично восстанавливает репродуктивные функции [8, 19, 27, 31]. Предпринятое нами лечение диабетических самцов крыс метформином (4 нед., 120 мг/кг/сутки) не только нормализовало глюкозный гомеостаз, толерантность к глюкозе и уровень инсулина, но частично восстанавливало показатели стероидогенеза и сперматогенеза. Так, в группе ДМ0 отмечали повышение сниженного при СД2 уровня базового тестостерона (табл. 1), восстановление до контрольных значений числа эпидидимальных СП, доли их подвижных форм, в том числе с поступательным прямолинейным движением (рис. 2). Эти данные хорошо согласуются с данными, полученными ранее нами и другими авторами, о восстанавливающем эффекте метформиновой терапии на тестикулярную функцию у грызунов с различными моделями СД [8, 9, 19, 21, 22, 27, 31].
Поскольку при СД2 метформиновая терапия восстанавливает метаболические и гормональные показатели, а также улучшает функционирование гонадной оси, то нами была выдвинута гипотеза, что такая терапия будет усиливать стимулирующие эффекты ЛГР-агонистов на тестикулярный стероидогенез и сперматогенез. Эта гипотеза базировалась на выявленном нами ранее усиливающем эффекте метформиновой терапии на стероидогенные эффекты ХГЧ при однократном его введении диабетическим крысам [9].
Нами показано, что лечение диабетических крыс метформином усиливает стероидогенный эффект ТП03 и ХГЧ в первый день обработки (рис. 1). Во второй день в группах ДМТ и ДМГ отмечалась тенденция к усилению эффектов ТП03 и ХГЧ, но различия с группами ДТ и ДГ уже не были статистически значимыми. Однако в дальнейшем потенцирующее влияние метформиновой терапии на эффекты ЛГР-агонистов исчезало (рис. 1, 2). Тем самым, усиливая стимулирующие продукцию тестостерона эффекты различных по механизму действия агонистов ЛГР при их однократном введении, метформиновая терапия не влияет на эти эффекты при длительном введении препаратов. Довольно неожиданное угасание потенцирующего эффекта метформиновой терапии на стероидогенные эффекты ТП03 и ХГЧ может быть обусловлено следующими причинами.
Метформин является стимулятором фермента АМФК, ключевого энергетического сенсора клетки, функциональная активность которого при диабетической патологии в большинстве тканей, включая семенники, снижается [32, 33]. Метформиновая терапия нормализует активность АМФК, что является одной из причин восстановления стероидогенеза в группе ДМ0 и потенцирования ответа тестикулярных клеток на однократное введение ТП03 и ХГЧ в группах ДМТ и ДМГ (рис. 1, табл. 2). В то же время при длительном влиянии агонистов ЛГР на стероидогенез, в результате перманентной активации АМФК метформином, вероятно, запускаются механизмы, препятствующие потенцированию стероидогенного эффекта ТП03 и ХГЧ. Это может быть обусловлено негативным влиянием метформин-активированной АМФК на экспрессию и активность белков стероидогенеза [34–37]. Так, в экспериментах с клетками гранулезы цыплят-бройлеров показано, что повышение активности АМФК ассоциировано со снижением экспрессии генов, кодирующих транспортный белок StAR, цитохром CYP11A1 и дегидрогеназу HSD3B, результатом чего является снижение синтеза прогестерона [38]. В лютеинизированных клетках гранулезы человека стимуляция АМФК агонистом адипонектина ингибирует цАМФ-зависимые каскады, снижая экспрессию ароматазы и продукцию эстрогенов [39]. В лютеальных клетках гиперактивация АМФК также подавляет стероидогенез, но не посредством подавления цАМФ-сигналинга и снижения экспрессии стероидогенных генов, а путем ингибирования гормоночувствительной липазы HSL [40]. Этот фермент гидролизует сложные эфиры холестерина, которые накапливаются в липидных каплях внутри клетки, и, тем самым, делает холестерин доступным для транспорта в митохондрии, где осуществляются начальные стадии стероидогенеза. Необходимо отметить, что ЛГ подавляет активность АМФК в лютеальных клетках, предотвращая его негативное влияние на стероидогенез [41]. Постоянная стимуляция АМФК метформином в ходе четырехнедельной терапии, тем самым, может быть сдерживающим фактором, препятствующим потенцированию стероидогенного эффекта ХГЧ и ТП03.
Метформиновая терапия, как показано нами в проведенном исследовании, наряду с улучшением тестикулярного стероидогенеза, нормализует сперматогенез, приближая оцениваемые параметры к их значениям в контроле, а в случае СП с поступательным прямолинейным движением их количество даже превышает таковое в контроле (рис. 2). Эти данные согласуются с результатами, полученными ранее нами и другими авторами, о восстановлении сперматогенной функции и морфологии семенных канальцев у грызунов с различными моделями СД при их лечении метформином [8, 9, 21, 27]. Ключевую роль здесь играет восстановление нарушенной при СД полярности клеток Сертоли и их плотных соединений, определяющих целостность гематотестикулярного барьера и нормальное протекание сперматогенеза [36, 42]. При этом на фоне нормализации процесса сперматогенеза метформином, дополнительная стимуляция сперматогенеза при обработке диабетических крыс ТП03 и ХГЧ в группах ДМТ и ДМГ не была выявлена (рис. 2). Вероятно, это обусловлено тем, что ресурс восстановления сперматогенеза в условиях метформиновой терапии полностью исчерпан и его показатели не отличаются или даже превышают таковые в контроле (рис. 2).
Таким образом, лечение метформином самцов крыс с СД2, индуцированным высокожировой диетой и низкой дозой стрептозотоцина, улучшает у них тестикулярный стероидогенез и нормализует сперматогенез, нарушенные в условиях диабетической патологии. Впервые установлено, что лечение метформином усиливает стероидогенные эффекты ЛГР-агонистов, взаимодействующих как с аллостерическим (ТП03), так и с ортостерическим (ХГЧ) сайтами рецептора, но только в первый день введения препаратов. В дальнейшем потенцирующий эффект метформиновой терапии не выявляется, что может быть обусловлено негативным влиянием активируемых метформином АМФК-зависимых путей в клетках Лейдига на стероидогенные каскады. Как метформин, так и агонисты ЛГР восстанавливают сперматогенез, причем показатели сперматогенеза в группах с лечением метформином, ТП03 и ХГЧ в отдельности сопоставимы с таковыми при совместном применении метформина и ЛГР-агонистов. На основании полученных данных сделан вывод, что длительное комбинированное применение метформина и агонистов ЛГР при СД2 не приводит к усилению их восстанавливающего эффекта на андрогенный статус и фертильность, но способно повысить стероидогенный эффект гонадотропина и ТП03 при однократном их введении.
Список литературы
Шпаков АО (2010) Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Проблемы эндокринологии. 56: 23–29. [Shpakov AO (2010) The functional state of the hypothalamic-pituitary-gonadal system in diabetes mellitus. Probl Endokrinol (Mosk.) 56: 23–29. (In Russ)].
Ding GL, Liu Y, Liu ME, Pan JX, Guo MX, Sheng JZ, Huang HF (2015) The effects of diabetes on male fertility and epigenetic regulation during spermatogenesis. Asian J Androl 17: 948–953. https://doi.org/0.4103/1008-682X.150844
Maresch CC, Stute DC, Alves MG, Oliveira PF, de Kretser DM, Linn T (2018) Diabetes-induced hyperglycemia impairs male reproductive function: a systematic review. Hum Reprod Update 24(1): 86–105. 2018. https://doi.org/10.1093/humupd/dmx033
Barkabi-Zanjani S, Ghorbanzadeh V, Aslani M, Ghalibafsabbaghi A, Chodari L (2020) Diabetes mellitus and the impairment of male reproductive function: Possible signaling pathways. Diabetes Metab Syndr 14: 1307–1314. https://doi.org/10.1016/j.dsx.2020.07.031
Шпаков АО (2018) Гонадотропины – от теории к клинической практике. СПб. ПОЛИТЕХ-пресс. ISBN 978-5-7422-6330-2. [Shpakov AO (2018) Gonadotropiny – ot teorii k klinicheskoj praktike. Sankt-Peterburg: POLITEKH-press. ISBN 978-5-7422-6330-2. (In Russ)].
Riccetti L, De Pascali F, Gilioli L, Potì F, Giva LB, Marino M, Tagliavini S, Trenti T, Fanelli F, Mezzullo M, Pagotto U, Simoni M, Casarini L (2017) Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod Biol Endocrinol 15: 2. https://doi.org/10.1186/s12958-016-0224-3
Casarini L, Lispi M, Longobardi S, Milosa F, La Marca A, Tagliasacchi D, Pignatti E, Simoni M (2012) LH and hCG action on the same receptor results in quantitatively and qualitatively different intracellular signaling. PLoS One 7:46682. https://doi.org/10.1371/journal.pone.0046682
Nna VU, Bakar ABA, Ahmad A, Mohamed M (2019) Down-regulation of steroidogenesis-related genes and its accompanying fertility decline in streptozotocin-induced diabetic male rats: ameliorative effect of metformin. Andrology 7: 110–123. https://doi.org/10.1111/andr.12567
Derkach KV, Bakhtyukov AA, Romanova IV, Zorina II, Bayunova LV, Bondareva VM, Morina IYu, Roy VK, Shpakov AO (2020) The effect of metformin treatment on the basal and gonadotropin-stimulated steroidogenesis in male rats with type 2 diabetes mellitus. Andrologia 52: 13816. https://doi.org/10.1111/and.13816
Shpakov AO, Dar’in DV, Derkach KV, Lobanov PS (2014) The stimulating influence of thienopyrimidine compounds on the adenylyl cyclase systems in the rat testes. Dokl Biochem Biophys 456: 104–107. https://doi.org/10.1134/S1607672914030065
Derkach KV, Dar’in DV, Bakhtyukov AA, Lobanov PS, Shpakov AO (2016) In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow) Suppl Ser A: Membrane and Cell Biology 10: 294–300. https://doi.org/10.1134/ S1990747816030132
Bakhtyukov AA, Derkach KV, Dar’in DV, Stepochkina AM, Shpakov AO (2019) A low molecular weight agonist of the luteinizing hormone receptor stimulates adenylyl cyclase in the testicular membranes and steroidogenesis in the testes of rats with type 1 diabetes. Biochemistry (Moscow) Suppl Ser A: Membrane and Cell Biology 13: 301–309. https://doi.org/10.1134/S1990747819040032
Bakhtyukov AA, Derkach KV, Dar’in DV, Shpakov AO (2019) Conservation of Steroidogenic Effect of the Low-Molecular-Weight Agonist of Luteinizing Hormone Receptor in the Course of Its Long-Term Administration to Male Rats. Dokl Biochem Biophys 484: 78–81. https://doi.org/10.1134/S1607672919010216
Bakhtyukov AA, Derkach KV, Gureev MA, Dar’in DV, Sorokoumov VN, Romanova IV, Morina IYu, Stepochkina AM, Shpakov AO (2020) Comparative study of the steroidogenic effect of human chorionic gonadotropin and thieno[2,3-d]pyrimidine-based allosteric agonist of luteinizing hormone receptor in young adult, aging and diabetic male rats. Int J Mol Sci 21: 7493. https://doi.org/10.3390/ijms21207493
van Straten NC, Schoonus-Gerritsma GG, van Someren RG, Draaijer J, Adang AE, Timmers CM, Hanssen RG, van Boeckel CA (2002) The first orally active low molecular weight agonists for the LH receptor: Thienopyr(im)idines with therapeutic potential for ovulation induction. Chembiochem 3: 1023–1026. https://doi.org/10.1002/1439-7633(20021004)3:10<1023::AID-CBIC1023>3.0.CO;2-9
van Koppen CJ, Zaman GJ, Timmers CM, Kelder J, Mosselman S, van de Lagemaat R, Smit MJ, Hanssen RG (2008) A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch Pharmacol 378: 503–514. https://doi.org/10.1007/s00210-008-0318-3
van de Lagemaat R, Raafs BC, van Koppen C, Timmers CM, Mulders SM, Hanssen RG (2011) Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology 152: 4350–4357. https://doi.org/10.1210/en.2011-1077
Nataraja SG, Yu HN, Palmer SS (2015) Discovery and development of small molecule allosteric modulators of glycoprotein hormone receptors. Front Endocrinol (Lausanne) 6 :142. https://doi.org/10.3389/fendo.2015.00142
Shpakov AO (2021) Improvement effect of metformin on female and male reproduction in endocrine pathologies and its mechanisms. Pharmaceuticals (Basel) 14: 42. https://doi.org/10.3390/ph14010042
Tseng CH (2021) The Effect of Metformin on Male Reproductive Function and Prostate: An Updated Review. World J Mens Health Epub ahead of print.https://doi.org/10.5534/wjmh.210001
Annie L, Jeremy M, Gurusubramanian G, Derkach KV, Shpakov AO, Roy VK (2020) Effect of metformin on testicular expression and localization of leptin receptor and levels of leptin in the diabetic mice. Mol Reprod Dev 87: 620–629. https://doi.org/10.1002/mrd.23342
Derkach KV, Bakhtyukov AA, Bayunova LV, Zorina II, Shpakov AO (2020) Normalization of testicular steroidogenesis and spermatogenesis in male rats with type 2 diabetes mellitus under the conditions of metformin therapy. Dokl Biol Sci 493: 110–113. https://doi.org/10.1134/S0012496620040031
Derkach KV, Bondareva VM, Chistyakova OV, Berstein LM, Shpakov AO (2015) The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int J Endocrinol 2015: 245459. https://doi.org/10.1155/2015/245459
Derkach KV, Bakhtyukov AA, Roy V, Gryaznov AYu, Bayunova LV, Shpakov AO (2020) The testicular leptin system in rats with different severity of type 2 diabetes mellitus. J Evol Biochem Physiol 56: 22–30. https://doi.org/10.1134/S0022093020010032
Narayana K, D’Souza UJ, Seetharama RK (2002) Ribavirin-induced sperm shape abnormalities in Wistar rat. Mutat Res 513: 193–196. https://doi.org/10.1016/s1383-5718(01)00308-4
Liu GL, Zhang YM, Dai DZ, Ding MJ, Cong XD, Dai Y (2013) Male hypogonadism induced by high fat diet and low dose streptozotocin is mediated by activated endoplasmic reticulum stress and IκBβ and attenuated by argirein and valsartan. Eur J Pharmacol 713: 78–88. https://doi.org/10.1016/j.ejphar.2013.04.030
Nna VU, Bakar ABA, Ahmad A, Mohamed M (2020) Diabetes-induced testicular oxidative stress, inflammation, and caspase-dependent apoptosis: the protective role of metformin. Arch Physiol Biochem 126: 1–12. https://doi.org/10.1080/13813455.2018.1543329
Khorasani V, Jeddi S, Yaghmaei P, Tohidi M, Ghasemi A (2019) Effect of long-term sodium nitrate administration on diabetes-induced anemia and glucose homeostasis in obese type 2 diabetic male rats. Nitric Oxide 86: 21–30. https://doi.org/10.1016/j.niox.2019.02.003
Jangir RN, Jain C (2014) Diabetes mellitus induced impairment of male reproductive functions: a review. Curr Diabetes Rev 10: 147–157. https://doi.org/10.2174/1573399810666140606111745
Newton CL, Whay AM, McArdle CA, Zhang M, van Koppen CJ, van de Lagemaat R, Segaloff DL, Millar RP (2011) Rescue of expression and signaling of human luteinizing hormone G protein-coupled receptor mutants with an allosterically binding small-molecule agonist. Proc Natl Acad Sci USA 108: 7172–7176. https://doi.org/10.1073/pnas.1015723108
Yan WJ, Mu Y, Yu N, Yi TL, Zhang Y, Pang XL, Cheng D, Yang J (2015) Protective effects of metformin on reproductive function in obese male rats induced by high-fat diet. J Assist Reprod Genet 32: 1097–1104. https://doi.org/10.1007/s10815-015-0506-2
Jiang X, Chen J, Zhang C, Zhang Z, Tan Y, Feng W, Skibba M, Xin Y, Cai L (2015) The protective effect of FGF21 on diabetes-induced male germ cell apoptosis is associated with up-regulated testicular AKT and AMPK/Sirt1/PGC-1α signaling. Endocrinology 156: 1156–1170. https://doi.org/10.1210/en.2014-1619
Guo Z, Yan X, Wang L, Wu J, Jing X, Liu J (2016) Effect of Telmisartan or Insulin on the Expression of Adiponectin and its Receptors in the Testis of Streptozotocin-Induced Diabetic Rats. Horm Metab Res 48: 404–412. https://doi.org/10.1055/s-0042-101549
Tosca L, Chabrolle C, Uzbekova S, Dupont J (2007) Effects of metformin on bovine granulosa cells steroidogenesis: possible involvement of adenosine 5' monophosphate-activated protein kinase (AMPK). Biol Reprod 76: 368–378. https://doi.org/10.1095/biolreprod.106.055749
Bertoldo MJ, Faure M, Dupont J, Froment P (2015) AMPK: a master energy regulator for gonadal function. Front Neurosci 9: 235. https://doi.org/10.3389/fnins.2015.00235
Yang W, Wang L, Wang F, Yuan S (2020) Roles of AMP-Activated Protein Kinase (AMPK) in Mammalian Reproduction. Front Cell Dev Biol 8: 593005. https://doi.org/10.3389/fcell.2020.593005
Estienne A, Bongrani A, Ramé C, Kurowska P, Błaszczyk K, Rak A, Ducluzeau PH, Froment P, Dupont J (2021) Energy sensors and reproductive hypothalamo-pituitary ovarian axis (HPO) in female mammals: Role of mTOR (mammalian target of rapamycin), AMPK (AMP-activated protein kinase) and SIRT1 (Sirtuin 1). Mol Cell Endocrinol 521: 111113. https://doi.org/10.1016/j.mce.2020.111113
Weaver EA, Ramachandran R (2020) Metformin attenuates steroidogenesis in ovarian follicles of the broiler breeder hen. Reproduction 160: 659–672. https://doi.org/10.1530/REP-20-0066
Grandhaye J, Hmadeh S, Plotton I, Levasseur F, Estienne A, LeGuevel R, Levern Y, Ramé C, Jeanpierre E, Guerif F, Dupont J, Froment P (2021) The adiponectin agonist, AdipoRon, inhibits steroidogenesis and cell proliferation in human luteinized granulosa cells. Mol Cell Endocrinol 520: 111080. https://doi.org/10.1016/j.mce.2020.111080
Przygrodzka E, Hou X, Zhang P, Plewes MR, Franco R, Davis JS (2021) PKA and AMPK Signaling Pathways Differentially Regulate Luteal Steroidogenesis. Endocrinology 162:bqab015. https://doi.org/10.1210/endocr/bqab015
Hou X, Arvisais EW, Davis JS (2010) Luteinizing hormone stimulates mammalian target of rapamycin signaling in bovine luteal cells via pathways independent of AKT and mitogen-activated protein kinase: modulation of glycogen synthase kinase 3 and AMP-activated protein kinase. Endocrinology 151: 2846–2857. https://doi.org/10.1210/en.2009-1032
Ye J, Luo D, Xu X, Sun M, Su X, Tian Z, Guan Q (2019) Metformin Improves Fertility in Obese Males by Alleviating Oxidative Stress-Induced Blood-Testis Barrier Damage. Oxid Med Cell Longev 2019: 9151067. https://doi.org/10.1155/2019/9151067
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


