Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1422-1439
Анализ некоторых физиологических и биохимических показателей у больных пневмонией COVID-19 математическими методами
М. С. Громов 1, С. М. Рогачева 1, *, М. А. Барулина 1, 2, А. А. Решетников 3, Д. А. Прохожев 1, А. Ю. Фомина 1
1 Саратовский медицинский университет “Реавиз”
Саратов, Россия
2 Институт проблем точной механики и управления РАН
Саратов, Россия
3 ГУЗ Саратовская городская клиническая больница № 2 им. В.И. Разумовского
Саратов, Россия
* E-mail: smro13@yandex.ru
Поступила в редакцию 03.08.2021
После доработки 15.09.2021
Принята к публикации 15.09.2021
Аннотация
Целью работы было провести ретроспективный анализ данных больных пневмонией, вызванной вирусом SARS-CoV-2, математическими методами определить значимость некоторых физиологических и биохимических показателей в качестве маркеров неблагоприятного исхода болезни. Случайная выборка пациентов с пневмонией COVID-19 составила 209 человек. Для математического анализа использовали физиологические показатели пациентов, описанные при госпитализации, а также показатели коагуляции крови и развития воспалительной реакции. Анализируемые показатели были распределены на категории относительно интервала референсных значений физиологической нормы. Корреляционный анализ проводили по категориальным данным относительно исхода заболевания. Алгоритмы расчета статистических характеристик и визуализация результатов были реализованы на языке Python. Достоверность отличий признаков при сравнении выборок пациентов оценивали по критерию согласия χ2 с поправкой Йетса. В исследовании показано, что возраст старше 50 лет и мужской пол можно считать факторами риска для пациентов с пневмонией COVID-19 (p < 0.05). Отмечено значимое влияние на исход болезни сердечно-сосудистых патологий (p < 0.01), в меньшей степени – диабета (p < 0.10). Выявлены максимальные коэффициенты корреляции уровня сатурации (–0.43) и частоты дыхания (0.43) с летальным исходом. Для пациентов старше 50 лет уровень сатурации при госпитализации ниже 80% стал маркером летальности. Показано, что повышение концентрации D-димера более 625 нг/мл у пациентов старше 80 лет ассоциировано с летальным исходом. Корреляции уровня C-реактивного белка (CRP) с исходом болезни не обнаружено. Проанализировано влияние кортикостероидов на исход болезни пациентов с различным содержанием CRP. Отмечено, что при использовании кортикостероидов уровень летальности пациентов с CRP ≤ 12.5 мг/л в 2.7 раз выше, чем пациентов с CRP > 12.5 мг/л (p < 0.01). Таким образом, применение адекватных математических методов позволило уточнить некоторые физиологические и биохимические показатели больных COVID-19, ассоциированные с летальным исходом.
SARS-CoV-2 – новый высокопатогенный β-коронавирус, вызывающий заболевание COVID-19 у человека, впервые был обнаружен в Китае в декабре 2019 г., быстро распространился по миру, вызвав пандемию.
Во всем мире проводятся активные исследования нового вируса и заболеваний, которое он вызывает. Известно, что вирион SARS-CoV-2 состоит из двух основных компонентов: 1) геномной РНК и белкового капсида, упакованных в нуклеокапсид; 2) фосфолипидного бислоя, который окружает нуклеокапсид. Фосфолипидный бислой включает спайк-белок (тример гликопротеина), фермент гемаглютинин-эстеразу и несколько структурных белков (Spike, Envelope и Membrane) [1].
Вирион взаимодействует с рецептором – ангиотензинпревращающим ферментом II типа (ACE2), его связыванию с ACE2 способствует клеточная трансмембранная сериновая протеаза типа 2 (TMPRSS), которая активирует S-белок вируса. ACE2 и TMPRSS представлены на поверхности различных клеток органов дыхания, пищевода, кишечника, сердца, надпочечников, мочевого пузыря, гипоталамуса и гипофиза, эндотелия и макрофагов [2, 3]. Это приводит к разнообразным клиническим проявлениям заболевания [4].
Преимущественно инфекция передается воздушно-капельным путем, реже – контактным. Инкубационный период составляет 1–14 дней с пиком в 3–7 дней; в латентный период вирус становится очень заразным. У пациентов проявляются симптомы гриппа, боли в горле, лихорадка, кашель, утомляемость и одышка; в некоторых случаях у пациентов развиваются желудочно-кишечные проблемы, такие как диарея и рвота [5, 6]. При инфицировании альвеолярных эпителиальных клеток у пациентов возникает пневмония (15% случаев), в тяжелых случаях (5% случаев) развивается острый респираторный дистресс-синдром (ОРДС) и полиорганная недостаточность [1, 4].
Возникновение ОРДС обусловлено агрессивной воспалительной реакцией иммунной системы человека, которая развивается в ответ на высвобождение вирусных частиц после их репродукции в инфицированных клетках. Эта реакция заключается в образовании чрезмерного количества цитокинов, что приводит к развитию процесса, называемого цитокиновым штормом [7]. Повышенные уровни цитокинов способствуют притоку иммунных клеток, таких как макрофаги, нейтрофилы и Т-клетки, из кровотока к месту инфекции; этот процесс оказывает деструктивное воздействие на ткани человека, вызывает повреждение легких и тяжелый ОРДС, который проявляется в низком уровне насыщения кислородом и является важной причиной смертности пациентов с COVID-19 [6, 7]. Показателем наличия острой фазы воспалительного ответа является повышенный уровень С-реактивного белка в крови пациентов [4].
Известно, что у больных COVID-19 выявляются нарушения свертывающей и фибринолитической систем крови. Отмечено повышение уровня D-димера, уменьшение протромбинового времени и активированного частичного тромбопластинового времени у пациентов со среднетяжелым и тяжелым течением COVID-19, у больных с неблагоприятным исходом [8, 9]. Поскольку эти изменения гемостаза соответствуют диссеминированному внутрисосудистому свертыванию крови, считают, что COVID-19 ассоциируется с венозным или артериальным тромбозом [10].
Пожилые люди и люди с сопутствующими заболеваниями, такими как диабет, гипертония, легочные заболевания, астма, бронхит и сердечно-сосудистые заболевания, склонны к развитию ОРДС и тромбозов, именно они становятся основными “заложниками” вируса SARS-CoV-2 [6].
Пандемия COVID-19 продолжается, и большое количество пациентов попадают в больницы с серьезным поражением легких, поэтому актуальным является обнаружение и уточнение физиологических признаков заболевания, на которые необходимо обращать особое внимание при лечении пациентов, чтобы не допустить его тяжелого развития и летального исхода. Насколько те или иные физиологические и биохимические показатели являются значимыми при прогнозе заболевания, при выборе стратегии лечения и ухода, позволяют определить математические методы анализа.
Нужно отметить, что в последнее время появилось большое количество работ, в которых авторы предлагают прогностические модели риска смерти и прогрессирования COVID-19 до тяжелого заболевания. В обзоре [11] проанализировано 107 таких моделей, из которых авторы выделили только одну модель оценки смертности 4C (Coronavirus Clinical Characterisation Consortium) как многообещающую [12]. Для всех остальных моделей был определен высокий риск систематической ошибки, в основном из-за нерепрезентативного отбора контрольных пациентов, исключения пациентов и нечеткой отчетности [11]. Авторы считают, что на данном этапе невозможно рекомендовать какие-либо модели для использования на практике, а дальнейшие исследования должны быть сосредоточены на проверке, сравнении, улучшении и обновлении лучших образцов, уточнении предикторов тяжести заболевания.
Целью работы явилось: провести ретроспективный анализ данных больных пневмонией, вызванной вирусом SARS-CoV-2, математическими методами определить значимость некоторых физиологических и биохимических показателей в качестве маркеров неблагоприятного исхода болезни.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использованы зашифрованные эпикризы пациентов с подтвержденным диагнозом COVID-19 и пневмонией, предоставленные ГУЗ Саратовская городская клиническая больница № 2 им. В.И. Разумовского. Пациенты были госпитализированы в период с 1 сентября по 1 декабря 2020 г. и получали лечение в соответствии с временными рекомендациями Минздрава РФ, включающее этиотропную, антикоагулянтную, иммуносупрессивную и симптоматическую терапию. Для анализа была использована случайная выборка пациентов – 209 человек.
По возрасту пациентов распределили на 5 возрастных категорий: 1 – 18 < 35 лет; 2 – 35 < 50 лет; 3 – 50 < 65 лет; 4 – 65 < 80 лет; 5 – ≥ 80 лет. При анализе учитывали также пол пациентов и наличие сопутствующего заболевания: диабета, сердечно-сосудистой (СС) патологии, онкологического заболевания. По признаку “пол” женщин отнесли к категории 1, мужчин – к категории 0. По признакам “СС-заболевание”, “диабет” и “онкология” пациентов с заболеванием отнесли к категории 1, без заболевания – к категории 0.
Для сравнительного математического анализа использовали физиологические и биохимические показатели пациентов, приведенные в эпикризах, значения которых сравнивали с референсными значениями физиологической нормы (табл. 1).
Таблица 1.
Некоторые физиологические и биохимические показатели, определяемые во время лечения пациентов с COVID-19, и их референсные значения
| № | Показатели | Обозначение | Референсные значения |
|---|---|---|---|
| 1 | Уровень сатурации, % | Sаt | >94 |
| 2 | Частота сердечных сокращений, мин–1 | Heart_rate | 60–80 |
| 3 | Частота дыхания, мин–1 | Breath_rate | 16–20 |
| 4 | Артериальное давление систолическое, мм рт. ст. | Sistolic_BP | 120–130 |
| 5 | Артериальное давление диастолическое мм рт. ст. | Diastolic_BP | 75–80 |
| 6 | Температура тела, °C | Temp | 36.6 |
| 7 | Индекс массы тела, кг/м2 | BM_index | 18–25 |
| Показатель развития процесса воспаления | |||
| 8 | C-реактивный белок, мг/л | CRP | 0–5 |
| Показатели коагуляции крови | |||
| 9 | Активированное частичное тромбопластиновое время, с | APTT | 22.5–35.5 |
| 10 | Протромбиновый индекс, % | PI | 73–122 |
| 11 | Фибриноген, г/л | Fibrinogen | 2–4 |
| 12 | Протромбиновое время, с | PT | 11–15 |
| 13 | D-димер, нг/мл | D-dimer | до 250 |
Анализируемые показатели были распределены на категории относительно интервала референсных значений. Результаты, соответствующие интервалу нормы, принимали за 0, отклонение от максимального значения нормы на 10, 20, 30% и т.д. в большую сторону записывали как 10, 20, 30…, отклонения от минимального значения нормы в меньшую сторону записывали как –10, –20, –30 и т.д.
Корреляционные диаграммы строили по категориальным данным относительно исхода заболевания: в интервале от 0 до 1 вероятность летального исхода растет с увеличением категории показателя; в интервале от 0 до –1 вероятность летального исхода растет с уменьшением категории показателя. Алгоритмы расчета статистических характеристик были реализованы на язык Python при использовании библиотек для математического и статистического анализа numpy, pandas (https://numpy.org/, https://pandas.pydata.org/pandas-docs/stable/). Визуализация полученных результатов была реализована также на языке Python с использованием библиотек seaborn и mathplotlib (http://seaborn.pydata.org/, https://matplotlib.org/). Целевой переменной при анализе данных служил исход заболевания: выписан, умер.
Достоверность отличий признаков при сравнении выборок пациентов оценивали по критерию согласия χ2 с поправкой Йетса, которая вводится для уменьшения числа искажений в случаях с малыми выборками [13]. В отдельных случаях достоверность результатов оценивали с помощью однофакторного дисперсионного анализа с использованием F-критерия Фишера. При уровне вероятности p > 0.10 различие выборок считали недостоверным [14].
Исследования проведены в соответствии с международными и российскими этическими принципами и нормами, одобрены комитетом по этике Медицинского университета “Реавиз”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
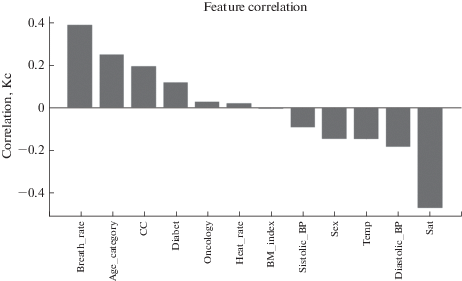
Первоначально была построена диаграмма корреляции физиологических признаков пациентов (209 человек) с неблагоприятным исходом болезни (рис. 1). Из диаграммы видно, что неблагоприятный исход болезни в наибольшей степени зависит от уровня сатурации (Sat) (коэффициент корреляции (Кс) = –0.43) и частоты дыхания (Breath_rate) (Кс = 0.39). Эти параметры взаимосвязаны: увеличение частоты дыхания у больных COVID-19, как правило, связано с уменьшением уровня сатурации.
В меньшей степени неблагоприятный исход ассоциирован с возрастом пациента (Кс = 0.25): чем выше возрастная категория, тем выше вероятность летального исхода; наличием сердечно-сосудистого (СС) заболевания (Кс = 0.20), наличием диабета (Кс = 0.16), снижением артериального диастолического давления (Diastolic_BP) (Кс = –0.19). В центре диаграммы расположены показатели, в наименьшей степени коррелирующие с исходом болезни, например, частота сердечных сокращений (Heart_rate) и индекс массы тела (BM_index). Таким образом, корреляционная матрица позволяет нам сравнить влияние показателей на исход болезни и выявить наиболее значимые.
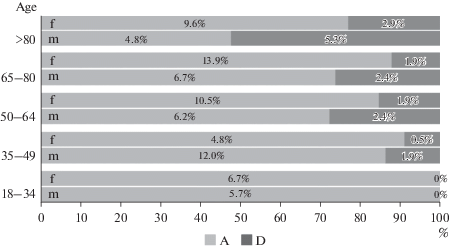
На рис. 2 приведено распределение пациентов исследуемой выборки (209 человек) по полу, возрасту с указанием исхода болезни. Женщин среди больных было больше – 110 человек, мужчин – 99 человек. Из диаграммы видно, что более 47% пациентов было старше 65 лет. Степень летальности рассчитывали по всей выборке (209 человек). В 1-ой возрастной группе не зафиксировано летальных исходов. С увеличением возраста увеличивался процент летальности, в каждой возрастной группе процент летальных исходов у мужчин был выше. В целом умерли 19.2% пациентов (40 человек), из них – мужчин 12.0%, женщин – 7.2%. Наибольшая летальность зафиксирована среди мужчин старше 80 лет – 52.4% от количества пациентов данной категории.
Рис. 2.
Распределение пациентов по полу (m – мужчины, f – женщины), возрасту и исходу болезни (А – жив, D – умер). По горизонтальной оси определяется процент летальных исходов в каждой категории больных. На диаграмме приведены проценты благоприятных и летальных исходов из расчета всей выборки пациентов (209 человек).
Большинство госпитализированных пациентов имели сопутствующее заболевание (табл. 2): СС заболевания – 66%, диабет – 20%, и онкологические – 11%. Из табл. 2 видно, что значимое влияние на исход болезни оказывает СС патология (p < 0.01), в меньшей степени – диабет (p < 0.1).
Таблица 2.
Оценка влияния сопутствующего заболевания на исход болезни
| Категория сопутствующего заболевания | Количество пациентов | Значимость влияния сопутствующего заболевания на исход | |||
|---|---|---|---|---|---|
| выписано | умерло | χ2 | p | ||
| СС | Есть | 104 | 34 | 6.93 | 0.008 |
| Нет | 65 | 6 | |||
| Диабет | Есть | 30 | 12 | 3.02 | 0.082 |
| Нет | 139 | 28 | |||
| Онкология | Есть | 17 | 5 | 0.027 | 0.868 |
| Нет | 152 | 35 | |||
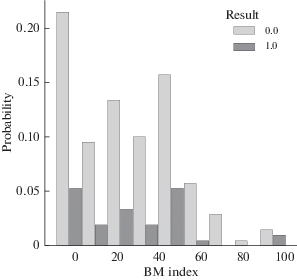
Рассмотрено влияние ожирения на исход COVID-19. В использованной выборке пациентов (209 человек) 73% имели повышенный индекс массы тела (ИМТ). Получено распределение выздоровевших и умерших пациентов в зависимости от отклонения этого показателя от нормы (рис. 3), которое не позволяет говорить о значимом влиянии степени ожирения на исход болезни.
Рис. 3.
Вероятность благоприятного (0) и летального (1) исходов болезни пациентов в зависимости от отклонения их индекса массы тела (BM_index) от нормы, %.
Разделив пациентов на две группы: с ИМТ в пределах физиологической нормы (всего 56 человек, умерли 11) и повышенным (всего 153 человек, умерли 29), мы провели статистическую оценку влияния избыточной массы тела на неблагоприятный исход болезни. Значимого влияния отклонения ИМТ от нормы на летальность обнаружено не было (χ2(1, n = 209 ) = 0.0126, p = 0.911).
Исследовано влияние уровня сатурации на исход болезни. Результаты математического анализа представлены в виде Violin (скрипичной) диаграммы (рис. 4). Эта статистическая диаграмма используется для визуализации распределения данных и их плотности вероятности. Каждая “скрипка” представляет группу переменных значений одной категории данных. Колоколообразная форма распределения означает нормальное распределение.
Рис. 4.
Скрипичная диаграмма, отражающая зависимость исхода болезни (0 – выписан, 1 – умер) от уровня сатурации (Sat) и категории возраста пациентов: 1 – 18 < 35 лет; 2 – 35 < 50 лет; 3 – 50 < 65 лет; 4 – 65 < 80 лет; 5 – ≥ 80 лет.
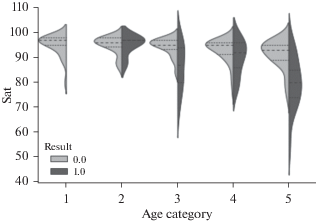
Из рис. 4 и табл. 3 видно, что у большинства выздоровевших пациентов уровень сатурации при госпитализации был выше 85%, среднее значение находилось в пределах 91.3–95.2%, медианное значение – 93–97%. Видно, что с увеличением возраста снижается среднее значение уровня сатурации выписанных пациентов.
Таблица 3.
Оценка влияния уровня сатурации (Sаt), определяемого у больных разного возраста при госпитализации, на исход болезни
| Категория возраста | Благоприятный исход болезни | Летальный исход болезни | p | ||||
|---|---|---|---|---|---|---|---|
| кол-во пациент. | среднее
значение Sаt ± S, % |
медиана Sаt | кол-во пациент. | среднее
значение Sаt ± S, % |
медиана Sаt | ||
| 18 < 35 лет | 26 | 95.2 ± 4.2 | 97.0 | 0 | – | – | – |
| 35 < 50 лет | 35 | 95.0 ± 3.7 | 96.0 | 5 | 95.2 ± 4.0 | 97.0 | 0.812 |
| 50 < 65 лет | 35 | 94.3 ± 3.7 | 95.0 | 9 | 86.2 ± 9.3 | 87.0 | 0.001 |
| 65 < 80 лет | 43 | 93.0 ± 4.9 | 95.0 | 9 | 89.8 ± 7.1 | 92.0 | 0.026 |
| ≥80 лет | 30 | 91.3 ± 6.0 | 93.0 | 17 | 79.9 ± 10.5 | 80.0 | 0.0003 |
Кривая распределения показателя сатурации у умерших из 2-ой возрастной группы не отличается от таковой у выздоровевших пациентов (рис. 4), средние значения уровня сатурации у этих групп совпадают (табл. 3). Видимо, состояние этих пациентов резко ухудшилось уже после госпитализации.
На скрипичной диаграмме наблюдается значительный разброс показателей сатурации умерших пациентов из трех старших групп. Средний уровень сатурации у них находился в пределах 86.2–79.9%, с возрастом понижался. Отмечено, что для пациентов старше 50 лет сатурация меньше 80% стала маркером летальности (p < 0.01).
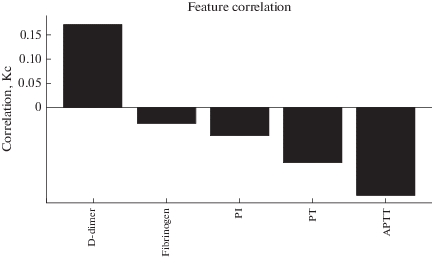
Исследовали корреляцию показателей свертывающей системы крови пациентов с исходом болезни (рис. 5), выборка составила 79 пациентов. Из диаграммы следует, что неблагоприятный исход болезни в значительной степени ассоциирован с увеличением концентрации D-димера (Кс = 0.17) и уменьшением АЧТВ (APTT) (Кс = –0.17 ).
Более подробно рассмотрено влияние концентрации D-димера в крови пациентов различных возрастных групп на исход болезни. Выборка составила 79 пациентов (39 летальных исходов). На рис. 6 в виде диаграммы рассеяния представлена зависимость исхода болезни от содержания D-димера и возраста пациентов. На диаграмме видно, что значительное увеличение уровня D-димера обнаружено в основном у пациентов старше 80 лет, и в большинстве случаев эти пациенты умерли, для пациентов данной возрастной категории повышение концентрации D-димера на 150% стало маркером летальности. У пациентов других возрастных категорий редко фиксировали повышение содержания D-димера более чем в 2 раза, летальных исходов среди них не было.
Рис. 6.
Зависимость исхода болезни (a) – выписан, (b) – умер от превышения уровня D-димера в крови относительно нормы и от возраста пациентов: 1 – 18 < 35 лет; 2 – 35 < 50 лет; 3 – 50 < 65 лет; 4 – 65 < 80 лет; 5 – ≥ 80 лет.
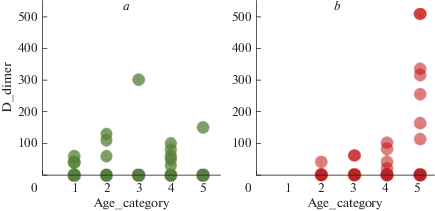
Из рис. 7 видно, что при нормальном уровне D-димера количество благоприятных и летальных исходов практически одинаково, при уровне D-димера на 300% выше нормы летальность составляет 100% – все эти пациенты относятся к 5-ой возрастной группе (рис. 6).
Рис. 7.
Вероятность благоприятного (0) и летального (1) исходов болезни пациентов в зависимости от превышения уровня D-димера в крови относительно нормы.
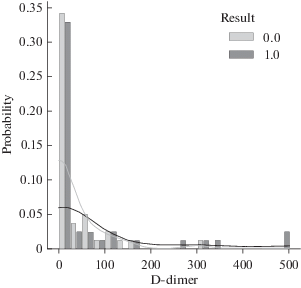
Статистический анализ полученных данных не выявил значимого отличия вероятности летального исхода при нормальном уровне D-димера от таковой при повышенном уровне D-димера (χ2(1, n = 79) = 0.023 с поправкой Йетса, p = 0.879). Видимо, это обусловлено малой выборкой пациентов, в которую вошли практически все летальные исходы (39).
Проведен статистический анализ показателей APTT, выборка составила 186 человек. Большинство умерших пациентов (34 человека) имели данный показатель на уровне нормы, 5 пациентов – выше нормы, значимого отличия вероятности летального исхода для этих категорий пациентов не обнаружено (χ2(1, n = 186) = 0.841 с поправкой Йетса, p = 0.359). Все пациенты (14 человек) с APTT ниже нормы выздоровели, видимо, благодаря антикоагулянтной терапии. Таким образом, величина APTT не может являться маркером летальности.
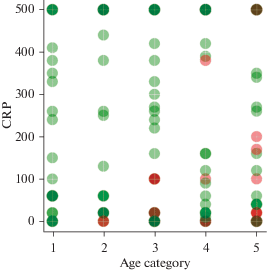
Следующий показатель, который был рассмотрен – С-реактивный белок (CRP), выборка пациентов составила 181 человек. Была проанализирована зависимость исхода болезни от его содержания в крови пациентов разного возраста. Она представлена на рис. 8 в виде диаграммы рассеяния параметров. Из диаграммы видно, что пациенты выздоравливали и умирали с самыми разными значениями этого показателя, т.е. корреляции в данном случае не обнаружено, но мы обратили внимание на значительную летальность пациентов с низким уровнем CRP.
Рис. 8.
Зависимость исхода болезни (красный – умер, зеленый – выписан) от превышения концентрации C-реактивного белка (CRP) в крови относительно нормы и от возраста пациентов: 1 – 18 < 35 лет; 2 – 35 < 50 лет; 3 – 50 < 65 лет; 4 – 65 < 80 лет; 5 – ≥ 80 лет.
Поэтому мы решили проверить, как влияет применение кортикостероидов (внутримышечные инъекции преднизолона или дексаметазона) на исход болезни пациентов с разным уровнем CRP. На рис. 9 представлено нормированное распределение пациентов (181 человек) с благоприятным и летальным исходами болезни в зависимости от содержания CRP в крови при проведении терапии кортикостероидами. Из диаграммы видно, что количество умерших пациентов составляет более 50% от общего количества пациентов с низким уровнем CRP (0–5 мг/л). Большая часть летальных исходов находится в интервале концентрации С-реактивного белка 0–12.5 мг/л.
Рис. 9.
Вероятность благоприятного (0) и летального (1) исхода заболевания в зависимости от превышения уровня С-реактивного белка (CRP) в крови относительно нормы на фоне лечения кортикостероидами.
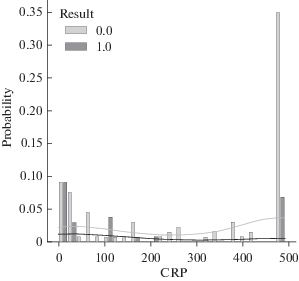
Нами проведен сравнительный анализ распределений пациентов, в терапии которых применялись и не применялись противовоспалительные стероиды, концентрацию CRP 12.5 мг/л использовали как пограничное значение (табл. 4).
Таблица 4.
Исход болезни пациентов с различным уровнем C-реактивного белка в крови в зависимости от лечения кортикостероидами; оценка достоверности отличий признаков групп пациентов
| Исход болезни | Количество пациентов, в терапии которых кортикостероиды | |||
|---|---|---|---|---|
| применяли | не применяли | |||
| CRP ≤ 12.5 мг/л | CRP > 12.5 мг/л | CRP ≤ 12.5 мг/л | CRP > 12.5 мг/л | |
| а | b | c | d | |
| Благоприятный | 33 | 66 | 21 | 22 |
| Летальный | 21 | 11 | 4 | 3 |
| Столбцы | Достоверность отличий признаков при сравнении выборок пациентов | |||
| а и b | χ2 (1, n = 181) = 9.118 с поправкой Йетса, p = 0.0025 | |||
| а и c | χ2 (1, n = 181) = 3.148 с поправкой Йетса, p = 0.076 | |||
| b и d | χ2 (1, n = 181) = 0.002 с поправкой Йетса, p = 0.963 | |||
| c и d | Малое количество наблюдений | |||
Из табл. 4. видно, что среди пациентов с концентрацией в крови CRP ≤ 12.5 мг/л, получавших кортикостероиды (дексаметодон, преднизолон), умерли 38.9%, из пациентов, не получавших стероиды, умерли 16%, достоверность отличий определена на уровне p < 0.10. Если CRP был выше 12.5 мг/л, то летальность при гормонотерапии составила 14.3%, а в отсутствие терапии стероидами умерли 12% пациентов, в данном случае из-за малого количества наблюдений, достоверность отличий определить невозможно. Достоверность отличия степени летальности пациентов в случае применения кортикостероидов при содержании в крови CRP ≤ 12.5 мг/л (38.9%) и при CRP > 12.5 мг/л (14.3%) определена на уровне доверительной значимости p < 0.01.
Таким образом, при использовании кортикостероидов уровень летальности пациентов с CRP ≤ 12.5 мг/л в 2.7 раз выше, чем пациентов с CRP > 12.5 мг/л (p < 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последнее время наблюдается рост числа больных COVID-19 с признаками пневмонии. Особенности пневмонии при COVID-19 заключаются в следующем: происходит поражение интерстициальной (соединительной) ткани, при острой форме заболевания – альвеол; чаще наблюдается двусторонне поражение легких; на компьютерной томографии пораженные участки выглядят полупрозрачно, так называемое “матовое стекло”; проявляется высокая степень дыхательной недостаточности, она быстро развивается. Помимо повреждения легких, у некоторых пациентов обнаруживают повреждения других органов, включая печень, почки, сердце и систему кроветворения, что свидетельствует о наличии системного воспаления [5, 6]. Перечисленные особенности связаны с патогенезом COVID-19, а именно развитием очень сильной воспалительной реакции организма на вирусные частицы, что приводит к поражению тканей собственного организма иммунокомпетентными клетками, вызывая ОРДС и полиорганную недостаточность [7].
При большом потоке больных с COVID-19 полезными являются маркеры развития заболевания, которые должны сигнализировать о возможности неблагоприятного исхода болезни [11]. Выявить такие маркеры, уточнить их параметры можно, проводя исследования на репрезентативных выборках пациентов с использованием адекватных методов статистического и корреляционного анализа.
В рамках представленного ретроспективного исследования эпикризов больных пневмонией, вызванной вирусом SARS-CoV-2 (случайная выборка составила 209 человек), нами проанализированы физиологические показатели пациентов, которые обязательно изучаются врачом при госпитализации, а также показатели коагуляции крови и развития воспалительной реакции – физиологических процессов, подверженных наибольшим изменениям при COVID-19.
Корреляционная диаграмма (рис. 1), для построения которой были использованы возраст, пол пациентов, наличие сопутствующего заболевания (СС, диабет, онкология) и 7 физиологических показателей (табл. 1), позволила выявить физиологические признаки пациентов, в наибольшей степени ассоциированные с неблагоприятным исходом болезни: возраст (Кс = 0.25), наличие сопутствующего заболевания (Кс = 0.16–0.20), уровень сатурации (Кс = –0.43). Эти признаки были более детально проанализированы.
В частности, показано, что уровень смертности среди госпитализированных с пневмонией больных растет с увеличением возраста пациентов (рис. 2). Так, в возрастной категории 18 < 35 лет (26 человек) не зафиксировано летальных исходов, в возрастной группе 35 < 50 (40 человек) – их 12.5%, в группе 50 < 65 лет (44 человека) – 20.5%, в группе 65 < 80 лет (52 человека) – 17.3%, в группе > 80 лет (47 человек) – 36.2%. Отмечено также, что женщин среди пациентов трех старших групп (после 50 лет) почти в 1.5 раза больше, чем мужчин, а смертность в 2.2 раза меньше: в группе женщин зафиксировано 16.5% неблагоприятных исходов, в группе мужчин – 36.2% (p < 0.05). В 3-ей возрастной группе мужчин летальных исходов 27.8%, в 4-ой группе – 26.3%, в группе мужчин старше 80 лет (21 человек) – 52.4%.
Полученные нами результаты согласуются с данными других исследователей, определяющих пожилой возраст и мужской пол как факторы риска неблагоприятного исхода COVID-19 [11, 12, 15]. Так, мета-анализ, включающий 3027 пациентов, инфицированных SARS-CoV-2 [16], определил, что для курящих мужчин в возрасте >65 лет данное заболевание является наиболее опасным. В настоящем исследовании с достаточной степенью достоверности (p < 0.05) показано, что возраст старше 50 лет и мужской пол можно считать факторами риска для пациентов с диагностированной пневмонией, вызванной SARS-CoV-2.
При рассмотрении влияния сопутствующего заболевания на исход болезни пациентов мы разделили заболевания на три категории: сердечно-сосудистая патология, диабет и онкология, не детализируя диагноз. 97% пациентов имели какую-либо патологию из перечисленных категорий, у многих в анамнезе присутствовали несколько заболеваний, так, у 90% больных диабетом была СС патология. При проведении статистического анализа мы рассматривали влияние каждой категории заболевания отдельно (табл. 2). Показано, что значимое влияние на исход болезни оказывает СС патология (p < 0.01). Смертность в группе таких больных в 3 раза выше, чем у пациентов без СС заболеваний. Смертность у больных диабетом в 1.7 раз выше, чем у пациентов без диабета (p < 0.10). Влияние онкологического заболевания на исход болезни не значимо (p > 0.10), возможно отсутствие статистически обоснованной корреляции в данном случае обусловлено малым количеством наблюдений.
СС заболевание, как наиболее значимый фактор, ухудшающий прогноз пациентов с COVID-19, отмечают разные авторы: в работе [17] установлено, что у умерших пациентов наиболее часто встречались артериальная гипертензия и заболевания сердца; в работе [18] артериальная гипертензия также указана как наиболее неблагоприятное заболевание с точки зрения прогноза; в исследовании [15] ишемическая болезнь сердца находится в списке заболеваний с наиболее высоким процентом летальности (26.3%).
Влияние диабета 2-го типа на исход болезни подробно рассмотрено в работах [15, 19], авторы отмечают увеличение летальности от COVID-19 у пациентов с данным заболеванием более чем в 2 раза. Полученные нами данные согласуются с результатами этих исследований.
Нами не выявлено значимого влияния на исход заболевания избыточной массы тела, об этом свидетельствуют результаты анализа, приведенные на корреляционной диаграмме (рис. 1) и в виде нормированного распределения (рис. 3), а также статистическая оценка достоверности отличий признаков. В работе [15] также не наблюдалось существенного различия по индексу массы тела между выписанными и умершими пациентами: средний показатель индекса массы тела выписанных пациентов составил 32.9 кг/м2, умерших – 30.9 кг/м2. Но обращает на себя внимание тот факт, что большая часть пациентов (73%) со среднетяжелой и тяжелой формами COVID-19 все-таки имеют избыточный вес. Ожирение в качестве значимого фактора риска неблагоприятного исхода COVID-19 отмечено в работе мексиканских авторов [18].
Известно, что снижение уровня сатурации до 95% при норме 98–99% является показанием к госпитализации больных COVID-19 в России [20]. Уровень сатурации свидетельствует о насыщении крови кислородом, падение показателя говорит о снижении одной из основных функций легких – переноса кислорода из воздуха в кровь. Снижение сатурации при COVID-19 обычно сопровождается одышкой, которая проявляется в увеличении частоты дыхания. Нами выявлены максимальные коэффициенты корреляции уровня сатурации (Кс = –0.43) и частоты дыхания (Кс = 0.43) – взаимосвязанных физиологических показателей – с летальным исходом (рис. 1). Детальное рассмотрение зависимости уровня сатурации выписанных и умерших пациентов от их возраста (рис. 4, табл. 3) позволило выявить некоторые закономерности: у большинства выздоровевших пациентов уровень сатурации при госпитализации был выше 85%, с увеличением возраста среднее значение уровня сатурации выписанных пациентов снижалось от 95.2 до 91.3%; у умерших пациентов средний уровень сатурации в зависимости от категории возраста был 86.2–79.9%, для пациентов старше 50 лет уровень сатурации при госпитализации ниже 80% стал маркером летальности (p < 0.01). Необходимо отметить, что одышка как основной признак пневмонии при COVID-19 упомянута во многих публикациях [5, 6, 16, 17], в работе [12] частота дыхания и степень сатурации кислородом включены в 8 основных предикторов при построении прогностической модели летального исхода заболевания.
Помимо тяжелой гипоксии у больных COVID-19 отмечают коагулопатии с развитием синдрома диссеминированного свертывания крови [21]. Поэтому при госпитализации больных с подозрением на COVID-19 или с подтвержденным COVID-19 эксперты рекомендуют определять уровень D-димера в крови, фибриноген и другие показатели свертывающей системы крови, оценить количество тромбоцитов и в соответствии с результатами анализов проводить антитромботическую терапию [21]. Известно, что уровень D-димера в крови, более чем в 2 раза превышающий верхнюю границу нормы, указывает на повышенный риск тромбоза глубоких вен нижних конечностей и тромбоэмболии легочных артерий [10, 21]. У больных COVID-19 предложено считать уровень D-димера в крови высоким, если он в 3–4 раза превышает верхнюю границу нормы, и крайне высоким при превышении верхней границы нормы в 5–6 раз и более [21]. Уровень D-димера 1 мг/мл введен в прогностическую модель летальности при COVID-19 [22].
В настоящем исследовании нами проанализированы показатели свертывающей системы крови в качестве предикторов летальности (рис. 5). На выборке из 79 пациентов установлены наибольшие коэффициенты корреляции для D-димера (Кс = 0.17) и APTT (Кс = –0.17), т.е. с увеличением содержания в крови D-димера и с уменьшением активированного частичного тромбопластинового времени (APTT) увеличивается вероятность летального исхода. Установлено, что повышение концентрации D-димера более чем в 2.5 раз относительно нормы (более 625 нг/мл) у пациентов старше 80 лет ассоциировано с летальным исходом (рис. 6). У пациентов других возрастных категорий редко фиксировали такое превышение, летальных исходов среди них не было. Статистически значимого отличия вероятности летального исхода при нормальном уровне D-димера от таковой при повышенном уровне D-димера обнаружено не было, возможно из-за недостаточного количества наблюдений (79 пациентов, из них 39 летальных исходов). Аналогичные результаты были получены при статистическом анализе показателя APTT (выборка составила 186 человек). Видимо, антитромботическая терапия является достаточно эффективной.
Основной причиной летальных исходов при COVID-19 является агрессивная воспалительная реакция организма – “цитокиновый шторм”. На это указывает корреляция тяжести заболевания COVID-19 и летальности с уровнем цитокинов, включая интерлейкин ИЛ-6 и ИЛ-8, аналогичное явление было обнаружено в предыдущих исследованиях ближневосточного респираторного синдрома (MERS) и тяжелого острого респираторного синдрома (SARS) [23]. У пациентов, инфицированных патогенными коронавирусами человека, цитокиновый шторм способствует острому повреждению легких и развитию ОРДС [1, 4, 23]. Следовательно, контроль цитокинового шторма предложен в качестве стратегии лечения пациентов с COVID-19, особенно в тяжелых случаях [23, 24].
Под действием противовоспалительных цитокинов увеличивается синтез С-реактивного белка – гликопротеина, вырабатываемого печенью и относящегося к белкам острой фазы воспаления. Его концентрация в крови возрастает в 10–100 раз в течение 24–48 ч после начала воспаления [25]. Содержание С-реактивного белка в крови, как правило, контролируют у госпитализированных пациентов, поэтому в качестве показателя развития воспалительного процесса нами был рассмотрен именно CRP. Необходимо отметить, что уровень С-реактивного белка учитывается во многих прогностических моделях риска смерти от COVID-19 [11, 12, 22].
Выборка пациентов для статистического анализа составила 181 человек. Корреляции содержания CRP с исходом болезни обнаружено не было, но отмечалось значительное количество летальных исходов при нормальном уровне этого белка (рис. 8). Поэтому было проанализировано влияние кортикостероидов (внутримышечные инъекции преднизолона или дексаметазона), применяемых в терапии, на исход болезни пациентов с различным содержанием CRP. Известно, что кортикостероиды могут использоваться для подавления цитокинового шторма, однако, основываясь на данных, полученных от пациентов с MERS и SARS, их применение не улучшило выживаемость, а скорее замедляло выведение вируса [23, 24].
Статистический анализ показал (табл. 4), что применение кортикостероидов при уровне CRP ≤ 12.5 мг/л c большей вероятностью приведет к летальному исходу, чем их отсутствие в терапии при этом уровне C-реактивного белка (p < 0.10) и чем их применение при уровне CRP > 12.5 мг/л (p < 0.01). Влияние на исход болезни применения кортикостероидов при уровне CRP > 12.5 мг/л не нашло статистического подтверждения, возможно, из-за малого количества наблюдений. Следовательно, при содержании в крови пациентов CRP ниже 12.5 мг/л применение кортикостероидов может привести к ухудшению состояния больных COVID-19, что согласуется с результатами исследований, приведенными в работах [23, 24].
Таким образом, применение адекватных компьютерных программ и математических методов позволило нам проанализировать значительный массив физиологических и биохимических показателей пациентов с пневмонией COVID-19 и выявить некоторые закономерности, которые можно использовать в клинической практике и в дальнейших исследованиях нового инфекционного заболевания.
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ
Ограничения связаны с ретроспективным дизайном исследования. Не все лабораторные исследования были выполнены у всех пациентов, поэтому частные выборки варьировали по количеству пациентов. Кроме того, значения лабораторных тестов могут быть искажены предшествующим лечением этих пациентов вне стационара. Интерпретация наших результатов также может быть ограничена из-за относительно небольшого размера общей выборки.
ЗАКЛЮЧЕНИЕ
Математический анализ ретроспективных данных 209 пациентов с пневмонией, вызванной вирусом SARS-CoV-2, позволил конкретизировать некоторые физиологические и биохимические показатели, свидетельствующие о неблагоприятном исходе болезни: возраст старше 50 лет, мужской пол, наличие у пациентов сердечно-сосудистой патологии, для пациентов старше 50 лет – сатурация меньше 80%, для пациентов старше 80 лет – уровень D-димера в 2.5 раза выше нормы. Отмечено, что при содержании в крови пациентов C-реактивного белка ниже 12.5 мг/л применение кортикостероидов приводит к увеличению вероятности летального исхода.
Список литературы
Mishra SK, Tripathi T (2021) One year update on the COVID-19 pandemic: Where are we now? Acta Tropica 214: 10577. https://doi.org/10.1016/j.actatropica.2020.105778
Ou X, Liu Y, Lei X, Li P, Mi D, Ren L, Guo L, Guo R, Chen T, Hu J, Xiang Z, Mu Z, Chen X, Chen J, Hu K, Jin Q, Wang J, Qian Z (2020) Characterisation of spike glycoprotein of SARS-CoV-2 on virus entry and its immunecrossreactivity with SARS-CoV-2. Version 2. Nature Communicat 11(1): 1620. https://doi.org/10.1038/s41467-020-15562-9
Hoffmann M, Kleine-Weber H, Schroeder S, Kru N, Erichsen S, Schiergens TS, Herrler G, Wu N, Nitsche A, Mu MA, Drosten C, Pohlmann S (2020) SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 181(2): 271–280. https://doi.org/10.1016/j.cell.2020.02.052
Фролова ЕВ, Филлиппова ЛВ, Учеваткина АВ, Пономаренко ВА, Борзова ЮВ, Шупицкая ОА, Тараскина АЕ, Гайковая ЛБ, Федоренко АС, Гомонова ВВ, Латария ЭЛ, Васильева НВ (2021) Иммунологические особенности пациентов с COVID-19 в зависимости от степени тяжести заболевания. Пробл мед микол 23(1):3-13. [Frolova EV, Filippova LV, Uchevatkina AV, Ponomarenko VA, Borzova YuV, Shurpitskaya OA, Taraskina AE, Gaykovaya LB, Fedorenko AS, Gomonova VV, Latariia EL, Vasilyeva NV (2021) Immunological features of patients with COVID-19, depending on the severity of the disease. Probl Med Mycol 23(1): 3–13. (In Russ)].
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Xia J, Yu T, Zhang X, Zhan L (2020) Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395: 507–513. https://doi.org/10.1016/S0140-6736(20)30211-7
Huang C, Wang Y, Li X., Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B (2020) Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395: 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Ragab D, Eldin SH, Taeimah M, Khattab R, Salem R (2020) The COVID-19 Cytokine Storm; What We Know So Far. Front Immunol 11: 1446. https://doi.org/10.3389/fimmu.2020.01446
Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X, Lu Z (2020) Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). J.A.M.A. Cardiology 5(7): 811–818. https://doi.org/10.1001/jamacardio.2020.1017
Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Guan L, Wei Y, Li H, Wu X, Xu J, Tu S, Zhang Y, Chen H, Cao B (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 395(10229): 1054–1062. https://doi.org/10.1016/S0140-6736(20)30566-31
Канорский СГ (2021) COVID-19 и сердце: прямое и косвенное влияние. Кубанск научн мед вестник 28(1): 16–31. [Kanorskii SG (2021) COVID-19 and the heart: direct and indirect impact. Kuban Scient Med Bull 28(1):16–31. (In Russ)]. https://doi.org/10.25207/1608-6228-2021-28-1-16-31
Wynants L, Van Calster B, Collins G S, Riley R D, Heinze G, Schuit E, Bonten MMJ, Dahly DL, Damen JA, Debray TPA, de Jong VMT, De Vos M, Dhiman P, Haller MC, Harhay MO, Henckaerts L, Heus P, Kammer M, Kreuzberger N, Lohmann A, Luijken K, Ma J, Martin GP, McLernon DJ, Navarro CLA, Reitsma JB, Sergeant JC, Shi C, Skoetz N, Smits LJM, Snell KIE, Sperrin M, Spijker R, Steyerberg EW, Takada T, Tzoulaki I, van Kuijk SMJ, van Bussel BCT, van der Horst ICC, van Royen FS, Verbakel JY, Wallisch C, Wilkinson J, Wolff R, Hooft L, Moons KGM, van Smeden M (2020) Prediction models for diagnosis and prognosis of covid-19: systematic review and critical appraisal. Br Med J 369: m1328. https://doi.org/10.1136/bmj.m1328
Knight SR, Ho A, Pius R, Buchan I, Carson G, Drake TM, Dunning J, Fairfield CJ, Gamble C, Green CA, Gupta R, Halpin S, Hardwick HE, Holden KA, Horby PW, Jackson C, Mclean KA, Merson L, Nguyen-Van-Tam JS, Norman L, Noursadeghi M, Olliaro PL, Pritchard MG, Russell CD, Shaw CA, Sheikh A, Solomon T, Sudlow C, Swann OV, Turtle LCw, Openshaw PJm, Baillie JK, Semple MG, Docherty AB, Harrison EM (2020) Risk stratification of patients admitted to hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: development and validation of the 4C Mortality Score. Br Med J 370 :m3339 https://doi.org/10.1136/bmj.m3339
Крамер Г (1975) Математические методы статистики. М. Мир. [Cramér H (1975) Mathematical methods of statistics. M. Mir. (In Russ)].
Greenwood PE, Nikulin MS (1996) A guide to chi-squared testing. New York. John Wiley & Sons.
Демидова Т Ю, Лобанова КГ, Переходов СН, Анциферов МБ, Ойноткинова ОШ (2021) Клинико-лабораторная характеристика пациентов с COVID-19 и сопутствующим сахарным диабетом 2 типа. Кардиоваскулярная терапия и профилактика 20(1): 2750. [Demidova TY, Lobanova KG, Perekhodov SN, Antsiferov MB, Oynotkinova OS (2021) Clinical and laboratory characteristics of patients with COVID-19 and concomitant type 2 diabetes. Cardiovasc Therapy and Prevention. 20(1): 2750. (In Russ)]. https://doi.org/10.15829/1728-8800-2021-2750
Zheng Z, Peng F, Xu B, Zhao J, Liu H, Peng J, Li Q, Jiang C, Zhou Y, Liu S, Ye C, Zhang P, Xing Y, Guo H, Tang W (2020) Risk factors of critical & mortal COVID-19 cases: A systematic literature review and meta-analysis. J Infect 81(2): e16–e25. https://doi.org/10.1016/j.jinf.2020.04.021
Chen T, Wu D, Chen H, Yan W, Yang D, Chen G, Ma K, Xu D, Yu H, Wang H, Wang T, Guo W, Chen J, Ding C, Zhang X, Huang J, Han M, Li S, Luo X, Zhao J, Ning Q (2020) Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. Br Med J 368: m1091. https://doi.org/10.1136/bmj.m1091
Parra-Bracamonte GM, Lopez-Villalobos N, Parra-Bracamonte FE (2020) Clinical characteristics and risk factors for mortality of patients with COVID-19 in a large data set from Mexico. Ann Epidemiol S1047-2797(20)30286-6. https://doi.org/10.1016/j.annepidem.2020.08.005
Шестакова МВ, Викулова ОК, Исаков МА, Дедов ИИ (2020) Сахарный диабет и COVID-19: анализ клинических исходов по данным регистра сахарного диабета Российской Федерации. Пробл эндокринол 66(1): 35–46. [Shestakova MV, Vikulova OK, Isakov MA, Dedov II (2020) Diabetes and COVID-19: analysis of the clinical outcomes according to the data of the Russian Diabetes Registry. Probl Endocrinol 66(1): 35–46. (In Russ)]. https://doi.org/10.14341/probl12458
Официальный интернет-портал правовой информации. Дата опубликования: 26.05.2020. Номер опубликования: 0001202005260023. [Official internet portal of legal information. Publication date: 26.05.2020. Number of publication: 0001202005260023. (In Russ)]. http://publication.pravo.gov.ru/Document/View/0001202005260023?index=4&rangeSize=1
Шляхто ЕВ, Арутюнов ГП, Беленков ЮН., Тарловская ЕИ, Конради АО, Панченко ЕП, Явелов ИС, Терещенко СН, Ардашев АВ, Арутюнов АГ, Григорьева НЮ, Джунусбекова ГА, Драпкина ОМ, Желяков ЕГ, Канорский СГ, Колоцей ЛВ, Козиолова НА, Комаров АЛ, Кропачева ЕС, Мальчикова СВ, Митьковская НП, Орлова ЯА., Петрова ММ, Ребров АП, Сисакян АС, Скибицкий ВВ, Снежицкий ВА, Сугралиев АБ, Фомин ИВ, Чесникова АИ, Шапошник ИИ (2020) Применение статинов, антикоагулянтов, антиагрегантов и антиаритмических препаратов у пациентов с COVID-19. Согласованная позиция экспертов Российского кардиологического общества, Евразийской ассоциации терапевтов, Национального общества по атеротромбозу, Общества специалистов по неотложной кардиологии, Евразийской аритмологической ассоциации. Кардиология 60(6): 4–14. [Shlyakhto EV, Arutyunov GP, Belenkov YuN, Tarlovskaya EI, Konradi AO, Panchenko EP, Yavelov IS, Tereshchenko SN, Ardashev AV, Arutyunov AG, Grigorieva NYu, Dzhunusbekova GA, Drapkina OM, Koziolova NA, Komarov AL, Kropacheva ES, Malchikova SV, Mitkovskaya NP, Orlova YaA, Petrova MM, Rebrov AP, Sisakian H, Skibitsky VV, Sugraliyev AB, Fomin IV, Chesnikova AI, Shaposhnik II, Zhelyakov EG, Kanorskii SG, Kolotsey LV, Snezhitskiy VA (2020) Use of Statins, Anticoagulants, Antiaggregants and Antiarrhythmic Drugs in Patients With COVID-19. The Agreed Experts’ Position of Russian Society of Cardiology, Eurasian Association of Therapists, National Society on Atherothrombosis, Societies of Experts in Urgent Cardiology, Eurasian Arrhythmology Association. Kardiologiia 60(6): 4–14. (In Russ)]. 5https://doi.org/10.18087/cardio.2020.6.n1180
Hu C, Liu Z, Jiang Y, Shi O, Zhang X, Xu K, Suo C, Wang Q, Song Y, Yu K, Mao X, Wu X, Wu M, Shi T, Jiang W, Mu L, Tully DC, Xu L, Jin L, Li S, Tao X, Zhang T, Chen X (2021) Early prediction of mortality risk among patients with severe COVID-19, using machine learning. Int J Epidemiol 49(6): 1918–1929. https://doi.org/10.1093/ije/dyaa171
Russell CD, Millar JE, Baillie JK (2020) Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 395(10223): 473–475. https://doi.org/10.1016/S0140-6736(20)30317-2
Miao Y, Fan L, Li J-Y (2020) Potential Treatments for COVID-19 Related Cytokine Storm – Beyond Corticosteroids. Front Immunol11: article 1445. https://doi.org/10.3389/?mmu.2020.01445
Кишкун АА (2006) Иммунологические и серологические исследования в клинической практике. ООО “Медицинское информационное агентство”. [Kishkun AA (2006) Immunological and serological studies in clinical practice. OOO “Meditsinskoye informatsionnoye agentstvo”. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова