Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1323-1343
Перспективы применения синтетических наночастиц в оптогенетическом протезировании сетчатки
А. Ю. Ротов 1, *, И. С. Романов 1, Я. В. Тараканчикова 2, 3, Л. А. Астахова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Университет Оулу
Оулу, Финляндия
3 Санкт-Петербургский национальный исследовательский Академический университет
им. Ж.И. Алфёрова РАН
Санкт-Петербург, Россия
* E-mail: rotovau@gmail.com
Поступила в редакцию 25.08.2021
После доработки 09.09.2021
Принята к публикации 09.09.2021
Аннотация
Оптогенетическое протезирование представляет собой подход, направленный на возвращение зрительной функции при дегенеративных заболеваниях сетчатки. Оно заключается в доставке генов, кодирующих светочувствительные белки, в клетки сетчатки, пережившие дегенерацию, в первую очередь биполярные и ганглиозные. В результате они превращаются в “псевдофоторецепторы” и могут взять на себя функцию утерянных палочек и колбочек. Ключевым элементом в процессе оптогенетического протезирования является вектор, доставляющий экзогенную ДНК в ядро клетки. Существует две основные категории векторов: вирусные и синтетические. Последние включают в себя наночастицы на основе различных полимеров, липидов и инертных металлов. Ранее считалось, что вирусы трансфицируют живые клетки более эффективно, чем синтетические частицы за счет специализированных механизмов доставки переносимого генетического материала. Однако к настоящему времени разработаны наночастицы, способные эффективно проникать через тканевые барьеры, захватываться клетками и успешно доставлять в ядро молекулы нуклеиновых кислот. В рамках настоящего обзора описаны современные подходы к разработке наноносителей и сформулированы основные требования к их физико-химическим свойствам, обеспечивающим наиболее эффективную доставку генетического материала сквозь барьерные структуры глаза в биполярные и ганглиозные клетки. По результатам анализа актуальных данных литературы отобраны несколько типов наночастиц, наиболее перспективных для использования в рамках оптогенетического протезирования сетчатки.
Оптогенетика – это подход, позволяющий регулировать физиологическую активность генетически модифицированных клеток с помощью световой стимуляции. Для ее реализации в клетки необходимо доставить экзогенную ДНК, кодирующую светочувствительный белок – ионный канал (бактериальные опсины) или метаботропный рецептор (опсины животных). Под воздействием света с определенными спектральными характеристиками у нейронов, экспрессирующих такие белки, будет происходить гиперполяризация или деполяризация мембраны [1]. Изначально оптогенетика применялась как инструмент для фундаментальных исследований нейронной активности, поскольку она позволяет с высокой точностью и селективностью контролировать работу отдельных клеток и их популяций. Свою основную прикладную значимость этот подход приобрел в рамках терапии дегенеративных заболеваний сетчатки, таких как возрастная макулодистрофия или пигментный ретинит. В ходе их развития происходит гибель фоторецепторных клеток сетчатки – палочек и колбочек – либо в области желтого пятна (макулы), либо начиная с периферии [2]. Зачастую другие типы нейронов сетчатки (горизонтальные, биполярные, амакриновые и ганглиозные) сохраняются в течение длительного времени, однако в отсутствие фоторецепторов, преобразующих энергию света в электрический сигнал, теряется первое и основное звено в цепи световосприятия. Оптогенетика позволяет “протезировать” зрение, то есть наделять изначально не способные к фоторецепции клетки сетчатки светочувствительностью, превратив их в “псевдофоторецепторы”. Наиболее перспективными мишенями для оптогенетического протезирования являются биполярные и ганглиозные клетки, а также сохранившиеся сегменты фоторецепторов, поскольку именно через них нервный импульс напрямую передается к мозгу [3].
Доставка ДНК, кодирующей светочувствительные белки, в клетки сетчатки происходит с помощью специальных носителей – векторов. Методы доставки без участия векторов, такие как прямая инъекция ДНК и электропорация, либо не позволяют трансфицировать клетки сетчатки, либо имеют крайне низкую эффективность. Существует две основные категории носителей для доставки генов: вирусные и синтетические векторы. Вирусные векторы конструируются на основе лентивирусов, вируса бешенства, аденовирусов и, чаще всего, на основе аденоассоциированных вирусов. Невирусные векторы включают разнообразные частицы субмикронного размера, связывающиеся с молекулами ДНК. В качестве их основы могут выступать полимеры, липиды и металлические нанокристаллы [4]. Традиционно считается, что наночастицы трансфицируют живые клетки гораздо менее эффективно, чем вирусы, поскольку у них отсутствуют специальные механизмы проникновения в клетку и доставки генетического материала в ядро. Однако за последние годы понимание механизмов взаимодействия частиц с тканями глаза и с отдельными клетками значительно углубилось, и исследователи научились решать задачу по доставке генов за счет оптимизации физико-химических свойств отдельных компонентов и носителя в целом.
Синтетические векторы обладают рядом преимуществ по сравнению с вирусами, их синтез существенно проще и относительно дешев, они обладают большей емкостью, особенно в сравнении с аденоассоциированным вирусом, который способен переносить фрагменты ДНК длиной не более 5 тыс. п.о., включая не только ген интереса, но и регуляторные последовательности, необходимые для экспрессии [5]. Наночастицы способны переносить полноценные плазмиды длиной до 20 тыс. п.о., что позволяет включать в последовательность дополнительные элементы, усиливающие экспрессию и ускоряющие транспорт плазмиды в ядро [4]. Несмотря на то, что глаз является иммунопривилегированным органом, введение в него вирусных векторов неизбежно вызывает иммунный ответ и синтез антител, блокирующих активность вирусов при повторных инъекциях [6]. В результате к настоящему времени синтетические наночастицы представляют собой широко распространенный и эффективный инструмент для трансфекции клеток сетчатки. Для более детального рассмотрения вопросов в этой области мы рекомендуем обратиться к недавним обзорным статьям [7, 8].
Следует отметить, что область применения синтетических наночастиц в доставке генетического материала в клетки сетчатки в настоящее время почти полностью сводится к генной терапии фоторецепторов и клеток пигментного эпителия. На животных моделях отрабатывают множество подходов по введению здоровой копии гена, чья экспрессия нарушена, или малых РНК, блокирующих экспрессию патологического продукта, но имеются лишь единичные работы, в которых наночастицы применяются для модификации других клеток сетчатки путем придания им светочувствительности. Целью данного обзора является анализ современных разработок в области синтетических носителей ДНК и оценка возможности их применения для оптогенетического протезирования биполярных и ганглиозных клеток сетчатки. В заключении будет сделан вывод о том, могут ли наночастицы конкурировать с вирусами за роль средства доставки в рамках этой специфической терапии.
ДОСТАВКА ЧАСТИЦ К СЕТЧАТКЕ
При доставке наночастиц следует учитывать, что сетчатка всех позвоночных инвертирована. Это означает, что первыми на пути распространения света – и ближе всего к заполняющему большую часть объема глаза стекловидному телу – оказываются ганглиозные клетки. Затем свет проходит через слой внутренних нейронов (амакриновых, биполярных и горизонтальных клеток) и в итоге попадает на наружный слой фоторецепторов, обращенных к пигментному эпителию и сосудистой оболочке глаза. Доставка материала к клеткам сетчатки может достигаться разными путями. При системном введении на пути вводимых частиц встает гематоретинальный барьер, образованный плотными контактами между клетками эндотелия сосудов сетчатки и клетками пигментного эпителия [9]. Аналогичные трудности возникают при доставке наночастиц с помощью глазных капель – в этом случае барьером выступает роговица глаза. И хотя некоторым типам частиц удается преодолеть данные барьеры и достичь сетчатки, очевидно, что более предпочтительным для данной цели является введение носителя непосредственно внутрь глаза. В настоящее время для введения как вирусных, так и невирусных векторов применяют главным образом интравитреальные и трансретинальные инъекции. Трансретинальное введение представляет собой сложную офтальмологическую операцию, проводимую глазным хирургом, в ходе которой проводится удаление части стекловидного тела (витрэктомия), затем в субретинальное (между сетчаткой и пигментным эпителием) пространство целевой области сетчатки вводится тонкая игла и выполняется инфузия небольшого объема изотонического солевого раствора. Вследствие этого под сетчаткой образуется пузырек, в который затем и вводится вектор через то же микроотверстие в сетчатке [10, 11]. Такой способ введения сопряжен со значительными сложностями и рисками, среди которых общие осложнения после витрэктомии, последующее истончение наружного ядерного слоя сетчатки, а также осложнения от общего наркоза. Дегенерирующая сетчатка, в которую требуется доставлять вещества при оптогенетическом протезировании, становится очень хрупкой, и прокол сетчатки иглой может в дальнейшем приводить к более крупным разрывам. Кроме того, процедура субретинального введения очень сложна технически и требует участия высококвалифицированных специалистов и применения специализированного оборудования.
Интравитреальные инъекции являются более простым и доступным способом доставки целевых веществ к сетчатке. Процедура проводится под местной анестезией, часто в амбулаторных условиях, и материал вводится непосредственно в полость стекловидного тела. В этом случае сетчатка не отслаивается от пигментного эпителия, а доставляемый материал подходит к сетчатке со стороны внутренних слоев, встречая на своем пути сначала ганглиозные, а затем биполярные клетки, которые и являются основными мишенями при оптогенетическом протезировании. Интравитреальный способ введения широко применяется для доставки терапевтических агентов, подавляющих эндотелиальные факторы роста, антибиотиков и глюкокортикоидов, а также вирусных векторов [12, 13]. При оценке способности вирусных или невирусных векторов достигать клеток сетчатки важно учитывать свойства барьеров, через которые им предстоит пройти на пути из стекловидного тела к ганглиозным и биполярным клеткам. Первым этапом прохождения частиц после интравитреальной инъекции является перемещение в самом стекловидном теле. Так, в работе Xu с соавт. [14] исследовалась способность частиц из полистирола проходить через эту структуру в зависимости от их размера и заряда поверхностных функциональных групп. Было показано, что частицы диаметром более 500 нм имеют весьма ограниченную подвижность, а среди более мелких частиц преимуществом при перемещении обладают нейтрально и отрицательно заряженные, поскольку они не связываются с отрицательно заряженными остатками гликозаминогликанов, образующих матрикс стекловидного тела.
Основной барьер на пути наночастиц – это внутренняя пограничная мембрана (ВПМ), выстилающая сетчатку с внутренней стороны и прилегающая к кортексу стекловидного тела. ВПМ – это базальная мембрана, которая представляет собой слои внеклеточного матрикса, состоящего из высокомолекулярных белков, среди которых ламинин, коллаген IV типа, нидоген-/энтактин-1 и -2, а также протеогликанов – перлекана, агрина и коллагена VIII типа [15]. Протеогликаны обладают высокой степенью гликозилирования, и боковые цепи образующих их гликозаминогликанов обусловливают высокий отрицательный заряд мембраны [16]. По-видимому, эту особенность следует принимать во внимание при разработке невирусных векторов для доставки в сетчатку со стороны стекловидного тела, поскольку нейтральный или отрицательный заряд не позволит частицам связаться с мембраной для дальнейшего преодоления, а слишком высокий положительный – полностью иммобилизует их в ее толще.
К настоящему времени нет исчерпывающих данных о том, каков предельный размер частиц, проникновение которых возможно через ВПМ. Имеются данные о том, что ряд моноклональных антител, белков и пептидов массой до 150 кДа способны проникать через нее [17]. Также было показано, что для вирусных векторов ВПМ является как физическим, так и биологическим барьером. Гепарансульфат, который является компонентом входящих в состав данной мембраны протеогликанов, связывается с аденоассоциированными вирусами 2-го и 3-го серотипа, что позволяет им накапливаться на поверхности между стекловидным телом и сетчаткой – именно это делает возможной трансдукцию сетчатки этими вирусами, в отличие от других серотипов [18, 19]. Хотя такой специфический механизм взаимодействия вирусов с ВПМ не должен иметь значения для проникновения невирусных векторов, однако этот пример показывает, что свойства отдельных компонентов данной мембраны могут оказывать существенное влияние на прохождение через нее наночастиц.
ВЗАИМОДЕЙСТВИЕ НАНОЧАСТИЦ С КЛЕТКАМИ
Захват клетками частиц из внеклеточной среды происходит за счет фагоцитоза или эндоцитоза [20]. Реализация того или иного механизма связана как с физико-химическими свойствами частиц – их размером, зарядом, формой, наличием специфических поверхностных групп, так и с типом захватывающей их клетки [21, 22]. Например, среди клеток сетчатки лишь пигментный эпителий и глиальные (мюллеровские) клетки способны к фагоцитозу и выполняют, по сути, роль макрофагов, удаляя фрагменты наружных сегментов фоторецепторов или клеток в состоянии апоптоза [23, 24]. Эта особенность позволяет им успешно захватывать достаточно крупные объекты, такие как бактерии, дрожжи и даже водоросли (диаметр 1–8 мкм) [25]. Однако в возбудимых клетках сетчатки, представляющих основной интерес в качестве мишеней для оптогенетического протезирования – фоторецепторах, биполярных и ганглиозных клетках – основным путем входа частиц в клетку является эндоцитоз, и они способны захватывать частицы диаметром до 250 нм [26–29]. Ряд исследований показывает, что оптимальный размер частиц для их наиболее быстрой и эффективной интернализации в клетку составляет около 50 нм [30, 31].
В зависимости от участвующих белков и липидов, а также морфологии образующихся мембранных структур, выделяют несколько типов эндоцитоза (см. обзор [20]). Основными являются эндоцитоз, опосредованный клатрином или кавеолином, но и другие клатрин/кавеолин-независимые механизмы также вносят вклад в захват внеклеточных частиц. Кавеолин-зависимый эндоцитоз регулируется белками семейства кавеолинов, и в большинстве типов клеток за образование везикул в первую очередь отвечает изоформа кавеолина-1. В сетчатке эта изоформа наиболее активно экспрессируется в мюллеровских клетках, клетках сосудов и в пигментном эпителии, а в фоторецепторах и других нейронах сетчатки обнаруживается лишь в небольшом количестве [32]. Таким образом, маловероятно, что наночастицы, предназначенные для трансдукции возбудимых клеток, будут захватываться по кавеолин-опосредованному типу. Клатрин-зависимый путь запускается либо при взаимодействии частиц со специфическими рецепторами на поверхности клетки (рецептор-опосредованный эндоцитоз), либо при возникновении ионных или диполь-дипольных взаимодействий частиц с плазматической мембраной (рецептор-независимый эндоцитоз) [33]. В обоих случаях образование везикул опосредуется комплексами белка клатрина, которые образуются на внутриклеточной стороне плазматической мембраны и совместно с рядом адаптерных белков образуют корзинообразную структуру вокруг наночастицы. В итоге частица заключается в мембранный пузырек (эндосому), который затем интернализуется во внутриклеточное пространство.
Для того, чтобы наночастица с большей вероятностью была поглощена путем рецептор-опосредованного эндоцитоза, ее поверхность можно конъюгировать с лигандами мембранных рецепторов, такими как лактоферрин или фолат [34, 35]. Для этой же цели наночастицы могут быть покрыты специфическими антителами, которые связываются с рецепторами на клетке-мишени [36]. Немодифицированные наночастицы, как правило, проникают в клетку путем рецептор-независимого эндоцитоза за счет ионных взаимодействий между плазматической мембраной клетки и собственным поверхностным зарядом. Поскольку участки фосфолипидов, образующие поверхность мембраны, имеют отрицательный заряд, то положительно заряженные (катионные) частицы более эффективно подвергаются эндоцитозу по сравнению с анионными или нейтральными [37, 38]. Однако поглощение большого количества положительно заряженных частиц может приводить к нарушению целостности клеточной мембраны и вызывать токсический эффект или даже приводить к гибели клетки [39, 40]. Следует также отметить, что отрицательно заряженные наночастицы эффективнее проникают в клетку, чем нейтральные [41].
Захваченные в ходе клатрин-зависимого эндоцитоза частицы, как правило, разрушаются по мере созревания эндосом и их слияния с лизосомами, под действием гидролаз, функционирующих в кислой среде (pH 4.5–6). Поэтому при создании наноносителей следует предусматривать способы, которыми частица сможет покинуть эндосому (см. обзор [42]). Так, например, некоторые типы липидных и полимерных наночастиц способны сливаться с мембраной эндосомы, высвобождая свое содержимое в цитозоль [43, 44]. Наиболее распространенный механизм выхода из эндосомы связан с разрушением ее мембраны за счет повышения внутреннего давления, и ранее предполагалось, что это явление связано с т.н. “эффектом протонной губки”. Согласно этой гипотезе, входящие в состав ряда частиц полимеры с высокой буферной емкостью могут подавлять снижение pH в эндосоме, что вынуждает клетку продолжать закачку в нее протонов и, вместе с ними, хлорид-анионов и молекул воды, повышая ее внутреннее давление [45]. Однако ряд экспериментальных работ показал, что такая модель не всегда точно предсказывает поведение частиц различного состава в клетке, это говорит о том, что если данный эффект и существует, его роль в разрушении эндосомы не ведущая [46, 47]. В качестве альтернативных путей рассматривается распад полимерных частиц на большое количество олигомеров, приводящий к скачку осмотического давления в эндосоме [48]; увеличение размеров частиц в условиях пониженного значения pH [49]; прямое разрушение мембраны эндосомы некоторыми полимерными компонентами частицы [50]. Механизмы, лежащие в основе выхода из эндосомы, могут оказаться токсичными для клетки, если они будут воздействовать на ее плазматическую мембрану. Для того, чтобы этого избежать, следует использовать в составе наночастиц полимеры, провоцирующие разрушение мембраны только в кислой среде, типичной для созревающих эндосом и эндолизосом. Если наночастице удается высвободиться из эндолизосомы, то плазмидная ДНК оказывается в цитозоле. Однако прежде чем сможет произойти экспрессия переносимого ею гена, ДНК должна оказаться в ядре клетки. Поскольку нейроны сетчатки являются зрелыми постмитотическими клетками, проникновение ДНК в ядро является критическим этапом, который существенно влияет на эффективность экспрессии светочувствительного белка (см. обзор [51]). Исследования показали, что лишь короткие фрагменты ДНК (200–300 п.о.) способны самостоятельно проникать через ядерные поры [52], однако при участии транспортных белков, цитозольных гистонов и шаперонов могут транспортироваться и более длинные фрагменты [53, 54]. Улучшить способность доставленной наночастицами экзогенной ДНК к проникновению в ядро возможно путем встраивания в ее нуклеотидную последовательность сигналов ядерной локализации, которые узнаются клеточными транскрипционными факторами. Например, энхансер вируса SV40, обычно используемый в составе плазмид для усиления экспрессии генов, содержит сигнал ядерной локализации, распознаваемый сразу несколькими транскрипционными факторами (AP-1, 2, 3, Tef- 1, 2, Oct1, NFκB) [55]. Комплекс фактора транскрипции с плазмидой затем распознается белками-импортинами, которые связываются с ним и доставляют к ядерным порам. Показано, что плазмиды без сайтов, узнаваемых транскрипционными факторами, не перемещаются в ядро, а остаются в цитозоле [56]. Таким образом, конструкция плазмидной ДНК не менее важна для эффективной трансдукции клеток, чем состав и строение носителей – наночастиц.
ВИДЫ НАНОЧАСТИЦ И ИХ ПРИМЕНЕНИЕ ДЛЯ ДОСТАВКИ ДНК В КЛЕТКИ СЕТЧАТКИ
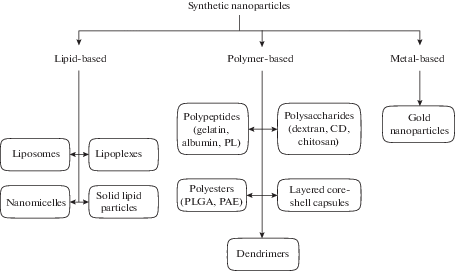
В следующих подразделах будут рассмотрены нанокапсулы на основе трех типов веществ: полимерных молекул (наиболее гетерогенная группа), липидов и инертных металлов (см. рис. 1). Для каждого будут приведены характерные особенности, определяющие способ их применения, и описаны экспериментальные работы, в которых этот тип частиц использовался для трансфекции клеток сетчатки или других тканей глаза.
ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ
Полипептиды
Желатин представляет собой частично гидролизованный коллаген и отличается высокой биосовместимостью, биодеградируемостью и возможностью присоединения разнообразных активных групп для направленной доставки. Благодаря этим свойствам он стал применяться при синтезе наночастиц для доставки лекарственных препаратов и генов в ткани человека и животных. Желатин представляет собой особый полипептид, в составе которого катионные, анионные и гидрофобные группы представлены в соотношении 1 : 1 : 1 [57]. Наночастицы из чистого желатина нестабильны и склонны к агрегации, поэтому их, как правило, модифицируют путем сшивки с другими соединениями, такими как альдегиды, микробная трансглутаминаза и др. Для связывания с анионной плазмидной ДНК благоприятным фактором является положительный заряд, которым характеризуются наночастицы из желатина типа А, но в то же время наночастицы с высоким положительным зарядом часто оказываются токсичными для клеток. Компромиссное решение было предложено Zorzi с соавт. [58], в работе которых были разработаны гибридные наночастицы из катионизированного желатина и полианионов декстрана сульфата и хондроитина сульфата. Такие частицы связываются с плазмидной ДНК, защищая ее от действия ДНКаз, проявляют пониженную токсичность в экспериментах in vitro и способны доставлять ДНК в клетки роговицы человека (ex vivo) и мыши (in vivo) [59].
Альбумин также является белковым носителем, который применяется для получения нетоксичных, неиммуногенных, биосовместимых и биодеградируемых наночастиц. Такие наночастицы обладают высокой связывающей способностью и хорошим профилем безопасности и переносимости. Первичная структура альбумина хорошо охарактеризована, и высокое содержание заряженных аминокислот позволяет связываться лекарственным веществам с положительным или отрицательным зарядом без вспомогательного участия других соединений [60]. Из альбумина можно синтезировать наночастицы относительно небольших размеров (50–300 нм). Поскольку альбумин имеет в своем составе широкий спектр функциональных групп, это позволяет проводить разные поверхностные модификации альбуминовых наночастиц, например, путем, ковалентного связывания с поверхностно-активными веществами, полилизином, полиэтиленгликолем (ПЭГ), трансферрином, моноклональными антителами и др. За последние годы опубликованы лишь работы, где с помощью альбуминовых наночастиц в сетчатку доставляют белки и лекарственные препараты [61, 62]. Первая и к настоящему времени единственная опубликованная попытка доставить генетический материал в ткани глаза при помощи таких частиц была совершена в 2007 г. [63], и в данной работе было показано, что наночастицы из сывороточного альбумина человека размером 120 нм успешно доставляют плазмиды с геном Cu, Zn-супероксиддисмутазы в клетки сетчатки мышей после интравитреальной инъекции, что подтверждает вестерн-блоттинг.
Среди пептидных полимеров, используемых для доставки различных веществ в ткани глаза выделяется CK30-ПЭГ. Он представляет собой 30 аминокислотных остатков лизина, дающих положительный заряд для связывания ДНК, к которым через остаток цистеина пришит ПЭГ, обеспечивающий стабильность структуры и улучшающий захват частицы клетками [64]. Поскольку у такой наночастицы оказывается большое количество катионных групп, она способна почти полностью (более чем на 90%) компенсировать отрицательный заряд крупной молекулы плазмидной ДНК, в результате чего та самопроизвольно конденсируется в компактную наноструктуру, устойчивую к ДНКазам. Показано, что частицы на основе CK30-ПЭГ при захвате клеткой немедленно транспортируются в ядро, избегая захвата в эндосому [65]. Это происходит за счет образования комплексов с ядерным белком нуклеолином, который в некотором количестве присутствует и на плазматической мембране. Впоследствии комплекс нуклеолина с наночастицей перемещается по микротрубочкам непосредственно в ядрышко, и плазмидная ДНК начинает экспрессию входящих в ее состав генов. Показано, что в сетчатке мышей нуклеолин экспрессируется во всех клеточных слоях, это позволяет предположить, что с помощью частиц на основе CK30-ПЭГ можно эффективно трансфицировать как ганглиозные, так и биполярные клетки [64]. Эксперимент по интравитреальному введению наночастиц, несущих плазмиду, кодирующую флуоресцентный маркер под неспецифичным промотором, подтвердил это предположение, поскольку экспрессия зеленого флуоресцентного белка (GFP) наблюдалась прежде всего в ганглиозных клетках [66]. Частицы на основе CK30-ПЭГ многократно использовались для проведения генной терапии у мышей с нарушениями экспрессии таких генов, как Rds, Rpr65 и Abca4 и приводили к значительному улучшению состояния сетчатки по сравнению с контролем [67–69]. Количественная оценка эффективности таких частиц также показала, что они способны приводить к сопоставимому с вирусными векторами уровню экспрессии целевого белка [70].
Полисахариды
Полисахариды являются биоразлагаемыми, биосовместимыми и неиммуногенными полимерами, их мономеры связаны друг с другом посредством гликозидных связей. Наиболее часто для создания носителей применяются декстран, хитозан и гиалуроновая кислота [71], однако последняя, ввиду отрицательного заряда при физиологических значениях pH, плохо связывает нуклеиновые кислоты и используется для их транспортировки только в комбинации с другими полимерами [72]. Декстран представляет собой полимер, состоящий из остатков глюкозы, и в нормальных условиях не имеет заряда. В результате эффективность связывания ДНК существенно снижается, и для переноса плазмид в декстрановые частицы необходимо включать дополнительные катионные компоненты. Так, способность успешно проникать в клетки и доставлять генетический материал была продемонстрирована для декстрановых частиц, модифицированных диэтиламиноэтилом, спермином и полиэтиленимином [73–75]. Несмотря на широкую распространенность как инструмента для трансфекции, декстрановые частицы до сих пор не применялись для тканей глаза. Родственная группа полимеров на основе остатков глюкозы – циклодекстрины – обладают рядом преимуществ по сравнению с декстраном: они легко приобретают положительный заряд за счет химических модификаций, ускоряют прохождение частиц через клеточную мембрану и способны образовывать комплексы включения, инкапсулируя переносимую молекулу в собственной полости [76]. Циклодекстрины обычно применяются в качестве носителей для доставки лекарственных препаратов в различные ткани глаза в составе капель, наносимых на роговицу [77, 78]. Однако недавние исследования показывают, что некоторые из модифицированных форм этих полимеров оказывают токсический эффект на клетки сетчатки [79], что ограничивает возможность их применения для доставки генетического материала.
Хитозан состоит из мономеров N-ацетил-D-глюкозамина и содержит большое количество аминогрупп, что обуславливает его положительный заряд при физиологических значениях pH. Это свойство делает наночастицы из хитозана крайне привлекательными для переноса плазмидной ДНК, однако их применение ограничивает низкая буферная емкость, не позволяющая частице покидать эндосому по механизму “протонной губки” [80]. Отчасти данная проблема решается введением в полимер дополнительных аминогрупп – в результате в эксперименте усиливается экспрессия белка, кодируемого доставляемой ДНК по сравнению с наночастицами из немодифицированного хитозана [81, 82]. Mitra с соавт. [83] выявили другую проблему, снижающую эффективность хитозановых частиц в роли вектора: оказавшись в стекловидном теле, полимеры на основе хитозана образуют вязкий гель, затрудняющий распространение частиц и соответственно ДНК по всему объему глаза. В результате экспрессия белка в сетчатке ограничивается небольшой областью вблизи места инъекции, что не позволит создать достаточно широкое поле зрения при оптогенетическом протезировании. Улучшить ситуацию может добавление в состав наночастиц дополнительных катионных полимеров, которые будут препятствовать образованию геля. Следует отметить, что Mitra с соавт. [83] также показали, что наночастицы на основе хитозана, модифицированого добавлением этиленгликоля, успешно трансфицируют клетки пигментного эпителия после субретинальной инъекции, не нарушая морфологию и функциональность сетчатки. Другие исследования показали возможность интравитреальной доставки генов (плазминогена и GFP) в ганглиозные клетки сетчатки, а также клетки внутреннего ядерного слоя с помощью частиц на основе коротких олигомеров хитозана и гибридных частиц, содержащих дополнительно поли(лактид-гликолид) [84, 85]. Таким образом, модифицированный хитозан является наиболее привлекательным полисахаридом, выступающим в роли основы для генетических векторов. Более подробно о факторах, влияющих на трансфекцию полиплексов на основе хитозана и его производных, можно ознакомиться в обзоре [86].
Другие типы полимеров
Поли(лактид-гликолид) (ПЛГ) – это полимер, состоящий из остатков молочной и гликолевой кислот, обе из которых являются типичными внутриклеточными метаболитами, что обеспечивает частицам на основе ПЛГ высокую биосовместимость и биоразлагаемость. Соотношение лактида и гликолида может варьировать вплоть до использования наночастиц из чистого полимера молочной кислоты, которые будут наиболее устойчивыми к разложению в условиях эндолизосомы [87]. Безопасность применения частиц на основе ПЛГ проверялась в различных экспериментах in vivo и их токсичность оказалась очень низкой [88]. Однако Thackaberry с соавт. [89] показали, что токсичность ПЛГ по отношению к тканям глаза может сильно варьировать в зависимости от формы наночастиц, оказываясь наименьшей для палочкоподобной формы. Одним из недостатков ПЛГ как потенциального средства доставки ДНК является нейтральный заряд при физиологических значениях pH, что ухудшает связывание с ним плазмидной ДНК. Поэтому обычно частицы конструируются с добавлением другого полимера, имеющего положительный заряд, например, хитозана или ПЭГ [90, 91]. С другой стороны, в кислой среде внутри эндолизосомы промежуточные продукты гидролиза ПЛГ приобретают положительный заряд, который возрастает по мере разрушения наночастицы. Эта особенность позволяет частицам эффективно покидать эндосомы, поскольку накапливающийся заряд приводит к их дестабилизации [92]. Несмотря на популярность в роли носителей лекарственных препаратов, частицы на основе ПЛГ применялись для доставки генетического материала в клетки сетчатки лишь в ограниченном числе экспериментальных работ. Помимо упомянутого выше исследования частиц, содержащих хитозан и ПЛГ, также следует отметить работу Zhang с соавт. [93], которые использовали наночастицы из немодифицированного ПЛГ для доставки плазмиды, кодирующей малую шпилечную РНК против регулятора транскрипции HIF-1α (важный участник процесса ангиогенеза при повреждениях сетчатки) и GFP. При интравитрельном введении наночастиц крысам с индуцированной неоваскуляризацией сосудистой оболочки глаза GFP экспрессировался в фоторецепторах, а также в клетках пигментного эпителия. Родственные ПЛГ соединения, полиаминоэфиры также используются в качестве основы для наноносителей и имеют преимущество в связывании ДНК за счет катионных аминогрупп [94].
Дендримеры являются уникальным классом наночастиц, которые представляют собой расходящиеся от центральной молекулы ветвящиеся цепи мономеров [95]. В результате они имеют вид разветвленной сферической структуры с внутренними полостями, которые могут удерживать различные макромолекулы, включая плазмидную ДНК. Наиболее популярными для транспортировки ДНК являются дендримеры полиамидоамина (ПАА), имеющие большое количество положительно заряженных аминогрупп, но также используются полиэтиленимин (ПЭИ) и полилизин [96]. Дендримеры обычно имеют размер от 1 до 100 нм (в зависимости от размера ветвящихся цепей), поглощаются клеткой путем клатрин-опосредованного эндоцитоза, а затем покидают эндосому за счет эффекта “протонной губки” [97]. В исследованиях in vivo дендримеры ПАА и ПЭИ показали высокую эффективность, однако с увеличением размера они становились токсичными для клеток за счет большого положительного заряда [98, 99]. Также дендримеры ПЭИ применялись для интравитреальной доставки в ганглиозные клетки сетчатки плазмиды, кодирующей малую шпилечную РНК [100].
Еще одним перспективным типом полимерного носителя являются многослойные нанокапсулы. Для их синтеза необходимо жесткое ядро – в его роли обычно выступают нанокристаллы ватерита (одна из полиморфных модификаций CaCO3), на которое поочередно слоями наносятся катионный (полиаргинин/полилизин) и анионный (декстран сульфат) полимеры [101]. Транспортируемые нуклеиновые кислоты образуют комплекс с самым первым положительно заряженным слоем и высвобождаются после разрушения полимерной оболочки во внутриклеточном пространстве. Для предотвращения токсического эффекта, связанного с повышением внутриклеточной концентрации ионов Ca2+ после разрушения ватеритового ядра, оно может быть удалено из капсул заранее с помощью хелатирующего агента (этилендиаминтетраацетат натрия). Важными преимуществами таких носителей являются повышенная стабильность и емкость. В ряде работ была показана эффективность нанокапсул для доставки миРНК, мРНК и плазмидной ДНК в клеточные культуры различных типов [102, 103]. Также мы получили предварительные результаты, согласно которым капсулы диаметром 50 нм успешно доставляют мРНК в клетки сетчатки мышей после интравитреальной инъекции [104], локализуясь преимущественно в фоторецепторах. Дополнительные модификации, направленные на повышение селективности таких частиц к биполярным и ганглиозным клеткам, могут сделать этот тип носителя пригодным для использования в оптогенетическом протезировании.
ЛИПИДНЫЕ НАНОЧАСТИЦЫ
Липосомы представляют собой сферические частицы, состоящие по меньшей мере из одного липидного бислоя, внутри которого заключена гидрофильная (водная) фаза. Бислои образованы преимущественно фосфолипидами и стеролами, аналогично клеточным мембранам. Липосомы могут выступать в качестве средства транспортировки для гидрофильных, гидрофобных и амфифильных соединений [105], к их преимуществам можно отнести отсутствие токсичности и слабые антигенные свойства, возможность точно контролировать при синтезе их размер, липидный состав и электрический заряд, а также возможность модифицировать их поверхность полимерами и антителами [106]. Частицы на основе катионных липидов способны не только эффективно захватываться клеткой путем эндоцитоза, но также сливаться с отрицательно заряженной мембраной эндосомы, высвобождая ДНК в цитозоль. Применение липосом для доставки лекарственных препаратов в глаз, в том числе в сетчатку, насчитывает уже несколько десятилетий. Липосомы служили средством доставки путем интравитреальных инъекций для таких соединений, как антибиотики [107], противовирусные препараты [108, 109], препараты, подавляющие ангиогенез [110]. Возможность использования липосом для доставки генов в клетки пигментного эпителия была продемонстрирована in vivo в исследовании Lajunen с соавт. [111], где плазмидная ДНК эффективно доставлялась в клетки пигментного эпителия посредством липосом, меченных трансферрином; такой препарат применялся на крысах в форме глазных капель. Кроме того, было показано, что при внутриглазных инъекциях липосом с плазмидной ДНК, кодирующей ген галактозидазы, происходила ее успешная доставка в ганглиозные клетки сетчатки и пигментный эпителий [112].
Наномицеллы представляют собой самособирающиеся липидные частицы, в отличие от липосом они образованы липидным монослоем, и в них выделяют гидрофобное ядро и гидрофильную оболочку. Наномицеллы обладают низкой токсичностью для тканей глаза что, например, было показано для носителей, состоящих из полиоксиэтилен-гидрогенизированного касторового масла 40 и октосинола 40 [113], и для комплексных носителей из октосинола 40 и токоферола-ПЭГ-сукцината, применяемых для доставки к тканям глаза рапамицина [114]. И хотя данные факты говорят о привлекательности липидных наномицелл как средства доставки генов в клетки сетчатки, однако к настоящему времени не опубликованы исследования, где изучалась бы их способность к транспортировке ДНК в ткани глаза.
Еще одной перспективной разновидностью транспортных наночастиц на основе липидов являются липоплексы. Под этим термином понимают компактные структуры, которые образуются при взаимодействии положительно заряженных за счет наличия дополнительных химических групп “головок” фосфолипидов с отрицательно заряженными молекулами нуклеиновых кислот. В таком комплексе нуклеиновые кислоты получают защиту от деградации [115]. В литературе описаны попытки использовать липоплексы для доставки малых интерферирующих РНК (миРНК) в ткани глаза. В одном из таких исследований оценивалось влияние поверхностного заряда ПЭГилированных липоплексов с миРНК на их проникновение и распределение в сетчатке при интравитреальных инъекциях мышам, и было показано, что оптимальными для данной цели являются положительно заряженные липоплексы [116]. В работе Amadio с соавт. [117] миРНК против антигена R человека (белка из семейства ELAV – embryonic lethal, abnormal vision) доставлялась при помощи липоплексов, вводимых интравитреально крысам с модельной диабетической ретинопатией. Липоплексы с указанной миРНК продемонстрировали успешную трансфекцию, и их введение привело к снижению уровня антигена R человека. В другом исследовании [118] на модели ex vivo (изолированные глаза быка, культура клеток пигментного эпителия человека) было показано, что покрытие липоплексов с плазмидной ДНК гиалуроновой кислотой приводит к заметному повышению эффективности интернализации и трансфекции, а также повышается подвижность таких липоплексов в матриксе стекловидного тела. Весьма многообещающие результаты также были получены в одной из недавних работ [119], где покрытые гиалуроновой кислотой липоплексы после интравитреальной инъекции крысам доставляли миРНК против каспазы-3 (активирующейся при дегенерации сетчатки) в различные клетки сетчатки, оказывая тем самым нейропротекторное действие. Кроме того, в данной работе отдельно ретинографически оценивалась потенциальная ретинотоксичность таких частиц и было показано, что они не демонстрируют никаких токсических эффектов.
В наночастицах на основе твердых липидов выделяют ядро из таких липидов, как октадециламин, диолеолил-3-триметиламмония пропан, диолеолил-фосфатидилэтаноламин, которое стабилизируется поверхностно-активными веществами в водной суспензии. В таких частицах существенно снижена подвижность доставляемого лекарственного вещества, и его высвобождение может быть более контролируемым [120]. Наночастицы из твердых липидов разделяют с жидколипидными частицами их низкую токсичность, но при этом имеют и ряд преимуществ, в частности, они представляются перспективным средством доставки для макромолекул. К настоящему времени уже опубликовано несколько работ, которые посвящены применению наночастиц на основе твердых липидов для доставки генетического материала в ткани глаза. Так, Torrecilla с соавт. [121] оценивали способность наночастиц на основе твердых липидов к доставке в культуры клеток эпителия роговицы человека малых шпилечных РНК, предназначенных для борьбы с неоваскуляризацией, и результаты были положительными. В другом исследовании [122] наночастицы на основе твердых липидов, покрытых гиалуроновой кислотой, были применены для доставки гена ретиношизина модельным мышам с ювенильным ретиношизисом. Уровень трансфекции в результате введения таких частиц путем интравитреальной инъекции был наиболее высоким в фоторецепторных клетках, но трансфекция также была отмечена и в ганглиозных клетках.
Обобщая описанные в данном разделе результаты, следует отметить, что особо перспективным средством доставки нуклеиновых кислот в клетки сетчатки видится сочетание липидной основы с покрытием полимерами. Опубликованные к настоящему времени данные по таким формам частиц кажутся весьма многообещающими, и было бы целесообразно применять их для доставки конструктов для оптогенетического протезирования сетчатки.
НАНОЧАСТИЦЫ ИЗ ИНЕРТНЫХ МЕТАЛЛОВ
Еще одним из направлений разработки наночастиц для доставки лекарственных препаратов и генетического материала является создание наночастиц из инертных металлов. Такие частицы являются потенциально нетоксичными, биосовместимыми, и существуют широкие возможности по их модификации с применением других материалов (полимеров, антител и др.). Еще одним преимуществом является относительная простота синтеза таких частиц. Среди инертных металлов наиболее широкое применение при изготовлении наночастиц для биомедицинских целей получило золото. Механизм интернализации золотых наночастиц зависит от характеристик поверхности, таких как заряд и размер, и чаще всего это эндоцитоз. В том случае, если наночастицы золота покрывают антителами, они входят в клетку по механизму рецептор-опосредованного эндоцитоза [123]. Наночастицы золота успешно справляются с задачей доставки крупных пептидов и нуклеиновых кислот, и каких-либо серьезных ограничений на размер переносимых молекул не накладывается [124]. Разработаны рецептуры, в которых частицы золота связываются с плазмидной ДНК посредством нековалентных электростатических взаимодействий, при этом происходит защита ДНК от расщепления ферментами [125, 126]. Необходимо отметить, что это подразумевает дополнительную функционализацию поверхности частиц золота лигандами, содержащими кватернизованные аминогруппы, ПЭИ и др. Альтернативный путь – модификация нитей нуклеиновых кислот таким образом, чтобы они ковалентно соединялись с поверхностью наночастиц. Для этой цели нуклеиновые кислоты модифицируются тиольными группами и в таком виде присоединяются к наночастицам золота, покрытым катионным полимером, и, например, в случае миРНК это приводило к эффективной трансфекции клеток в культуре [127]. Кроме того, наночастицы золота можно конъюгировать с разными лигандами, включая трансферрин и антитела, обеспечивающими адресную доставку [128, 129].
Исследований по доставке генетического материала наночастицами золота в ткани глаза, к настоящему времени опубликовано немного. В одном из них Sharma с соавт. [130] показали, что наночастицы золота, покрытые ПЭИ, способны переносить плазмидную ДНК в клетки роговицы в модели in vitro (роговица человека), а также не проявляют токсичность в отношении роговицы кролика в экспериментах in vivo. Недавно был предложен способ доставки золотыми наночастицами плазмидной ДНК с целью оптогенетического протезирования сетчатки [131]. В качестве носителя выступали нанопалочки (nanorods) из золота, конъюгированные с антителом, либо к PKCα (протеинкиназа С-альфа, белок, специфично экспрессируемый биполярными клетками сетчатки), либо к Thy1 (белок, специфично экспрессируемый ганглиозными клетками), что позволило добиться адресной доставки. Кроме того, наночастицы различались максимумом поверхностного плазмонного резонанса – 780 нм для наночастиц, предназначенных для доставки гена в ганглиозные клетки, и 850 нм – для частиц, направляемых в биполярные клетки. Далее интернализация наночастиц после интравиреальной инъекции мышам инициировалась путем воздействия лазера с одной или другой длиной волны, чтобы инициировать вход частиц в нужные клетки. В данной работе золотые наночастицы продемонстрировали селективную трансфекцию и, что не менее важно, превосходный профиль безопасности (потенциальные токсические эффекты оценивались ретинографически, методом оптической когерентной томографии на предмет целостности структур глаза после воздействия и иммуногистохимически). На данный момент работа Batabyal с соавт. [131] – единственный опубликованный эксперимент по оптогенетическому протезированию сетчатки с применением синтетических векторов.
ЗАКЛЮЧЕНИЕ
Исходя из свойств барьеров внутри глаза, которые должен преодолеть синтетический вектор, прежде чем достигнет сетчатки, и механизмов его взаимодействия с клетками-мишенями, можно сделать вывод о его оптимальных параметрах. Успешнее всего преодолевают стекловидное тело и захватываются клетками сетчатки сравнительно небольшие наночастицы диаметром не более 100–150 нм. Наиболее благоприятный заряд этих частиц сложно определить ввиду следующей противоречивой ситуации: при отрицательном заряде частица хуже захватывается клетками и связывается с ДНК, при положительном заряде – сильнее задерживается стекловидным телом и имеет потенциально большую токсичность. Таким образом, для эффективной частицы допустим лишь небольшой положительный или отрицательный заряд, либо она должна быть вообще не заряженной. При этом в каждом случае возможны различные модификации, позволяющие нивелировать недостатки заряда того или иного знака. Например, скомпенсировать низкую эффективность эндоцитоза анионных частиц можно за счет добавления поверхностных лигандов и увеличения шансов на захват по пути рецептор-опосредованного эндоцитоза.
Анализ опубликованных за последние годы исследований наночастиц для доставки генов в клетки сетчатки показал, что в настоящее время большинство таких носителей ориентированы на нужды генной терапии. Они преимущественно трансфицируют фоторецепторы и клетки пигментного эпителия, то есть типы клеток, в которых чаще всего происходят мутации, приводящие к гибели светочувстительного звена и, как следствие, потере зрения [132]. В то же время оптогенетическое протезирование применяется при клинической картине, соответствующей поздней стадии дегенерации сетчатки, когда фоторецепторы уже полностью погибли, и генная терапия по устранению пагубного действия той или иной мутации уже не даст никакого положительного эффекта. Для такой терапии необходима разработка носителей, способных доставлять гены светочувствительных белков во внутренние слои сетчатки, к биполярным и ганглиозным клеткам.
Из рассмотренных в рамках данного обзора наночастиц в качестве наиболее перспективных можно выделить полимерные частицы CK30-ПЭГ и на основе ПЛГ-хитозана, липоплексы, покрытые гиалуроновой кислотой и частицы золота, поверхностно модифицированные антителами. Для них всех показана способность успешно доставлять нуклеиновые кислоты (ДНК или РНК) как минимум в ганглиозные клетки после интравитреального введения. Несмотря на это, они, как и прочие рассмотренные типы наночастиц, требуют дополнительных исследований и проведения модификаций, прежде чем их можно будет считать специализированными векторами для оптогенетического протезирования сетчатки.
Список литературы
Kirpichnikov MP, Ostrovsky MA (2019) Optogenetics and Vision. Her Russ Acad Sci 89: 34–38. https://doi.org/10.1134/S1019331619010039
Duncan JL, Pierce EA, Laster AM, Daiger SP, Birch DG, Ash JD, Iannaccone A, Flannery JG, Sahel JA, Zack DJ, Zarbin MA (2018) Inherited retinal degenerations: current landscape and knowledge gaps. Transl Vis Sci Technol 7(4): 6–16. https://doi.org/10.1167/tvst.7.4.6
Фирсов МЛ (2017) Перспективы оптогенетического протезирования сетчатки. Журн высш нерв деят им ИП Павлова 67(5): 53–62. [Firsov ML (2017) Prospects of optogenetic prosthetics of a retina. Zh Vyssh Nerv Deiat Im I P Pavlova 67(5): 53–62. (In Russ)]. https://doi.org/10.7868/S0044467717050069
Planul A, Dalkara D (2017) Vectors and Gene Delivery to the Retina. Annu Rev Vis Sci 1(3): 121–140. https://doi.org/10.1146/annurev-vision-102016-061413
Tornabene P, Trapani I, Minopoli R, Centrulo M, Lupo M, de Simone S, Tiberi P, Dell’Aquila F, Marrocco E, Iodice C, Iuliano A, Gesualdo C, Rossi S, Giaquinto L, Albert S, Hoyng CB, Polishchuk E, Cremers FPM, Surace EM, Simonelli F, De Matteis MA, Polishchuk R, Auricchio A (2019) Intein-mediated protein trans-splicing expands adeno-associated virus transfer capacity in the retina. Sci Transl Med 11(492): eaav4523. https://doi.org/10.1126/scitranslmed.aav4523
Li Q, Miller R, Han PY, Pang J, Dinculescu A, Chiodo V, Hauswirth WW (2008) Intraocular route of AAV2 vector administration defines humoral immune response and therapeutic potential. Mol Vis 14: 1760–1769.
Adijanto J, Naash MI (2015) Nanoparticle-based technologies for retinal gene therapy. Eur J Pharm Biopharm 95: 353–367. https://doi.org/10.1016/j.ejpb.2014.12.028
Scheive M, Yazdani S, Hajrasouliha AR (2021) The utility and risks of therapeutic nanotechnology in the retina. Ther Adv Ophthalmol 13: 25158414211003381. https://doi.org/10.1177/25158414211003381
Streilein JW (2003) Ocular immune privilege: therapeutic opportunities from an experiment of nature. Nat Rev Immunol 3: 879–889. https://doi.org/10.1038/nri1224
Fischer MD, Hickey DG, Singh MS, MacLaren RE (2016) Evaluation of an optimized injection system for retinal gene therapy in human patients. Hum Gene Ther Methods 27: 150–158. https://doi.org/10.1089/hgtb.2016.086
Ochakovski GA, Bartz-Schmidt KU, Fischer MD (2017) Retinal gene therapy: surgical vector delivery in the translation to clinical trials. Front Neurosci 11:174. https://doi.org/10.3389/fnins.2017.00174
Du L, Peng H, Wu Q, Zhu M, Luo D, Ke X, Yang P, Lei B (2015) Observation of total VEGF level in hyperglycemic mouse eyes after intravitreal injection of the novel anti-VEGF drug conbercept. Mol Vis 21: 185–193.
Dalkara D, Byrne LC, Klimczak RR, Visel M, Yin L, Merigan WH. Schaffer DV (2013) In vivo-directed evolution of a new adeno-associated virus for therapeutic outer retinal gene delivery from the vitreous. Sci Transl Med 5: 189 https://doi.org/10.1126/scitranslmed.3005708
Xu Q, Boylan NJ, Suk JS, Wang YY, Nance EA, Yang JC, Hanes J (2013) Nanoparticle diffusion in, and microrheology of, the bovine vitreous ex vivo. J Control Release 167(1): 76–84. https://doi.org/10.1016/j.jconrel.2013.01.018
Candiello J, Balasubramani M, Schreiber EM, Cole GJ, Mayer U, Halfter W, Lin H (2007) Biomechanical properties of native basement membranes. FEBS J 274(11): 2897–2908. https://doi.org/10.1111/j.1742-4658.2007.05823.x
Halfter W, Sebag J, Cunningham ET (2014) II. E. Vitreoretinal interface and inner limiting membrane. In: Vitreous: in Health and Disease 165–191. Springer Science NY & Business Media New York. https://doi.org/10.1007/978-1-4939-1086-1_11
Halfter W, Winzen U, Bishop PN, Eller A (2006) Regulation of eye size by retinal basement membrane and vitreous body. Invest Ophthalmol Vis Sci 47(8): 3586–3594.
Dalkara D, Byrne LC, Klimczak RR, Visel M, Yin L, Merigan WH, Flannery JG, Schaffer DV (2013) In vivo-directed evolution of a new adeno-associated virus for therapeutic outer retinal gene delivery from the vitreous. Sci Transl Med 5: 189ra76. https://doi.org/10.1126/scitranslmed.3005708
Boye SL, Bennett A, Scalabrino ML, McCullough KT, Van Vliet K, Choudhury S, Boye SE (2016) Impact of heparan sulfate binding on transduction of retina by recombinant adeno-associated virus vectors. J Virol 90(8): 4215-4231. https://doi.org/10.1128/JVI.00200-16
Doherty GJ, McMahon HT (2009) Mechanisms of endocytosis. Annu Rev Biochem 78: 857–902. https://doi.org/10.1146/annurev.biochem.78.081307.110540
Verma A, Stellacci F (2010) Effect of surface properties on nanoparticle-cell interactions. Small 6: 12–21. https://doi.org/10.1002/smll.200901158
Hillaireau H, Couvreur P (2009) Nanocarriers’ entry into the cell: relevance to drug delivery. Cell mol life Sci 66: 2873–2896. https://doi.org/10.1007/s00018-009-0053-z
Bejarano-Escobar R, Sánchez-Calderón H, Otero-Arenas J, Martín-Partido G, Francisco-Morcillo J (2017) Müller glia and phagocytosis of cell debris in retinal tissue. J Anat 231(4): 471–483. https://doi.org/10.1111/joa.12653
Finnemann SC, Bonilha VL, Marmorstein AD, Rodriguez-Boulan E (1997) Phagocytosis of rod outer segments by retinal pigment epithelial cells requires alpha(v)beta5 integrin for binding but not for internalization. Proc Natl Acad Sci USA 94: 12932–12937. https://doi.org/10.1073/pnas.94.24.12932
Mayerson PL, Hall MO (1986) Rat retinal pigment epithelial cells show specificity of phagocytosis in vitro. J Cell Biol 103: 299–308. https://doi.org/10.1083/jcb.103.1.299
Hollyfield JG, Rayborn ME (1987) Endocytosis in the inner segment of rod photoreceptors: analysis of Xenopus laevis retinas using horseradish peroxidase. Exp Eye Res 45: 703–719. https://doi.org/10.1007/978-1-4757-9441-0_7
Jockusch WJ, Praefcke GJ, McMahon HT, Lagnado L (2005) Clathrin-dependent and clathrin-independent retrieval of synaptic vesicles in retinal bipolar cells. Neuron 46(6): 869–878. https://doi.org/10.1016/j.neuron.2005.05.004
Butowt R, von Bartheld CS (2001) Sorting of internalized neurotrophins into an endocytic transcytosis pathway via the Golgi system: ultrastructural analysis in retinal ganglion cells. J Neurosci 21(22): 8915–8930. https://doi.org/10.1523/JNEUROSCI.21-22-08915.2001
Chithrani BD, Chan WC (2007) Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes. Nano Lett 7(6): 1542–1550. https://doi.org/10.1021/nl070363y
Jin H, Heller DA, Sharma R, Strano MS (2009) Size-dependent cellular uptake and expulsion of single-walled carbon nanotubes: single particle tracking and a generic uptake model for nanoparticles. ACS Nano 3(1): 149–158. https://doi.org/10.1021/nn800532m
Wang S-H, Lee C-W, Chiou A, Wei P-K (2010) Size-dependent endocytosis of gold nanoparticles studied by three-dimensional mapping of plasmonic scattering images. J Nanobiotechnol 8(1):33. https://doi.org/10.1186/1477-3155-8-33
Li X, McClellan ME, Tanito M, Garteiser P, Towner R, Bissig D, Berkowitz BA, Fliesler SJ, Woodruff ML, Fain GL, Birch DG, Khan MS, Ash JD, Elliott MH (2012) Loss of caveolin-1 impairs retinal function due to disturbance of subretinal microenvironment. J Biol Chem 287: 16424–16434. https://doi.org/10.1016/j.ajpath.2013.10.022
McMahon HT, Boucrot E (2011) Molecular mechanism and physiological functions of clathrin-mediated endocytosis. Nat Rev Mol Cell Biol 12: 517–533. https://doi.org/10.1038/nrm3151
Xu S, Olenyuk BZ, Okamoto CT, Hamm-Alvarez SF (2013) Targeting receptor-mediated endocytotic pathways with nanoparticles: rationale and advances. Adv Drug Deliv Rev 65: 121–138. https://doi.org/10.1016/j.addr.2012.09.041
Moradi E, Vllasaliu D, Garnett M, Falcone F, Stolnik S (2012) Ligand density and clustering effects on endocytosis of folate modified nanoparticles. R Soc Chem Adv 2(7): 3025–3033. https://doi.org/10.1039/c2ra01168a
Cardoso MM, Peca IN, Roque AC (2012) Antibody-conjugated nanoparticles for therapeutic applications. Curr Med Chem 19: 3103–3127. https://doi.org/10.2174/092986712800784667
Cho EC, Xie J, Wurm PA, Xia Y (2009) Understanding the role of surface charges in cellular adsorption versus internalization by selectively removing gold nanoparticles on the cell surface with a I2/KI etchant. Nano letters 9: 1080–1084. https://doi.org/10.1021/nl803487r
Marano F, Hussain S, Rodrigues-Lima F, Baeza-Squiban A, Boland S (2011) Nanoparticles: molecular targets and cell signalling. Arch Toxicol 85(7): 733–741 https://doi.org/10.1007/s00204-010-0546-4
Dawson KA, Salvati A, Lynch I (2009) Nanotoxicology: nanoparticles reconstruct lipids. Nat Nanotechnol 4(2): 84–85 https://doi.org/10.1038/nnano.2008.426
Hoffmann F, Cinatl J, Kabičková H, Kreuter J, Stieneker F (1997) Preparation, characterization and cytotoxicity of methylmethacrylate copolymer nanoparticles with a permanent positive surface charge. Int J Pharm 157(2): 189–198. https://doi.org/10.1016/s0378-5173(97)00242-1
Patil S, Sandberg A, Heckert E, Self W, Seal S (2007) Protein adsorption and cellular uptake of cerium oxide nanoparticles as a function of zeta potential. Biomaterials 28(31): 4600–4607. https://doi.org/10.1016/j.biomaterials.2007.07.029
Smith SA, Selby LI, Johnston AP, Such GK (2018) The endosomal escape of nanoparticles: toward more efficient cellular delivery. Bioconjug Chem 30(2): 263–272. https://doi.org/10.1021/acs.bioconjchem.8b00732
Mout R, Ray M, Tay T, Sasaki K, Yesilbag Tonga G, Rotello VM (2017) General Strategy for Direct Cytosolic Protein Delivery via Protein-Nanoparticle Co-engineering. ACS Nano 11: 6416−6421. https://doi.org/10.1021/acsnano.7b02884
Kono K, Torikoshi Y, Mitsutomi M, Itoh T, Emi N, Yanagie H, Takagishi T (2001) Novel gene delivery systems: complexes of fusigenic polymer-modified liposomes and lipoplexes. Gene Ther 8: 5−12. https://doi.org/10.1038/sj.gt.3301365
Vermeulen LMP, De Smedt SC, Remaut K, Braeckmans K (2018) The proton sponge hypothesis: Fable or fact? Eur J Pharm Biopharm 129: 184−190. https://doi.org/10.1016/j.ejpb.2018.05.034
Funhoff AM, van Nostrum CF, Koning GA, Schuurmans-Nieuwenbroek NM, Crommelin DJ, Hennink WE (2004) Endosomal escape of polymeric gene delivery complexes is not always enhanced by polymers buffering at low pH. Biomacromolecules 5: 32−39. https://doi.org/10.1021/bm034041+
Benjaminsen RV, Mattebjerg MA, Henriksen JR, Moghimi SM, Andresen TL (2013) The Possible “Proton Sponge” Effect of Polyethylenimine (PEI) Does Not Include Change in Lysosomal pH. Mol Ther 21: 149−157. https://doi.org/10.1038/mt.2012.185
Massignani M, Canton I, Sun T, Hearnden V, Macneil S, Blanazs A, Armes SP, Lewis A, Battaglia G (2010) Enhanced fluorescence imaging of live cells by effective cytosolic delivery of probes. PLoS One 5(5): e10459. https://doi.org/10.1371/journal.pone.0010459
You J-O, Auguste DT (2009) Nanocarrier cross-linking density and pH sensitivity regulate intracellular gene transfer. Nano Lett 9: 4467−4473. https://doi.org/10.1021/nl902789s
Tran KK, Zhan X, Shen H (2014) Polymer Blend Particles with Defined Compositions for Targeting Antigen to Both Class I and II Antigen Presentation Pathways. Adv Healthcare Mater 3: 690−702. https://doi.org/10.1002/adhm.201300306
Durymanov M, Reineke J (2018) Non-viral delivery of nucleic acids: insight into mechanisms of overcoming intracellular barriers. Front Pharmacol 9: 971. https://doi.org/10.3389/fphar.2018.00971
Ludtke JJ, Zhang G, Sebestyén MG, Wolff JA (1999) A nuclear localization signal can enhance both the nuclear transport and expression of 1 kb DNA. J Cell Sci 112(12): 2033–2041. https://doi.org/10.1242/jcs.112.12.2033
Dhanoya A, Wang T, Keshavarz-Moore E, Fassati A, Chain BM (2013) Importin-7 mediates nuclear trafficking of DNA in mammalian cells. Traffic 14:165–175. https://doi.org/10.1111/tra.12021
Lachish-Zalait A, Lau CK, Fichtman B, Zimmerman E, Harel A, Gaylord MR, Forbes DJ, Elbaum M (2009) Transportin mediates nuclear entry of DNA in vertebrate systems. Traffic 10: 1414–1428. https://doi.org/10.1111/j.1600-0854.2009.00968.x
Lam AP, Dean DA (2010) Progress and prospects: nuclear import of nonviral vectors. Gene Ther 17: 439–447. https://doi.org/10.1038/gt.2010.31
Dean DA, Dean BS, Muller S, Smith LC (1999) Sequence requirements for plasmid nuclear import. Exp Cell Res 253: 713–722. https://doi.org/10.1006/excr.1999.4716
Elzoghby AO (2013) Gelatin-based nanoparticles as drug and gene delivery systems: reviewing three decades of research. J Control Release 172(3):1075-1091. https://doi.org/10.1016/j.jconrel.2013.09.019
Zorzi GK, Parraga JE, Seijo B, Sanchez A (2011) Hybrid nanoparticle design based on cationized gelatin and the polyanions dextran sulfate and chondroitin sulfate for ocular gene therapy. Macromol Biosci 11: 905–913. https://doi.org/10.1002/mabi.201100005
Contreras-Ruiz L, Zorzi GK, Hileeto D, Lopez-Garcia A, Calonge M, Seijo B, Sanchez A, Diebold Y (2013) A nanomedicine to treat ocular surface inflammation: performance on an experimental dry eye murine model. Gene Ther 20: 467–477. https://doi.org/10.1038/gt.2012.56
Elzoghby AO, Samy WM, Elgindy NA (2012) Albumin-based nanoparticles as potential controlled release drug delivery systems. J Control Release 157(2): 168–182. https://doi.org/10.1016/j.jconrel.2011.07.031
Mo Y, Barnett ME, Takemoto D, Davidson H, Kompella UB (2007) Human serum albumin nanoparticles for efficient delivery of Cu, Zn superoxide dismutase gene. Mol Vis 13: 746–757.
Huang D, Chen YS, Rupenthal ID (2017) Hyaluronic acid coated albumin nanoparticles for targeted peptide delivery to the retina. Mol Pharm 14(2): 533–545. https://doi.org/10.1021/acs.molpharmaceut.6b01029
Tzameret A, Ketter-Katz H, Edelshtain V, Sher I, Corem-Salkmon E, Levy I, Last D, Guez D, Mardor Y, Margel S, Rotenstrich Y (2019) In vivo MRI assessment of bioactive magnetic iron oxide/human serum albumin nanoparticle delivery into the posterior segment of the eye in a rat model of retinal degeneration. J Nanobiotechnology 17(1): 3. https://doi.org/10.1186/s12951-018-0438-y
Conley SM, Naash MI (2010) Nanoparticles for retinal gene therapy. Prog Retin Eye Res 29(5): 376–397. https://doi.org/10.1016/j.preteyeres.2010.04.004
Chen X, Kube DM, Cooper MJ, Davis PB (2008) Cell surface nucleolin serves as receptor for DNA nanoparticles composed of pegylated polylysine and DNA. Mol Ther 16(2): 333–342. https://doi.org/10.1038/sj.mt.6300365
Farjo R, Skaggs J, Quiambao AB, Cooper MJ, Naash MI (2006) Efficient non-viral ocular gene transfer with compacted DNA nanoparticles. PloS One 1(1): e38 https://doi.org/10.1371/journal.pone.0000038
Koirala A, Conley SM, Makkia R, Liu Z, Cooper MJ, Sparrow JR, Naash MI (2013) Persistence of non-viral vector mediated RPE65 expression: case for viability as a gene transfer therapy for RPE-based diseases. J Control Release 172: 745–752. https://doi.org/10.1016/j.jconrel.2013.08.299
Han Z, Conley SM, Makkia RS, Cooper MJ, Naash MI (2012) DNA nanoparticle-mediated ABCA4 delivery rescues Stargardt dystrophy in mice. J Clin Invest 122: 3221–3226. https://doi.org/10.1172/JCI64833
Cai X, Conley SM, Nash Z, Fliesler SJ, Cooper MJ, Naash MI (2010) Gene delivery to mitotic and postmitotic photoreceptors via compacted DNA nanoparticles results in improved phenotype in a mouse model of retinitis pigmentosa. FASEB J 24: 1178–1191. https://doi.org/10.1096/fj.09-139147
Han Z, Conley SM, Makkia R, Guo J, Cooper MJ, Naash MI (2012) Comparative analysis of DNA nanoparticles and AAVs for ocular gene delivery. PLoS One 7(12): e52189 https://doi.org/10.1371/journal.pone.0052189
Dubashynskaya N, Poshina D, Raik S, Urtti A, Skorik YA (2020) Polysaccharides in ocular drug delivery. Pharmaceutics 12(1): 22. https://doi.org/10.3390/pharmaceutics12010022
Oliveira AV, Marcelo A, da Costa AM, Silva GA (2016) Evaluation of cystamine-modified hyaluronic acid/chitosan polyplex as retinal gene vector. Mater Sci Eng C Mater Biol Appl 58: 264–272. https://doi.org/10.1016/j.msec.2015.08.047
Abdullah S, Wendy-Yeo WY, Hosseinkhani H, Hosseinkhani M, Masrawa E, Ramasamy R, Rosli R, Rahman SA, Domb AJ (2010) Gene transfer into the lung by nanoparticle dextran-spermine/plasmid DNA complexes. J Biomed Biotechnol 2010: 284840. https://doi.org/10.1155/2010/284840
Onishi Y, Eshita Y, Murashita A, Mizuno M, Yoshida J (2007) Characteristics of DEAE-dextran-MMA graft copolymer as a nonviral gene carrier. Nanomedicine 3(3): 184–191. https://doi.org/10.1016/j.nano.2007.07.002
Kasper JC, Schaffert D, Ogris M, Wagner E, Friess W (2011) Development of a lyophilized plasmid/LPEI polyplex formulation with long-term stability – A step closer from promising technology to application. J Control Release 151(3): 246–255. https://doi.org/10.1016/j.jconrel.2011.01.003
Raemdonck K, Martens TF, Braeckmans K, Demeester J, De Smedt SC (2013) Polysaccharide-based nucleic acid nanoformulations. Adv Drug Deliv Rev 65(9): 1123–1147. https://doi.org/10.1016/j.addr.2013.05.002
Loftsson T, Stefánsson E (2017) Cyclodextrins and topical drug delivery to the anterior and posterior segments of the eye. Int J Pharm 531(2): 413–423. https://doi.org/10.1016/j.ijpharm.2017.04.010
Tanito M, Hara K, Takai Y, Matsuoka Y, Nishimura N, Jansook P, Loftsson T, Stefánsson E, Ohira A (2011) Topical dexamethasone-cyclodextrin microparticle eye drops for diabetic macular edema. Invest Ophthalmol Vis Sci 52(11): 7944–7948. https://doi.org/10.1167/iovs.11-8178
Prajapati M, Christensen G, Paquet-Durand F, Loftsson T (2021) Cytotoxicity of β-Cyclodextrins in Retinal Explants for Intravitreal Drug Formulations. Molecules 26(5): 1492. https://doi.org/10.3390/molecules26051492
Mao S, Sun W, Kissel T (2010) Chitosan-based formulations for delivery of DNA and siRNA. Adv Drug Deliv Rev 62(1): 12–27. https://doi.org/10.1016/j.addr.2009.08.004
Roy K, Ghosn B, Kasturi SP (2008) Enhancing polysaccharide-mediated delivery of nucleic acids through functionalization with secondary and tertiary amines. Curr Top Med Chem 8(4): 331–340. https://doi.org/10.2174/156802608783790947
Badazhkova VD, Raik SV, Polyakov DS, Poshina DN, Skorik YA (2020) Effect of Double Substitution in Cationic Chitosan Derivatives on DNA Transfection Efficiency. Polymers 12(5): 1057. https://doi.org/10.3390/polym12051057
Mitra RN, Han Z, Merwin M, Al Taai M, Conley SM, Naash MI (2014) Synthesis and characterization of glycol chitosan DNA nanoparticles for retinal gene delivery. ChemMedChem 9(1): 189. https://doi.org/10.1002/cmdc.201300371
Jin J, Zhou KK, Park K, Hu Y, Xu X, Zheng Z, Tyagi P, Kompella UB, Ma JX (2011) Anti-inflammatory and antiangiogenic effects of nanoparticle-mediated delivery of a natural angiogenic inhibitor. Invest Ophthalmol Vis Sci 52(9): 6230–6237. https://doi.org/10.1167/iovs.10-6229
Puras G, Zarate J, Díaz-Tahoces A, Marcelino AT, Fernández E, Pedraz JL (2013) Oligochitosan polyplexes as carriers for retinal gene delivery. Eur J Pharm Sci 48(1–2): 323–331. https://doi.org/10.1016/j.ejps.2012.11.009
Критченков АС, Andranovits S, Скорик ЮА (2017) Хитозан и его производные: векторы в генной терапии. Успехи химии 86(3): 231–239. [Kritchenkov AS, Andranovits S, Skorik YuA (2017) Chitosan and its derivatives: vectors in gene therapy. Russ Chem Rev 86(3): 231–239. (In Russ)]. https://doi.org/10.1070/RCR4636
Makadia HK, Siegel SJ (2011) Poly lactic-co-glycolic acid (PLGA) as biodegradable controlled drug delivery carrier. Polymers 3(3): 1377–1397. https://doi.org/10.3390/polym3031377
Semete B, Booysen L, Lemmer Y, Kalombo L, Katata L, Verschoor J, Swai HS (2010) In vivo evaluation of the biodistribution and safety of PLGA nanoparticles as drug delivery systems. Nanomedicine 6(5): 662-671. https://doi.org/10.1016/j.nano.2010.02.002
Thackaberry EA, Farman C, Zhong F, Lorget F, Staflin K, Cercillieux A, Miller PE, Schuetz C, Chang D, Famili A, Daugherty AL, Rajagopal K, Bantseev V (2017) Evaluation of the toxicity of intravitreally injected PLGA microspheres and rods in monkeys and rabbits: effects of depot size on inflammatory response. Invest Ophthalmol Vis Sci 58(10): 4274–4285. https://doi.org/10.1167/iovs.16-21334
Kim IS, Lee SK, Park YM, Lee YB, Shin SC, Lee KC, Oh IJ (2005) Physicochemical characterization of poly (L-lactic acid) and poly (D, L-lactide-co-glycolide) nanoparticles with polyethylenimine as gene delivery carrier. Int J Pharm 298(1): 255–262. https://doi.org/10.1016/j.ijpharm.2005.04.017
Tahara K, Sakai T, Yamamoto H, Takeuchi H, Kawashima Y (2008) Establishing chitosan coated PLGA nanosphere platform loaded with wide variety of nucleic acid by complexation with cationic compound for gene delivery. Int J Pharm 354(1-2): 210–216. https://doi.org/10.1016/j.ijpharm.2007.11.002
Panyam J, Zhou WZ, Prabha S, Sahoo SK, Labhasetwar V (2002) Rapid endo-lysosomal escape of poly (DL-lactide-coglycolide) nanoparticles: implications for drug and gene delivery. FASEB J 16(10): 1217–1226. https://doi.org/10.1096/fj.02-0088com
Zhang C, Wang Y-S, Wu H, Zhang Z-X, Cai Y, Hou H-Y, Zhao W, Yang X-M, Ma J-X (2010) Inhibitory efficacy of hypoxia-inducible factor 1α short hairpin RNA plasmid DNA-loaded poly (D, L-lactide-co-glycolide) nanoparticles on choroidal neovascularization in a laser-induced rat model. Gene Ther 17(3): 338–351. https://doi.org/10.1038/gt.2009.158
Shen J, Kim J, Tzen SY, Ding K, Hafiz Z, Long D, Wang J, Gree JJ, Campochia PA (2020) Suprachoroidal gene transfer with nonviral nanoparticles. Sci Adv 6(27): eaba1606. https://doi.org/10.1126/sciadv.aba1606
Chaplot SP, Rupenthal ID (2014) Dendrimers for gene delivery–a potential approach for ocular therapy? J Pharm Pharmacol 66(4): 542–556. https://doi.org/10.1111/jphp.12104
Eichman JD, Bielinska AU, Kukowska-Latallo JF, Baker JR Jr (2000) The use of PAMAM dendrimers in the efficient transfer of genetic material into cells. Pharm Sci Technol Today 3: 232–245. https://doi.org/10.1016/s1461-5347(00)00273-x
Boussif O, Lezoualc’h F, Zanta MA, Mergny MD, Scherman D, Demeneix B, Behr JP (1995) A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proc Natl Acad Sci USA 92: 7297–7301. https://doi.org/10.1073/pnas.92.16.7297
Albertazzi L, Gherardini L, Brondi M, Sulis Sato S, Bifone A, Pizzorusso T, Ratto GM, Bardi G (2013) In vivo distribution and toxicity of PAMAM dendrimers in the central nervous system depend on their surface chemistry. Mol Pharm 10: 249–260. https://doi.org/10.1021/mp300391v
Rudolph C, Lausier J, Naundorf S, Muller RH, Rosenecker J (2000) In vivo gene delivery to the lung using polyethylenimine and fractured polyamidoamine dendrimers. J Gene Med 2: 269–278. https://doi.org/10.2147/ijn.s4937
Liao HW, Yau KW (2007) In vivo gene delivery in the retina using polyethylenimine. Biotechniques 42(3): 285–288. https://doi.org/10.2144/000112404
Tarakanchikova Y, Muslimov A, Sergeev I, Lepik K, Yolshin N, Goncharenko A, Vasilyev K, Eliseev I, Bukatin A, Sergeev V, Pavlov S, Popov A, Meglinski I, Afanasiev B, Parakhonskiy B, Sukhorukov G, Gorin D (2020) A highly efficient and safe gene delivery platform based on polyelectrolyte core–shell nanoparticles for hard-to-transfect clinically relevant cell types. J Mater Chem B 8(41): 9576–9588. https://doi.org/10.1039/d0tb01359e
Tarakanchikova Y, Alzubi J, Pennucci V, Follo M, Kochergin B, Muslimov A, Skovorodkin I, Vainio S, Antipina MN, Atkin V, Popov A, Meglinski I, Cathomen T, Cornu TI, Gorin DA, Sukhorukov GB, Nazarenko I (2020) Biodegradable nanocarriers resembling extracellular vesicles deliver genetic material with the highest efficiency to various cell types. Small 16(3): 1904880. https://doi.org/10.1002/smll.201904880
Brodskaia AV, Timin AS, Gorshkov AN, Muslimov AR, Bondarenko AB, Tarakanchikova YV, Zabrodskaya YA, Baranovskaya IL, Il’inskaja EV, Sakhenberg EI, Sukhorukov GB, Vasin AV (2018) Inhibition of influenza A virus by mixed siRNAs, targeting the PA, NP, and NS genes, delivered by hybrid microcarriers. Antiviral Res 158: 147–160. https://doi.org/10.1016/j.antiviral.2018.08.003
Rotov AY, Sitnikova VS, Tarakanchikova YV, Muslimov AR, Firsov ML (2020) Polymer nanocapsules as an instrument for targeted delivery into retinal cells. Int Conference “Optogenetics+ 2020” and the workshop on advanced methods of noninvasive control of neuronal activity: abctracts 49–51.
Allen TM, Cullis PR (2004) Drug delivery systems: entering the mainstream. Science 303(5665): 1818–1822. https://doi.org/10.1126/science.1095833
Honda M, Asai T, Oku N, Araki Y, Tanaka M, Ebihara N (2013) Liposomes and nanotechnology in drug development: focus on ocular targets. Int J Nanomed 8: 495. https://doi.org/10.2147/IJN.S30725
Fishman PH, Peyman GA, Lesar T (1986) Intravitreal liposome-encapsulated gentamicin in a rabbit model. Prolonged therapeutic levels. Invest Ophthalmol Vis Sci 27(7): 1103–1106.
Peyman GA, Khoobehi B, Tawakol M, Schulman JA, Mortada HA, Alkan H, Fiscella R (1987) Intravitreal injection of liposome-encapsulated ganciclovir in a rabbit model. Retina 7(4): 227–229. https://doi.org/10.1097/00006982-198707040-00005
Akula SK, Ma PE, Peyman GA, Rahimy MH, Hyslop NE, Janney A, Ashton P (1994) Treatment of cytomegalovirus retinitis with intravitreal injection of liposome encapsulated ganciclovir in a patient with AIDS. Br J Ophthalmol 78(9): 677–680. https://doi.org/10.1136/bjo.78.9.677
Honda M, Asai T, Umemoto T, Araki Y, Oku N, Tanaka M (2011) Suppression of choroidal neovascularization by intravitreal injection of liposomal SU5416. Arch Ophthalmol 129(3): 317–321. https://doi.org/10.1001/archophthalmol.2011.12
Lajunen T, Hisazumi K, Kanazawa T, Okada H, Seta Y, Yliperttula M, Takashima Y (2014) Topical drug delivery to retinal pigment epithelium with microfluidizer produced small liposomes. Eur J Pharm Sci 62: 23–32. https://doi.org/10.1016/j.ejps.2014.04.018
Masuda I, Matsuo T, Yasuda T, Matsuo N (1996) Gene transfer with liposomes to the intraocular tissues by different routes of administration. Invest Ophthalmol Vis Sci 37(9): 1914–1920.
Mandal A, Cholkar K, Khurana V, Shah A, Agrahari V, Bisht R, Pal D, Mitra AK (2017) Topical formulation of self-assembled antiviral prodrug nanomicelles for targeted retinal delivery. Mol Pharm 14(6): 2056–2069. https://doi.org/10.1021/acs.molpharmaceut.7b00128
Cholkar K, Gunda S, Earla R, Pal D, Mitra AK (2015) Nanomicellar topical aqueous drop formulation of rapamycin for back-of-the-eye delivery. AAPS PharmSciTech 16(3): 610–622. https://doi.org/10.1208/s12249-014-0244-2
Sahu B, Chug I, Khanna H (2021) The Ocular Gene Delivery Landscape. Biomolecules 11(8): 1135. https://doi.org/10.3390/biom11081135
Huang X, Chau Y (2019) Investigating impacts of surface charge on intraocular distribution of intravitreal lipid nanoparticles. Exp Eye Res 186: 107711. https://doi.org/10.1016/j.exer.2019.107711
Amadio M, Pascale A, Cupri S, Pignatello R, Osera C, Leggio GM, Bucolo C (2016) Nanosystems based on siRNA silencing HuR expression counteract diabetic retinopathy in rat. Pharmacol Res 111: 713–720. https://doi.org/10.1016/j.phrs.2016.07.042
Martens TF, Peynshaert K, Nascimento TL, Fattal E, Karlstetter M, Langmann T, Picaud S, Demeester J, De Smedt SC, Remaut K, Braeckmans K (2017) Effect of hyaluronic acid-binding to lipoplexes on intravitreal drug delivery for retinal gene therapy. Eur J Pharm Sci 103: 27–35. https://doi.org/10.1016/j.ejps.2017.02.027
Ribeiro MC, de Miranda MC, Cunha PD, Andrade GF, Fulgêncio GD, Gomes DA, Fialho SL, Pittella F, Charrueau C, Escriou V, Silva-Cunha A (2021) Neuroprotective Effect of siRNA Entrapped in Hyaluronic Acid-Coated Lipoplexes by Intravitreal Administration. Pharmaceutics 13(6): 845. https://doi.org/10.3390/pharmaceutics13060845
Jain AK, Gupta U (2020) Nanomaterials Used for Delivery of Bioactives. In: Nanomaterials and Environmental Biotechnology 381–406. Springer Nature Switzerland AG. https://doi.org/10.1007/978-3-030-34544-0_19
Torrecilla J, Gómez-Aguado I, Vicente-Pascual M, del Pozo-Rodríguez A, Solinís MÁ, Rodríguez-Gascón A (2019) MMP-9 downregulation with lipid nanoparticles for inhibiting corneal neovascularization by gene silencing. Nanomaterials 9(4): 631. https://doi.org/10.3390/nano9040631
Apaolaza PS, del Pozo-Rodríguez A, Solinís MA, Rodríguez JM, Friedrich U, Torrecilla J, Weber BH, Rodríguez-Gascón A (2016) Structural recovery of the retina in a retinoschisin-deficient mouse after gene replacement therapy by solid lipid nanoparticles. Biomaterials 90: 40–49. https://doi.org/10.1016/j.biomaterials.2016.03.004
Tkachenko AG, Xie H, Coleman D, Glomm W, Ryan J, Anderson MF, Feldheim DL (2003) Multifunctional gold nanoparticle-peptide complexes for nuclear targeting. J Am Chem Soc 125(16): 4700–4701. https://doi.org/10.1021/ja0296935
Ghosh P, Han G, De M, Kim CK, Rotello VM (2008) Gold nanoparticles in delivery applications. Adv Drug Deliv Rev 60(11): 1307–1315. https://doi.org/10.1016/j.addr.2008.03.016
McIntosh CM, Esposito EA, Boal AK, Simard JM, Martin T, Rotello VM (2001) Inhibition of DNA transcription using cationic mixed monolayer protected gold clusters. J Am Chem Soc 123(31): 7626–7629. https://doi.org/10.1021/ja015556g
Han G, Martin CT, Rotello VM (2006) Stability of gold nanoparticle bound DNA toward biological, physical, and chemical agents. Chem Biol Drug Des 67(1): 78–82. https://doi.org/10.1021/ja015556g
Oishi M, Nakaogami J, Ishii T, Nagasaki Y (2006) Smart PEGylated gold nanoparticles for the cytoplasmic delivery of siRNA to induce enhanced gene silencing. Chem Lett 35(9): 1046–1047. https://doi.org/10.1246/cl.2006.1046
Yang PH, Sun X, Chiu JF, Sun H, He QY (2005) Transferrin-mediated gold nanoparticle cellular uptake. Bioconjug Chem 16(3): 494–496. https://doi.org/10.1021/bc049775d
Kumar S, Aaron J, Sokolov K (2008) Directional conjugation of antibodies to nanoparticles for synthesis of multiplexed optical contrast agents with both delivery and targeting moieties. Nat Protoc 3(2): 314–320. https://doi.org/10.1038/nprot.2008.1
Sharma A, Tandon A, Tovey JC, Gupta R, Robertson JD, Fortune JA, Klibanov AM, Cowden JW, Rieger FG, Mohan RR (2011) Polyethylenimine-conjugated gold nanoparticles: Gene transfer potential and low toxicity in the cornea. Nanomedicine 7(4): 505–513. https://doi.org/10.1016/j.nano.2011.01.006
Batabyal S, Kim S, Wright W, Mohanty S (2021) Layer-specific nanophotonic delivery of therapeutic opsin-encoding genes into retina. Exp Eye Res 205: 108444. https://doi.org/j.exer.2021.108444
Verbakel SK, van Huet RA, Boon CJ, den Hollander AI, Collin RW, Klaver CC, Hoyng CB, Roepman R, Klevering BJ (2018) Non-syndromic retinitis pigmentosa. Prog Retin Eye Res 66: 157–186. https://doi.org/10.1016/j.preteyeres.2018.03.005
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова