Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1344-1358
Биоэлектрический импеданс миокарда и печени у крыс при хроническом воздействии доксорубицина
Н. Л. Коломеец 1, *, О. В. Суслонова 1, С. Л. Смирнова 1, Е. А. Пешкин 1, И. М. Рощевская 2
1 Коми научный центр Уральского отделения Российской академии наук
Сыктывкар, Россия
2 Научно-исследовательский институт фармакологии им. В.В. Закусова
Москва, Россия
* E-mail: kolomeec@frc.komisc.ru
Поступила в редакцию 29.06.2021
После доработки 26.07.2021
Принята к публикации 26.07.2021
Аннотация
Выявлены изменения биоэлектрического импеданса миокарда и печени у самцов крыс линии Вистар при хроническом воздействии доксорубицина. Многочастотные биоимпедансные и эхокардиографические исследования проведены до и спустя два месяца после первой инъекции доксорубицина (кумулятивная доза 10 мг/кг, разделенная на 4 инъекции в течение 4-ех недель) или физиологического раствора; гистологические исследования миокарда левого желудочка сердца и печени – в конце эксперимента. Спустя два месяца после первой инъекции доксорубицина у 56% животных наблюдали снижение фракции выброса левого желудочка сердца на 13 ± 2%. В миокарде левого желудочка сердца у 33% крыс, получавших доксорубицин, гистологически выявлены кровоизлияние, внутри- и межклеточная вакуолизация. Показаны морфологические изменения печени у всех крыс, подверженных хроническому воздействию доксорубицина. У крыс, получавших доксорубицин, изменение зависимости активного сопротивления биоэлектрического импеданса сердца и печени от частоты тока, статистически значимое уменьшение отношения сопротивлений при низкой и высокой частоте в сравнении с контрольными животными указало на накопление межклеточной жидкости, вызванное нарушением микроциркуляции, повреждениями клеточных мембран сосудов. Морфологические изменения миокарда и печени (гистологически подтвержденные) привели к меньшим абсолютным значениям фазового угла (миокарда и печени) и реактивного сопротивления (печени) биоэлектрического импеданса по сравнению с контрольными животными. Обнаружена статистически значимая зависимость между фазовым углом биоэлектрического импеданса миокарда при высоких частотах тока и толщиной свободной стенки левого желудочка сердца. Меньшее внеклеточное сопротивление биоэлектрического импеданса печени у крыс, получавших доксорубицин, по сравнению с контрольными животными свидетельствует о расширении пространства между гепатоцитами, разрушении клеток.
Антрациклины считаются важным классом лекарств при лечении рака, включая лейкоз, лимфому и рак молочной железы, но также остаются проблемными химиотерапевтическими средствами, учитывая их кардиотоксические эффекты. Одним из факторов, определяющих развитие сердечной недостаточности, является кумулятивная доза лекарства [1]. На результаты лечения пациентов в онкологическом отделении значительное влияние также оказывает дисфункция печени [2]. Для снижения риска кардио- и гепатоксичности, вызванной антрациклинами, необходимо тщательное наблюдение за пациентами. Необходимо изучение механизмов развития дисфункции печени и нарушения деятельности сердца в эксперименте на животных.
Биоимпедансные обследования онкологических пациентов использовали для быстрой оценки изменения параметров состава тела (выраженности отека, количества жировой и мышечной ткани) в динамике химиотерапии [3], прогноза выживаемости [4]. У пациентов на поздней стадии сердечной недостаточности применение биоимпедансного метода не вызвало нарушения ритма сердца во время измерений, что позволило предположить его безопасность [5].
Неинвазивное измерение биоэлектрического импеданса тела человека и животных имеет ограничения в диагнозе патологических изменений. Прямое измерение электрического сопротивления ткани миокарда [6], печени [7] поможет оценить морфофункциональные изменения при развитии патологических процессов.
Поскольку доксорубицин вызывает токсическое повреждение клеток миокарда, сосудов, печени [8–11], можно предполагать изменение компонентов биоэлектрического импеданса живой ткани, характеризующих кровоснабжение ткани и состояние клеточных и внутриклеточных мембран.
Цель работы – исследовать показатели биоэлектpичеcкого импеданса миокарда и печени крыс при хроническом воздействии доксорубицина в эксперименте, выявить зависимость биоэлектрических показателей от морфофункционального состояния органов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на самцах крыс линии Вистар (14 особей) массой тела 335.6 ± 21.6 г, в возрасте 4-ех месяцев, полученных из питомника лабораторных животных (Коми НЦ УрО РАН, г. Сыктывкар, Россия). Животных содержали в условиях свободного доступа к водопроводной питьевой воде и корму в помещении с естественно-искусственным освещением. Крысы находились в вентилируемых клетках группами по 2–3 особи при температуре 20–22°C на подстилке из древесных стружек.
Все процедуры, выполненные в исследовании, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям комиссии по биоэтике Отдела сравнительной кардиологии Федерального исследовательского центра “Коми научный центр Уральского отделения Российской академии наук”.
Первую группу (опытную) составили 9 животных, которым внутрибрюшинно вводили доксорубицинор (Teva, Россия) в кумулятивной дозе 10 мг/кг, растворенной в физиологическом растворе (0.9%-ный раствор NaCl, 5 мл/кг), разделенной на 4 инъекции в течение 4-ех недель. Крысам второй группы (контрольной, n = 5) вводили аналогичную дозу физиологического раствора.
До (исходное состояние) и спустя два месяца после первой инъекции препарата проводили эхокардиографическое исследование (ЭхоКГ), измерения биоэлектрического импеданса тела крыс тетраполярным методом.
Для седации при ЭхоКГ, при исследовании и измерении биоэлектрического импеданса тела использовали золетил (Zoletil, Вирбак, Франция, 3.5 мг/100 г массы тела, внутримышечно). При проведении острого эксперимента со вскрытием грудной клетки животного использовали наркоз с сочетанием золетила (3.5 мг/100 г массы тела, внутримышечно) и уретана (650 мг/кг массы тела, внутрибрюшинно). Крысам перед вскрытием грудной клетки проводили трахеотомию, и переводили животных на искусственное дыхание с использованием аппарата SAR-830/AP (CWE Inc., США). Частота дыхания составляла 60 дыханий в мин, дыхательный объем подбирали индивидуально.
Измеряли длину тела крыс без хвоста (L) в см. Индекс массы тела вычисляли как отношение массы тела (г) к квадрату длины тела L (см2). Массу тела крыс определяли с помощью лабораторных электронных весов EK 2000i (AND, Япония, точность 0.1 г).
ЭхоКГ-исследование проводили с использованием ультразвуковой системы Logiq Pro (General Electric, США) с линейным датчиком 10 МГц в М-режиме. Показатель сократимости левого желудочка сердца – фракцию выброса – высчитывали по формуле Тейхольца [12].
Многочастотный биоэлектрический импеданс органов и тканей тела измеряли при помощи анализатора физических свойств материалов и веществ 126094W (Solartron Analytical, Великобритания). Полученные измерения отражали усредненную во времени (в течение 4-ех с) характеристику электрического сопротивления.
Биоэлектрический импеданс тела измеряли при помощи игольчатых электродов из нержавеющей стали, которые размещали согласно рекомендациям [13], предложенным для оценки состава тела у крысы. Расстояние между измеряющими электродами составило 11 см.
Измерение электрического импеданса тканей и органов проводили на эпикарде в медиальной части вентральной поверхности свободной стенки левого желудочка сердца; на поверхности печени спустя два месяца после первой инъекции препарата. Использовали датчик с медными электродами (диаметр 0.1 мм, длина контакта ~1 мм), расстояние между измеряющими электродами 1.5 мм, токовыми – 4.5 мм.
При значительном расстоянии между электродами в сравнении с толщиной миокарда электрический ток охватывает существенную долю толщины стенки левого желудочка сердца, минимизируется влияние анизотропии ткани (ориентации волокон в слоях миокарда) на измерения сопротивления миокарда [14].
По окончании эксперимента сердце и печень вырезали. Массу органов определяли с помощью лабораторных электронных весов EK 2000i (AND, Япония, точность 0.1 г).
Вычисляли изменение фракции выброса левого желудочка сердца относительно исходного значения по формуле: 100 × (EF1 – EF0)/EF0, где EF0 – исходное значение фракции выброса, EF1 – значение спустя два месяца после первой инъекции доксорубицина.
Сравнивали изменения компонентов биоэлектрического импеданса тела крыс опытной и контрольной групп: активного (R/L) и реактивного сопротивления (Im/L), амплитуды (Z/L), нормированных на длину тела, фазового угла (ϕ) при девяти частотах тока в диапазоне от 10 до 200 кГц относительно исходных значений.
Сравнивали значения компонентов биоэлектрического импеданса миокарда и печени у крыс опытной и контрольной групп при восьми частотах тока в диапазоне от 10 до 150 кГц.
Выбранный частотный диапазон (из диапазона β-дисперсии) характеризуется резким частотным градиентом, свойственным живым тканям [15], используется при измерениях импеданса для оценки гемодинамики, изменения объема внеклеточной жидкости [16]. Нарушение целостности клеток при введении кумулятивной дозы доксорубицина может привести к изменению частотной зависимости биоэлектрического импеданса миокарда и печени.
Вычисляли отношение биоэлектрического импеданса миокарда и печени, измеренных при двух частотах: Z30\Z100, R10\R20 и R10\R100, характеризующего крутизну дисперсии сопротивления (уменьшения сопротивления с увеличением частоты тока) живой ткани.
Используя алгоритм аппроксимации данных (годографа) дугой окружности [17], вычисляли параметры модели Коула: внеклеточное (Re = R0) и внутриклеточное сопротивление (Ri = R0R∞/(R0 – R∞)). Определяли оценки суммарного объема воды и объема внеклеточной жидкости тела крыс согласно рекомендациям [18].
Изготавливали поперечные гистологические срезы миокарда и печени толщиной 7 мкм на санном микротоме МС-2, срезы окрашивали гематоксилином и эозином по стандартной методике и фотографировали цифровой камерой-окуляром (DCM500, Бельгия). По гистологическим срезам оценивали толщину свободной стенки левого желудочка сердца в медиальной ее части.
Статистическая обработка проведена с помощью пакета программ статистического анализа Statistica 10.0. Для проверки нормальности распределения количественных признаков использовали критерий Шапиро–Уилка. Равенство дисперсий распределений признаков в группах проверяли по критерию Левена. Нормально распределенные количественные признаки представлены как среднее арифметическое ± стандартное отклонение. При распределении, не соответствующем нормальному, величины описаны при помощи медианы Ме и межквартильного размаха (Q1–Q3). Уровень значимости различий принимали равным 0.05. Сравнения двух групп из совокупностей с нормальным распределением проводили с помощью t-критерия Стьюдента, отличающихся от нормального распределения – по критерию Манна–Уитни или Вилкоксона. Для выявления различия биоэлектрического импеданса сердца и печени на множестве частот тока использовали однофакторный дисперсионный анализ для повторных измерений или многомерный дисперсионный анализ (критерий Пиллая) с последующей процедурой апостериорного сравнения средних (по критерию Бонферрони или Тьюки в зависимости от числа сравнений) или критерий Манна–Уитни с корректировкой уровня статистической значимости при множественных сравнениях по формуле p = 1 – 0.951/n. Для анализа воздействия доксорубицина на изменение массы тела опытных крыс проводили дисперсионный анализ для повторных измерений. Корреляционный анализ (для всей выборки крыс) проводили по критерию Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изменения функции левого желудочка сердца
У крыс, получавших доксорубицин, наблюдали статистически значимое уменьшение фракции выброса левого желудочка сердца (рис. 1) с 91.5 (91.0, 92.1)% до 82.8 (78.5, 87.0)% (T = 3, Z = 3.0, р = 0.003, критерий Вилкоксона). У крыс контрольной группы фракция выброса левого желудочка сердца практически не изменилась и составила исходно 91.1 (90.3, 94.1)% и в конце эксперимента – 89.5 (89.1, 91.1)%.
Рис. 1.
ЭхоКГ сердца в М-режиме у крысы (№ 9, подгруппа 56%) из опытной группы в начале (a) и в конце (b) эксперимента.
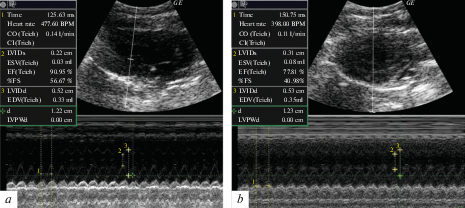
У 44% крыс опытной группы изменение фракции выброса левого желудочка сердца относительно исходного значения статистически значимо не отличалось от такового у крыс контрольной группы (–3 ± 5% и –2 ± 4% соответственно). У 56% крыс опытной группы фракция выброса левого желудочка сердца статистически значимо уменьшилась с 91.7 (91.0, 92.1)% до 78.5 (77.8, 80.5)% (T = 0, Z = 2.0, р = 0.043, критерий Вилкоксона); изменение фракции выброса левого желудочка сердца относительно исходного значения по сравнению с контрольными животными статистически значимо больше (–13 ± 2% и –2 ± 4% соответственно, t = 5.2, сс = 7, р = 0.001).
Масса тела, сердца, печени
На массу тела крыс оказывал влияние временной фактор (F1,11 = 66.5, р < 0.001) и сочетание временного изменения и воздействия доксорубицина (F1,11 = 7.9, р = 0.017). У крыс опытной группы масса тела за период эксперимента статистически значимо увеличилась с 334.7 ± 22.1 до 366.8 ± 18.5 г (р = 0.003, критерий Бонферрони), у контрольных крыс – с 335.8 ± 26.3 до 401.5 ± 22.4 (р < 0.001, критерий Бонферрони). Выявлены значимые межгрупповые различия в изменении массы (U = 4.0, Z = –2.1, р = 0.037) и длины тела (t = –3.1, cc = 11, р = 0.01), обхвата грудной клетки (t = –3.7, cc = 11, р = 0.004) у крыс контрольной (на 20 (18, 22)%, 9 ± 2% и 9 ± 3% соответственно) и опытной (на 9 (5, 14)%, 1 ± 5% и -3 ± 6% соответственно) групп относительно исходного значения.
Масса сердца у контрольных и опытных животных не различалась (1.1 (1.1, 1.2) г). Выявлена большая масса печени у опытных крыс (14.1 ± 1.9 г) по сравнению с контрольными животными (11.0 ± 0.3 г; t = 3.2, cc = 11, р = 0.008). Относительные массы сердца, печени у опытных крыс были статистически значимо больше, чем у контрольных животных (табл. 1).
Таблица 1.
Относительные массы сердца и печени у опытных и контрольных животных
| Наименование показателя | Значение показателя, г/кг | Значение статистического теста и достигнутого уровня статистической значимости | |
|---|---|---|---|
| опытная группа | контрольная группа | ||
| Относительная масса сердца | 3.1 ± 0.1 | 2.9 ± 0.2 | t = 2.3, cc = 11, р = 0.042 |
| Относительная масса печени | 38.6 ± 5.5 | 27.5 ± 1.7 | t = 3.8, cc = 11, р = 0.003 |
Результаты биоимпедансного исследования
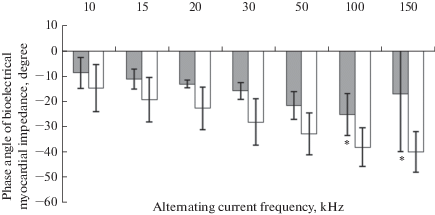
Выявлены статистически значимые различия (F4,7 = 8.5, р = 0.028) фазового угла биоэлектрического импеданса миокарда (при частотах 10, 15, 20, 30, 50, 100 и 150 кГц тока) у крыс опытной и контрольной групп. Абсолютные значения фазового угла биоэлектрического импеданса миокарда у опытных крыс были ниже значений у контрольных крыс при 100 (25.0 ± 8.2° и 38.0 ± 7.6°, р = 0.04, критерий Тьюки) и 150 кГц (17.1 ± 22.7° и 39.8 ± 8.0°, р = 0.047, критерий Тьюки) электрического тока (рис. 2). Существенно меньшие абсолютные значения фазового угла (на 42–59% относительно средних значений, р < 0.003, критерий Стьюдента) биоэлектрического импеданса миокарда наблюдали у 56% крыс опытной группы в сравнении с крысами контрольной группы при частотах 30–100 кГц тока. У остальных 44% крыс опытной группы не выявлено различий фазового угла биоэлектрического импеданса миокарда по сравнению с контрольными крысами. В подгруппах опытных крыс не обнаружено значимых различий в изменении фракции выброса левого желудочка сердца относительно исходного значения.
Рис. 2.
Фазовый угол биоэлектрического импеданса миокарда у крыс опытной (серые столбики) и контрольной (белые столбики) групп. * – р < 0.05.
Обнаружена статистически значимая зависимость между абсолютным значением фазового угла биоэлектрического импеданса миокарда при 100 кГц (rS = 0.6, р = 0.029), 150 кГц (rS = 0.9, р = 0.005) и толщиной свободной стенки левого желудочка сердца.
Активное сопротивление биоэлектрического импеданса миокарда не различалось у крыс опытной и контрольной групп; при низких частотах (10, 15 кГц) среднее значение показателя было ниже, а при высоких (начиная с 20 кГц) – выше у опытных крыс в сравнении с контрольными. Выявлено меньшее отношение значений сопротивления миокарда у опытных крыс в сравнении с контрольными животными при двух частотах тока: Z30\Z100 (1.4 ± 0.2 и 1.7 ± 0.3, t = –2.5, сс = 20, р = 0.021) и R10\R100 (1.9 ± 0.5 и 3.0 ± 1.3, t = –2.3, сс = 14, р = 0.04).
Отмечены межгрупповые различия (F1,10 = 13.1, р = 0.005), влияние фактора частоты тока (F1,10 = 25.4, р < 0.001) и сочетание факторов частота тока\группа (F1,10 = = 10.9, р = 0.008) на величину реактивного сопротивления биоэлектрического импеданса печени (при 50 и 70 кГц тока) у крыс двух групп. Абсолютное значение реактивного сопротивления биоэлектрического импеданса печени было меньше у опытных крыс в сравнении с контрольными крысами при 50 кГц (258.4 ± 79.2 Ом и 527.2±161.0 Ом, р = 0.011, критерий Бонферрони) электрического тока.
Установлена обратная корреляционная связь абсолютного значения реактивного сопротивления биоэлектрического импеданса печени при 50 кГц (rS = –0.6, р = 0.026) и 70 кГц (rS = –0.7, р = 0.013) с массой печени.
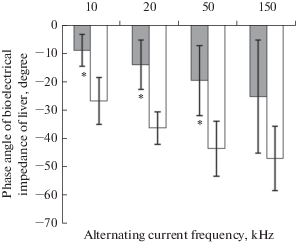
Показаны межгрупповые различия (F4,6 = 9.3, р = 0.01) фазового угла биоэлектрического импеданса печени (при 10, 20, 50 и 150 кГц тока). Выявлено меньшее абсолютное значение фазового угла биоэлектрического импеданса печени у опытных крыс в сравнении с контрольными животными при частоте 10 кГц (9.1 ± 5.6° и 26.9 ± 8.3°, р = 0.003, критерий Тьюки), 20 кГц (14.2 ± 8.7° и 36.5 ± 5.8°, р = 0.001, критерий Тьюки) и 50 кГц (19.8 ± 12.2° и 43.8 ± 9.6°, р = 0.008, критерий Тьюки) электрического тока (рис. 3).
Рис. 3.
Фазовый угол биоэлектрического импеданса печени у крыс опытной (серые столбики) и контрольной (белые столбики) групп. * – р < 0.05.
Между абсолютным значением фазового угла биоэлектрического импеданса печени и массой печени наблюдали статистически значимую взаимосвязь, наиболее сильную при частоте тока 20 кГц (rS = –0.9, р < 0.001).
Активное сопротивление биоэлектрического импеданса печени не различалось у крыс опытной и контрольной групп; при 10 кГц среднее значение сопротивления было ниже, а при остальных частотах было выше у опытных крыс в сравнении с контрольными. Выявлено меньшее отношение значений сопротивления печени у опытных крыс в сравнении с контрольными при двух частотах тока: Z30\Z100 (1.4 ± 0.3 и 1.9 ± 0.3, t = –2.7, сс = 11, р = 0.021) и R10\R20 (1.2 ± 0.1 и 1.5 ± 0.2, t = –4.6, сс = 10, р = 0.001). Обнаружена статистически значимая зависимость между отношением значений сопротивления печени R10\R20 (rS = 0.9, р < 0.001) и массой печени.
Выявлено меньшее внеклеточное сопротивление биоэлектрического импеданса печени у опытных крыс (1280.6 ± 546.5 Ом, t = –2.7, cc = 10, р = 0.024) в сравнении с контрольными (2312.7 ± 802.4 Ом).
Медиана активного сопротивления биоэлектрического импеданса тела крыс обеих групп уменьшилась к концу эксперимента при всех частотах; у крыс опытной группы наблюдали меньшие изменения сопротивления тела (не более 6%) по сравнению с крысами контрольной группы (6–14%). Обнаружена значимая взаимосвязь между изменениями активного сопротивления биоэлектрического импеданса тела крыс и массы тела (наиболее сильная при 10 кГц: rS = –0.6, р = 0.009), обхвата грудной клетки (наиболее сильная при 70 кГц: rS = –0.7, р = 0.003) в период эксперимента.
Выявлено меньшее изменение фазового угла биоэлектрического импеданса тела (t = –2.5, cc = 16, р = 0.022) в период эксперимента у крыс опытной группы (на 10 ± 14%, t = 2.7, р = 0.019) в сравнении с крысами контрольной группы (на 27 ± 9%, t = 6.9, р = 0.002) при 80 кГц тока. Существенно меньшее изменение (на 1 ± 7%, t = –5.7, р < 0.001) абсолютного значения фазового угла биоэлектрического импеданса миокарда при 80 кГц тока наблюдали у 67% крыс опытной группы в сравнении с крысами контрольной группы. Меньшее увеличение абсолютного значения фазового угла биоэлектрического импеданса тела сопутствует большему уменьшению фракции выброса (при 80 кГц: rS = –0.5, р = 0.042; при 30 кГц: rS = –0.5, р = 0.048) к концу эксперимента у крыс опытной группы в сравнении с крысами контрольной группы.
Не было выявлено статистически значимых межгрупповых различий в изменении оцениваемых нами объемов внеклеточной жидкости, суммарного объема воды в теле крыс и их отношения.
Гистологическая картина миокарда
Спустя два месяца после первой инъекции доксорубицина у 33% крыс опытной группы выявлено увеличение полости левого желудочка. В миокарде левого желудочка сердца у 33% крыс опытной группы были обнаружены кровоизлияние, внутри- и межклеточная вакуолизация, очаги мононуклеарной инфильтрации (рис. 4а).
Рис. 4.
Гистологические срезы миокарда свободной стенки левого желудочка сердца (×400) у крыс через два месяца хронического воздействия доксорубицина (а) и контрольной группы (b). На срезе (а) наблюдаются кровоизлияния, внутри- и межклеточная вакуолизация.

У остальных крыс опытной группы не обнаружено явных гистопатологических изменений в миокарде.
Толщины передней части свободной стенки левого желудочка сердца, измеренные по гистологическим срезам, у опытных и контрольных животных не различались (4.8 ± 0.7 и 4.7 ± 0.2 мм соответственно).
Гистологическая картина печени
Спустя два месяца после первой инъекции доксорубицина в печени крыс опытной группы наблюдалась слабая или умеренная лимфоцитарная инфильтрация отдельных портальных трактов с проникновением в печеночные дольки, вакуолизация гепатоцитов, отек пространства Диссе. У 22% крыс отмечена выраженная инфильтрация с проникновением лимфоцитов в межоболочечное пространство, появление 2-ядерных гепатоцитов, субкапсулярный некроз гепатоцитов, зернистая дистрофия печеночных клеток, вакуольная дистрофия эпителия мелких желчных протоков, неравномерное кровенаполнение сосудов (рис. 5).
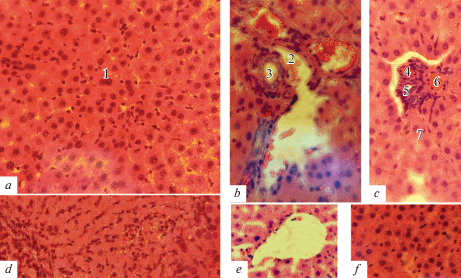
Рис. 5.
Гистологическая картина печени (×400) у крыс опытной (a–e) и контрольной (f) групп.
На фотографиях указано: (a) лимфоцитарная инфильтрация, двуядерные гепатоциты (1);
(b) портальный тракт (2), отек сосудов, слабая лимфоцитарная инфильтрация, строма не склерозирована, эпителий мелких желчных протоков с вакуольной дистрофией (3);
(c) портальная артерия (4), эпителиоциты желчного протока с вакуолизированной цитоплазмой (5), портальная вена (6), неполнокровные синусоиды (7) между гепатоцитами;
(d) субкапсулярный некроз гепатоцитов;
(e) печеночная долька с отеком пространства Диссе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами было отмечено статистически значимое снижение фракции выброса левого желудочка сердца в среднем на 13% у 56% крыс, получавших доксорубицин (у остальных не было функциональных изменений сократительной функции левого желудочка сердца). Гистологически у крыс с хроническим воздействием доксорубицина обнаружены морфологические изменения в миокарде левого желудочка сердца и печени, нарушение кровообращения в микрососудах.
Доксорубицин вызывает структурное повреждение сосудов, нарушение микроциркуляции и снижение перфузии миокарда [19].
Кумулятивная доза доксорубицина 10 мг/кг массы тела животного, выбранная нами, является значимой для развития дилатационной кардиомиопатии [20]. Введение доксорубицина в течение 4-ех недель с интервалом в одну неделю привело к гистологически подтвержденным повреждениям в сердце и печени, вызванным окислительным стрессом [21], снижению фракции выброса левого желудочка сердца [22].
С помощью световой микроскопии были выявлены небольшие (менее 5% повреждения миоцитов) изменения миокарда (вакуолизация цитоплазмы и/или лизис миофибрилл) только у 25% животных, получивших кумулятивную дозу доксорубицина 10 мг/кг, не было статистически значимых изменений фракции выброса левого желудочка сердца [23].
В обзорном исследовании (на основании 72% рассмотренных работ) отмечено, что при токсическом воздействии антрациклинов подавление фракции выброса левого желудочка сердца у крыс относительно исходного значения колеблется в пределах от 10 до 40% [24].
Большая относительная масса сердца и печени у крыс опытной группы в сравнении с крысами контрольной группы, отмеченная нами, может свидетельствовать об отеке [9, 25, 26]. В некоторых работах наблюдали уменьшение массы сердца из-за гибели кардиомиоцитов [8, 27]. Доксорубицин вызывал нарушение кровотока, некроз паренхимы печени, дегенеративные изменения гепатоцитов, воспаление в портальном пространстве [28].
Отмеченное нами уменьшение отношения сопротивлений биоэлектрического импеданса сердца и печени у опытных крыс при двух частотах в сравнении с контрольными животными, снижение активного сопротивления биоэлектрического импеданса органов тела при низкой частоте и повышение при высоких частотах тока указывает на накопление межклеточной жидкости, вызванное нарушением микроциркуляции.
Активное сопротивление биоэлектрического импеданса тканей тела характеризует растворы электролитов в межклеточном (при низких частотах тока), интерстициальном и внутриклеточном (при высоких частотах тока) пространствах [29]. При повреждении клеточных мембран, нарушении структурной организации тканей тела изменяется зависимость сопротивления ткани от частоты тока: значения при низкой и высокой частоте тока приближаются друг к другу [30]. Уменьшение отношения сопротивлений Z9.4\Z110 миокарда человека, отмеченное при наполнении сосудистого русла и интерстициального пространства кардиоплегическим раствором, указывало на нарушение обмена электролитов и формирование клеточного отека [31].
Ранее при воздействии доксорубицина (однократно введенная доза 10 мг/кг за неделю до измерений) было показано увеличение биоимпеданса миокарда (на 33%), измеряемого на глубине 1 мм при частоте тока 10 кГц у крыс при гистологически выявленном выраженном интерстициальном отеке, дилатации миокарда [32].
Окислительный стресс (вызванный токсическим воздействием доксорубицина [26]) приводит к ухудшению емкостных свойств мембраны [15]. При уменьшении клеточной массы, нарушениях нормального функционирования клеток, увеличении объема внеклеточной жидкости снижаются абсолютные значения реактивного сопротивления и фазового угла биоэлектрического импеданса тела [33].
Показанные нами различия фазового угла биоэлектрического импеданса миокарда желудочка сердца у опытных крыс свидетельствуют о структурно-функциональных изменениях миокарда левого желудочка сердца у животных, получивших доксорубицин.
При частотах 100 и 150 кГц нами выявлена зависимость показателя от толщины свободной стенки миокарда. Однако статистически значимые различия в электрическом сопротивлении миокарда и влияющей на сопротивление толщине передней стенки левого желудочка сердца у крыс двух групп нами не выявлены.
Биоимпеданс миокарда, измеряемый с эпикарда желудочка сердца, зависит от толщины стенки [34].
Значимое снижение сопротивления миокарда (измерение на эпикарде при 1 кГц) [35] и отношения сопротивлений миокарда при низкой и высокой частоте [6] отмечено при инфаркте миокарда. Уменьшение биоэлектрического импеданса миокарда при низких частотах может указывать на снижение количества кардиомиоцитов в ткани [35].
Нами выявлены статистически значимые меньшие значения реактивного сопротивления и фазового угла биоэлектрического импеданса, внеклеточного сопротивления печени у крыс опытной группы в сравнении с крысами контрольной группы.
Отмечены низкие значения Re спустя 30 мин после электропорации, вероятно, вызванные расширением пространства между гепатоцитами, разрушением клеток [36]. Уменьшение активного и реактивного сопротивления биоэлектрического импеданса печени отмечено при фиброзе [37]. Уменьшение фазового угла и амплитуды биоэлектрического импеданса печени (в рассматриваемом нами диапазоне частот) выявлено при циррозе [38].
Нами установлена обратная корреляционная связь абсолютного значения реактивного сопротивления и фазового биоэлектрического импеданса печени с массой печени. Реактивное сопротивление и фазовый угол биоэлектрического импеданса печени являются индикатором отека.
Доксорубицин, являясь ингибитором пролиферации клеток [39], способствует уменьшению мышечной массы, атрофии тканей большинства типов клеток в организме [8, 40]. При саркопении, наблюдаемой у пациентов, прошедших химиотерапию, абсолютное значение фазового угла биоэлектрического импеданса тела было ниже [4]. Фазовый угол биоэлектрического импеданса тела, являясь индикатором соотношения внеклеточной и внутриклеточной жидкости в организме, снижается у пациентов при асците [41].
Снижение фракции выброса левого желудочка сердца у пациентов при воздействии доксорубицина выявляется при достижении уровня повреждения миокарда, когда исчерпаны компенсаторные механизмы [42].
Меньшее увеличение абсолютного значения фазового угла биоэлектрического импеданса тела у крыс при токсическом воздействии доксорубицина вызвано ухудшением состояния органов, мышечных тканей при повреждении клеточных мембран, нарушении микроциркуляции, отеках. В сравнении с эхокардиографическим исследованием неинвазивный биоимпедансный показатель выявил токсические изменения в миокарде у большего количества животных (67% против 56%).
Прямое измерение биоимпеданса миокарда используется для диагностики и мониторинга физиологического состояния в имплантируемых медицинских устройствах [43]. В нашем исследовании существенное изменение фазового угла биоэлектрического импеданса миокарда при токсическом воздействии доксорубицина наблюдали в том числе у животных, у которых не было выявлено значимых изменений сократительной функции, то есть показатель отразил морфофункциональные изменения на более раннем этапе развития токсического поражения.
Применение комплекса методов (биоимпедансного, эхокардиографического и гистологического) позволило подтвердить токсическое поражение миокарда и печени кумулятивной дозой доксирубицина и выявить корреляционные связи между показателями биоимпеданса и морфофункциональными изменениями.
ЗАКЛЮЧЕНИЕ
Повреждение тканей сердца и печени, нарушение процессов микроциркуляции органов у крыс, получивших кумулятивную дозу доксорубицина, приводит к уменьшению абсолютного значения фазового угла биоэлектрического импеданса органов, отношения значений сопротивления при низкой и высокой частоте тока в сравнении с крысами контрольной группы. Выявлена связь между изменением фазового угла биоэлектрического импеданса тела и фракции выброса левого желудочка сердца; между фазовым углом биоимпеданса миокарда и толщиной свободной стенки.
Список литературы
Volkova M, Russell R 3rd (2011) Anthracycline cardiotoxicity: prevalence, pathogenesis and treatment. Current Cardiol Rev 7(4): 214–220. https://doi.org/10.2174/157340311799960645
Damodar G, Smitha T, Gopinath S, Vijayakumar S, Rao Y (2014) An evaluation of hepatotoxicity in breast cancer patients receiving injection Doxorubicin. Ann Med Health Sci Res 4(1): 74–79. https://doi.org/10.4103/2141-9248.126619
Muramatsu M, Tsuchiya A, Ohta S, Iijima Y, Maruyama M, Onodera Y, Hagihara M, Nakaya N, Sato I, Omura K, Ueno S, Nakajima H (2015) Measuring body composition using the bioelectrical impedance method can predict the outcomes of gemcitabine-based chemotherapy in patients with pancreatobiliary tract cancer. Oncol Lett 10(6): 3535–3541. https://doi.org/10.3892/ol.2015.3811
Davis MP, Panikkar R (2019) Sarcopenia associated with chemotherapy and targeted agents for cancer therapy. Ann Palliat Med 8(1): 86–101. https://doi.org/10.21037/apm.2018.08.02
Roehrich L, Suendermann S, Just IA, Knierim J, Mulzer J, Mueller M, Eulert-Grehn JJ, Hummel M, Starck C, Potapov E, Knosalla C, Falk V, Schoenrath F (2020) Safety of bioelectrical impedance analysis in advanced heart failure patients. Pacing Clin Electrophysiol 43(10): 1078–1085. https://doi.org/10.1111/pace.14018
Торнуев ЮВ, Балахнин СМ, Преображенская ВК, Манвелидзе РА, Ивлева ЕК (2016) Биоимпедансометрия миокарда при очаговых и диффузных повреждениях различного генеза. Совр пробл науки и образов N 4. [Tornuev YuV, Balakhnin SM, Preobrazhenskaya VK, Manvelidze RA, Ivleva EK Bioimpedance measuring myocardium in focal and diffuse injuries of various genesis. Modern Problems Sci Educat N 4. (In Russ)]. https://doi.org/10.17513/spno.25001
Панченков ДН, Леонов СД, Степанова ЮА, Алиханов РБ, Родин АВ, Баженов СМ (2017) Морфофункциональный анализ паренхимы печени при ее диффузном поражении n-нитрозодиэтиламином в эксперименте. Диагностич и интервенцион радиол 11(2): 61–69. [Panchenkov DN, Leonov SD, Stepanova YuA, Alikhanov RB, Rodin AV, Bazhenov SM (2017) Morpho-functional analysis of the liver parenchyma in case of its defeat by n-nitrosodiethylamine in experiment. Diagn Intervent Radiol 11(2): 61–69. (In Russ)].
Лушникова ЕЛ, Непомнящих ЛМ, Молодых НА, Клинникова МГ, Молодых ОП (2011) Структурная реорганизация миокарда крыс и численность кардиомиоцитов при действии доксорубицина и тритерпеноидов. Фундамент исследов (6): 98–102. [Lushnikova EL, Nepomnyashchikh LM, Molodykh NA, Klinnikova MG, Molodykh OP (2011) Structural reorganization of the rat myocardium and the total number of cardiomyocytes under the action of doxorubicin and triterpenoids. Fundament Res (6): 98–102. (In Russ)].
Putri H, Nagadi S, Larasati YA, Wulandari N, Hermawan A (2013) Cardioprotective and hepatoprotective effects of Citrus hystrixpeels extract on rats model. Asian Pac J Trop Biomed 3(5): 371–375. https://doi.org/10.1016/S2221-1691(13)60079-9
Salouege I, Ali RBen, Saïd DBen, Elkadri N, Kourda N, Lakhal M, Klouz A (2014) Means of evaluation and protection from doxorubicin-induced cardiotoxicity and hepatotoxicity in rats. J Cancer Res Ther 10(2): 274–278. https://doi.org/10.4103/0973-1482.136557
Kalyanaraman B (2020) Teaching the basics of the mechanism of doxorubicin-induced cardiotoxicity: Have we been barking up the wrong tree? Redox Biol 29: 101394. https://doi.org/10.1016/j.redox.2019.101394
Teichholz LE, Kreulen T, Herman MV, Gorlin R (1976) Problems in echocardiographic volume determinations: echocardiographic-angiographic correlations in the presence of absence of asynergy. Am J Cardiol 37(1): 7–11. https://doi.org/10.1016/0002-9149(76)90491-4
Hu L, Maslanik T, Zerebeckyj M, Plato CF (2012) Evaluation of bioimpedance spectroscopy for the measurement of body fluid compartment volumes in rats. J Pharmacol Toxicol Methods 65: 75–82. https://doi.org/10.1016/j.vascn.2012.02.001
Raghavan K, Porterfield JE, Kottam ATG, Feldman MD, Escobedo D, Valvano JW, Pearce JA (2009) Electrical conductivity and permittivity of murine myocardium. IEEE Transaction Biomed Enginer 56(8): 2044–2052. https://doi.org/10.1109/TBME.2009.2012401
Торнуев ЮВ, Хачатрян РГ, Хачатрян АП, Махнев ВП, Осенний АС (1990) Электрический импеданс биологических тканей. М. Изд-во ВЗПИ. [Tornuev YuV, Hachatryan RG, Hachatryan АP, Mahnev VP, Osenniy АS Electricheskiy impedans biologicheskih tkaney [Electrical impedance of biological tissues]. Мoscow. Izd-vо VZPI. 1990. (In Russ)].
Цветков АА (2010) Биоимпедансные методы контроля системной гемодинамики. М. Изд-во Фирма “Слово”. [Tsvetkov AA Bioimpedansnyye metody kontrolya sistemnoy gemodinamiki. Мoscow. Izd-vо Firma “Slovo”. (In Russ)].
Kun S, Ristic B, Peura RA, Dunn RM (1999) Real-time extraction of tissue impedance model parameters for electrical impedance spectrometer. Med Biol Eng Comput 37(4): 428–432. https://doi.org/10.1007/BF02513325
Cornish BH, Thomas BJ, Ward LC (1993) Improved prediction of extracellular and total body water using impedance loci generated by multiple frequency bioelectrical impedance analysis. Phys Med Biol 38 (3): 337–346. https://doi.org/10.1088/0031-9155/38/3/001
Galán-Arriola C, Vílchez-Tschischke JP, Lobo M, López GJ, de Molina-Iracheta A, Pérez-Martínez C, Villena-Gutiérrez R, Macías Á, Díaz-Rengifo IA, Oliver E, Fuster V, Sánchez-González J, Ibanez B (2021) Coronary microcirculation damage in anthracycline cardiotoxicity. Cardiovasc Res:cvab053. https://doi.org/10.1093/cvr/cvab053
Hayward R, Hydock DS (2007) Doxorubicin cardiotoxicity in the rat: an in vivo characterization. J Am Assoc Lab Anim Sci 46(4): 20–32.
Shivakumar P, Rani MU, Reddy AG, Anjaneyulu YA (2012) Study on the Toxic Effects of Doxorubicin on the Histology of Certain Organs. Toxicol Int 19(3): 241–244. https://doi.org/10.4103/0971-6580.103656
Абрамов АА, Лакомкин ВЛ, Просвирнин АВ, Капелько ВИ (2019) Характеристика давления и объема левого желудочка при диастолической и систолической дисфункции. Кардиология 59(4): 45–51. [Abramov AA, Lakomkin VL, Prosvirnin AV, Kapelko VI (2019) Pressure and Volume Characteristics of the Left Ventriclе in Its Diastolic and Systolic Dysfunction. Kardiologiia 59(4): 45–51. (In Russ). https://doi.org/10.18087/cardio.2019.4.2647
Kang Y, Wang W, Zhao H, Qiao Z, Shen X, He B (2017) Assessment of Subclinical Doxorubicin-induced Cardiotoxicity in a Rat Model by Speckle-Tracking Imaging. Arq Bras Cardiol 109(2): 132–139. https://doi.org/10.5935/abc.20170097
Georgiadis N, Tsarouhas K, Rezaee R, Nepka H, Kass GE, Dorne JC, Stagos D, Toutouzas K, Spandidos DA, Kouretas D, Tsitsimpikou C (2020) What is considered cardiotoxicity of anthracyclines in animal studies. Oncol Rep 44(3): 798–818. https://doi.org/10.3892/or.2020.7688
Саликова СП, Бахтияров РЗ (2008) Роль структурных изменений эндотелия и миокарда в развитии экспериментальной сердечной недостаточности. Морфология 134(5): 20–25. [Salikova SP, Bakhtiyarov RZ (2008) The role of structural changes of the endothelium and myocardium in the development of experimental heart failure. Morphology 134(5): 20–25. (In Russ)].
Yu X, Cui L, Zhang Z, Zhao Q, Li S (2013) α-Linolenic acid attenuates doxorubicin-induced cardiotoxicity in rats through suppression of oxidative stress and apoptosis. Acta Biochim Biophys Sinica 45(10): 817–826. https://doi.org/10.1093/abbs/gmt082
Chen PY, Hou CW, Shibu MA, Day CH, Pai P, Liu ZR, Lin TY, Viswanadha VP, Kuo CH, Huang CY (2017) Protective effect of Co-enzyme Q10 on doxorubicin-induced cardiomyopathy of rat hearts. Environ Toxicol 32(2): 679–689. https://doi.org/10.1002/tox.22270
Yagmurca M, Bas O, Mollaoglu H, Sahin O, Nacar A, Karaman O, Songur A (2007) Protective effects of erdosteine on doxorubicin-induced hepatotoxicity in rats. Arch Med Res 38(4): 380–385. https://doi.org/10.1016/j.arcmed.2007.01.007
Kyle UG, Bosaeus I., De Lorenzo AD, Deurenberg P, Elia M, Gómez JM, Heitmann BL, Kent-Smith L, Melchior JC, Pirlich M, Scharfetter H, Schols AM, Pichard C (2004) Composition of the ESPEN Working Group. Bioelectrical impedance analysis–part I: Review of principles and methods. Clin Nutr 23(5): 1226–1243. https://doi.org/10.1016/j.clnu.2004.06.004
Demirci C, Aşcı G, Demirci MS, Özkahya M, Töz H, Duman S, Sipahi S, Erten S, Tanrısev M, Ok E (2016) Impedance ratio: a novel marker and a powerful predictor of mortality in hemodialysis patients. Int Urol Nephrol 48(7): 1155–1162. https://doi.org/10.1007/s11255-016-1292-1
Бубнов ВА, Пузенко ДВ (2012) Биоэлектрическая импедансометрия как метод оценки состояния миокарда во время операции на открытом сердце. Клин практика 3(3): 25–30. [Bubnov VA, Puzenko DV (2012) Bioelectric impedancemetry as a method of assessment of the myocardium during open-heart surgery. J Clin Practice 3(3): 25–30. (In Russ)]. https://doi.org/10.17816/clinpract3325-30
Новиков ВЕ, Крикова АВ, Новиков АС (2011) Биоимпедансометрическая оценка повреждения миокарда различными экзогенными факторами. Курский научно-практ вестн. Человек и его здоровье 1: 16–18. [Novikov VE, Krikova AV, Novikov AS (2011) Bioimpedansometric assessment of myocardial damage by various exogenous factors. Kursk Sci Pract Bull. Man and his Health 1: 16–18. (In Russ)].
Dittmar M (2003) Reliability and variability of bioimpedance measures in normal adults: effects of age, gender, and body mass. Am J Phys Anthropol 122(4): 361–370. https://doi.org/10.1002/ajpa.10301
Tsai J-Z, Cao H, Tungjitkusolmun S, Woo EJ, Vorperian VR, Webster JG (2000) Dependence of apparent resistance of four-electrode probes on insertion depth. IEEE Transact Biomed Engineer 47(1): 41–48. https://doi.org/10.1109/10.817618
Schwartzman D, Chang I, Michele JJ, Mirotznik MS, Foster KR (1999) Electrical Impedance Properties of Normal and Chronically Infarcted Left Ventricular Myocardium. J Intervent Cardiac Electrophysiol 3: 213–224. https://doi.org/10.1023/a:1009887306055
Ivorra A, Rubinsky B (2007) In vivo electrical impedance measurements during and after electroporation of rat liver. Bioelectrochemistry 70(2): 287–295. https://doi.org/10.1016/j.bioelechem.2006.10.005
Wang H, He Y, Yang M, Yan Q, You F, Fu F, Wang T, Huo X, Dong X, Shi X (2014) Dielectric properties of human liver from 10 Hz to 100 MHz: normal liver, hepatocellular carcinoma, hepatic fibrosis and liver hemangioma. Biomed Mater Engineer 24(6): 2725–2732. https://doi.org/10.3233/BME-141090
Laufer S, Ivorra A, Reuter VE, Rubinsky B, Solomon SB (2010) Electrical impedance characterization of normal and cancerous human hepatic tissue. Physiol Meas 31(7): 995–1009. https://doi.org/10.1088/0967-3334/31/7/009
Denard B, Lee C, Ye J (2012). Doxorubicin blocks proliferation of cancer cells through proteolytic activation of CREB3L1. eLife. 1: e00090. https://doi.org/10.7554/eLife.00090
Huang SC, Wu JF, Saovieng S, Chien WH, Hsu MF, Li XF, Lee SD, Huang CY, Huang CY, Kuo CH (2017) Doxorubicin inhibits muscle inflammation after eccentric exercise. J Cachexia, Sarcopenia and Muscle 8(2): 277–284. https://doi.org/10.1002/jcsm.12148
Peres WAF, Lento DF, Baluz K, Ramalho A (2012) Phase angle as a nutritional evaluation tool in all stages of chronic liver disease. Nutricion Hospitalaria 27(6): 2072–2078. https://doi.org/10.3305/nh.2012.27.6.6015
Кузьмина ТП, Давыдкин ИЛ, Терешина ОВ, Данилова ОЕ, Шпигель АС, Бетанели ТШ, Наумова КВ, Попельнюк НС (2019) Кардиотоксичность и методы ее диагностики у пациентов гематологического профиля (обзор литературы). Сибирск научн мед журн 39(1): 34–42. [Kuzmina TP, Davydkin IL, Tereshina OV, Danilova OE, Shpigel AS, Betaneli TSh, Naumova KV, Popelnyuk NS (2019) Cardiotoxicity and methods of its diagnosis in hematology patients (review). Siber Sci Med J 39 (1): 34–42. (In Russ)].
Rodriguez S, Ollmar S, Waqar M, Rusu AA (2016) Batteryless Sensor ASIC for Implantable Bio-Impedance Applications. IEEE Transact Biomed Circuits and Systems 10(3): 533–544. https://doi.org/10.1109/TBCAS.2015.2456242
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


