Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1440-1452
Возрастные изменения вклада NO и калиевых каналов в дилатацию пиальных артериальных сосудов у крыс
В. Н. Шуваева 1, *, О. П. Горшкова 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: shuvaevavn@infran.ru
Поступила в редакцию 13.08.2021
После доработки 14.09.2021
Принята к публикации 14.09.2021
Аннотация
Важную роль в передаче сигналов от продуцируемого эндотелием NO к гладкомышечным клеткам сосудов играют кальций-зависимые калиевые каналы большой проводимости (BKCa-каналы). Целью работы было изучение возрастных изменений вклада NO и BKCa-каналов в вызванную ацетилхолином (АХ) дилатацию пиальных артерий и оценка роли eNOS- и iNOS-продуцируемого NO у крыс Вистар в возрасте 4-х и 9-ти месяцев. Для этого выключали механизмы регуляции сосудистого тонуса с помощью аппликации блокаторов и методом прижизненной микрофотосъемки регистрировали изменение диаметра пиальных артерий на АХ на фоне блокады BKCa-каналов тетраэтиламмонием (ТЭА), NO – L-NAME, iNOS – аминогуанидином (AG). Определяли число дилатаций и степень дилатации пиальных артерий в ответ на действие АХ. Эти данные сравнивали с данными, полученными в отсутствие блокады. Оценивали вклад механизмов, опосредованных активацией BKCa-каналов, eNOS и iNOS, в дилатацию 3-ех групп пиальных артерий: мелких (диаметром менее 20 мкм), средних (20–40 мкм) и крупных (более 40 мкм). У молодых крыс NO, продуцируемый eNOS, вносит значительный вклад в регуляцию АХ-индуцированной вазодилатации средних и крупных артерий, тогда как у мелких артерий преобладает активация ВКСа-каналов. С возрастом снижается вклад eNOS-опосредованных механизмов в дилатацию средних и крупных артерий, но в процесс дилатации включается iNOS, а также повышается вклад в поддержание базального тонуса и функциональной активности ВКСа-каналов средних и крупных пиальных артерий, которая зависит от NO, продуцируемого iNOS.
ВВЕДЕНИЕ
Эндотелий продуцирует большое количество вазоактивных веществ [1, 2]. При старении, когда усиливается дисфункция эндотелия и зачастую нарушается мозговое кровообращение, способность сосудов регулировать кровоснабжение мозга приобретает жизненно важное значение, а исследование механизмов регуляции сосудистого тонуса, в частности вазодилатации, становится актуальным.
Возникновение дисфункции эндотелия (ЭД) при старении связывают со снижением биодоступности оксида азота (NO) [3, 4]. Эндогенный NO генерируется синтазой оксида азота (NOS). В сосудистой системе существует несколько видов NOS: эндотелиальная (eNOS), нейрональная (nNOS) и индуцибельная (iNOS) [5, 6]. Первичным источником эндогенного NO является эндотелиальная eNOS [6, 7]. С возрастом снижается уровень eNOS и повышается уровень iNOS [4]. Согласно экспериментальным и клиническим данным, в то время как активация eNOS генерирует небольшое количество NO в течение коротких периодов времени, стимуляция iNOS приводит к замедленному и длительному высвобождению большого количества NO [6, 7]. Чрезмерное количество NO усугубляет окислительно/нитрозативный стресс, приводящий к снижению биодоступности NO и ухудшению вазодилататорной функции эндотелия [6–8].
Значимую роль в передаче сигналов от продуцируемых эндотелием вазоактивных веществ к гладкомышечным клеткам (ГМК) сосудов играют кальций-зависимые калиевые каналы большой проводимости (BKCa-каналы). NO в сосудах головного мозга воздействует на BKCa-каналы либо непосредственно, либо через рианодиновые PKG-зависимые механизмы [9, 10], стимулируя чувствительные к рианодину запасы Са2+ в саркоплазматическом ретикулуме и вызывая дискретные токи Са2+, активирующие соседние кластеры BKCa-каналов [9]. Изменение активности BKCa-каналов, в свою очередь, также может изменять NO зависимую дилатацию сосудов [11]. Особенности возрастных изменений вклада NO и BKCa-каналов в дилатацию сосудов головного мозга к настоящему времени изучены не в полной мере. Учитывая, что уровень NO, продуцируемого eNOS, с возрастом снижается, интересным представляется исследовать, как изменяется вклад iNOS-продуцированного NO в дилататорную реакцию сосудов головного мозга у стареющих особей.
Целью данной работы было изучение возрастных изменений вклада NO и кальций-зависимых калиевых каналов большой проводимости в дилатацию мозговых сосудов. Проводилось сравнительное исследование вклада BKCa-каналов и NO в дилатацию пиальных артерий на воздействие ацетилхолина (АХ), а также оценивалась роль NO, продуцируемого eNOS- и iNOS, в дилатации на АХ у крыс Вистар в возрасте 4-х и 9-ти месяцев. Для этого использовали выключение механизмов регуляции сосудистого тонуса с помощью блокаторов и регистрировали реакцию пиальных артерий на воздействие АХ на фоне блокады BKCa-каналов, eNOS и iNOS и в ее отсутствие.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании использованы самцы крыс Вистар в возрасте 4-ех (n = 18, масса тела 240 ± 20 г) и 9-ти месяцев (n = 18, масса тела 450 ± 30 г) из ЦКП “Биоколлекция ИФ РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (Европейская конвенция, 19.07.2014) и требованиями Комиссии по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Были соблюдены все применяемые в исследованиях международные, национальные и/или институциональные принципы использования животных. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
Крыс наркотизировали хлоралгидратом (43 мг/100 г массы тела, внутрибрюшинно). Среднее артериальное давление (АД) у наркотизированных крыс измеряли инвазивным методом через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к компьютеру, работающему с оригинальной программой визуализации значений АД, разработанной в нашей лаборатории. Среднее АД составило у наркотизированных крыс в возрасте 4-ех месяцев – 97 ± 4 мм рт. ст., у крыс в возрасте 9-ти месяцев – 99 ± 4 мм рт. ст. Методом прижизненной микрофотосъемки через трепанационное отверстие площадью примерно 1.6 см2 в теменной области черепа у каждого животного фотографировали пиальные сосуды в стандартных условиях при непрерывном орошении поверхности мозга раствором (температура раствора 37°С) Кребса (фоновое изображение) и их реакцию на воздействие – аппликацию того или иного вещества. Исследовали дилатацию пиальных артерий на АХ [12], который в концентрации 10–7 М вызывает преимущественно дилатацию артерий, в том числе церебральных [13], стимулируя образование в эндотелиальных клетках вазодилататоров, в частности NO.
Поочередно ингибируя с помощью блокаторов механизмы вазодилатации, мы регистрировали изменение числа дилатированных пиальных артерий и степени их дилатации в ответ на аппликацию АХ. Индуцированную АХ дилатацию в отсутствие блокады считали базовой реакцией (100% дилатаций), и с ней сравнивали результаты, полученные при ингибировании механизмов вазодилатации. Экспериментальных крыс разделили на 6 групп: 3 группы крыс в возрасте 4-х мес. и 3 группы крыс в возрасте 9-ти мес., в каждой группе было по 6 особей. У 2-х групп крыс в возрасте 4-х и 9-ти мес. изучали реакции артерий на орошение поверхности головного мозга раствором хлорида ацетилхолина (АХ, Sigma, 10–7 М, 5 мин) в отсутствие и на фоне блокады BKCa-каналов хлоридом тетраэтиламмония [14] (ТЕА, “Вектон”, Россия, 2 мМ, предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокатора). У 2-х других групп крыс в возрасте 4-х и 9-ти мес. изучали реакции артерий на АХ в отсутствие и на фоне последовательной блокады NO-зависимой вазодилатации раствором метилового эфира нитро-L-аргинина [15, 16] (L-NAME, ICN Biomed. Inc, 10–3 М, предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокатора) и затем совместной блокады NO и BKCa-каналов (L-NAME (10–3 М) + ТЭА (2 мМ), предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокаторов). У 2-х последних групп крыс в возрасте 4-х и 9-ти мес. изучали реакции пиальных артерий на АХ в отсутствие и на фоне блокады iNOS раствором бикарбоната аминогуанидина [16] (AG, ICN Biomed. Inc, 1 мМ, предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокатора) и дополнительной блокады BKCa-каналов хлоридом тетраэтиламмония (ТЕА, “Вектон”, Россия, 2 мМ, предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокаторов).
В реакциях пиальных артерий на АХ в отсутствие блокады у крыс одного возраста значимых различий между животными внутри отдельных групп в сериях с введением различных блокаторов не обнаружено (проверка по критерию Краскела–Уоллеса). Эксперимент длился примерно 90 мин, после его окончания животных усыпляли передозировкой раствора хлоралгидрата.
На изображениях участков пиальной сосудистой сети измеряли (программа Inspector Matrox) ширину потока эритроцитов, соответствующую внутреннему диаметру сосуда. Об изменении роли ВКСa-каналов и NO в дилатации сосудов судили по изменению числа дилатированных сосудов и степени их дилатации в ответ на воздействие АХ до и после применения блокаторов. У каждой крысы было измерено в среднем 40 ± 2 участка пиальной артериальной сосудистой сети. Для анализа исследованные артериальные сосуды были разделены на 3 группы в соответствии с их начальными диаметрами: 1) <20 мкм (мелкие), 2) 20–40 мкм (средние) и 3) >40 мкм (крупные).
Изменение числа сосудов, расширившихся в ответ на воздействие, выражали в процентах относительно общего числа исследованных сосудов в группе. Степень дилатации ΔД оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия препарата, отнесенную к диаметру сосуда Д1 перед воздействием, %:
Считали, что реакция на воздействие отсутствует, если изменения диаметра не превышали 5.0 ± 0.5%. Это значение, как мы предварительно установили, регистрируется в покое в отсутствие каких-либо воздействий.
Данные по отдельной группе сосудов усреднялись для каждого животного и использовались для статистических сравнений. Анализ данных проводили с использованием программы InStat 3.02 (“GraphPad Software Inc.”, США), данные представляли в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, отличном от нормального, при сравнении нескольких групп применяли критерий Краскела–Уоллиса. При попарном сравнении 2-х групп данных применяли U-критерий Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У 9-месячных крыс число дилатаций на АХ было достоверно меньше чем у 4-месячных (р < 0.05). Число дилатированных участков у артерий разных калибров составило в среднем 35.4 ± 1.6% от количества исследованных участков у 9-месячных крыс и 41.3 ± 2.2% у 4-месячных животных. Степень дилатации на АХ артерий различных диаметров снижалась от мелких к более крупным сосудам во всех группах крыс обоих возрастов. Выключая поочередно изучаемые механизмы вазодилатации, сравнивали данные об АХ-индуцированной дилатации пиальных артерий на фоне блокады с результатами реакции на АХ в ее отсутствие (число дилатаций в отсутствие блокады принимали за 100%).
Аппликация ТЕА у крыс в возрасте 4-ех месяцев вызывала констрикцию 65% мелких сосудов и в среднем около 40% средних и крупных артерий. Число дилататорных реакций на воздействие АХ на фоне предварительного введения ТЕА снижалось на 42, 34 и 23% у мелких, средних и крупных артерий соответственно (рис. 1a).
Рис. 1.
Изменение числа индуцированных АХ дилатаций пиальных артерий разных калибров на фоне блокады ВКСа-каналов (ТEА + АCh), либо eNOS (L-NAME + ACh), либо одновременной блокады eNOS и ВКСа-каналов (L-NAME + ТEА + ACh), либо iNOS (AG + ACh), либо одновременной блокады iNOS и ВКСа-каналов (AG + ТEА + АCh) относительно дилатации на АCh в отсутствие блокады (100%) у крыс в возрасте 4-ех (a) и 9-ти месяцев (b). По оси ординат: примененные блокаторы, по оси абсцисс: число АCh-индуцированных дилатаций при блокаде (%) относительно числа дилатаций в отсутствие блокады (100%). Число дилатированных участков у мелких сосудов, < 20 мкм – темная заливка, у средних сосудов, 20–40 мкм – белая заливка, у крупных сосудов, > 40 мкм – серая заливка. # – p < 0.05, * – p < 0.01, ** – p < 0.001.
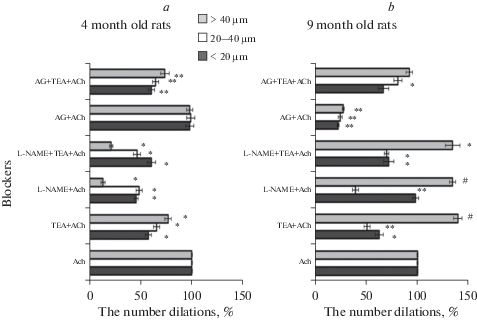
На фоне блокады NOS посредством L-NAME число АХ-индуцированных дилатаций у 4-месячных крыс снижалось значительно: у мелких и средних артерий примерно в равной степени на 54 и 51% соответственно. Сильнее всего, на 86%, была подавлена АХ-индуцированная дилатация крупных артерий (рис. 1a). Одновременная блокада ВКСa-каналов и NO у молодых крыс приводила к подавлению АХ-индуцированной дилатации во всех группах сосудов. (рис. 1a). Наиболее выраженные изменения отмечены в группе крупных сосудов (на 78%). С уменьшением диаметра различия в реакциях на АХ до и после одновременной блокады ВКСa-каналов и NO достоверно снижались (р < 0.05, KW = 12.1, критерий Краскела–Уоллиса), и в группе мелких сосудов снижение числа дилатаций составляло 39%. При этом уменьшение дилатации у мелких артерий было примерно таким же, как при блокаде только ВКСа-каналов, а у средних и крупных соответствовало значениям, полученным при блокаде только eNOS (U-критерий Манна–Уитни).
На фоне блокады iNOS у молодых крыс в возрасте 4-ех месяцев число АХ-индуцированных дилатаций во всех группах артерий не изменялось по сравнению с реакцией на АХ в отсутствие блокады. Совместная блокада ВКСa-каналов и iNOS приводила к снижению АХ-индуцированной дилатации мелких и средних артерий в среднем на 35%, а крупных пиальных артерий на 26% (рис. 1a). Это снижение соответствовало уменьшению числа дилатаций на фоне блокады только ВКСa-каналов (U-критерий Манна–Уитни, рис. 1a).
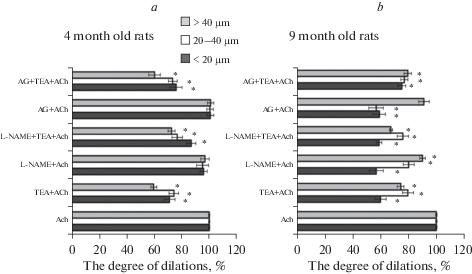
Степень дилатации на АХ при блокировании ВКСa-каналов у 4-месячных крыс снижалась на 28.7 ± 4.0, 25.6 ± 3.4 и 40.2 ± 2.2% соответственно у мелких, средних и крупных артерий (рис. 2a). Применение L-NAME в качестве блокатора не вызывало достоверного изменения степени дилатации во всех группах артерий по сравнению с АХ-индуцированной дилатацией в отсутствие блокады. Совместная блокада ВКСa-каналов и еNOS у молодых крыс приводила к снижению степени дилатации мелких артерий на 13.0 ± 3.3%, средних – на 23.2 ± 3.8% и крупных – на 27.3 ± 2.5%, тогда как блокада iNOS не изменяла степень дилатации у сосудов всех калибров. На фоне совместной блокады ВКСa-каналов и iNOS снижение степени дилатации было примерно таким же, как на фоне блокады только ВКСa-каналов: на 23.9 ± 4.4, 26.4 ± 3.2 и 39.6 ± 4.2% у мелких, средних и крупных пиальных артерий соответственно (рис. 2a).
Рис. 2.
Изменение степени индуцированных АХ дилатаций пиальных артерий разных калибров на фоне блокады ВКСа-каналов (ТEА + АCh), либо eNOS (L-NAME + ACh), либо одновременной блокады eNOS и ВКСа-каналов (L-NAME + ТEА + ACh), либо iNOS (AG + ACh), либо одновременной блокады iNOS и ВКСа-каналов (AG + ТEА + АCh) относительно дилатации на АCh в отсутствие блокады (100%) у крыс в возрасте 4-ех (a) и 9 месяцев (b). По оси ординат: примененные блокаторы, по оси абсцисс: степень АХ-индуцированных дилатаций при блокаде (%) относительно степени дилатации в отсутствие блокады (100%). Степень дилатации мелких сосудов, < 20 мкм – темная заливка, средних сосудов, 20–40 мкм – белая заливка, крупных сосудов, > 40 мкм – серая заливка. * – p < 0.01.
Аппликация ТЕА у крыс в возрасте 9-ти месяцев вызывала констрикцию 52% мелких и средних артерий и 60% крупных. В группе средних и крупных артерий число констрикций достоверно превышало значения (43 и 46%), полученные на более молодых крысах (р < 0.01, U = 45.1, U-критерий Манна–Уитни). Число дилатаций на воздействие АХ на фоне предварительного введения ТЕА у крыс в возрасте 9-ти месяцев в группах мелких и средних артерий уменьшилось по сравнению с базовой дилатацией на АХ (на 37 и 49% соответственно). Число дилатированных участков крупных артерий на фоне блокады ВКСa-каналов увеличилось до 139% (рис. 1b). Уменьшение числа и степени дилатаций в среднем на 40% на фоне блокады ВКСа-каналов в группе мелких артерий у 9-месячных крыс соответствовало значениям аналогичных показателей у 4-месячных животных (U-критерий Манна–Уитни), а в группе средних артерий – уменьшение числа дилатаций (в среднем на 49%) было достоверно более значительным, чем у молодых крыс (на 34%, p < 0.01, U = 1, U-критерий Манна–Уитни). Степени дилатации средних и крупных артерий у 9- и 4-месячных крыс достоверно не различались (U-критерий Манна–Уитни).
На фоне блокады еNOS у 9-месячных крыс число АХ-индуцированных дилатаций мелких артерий не менялось по сравнению с реакцией в отсутствие блокады, у средних уменьшалось на 60% и существенно увеличивалось до 134% у крупных пиальных артерий (рис. 1b). Снижение числа дилатаций средних артерий до 40 ± 3% у 9-месячных крыс соответствовало аналогичному значению у 4-месячных животных. Число дилатаций крупных артерий у 9-месячных крыс было достоверно больше (134 ± 3%, p < 0.01, U = 18, U-критерий Манна–Уитни), степень дилатации средних и крупных артерий не отличалась от аналогичных значений у 4-месячных крыс (U-критерий Манна–Уитни).
Совместная блокада ВКСa-каналов и еNOS у 9-месячных крыс приводила к подавлению АХ-индуцированной дилатации в группах мелких и средних артерий: соответственно на 28 и 30%, а в группе крупных артерий – к увеличению количества дилатаций на 34% (рис. 1b). При этом число дилатаций мелких артерий (72 ± 5%) было примерно таким же, как при блокаде только ВКСа-каналов (63 ± 4%, U-критерий Манна–Уитни) (рис. 1b), но много меньше, чем при блокаде только еNOS (98.0 ± 1.1%, р < 0.01, U = 11.22, U-критерий Манна–Уитни). А в группе средних артерий уменьшение числа АХ-индуцированных дилататорных ответов на фоне совместной блокады еNOS и ВКСа-каналов было достоверно меньше (на 30 ± 1%), чем при применении каждого из блокаторов в отдельности (L-NAME на 60.0 ± 1.1%, р < 0.01, U = 27.54, U-критерий Манна–Уитни, ТЭА на 49.0 ± 1.1%, р < 0.01, U = 19.2, U-критерий Манна–Уитни). Число дилатаций крупных артерий при совместной блокаде еNOS и ВКСа-каналов (134 ± 2.6%) соответствовало значениям, полученным при применении каждого из блокаторов в отдельности (ТЭА: 139.0 ± 1.5, р > 0.05, U = 8, U-критерий Манна–Уитни; L-NAME: 134.0 ± 1.1% р > 0.05, U = 18, U-критерий Манна–Уитни).
У крыс в возрасте 9-ти месяцев на фоне блокады iNOS число дилатированных участков артерий всех калибров значительно снизилось во всех группах сосудов в среднем на 75% (рис. 1b). Совместная блокада iNOS и ВКСa-каналов достоверно снижала число дилатаций мелких артерий на 33% (р < 0.001, U = 16, U-критерий Манна–Уитни) и средних артерий на 19% (р < 0.001, U = 25, U-критерий Манна–Уитни), достоверного снижения числа дилатаций крупных артерий не зарегистрировано (рис. 1b). В группе мелких сосудов это снижение (на 33.0 ± 1.8%) соответствовало значениям, полученным при применении только блокатора ВКСa-каналов (на 42.0 ± 1.1%, р < 0.01, U = 0, U-критерий Манна–Уитни).
Степень АХ-индуцированной дилатации у 9-месячных крыс на фоне блокады ВКСa-каналов снижалась у мелких артерий на 39.8 ± 4.0%, средних – на 20.2 ± 4.0% и крупных – на 25.5 ± 2.4%. Блокада еNOS приводила к снижению степени дилатации мелких артерий на 42.9 ± 5.0%, средних – на 19.7 ± 4.0% и крупных – на 9.8 ± 2.0% (рис. 2b). На фоне совместной блокады ВКСa-каналов и еNOS степень дилатации уменьшалась на 40.9 ± 2.0% у мелких, на 23.8 ± 4.0% – у средних и на 32.4 ± 1.2% – у крупных артерий. Степень АХ-индуцированной дилатации у 9-месячных крыс на фоне блокады iNOS у мелких и средних артерий снижалась в среднем на 40%, тогда как у крупных артерий снижение степени дилатации составило только 8.9 ± 3.8% (рис. 1b, 2b). Совместная блокада ВКСa-каналов и iNOS приводила к снижению степени дилатации сосудов всех исследованных диаметров в среднем на 20% (рис. 2b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Большое количество экспериментов на животных и клинических исследований показали, что старение вызывает дисфункцию эндотелия (ЭД), приводящую к снижению вазодилатации. Наше исследование подтвердило предыдущие сообщения. У крыс в возрасте 9-ти месяцев число пиальных артерий, расширившихся в ответ на воздействие АХ, было достоверно меньше, чем у более молодых животных.
Известно, что воздействуя на сосудистую стенку, АХ вызывает активацию мускариновых рецепторов. Стимуляция последних приводит к увеличению цитозольного кальция, что является необходимым условием для высвобождения из эндотелия вазодилататоров, таких как NO, простагландины, эндотелиальный гиперполяризующий фактор и др. [17]. В качестве ключевого фактора развития ЭД при старении в настоящее время рассматривается уменьшение генерации NO эндотелием и нарушение его диффузии от эндотелия к ГМК, т.е. изменение уровня и биодоступности NO [4]. В наших экспериментах у 4-месячных крыс на фоне блокады eNOS значительно снижалось число дилатаций во всех группах артерий без изменения степени дилатации (рис. 1a, 2a). Число АХ-индуцированных дилатаций мелких и средних артерий снизилось примерно вдвое по сравнению с реакцией в отсутствие блокады, наибольшее снижение числа дилатаций (на 86%) отмечено у крупных артерий. По сравнению с 4-месячными крысами у 9-месячных животных на фоне применения L-NAME в группе мелких сосудов уменьшалась только степень дилатации, без изменения числа дилатированных сосудов (рис. 1b, 2b). Снижение числа и степени дилатации средних артерий у 9-месячных крыс соответствовало аналогичным значениям у более молодых животных, тогда как число дилатаций крупных артерий на фоне блокады NO увеличивалось. Таким образом, нами были обнаружены возрастные изменения NO-опосредованной дилатации мелких и крупных пиальных артерий. Увеличение количества дилатаций крупных сосудов на фоне блокады еNOS у стареющих животных может быть связано с дисбалансом активных форм кислорода и оксида азота, характерном для стареющих особей [18]. Было показано, что дисбаланс в соотношении NO и супероксид-анионов из-за преобладания супероксид-анионов приводит к изменению реакционной способности сосудов [5]. Также, несмотря на то, что одной из основных причин нарушения эндотелий-зависимой вазодилатации считается снижение активности eNOS, в последнее время было установлено, что с возрастом в сосудистой ткани повышается экспрессия другого типа NO-синтаз – индуцибельной NO-синтазы [5]. Это предполагает, что iNOS может вносить вклад в вызванную старением эндотелиальную дисфункцию [5, 6, 18, 19].
В наших экспериментах применение селективного блокатора iNOS – аминогуанидина достоверно уменьшало число и степень АХ-индуцированной дилататорной реакции исследованных артериальных сосудов у 9-месячных крыс, тогда как у молодых крыс число и степень дилатаций сосудов достоверно не изменялись. Следовательно, можно утверждать, что у крыс в возрасте 4-ех месяцев индуцибельная NO-синтаза либо не образуется, либо ее активность крайне невысока, старение же сопровождается включением iNOS в процесс дилатации пиальных артерий всех калибров. Ингибирование iNOS уменьшает уровень вазоактивного NO в клетках, тем самым повышая сосудистый тонус и уменьшая эндотелий-зависимую дилатацию [20].
Значимую роль в передаче сигналов от продуцируемых эндотелием вазоактивных веществ к ГМК сосудов играют BKCa-каналы [21]. Применение ТЭА, являющегося блокатором калиевых каналов, преимущественно ингибирующим ВКСа-каналы, у крыс в возрасте 4-ех месяцев в наших экспериментах приводило к констрикции в среднем 65% мелких и 45% средних и крупных пиальных артериальных сосудов. Число и амплитуда АХ-опосредованных дилататорных реакций сосудов, предварительно подвергнутых воздействию ТЕА, у 4-месячных крыс снижались во всех группах исследованных сосудов (рис. 1a, 2а). Эти данные показывают, что в физиологических условиях ВКСа-каналы участвуют в поддержании базального тонуса и обеспечении вазодилататорных реакций пиальных артериальных сосудов на воздействие АХ. У 9-месячных крыс, по сравнению с более молодыми животными, число констрикций в ответ на применение блокатора ВКСа-каналов увеличивалось в среднем на 50–60% только в группах средних и крупных пиальных артериальных сосудов. Число АХ-опосредованных дилатаций мелких и средних артерий на фоне блокады ВКСа-каналов у крыс в возрасте 9-ти месяцев уменьшалось в среднем на 44% (рис. 1b). Уменьшение числа дилатаций в группе мелких артерий у 9-месячных крыс соответствовало значениям у 4-месячных животных, а в группе средних артерий было выражено сильнее, чем у молодых крыс. Следовательно, можно предположить, что с возрастом вклад ВКСа-каналов в АХ-индуцированный дилататорный ответ увеличивается только в группе средних пиальных артериальных сосудов.
Число расширившихся на воздействие АХ крупных артерий на фоне блокады ВКСа-каналов возрастало (рис. 1b). Известно, что в АХ-индуцированной эндотелий-зависимой вазодилатации наряду с другими факторами немаловажную роль играет механизм эндотелиальной гиперполяризации. Гиперполяризация распространяется по щелевым контактам вдоль эндотелия и радиально по миоэндотелиальным соединениям, вызывая расслабление ГМК [22–24]. Для распространения гиперполяризации важно наличие активированных ионных каналов. Ведущую роль в этом процессе отводят чувствительным к электрическому напряжению K+-каналам (KV) и ВKСа-каналам [22, 25, 26]. Роль и функции ВКСa-каналов весьма разнообразны [27]. Активация BKСа-каналов внутриклеточными, локальными и временными токами (“искрами”) Ca2+ оказывает гиперполяризующее влияние на мембранный потенциал ГМК, снижая активность потенциал-зависимых кальциевых каналов и ограничивая приток Ca2+, тем самым способствуя релаксации ГМК и расширению сосудов. BKСа-каналы регулируются различными факторами, которые могут изменять условия их открытия, чувствительность к Ca2+ и экспрессию субъединиц. Вероятность открытия ВКСa-каналов определяется как мембранным напряжением, так и внутриклеточной концентрацией Са2+ и Mg2+ [28]. При старении пути передачи сигналов между эндотелиальными и ГМ клетками могут меняться. Экспериментально было показано, что с возрастом изменяются экспрессия и функции ВКСa-каналов [28], и активация ВКСа-каналов может снижать эффективность дилатации [22]. В литературе имеются сведения о том, что в покое у старых животных, по сравнению с молодыми особями, открыто больше калиевых каналов [25]. Это приводит к тому, что радиальные миоэндотелиальные переходы сохраняются [23] и местная дилатация осуществляется локальными токами Са2+ [29], но продольное проведение электрических сигналов по эндотелию для координации расслабления ГМК, необходимого для дилатации сосуда, c возрастом нарушается [22, 24, 25, 30]. Электрические сигналы, проходя вдоль эндотелия, рассеиваются, область передачи сигнала уменьшается [25]. У старых особей происходит большая утечка и рассеяние сигнала в силу того, что у них открыто больше К+-каналов. Блокада К+-каналов у старых животных, предотвращая диссипацию электрического сигнала, может приводить к восстановлению и даже увеличению продольной электропроводности, и, следовательно, к увеличению дилатации [22, 25, 31]. Полученные нами данные указывают на нарушение способности эндотелия проводить электрические сигналы, связанное с изменением активности калиевых каналов, в частности ВKСа-каналов, опосредующих дилатацию крупных пиальных артерий у 9‑месячных крыс.
При совместной блокаде eNOS и ВКСа-каналов у крыс в возрасте 4-х месяцев число АХ-индуцированных дилатаций и степень дилататорной реакции во всех группах артерий существенно снижались относительно реакции на АХ в отсутствие блокады (рис. 1a, 2a). При этом уменьшение дилатации у мелких артерий было примерно таким же, как при блокаде только ВКСа-каналов, а у средних и крупных соответствовало значениям, полученным при блокаде только eNOS. Эти данные указывают на преимущественный вклад механизма активации NO в регуляцию АХ-индуцированной дилатации средних и крупных артерий у молодых крыс [6] и преобладание механизма активации ВКса-каналов в дилатации мелких артерий [32].
У 9-месячных крыс при совместной блокаде еNOS и ВКСа-каналов зафиксировано снижение АХ-индуцированной дилатации в группах мелких и средних артерий. При этом число дилатаций мелких артерий было примерно таким же, как при блокаде только ВКСа-каналов (рис. 1b, 2b), но много меньше, чем при блокаде только еNOS, что указывает на существенный вклад ВКСа-каналов в дилатацию мелких пиальных артерий у этих животных. А в группе средних артерий уменьшение числа АХ-индуцированных дилататорных ответов на фоне совместной блокады еNOS и ВКСа-каналов было достоверно меньше, чем при применении каждого из блокаторов в отдельности. Число дилатаций крупных артерий при совместной блокаде еNOS и ВКСа-каналов увеличивалось и соответствовало значениям, полученным при применении каждого из блокаторов в отдельности, что может свидетельствовать о равном участии обоих исследованных механизмов в АХ-индуцированной дилатации крупных пиальных артерий. Следовательно, на основании полученных данных можно утверждать, что старение сопровождается снижением роли NO-опосредованных механизмов в дилатации средних и крупных пиальных артерий.
На фоне одновременной блокады ВКСа-каналов и iNOS у 4-месячных крыс число АХ-индуцированных дилатаций и их степень во всех группах пиальных артерий снижались примерно до значений, полученных на фоне блокады только ВКСa-каналов (рис. 1a, 2a). У крыс в возрасте 9-ти месяцев совместная блокада iNOS и ВКСа-каналов приводила к уменьшению числа АХ-индуцированных дилатаций только в группе мелких артерий (рис. 1b, 2b). Это снижение соответствовало значениям, полученным при применении только блокаторов ВКСa-каналов. Уменьшение числа и степени дилатации средних сосудов проявлялось в меньшей степени, чем в случае применения каждого из блокаторов в отдельности. А в группе крупных сосудов совместное применение блокаторов iNOS и ВКСа-каналов позволило исключить увеличение числа АХ-опосредованных дилатаций, наблюдаемое на фоне применения только блокатора ВКСа-каналов. Полученные нами данные свидетельствуют о том, что при старении NO, продуцируемый iNOS, наряду с NO, синтезируемым eNOS, играет роль в регуляции активности ВКСа-каналов и в индуцированной АХ дилатации пиальных артериальных сосудов.
ЗАКЛЮЧЕНИЕ
Сравнительное исследование вклада NO и BKCa-каналов в дилатацию пиальных артериальных сосудов показало, что у молодых крыс механизм, опосредованный NO, продуцируемым eNOS, играет значительную роль в регуляции АХ-индуцированной вазодилатации средних и крупных артерий. С уменьшением диаметра сосудов возрастает роль регуляторных процессов, связанных с активацией ВКСа-каналов.
С возрастом снижается вклад eNOS-опосредованных механизмов в дилатацию средних и крупных артерий, но в процесс дилатации включается iNOS. Старение также сопровождается повышением вклада в поддержание базального тонуса и функциональной активности ВКСа-каналов средних и крупных пиальных артерий, которая зависит от NO, продуцируемого iNOS.
Список литературы
Zhang DX, Gutterman DD (2011) Transient receptor potential channel activation and endothelium-dependent dilation in the systemic circulation. J Cardiovasc Pharmacol 57(2): 133–139. https://doi.org/10.1097/FJC.0b013e3181fd35d1
Thakore P, Earley S (2019) Transient Receptor Potential Channels and Endothelial Cell Calcium Signaling. Compr Physiol 9(3): 1249–1277. https://doi.org/10.1002/cphy.c180034
Puzserova A, Ilovska V, Balis P, Slezak P, Bernatova I (2014) Age-related alterations in endothelial function of femoral artery in young SHR and WKY rats. Biomed Res Int 2014(1): 658479. https://doi.org/10.1155/2014/658479
Sertedaki E, Veroutis D, Zagouri F, Galyfos G, Filis K, Papalambros A, Aggeli K, Tsioli P, Charalambous G, Zografos G, Sigala F (2020) Carotid Disease and Ageing: A Literature Review on the Pathogenesis of Vascular Senescence in Older Subjects. Curr Gerontol Geriatr Res 13; 2020: 8601762. https://doi.org/10.1155/2020/8601762
Tian J, Yan Z, Wu Y, Zhang SL, Wang K, Ma XR, Guo L, Wang J, Zuo L, Liu J, Quan L, Liu HR (2010) Inhibition of iNOS protects endothelial-dependent vasodilation in aged rats. Acta Pharmacol Sin 31(10): 1324–1328. https://doi.org/10.1038/aps.2010.111
Cau SB, Carneiro FS, Tostes RC (2012) Differential modulation of nitric oxide synthases in aging: therapeutic opportunities. Front Physiol 3: 218. https://doi.org/10.3389/fphys.2012.00218
Tejero J, Shiva S, Gladwin MT (2019) Sources of Vascular Nitric Oxide and Reactive Oxygen Species and Their Regulation. Physiol Rev 1: 99(1): 311–379. https://doi.org/0.1152/physrev.00036.2017
Feletou M, Kohler R, Vanhoutte PM (2012) Nitric oxide: Orchestrator of endothelium-dependent responses. Ann Med 44: 694–716. https://doi.org/10.3109/07853890.2011.585658
Yuill KH, McNeish AJ, Kansui Y, Garland CJ, Dora KA (2010) Nitric oxide suppresses cerebral vasomotion by sGC-independent effects on ryanodine receptors and voltage-gated calcium channels. J Vasc Res 47(2): 93–107. https://doi.org/10.1159/000235964
Tykocki NR, Boerman EM, Jackson WF (2017) Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol 7(2): 485–581. https://doi.org/10.1002/ cphy.c160011
Schmid J, Müller B, Heppeler D, Gaynullina D, Kassmann M, Gagov H, Mladenov M, Gollasch M, Schubert R (2018) The unexpected role of calcium-activated potassium channels: limitation of NO-induced arterial relaxation. J Am Heart Assoc 7(7): e007808. https://doi.org/10.1161/JAHA.117.007808
Sandow SL, Senadheera S, Grayson TH, Welsh DG, Murphy TV (2012) Calcium and endothelium-mediated vasodilator signaling. Adv Exp Med Biol 740: 811–831.
Шуваева ВН, Горшкова ОП (2018) Модуляция тонуса церебральных артерий ацетилхолином у крыс разных линий. Рос физиол журн им ИМ Сеченова 104(7): 807–816. [Shuvaeva VN, Gorshkova OP (2018) Modulation of cerebral artery tone by acetylcholine in rats of different strains. Russ J Phisol 104(7): 807–816. (In Russ)].
Wang J, Kim D (2018) Activation of voltage-dependent K(+) channels strongly limits hypoxia-induced elevation of [Ca(2+) ](i) in rat carotid body glomus cells. J Physiol 596(15): 3119–3136. https://doi.org/10.1113/JP275275
Kaneguchi A, Ozawa J, Minamimoto K, Yamaoka K (2020) Nitric oxide synthase inhibitor L‑NG-nitroarginine methyl ester (L-NAME) attenuates remobilization-induced joint inflammation. Nitric Oxide 96: 13–19. https://doi.org/10.1016/j.niox.2020.01.003
Gericke A, Goloborodko E, Sniatecki JJ, Steege A, Wojnowski L, Pfeiffer N (2013) Contribution of nitric oxide synthase isoforms to cholinergic vasodilation in murine retinal arterioles. Exp Eye Res 109: 60–66. https://doi.org/10.1016/j.exer.2013.01.012
Matz RL, Schott C, Stoclet JC, Andriantsitohaina R (2000) Age-related endothelial dysfunction with respect to nitric oxide, endothelium-derived hyperpolarizing factor and cyclooxygenase products. Physiol Res 49(1): 11–18.
Liguori I, Russo G, Curcio F, Bulli G, Aran L (2018) Oxidative stress, aging and diseases. Clin Interv Aging 13: 757–772. .https://doi.org/10.2147/CIA.S158513
Васина ЛВ, Петрищев НН, Власов ТД (2017) Эндотелиальная дисфункция и ее основные маркеры. Регионарное кровообращение и микроциркуляция 16(1): 4–15. [Vasina LV, Petrishchev NN, Vlasov TD (2017) Endothelial dysfunction and its main markers. Regional blood circul and microcircul 16(1): 4–15. (In Russ)]. https://doi.org/10.24884/1682-6655-2017-16-1-4-15
Солодков АР, Ятковская НМ (2013) Изменения эндотелий-зависимой дилатации и альфа-1 адренореактивности аорты крыс, вызванные ингибированием индуцибельной NO-синтазы после ограничения двигательной активности. Рос физиол журн им ИМ Сеченова 99(7): 859–868. [Solodkov AP, Iatskovskaia NM (2013) Changes in endothelium-dependent dilation and alpha1-adrenoreactivity of rat aorta caused by inducible NO-synthase inhibition after motor activity restrictions. Russ J Physiol 99(7): 859–868. (In Russ)].
Earley S (2011) Endothelium-dependent cerebral artery dilation mediated by transient receptor potential and Ca2+-activated K+ channels. J Cardiovasc Pharmacol 57(2): 148–153. https://doi.org/10.1097/FJC.0b013e3181f580d9
Beleznai TZ, Yarova PL, Yuill KH, Dora KA (2011) Smooth muscle Ca2+-activated and voltage-gated K+channels modulate conducted dilation in rat isolated small mesenteric arteries. Microcircul 18: 487–500. https://doi.org/10.1111/j.1549-8719.2011.00109.x
de Wit C, Griffith TM (2010) Connexins and gap junctions in the EDHF phenomenon and conducted vasomotor responses. Pflugers Arch – Eur J Physiol 459: 897–914. https://doi.org/10.1007/s00424-010-0830-4
Feher A, Broskova Z, Bagi Z (2014) Age-related impairment of conducted dilation in human coronary arterioles. Am J Physiol Heart Circ Physiol 306: H1595–H1601. https://doi.org/10.1152/ajpheart.00179.2014
Behringer EJ, Shaw RL,Westcott EB, Socha MJ, Segal SS (2013) Aging impairs electrical conduction along endothelium of resistance arteries through enhanced Ca2+-activated K+ channel activation. Arterioscler Thromb Vasc Biol 33(8): 1892–1901. https://doi.org/10.1161/ATVBAHA.113.301514
Longden TA, Dabertrand F, Koide M, Gonzales A, Tykocki1 NR, Brayden JE, Hill-Eubanks D, Nelson MT (2017) Capillary K+-sensing initiates retrograde hyperpolarization to locally increase cerebral blood flow. Nat Neurosci 20(5): 717–726. https://doi.org/10.1038/nn.4533
Krishnamoorthy-Natarajan G, Koide M (2016) BK Channels in the Vascular System. Int Rev Neurobiol 128: 401–438. https://doi.org/10.1016/bs.irn.2016.03.017
Carvalho-de-Souza JL, Varanda WA, Tostes RC, Chignalia AZ (2013) BK Channels in Cardiovascular Diseases and Aging. Aging Dis 4(1): 38–49.
Dabertrand F, Nelson MT, Brayden JE (2012) Acidosis dilates brain parenchymal arterioles by conversion of calcium waves to sparks to activate BK channels. Circ Res 110(2): 285–294. https://doi.org/10.1161/CIRCRESAHA.111.258145
Behringer EJ, Hakim MA (2019) Functional interaction among KCa and TRP channels for cardiovascular physiology: modern perspectives on aging and chronic disease. Int J Mol Sci 20(6): 1380. https://doi.org/10.3390/ijms20061380
Behringer EJ, Segal SS (2012) Tuning electrical conduction along endothelial tubes of resistance arteries through Ca2+-activated K+ channels. Circ Res 110: 1311–1321. https://doi.org/10.1161/CIRCRESAHA.111.262592
Ye Y, Gao M, Feng L, Feng B, Ma X (2019) Isoliquiritigenin-induced vasodilation by activating large-conductance Ca(2+)-activated K(+) channels in mouse mesenteric arteries. Clin Exp Pharmacol Physiol 46(11): 1044–1052. https://doi.org/10.1111/1440-1681.13156
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


