Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1553-1567
Изменение электрокортикографических показателей крыс в ситуации реальной угрозы жизни в модели витального стресса
Н. К. Апраксина 1, *, Т. В. Авалиани 1, С. Г. Цикунов 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: natalapraksina@mail.ru
Поступила в редакцию 19.09.2021
После доработки 05.10.2021
Принята к публикации 05.10.2021
Аннотация
На модели витального стресса изучалось влияние психотравмирующего воздействия на ритмическую структуру электрокортикограммы (ЭКоГ) мозга крыс при переживании гибели партнера от действий хищника. Показано, что момент переживания угрозы жизни сопровождается достоверным повышением медленноволновой активности в диапазоне дельта-ритма, усилением межполушарной асимметрии по ЭКоГ показателям в диапазоне альфа- и дельта-частот в лобной области и снижением асимметрии в диапазоне тета-ритма в лобной части и дельта-ритма в затылочной коре полушарий мозга. Наиболее выраженные изменения биоэлектрической активности мозга по показателю индекса ритма в диапазоне альфа-, бета-, тета- и дельт-частот, а также изменению асимметрии выявлены через два часа после стресса, а высокий уровень индекса ритма в диапазоне дельта-активности сохранялся до 3-х суток после угрозы жизни, что свидетельствует о выраженном аверсивном характере психотравмирующего воздействия и важной роли дельта-активности в отражении пережитых обстоятельств витального стресса. Изменение ритмической структуры ЭКоГ показателей крыс непосредственно в момент ситуации, угрожающей жизни, может выступать объективным показателем переживаемого страха при витальном стрессе и свидетельствовать о запуске процессов формирования посттравматического стрессового расстройства.
Переживания психотравмирующих событий, выходящих за рамки повседневного опыта, в частности, военных действий, природных и техногенных катастроф, а также насилия, как сексуального, так и семейного характера, становятся в последние десятилетия частым атрибутом современной жизни во всем мире. Возрастает необходимость поиска возможных биомаркеров, прогностических критериев в оценке развития психотравмы, вызванной экстремальными факторами. Нейрофизиологические механизмы посттравматических стрессовых расстройств (ПТСР) остаются недостаточно изученными. Моделирование подобных психических травм в экспериментальных условиях на животных сопровождается рядом трудностей: поиском стрессирующего агента, природа которого связана только с эмоциональным воздействием, а также выбором стрессора, представляющего реальную угрозу жизни. Модель витального стресса, применяемая в настоящем исследовании – психическая травма, вызванная переживанием ситуации угрозы собственной жизни, приводит к длительным психоэмоциональным нарушениям тревожного и депрессивного характера и позволяет исследовать последствия воздействия в отсроченный период [1, 2].
В настоящее время среди большого спектра предполагаемых диагностических биомаркеров невротических расстройств тревожного характера не выявлено специфичного диагностического критерия данного типа нарушений ЦНС [3]. Проявления эмоциональных состояний как человека, так и животных находят отражение в изменении биоэлектрической активности мозга, преимущественно в соотношении основных ритмов: дельта, тета, альфа и бета [4]. Показана связь возникающих изменений показателей ЭКоГ у крыс с неврологическими нарушениями в результате черепно-мозговой травмы и сходство с таковыми в клинической практике [5]. При психических расстройствах наблюдается изменение спектра мощности, индекса ритмов биоэлектрической активности мозга [6]. Мы предположили, что одним из возможных маркеров, свидетельствующих о состоянии переживаемого ужаса и страха, в модели витального стресса могут быть показатели биоэлектрической активности коры больших полушарий (ЭКоГ показатели), отражающие состояние кортикальной нейродинамики и стабильных изменений нейроанатомических и биохимических взаимосвязей, лежащих в основе патогенеза психоэмоциональных расстройств.
Таким образом, цель данного исследования заключалась в оценке биоэлектрической активности мозга самок крыс по показателю индекса ЭКоГ ритмов в диапазоне альфа-, бета-, тета- и дельта-частот в момент нанесения психотравмирующего воздействия и в ранний посттравматический стрессовый период.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры с животными выполнялись с соблюдением международных принципов и правил Европейской конвенции о защите позвоночных животных, используемых для экспериментальных целей (Страсбург, 1986). Исследования соответствовали основным требованиям биомедицинской этики и были согласованы с локальным этическим комитетом ФГБНУ Институт экспериментальной медицины (№ 2/16 от 12.05.2016).
Эксперименты проводили на половозрелых самках крысах породы Вистар (ФГПУ Питомник лабораторных животных “Рапполово”, Ленинградская область) одинакового возраста (7 месяцев), имевших перед началом исследования массу 180–200 г (n = 30) без учета фазы эстрального цикла. Использование в данной работе самок крыс обусловлено необходимостью решения последующих задач по оценке влияния витального стресса на организм матери и трансгенерационной передаче эффектов психотравмы матерей потомству. Животные содержались в условиях вивария в клетках по 5 особей в каждой при постоянном доступе к воде и стандартному комбинированному корму для грызунов, одинаковом температурном режиме (22 ± 2 °С), влажности, освещенности (инвертированный свет 8.00–20.00.) и уровне шума.
Модель психической травмы
Психическую травму у самок крыс моделировали обстоятельствами переживания ситуации гибели партнера от действий хищника и угрозой собственной жизни [7]. С этой целью животных помещали в террариум к тигровому питону, где одно из них становилось жертвой пищевых потребностей хищника. Пережившие гибель партнера животные далее находились в террариуме за прозрачной перегородкой в течение 30–40 мин. Во время нанесения психической травмы у крыс фиксировали выраженные реакции страха, проявившееся у животных в виде таких поведенческих актов, как “фризинг”, сбивания в кучи, вертикальные стойки, продолжительный и измененный груминг. Отдельные животные могли осуществлять ажитированное бесконтрольное перемещение по террариуму.
Стереотаксические операции по установке корковых электродов
Установку корковых электродов проводили под золетиловым наркозом посредством интраперитонеального введения препарата Zoletil 100 (30 мг/кг) (Virbac, Франция) с предварительной внутримышечной премедикацией 2%-ным раствором рометара (8 мг/кг) (Rometar, Чехия). Предварительно побритую поверхность головы обрабатывали 5%-ным раствором йода. Для предотвращения воспалительного процесса вводили 1 мл бициллина-3 (30 000 ЕД) в мышцу задней конечности. Производили продольный разрез кожи на голове длиной 2.5 см по саггитальной линии. Счищали надкостницу с предварительной анестезией 0.5%-ным раствором новокаина. С помощью сверла с ограничителем на 0.3 мм делали отверстия, далее имплантировали серебряные шаровидные электроды (d = 1 мм) в лобных и затылочных областях справа и слева, симметрично по следующим координатам: АР = 3 мм (вперед/назад от брегмы), SD = 2 мм (латерально от сагиттального шва), Н = 0.3 мм (глубина погружения в кости черепа). Индифферентный и референтный электроды располагали на затылочной кости справа и слева от сагиттального шва (SD = 1.5 мм, АР = –10). Все электроды коммутировались на микроразъеме, зафиксированном на черепе, с предварительно установленными титановыми крепежными скобами самотвердеющей пластмассой. Зашивали кожный разрез шелковыми нитками, обрабатывали рану стрептоцидом. Послеоперационный период составлял 7 дней. При проведении операции использовали стереотаксический прибор фирмы Medicor (Венгрия). Стереотаксические координаты определялись по атласу [8]. Непосредственно на время эксперимента устанавливался телеметрический регистратор биопотенциалов.
Оценка биоэлектрической активности мозга самок крыс
Регистрацию биоэлектрической активности мозга в лобных и затылочных областях слева и справа соответственно проводили через 7 дней после вживления электродов, каждый сеанс длился 20 мин при свободном перемещении крыс в клетке при использовании компьютерно-аппаратного комплекса Синхро-С, который позволял проводить индексометрический анализ [9]. Строили распределения периодов колебаний ЭЭГ правого и левого полушарий за весь сеанс. По площадям распределений в соответствующих диапазонах вычисляли индекс альфа-, бета-, тета- и дельта-ритмов, представляющий долю ритма, отношение количества колебаний относительно общего количества колебаний остальных ритмов за 20-минутный интервал с периодом анализа 2 мин, а также коэффициент асимметрии индекса ритмов между левой и правой сторонами мозга, рассчитанный по формуле:
где a – значение первого числа; b – величина второго числа [9]. Фоновые значения ЭКоГ (Фон) крыс регистрировали в террариуме с питоном за закрытой прозрачной перфорированной перегородкой. Для оценки влияния витального стресса на показатели биоэлектрической активности мозга ЭКоГ регистрацию проводили непосредственно во время нанесения психогенной травмы в террариуме с питоном, в момент захвата жертвы при открытой перегородке, через 2 ч после стресса и на 3-и сутки после воздействия.Дизайн эксперимента:
1) Отбор животных (самки крыс массой 180–200 г в возрасте 7 мес.).
2) Стереотаксические операции по вживлению корковых электродов.
3) Послеоперационный период – 7 сут.
4) Фиксация телеметрического регистратора оперированным крысам, пробная регистрация ЭКоГ показателей, отбраковка животных.
5) Начало эксперимента:
6) Фиксация телеметрического регистратора крысам, регистрация фоновых ЭКоГ показателей в течение 20 мин в специальной клетке при свободном перемещении животного вне террариума с питоном.
7) Регистрация фоновых ЭКоГ показателей в течение 20 мин в специальной клетке внутри террариума с питоном, за закрытой прозрачной, перфорированной перегородкой, при нахождении сородичей.
8) Открытие перегородки в террариуме. Моделирование ситуации угрозы жизни, захват, удушение, заглатывание сородича питоном. Регистрация ЭКоГ показателей в течение 20 мин витального стресса в специальной клетке внутри террариума с питоном с открытой перегородкой. После заглатывания жертвы регистрация ЭКоГ показателей за закрытой перегородкой.
9) Регистрация ЭКоГ показателей в течение 20 мин в специальной клетке, вне террариума, спустя 2 ч после витального стресса.
10) Регистрация ЭКоГ показателей в течение 20 мин в специальной клетке вне террариума, на 3-и сутки после витального стресса.
11) Выведение животных из эксперимента.
Статистические методы оценки результатов
Для выявления статистически значимых различий применяли пакет программ StatisticaV.10, оценку проводили однофакторным дисперсионным анализом для повторных измерений (Repeated Measures ANOVA) с последующими апостериорными сравнениями при помощи t-критерия Стьюдента для зависимых выборок с поправкой на множественные сравнения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ биоэлектрической активности мозга самок крыс, переживших витальный стресс по показателям индекса ритмов в диапазоне альфа-, бета-, тета- и дельта-частот выявил достоверные изменения по сравнению с фоновыми значениями в зависимости от времени регистрации ЭКоГ относительно психотравмирующего воздействия.
Достоверное снижение индекса альфа-ритма наблюдалось через два часа после витального стресса в правой лобной области (рис. 1b) и в обеих затылочных областях по сравнению с фоновыми значениями (рис. 1c, d). Нами не выявлено достоверных изменений биоэлектрической активности мозга по показателю индекса альфа-ритма у самок крыс, переживших ситуацию, связанную с угрозой жизни, непосредственно в момент нанесения психотравмирующего воздействия, а также в острый период после травмы на 3-и сутки (рис. 1a).
Рис. 1.
Показатели индекса ритма в диапазоне альфа-частот у самок крыс, переживших витальный стресс. По оси абсцисс – название групп животных: BC (background condition) – фоновые показатели, Stress – показатели в момент угрозы жизни, 2h after stress – через 2 ч после стрессорного воздействия, 3 after stress – на 3-и сутки после стресса. По оси ординат – отношение количества колебаний альфа-ритма к общему количеству колебаний, выраженные в условных единицах (c.u.). Индекс альфа-ритма в левой фронтальной области (a), в правой фронтальной области – (b), в левой затылочной области – (с), в правой затылочной части – (d). * – достоверность различий индекса альфа-ритма по сравнению с фоновыми показателями (p < 0.05), ** – достоверность различий индекса альфа-ритма экспериментальных групп по сравнению с фоновыми показателями (p < 0.01), оцененные по однофакторному дисперсионному анализу для повторных измерений с последующими апостериорными сравнениями при помощи t-критерия Стьюдента для зависимых выборок с поправкой на множественные сравнения. Данные представлены в виде среднего ± ошибка среднего.

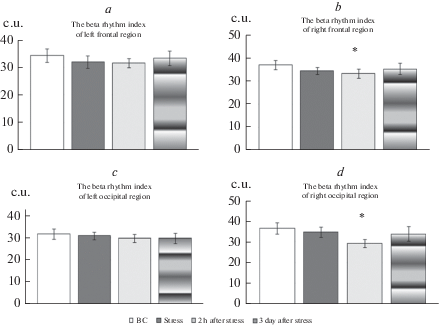
Показатели индекса бета-ритма также изменялись в зависимости от срока ЭКоГ регистрации у стрессированных животных (рис. 2). Через два часа после стресса в правой лобной (рис. 2b) и затылочной областях (рис. 2d) регистрируется достоверное падение индекса бета-ритма по сравнению с фоновыми значениями. Достоверных изменений индекса бета-ритма во время стресса и в раннем отдаленном периоде после стрессорного воздействия по сравнению с фоновыми значениями не выявлено.
Рис. 2.
Показатели индекса ритма в диапазоне бета-частот у самок крыс, переживших витальный стресс. Индекс бета-ритма в левой фронтальной области (a), в правой фронтальной области – (b), в левой затылочной области – (с), в правой затылочной части – (d). По оси ординат – соотношение количества колебаний бета-ритма к общему количеству колебаний в условных единицах (c.u.). *p < 0.05 – достоверность отличий индекса бета-ритма в правой лобной области спустя 2 ч после стресса по сравнению с фоновыми значениями. Остальные обозначения те же, что и на рис. 1.
Показано достоверное изменение медленноволновой активности коры больших полушарий мозга самок крыс после переживания ситуации угрозы жизни (рис. 3, 4). Достоверное повышение индекс ритма в диапазоне тета-активности регистрируется вправой лобной и обеих затылочных областях коры мозга через 2 ч после стресса (рис. 3b–d). Эти изменения биоэлектрической активности коры мозга нивелируются у стрессированных животных в раннем отдаленном периоде.
Рис. 3.
Показатели индекса ритма в диапазоне тета-частот у самок крыс, переживших витальный стресс. Индекс тета-ритма в левой фронтальной области (a), в правой фронтальной области – (b), в левой затылочной области – (с), в правой затылочной части – (d). По оси ординат – соотношение количества колебаний тета-ритма к общему количеству колебаний в условных единицах (c.u.). ** – достоверность отличий индекса тета-ритма правой лобной области по сравнению с фоновыми показателям и спустя 2 ч после стресса (p < 0.01). *** – достоверность отличий индекса тета-ритма правой затылочной области на третьи сутки после стресса по сравнению с фоновыми значениями (p < 0.001). Остальные обозначения те же, что и на рис. 1.
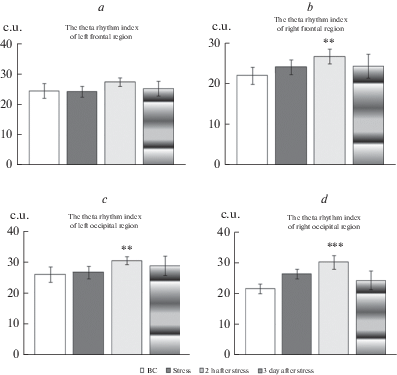
Рис. 4.
Показатели индекса ритма в диапазоне дельта-частот у самок крыс, переживших витальный стресс. По оси ординат – соотношение количества колебаний дельта-ритма к общему количеству колебаний, выраженное в условных единицах (c.u.). Индекс дельта-ритма в левой фронтальной области (a), в правой фронтальной области – (b), в левой затылочной области – (с), в правой затылочной части – (d). Остальные обозначения те же, что и на рис. 1.
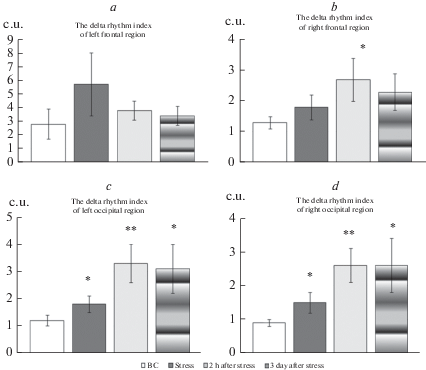
Достоверное повышение индекса дельта-ритма зарегистрировано непосредственно во время нанесения психотравмирующего воздействия, в момент переживания витального стресса в левой и правой затылочной области (рис. 4). Через 2 ч после стресса выявлено достоверное повышение индекса дельта-активности в правой лобной и обеих затылочных областях коры головного мозга крыс, а на 3-и сутки и в обеих затылочных областях (рис. 4).
Нами выявлено изменение уровня асимметрии между левым и правым полушарием по ЭКоГ-показателям в лобной и затылочной области коры больших полушарий после психогенной травмы (табл. 1).
Таблица 1.
Коэффициенты асимметрии индекса ЭКоГ ритмов в диапазоне альфа-, бета-, тета- и дельта-частот самок крыс, переживших стресс
| Коэффициент ассиметрии индекса альфа-ритма, % | Коэффициент ассиметрии индекса бета-ритма, % | Коэффициент ассиметрии индекса тета-ритма, % | Коэффициент ассиметрии индекса дельта-ритма, % | |||||
|---|---|---|---|---|---|---|---|---|
| лобная область | затылочная область | лобная область | затылочная область | лобная область | затылочная область | лобная область | затылочная область | |
| Фон | 2.6 | 1.2 | 7.9 | 15.9 | 10.2 | 16.2 | 53.6 | 25.0 |
| Стресс | 7.4↑* | 0.2 | 7.5 | 12.7 | 0.8↓** | 12.1 | 68.4↑* | 16.7↓* |
| 2 ч после стресса | 0.3 | 1.4 | 5.4 | 1.3↓** | 2.5↓** | 10.6↓* | 28.9↓* | 21.2 |
| 3-и сутки после стресса | 0.5 | 1.1 | 5.7 | 14.1 | 3.9↓** | 14.9 | 32.3↓* | 16.1↓* |
Примечание: Фон – контрольные показатели индекса ритмов до нанесения психотравмы; стресс – коэффициент ассиметрии индекса ритмов в момент угрозы жизни; 2 ч после стресса – спустя 2 ч после нанесения психотравмы; 3-и сутки после стресса – показатели на 3-и сутки после воздействия; ↓ – снижение асимметрии, ↑ – усиление асимметрии, * – достоверные отличия показателей по сравнению с фоновыми значениями (p < 0.05), ** – достоверные отличия по сравнению с фоновыми значениями (p < 0.01). Данные представлены в %.
Для животных до переживания психотравмирующего события было свойственно наличие выраженной асимметрии показателей индекса дельта-ритма в лобной и затылочной областях коры, а также индекса бета- и тета-ритмов преимущественно в затылочной коре (табл. 1).
В момент нанесения психогенной травмы (“стресс”) наблюдалось достоверное увеличение асимметрии индекса альфа- и дельта-ритмов в лобной области коры, снижение асимметриииндекса тета-активности в лобной коре, а дельта-ритма в затылочной части по сравнению с фоновыми значениями (табл. 1).
Через 2 ч после стресса регистрировалось достоверное снижение асимметрии индекса бета-активности в затылочной области, тета-активности в обеих областях коры полушарий головного мозга, а также дельта-ритма в лобной части коры. Усиление асимметрии индекса дельта-активности наблюдалось только в затылке по сравнению с контролем (табл. 1).
Достоверные изменения асимметрии ЭКоГ показателей спустя 3-е суток после психогенной травмы фиксировались в лобной и затылочной областях коры мозга и проявлялись в виде снижения асимметрии индекса тета- и дельта-активности по сравнению с фоном (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Переживание эмоционального стресса приводит к изменению функционального состояния организма, вызывая нарушение активности сердечно-сосудистой, дыхательной системы, психомоторных реакций и отражается как на поведенческом, так и молекулярно-биохимическом уровнях. Ранее нами было показано, что психогенная травма у крыс вызывает эмоциональные реакции в виде страха, ужаса, проявляющиеся в виде “примерзания”, застывания, их неспособности к передвижению с последующими изменениями в поведении, характерными для ПТСР у человека [2], одним из типичных проявлений которого являются многократное повторное переживание травматических событий в форме навязчивых воспоминаний в дневное время, снов или кошмаров по ночам [10]. Вопрос возможных маркеров изнуряющих воспоминаний при ПТСР, в зарубежной литературе именуемых “флэш-бэков”, в настоящее время широко обсуждается. Существенная роль отводится показателям ЭЭГ в оценке тяжести ПТСР [11].
Результаты наших исследований показали изменение биоэлектрической активности мозга крыс при переживании витального стресса в момент нанесения психотравмирующего воздействия, а также в ранний отдаленный период, которое может отражать нарушение функционального состояния ЦНС. На сегодняшний день в имеющейся литературе выявлена корреляция нейропсихологических нарушений при ПТСР с изменением параметров ЭЭГ [12–14]. Необходимо отметить, что вопрос изменения биоэлектрической активности мозга при переживании витального стресса остается малоизученным. Исследований, анализирующих изменение индекса ритмов, выявление асимметрии ЭКоГ-показателей при переживании ситуации, связанной с угрозой жизни, до настоящего времени не проводилось.
Данное исследование выполнено на самках крыс без учета фазы эстрального цикла. Тем не менее, нейроэндокринные взаимодействия играют ключевую роль в патогенезе психоневрологических нарушений, вызванных витальным стрессом, а гормональный статус особей выступает с одной стороны как индикатор выраженности функциональных расстройств, а с другой стороны служит маркером группы риска ПТСР. Исходя из поставленных задач, наше исследование не было направлено на определение роли гормонального фактора в патогенезе посттравматического стрессового расстройства. Важным в данном эксперименте представлялся поиск способа объективизации чувства ужаса, страха при переживании ситуации угрозы собственной жизни у крыс (момента захвата, удушения и заглатывания сородича хищником), фиксации переживаемого страха животным вне зависимости от нахождения в той или иной фазе эстрального цикла и оценке развертывания программы ПТСР в ранний отдаленный период.
Нами показано, что переживание ситуации угрозы жизни самками крыс проявляется увеличением индекса дельта-ритма в затылочной области коры непосредственно в момент нанесения психотравмирующего воздействия. Данный ЭКоГ параметр, на наш взгляд, может характеризовать степень страха и являться объективным показателем переживаемого чувства ужаса при психогенном стрессе. Сохраняющийся до 3-х суток высокий уровень индекса ритма у стрессированных крыс в диапазоне дельта-активности может свидетельствовать о выраженном аверсивном характере психотравмирующего воздействия. По данным литературы усиление дельта-активности свидетельствует о состоянии отчаяния/безнадежности, ангедонии, что является одним из проявлений ПТСР и коррелирует с изменениями в центральной префронтальной извилине уровня серотонина (5-HT) и нейропептида Y (NPY) в базолатеральном ядре и амигдале у крыс [5]. Кроме того, выявлена корреляция дельта-ритма и вегетативной активности организма (вариабельностью сердечного ритма), уровнем секреции кортизола [15], который повышается при стрессе. Переживание ситуации гибели сородича от действий хищника является мотивационной ситуацией, связанной с опасностью, и сопровождается усилением дельта-активности, что согласуется с данными литературы [16, 17].
Результаты исследования показывают, что наиболее выраженные изменения биоэлектрической активности у самок крыс наблюдаются спустя 2 ч после психогенной травмы. Уровень дельта-активности остается выше, чем фоновые значения и сопровождается усилением еще и тета-ритма в правой лобной и обоих затылочных отделах коры головного мозга. В исследованиях на грызунах в модели социального стресса поражения также отмечено повышение медленноволновой активности в острый период стресса. Активация медленноволновой активности во фронтальной области коры может быть связана с комплексной стимуляцией гиппокампальных и экстрагиппокампальных регионов, в том числе гипоталамуса [18–20]. Интересно отметить, что данный ритм у крыс регистрируется во время исследовательского поведения, которое включает различные типы движения, обнюхивание и ориентацию в пространстве [21]. Показано, что у грызунов тета-ритм гиппокампа сильно коррелирует с поведением [22]. Состояние неподвижности (поза при ожидании угрозы) и автоматические типы движения, таких как мигание глаз, груминг, связаны с нерегулярной гиппокампальной активностью. Небольшие движения, такие как изменения позы или изолированное движение головой или конечностью, связаны с ритмической активностью тета-ритма уменьшенной амплитуды и сниженной средней частотой [23]. Результаты наших предыдущих исследований указывали на измененное поведение крыс при переживании ситуации угрозы жизни, возможно, усиление именно тета-ритма свидетельствует о формировании условно-рефлекторной реакции страха, обусловленной синхронизацией тета-активности в нейронах миндалины и гиппокампа, служащей для улучшения нейрональной связи во время извлечения памятного следа [24]. Однако в актуализации аффективной памяти страха участие тета-ритма маловероятно.
Наряду с изменением медленноволновой активности нами было зарегистрировано угнетение альфа- и бета-ритмов. Результаты нашего исследования выявили достоверное падение индекса альфа-ритма в правой лобной области и в обеих затылочных областях только через 2 ч после психотравмирующего события. В задних отделах полушария, как правило, ритм доминирует в норме в состоянии бодрствования. Угнетение альфа-ритма связывают с концентрацией внимания [25], а также участием в процессах избирательного торможения [26]. Вполне вероятно, что выявленное нами снижение активности альфа-ритма спустя двухчасовой интервал от момента переживания из-за гибели сородича от действий хищника, связано с консолидацией памяти, формированием памятного следа на психотравмирующее событие. Эти изменения могут затрагивать таламокортикальную систему, гиппокамп, ретикулярную формацию, обусловленные слуховыми и зрительными стимуляциями в момент нанесения психической травмы [27]. В некоторых исследованиях было установлено, что альфа-ритм подавляется при эмоциональных переживаниях [28], а смена его на дельта-ритм отражает развитие стрессовой реакции. В пользу утверждения о сильном эмоциональном переживании, страхе, ужасе свидетельствуют работы, показывающие подавление альфа-ритма при “страхе” и “горе” [29, 30].
Данные литературы показывают, что наиболее сильное увеличение мощности бета-ритма происходит при стрессе [31], в частности, при предъявлении больным объекта фобии происходит усиление бета-активности [32]. Однако результаты нашей работы обнаруживают противоположный эффект. Мы наблюдаем снижения бета-ритма в правой лобной и затылочной областях через 2 ч после стресса.
Преимущественные изменения ЭКоГ-показателей у самок крыс при витальном стрессе регистрировались в лобных и затылочных областях правого полушария, что отражает преобладание негативных эмоций при переживании ситуации угрозы жизни, поскольку именно правое полушарие вносит негативную окраску в эмоциональное восприятие окружающего мира [33]. В соответствии с взглядами Heller [34] можно предположить, что выявленная нами локализация фокуса изменений индекса ритмов в результате витального стресса в лобной области свидетельствует об активации системы реализации эмоциональных реакций на стресс, а изменения затылочной области является мобилизацией вегетативной нервной и гормональной (симпато-медуллярной) систем и вследствие этого реализацией последующей стратегии поведения (активной стратегии поведения) [35].
Важным аспектом работы, направленной на понимание механизмов возникновения ПТСР и других психических расстройств, является вопрос межполушарных взаимодействий. Ранее нами было показано, что выраженность поведенческих и электрофизиологических нарушений у крыс, переживших витальный стресс, в частности изменение пространственной организации ЭКоГ, зависит от межполушарной асимметрии [36]. Согласно литературным данным, при нейропсихологических нарушениях при ПТСР отмечается изменение асимметрии показателей альфа-ритма во фронтальной области коры [37]. Наши результаты согласуются с данными литературы, демонстрируя изменение асимметрии лобной коры по показателю индекса альфа-ритма, и отражают развитие патологических процессов в ЦНС при ПТСР.
В данной работе показано снижение межполушарной асимметрии по показателю индекса тета- и дельта-активности после витального стресса, которое мы связываем со снижением стрессоустойчивости организма к психотравмирующему воздействию, что подтверждается данными по выявлению степени асимметрии в результате влияния сильных или длительных раздражителей [38]. Напротив, данные, демонстрирующие усиление асимметрии индекса дельта-ритма в лобной области коры больших полушарий самок крыс в момент переживания ситуации захвата, удушения сородича хищником, связано, вероятно, с обеспечением реализации эмоционально-стрессовой реакции.
Таким образом, переживание ситуации угрозы жизни отражается в изменении ритмической структуры ЭКоГ, межполушарной асимметрии показателей индекса ритма в диапазоне альфа-, бета-, тета- и дельта-частот непосредственно при нанесении травмы и в раннем отдаленном периоде. Выраженный аверсивный характер витального стресса проявляется в повышенном уровне дельта-активности в затылочной области коры в момент переживания психотравмирующего события. По-видимому, наибольшее значение в последующем воспроизведении переживаемых обстоятельств гибели сородича играет дельта-активность, достоверные изменения которой регистрируются и в ранний посттравматический стрессовый период. Полученные данные позволяют установить вклад психоэмоционального переживания ситуации угрозы жизни в патогенез развития ПТСР и разработку методов коррекции данных состояний.
Список литературы
Никульчева НГ, Клюева НН, Парфёнова НС, Виноградова ТВ, Калашникова НМ, Белова ЕВ, Цикунов СГ (2016) Исследование влияния психогенного стресса на липидный обмен крыс-самцов в отдаленном периоде. Нейрокомпьютеры: разработка, применение 5: 56–58. [Nikulcheva NG, Kliueva NN, Parfenova NS, Vinogradova TV, Kalashnikova NM, Belova EV, TSikunov SG (2016) Investigation of the effect of psychogenic stress on the lipid metabolism of male rats in the long-term period. Neurocomputers: development, application 5: 56–58. (In Russ)].
Цикунов СГ, Пшеничная АГ, Клюева НН, Виноградова ТВ, Денисенко АД (2016) Витальный стресс вызывает длительные расстройства поведения и обмена липидов у самок крыс. Обзоры по клин фармакол и лекарств терапии 14(4): 32–41. [Tsikunov SG, Pshenichnaya AG, Klyueva NN, Vinogradova TV, Denisenko AD (2016) Vital stress causes long-lasting behavioral disorders and lipid metabolism deviations in female rats. Rev Clin Pharmacol Drug Therapy 14(4): 32–41. (In Russ)]. https://doi.org/10.17816/RCF14432-41
Bandelow B, Baldwin D, Abelli M, Bolea-Alamanac B, Bourin M, Chamberlain SR, Cinosi E, Davies S, Domschke K, Fineberg N, Grünblatt E, Jarema M, Kim Y-K, Maron E, Masdrakis V, Mikova O, Nutt D, Pallanti S, Pini S, Ströhle A, Thibaut F, Vaghi M, Won E, Wedekind D, Wichniak A, Woolley J, Zwanzger P, Riederer P (2017) Biological markers for anxiety disorders, OCD and PTSD: A consensus statement. Part II: Neurochemistry, neurophysiology and neurocognition. World J Biol Psychiatry 18(3): 162–214. https://doi.org/10.1080/15622975.2016.1190867
Пашков АА, Дахтин ИС, Харисова НС (2017) Электроэнцефалографические биомаркеры экспериментально индуцированного стресса. Вестник ЮУрГУ. Сер Психология 10(4): 68–82. [Pashkov AA, Dahtin IS, Harisova NS (2017) Electroencephalographic biomarkers of experimentally induced stress. Bull SUSU. Ser Psychology 10(4): 68–82. (In Russ)]. https://doi.org/10.14529/psy170407
Сысоев ЮИ, Пьянкова ВА, Крошкина КА, Карев ВЕ, Оковитый СВ (2020) Кросскорреляционный и когерентный анализ электрокортикограмм крыс, перенесших черепно-мозговую травму. Рос физиол журн им ИМ Сеченова 106(3): 315–328. [Sysoev JuI, P’jankova VA, Kroshkina KA, Karev VE, Okovityj SV (2020) (Cross-correlation and coherent analysis of electrocorticograms of rats with traumatic brain injury. Russ J Physiol 106(3): 315–328. (In Russ)]. https://doi.org/10.31857/S0869813920030085
Nedelcovych MT, Gould RW, Zhan X, Bubser M, Gong X, Grannan M, Thompson AT, Ivarsson M, Lindsley CW, Conn PJ, Jones CK (2015) A rodent model of traumatic stress induces lasting sleep and quantitative electroencephalographic disturbances. ACS Chem Neurosci 6(3): 485–493. https://doi.org/10.1021/cn500342u
Цикунов СГ (2015) Нейробиология витального стресса. Новые модели психической травмы и посттравматического стрессового расстройства. Обзоры по клин фармакол и лекарств терапии 13: 187–188. [Tsikunov SG (2015) Neurobiology of vital stress. New models of mental trauma and post-traumatic stress disorder. Rev Clin Pharmacol Drug Therapy 13: 187–188. (In Russ)].
Paxinos G, Watsone C (2006) The Rat Brain in Stereotaxic Coordinates. 6th Edition. Elsevier AcadPress. Amsterdam, Boston. eBookISBN: 9780080475158
Константинов КВ, Леонова МК, Мирошников ДБ, Клименко ВМ (2014) Особенности восприятия акустического образа собственной биоэлектрической активности головного мозга. Рос физиол журн им ИМ Сеченова 100(6): 710–721. [Konstantinov KV, Leonova MK, Miroshnikov DB, Klimenko VM (2014) Specifics of perception of acoustic image of intrinsic bioelectric brain activity. Russ J Physiol 100(6): 710–721. (In Russ)].
Kirkpatrick HA, Heller GM (2014) Post-Traumatic Stress Disorder: Theory and Treatment Update. Int J Psychiatry in Med 47(4): 337–346. https://doi.org/10.2190/PM.47.4.h
Lobo I, Portugal LC, Figueira I, Volchan E, David I, Garcia Pereira M, de Oliveira L (2015) EEG correlates of the severity of posttraumatic stress symptoms: A systematic review of the dimensional PTSD literature. J Affect Disord 183: 210–220. https://doi.org/10.1016/j.jad.2015.05.015
Шадрина ИВ, Дедова КН, Пугачёв АН (2011) Нейрофизиологические особенности работы головного мозга (по результатам анализа показателей ЭЭГ) и их влияние на психологические характеристики у пациентов с посттравматическим стрессовым расстройством. Вестник ЮУрГУ. Серия: Образование, здравоохранение, физическая культура 7(224): 84–86. [Shadrina IV, Dedova KN, Pugachjov AN (2011) Neurophysiological features of the brain (based on the results of the analysis of EEG indicators) and their effect on psychological characteristics in patients with post-traumatic stress disorder. Bull SUSU. Series: Education, Health Care, Physical Education 7(224): 84–86. (In Russ)].
Набиев РГ, Кондратьева ОГ, Шибкова ДЗ (2015) Изменения функционального состояния центральной нервной системы при формировании посттравматического стрессового расстройства. Совр пробл науки и образов 3: 595–602. [Nabiev RG, Kondrat’eva OG, Shibkova DZ, (2015) Changes in the functional state of the central nervous system during the formation of post-traumatic stress disorder. Modern Problems Sci and Educat 3: 595–602. (In Russ)].
Апраксина НК, Авалиани ТВ, Цикунов СГ (2018) Динамика ЭКОГ – показателей самок крыс во время и после витального стресса. Обзоры по клин фармакол и лекарств терапии 16(1): 14–15. [Apraksina NK, Avaliani TV, Cikunov SG (2018) Dynamics of ECOG indicators of female rats during and after vital stress. Rev Clin Pharmacol Drug Therapy 16 (1): 14–15. (In Russ)].
Gronfier C, Simon C, Piquard F, Ehrhart J, Brandenberger G (1999) Neuroendocrine processes underlying ultradian sleep regulation in man. Clin Endocrinol Metab 84(8): 2686–2690. https://doi.org/10.1210/jcem.84.8.5893
Knyazev GG (2012) EEG delta oscillations as a correlate of basic homeostatic and motivational processes. Neurosci Biobehav Rev 36(1): 677–695. https://doi.org/10.1016/j.neubiorev.2011.10.002
Schutter D, van. Honk J (2004) Decoupling of midfrontal delta–beta oscillations after testosterone administration. Int J Psychophysiol 53(1): 71–73. https://doi.org/10.1016/j.ijpsycho.2003.12.012
Mitchell SJ, Ranck JB Jr (1980) (Generation of theta rhythm in medial entorhinal cortex of freely moving rats. Brain Res 189: 49–66. https://doi.org/10.1016/0006-8993(80)90006-2
Collins DR, Lang EJ, Pare D (1999) Spontaneous activity of the perirhinal cortex in behaving cats. Neuroscience 89: 1025–1039. https://doi.org/10.1016/S0306-4522(98)00396-0
Kahana MJ, Seelig D, Madsen JR (2001) Theta returns. Current Opinion Neurobiol 11(6): 739–744. https://doi.org/10.1016/S0959-4388(01)00278-1
Buzsaki G (2005) Theta rhythm of navigation: link between path integration and landmark navigation, episodic and semantic memory. Hippocampus 15(7): 827–840. https://doi.org/10.1002/hipo.20113
Young CK, McNaughton N (2009) Coupling of theta oscillations between anterior and posterior midline cortex and with the hippocampus in freely behaving rats. Cerebral Cortex 19(1): 24. https://doi.org/10.1093/cercor/bhn055
Vanderwolf CH (1969) Hippocampal electrical activity and voluntary movement in the rat. Electroencephalogr Clin Neurophysiol 26(4): 407–418. https://doi.org/10.1016/0013-4694(69)90092-3
Seidenbecher T, Laxmi TR, Stork O, Pape HC (2003) Amygdalar and hippocampal theta rhythm synchronization during fear memory retrieval. Science 301: 846–850. https://doi.org/10.1126/science.1085818
Babiloni C, Miniussib C, Babilonia F, Carduccia F, Cincottia F, Del Percioa C, Sirelloa G, Fracassib C, Nobred AC, Rossinib PM (2004) Sub-second “temporal attention” modulates alpha rhythms. A high-resolution EEG study. Cognit Brain Res 19(3): 259–268. https://doi.org/10.1016/j.cogbrainres.2003.12.010
Klimesch W, Sauseng P, Hanslmayr S (2007) EEG alpha oscillations: the inhibition–timing hypothesis. Brain Res Rev 53(1): 63–68. https://doi.org/10.1016/j.brainresrev.2006.06.003
Гнездицкий ВВ, Куликова СН, Кошурникова ЕЕ (2009) Особенности ЭЭГ и Р300 в оценке когнитивных нарушений. Функциональная диагностика. Неврология 3: 43–49. [Gnezdickij VV., Kulikova SN, Koshurnikova EE (2009) Features of EEG and P300 in the assessment of cognitive impairment. Functional diagnostics. Neurology 3: 43–49. (In Russ)].
Спиридонова МД (2013) Особенности спектров мощности ЭЭГ при переживании чувства страха. Молодой ученый 8: 130–132. [Spiridonova MD (2013) Features of EEG power spectra when experiencing a feeling of fear. Young Scientist 8: 130–132. (In Russ)].
Лапин ИА, Алфимова МВ (2014) ЭЭГ-маркеры депрессивных состояний. Социальная и клиническая психиатрия 24(4): 81–89. [Lapin IA, Alfimova MV (2014) EEG markers of depressive states. Social and Clin Psychiatry 24(4): 81–89. (In Russ)].
Данько СГ, Бехтерева НП, Шемякина НВ, Антонова ЛВ (2003) Электроэнцефалографические корреляты мысленного переживания эмоциональных личных и сценических ситуаций. Сообщение II. Характеристики пространственной синхронизации. Физиология человека 29(6): 685–693. [Dan’ko SG, Behtereva NP, Shemjakina NV, Antonova LV (2003) Electroencephalographic correlates of mental experience of emotional personal and stage situations. Message II. Characteristics of spatial synchronization. Human Physiology 29(6): 685–693. (In Russ)].
Ильюченок ИР (1996) Различия частотных характеристик ЭЭГ при восприятии положительно – эмоциональных, отрицательно-эмоциональных и нейтральных слов. Журн высш нервн деятельности 46 (3): 457–468. [Il’juchenok IR (1996) Differences in the frequency characteristics of the EEG in the perception of positive – emotional, negative-emotional and neutral words. J Higher Nerv Activity 46(3): 457–468. (In Russ)].
Хомская ЕД, Батова НЯ (1992) Мозг и эмоции (нейропсихологическое исследование). М. Изд-во МГУ. [Homskaja ED, Batova NJa (1992) Brain and Emotions (neuropsychological research). Moscow. MSU Publ House. (In Russ)].
Aftanas LI, Reva NV, Varlamov AA, Pavlov SV, Makhnev VP (2004) Analysis of evoked EEG synchronization and desynchronization in conditions of emotional activation in humans: temporal and topographic characteristics. Neurosci Behav Physiol 34(8): 859–867.
Heller W (1993) Neuropsychological mechanisms of individual differences in emotion, personality, and arousal. Neuropsychology 7(4): 476–489. https://doi.org/10.1037/0894-4105.7.4.476
Середенин СБ, Кожедуб РГ, Свидерская НЕ, Королькова ТА, Кожечкин СН, Коштоянц ОХ (2001) Особенности стресс-реакции у крыс с генетчески детерминированной эмоциональностью (по показателям ЭЭГ). Журнал высш нервн деятельности 5: 617–624. [Seredenin SB, KozhedubR.G., Sviderskaja NE, Korol’kova TA, Kozhechkin SN, Koshtojanc OH (2001) Features of stress reaction in rats with genetically determined emotionality (according to EEG indicators). J Higher Nerv Activity 5: 617–624. (In Russ)].
Авалиани ТВ, Константинов КВ, Быкова АВ, Апраксина НК, Цикунов СГ (2014) Коррекция функционального состояния самок крыс методом ЭЭГ-зависимого акустического воздействия в модели витального стресса. Нейрокомпьютеры: разработка, применение 7: 5–10. [Avaliani TV, Konstantinov KV, Bykova AV, Apraksina NK, Cikunov SG (2014) Correction of the functional state of female rats by the method of EEG-dependent acoustic exposure in the model of vital stress. Neurocomputers: Development, Application 7: 5–10. (In Russ)].
Maier SF, Watkins LR, Fleshner M (1994) Psychoneuroimmunology: the interface between behaviour, brain and immunity. Am Psychologist 49(12): 1004–1017. https://doi.org/10.1037/%2F0003-066x.49.12.1004
Русалова МН, Костюнина МБ (2000) Отражение в межполушарном распределении частотно-амплитудных показателей ЭЭГ силы эмоционального переживания, величины потребности и вероятности ее удовлетворения. Физиология человека 26(1): 32–39. [Rusalova MN, Kostjunina MB (2000) Reflection in the interhemispheric distribution of frequency-amplitude EEG indicators of the strength of emotional experience, the magnitude of the need and the probability of its satisfaction. Human Physiology 26(1): 32–39. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


