Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1542-1552
Роль активного фрагмента AgRР 25–51 в регуляции функциональной активности норадренергических нейронов locus coeruleus и в биосинтезе норадреналина
А. Л. Михрина 1, Л. О. Савельева 1, И. Ю. Морина 1, И. В. Романова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Российской академии наук
Санкт-Петербург, Россия
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 29.09.2021
После доработки 06.10.2021
Принята к публикации 11.10.2021
Аннотация
Результаты двойного флуоресцентного иммуномечения и конфокальной микроскопии демонстрируют локализацию непосредственно вокруг тел норадренергических (НА) нейронов locus coeruleus (LC) иммунопозитивных к AgRP (agouti gene related protein) отростков, присутствие в телах НА-нейронов меланокортиновых рецепторов 3-го, но не 4-го типа. Эти данные свидетельствует о возможности прямого влияния фрагмента AgRP 83–132 на НА-нейроны. В экспериментах на мышах C57BL/6J через 3 ч после введения в LC фрагмента AgRP 25–51, действие которого не связано с влиянием на G-белок-связанные меланокортиновые рецепторы, выявлен его тормозный эффект на НА-нейроны. С помощью иммуногистохимического метода на срезах мозга в нейронах LC не выявлено изменения уровня тирозингидроксилазы, фосфорилированной по серину-40, однако найдено достоверное уменьшение уровня тирозингидроксилазы, фосфорилированной по серину-31, и уровня дофамин-β-гидроксилазы. Данные ПЦР в реальном времени демонстрируют, что после введения AgRP 25–51 наблюдается достоверное уменьшение уровня мРНК тирозингидроксилазы, уровня мРНК норадреналин-транспортера и уровня мРНК GAD65/67 – ферментов биосинтеза гаммааминомасляной кислоты. Результаты высокоэффективной жидкостной хроматографии демонстрируют, что после введения AgRP 25–51 в LC в стриатуме и орбито-фронтальном кортексе – основных мишенях НА-нейронов LC, наблюдается уменьшение и уровня НА. В статье обсуждаются механизмы взаимодействия меланокортиновой системы с НА-нейронами LC.
Норадреналин (НА) – важнейший нейромедиатор мозга – вовлечен в регуляцию различных его функций, таких как: пробуждение, внимание, рабочая память, обработка сенсорной информации и патогенез многих заболеваний (депрессия, биполярное расстройство, нейродегенеративные и др.) [1–3].
Этапы биосинтеза НА хорошо изучены. В НА-эргических нейронах сначала из L-тирозина осуществляется синтез дофамина с помощью двух ферментов: тирозингидроксилазы (ТH) и ДОФА-декарбоксилазы. Затем в этих же клетках из дофамина образуется НА благодаря работе фермента дофамин-β-гидроксилазы (DBH). Таким образом, биосинтез НА зависит от трех ферментов (в отличие от дофамина, синтез которого осуществляется с помощью двух ферментов). При этом ТH – скорость лимитирующий фермент биосинтеза всех катехоламинов, он экспрессируется в клетках, но его активность определяется фосфорилированием по остаткам серина (8, 19, 31 и 40), связанных с различными внутриклеточными посредниками [4]. Основной путь активации ТH – фосфорилирование по серину-40, которое зависит от G-белок-опосредованных механизмов внутриклеточной сигнализации, в частности, от протеинкиназы А. Остальные пути фосфорилирования приводят к гораздо меньшей активации, при этом в фосфорилировании серина-31 участвует ERK 1/2 модуль MAPK-киназного каскада и Cdk5 киназа–G-белок-независимые механизмы [4]. Таким образом, биосинтез НА зависит от экспрессии и активации ТH, определяющих уровень дофамина, который является субстратом для образования НА, а также от уровня DBH в клетке.
НА-эргические нейроны локализованы в структурах ствола мозга. Согласно классификации, предложенной в 1984 г. [5]. НА-нейроны расположены в областях А1–А7. Самая крупная группа (А6) – голубое пятно (locus coeruleus – LC), посылает проекции к нейросекреторным центрам гипоталамуса, в стриатум, обонятельные бугорки, орбитофронтальные отделы коры больших полушарий и др. Таким образом, механизмы, вовлеченные в регуляцию НА-нейронов LC, оказывают влияние и на перечисленные структуры мозга и, соответственно, их функции.
Агути-подобный пептид (AgRP – agouti related peptide/agouti gene related peptide) обнаружен более 20 лет назад [6]. В мозге обильная экспрессия молекулы-предшественника AgRP выявлена в нейронах аркуатного ядра гипоталамуса, а иммунопозитивные к AgRP отростки выявлены в различных областях мозга крысы, в частности, в структурах, где расположены тела дофаминергических нейронов и рядом с НА-эргическими [7]. Однако какие-либо исследования о влиянии AgRP на НА-нейроны нам не известны. Следует отметить тот факт, что в исследованиях, проведенных на мышах [8], не показано присутствие AgRP-иммунопозитивных отростков в НА-формациях мозга.
Было показано, что в ходе посттрансляционных изменений из молекулы-предшественника образуется три активных фрагмента AgRP: 25–51, 54–82 и 83–132 [9]. Только фрагмент AgRP 83–132 способен связываться с меланокортиновыми рецепторами 3-го и 4-го типов (МСR3/4) [10]. Функциональное значение этого фрагмента связывают с регуляцией пищевого поведения как эндогенного антагониста этих G-белок-связанных рецепторов. Блокирование в гипоталамусе МCR3 и МCR4 приводило к активации аппетита и изменению энергетического баланса организма [11]. Также в литературе обсуждается вопрос о том, что AgRP 83–132 может оказывать свои эффекты независимо от меланокортиновых пептидов, действуя как обратный агонист MCR3 [12, 13]. В экспериментах in vivo и in vitro было показано, что AgRP 83–132 оказывает тормозный эффект на уровень ТН и ее активность в нейронах среднего мозга, что приводило к уменьшению биосинтеза дофамина в стриатуме [14, 15]. Фрагменты AgRP 25–51 и 54–82 также обладают биологической активностью. В частности, после введения фрагмента AgRP 25–51 в вентральную тегментарную область (ventral tegmental area – VTA) в нейронах VTA было выявлено уменьшение фосфорилированной формы ТН по серину-31 (рТН31) и уменьшение уровня дофамина в вентральном стриатуме, куда приходят проекции нейронов VTA [15]. Эти эффекты AgRP на биосинтез дофамина могут быть связаны с влиянием фрагмента 25–51 на G-белок-независимые механизмы. Какие-либо исследования о влиянии этого фрагмента на НА-нейроны нам не известны.
Цель настоящей работы – исследовать возможность и механизмы влияния AgRP, в частности активного фрагмента AgRP 25–51, на системы биосинтеза НА, а также оценить уровень НА в стриатуме и орбитофронтальной коре – областях мозга, куда приходят основные проекции от НА-нейронов LC после введения фрагмента AgRP 25–51 в LC.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на половозрелых самках мышей С57Bl/6J (20–22 г) одной фазы овариального цикла. Все эксперименты проводили в соответствии с требованиями Этического комитета Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, European Communities Council Directive 1986 (2010/63/EEC) и правилам, изложенным в “Guide for the Care and Use of Laboratory Animals”. Эксперименты проводили в утренние часы (10–13 ч), перед началом каждого эксперимента животных наркотизировали внутрибрюшинно хлоралгидратом (400 мг/кг).
Для иммуногистохимических исследований с использованием флуоресцентных меток мышей (n = 3) подвергали транскардиальной перфузии мозга с помощью перфузионного насоса: сначала пропускали 50 мл 0.1 М натрий-фосфатного буфера (PBS, рН 7.4), потом 100 мл свежеприготовленного 4%-ного раствора параформальдегида, растворенного в PBS. Мозг дофиксировали в течение ночи в том же фиксаторе (4°С), промывали в PBS, погружали на 3-е суток (при 4°С) в 30%-ный раствор сахарозы, растворенной в PBS, замораживали с помощью изопентана (Sigma, США) при – 42°С и хранили при – 80°С до проведения исследований.
Для инъекций пептида мышей фиксировали в стереотаксисе для мелких животных (СЭЖ-5, Россия). Для введения были использованы стереотаксические координаты (AP = 5.5 мм; L = 1 мм, V = 3.5 мм от брегма) согласно атласу мозга мыши [16]. С помощью шприца Гамильтона билатерально были проведены инъекции 0.6 нмоль AgRP 25–51 (PhoenixPeptide Inc., США) в объеме 0.5 мкл (n = 7). Время каждой инъекции составило 5 мин. Контрольным мышам (n = 7) вводили соответствующие объемы стерильного 0.9%-ного раствора NaCl, который также был использован для растворения пептида. Через 3 ч после второго введения мышей декапитировали, мозг извлекали и подготавливали для обработки различными методами. Из мозга во фронтальной плоскости вырезали область, содержащую LC, которую по средней линии делили на две половины. Одну для иммуногистохимических исследований погружали в свежеприготовленный раствор 4%-ного параформальдегида на 3 суток при 4°С; вторую половину замораживали в сухом льду для выделения общей РНК. Ткань стриатума и орбитофронтальной коры быстро замораживали в сухом льду, гомогенизировали в 4-х кратном объеме холодной 0.1 М перхлорной кислоты, центрифугировали 10 мин (12 000 g при 4°С); надосадок замораживали (–80°С) и в дальнейшем использовали для анализа НА методом обращеннофазной высокоэффективной жидкостной хроматографии (ВЭЖХ) с электрохимической детекцией на хроматографе Beckman Coulter (США) [17], как описано ранее [15]; результаты ВЭЖХ представлены в процентах относительно контрольного (100%) уровня.
Следует отметить, что контроль попадания инъекции над областью LC оценивали визуально для ткани, которую анализировали с помощью ПЦР, и на срезах мозга при проведении иммуногистохимических исследований.
Для иммуногистохимических исследований фиксированную ткань промывали в PBS (pH 7.4) и после криопротекции при 4°С в 30%-ном растворе сахарозы, разведенной на PBS, замораживали c помощью изопентана при –42°С и хранили при ‒80°С. С помощью криостата (Leiсa СМ-1510, Германия) из области мозга, где локализован LC, были изготовлены чередующиеся серии фронтальных срезов толщиной 16 мкм, каждый пятый срез монтировали на стекла SuperFrost/plus (Menzel, Германия). Стекла высушивали и после демаскировки антигена кипячением в цитратном буфере (рН 6.0) использовали для иммуногистохимических реакций, протокол которых ранее подробно описан [15].
Для двойного флуоресцентного иммуномечения срезы инкубировали 48 ч (при 4°С) в смеси первичных моноклональных антител мыши к ТH (Sigma, США) в разведении 1 : 2000 с поликлональными антителами кролика к AgRP 83–132 (PhoenixPeptide Inc., 1 : 500), или кролика к МСR3 (Sigma, США; 1 : 500), или кролика к МCR4 (PhoenixPeptide Inc.; 1 : 200). Также для реакций была использована смесь первичных моноклональных антител мыши к двум формам глутаматдекарбоксилазы (GAD) – ферментам биосинтеза ГАМК – GAD65 (Abcam, Великобритания; 1 : 1000) и GAD67 (Invitrogen, США; 1 : 1000) с теми же антителами кролика к МCR3 (1 : 500) или к МCR4 (1 : 200). Для визуализации реакции была использована смесь соответствующих вторичных антител, конъюгированных с различными флуорохромами: осла против Ig мыши-Alexa-568 и цыпленка против Ig кролика-Alexa-488 (Invitrogen, США) в разведении 1 : 1000. После промывки в буфере стекла со срезами заключали под покровное стекло с помощью среды Мовиол (Sigma-Aldrich, США) и хранили при 4°C до ее полимеризации.
Для одиночного иммуномечения использовали первичные антитела кролика к фосфорилированной ТH по серину-40 (рТН40, Millipore, США; 1 : 2000), или кролика к фосфорилированной ТH по серину-31 (pTH31, Genetex, США; 1 : 500) или кролика к DBH (Abcam, Великобритания; 1 : 500). После тщательной промывки срезы инкубировали 1 ч при комнатной температуре со вторичными Ig козы против кролика, конъюгированными с биотином (VectorLabs., Великобритания; 1 : 300). Стекла промывали и наносили на них раствор комплекса стрептавидин-пероксидаза (Sigma, США; 1 : 1000). Визуализацию проводили с помощью 0.05%-ного диаминобензидина (Sigma, США) с 0.015% перекиси водорода. Реакцию останавливали дистиллированной водой и после стандартной гистологической обработки срезы заключали под покровное стекло с помощью прозрачной среды Bio Maunt (Bio-optica, Италия). Специфичность всех иммуногистохимических реакций проверяли с помощью негативного контроля (реакции без первичных и без вторичных антител).
Анализ срезов с флуоресцентным иммуномечением проводили с помощью микроскопа DMI6000 и лазерной сканирующей конфокальной установки TCS SP5-II (Leiсa Microsystems, Германия). Последовательное сканирование проводили с помощью иммерсионного объектива х63, лазеров с длиной волны возбуждения 488 и 568 нм. Изображения анализировали с помощью пакета программ Leica LAS AF.
Изображения LC с одиночным иммуномечением получали c помощью микроскопа Carl Zeiss Axio A1 (Германия) со встроенной телевизионной камерой и программы Axio-Vision 4.8. Для каждой иммуногистохимической реакции было сделано 8–10 снимков. С помощью программы Image J на каждом из снимков в нейронах была определена оптическая плотность (ОП) pTH40, pTH31 или DBH в условных единицах (у. е.).
Для оценки экспрессии генов использовали количественную ПЦР в реальном времени. Тотальную РНК выделяли с помощью TRI-reagent (Invitrogen, США) согласно инструкции производителя. Для приготовления обратной транскрипции (ОТ) использовали 1 мкг РНК и набор фирмы Синтол (Россия). Амплификацию проводили в растворе (общий объем 25 мкл), который содержал 10 нг ОТ-продукта, 0.4 мкМ прямого и обратного праймеров и реакционную смесь qPCRmix-HS SYBR+LowROX (Евроген, Россия), согласно инструкции производителя. ПЦР в реальном времени проводили по стандартному протоколу (Applied BioSystems, США), как описано ранее [18]. Каждый цикл реакции (всего 40 циклов) состоял из четырех этапов: предварительная денатурация 5 мин при 95°С, денатурация 40 с при 95°С, отжиг с праймерами в течение 30 с при 57°С, стадия наращивания продукта 35 с при 75°С. Так как для детекции продукции был использован интеркалирующий краситель SYBR Green, то на последнем этапе цикла делали кривую плавления конечного продукта реакции 40 мин при 95 и 57°С. В качестве негативного контроля для обратной транскрипции служили пробы с мРНК, но без фермента обратной транскриптазы, а для контроля самой ПЦР служили пробы с праймером, но без продукта обратной транскрипции. Амплификационный сигнал детектировали с помощью прибора 7500 Real-Time PCR System (Life Technologies, Thermo Fisher Scientific Inc., США) в 96-луночных планшетах (3 раза для каждой пробы).
Для реакций использовали прямой (forvard – F) и обратный (revers – R) праймеры, синтезированные фирмой Евроген (Россия), характеристики которых представлены в табл. 1.
Таблица 1.
Последовательность использованных в работе праймеров мыши
| Ген | Положение | Последовательность | NCBI номер |
|---|---|---|---|
| Тh | F | TCTCAGAGCAGGATACCAAGCA | NM_009377.2 |
| R | GCATCCTCGATGAGACTCTGC | ||
| Dbh | F | CTTCCCCCGACACCACATCATCA | NM_013556.2 |
| R | CCGGTCAACAAAGGCAGTCTCC | ||
| Slc6a2 | F | CCATACCAAATACTCCAAATACAAG | NM_009209.3 |
| R | CGTGAAGAGTTTCCGGTGTCGCTT | ||
| Gad65 | F | TCAACTAAGTCCCACCCTAAG | NM_008078.2 |
| R | CCCTGTAGAGTCAATACCTGC | ||
| Gad67 | F | CTCAGGCTGTATGTCAGATGTTC | NM_008077.4 |
| R | AAGCGAGTCACAGAGATTGGTC | ||
| Hprt1 | F | AGCCGACCGGTTCTGTCAT | KR817915 |
| R | GGTCATAACCTGGTTCATCATCAC | ||
| 18s | F | GGGAGCCTGAGAAACGGC | NR_003278.3 |
| R | GGGTCGGGAGTGGGTAATTT |
В качестве референсных генов использовали ген Hprt1, кодирующий гипоксантин-гуанин фосфорибозилтрансферазу-1 и ген 18s рибосомальной РНК. Количественный анализ относительного уровня мРНК проводили с помощью метода delta-delta Ct. Результаты обрабатывали с помощью программ 7500 Software v.2.0.6 и Expression Suite Software v.1.0.3.
Статистический анализ результатов ВЭЖХ проведен с помощью однофакторного дисперсионного анализа (ANOVA), иммуногистохимических исследований и ПЦР – с помощью парного двухвыборочного t-критерия для независимых выборок при уровне значимости р < 0.05 в пакете программ STATISTICA.10. Результаты представлены как среднее ± стандартная ошибка и в процентах по сравнению с соответствующим контрольным уровнем.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ двойного флуоресцентного иммуномечения в LC демонстрирует локализацию AgRP-иммунопозитивных отростков непосредственно вокруг тел ТН-иммунопозитивных нейронов (рис. 1a), локализацию МCR3 как в телах ТН-иммунопозитивных клеток, а также и ТН-иммунонегативных клеток (рис. 1b). При этом в ТН-иммунопозитивных клетках не выявлено МCR4, однако MCR4 выявлялись в ТН-иммунонегативных клетках в этой области. Результаты анализа двойного иммуномечения свидетельствует о локализации МCR3 (рис. 2a) и МCR4 (рис. 2b) в телах GAD65/67-иммунопозитивных клеток, локализованных вокруг НА-нейронов LC.
Рис. 1.
Двойное флуоресцентное иммуномечение тирозингидроксилазы (красный, Alexa-568) c AgRp (зеленый, Alexa-488, a) или MCR3 (зеленый, Alexa-488, b). Обозначения: сплошные стрелки указывают на тела НА-нейронов (a) или локализацию MCR3 в них (b), пунктирные стрелки – на AgRP-иммунопозитивные отростки (a), фигурные стрелки – MCR3 в тирозингидроксилаза-иммунонегативных структурах (b). Масштаб 20 мкм.
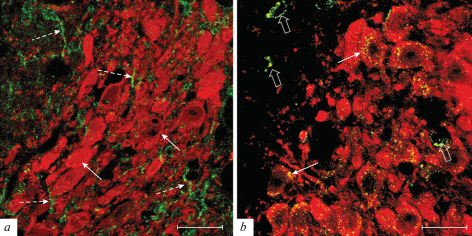
Рис. 2.
Двойное флуоресцентное иммуномечение меланокортиновых рецепторов (зеленый, Alexa-488) MCR3 (a) или MCR4 (b) и GAD65/67 (красный, Alexa-568) в locus coeruleus мыши. Обозначения: звездочки – место локализации ядра, стрелки указывают на колокализацию (желтое свечение) MCR3 (a) или MCR4 (b) в GAD-иммунопозитивных нейронах. Масштаб 20 мкм.

Анализ оптической плотности pТН40 в нейронах LC после введения AgRP 25–51 свидетельствует об отсутствии достоверных изменений по сравнению с уровнем в контрольной группе (0.52 ± 0.01 и 0.55 ± 0.02 у. е. соответственно), рис. 3.
Рис. 3.
Количественный анализ оптической плотности фосфорилированных по серину-40 и серину-31 форм тирозингидроксилазы (pTH40, pTH31) и дофамин-β-гидроксилазы (DBH) в нейронах locus coeruleus. * – достоверность отличий от контроля (р < 0.05), a. u. – условные единицы.

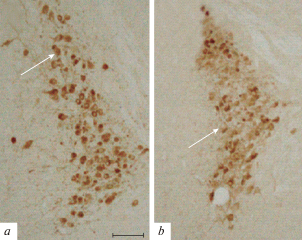
Анализ оптической плотности pTH31 в нейронах LC после введения AgRP 25–51 свидетельствует об уменьшении ее уровня по сравнению с контрольным на 47%, p < 0.05 (соответственно 0.14 ± 0.01 и 0.26 ± 0.03 у. е.), рис. 3, 4.
Рис. 4.
Иммуногистохимическая реакция к фосфорилированной по серину-31 форме тирозингидроксилазы (pTH31) в locus coeruleus мыши в контроле (a) и после введения фрагмента AgRP 25–51 (b). Обозначения: стрелки указывают на тела иммунопозитивных нейронов. Масштаб 50 мкм.
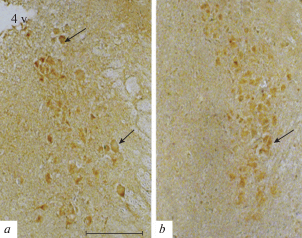
Анализ оптической плотности DBH в нейронах LC показал, что после введения AgRP 25–51 ее уровень был ниже (на 62%, р < 0.05) по сравнению с контрольным (соответственно 0.11 ± 0.01 и 0.30 ± 0.01 у.е.) рис. 3, 5.
Рис. 5.
Иммуногистохимическая реакция к дофамин-β-гидроксилазе в locus coeruleus мыши в контроле (a) и после введения фрагмента AgRP 25–51 (b). Обозначения: 4v – полость четвертого желудочка мозга, стрелки указывают на тела иммунопозитивных нейронов. Масштаб 100 мкм.
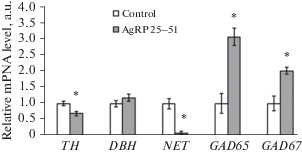
Результаты ПЦР в реальном времени демонстрируют (рис. 6), что после введения AgRP 25–51 в области LC происходит уменьшение уровня мРНК ТН (на 32%, р < 0.05), при этом не наблюдается достоверных изменений уровня мРНК DBH, а уровень мРНК NET снижается (на 93%, р < 0.05) по сравнению с соответствующим контрольным уровнем. В этом эксперименте также выявлено увеличение мРНК GAD65 (в 3 раза, р < 0.05) и GAD67 (в 2 раза, р < 0.05).
Рис. 6.
Анализ относительного уровня мРНК тирозингидроксилазы (ТН), дофамин-β-гидроксилазы (DBH), мембранного транспортера норадреналина (NET), глутаматдекарбоксилазы 65 и 67 (GAD65 и GAD67) в области locus coeruleus после введения фрагмента AgRP 25–51. * – достоверность отличий от контроля (р < 0.05), a.u. – условные единицы.
Результаты ВЭЖХ демонстрируют, что после введения в LC AgRP 25–51 в стриатуме наблюдается снижение уровня HA (на 54%, p < 0.05), в области орбитофронтальной коры не выявлено достоверных изменений (наблюдается уменьшение уровня НА на 15%, p > 0.05) по сравнению с контрольным уровнем.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Представленные результаты демонстрируют присутствие AgRP-иммунопозитивных отростков вокруг ТН-иммунопозитивных клеток LC мыши. В данном случае TH является маркером НА-нейронов, в которых локализованы MCR3 (рис. 1b), но не MCR4. При этом как MCR3, так и MCR4 выявлены в TH-иммунонегативных структурах, в частности GAD-иммунопозитивных, расположенных рядом с НА-нейронами (рис. 2a, b). Эти данные свидетельствуют о возможности как прямого влияния фрагмента AgRP 83–132 на функциональную активности НА-нейронов через связывание с MC3R, так и опосредованно, через ГАМК-нейроны, блокируя в них MCR3/MCR4. Этот эффект, очевидно, препятствует стимулирующему влиянию меланокортинов через эти метаботропные рецепторы, активирующие цАМФ, и приводит к снижению функциональной активности нейронов.
Из терминалей AgRPергических отростков вместе с фрагментом 83–132 в эквивалентных количествах выделяется и фрагмент 25–51 [9]. В настоящем эксперименте in vivo результаты анализа оптической плотности pTH31 и DBH демонстрируют тормозное влияние фрагмента AgRP 25–51 на активность НА-нейронов LC, которое может осуществляется через G-белок-независимые пути внутриклеточной сигнализации (МАРК-сигнальный путь). Не было выявлено достоверных изменений уровня рТН40 после введения фрагмента AgRP 25–51, что подтверждает данные об отсутствии у этого фрагмента сродства к MCR [19].
Результаты ПЦР демонстрируют, что после введения фрагмента AgRP 25–51 в области, где локализованы НА-нейроны LC наблюдается уменьшение уровня мРНК ТН и мембранного транспортера НА (NET) – регулятора обратного захвата НА, что свидетельствует о тормозном влиянии фрагмента 25–51 на системы биосинтеза НА. При этом достоверных изменений уровня мРНК DBH не выявлено, что противоречит результатам анализа уровня этого фермента в клетках (рис. 6). Следует учитывать, что с помощью иммуногистохимии уровень белка оценивали непосредственно в телах НА-нейронов, а с помощью ПЦР мы анализировали ткань, содержащую не только тела нейронов LC, но и расположенные рядом отростки НА-нейронов, также содержащие мРНК DBH. При этом в ткани вокруг LC могут располагаться не только НА-ергические отростки нейронов LC, но и проекции от других НА-групп, в частности от ядра одиночного тракта [20], в котором, по-видимому, уровень экспрессии DBH компенсаторно может возрастать при снижении функциональной активности НА-нейронов LC.
Представленные данные, демонстрирующие уменьшение уровня непосредственно НА в стриатуме, подтверждают результаты об уменьшении функциональной активности систем биосинтеза НА в LC и тормозный эффект на них фрагмента AgRP 25–51. При этом в ткани орбитофронтальной коры не выявлено статистически достоверных изменений уровня НА. Можно лишь предположить, что тормозный эффект может быть достигнут через более длительный промежуток времени.
После введения фрагмента AgRP 25–51 на фоне снижения активности систем биосинтеза НА в LC (мРНК ТН и NET, белков рТН31 и DBH) нами получены данные, демонстрирующие увеличение уровня мРНК GAD65 и 67 (ферментов биосинтеза ГАМК) в области LC. В связи с этим можно предположить возможность как прямого влияния AgRP 25–51 не только на НА-нейроны, но и на нейроны другой эргичности, а также и то, что подобный эффект может быть связан с нарушением взаимосвязей НА–ГАМК, что, однако, требует дальнейшего исследования.
Ранее нами были получены данные о тормозном влиянии AgRP 25–51 на функциональную активность дофаминергических нейронов [15]. Представленные в настоящем исследовании результаты впервые свидетельствуют о возможности тормозного эффекта этого фрагмента и на НА-нейроны, что расширяет представления о механизмах регуляции функциональной активности НА-нейронов мозга и функциональной роли AgRP.
Список литературы
Ramos BP, Arnsten AF (2007) Adrenergic Pharmacology and Cognition: Focus on the Prefrontal Cortex. Pharmacol Ther 113(3): 523–536. https://doi.org/10.1016/j.pharmthera.2006.11.006
Reader TA (1978) The effects of dopamine, noradrenaline and serotonin in the visual cortex of the cat. Cell Molec Life Sci 34(12): 1586–1588. https://doi.org/10.1007/BF02034690
Seung-Hee L, Yang D (2012) Neuromodulation of Brain States. Neuron 76(1): 209–222. https://doi.org/10.1016/j.neuron.2012.09.012
Daubner SC, Le T, Wang S (2011) Tyrosine hydroxylase and regulation of dopamine synthesis. Arch Biochem Biophys 508(1): 1–12. https://doi.org/10.1016/j.abb.2010.12.017
Moore RY, Card JP (1984) Noradrenaline-containing neuron systems. In: Handbook of chemical neuroanatomy. Classical transmitters in the CNS. Eds Björklund A, Hökfelt T (Eds) Elsevier. Amsterdam 2 (I): 123–156.
Ollmann MM, Wilson BD, Yang YK, Kerns JA, Chen Y, Gantz I, Barsh GS (1997) Antagonism of central melanocortin receptors in vitro and in vivo by agouti-related protein. Science 278: 135–138. https://doi.org/10.1126/science.278.5335.135
Bagnol D, Lu XY, Kaelin CB, Day HE, Ollmann M, Gantz I, Akil H, Barsh GS, Watson SJ (1999) Anatomy of an Endogenous Antagonist: Relationship between Agouti-Related Protein and Proopiomelanocortin in Brain. J Neurosci 19: 1–7. https://doi.org/10.1523/JNEUROSCI.19-18-j0004.1999
Wang D, He X, Zhao Z, Feng Q, Lin R, Sun Y, Ding T, Xu F, Luo M, Zhan C (2015) Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Front Neuroanat 9: Article 40. doi: . eCollection 2015https://doi.org/10.3389/fnana.2015.00040
Creemers JW, Pritchard LE, Gyte A, Le Rouzic P, Meulemans S, Wardlaw SL, Zhu X, Steiner DF, Davies N, Armstrong D, Luckman SM, Schmitz CA, Rick AD, Brennand JC, White A, Lawrence CB (2006) Agouti-related protein is posttranslationally cleaved by proprotein convertase 1 to generate agouti-related protein (AGRP) 83–132: interaction between AGRP83–132 and melanocortin receptors cannot be influenced by syndecan-3. Endocrinology 147(4): 1621–1631. https://doi.org/10.1210/en.2005-1373
Cone RD (2005) Anatomy and regulation of the central melanocortin system. Nat Neurosci 8 (5): 571–578. https://doi.org/10.1038/nn1455
Lee M, Wardlaw SL (2007) The central melanocortin system and the regulation of energy balance. Front Biosci 12: 3994–4010. https://doi.org/10.2741/2366
Tolle V, Low MJ (2008) In vivo evidence for inverse agonism of Agouti-related peptide in the central nervous system of proopiomelanocortin-deficient mice. Diabetes 57 (1): 86–94. https://doi.org/10.2337/db07-0733
Goto K, Inui A, Takimoto Y, Yuzuriha H, Asakawa A, Kawamura Y, Tsuji H, Takahara Y, Takeyama C, Katsuura G, Kasuga M (2003) Acute intracerebroventricular administration of carboxyl-terminal fragments of agouti-related peptide produces a long-term decrease in energy expenditure in rats. Int J Mol Med 12: 379–383. https://doi.org/10.3892/ijmm.12.3.379
Mikhrina AL, Romanova IV (2015) A role of AGRP in regulating dopaminergic neurons in the brain. Neurosci Behav Physiol 45 (5): 536–541. https://doi.org/10.1007/s11055-015-0107-7
Mikhrina AL, Saveleva LO, Alekseeva OS, Romanova IV (2020) Effects of Active Fragments AgRP 83–132 and 25–51 on Dopamine Biosynthesis in the Brain. Neurosci Behav Physiol 50 (3): 367–373. https://doi.org/10.1007/s11055-020-00908-z
Paxinos G, Franklin KBJ (2001) The mouse brain in stereotaxic coordinates. Int Standard Book Number: 0-12-547636-1. Eds Press. CD-ROM. http://www.academicpress.com
Krasnova IN, Bychkov ER, Lioudyno VI, Zubareva OE, Dambinova SA (2000) Intracerebroventricular administration of substance P increases dopamine content in the brain of 6-hydrodopamine lesioned rats. Neuroscience 95(1): 113–117. https://doi.org/10.1016/s0306-4522(99)00400-5
Romanova IV, Derkach KV, Mikhrina AL, Sukhov IB, Mikhailova EV, Shpakov AO (2018) The Leptin, Dopamine and Serotonin Receptors in Hypothalamic POMC-Neurons of Normal and Obese Rodents. Neurochem Res 43(4): 821–837. https://doi.org/10.1007/s11064-018-2485-z
Pritchard LE, White A (2005) Agouti-related protein: more than a melanocortin-4 receptor antagonist? Peptides 26 (10): 1759–1770. https://doi.org/10.1016/j.peptides.2004.11.036
Aston-Jones G (2004) Locus Coeruleus, A5 and A7 Noradrenergic Cell Groups. In: The rat nervous system. Elsevier. Third Edition. USA. 11: 259–294.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


