Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 2, стр. 187-202
Влияние однократной нормобарической гипоксии у крыс в возрасте 10 дней на сенсомоторное развитие и поведение животных
Д. Д. Хухарева 1, Ю. А. Суханова 1, Е. А. Себенцова 2, Н. Г. Левицкая 1, 2, *
1 Биологический факультет МГУ им. М.В. Ломоносова
Москва, Россия
2 Институт молекулярной генетики РАН
Москва, Россия
* E-mail: nglevitskaya@gmail.com
Поступила в редакцию 20.08.2020
После доработки 07.11.2020
Принята к публикации 24.11.2020
Аннотация
Гипоксия плода или новорожденного является одной из основных причин неонатальной смертности и вызывает долговременные нарушения моторных и когнитивных функций. Целью представленной работы явилось изучение эффектов однократной нормобарической гипоксии у крыс в возрасте 10 дней (модель доношенной беременности человека). Самцов и самок крыс линии Вистар подвергали гипоксическому воздействию длительностью 2 ч при содержании кислорода 8%. Контрольные животные содержались в тех же условиях при нормальном содержании кислорода. С 11-го по 35-й день жизни оценивали уровень физического и моторного развития, двигательную и исследовательскую активность, уровень тревожности. Уровень летальности при использованном воздействии составил 21.1%. У крыс обоего пола отмечалось замедление прироста массы тела и нарушение воспроизведения моторных рефлексов. Нарушения координации движений и способности поддерживать равновесие были зарегистрированы у самцов, но не самок крыс, перенесших неонатальную гипоксию. У самок крыс аделесцентного возраста, подвергавшихся гипоксии, отмечалось увеличение тревожности в тесте приподнятый крестообразный лабиринт. Полученные результаты свидетельствуют о гендер-зависимом характере эффектов неонатальной гипоксии. Использованную методику можно рассматривать в качестве модели гипоксического повреждения мозга доношенных новорожденных.
Гипоксия плода или новорожденного является одной из основных причин неонатальной смертности, вызывает повреждения ЦНС и нарушает нормальное развитие мозга, что приводит к долговременным нарушениям моторных и когнитивных функций [1, 2]. Перинатальная гипоксия (ПГ) может приводить в дальнейшем к развитию детского церебрального паралича, синдрома дефицита внимания и гиперактивности, аутизма, эпилепсии и целого ряда когнитивных расстройств [2, 3]. Морфологические и функциональные нарушения, вызванные ПГ, зависят от степени доношенности ребенка [4–6]. ПГ регистрируется более чем у 60% недоношенных новорожденных и приводит к уменьшению объема полушарий мозга, увеличению желудочков и повреждениям белого вещества [6]. У доношенных новорожденных ПГ отмечается реже (2–4 случая на 1000 новорожденных), но сопровождается высоким уровнем летальности [7]. При этой патологии наблюдаются повреждения как белого, так и серого вещества головного мозга [6]. Клинические исследования также свидетельствуют о зависимости последствий ПГ от пола ребенка. У мальчиков, перенесших гипоксию, выше уровень неонатальной смертности и более выражены отдаленные последствия ПГ по сравнению с девочками [5, 6]. Высокий уровень заболеваемости и тяжелые неврологические последствия определяют актуальность поиска эффективных стратегий профилактики и минимизации отдаленных эффектов гипоксии как у доношенных, так и недоношенных новорожденных с различной тяжестью повреждения мозга [8].
Последствия перинатальной гипоксии активно исследуются в экспериментах на животных, главным образом, на грызунах. При этом необходимо учитывать, что многие важнейшие этапы развития мозга у грызунов происходят в раннем постнатальном периоде. Анализ гистологического и функционального созревания мозга позволил сопоставить мозг крысы в течение первой недели жизни с мозгом недоношенного новорожденного, а в возрасте 10–12 дней – с мозгом доношенного новорожденного ребенка [9]. Для исследования эффектов ПГ на грызунах применяется ряд экспериментальных моделей. Наиболее широко используемой является модель Rice–Vannucci, разработанная в начале 1980-х годов. Эта модель гипоксии/ишемии включает в себя комбинацию односторонней перевязки общей сонной артерии у 7-дневного детеныша крысы с последующим помещением животного в условия пониженного содержания кислорода [10]. Уровень зрелости ЦНС 7-дневного детеныша крысы сопоставим с 32–34-недельным эмбрионом или с недоношенным новорожденным. Для моделирования гипоксии новорожденных с высокой степенью недоношенности грызунов подвергали гипоксии на 3-й постнатальный день (ПНД) [5]. Недостатком модели Rice–Vannucci является необходимость хирургического воздействия и наркоза, а также фокальный характер повреждения мозга [1]. Для моделирования ПГ у грызунов используют также гипоксическое воздействие без ишемии. Проведенные исследования свидетельствуют о наличии гистологических [11, 12], функциональных и поведенческих изменений у грызунов, вызванных однократным неонатальным гипоксическим воздействием [1, 13, 14]. Ранее нами было проведено исследование эффектов однократной нормобарической гипоксии (ОНГ, 8% О2, 2 ч) на 2-й день жизни крыс и мышей как модели умеренного гипоксического повреждения мозга недоношенных новорожденных. Нами были выявлены зависимые от пола эффекты гипоксии на уровне транскрипционной активности генов, содержания нейротрофина и прооксидантного-антиоксидантного баланса, а также нарушения сенсомоторного развития, поведения и когнитивных функций у крыс и мышей, перенесших ОНГ на 2-й день жизни [15–17].
Целью представленной работы явилось изучение последствий однократной нормобарической гипоксии на 10-й день жизни крыс. Для оценки неврологических последствий такого воздействия было изучено влияние гипоксии на физическое и моторное развитие крыс, а также на уровень тревожности и исследовательское поведение животных в адолесцентый период. В работе были использованы самцы и самки крыс, что позволило выявить гендер-зависимый характер эффектов гипоксии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах линии Вистар обоего пола. Всего в работе было использовано 70 крыс из 7 выводков. Животных содержали в стандартных условиях вивария с соблюдением 12-часового светового режима и со свободным доступом к воде и пище. Условия содержания и экспериментальные процедуры одобрены Комиссией по биоэтике МГУ имени М.В. Ломоносова (протокол № 97ж от 30.10.2019). Исследование проведено с соблюдением биоэтических норм обращения с экспериментальными животными в соответствии с требованиями Директивы 2010/63/EU Европейского Парламента от 22.09.2010.
День рождения крысят принимали за нулевой день жизни. На десятый постнатальный день (10 ПНД) животных взвешивали, маркировали, затем каждый выводок делили на 2 группы. Крыс одной группы (n = 38, 20 самцов и 18 самок) на 10-й ПНД изымали из гнезда и на 2 ч помещали в термостатируемую камеру (37°С), в которую подавали газовую смесь (8% О2 и 92% N2) (группа гипоксия). Остальных животных (n = 32, 15 самцов и 17 самок) не подвергали воздействию гипоксии, также изымали из гнезда и помещали в аналогичные условия при нормоксии (21% О2) (группа контроль). Детеныши каждого выводка вместе с матерью содержались в отдельной клетке до достижения ими месячного возраста. Регистрировали массу тела животных и возраст открытия глаз. Анализировали изменения массы тела относительно исходных значений (10-й ПНД, до сеанса гипоксии).
Уровень психомоторного развития крыс оценивали при помощи стандартных тестов [18]. Рефлекс отрицательного геотаксиса – крысенка помещали на наклонную поверхность (45°) длиной 30 см головой в направлении склона. Регистрировали латентный период поворота, т.е. время, за которое животное поворачивается на 180°, а также время достижения верхнего края склона. Максимальное время наблюдения 120 с. Если в течение максимального периода наблюдения крыса не выполняла задачу, то это время принимали за время выполнения реакции. Выполнение рефлекса оценивали 2 раза – в возрасте 11 и 12 дней. Рефлекс ползания – крысенка помещали в центр окружности диаметром 13 см и регистрировали время, через которое животное всеми четырьмя лапами окажется вне круга. Максимальное время наблюдения составляло 120 с. Выполнение задачи оценивали 2 раза – в возрасте 11 и 13 дней. Уровень физической выносливости крысят оценивали в тесте горизонтальный стержень (с 18-го по 22-й ПНД ежедневно). При тестировании крысят помещали на неподвижный деревянный стержень диаметром 5 мм, укрепленный на высоте 20 см над поверхностью. Регистрировали время удержания на стержне. Для выявления нарушений равновесия и координации движений использовали тест вращающийся стержень (Rota Rod, Columbus Instrument, США). На 23-й ПНД животных адаптировали к установке. Для этого каждую крысу 3 раза с интервалом в 5 мин помещали на равномерно вращающийся (4 об/мин) горизонтальный цилиндр диаметром 7 см. Длительность каждой попытки не превышала 30 с. Регистрировали число животных, успешно выполнивших задачу (удержавшихся на стержне в течение 30 с). На следующий день крысу помещали на стержень, вращающийся с равномерным ускорением (исходная скорость вращения – 4 об/мин, ускорение – 0.2 об/мин c). Регистрировали время удержания на стержне. Максимальное время тестирования составляло 2 мин.
Оценку уровня двигательной и исследовательской активности проводили в тесте Открытое поле (ОП) в возрасте 30 ПНД. Экспериментальная установка (НПК Открытая Наука, Россия) представляет собой круглую арену (диаметр 97 см, высота стенок 42 см). Пол установки поделен на 19 сегментов двумя окружностями и шестью диаметрами. Эксперимент проводился в тишине и при красном освещении. Животное помещали в центр арены и в течение 2 мин регистрировали следующие показатели: длину пробега (количество пересеченных сегментов), число стоек (подъемов на задние лапы) и выходов в центр поля.
Оценку уровня тревожности на 31-й ПНД крыс проводили в тесте Приподнятый крестообразный лабиринт (ПКЛ). Экспериментальная камера лабиринта (НПК Открытая Наука, Россия) состояла из четырех расходящихся из центра рукавов (длина рукавов – 50 см, ширина – 15 см, высота стенок – 30 см). Два противоположных рукава были затемнены и закрыты стенками с торцов; два других − ярко освещены и открыты. Лабиринт устанавливался на высоте 55 см от пола. Крысу помещали в центр лабиринта и в течение 3-х мин регистрировали время нахождения на открытых рукавах лабиринта, количество выходов на открытые и закрытые рукава, число стоек и свешиваний с открытых рукавов. Вычисляли процент времени, проведенного на открытых рукавах от общего времени тестирования, и процент выходов на открытые рукава от суммарного числа выходов.
При статистической обработке данных использовали пакет программ Statistica 10. Оценку нормальности распределения выборок проводили с использованием критерия Колмогорова–Смирнова. Распределение всех выборок соответствовало нормальному (p > 0.20), что позволило применить дисперсионный анализ (ANOVA). Использовали двухфакторный ANOVA для факторов “гипоксия” (нормоксия/гипоксия) и “пол” (самцы/самки). Для оценки динамических показателей (изменение массы тела и показатели сенсомоторного развития) применяли трехфакторный ANOVA (факторы “гипоксия” и “пол”) с повторными измерениями (фактор “возраст”/“день тестирования”). При отсутствии значимого эффекта фактора “пол” и значимого взаимодействия между факторами, сравнивали результаты, полученные на всей выборке крыс. В случае статистически значимого эффекта факторов или их взаимодействия для дальнейшей оценки различий между группами при post-hoc анализе использовали критерий Fisher LSD. Для сравнения долевых показателей (уровень летальности; процент крыс, удержавшихся на вращающемся стержне) был использован тест сравнения пропорций (differences between proportions). Различия между группами считали статистически значимыми при p < 0.05. Данные на рисунках и в таблице представлены в виде среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Во время 2-часового гипоксического воздействия умерло 8 крысят (21.1% по всей выборке животных). В подгруппе самцов уровень летальности составил 28.6%, в подгруппе самок – 11.8%, однако статистически значимых отличий по этому показателю между самцами и самками зарегистрировано не было (p = 0.23, тест сравнения пропорций). У выживших животных наблюдался выраженный цианоз, о чем свидетельствовало посинение кожных покровов. В контрольной группе в ходе эксперимента выжили все крысы.
Оценка уровня физического и моторного развития
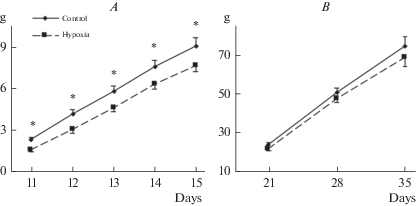
Не было выявлено статистически значимых отличий между группами животных по возрасту открытия глаз и исходной массе тела на 10-й ПНД (до сеанса гипоксии) (табл. 1). Трехфакторный ANOVA с повторными измерениями показал статистически значимое влияние фактора “возраст” (F8,464 = 1059.6; p < 0.001) на изменение массы тела крыс в течение периода регистрации (10–35-й ПНД). Не было зарегистрировано значимого влияния фактора “пол” (F1,58 < 0.001; p > 0.98), а также взаимодействие факторов “возраст” × “пол” (F1,58 = 1.65; p = 0.12), что позволило анализировать изменения массы тела по всей выборке животных (рис. 1). Применение трехфакторного ANOVA с повторными измерениями показало статистически значимое влияние фактора “гипоксия” на прирост массы тела крыс с 11-го до 15-го ПНД (F1,58 = 7.80; p < 0.01), при дальнейших измерениях (21–35-й ПНД) значимого влияния этого фактора (F1,58 = 0.40; p = 0.55) отмечено не было. Значимого взаимодействия факторов “возраст” х “гипоксия” зарегистрировано не было (F4,232 = 0.40; p = 0.80 и F2,116 = 0.10; p = 0.91, для возраста 11–15-й ПНД и 21–35-й ПНД соответственно). Последующий анализ показал значимое отставание по приросту массы тела в группе гипоксия с 11 по 15-й ПНД относительно контроля.
Таблица 1.
Показатели физического развития и поведения крыс в тесте Открытое поле в группах контроль и гипоксия Table 1. The parameters of physical development and behaviour of rats in the Open field test in the control and hypoxia groups
| Показатели Parameters |
Контроль Control (n = 32) |
Гипоксия Hypoxia (n = 30) |
Результаты 2-х факторного ANOVA 2-way ANOVA results |
||
|---|---|---|---|---|---|
| фактор “гипоксия” factor “hypoxia” F1,58 (p) |
фактор “пол” factor “sex” F1,58 (p) |
“гипоксия” × “пол” “hypoxia” × “sex” F1,58 (p) |
|||
| Масса тела до гипоксии (10 ПНД, г) (Body weight before hypoxia, 10 PND, g) |
17.7 ± 0.4 | 17.2 ± 0.4 | F = 0.28 (0.60) | F = 0.80 (0.38) | F = 0.06 (0.81) |
| Возраст открытия глаз (дни) Age of eye opening, day |
14.9 ± 0.2 | 15.1 ± 0.2 | F = 0.52 (0.48) | F = 0.01 (0.93) | F = 0.21 (0.65) |
| Тест Открытое поле (Open Field test) | |||||
| Число пересеченных сегментов The number of segment crosses |
44.8 ± 3.0 | 42.0 ± 2.6 | F = 0.50 (0.49) | F = 0.61 (0.44) | F = 0.66 (0.42) |
| Число стоек The number of rears |
8.2 ± 0.8 | 7.8 ± 1.0 | F = 0.10 (0.76) | F = 0.04 (0.85) | F = 0.42 (0.52) |
| Число выходов в центр арены The number of entries into arena center |
3.2 ± 0.4 | 3.2 ± 0.3 | F = 0.02 (0.92) | F = 0.001 (0.96) | F = 0.01 (0.94) |
Рис. 1.
Изменение массы тела крыс относительно исходных значений (10-й постнатальный день (ПНД), до сеанса гипоксии) с 11-го по 15-й ПНД (A) и с 21-го по 35-й ПНД (B) в группах контроль и гипоксия. По оси абсцисс – возраст крыс (дни), по оси ординат – изменение массы тела (g). Число крыс в группах: контроль – 32, гипоксия – 30. Значимые отличия от контроля отмечены * (p < 0.05). Fig. 1. Changes of body weight relative to the baseline values (10 postnatal day (PND), before hypoxic exposure) from 11 to 15 PND (A) and from 21 to 35 PND (B) in the control and hypoxia groups. The X-axis – the age of rats (days), the Y-axis – weight gain (g). The number of rats in control group – 32, in hypoxia group – 30. Significant differences vs control marked * (p < 0.05).
Тест Рефлекс отрицательного геотаксиса. Анализ полученных результатов при помощи трехфакторного ANOVA с повторными измерениями не выявил значимого влияния фактора “пол”, а также значимого взаимодействия факторов “пол” × “гипоксия” для латентного периода поворота (F1,58 = 0.52; p = 0.47 и F1,58 = 1.34; p = 0.25 соответственно) и времени достижения верхнего края склона (F1,58 = 0.39; p = 0.54 и F1,58 = 0.89; p = 0.35 соответственно). Это позволило представить данные, полученные по всей выборке животных. Для показателя латентного периода поворота ANOVA не выявил значимого влияния факторов “гипоксия” и “день тестирования” (F1,58 = 1.70; p = 0.20 и F1,58 = 0.91; p = 0.35), однако было зарегистрировано статистически значимое взаимодействие этих факторов (F1,58 = 4.01; p < 0.05).
Последующий анализ показал значимое увеличение латентного периода поворота в группе гипоксия по сравнению с контролем при первом тестировании (11-й ПНД) (рис. 2A). Для времени достижения края склона ANOVA показал статистически значимое влияние факторов “гипоксия” и “день тестирования” (F1,58 = 5.67; p = 0.02 и F1,58 = = 43.08; p < 0.0001 соответственно), а также взаимодействие этих факторов (F1,58 = = 4.13; p < 0.05). Последующий анализ выявил значимое превышение времени достижения края склона при первом тестировании (11-й ПНД) в группе гипоксия по сравнению с группой контроль. При повторном тестировании в обеих группах величина показателя была значимо ниже, чем на 11-й ПНД (рис. 2B).
Рис. 2.
Показатели становления моторных рефлексов в группах контроль и гипоксия. По оси абсцисс – дни тестирования, по оси ординат: А – латентный период поворота (s) и B – время достижения верхнего края склона (s) в тесте рефлекс отрицательного геотаксиса, C – время выполнения задачи в тесте рефлекс ползания (s). Число крыс в группах: контроль – 32, гипоксия – 30. Значимые отличия от контроля отмечены * (p < 0.05); от соответствующего показателя при первом тестировании – # (p < 0.05). Fig. 2. Parameters of motor reflexes maturation in the control and hypoxia groups. The X- axis – testing days, the Y-axis: A – latency to turn around (s) and B – time of reaching the top of the slope (s) in the test Negative Geotaxis, C – time for task performance in the Gait Reflex test (s). The number of rats in control group – 32, in hypoxia group – 30. Significant differences vs control marked * (p < 0.05), differences vs corresponding value at the first testing – # (p < 0.05).

Тест Рефлекс ползания. Анализ полученных результатов при помощи трехфакторного ANOVA с повторными измерениями не выявил значимого влияния фактора “пол”, также значимого взаимодействия факторов “пол” × “гипоксия” для времени выполнения задачи (F1,58 = 2.31; p = 0.18 и F1,58 = 0.70; p = 0.41 соответственно), что позволило представить данные, полученные по всей выборке животных. Также не было зарегистрировано влияния фактора “гипоксия” и взаимодействия факторов “гипоксия” × “день тестирования”. Отмечалось статистически значимое влияние фактора “день тестирования” (F1,58 = 23.24; p < 0.001). Post hoc анализ показал значимое снижение времени выполнения задачи при повторном тестировании относительно соответствующих значений на 11-й ПНД в обеих группах (рис. 2C).
Тест Горизонтальный стержень. Трехфакторный ANOVA с повторными измерениями не выявил значимого влияния фактора “гипоксия” (F1,58 = 0.19; p = 0.67), а также взаимодействия факторов “гипоксия” × “пол” (F1,58 = 0.01; p = 0.94) и “гипоксия” × “день тестирования” (F3,174 = 0.34; p = 0.80) для времени удержания на стержне. Отмечалось статистически значимое влияние факторов “пол” (F1,58 = 4.08; p < 0.05) и “день тестирования” (F3,174 = 83.85; p < 0.001), а также взаимодействие этих факторов (F3,174 = 4.13; p < 0.01). Дальнейший анализ показал, что во всех группах в ходе тестирования значимо увеличивалось время удержания на стержне (p < 0.01 относительно показателя при первом тестировании). В подгруппах самок при втором и третьем тестировании время удержания на стержне было статистически значимо меньше, чем в подгруппах самцов (рис. 3).
Рис. 3.
Изменение времени удержания на неподвижном горизонтальном стержне у самцов и самок крыс в группах контроль и гипоксия. По оси абсцисс – дни тестирования, по оси ординат – время удержания (s). Число самцов/самок крыс в группах: контроль – 15/17, гипоксия – 14/16. Значимые отличия от соответствующей подгруппы самцов отмечены & (p < 0.05). Fig. 3. Changes of the holding time on the fixed horizontal rod in the male and female rats from the control and hypoxia groups. The X-axis – testing days, the Y-axis – the holding time (s). The number of male/female rats in the control group – 15/17, in hypoxia group – 14/16. Significant differences vs corresponding male subgroup marked & (p < 0.05).
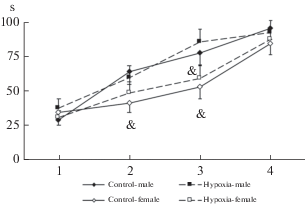
Тест вращающийся стержень. В первый день тестирования животных помещали на равномерно вращающийся стержень 3 раза. В ходе адаптации к установке доля крыс, успешно справившихся с задачей, увеличивалась во всех группах (рис. 4А). Однако при первых двух попытках величина этого показателя в группе крыс, перенесших гипоксию, была статистически значимо меньше, чем в контроле (p < 0.04, тест сравнения пропорций).
Рис. 4.
Показатели самцов и самок крыс в группах контроль и гипоксия в тесте вращающегося стержня (Rota Rod). A: по оси абсцисс – номер попытки, по оси ординат – процент крыс, удержавшихся на равномерно вращающемся стержне не менее 30 с. B – время удержания на стержне, вращающемся с ускорением (s). Число самцов/самок крыс в группах: контроль – 15/17, гипоксия – 14/16. Значимые отличия от соответствующего контроля отмечены * (p < 0.05). Fig. 4. The parameters of the male and female rats from the control and hypoxia groups in the Rota Rod test. A: the X-axis – the trial number, the Y-axis – the percentage of rats which hold on the rod revolving with constant speeds for more than 30 s. B: the Y-axis – the latency to fall from rod rotating with increasing speed (s). The number of male/female rats in the control group – 15/17, in hypoxia group – 14/16. Significant differences vs corresponding control marked * (p < 0.05).

Оценка способности крыс удерживаться на стержне, вращающемся с ускорением, не выявила значимого влияния факторов “гипоксия” (F1,58 = 0.85; p = 0.36) и “пол” (F1,58 = 0.18; p = 0.67) на время удержания, однако было зарегистрировано взаимодействие этих факторов на уровне тенденции (F1,58 = 3.79; p < 0.06). Дальнейший анализ показал, что время удержания на стержне в подгруппе самцов, перенесших гипоксию, статистически значимо меньше, чем в подгруппе контрольных самцов. В подгруппе самок отличий по этому показателю отмечено не было (рис. 4B).
Оценка поведения крыс
Тест открытое поле. В возрасте 30 ПНД оценивали поведение крыс в этом тесте. Двухфакторный ANOVA не выявил значимого влияния факторов “гипоксия” и “пол”, а также взаимодействия этих факторов для следующих показателей: величина пробега, число стоек и выходов в центр арены (табл. 1).
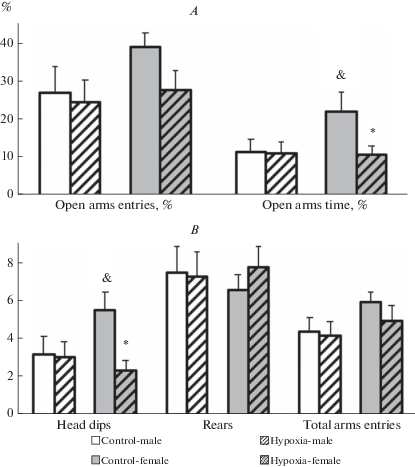
Тест приподнятый крестообразный лабиринт. В возрасте 31-го ПНД оценивали уровень тревожности крыс в тесте ПКЛ. Применение двухфакторного ANOVA показало значимое влияние фактора “гипоксия” (F1,55 = 4.41; p = 0.04), а также взаимодействие факторов “гипоксия” × “пол” на уровне тенденции (F1,55 = 3.57; p < 0.06) для количества свешиваний с открытых рукавов лабиринта. Значимого влияния фактора “пол” на величину этого показателя отмечено не было (F1,55 = 1.07; p = 0.31). Для времени, проведенного на открытых рукавах лабиринта, отмечалось влияние факторов “гипоксия” и “пол” на уровне тенденции (F1,55 = 3.56; p < 0.07 и F1,55 = 3.20; p < 0.08 соответственно), взаимодействия этих факторов не наблюдалось (F1,55 = 2.10; p = 0.15). Для остальных показателей поведения в ПКЛ (выходы на открытые рукава лабиринта, число стоек и суммарное число выходов на рукава) не было выявлено значимого влияния факторов “гипоксия” и “пол”, а также взаимодействия этих факторов (F1,55 < 2.00; p > 0.17). Дальнейший анализ показал статистически значимое снижение числа свешиваний и процента времени, проведенного на открытых рукавах лабиринта, в подгруппе самок, перенесших гипоксию, по сравнению с контрольными самками. В подгруппе самцов значимых отличий параметров поведения в ПКЛ между опытом и контролем отмечено не было. Однако число свешиваний и процент времени, проведенного на открытых рукавах лабиринта, в подгруппе контрольных самок статистически значимо превышали соответствующие показатели в подгруппе контрольных самцов (рис. 5).
Рис. 5.
Параметры поведения самцов и самок крыс в группах контроль и гипоксия в тесте Приподнятый крестообразный лабиринт. A – процент выходов на открытые рукава и процент времени, проведенного на открытых рукавах; B – число свешиваний, стоек и суммарное число выходов на рукава. Число самцов/самок крыс в группах: контроль – 15/17, гипоксия – 14/16. Значимые отличия от соответствующего контроля отмечены * (p < 0.05), от соответствующей подгруппы самцов – &. Fig. 5. Behavioural parameters of the male and female rats from the control and hypoxia groups in the Elevated Plus Maze test. A – the percentage of the number of open arm entries and the percentage of the time spent in the open arms; B – head dipping, rearing and total arms entries. The number of male/female rats in the control group – 15/17, in hypoxia group – 14/16. Significant differences vs corresponding control marked * (p < 0.05), differences vs corresponding male subgroup marked & (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения механизмов негативных эффектов перинатальной гипоксии и поиска способов их ослабления и предотвращения необходимы адекватные модели на животных. В представленной работе была использована модифицированная модель неонатальной гипоксии без ишемии (8% О2 в течение 2 ч) на крысах в возрасте 10 дней. По уровню зрелости мозг крысы в возрасте 10–12 дней сопоставим с мозгом доношенного новорожденного ребенка [9]. Поэтому использованную нами модель можно рассматривать в качестве модели острой гипоксии доношенных новорожденных [19, 20]. Ранее нами было проведено изучение острых и отставленных эффектов аналогичного воздействия на крыс и мышей в возрасте 2-го ПНД, модели гипоксии новорожденных с высокой степенью недоношенности [15–17].
В настоящей работе была зарегистрирована значительная неонатальная смертность крыс (21.1%). При этом уровень летальности в подгруппе самцов в 2.4 раза превышал соответствующий показатель в группе самок. Однако это отличие не было статистически значимым, что, вероятно, связано с недостаточной величиной выборки. Летальность при гипоксии на 10-й ПНД значительно превышала зарегистрированную нами ранее в модели ОНГ на 2-й день жизни крыс (от 4.5 до 10% в различных сериях экспериментов) [15, 16].
Согласно клиническим данным, перинатальная гипоксия является одной из основных причин перинатальной смертности [2, 14]. При гипоксии у доношенных новорожденных наблюдается более высокий уровень летальности, чем у недоношенных [6]. Показано, что уровень неонатальной смертности выше у мальчиков, перенесших перинатальную гипоксию, чем у девочек после аналогичного воздействия [5, 6].
Для оценки влияния ОНГ на 10-й день жизни на физическое развитие крысят регистрировали изменения массы тела, возраст открытия глаз и изучали становление моторных рефлексов. Одним из показателей уровня развития крыс является возраст открытия глаз. Оценка этого параметра в данном исследовании не выявила достоверных различий между группами животных. Ранее нами не было зарегистрировано изменения возраста открытия глаз у крыс и мышей, перенесших ОНГ на 2-й день жизни [15–17]. Большинство исследований эффектов перинатальной гипоксии также не выявило изменения этого показателя у самцов и самок грызунов в различных моделях острой гипоксии или гипоксии/ишемии [21, 22].
Нами было зарегистрировано замедление прироста массы тела в течение 5 дней после ОНГ у крыс обоего пола. Сравнение с эффектами ОНГ на 2-й день жизни крыс показало, что характер изменений массы тела определялся возрастом гипоксического воздействия. ОНГ на ранних стадиях развития приводила к замедлению прироста массы тела у самок, но не у самцов крыс в течение 2-х недель после воздействия [15].
Показателем развития потомства грызунов также является скорость созревания сенсорно-моторных рефлексов в период вскармливания. В данной работе было зарегистрировано нарушение выполнения рефлекса отрицательного геотаксиса на 11-й ПНД у самцов и самок крыс, перенесших гипоксию. Увеличение времени выполнения этого рефлекса указывает на нарушение взаимосвязи между экстероцептивными стимулами и локомоторным ответом [14]. Влияния на выполнение рефлекса ползания отмечено не было, что свидетельствует об отсутствии воздействия этого фактора на двигательную активность. Ранее нами было показано нарушение выполнения рефлекса переворота на плоскости (6-й ПНД) и отрицательного геотаксиса (12-й ПНД) у крыс, подвергавшихся ОНГ на 2-й день жизни; влияния на выполнение рефлекса ползания не наблюдалось [15, 16]. Полученные нами результаты согласуются с данными литературы. Замедление становления ранних моторных рефлексов таких, как рефлекс переворота и отрицательного геотаксиса зарегистрировано в различных моделях неонатальной гипоксии и гипоксии/ишемии [14, 22–24], при этом влияния на выполнение рефлекса ползания отмечено не было [22, 25]. Показано, что нарушения становления ранних рефлексов у грызунов коррелируют с долговременным функциональным и когнитивным дефицитом [23]. Согласно клиническим данным, у новорожденных, перенесших перинатальную гипоксию, нарушения ранних рефлексов (таких как рефлекс Моро, подошвенный, хватательный, сосательный рефлексы) являются высокопредиктивными для дальнейшего развития церебрального паралича и задержки умственного развития [24].
Для оценки влияния неонатальной гипоксии на физическую выносливость и координацию движений регистрировали время удержания на неподвижном и вращающемся стержнях. В случае неподвижного стержня в ходе 4-дневного тестирования (18–21-й ПНД) у крыс обеих групп время удержания увеличивалось, что свидетельствует об обучении моторной задаче. У самок возрастание этого показателя происходило медленнее, чем у самцов, но при последнем предъявлении значимых отличий между самцами и самками не наблюдалось. Нами не было выявлено изменения времени удержания на неподвижном стержне у крыс, перенесших гипоксию, что свидетельствует об отсутствии влияния на физическую выносливость. Ранее было исследовано влияние неонатальной гипоксии/ишемии (4-й ПНД) на способность к удержанию на горизонтальном стержне [26]. В работе было зарегистрировано снижение времени удержания на стержне у крыс с 5-го по 16-й ПНД, однако при дальнейших измерениях (17–21-й ПНД) отличий от контроля не наблюдалось, что согласуется с полученными нами данными. При оценке координации движений (тест Rota Rod) наблюдалось нарушение способности удерживаться на вращающемся стержне у крыс, перенесших гипоксию. Такое нарушение отмечалось как в случае равномерного вращения стержня, так и при вращении с ускорением. В первом случае эффект не зависел от пола животных, а во втором – нарушения наблюдались только в подгруппе самцов, перенесших гипоксию. Негативное влияние гипоксии на координацию движений в тесте Rota Rod отмечалось в модели гипоксии/ишемии у 7-дневных крыс, однако аналогичное воздействие у крыс 3-дневного возраста не влияло на выполнение задачи в этом тесте [4]. В модели неонатальной гипоксии без ишемии способность крыс к удержанию на вращающемся стержне ранее не исследовалась. Показано, что у животных наибольшие морфологические изменения, вызванные перинатальной гипоксией, наблюдались в зонах мозга, контролирующих движение, таких как кора, базальные ганглии, гиппокамп, мозжечок [27]. Такие изменения могут лежать в основе зарегистрированных нами нарушений моторных функций у крыс, перенесших ОНГ на 10-й день жизни. Клинические данные подтверждают связь повреждения базальных ганглиев и таламических структур у доношенных новорожденных, перенесших гипоксию, с моторными нарушениями, регистрируемыми в возрасте 7 лет [28].
Влияние ОНГ на исследовательское поведение и уровень тревожности животных изучали у крыс адолесцентного возраста. Оценка поведения крыс в тесте ОП на 30-й день жизни не выявила отличий между крысами, перенесшими гипоксию, и контролем. Ранее нами было показано увеличение двигательной активности в этом тесте у 30-дневных крыс, перенесших ОНГ на 2-й день жизни, что свидетельствовало о гиперактивности при помещении в новые условия [16]. Другими исследователями также отмечалась гиперактивность в ОП у крыс и мышей, перенесших гипоксию в 1–2-е дни жизни [14, 29]. Влияние ОНГ на 10-й день жизни крыс на поведение в ОП ранее не исследовалось. У взрослых крыс, перенесших гипоксию/ишемию на 7-й день жизни, отмечалась повышенная двигательная активность в тесте ОП [30, 31], однако в адолесцентном возрасте (3 недели) у животных, перенесших аналогичное воздействие, изменений поведения в ОП зарегистрировано не было [23]. Вероятно, эффекты неонатальной гипоксии на поведение в ОП определяются возрастом гипоксического воздействия и возрастом тестирования поведения грызунов.
В тесте ПКЛ нами было зарегистрировано снижение числа свешиваний и процента времени, проведенного на открытых рукавах лабиринта, в подгруппе самок, перенесших гипоксию, по сравнению с контрольными самками. При этом показатели, связанные с двигательной и исследовательской активностью (число стоек и суммарное число выходов на рукава), не изменялись. Полученные нами данные свидетельствуют о повышенном уровне тревожности у самок, перенесших гипоксию, по сравнению с контрольными самками. В подгруппе самцов, перенесших ОНГ, нами не было зарегистрировано изменения показателей тревожности и исследовательской активности относительно контроля, однако следует отметить более высокий уровень тревожности у контрольных самцов по сравнению с самками. Аналогичные половые отличия в поведении крыс в тесте ПКЛ были зарегистрированы ранее [32]. Вызванное гипоксией увеличение тревожности в ПКЛ может проявляться у самок на фоне невысокой фоновой тревожности, но не в случае самцов, исходная тревожность которых была достаточно высокой. Данные по влиянию перинатальной гипоксии на уровень тревожности грызунов крайне противоречивы. В модели гипоксии/ишемии (7-й ПНД) было показано увеличение тревожности у взрослых животных, при этом зависимости от пола отмечено не было [31]. В моделях перинатальной и неонатальной асфиксии (0–1-й ПНД) отмечалось как увеличение тревожности в ПКЛ у взрослых самцов крыс, перенесших гипоксию/ишемию [13, 33], так и отсутствие влияния такого воздействия на уровень тревожности в этом тесте [34]. Самки в этих исследованиях использованы не были. У животных, перенесших неонатальную гипоксию без ишемии на 10-й день жизни, поведение в ПКЛ ранее не исследовалось. Противоречивые результаты, полученные при изучении влияния перинатальной гипоксии на уровень тревожности животных, могут быть связаны с различиями в экспериментальных моделях гипоксии, разными сроками и условиями тестирования тревожности.
Проведенные нами исследования показали, что влияние неонатальной гипоксии на координацию движений и уровень тревожности зависит от пола животных. Результаты клинических исследований свидетельствуют о гендер-зависимом характере острых и отставленных эффектов перинатальной гипоксии [5, 6]. Однако в экспериментах на животных этот вопрос недостаточно изучен, существующие в литературе данные противоречивы, что определяется недостаточным количеством исследований, в которых учитывался пол животных [35].
Согласно клиническим данным, дети, перенесшие перинатальную гипоксию, характеризуются нарушением двигательных функций, сниженной способностью к обучению, невнимательностью, гиперактивностью, повышенной тревожностью и другими когнитивными нарушениями [2, 5]. Результаты, полученные в экспериментах на животных, также свидетельствуют о негативных эффектах перинатальной гипоксии [1–3, 14].
Вопрос о разработке адекватных моделей перинатальной гипоксии для дальнейшего изучения эффектов и поиска путей коррекции ее последствий до настоящего времени остается не решенным. Большинство биохимических и патофизиологических данных, связанных с последствиями перинатальной гипоксии у грызунов, получены с использованием модели гипоксии–ишемии Rice–Vannucci [1, 5, 10]. Гипоксии/ишемии подвергали животных в возрасте от 3-х до 7-ми дней [30, 35], что можно рассматривать как модель гипоксии новорожденных различной степени недоношенности [36, 37]. Неинвазивные модели гипоксии без ишемии используются реже, чем модель Rice–Vannucci, хотя их преимуществом является отсутствие травмирующего эффекта хирургической операции и наркоза. В моделях перинатальной [38] и неонатальной [13] асфиксии гипоксическому воздействию подвергаются животные в день родов или на 1–2-й постнатальный день, что соответствует новорожденным с высокой степенью недоношенности. Гипоксическое воздействие у крыс в 10-дневном возрасте было использовано для моделирования эпилепсии, при этом в ходе воздействия содержание кислорода в камере постепенно снижали с 7 до 1% в течение 15–25 мин до появления апноэ [39, 40]. В данной работе были исследованы изменения физического развития и поведения у крыс, перенесших однократную нормобарическую гипоксию (8% О2 в течение 2 ч) в возрасте 10-ти дней, когда по уровню созревания мозг крысы сопоставим с мозгом доношенного новорожденного [9]. Было показано, что использованное воздействие приводит к замедлению физического и моторного развития животных, нарушению координации движений и увеличению тревожности у крыс аделесцентного возраста. Полученные с применением данной модели результаты согласуются с клиническими данными [2, 5]. Использованную методику можно рассматривать в качестве модели для исследования последствий острой гипоксии доношенных новорожденных.
Список литературы
Millar L.J., Shi L., Hoerder-Suabedissen A., Molnár Z. Neonatal hypoxia ischaemia: mechanisms, models, and therapeutic challenges. Front. Cell. Neurosci. 11: 1–36. 2017. https://doi.org/10.3389/fncel.2017.00078
Piesova M., Mach M. Impact of perinatal hypoxia on the developing brain. Physiol. Res. 69: 199–213. 2020. https://doi.org/10.33549/physiolres.934198
Sukhanova I.A., Sebentsova E.A., Levitskaya N.G. The acute and delayed effects of perinatal hypoxic brain damage in children and in model experiments with rodents. Neurochem. J. 10(4): 258–272. 2016. https://doi.org/10.1134/S1819712416040127
Alexander M., Garbus H., Smith A.L.L., Rosenkrantz T.S.S., Fitch R.H.H. Behavioral and histological outcomes following neonatal HI injury in a preterm (P3) and term (P7) rodent model. Behav. Brain Res. 259: 85–96. 2014. https://doi.org/10.1016/j.bbr.2013.10.038
Smith A., Alexander M., Rosenkrantz T., Sadek M., Fitch R. Sex differences in behavioral outcome following neonatal hypoxia ischemia: insights from a clinical meta-analysis and a rodent model of induced hypoxic ischemic brain injury. Exp. Neurol. 254: 54–67. 2014. https://doi.org/10.1016/j.expneurol.2014.01.003
Cohen S.S., Stonestreet B.S. Sex differences in behavioral outcome following neonatal hypoxia ischemia: insights from a clinical meta-analysis and a rodent model of induced hypoxic ischemic injury. Exp. Neurol. 256: 70–73. 2014. https://doi.org/10.1016/j.expneurol.2014.03.018
Delcour M., Russier M., Amin M., Baud O., Paban V., Barbe M.F., Coq J.O. Impact of prenatal ischemia on behavior, cognitive abilities and neuroanatomy in adult rats with white matter damage. Behav. Brain Res. 232(1): 233–244. 2012. https://doi.org/10.1016/j.bbr.2012.03.029
Lee B.S., Jung E., Lee Y., Chung S.-H. Hypothermia decreased the expression of heat shock proteins in neonatal rat model of hypoxic ischemic encephalopathy. Cell Stress Chaperones. 22(3): 409–415. 2017. https://doi.org/10.1007/s12192-017-0782-0
Jantzie L., Robinson S. Preclinical models of encephalopathy of prematurity. Dev. Neurosci. 37 (4): 277–288. 2015. https://doi.org/10.1159/000371721
Rice J.E., Vannucci R.C., Brierley J.B. The influence of immaturity on hypoxic-ischemic brain damage in the rat. Ann. Neurol. 9(2): 131–141. 1981. https://doi.org/10.1002/ana.410090206
Отеллин В.А., Хожай Л.И., Ватаева Л.А., Шишко Т.Т. Отдаленные последствия воздействия гипоксии в перинатальный период развития на структурно-функциональные характеристики мозга у крыс. Рос. физиол. журн. им. И.М. Сеченова. 97(10): 1092–1100. 2011. [Otellin V.A., Khozhaĭ L.I., Vataeva L.A., Shishko T.T. The remote consequences of hypoxia influence in perinatal development period on structurally functional characteristics of the rat brain. Russ. J. Physiol. 97(10): 1092–1100. 2011. (In Russ)].
Отеллин В.А., Хожай Л.И., Ватаева Л.А. Влияние гипоксии в раннем перинатальном онтогенезе на поведение и структурные характеристики головного мозга крыс. Журн. эволюц. биохим. физиол. 48(5): 467–472. 2012. [Otellin V.A., Khozhaj L.I., Vataeva L.A. Effect of hypoxia in early perinatal ontogenesis on behavior and structural characteristics of the rat brain. Zh. Evol. Biokhim. Fiziol. 48(5): 467–473. 2012. (In Russ)].
Takada S., Motta-Teixeira L., Machado-Nils A., Lee V., Sampaio C., Polli R., Malheiros J., Takase L., Kihara A., Covolan L., Xavier G., Nogueira M. Impact of neonatal anoxia on adult rat hippocampal volume, neurogenesis and behavior. Behav. Brain Res. 296: 331–338. 2016. https://doi.org/10.1016/j.bbr.2015.08.039
Wang Z., Zhan J., Wang X., Gu J., Xie K., Zhang Q., Liu D. Sodium hydrosulfide prevents hypoxia-induced behavioral impairment in neonatal mice. Brain Res. 1538: 126–134. 2013. https://doi.org/10.1016/j.brainres.2013.09.043
Sukhanova I.A., Sebentsova E.A., Khukhareva D.D., Manchenko D.M., Glazova N.Y., Vishnyakova P.A., Inozemtseva L.S., Dolotov O.V., Vysokikh M.Y., Levitskaya N.G. Gender-dependent changes in physical development, BDNF content and GSH redox system in a model of acute neonatal hypoxia in rats. Behav. Brain Res. 350: 87–98. 2018. https://doi.org/10.1016/j.bbr.2018.05.008
Sukhanova I.A., Sebentsova E.A., Khukhareva D.D., Vysokikh M.Y., Bezuglov V.V., Bobrov M Y., Levitskaya N.G. Early-life N-arachidonoyl-dopamine exposure increases antioxidant capacity of the brain tissues and reduces functional deficits after neonatal hypoxia in rats. Int. J. Dev. Neurosci. 78: 7–18. 2019. https://doi.org/10.1016/j.ijdevneu.2019.06.007
Хухарева Д.Д., Гусева К.Д., Суханова Ю.А., Себенцова Е.А. Левицкая Н.Г. Физиологические эффекты острой неонатальной нормобарической гипоксии у мышей линии C57Dl/6. Журнал высш. нерв. деятельн. им. И.П. Павлова. 70(4): 515–527. 2020. [Khukhareva D.D., Guseva K.D., Sukhanova Iu. A., Sebentsova E.A., Levitskaya N.G. Physiological effects of acute neonatal normobaric hypoxia in C57Bl/6 mice. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 70(4): 515–527. 2020. (In Russ)]. https://doi.org/10.31857/S0044467720040048
Altman J., Sudarshan K. Postnatal development of locomotion in the laboratory rat. Anim. Behav. 23: 896–920. 1975. https://doi.org/10.1016/0003-3472(75)90114-1
Brazel C.Y., Rosti R.T., Boyce S., Rothstein R.P., Levison S.W. Perinatal hypoxia/ischemia damages and depletes progenitors from the mouse subventricular zone. Dev. Neurosci. 26(2-4): 266–274. 2004. https://doi.org/10.1159/000082143
Coq J.-O., Delcour M., Massicotte V.S., Baud O., Barbe M.F. Prenatal ischemia deteriorates white matter, brain organization, and function: implications for prematurity and cerebral palsy. Dev. Med. Child Neurol. 58: 7–11. 2016. https://doi.org/10.1111/dmcn.13040
Kletkiewicz H., Nowakowska A., Siejka A., Mila-Kierzenkowska C., Woźniak A., Caputa M., Rogalska J. Deferoxamine improves antioxidative protection in the brain of neonatal rats: The role of anoxia and body temperature. Neurosci. Lett. 628: 116–122. 2016. https://doi.org/10.1016/j.neulet.2016.06.022
Peterson B., Won S., Geddes R., Sayeed I., Stein D. Sex-related differences in effects of progesterone following neonatal hypoxic brain injury. Behav. Brain Res. 286: 152–165. 2015. https://doi.org/10.1016/j.bbr.2015.03.005
Lubics A., Reglodi D., Tamas A., Kiss P., Szalai M., Szalontay L., Lengvári I. Neurological reflexes and early motor behavior in rats subjected to neonatal hypoxic-ischemic injury. Behav. Brain Res. 157(1): 157–165. 2005. https://doi.org/10.1016/j.bbr.2004.06.019
Ten V., Bradley-Moore M., Gingrich J., Stark R., Pinsky D. Brain injury and neurofunctional deficit in neonatal mice with hypoxic-ischemic encephalopathy. Behav. Brain Res. 145(1–2): 209–219. 2003. https://doi.org/10.1016/s0166-4328(03)00146-3
Huang H., Wen X., Liu H. Sex differences in brain MRI abnormalities and neurodevelopmental outcomes in a rat model of neonatal hypoxia-ischemia. Int. J. Neurosci. 126(7): 647–657. 2016. https://doi.org/10.3109/00207454.2015.1047016
Fan L., Lin S., Pang Y., Lei M., Zhang F., Rhodes P., Cai Z. Hypoxia-ischemia induced neurological dysfunction and brain injury in the neonatal rat. Behav. Brain Res. 165(1): 80–90. 2005. https://doi.org/10.1016/j.bbr.2005.06.033
Журавин И.А., Дубровская Н.М., Туманова Н.Л. Постнатальное физиологическое развитие крыс после острой пренатальной гипоксии Рос. физиол. журн. им. И.М. Сеченова. 89(5): 522–532. 2003. [Zhuravin I.A., Dubrovskaya N.M., Tumanova N.L. Postnatal physiological development of rats after acute prenatal hypoxia. Russ. J. Physiol. 85(5): 522–532. 2003. (In Russ)].
Mercure E., Barnett A.L. Neonatal brain MNRI and motor outcome at school age in children with neonatal encephalopathy: a review of personal experience. Neural Plasticity. 10(1–2): 51–57. 2003. https://doi.org/10.1155/NP.2003.51
Ордян Н.Э., Акулова В.К., Пивина С.Г., Отеллин В.А., Тюренков И.Н. Нарушения вследствие перинатальной гипоксии поведенческой и гормональной стресс-реакций крыс адолесцентного возраста и их коррекция новым производным ГАМК. Журн. эволюц. биохим. физиол. 55(1): 59–64. 2019. [Ordyan N.E., Akulova V.K., Pivina S.G., Otellin V.A., Tyurenkov I.N. Perinatal hypoxia-induced impairments of behavioral and hormonal stress responses in rats and their correction by a novel GABA derivative. Zh. Evol. Biokhem. Fiziol. 55(1): 59–64. 2019. (In Russ)]. https://doi.org/10.1134/S0044452919010091
Confortim H.D., Deniz B.F., de Almeida W., Miguel P.M., Bronauth L., Vieira M.C., de Oliveira B.C., Pereira L.O. Neonatal hypoxia-ischemia caused mild motor dysfunction, recovered by acrobatic training, without affecting morphological structures involved in motor control in rats. Brain Res. 1707: 27–44. 2019. https://doi.org/10.1016/j.brainres.2018.11.021
Markostamou I., Ioannidis A., Dandi E., Mandyla M.A., Nousiopoulou E., Simeonidou C., Spandou E., Tata D.A. Maternal separation prior to neonatal hypoxia-ischemia: Impact on emotional aspects of behavior and markers of synaptic plasticity in hippocampus. Int. J. Dev. Neurosci. 52: 1–12. 2016. https://doi.org/10.1016/j.ijdevneu.2016.04.002
Johnston A.L., Files S.E. Sex differences in animal tests of anxiety. Physiol. Behav. 49: 245–250. 1991. https://doi.org/10.1016/0031-9384(91)90039-q
Morales P., Simola N., Bustamante D., Lisboa F., Fiedler J., Gebicke-Haerter P.J., Morelli M., Tasker R.A., Herrera-Marschitz M. Nicotinamide prevents the long-term effects of perinatal asphyxia on apoptosis, non-spatial working memory and anxiety in rats. Exp. Brain Res. 202: 1–14. 2010. https://doi.org/10.1007/s00221-009-2103-z
Galeano P., Blanco Calvo E., Madureira de Oliveira D., Cuenya L., Kamenetzky G.V., Mustaca A.E., Barreto G.E., Giraldez-Alvarez L.D., Milei J., Capani F. Long-lasting effects of perinatal asphyxia on exploration, memory and incentive downshift. Int. J. Dev. Neurosci. 29(6): 609–619. 2011. https://doi.org/10.1016/j.ijdevneu.2011.05.002
Durán-Carabali L.E., Arcego D.M., Sanches E.F., Odorcyk F.K., Marques M.R., Tosta A., Reichert L., Carvalho A.S., Dalmaz C., Netto C.A. Preventive and therapeutic effects of environmental enrichment in Wistar rats submitted to neonatal hypoxia-ischemia. Behav. Brain Res. 359: 485–497. 2019. https://doi.org/10.1016/j.bbr.2018.11.036
Northington F.J. Brief update on animal models of hypoxic-ischemic encephalopathy and neonatal stroke. ILAR J. 47(1): 32–38. 2006. https://doi.org/10.1093/ilar.47.1.32
Vannucci R.C., Vannucci S.J. Perinatal hypoxic-ischemic brain damage: Evolution of an animal model. Dev. Neurosci. 27(2-4): 81–86. 2005. https://doi.org/10.1159/000085978
Marriott A.L., Rojas-Mancilla E., Morales P., Herrera-Marschitz M., Tasker R.A. Models of progressive neurological dysfunction originating early in life. Prog. Neurobiol. 155: 2–20. 2017. https://doi.org/10.1016/j.pneurobio.2015.10.001
Chen W.F., Chang H., Huang L.T., Lai M.C., Yang C.H., Wan T.H., Yang S.N. Alterations in long-term seizure susceptibility and the complex of PSD-95 with NMDA receptor from animals previously exposed to perinatal hypoxia. Epilepsia. 47(2): 288–296. 2006. https://doi.org/10.1111/j.1528-1167.2006.00420.x
Mikati M.A., Zeinieh M.P., Kurdi R.M., Harb S.A., El Hokayem J.A., Daderian R.H., Shamseddine A., Obeid M., Bitar F.F., El-Sabban M. Long-term effects of acute and of chronic hypoxia on behavior and on hippocampal histology in the developing brain. Brain Res. Dev. Brain Res. 157(1): 98–102. 2005. https://doi.org/10.1016/j.devbrainres.2005.03.007
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


