Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 2, стр. 203-220
Развитие осевой локомоторной мускулатуры у половозрелого окуня-клювача Sebastes mentella (Sebastidae)
В. П. Панов 1, *, С. С. Сафонова 1, А. М. Орлов 2, 3, 4, 5, 6, 7, А. Ю. Рольский 8, 9, Д. В. Артеменков 3
1 Российский государственный аграрный университет – Московская сельскохозяйственная
академия им. К.А. Тимирязева
Москва, Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
(ВНИРО)
Москва, Россия
4 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
5 Дагестанский государственный университет
Махачкала, Россия
6 Прикаспийский институт биологических ресурсов ДФИЦ РАН
Махачкала, Россия
7 Томский государственный университет
Томск, Россия
8 Полярный филиал ВНИРО (ПИНРО им. Н.М. Книповича)
Мурманск, Россия
9 Мурманский государственный технический университет
Мурманск, Россия
* E-mail: panovval@gmail.com
Поступила в редакцию 17.10.2020
После доработки 02.12.2020
Принята к публикации 13.12.2020
Аннотация
Приводятся результаты исследования гистологической структуры локомоторной осевой (скелетной) мышечной ткани окуня-клювача Sebastes mentella и рассматриваются ее онтогенетические изменения. Его скелетная мускулатура состоит из белых и красных волокон. Получены данные по количественному распределению указанных волокон вдоль тела половозрелых рыб в кранио-каудальном направлении, их соотношение в туловищной и хвостовой частях. Диаметр этих двух типов волокон достигает значительных размеров, как у ряда глубоководных медленнорастущих видов (>300 мкм – белые волокна, >150 мкм – красные волокна). Плотность белых волокон выше, чем красных (80.7 ± 2.0 против 54.7 ± 1.5%), что обусловлено различным содержанием жировой и соединительной ткани (эндомизия). Вариабельность белых волокон у большинства размерных групп рыб существенно ниже, чем красных. Особенностью, которая не отмечена у других глубоководных видов рыб с невысокой скоростью роста, является относительно частая встречаемость красных волокон с расслоением саркоплазмы на две зоны (слоя) – внешнюю и внутреннюю (“двойные” структуры), природа которой пока неясна.
Среди четырех видов морских окуней рода Sebastes, обитающих в северной Атлантике и морях Северного Ледовитого океана наиболее массовым является окунь-клювач S. mentella [1–4]. Вопросам биологии, экологии и распространению этого промыслового вида посвящен ряд работ [3, 5–10].
Окунь-клювач относится к медленнорастущим видам рыб. Известно, что прирост длины у половозрелых особей не превышает 1.0 см в год [10–13]. Максимальные абсолютные и относительные приросты отмечены у неполовзрелых особей, которые составляют 1.7–2.1 см, или 6.2–9.4% в год [3]. По мере созревания приросты снижаются и в возрасте 10–19 лет составляют 1.1–1.7 см и 3.0–4.6% соответственно. Начиная с возраста 21-го года, они снижаются еще в большей степени (абсолютные – до 0.5–1.0 см, относительные – до 1.0–2.2%) [3]. Окунь-клювач в массе, независимо от места обитания, созревает поздно – в возрасте 9–19 лет при длине 29–45 см [14].
Рост животного в целом определяется ростом отдельных частей его тела, поэтому морфологические исследования различных видов приобретают важное значение. Общая характеристика внешней морфологии окуня-клювача представлена в отдельных работах [6, 15, 16].
Основной морфологической структурой тела, которая определяет интенсивность роста животных, является соматическая или скелетная мускулатура. Вопросам, связанным с развитием мышц, уделяется большое внимание при искусственном выращивании различных видов рыб, в том числе, морских – обыкновенного лаврака Dicentrarchus labrax, атлантической трески Gadus morhua, спара золотистого Sparus aurata, зубана Dentex dentex и др. [17–21].
В теле большинства видов рыб, как пресноводных, так и морских, топографически выделяются две хорошо выраженные мышцы – красная (musculus lateralis superficialis) и белая (musculus lateralis profundus) [22]. Красные мышцы находятся непосредственно под кожей вдоль горизонтальной миосепты от головы до хвостового плавника. Их волокна содержат много миоглобина и дыхательных ферментов. Белые мышцы располагаются глубже и отличаются более светлой окраской. Волокна этого типа отличаются высоким содержанием ферментов анаэробного цикла и получают энергию за счет гликолиза. Две эти морфологические структуры в соответствии с присущим им метаболизмом относятся к различным локомоторным системам [22–25]. У большинства видов рыб красные мышцы функционируют при относительно невысоких скоростях плавания, а белые – при быстрых и резких движениях [26–28]. Соотношение этих двух типов мышц в теле рыб в каудальном направлении изменяется: доля красных мышц увеличивается, а белых– уменьшается [29–31]. Красные мышечные волокна тонкие, в поперечном сечении округлые и плотно лежащие. В отличие от красных, белые волокна угловатые, крупные и более разнообразные по размеру [32–36].
Так как североатлантические окуни рода Sebastes не являются объектами аквакультуры, с этим, по-видимому, связано отсутствие опубликованных данных об их росте и гистологической структуре скелетных мышц, в том числе и окуня-клювача, ценной в пищевом отношении рыбы. Данный вид является важным объектом промысла, пищевую ценность его определяет, прежде всего, скелетная мускулатура, исследования которой в различных направлениях являются актуальными и перспективными. Целью настоящего исследования является определение морфофункциональных особенностей соматической мускулатуры у половозрелого окуня-клювача различного возраста.
МЕТОДЫ ИССЛЕДОВАНИЯ
Сбор материала для изучения гистоструктуры окуня-клювача осуществлен в период научно-исследовательских работ в июне-июле 2018 г. на борту НИС “Атлантида” в море Ирмингера (59°60′–64°60′ с.ш., 26°20′–41°50′ з.д.) в районе регулирования НЕАФК (Комиссия по рыболовству в северо-восточной части Атлантики), включая открытые воды и исключительные экономические зоны (ИЭЗ) Гренландии и Исландии. При проведении траловых работ использовали разноглубинный трал 78.7/416 м проекта 2492-02, канатная и сетная части которого изготовлены из современных облегченных материалов, размеры ячеи в крыльях 68 мм и кутце 16 мм.
Для изучения гистоструктуры клюворылого окуня отобраны 24 пробы из уловов 8-ми тралений на глубинах 650 и 700 м (рис. 1). Видовую идентификацию рыб в уловах осуществляли по рекомендованным определителям [5]. Объектами настоящего исследования послужили самки и самцы клюворылого окуня Sebastes mentella (табл. 1) длиной 32–40 см и 33–42 см и массой 334–940 и 334–954 г. соответственно. Возраст рыб определяли по методике изучения возраста окуней с помощью отолитов и чешуи, которая изложена в Руководстве по выполнению Международной глубоководной пелагической экосистемной съемки в море Ирмингера и сопредельных водах, разработанное и утвержденное WGIDEEPS [37].
Рис. 1.
Район и маршрут выполненной работы НИС “Атлантида” (черная линия) с местами сбора образцов для изучения гистоструктуры клюворылого окуня (⚫ – места отбора проб c номерами тралений; – – маршрут судна; --- – границы ИЭЗ). Fig. 1. Area and worked route by R/V Atlantida (black line) with sampling sites for studying the histostructure of beaked redfish (⚫ – sampling sites with trawl numbers; – – vessel route; --- – EEZ boundaries.

Таблица 1.
Информация о поимках клюворылого окуня Table 1. Information on captures of beaked redfish
| Пол Sex |
Длина, см Length, cm |
Масса, г Weight, g |
Дата поимки Catch date |
№ Трала Trawl № |
Широта, с.ш. Latitude, N |
Долгота, з.д Longitude, W |
Глубина, м Depth, m |
|---|---|---|---|---|---|---|---|
| Самки Females |
370 | 608 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 |
| 400 | 940 | 23.06.2018 | 36 | 63°06′ | 28°41′ | 700 | |
| 400 | 890 | 23.06.2018 | 36 | 63°06′ | 28°41′ | 700 | |
| 380 | 728 | 24.06.2018 | 38 | 62°35′ | 27°27′ | 700 | |
| 300 | 352 | 26.06.2018 | 44 | 62°35′ | 33°32′ | 700 | |
| 300 | 344 | 26.06.2018 | 44 | 62°35′ | 33°32′ | 700 | |
| 330 | 432 | 28.06.2018 | 52 | 62°35′ | 39°21′ | 700 | |
| 320 | 384 | 28.06.2018 | 52 | 62°35′ | 39°21′ | 700 | |
| 360 | 546 | 03.07.2018 | 69 | 61°45′ | 29°27′ | 650 | |
| 340 | 522 | 04.07.2018 | 74 | 61°46′ | 33°20′ | 650 | |
| Самцы Males |
420 | 878 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 |
| 390 | 606 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 300 | 334 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 400 | 748 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 340 | 448 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 340 | 554 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 370 | 618 | 15.06.2018 | 8 | 64°05′ | 34°42′ | 700 | |
| 410 | 942 | 24.06.2018 | 38 | 62°35′ | 27°27′ | 700 | |
| 420 | 954 | 26.06.2018 | 44 | 62°35′ | 33°32′ | 700 | |
| 410 | 786 | 26.06.2018 | 44 | 62°35′ | 33°32′ | 700 | |
| 390 | 692 | 26.06.2018 | 44 | 62°35′ | 33°32′ | 700 | |
| 350 | 528 | 28.06.2018 | 52 | 62°35′ | 39°21′ | 700 | |
| 370 | 648 | 02.07.2018 | 67 | 62°10′ | 27°29′ | 700 | |
| 330 | 396 | 04.07.2018 | 74 | 61°46′ | 33°20′ | 650 |
Образцы мышц были взяты за головой, у основания спинного плавника (в средней части туловища) и в области хвостового стебля (рис. 2). Отбор образцов происходил по одной схеме у всех рыб. Собранные пробы хранились в зафиксированном состоянии в 4%-ном растворе формалина. Для получения желатиновых срезов выполнялась проводка образцов через растворы желатина различных концентраций (7, 12.5 и 25%) при 37°С. Гистологические срезы толщиной 15 мкм получали на замораживающем микротоме МЗП-01 Техном, оснащенном охладителем ОМТ 28-02 Е. Окраска осуществлялась Суданом III (Вектон, Россия), окрашивающим жир оранжевым цветом, и гематоксилином Карацци (Абрис+, Россия), окрашивающим ядра в сине-фиолетовый цвет. Для исследования полученных препаратов использовали световой микроскоп Микромед С-1 с объективами 4/0.10 160/0.17; 10/0.25 160/0.17 и S40/0.65 160/0.17. На препаратах определяли диаметр белых и красных мышечных волокон и их плотность [38]. Красные и белые волокна дифференцировались по среднему диаметру, интенсивности окраски и расположению миофибрилл. Микрофотографии были сделаны при помощи фотоаппарата Sony Cybershot и обработаны с использованием программы PixBuilder Studio. Методом аппликации устанавливали долю поверхностных боковых мышц в области хвостового стебля [39]. Полученный материал обработан статистически с использованием программного обеспечения Microsoft Office Excel. Рассчитывались такие показатели как среднее абсолютное значение со стандартной ошибкой средней (M ± m), коэффициент вариации (Cv, %). Достоверность различий определялась по t-критерию Стьюдента при p ≤ 0.05 (по Пирсону).
Рис. 2.
Схема мест отбора гистологических проб у окуня-клювача. Образцы мускулатуры были собраны за головой, у основания спинного плавника (в средней части туловища) и в области хвостового стебля (обозначено черной штриховкой). Fig. 2. Diagram of places for sampling histological samples from a beaked redfish. Muscle samples were collected behind the head, at the base of the dorsal fin (in the middle part of the body) and in the area of the caudal stem (indicated by black shading).

РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Скелетная мускулатура окуня-клювача состоит из белых (быстрых) и красных (медленных) волокон [40, 41]. Красные мышцы располагаются под кожей вдоль средней линии на протяжении туловища и хвоста рыб. Остальная масса осевой мускулатуры представлена более глубоко расположенными белыми волокнами (табл. 2). Окунь-клювач, независимо от массы, обладает очень крупными как белыми, так и красными мышечными волокнами, несмотря на небольшие размеры рыб. В возрасте 12 лет у мелких рыб (группа 1) диаметр белых мышечных волокон вдоль тела (от головы до хвоста) не различается (табл. 2). По достижении 14 лет у более крупных рыб (начиная с группы 2), как правило, по средним значениям, рассчитанным по трем точкам отобранных образцов мышечной ткани, диаметр волокон увеличивается с 109.8 ± 0.7 до 149.5 ± 13.0 мкм (p ≤ 0.05). У головы и в туловище под спинным плавником размеры волокон имеют сходные диаметры, а в хвостовой части они существенно мельче (p ≤ 0.05). Диаметр отдельных белых волокон, расположенных у головы, достигает 330 мкм, в туловище – 380 и в хвосте – 363 мкм. Среднее соотношение наиболее крупных волокон и самых мелких составляет у головы – 5.6, в туловище – 5.2, в хвосте – 5.1. При этом коэффициент вариации колеблется в пределах 29.2–30.6%.
Таблица 2.
Соотношение максимальных и минимальных диаметров белых и красных мышечных волокон и их вариабельность Table 2. The ratio of the maximum and minimum diameters of white and red muscle fibers and their variability
| Размерные
группы рыб Fish size group |
Возраст, лет Age, years |
Длина рыб, мм* Fish length, mm |
Масса рыб, г* Fish weight, g |
Белые
волокна White fibers |
Красные
волокна Red fibers |
||
|---|---|---|---|---|---|---|---|
| max/min | Cv,% | max/min | Cv,% | ||||
| 1 (n = 4) | 12.2 ± 0.7 | $\frac{{305.0 \pm 5.0}}{{300{\kern 1pt} - {\kern 1pt} 320}}$ | $\frac{{353.5 \pm 10.8}}{{334{\kern 1pt} - {\kern 1pt} 384}}$ | 6.8 | 34.6 | 10.6 | 66.0 |
| 2 (n = 3) | 14.2 ± 0.3 | $\frac{{333.3 \pm 3.3}}{{330{\kern 1pt} - {\kern 1pt} 340}}$ | $\frac{{425.3 \pm 15.4}}{{396{\kern 1pt} - {\kern 1pt} 448}}$ | 6.6 | 33.9 | 15.7 | 73.6 |
| 3 (n = 4) | 15.1 ± 0.8 | $\frac{{347.5 \pm 4.8}}{{340{\kern 1pt} - {\kern 1pt} 360}}$ | $\frac{{537.5 \pm 7.5}}{{522{\kern 1pt} - {\kern 1pt} 554}}$ | 5.6 | 32.9 | 10.8 | 61.0 |
| 4 (n = 4) | 17.2 ± 0.8 | $\frac{{375.0 \pm 5.0}}{{370{\kern 1pt} - {\kern 1pt} 390}}$ | $\frac{{620.0 \pm 9.7}}{{606{\kern 1pt} - {\kern 1pt} 648}}$ | 4.4 | 27.4 | 8.1 | 43.5 |
| 5 (n = 4) | 18.7 ± 1.1 | $\frac{{395.0 \pm 6.5}}{{380{\kern 1pt} - {\kern 1pt} 410}}$ | $\frac{{738.5 \pm 19.6}}{{692{\kern 1pt} - {\kern 1pt} 786}}$ | 5.0 | 27.7 | 10.5 | 45.2 |
| 6 (n = 2) | 20.0 ± 1.5 | $\frac{{410.0 \pm 10.0}}{{400{\kern 1pt} - {\kern 1pt} 420}}$ | $\frac{{884.0 \pm 6.0}}{{878{\kern 1pt} - {\kern 1pt} 890}}$ | 4.9 | 28.3 | 9.0 | 61.0 |
| 7 (n = 3) | 20.1 ± 1.1 | $\frac{{410.0 \pm 5.8}}{{400{\kern 1pt} - {\kern 1pt} 420}}$ | $\frac{{945.3 \pm 4.4}}{{940{\kern 1pt} - {\kern 1pt} 954}}$ | 4.3 | 29.7 | 14.2 | 48.5 |
| Среднее Average |
16.8 ± 1.2 | 364.2 ± 8.0 | 619.9 ± 41.4 | 5.4 | 30.6 | 11.3 | 57.0 |
В среднем, вариабельность красных мышечных волокон по диаметру существенно превышает величину этого показателя в белых волокнах (разница 26.4%). Соответственно наблюдается снижение значений коэффициента вариации с 34.6 до 29.7%. Возможно, в связи с отсутствием некоторых образцов такой достаточно четкой картины не наблюдается в красных мышцах (табл. 2).
Плотность волокон постепенно уменьшается с возрастом рыб, однако четкой закономерности в этом процессе не наблюдается. Во многом это определяется топографией белых мышц. В среднем, плотность быстрых волокон по трем областям тела окуней разных размерных групп 1, 2, 3, 4, 5, 6, 7 составляет: 85.5 ± 4.0; 87.0 ± 2.8; 87.9 ± 3.6; 78.7 ± 7.3; 77.5 ± 4.3; 72.3 ± 7.1 и 76.1 ± 3.2% соответственно. При этом отмечается тенденция к снижению мышечного компонента в хвосте рыб (табл. 3).
Таблица 3.
Морфометрия белых мышечных волокон в различных частях тела рыб Table 3. Morphometry of white muscle fibers in different parts of the fish body
| Группа рыб Fish group |
Диаметр волокон, мкм Fibres diameter, µm |
Плотность волокон, % Fibers density, % |
||||
|---|---|---|---|---|---|---|
| голова head (n = 200–400) |
туловище middle part of the body (n = 200–400) |
хвост tail (n = 150–350) |
голова head |
туловище middle part of the body |
хвост tail |
|
| 1 | $\frac{{108.3 \pm 2.0}}{{41.3{\kern 1pt} - {\kern 1pt} 280.5}}$ | $\frac{{110.7 \pm 2.0}}{{41.3{\kern 1pt} - {\kern 1pt} 231.0}}$ | $\frac{{108.7 \pm 2.8}}{{41.3{\kern 1pt} - {\kern 1pt} 330.0}}$ | 81.5 | 93.5 | 81.4 |
| 2 | $\frac{{129.5 \pm 2.5}}{{33.0{\kern 1pt} - {\kern 1pt} 280.5}}$ | $\frac{{131.2 \pm 2.8}}{{49.5{\kern 1pt} - {\kern 1pt} 272.3}}$ | $\frac{{112.9 \pm 2.6{\kern 1pt} *}}{{33.0{\kern 1pt} - {\kern 1pt} 214.5}}$ | 88.8 | 90.6 | 81.6 |
| 3 | $\frac{{137.3 \pm 2.1}}{{49.5{\kern 1pt} - {\kern 1pt} 297.0}}$ | $\frac{{143.5 \pm 3.1}}{{57.8{\kern 1pt} - {\kern 1pt} 297.0}}$ | $\frac{{119.8 \pm 3.0{\kern 1pt} *}}{{49.5{\kern 1pt} - {\kern 1pt} 280.5}}$ | 88.9 | 93.5 | 81.2 |
| 4 | $\frac{{148.0 \pm 2.1}}{{57.8{\kern 1pt} - {\kern 1pt} 247.5}}$ | $\frac{{143.1 \pm 2.1}}{{57.8{\kern 1pt} - {\kern 1pt} 297.0}}$ | $\frac{{130.4 \pm 2.4{\kern 1pt} *}}{{66.0{\kern 1pt} - {\kern 1pt} 255.8}}$ | 92.5 | 76.0 | 67.6 |
| 5 | $\frac{{152.1 \pm 2.6}}{{66.0{\kern 1pt} - {\kern 1pt} 330.0}}$ | $\frac{{153.7 \pm 2.0}}{{66.0{\kern 1pt} - {\kern 1pt} 297.0}}$ | $\frac{{133.1 \pm 2.1{\kern 1pt} *}}{{66.0{\kern 1pt} --{\kern 1pt} 363.0}}$ | 85.1 | 77.4 | 70.1 |
| 6 | $\frac{{144.4 \pm 2.4}}{{66.0{\kern 1pt} - {\kern 1pt} 264.0}}$ | $\frac{{141.6 \pm 3.1}}{{57.8{\kern 1pt} - {\kern 1pt} 379.5}}$ | $\frac{{116.5 \pm 2.4{\kern 1pt} *}}{{49.5{\kern 1pt} - {\kern 1pt} 198.0}}$ | 65.9 | 86.7 | 64.6 |
| 7 | $\frac{{168.24 \pm 3.6}}{{49.5{\kern 1pt} - {\kern 1pt} 330.0}}$ | $\frac{{155.7 \pm 2.8}}{{82.5{\kern 1pt} - {\kern 1pt} 280.5}}$ | $\frac{{127.4 \pm 3.0{\kern 1pt} *}}{{66.0{\kern 1pt} - {\kern 1pt} 247.5}}$ | 73.9 | 82.4 | 71.9 |
| Среднее Average |
$\frac{{141.1 \pm 7.1}}{{51.9{\kern 1pt} - {\kern 1pt} 289.9}}$ | $\frac{{139.9 \pm 5.7}}{{58.9{\kern 1pt} - {\kern 1pt} 293.5}}$ | $\frac{{121.3 \pm 3.4{\kern 1pt} *}}{{53.0{\kern 1pt} - {\kern 1pt} 269.9}}$ | 82.4 ± 3.6 | 85.7 ± 2.8 | 74.0 ± 2.7 |
* В табл. 3 и 4 – разность по сравнению с головой достоверна при p ≤ 0.05. Над чертой – средние значения показателя. Под чертой – пределы колебания показателя. * In tables 3 and 4, the difference compared to the head is significant at p ≤ 0.05. Above the line – average values of the indicator. Under the line – the limits of the indicator fluctuation.
В возрасте 19 лет средний диаметр мышечных волокон у окуня-клювача увеличивается до достижения рыбами определенной массы (738.5 г). В дальнейшем этот диаметр уменьшается, что может говорить о возможных процессах гиперплазии в белой мышечной ткани. При этом наблюдается уменьшение плотности волокон в области головы и хвоста (табл. 3).
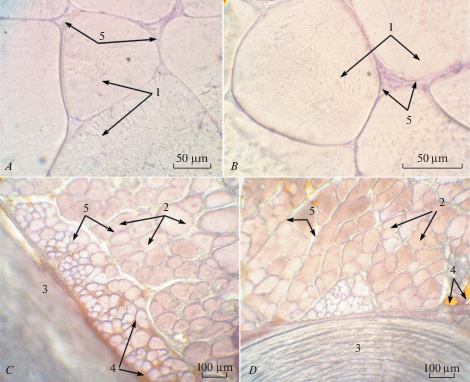
Диаметр красных мышечных волокон у окуня-клювача, как и у большинства видов рыб, существенно меньше, чем белых. При этом можно отметить, что размеры медленных волокон в каудальном направлении изменяются незначительно или даже достоверно увеличиваются как, например, у самых мелких рыб (12 лет). Это свидетельствует о хорошо выраженной гипертрофии этого типа волокон у окуня-клювача. Подобно белым волокнам, диаметр красных в хвосте существенно уменьшается у определенной ранее группы рыб (6), что, возможно, обусловлено процессом гиперплазии (табл. 4). В среднем, максимальное соотношение наиболее крупных волокон к самым мелким составляет у головы 10.0, в туловище – 8.0, в хвосте – 13.9. При этом коэффициент вариации колеблется в пределах 53.0–56.2%. В белых волокнах наблюдаются хорошо выраженные, радиально расходящиеся миофибриллы и тонкий слой саркоплазмы под оболочной, в то время как в красных она располагаются точечно (рис. 3A, B). Как и диаметр, плотность красных волокон ниже, чем белых, что определяется хорошо развитым перимизием и интенсивным накоплением на его основе жировой ткани (рис. 3C, D).
Таблица 4.
Морфометрия красных мышц в различных частях рыб Table 4. Morphometry of red muscles in different parts of fish
| Группа рыб Fish group |
Диаметр волокон, мкм Fibres diameter, µm |
Плотность волокон, % Fibers density, % |
||||
|---|---|---|---|---|---|---|
| голова head (n = 50–100) |
туловище middle part of the body (n = 50–150) |
хвост tail (n = 130–350) |
голова head |
туловище middle part of the body |
хвост tail |
|
| 1 | $\frac{{28.8 \pm 1.5}}{{8.3{\kern 1pt} - {\kern 1pt} 82.5}}$ | $\frac{{30.5 \pm 1.9}}{{11.6{\kern 1pt} - {\kern 1pt} 66.0}}$ | $\frac{{36.4 \pm 1.4{\kern 1pt} *}}{{8.3{\kern 1pt} - {\kern 1pt} 148.5}}$ | 50.9 | 50.5 | 52.5 |
| 2 | $\frac{{26.7 \pm 1.9}}{{8.3{\kern 1pt} - {\kern 1pt} 107.3}}$ | $\frac{{29.5 \pm 2.1}}{{8.3{\kern 1pt} - {\kern 1pt} 148.5}}$ | $\frac{{30.1 \pm 2.1}}{{8.3{\kern 1pt} - {\kern 1pt} 132.0}}$ | 51.3 | 52.2 | 50.8 |
| 3 | $\frac{{35.4 \pm 3.6}}{{13.2{\kern 1pt} - {\kern 1pt} 82.5}}$ | – | $\frac{{41.1 \pm 1.6}}{{8.3{\kern 1pt} - {\kern 1pt} 148.5}}$ | 52.0 | – | 57.9 |
| 4 | – | $\frac{{43.1 \pm 3.1}}{{14.9{\kern 1pt} - {\kern 1pt} 87.5}}$ | $\frac{{40.4 \pm 1.0}}{{8.3{\kern 1pt} - {\kern 1pt} 99.0}}$ | – | 52.4 | 51.0 |
| 5 | $\frac{{46.7 \pm 2.7}}{{9.9{\kern 1pt} - {\kern 1pt} 123.8}}$ | $\frac{{49.0 \pm 3.1}}{{16.5{\kern 1pt} - {\kern 1pt} 107.3}}$ | $\frac{{50.4 \pm 1.1}}{{9.9{\kern 1pt} - {\kern 1pt} 148.5}}$ | 52.8 | 69.9 | 61.1 |
| 6 | – | – | $\frac{{45.9 \pm 2.7}}{{16.5{\kern 1pt} - {\kern 1pt} 148.5}}$ | – | – | 52.2 |
| 7 | -– | – | $\frac{{45.8 \pm 1.8}}{{9.9{\kern 1pt} - {\kern 1pt} 140.3}}$ | – | – | 62.4 |
| Среднее Average |
$\frac{{34.4 \pm 4.5}}{{9.9{\kern 1pt} - {\kern 1pt} 99.0}}$ | $\frac{{38.0 \pm 4.8}}{{12.8{\kern 1pt} - {\kern 1pt} 102.3}}$ | $\frac{{41.4 \pm 2.5}}{{9.9{\kern 1pt} - {\kern 1pt} 137.9}}$ | 51.8 ± 0.4 | 56.2 ± 4.5 | 55.4 ± 1.9 |
Рис. 3.
Общий вид мускулатуры (в средней части туловища): А – белая мускулатура самки (группа 3, масса – 546 г), B – белая мускулатура самца (группа 4, масса – 606 г), C – красная мускулатура самки (группа 3, масса – 546 г), D – красная мускулатура самца (группа 4, масса – 606 г). 1 – белые мышечные волокна с радиально расположенными миофибриллами, 2 – красные мышечные волокна, 3 – кожа, 4 – липоциты, 5 – эндомизий. Увеличение: A, B – 600x; C, D – 150x. Fig. 3. General view of the musculature (in the middle part of the body): A – white female musculature (group 3, weight – 546 g), B – white male musculature (group 4, weight – 606 g), C - red female musculature (group 3, weight – 546 g), D – red male musculature (group 4, weight – 606 g). 1 – white muscle fibers with radially located myofibrils, 2 – red muscle fibers, 3 – skin, 4 – lipocytes, 5 – endomysium. Magnification: A, B – 600x; C, D – 150x.
У изученных рыб соотношение размерных групп белых мышечных волокон несколько изменяется. С увеличением массы окуней во всех отделах тела, как правило, уменьшается количество мелких волокон (30–80 мкм). Волокна диаметром менее 30 мкм, которые характерны для многих видов рыб, не отмечены. У мелких рыб (группы 1–3) модальный класс составляют волокна с диаметром 80–130 мкм (от 40 до 55%). У рыб в возрасте 17–20 лет (группы 4–7), в связи с процессами гипертрофии, модальный класс у головы и в туловище составляют волокна от 130 до 180 мкм (40–53%). Неизменной остается хвостовая часть, где модальный класс состоит из волокон от 80 до 130 мкм. Этим обуславливается снижение среднего диаметра волокон в каудальном направлении. Уменьшение среднего диаметра волокон у рыб 19 лет (группа 5), вероятно, связано с повышением доли волокон диаметром 80–130 мкм и снижением количества крупных (180–280 мкм) (рис. 4А).
Рис. 4.
Распределение диаметров белых и красных волокон: за головой ( ), посередине туловища (
), посередине туловища ( ), в хвосте (
), в хвосте ( ). А1–А7 – белая мускулатура; B1–B7 – красная (цифры обозначают номера групп).
Fig. 4. Distribution of diameters of white and red fibers: behind the head (
). А1–А7 – белая мускулатура; B1–B7 – красная (цифры обозначают номера групп).
Fig. 4. Distribution of diameters of white and red fibers: behind the head ( ), in the middle of the body (
), in the middle of the body ( ), in the tail (
), in the tail ( ). A1–A7 – white muscles; B1–B7 – red (numbers indicate group numbers).
). A1–A7 – white muscles; B1–B7 – red (numbers indicate group numbers).

Образцы мышечной ткани, взятые в различных частях тела рыб, оказались неполными. В связи с этим красные мышцы у некоторых размерных групп окуней были частично утрачены. Несмотря на это, на имеющихся образцах мышечной ткани, содержащих медленные волокна, можно выявить некоторые особенности в их количественной структуре. Фактически у всех размерных групп рыб модальным классом являются волокна диаметром 20–50 мкм. Их доля у головы составляет 50–66%, в середине туловища 50–70% и в хвосте 50–92%. В каудальной области наблюдаются и более крупные волокна, попадающие в класс 110–150 мкм (1.7–2.5%). При этом общей закономерности распределения этих волокон у разноразмерных рыб не отмечено, что связано, по-видимому, с чередующимися процессами гипертрофии и гиперплазии. Например, как и в случае с белыми волокнами, у рыб в из шестой группы отсутствуют самые крупные волокна (рис. 4B1–B7).
Для гистоструктуры белых мышц характерно незначительное содержание жировых включений. Крупные скопления липоцитов отмечены непосредственно под кожей и в красных мышцах. Белые волокна разделены тонким эндомизием. При этом между окислительными волокнами наблюдаются достаточно широкие соединительнотканные прослойки.
Белые мышечные волокна разнообразны по форме и расположению. Часто встречаются участки, состоящие из крупных волокон (до 300 мкм). На поперечном разрезе такие волокна имеют необычную форму. Они или удлиненные в разных направлениях или имеют вид нескольких сросшихся волокон. Наиболее часто такой тип волокон встречается у крупных рыб в возрасте 19–20 лет (группы 5–7) (рис. 5).
Рис. 5.
Разнообразие форм белых волокон. А – группа 6, самка массой 890 г (позади головы), B – группа 5, самец массой 692 г (хвостовой стебель), C – группа 2, самка массой 432 г (позади головы), D – группа 4, самец массой 606 г (средняя часть туловища); 1 – мышечные волокна, 2 – эндомизий. Увеличение: 150×. Fig. 5. A variety of forms of white fibers. A – group 6, female weighing 890 g (behind the head), B – group 5, male weighing 692 g (caudal peduncle), C – group 2, female weighing 432 g (behind the head), D – group 4, male weighing 606 g (middle part of the body); 1 – muscle fibers, 2 – endomysium. Magnification: 150×.

Форма поперечного среза белых волокон у изученных размерных групп рыб различается. У окуней первой группы преобладают угловатые по форме волокна. В последующем, с увеличением размеров особей, наблюдается постепенное сглаживание углов у волокон (группы 2–3). У крупных рыб (группы 4–7) подавляющее число волокон имеют округлую форму. Подобная структурная организация характерна для белой мускулатуры во всех частях туловища, но в каудальной части крупных рыб округлые волокна встречаются чаще, чем в мышцах непосредственно за головой и середине тела.
Волокна красных мышц имеют округлую, в массе однообразную форму. В то же время среди них встречаются довольно большие, в несколько раз превышающие рядом лежащие, волокна (до 150 мкм). Визуально их количество увеличивается в каудальном направлении, что, вероятно, сказывается на среднем диаметре волокон в хвосте рыб. Для рыб 19–20 лет (группы 5–7) характерны видоизмененные красные волокна, саркоплазма которых визуально распадается на внешний и внутренний слои. Такие структуры встречаются непосредственно под кожей единично или группами по 5–10 штук среди обычных волокон. Периферический диаметр кольцевидного внешнего волокна составляет 115.8 ± 3.8 (Cv = 18.2%), а внутреннего – 57.1 ± 2.1. Отношение диаметра внешнего волокна к внутреннему составляет 2.10 ± 0.06.
Особенностью красных мышечных волокон (в отличие от белых) является большое количество саркоплазмы, которая находится под сарколеммой, а миофибриллы локализованы в центральной части [32, 34, 42]. Процессы, связанные с изменением структуры волокна, начинаются в центральной части, там, где располагаются миофибриллы (“инициаторы” расщепления). В последующем это получает продолжение в виде распространения “инициатора” в различных направлениях, вызывая смещение структур саркоплазмы. Это, возможно, приводит к определенным аномалиям в строении мышечного волокна, в частности, уменьшению площади, занимаемой миофибриллами. Конечный этап подобного рода изменений проявляется в виде обособления центральной части волокна, в которой концентрируются сократительные структуры. Для того, чтобы ответить на вопросы, приводят ли подобные изменения к отклонениям в работе миофибриллярного аппарата и сократительной функции волокна, а соответственно и локомоторной активности рыб, требуются дальнейшие исследования. На гистопрепаратах можно проследить предполагаемый процесс образования подобных волокон (рис. 6). В белых мышцах отмечены похожие, но единичные волокна.
Рис. 6.
Последовательные (А–D) стадии формирования расщепленного волокна в хвостовом стебле самки (группа 6, масса 890 г): 1 – появление в центре волокна “инициатора расщепления”, 2 – разрастание образования в разные стороны, 3 – смещение структур волокна, 4 – обособление центральной части. Увеличение: 600×. Fig. 6. Consecutive (A–D) stages of the formation of a split fiber in the female caudal peduncle (group 6, weight 890 g): 1 – the appearance of a “cleavage initiator” in the center of the fiber, 2 – rowth of the formation in different directions, 3 – displacement of fiber structures, 4 – separation of the central part. Magnification: 600×.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Соматическая мускулатура окуня-клювача, подобно многим пресноводным и морским видам рыб, состоит из белых и красных волокон. Наряду с медленным ростом, характерной особенностью этих рыб является своеобразное строение мышечной ткани. Как белые, так и красные мышцы имеют в составе волокна с большим диаметром, что оказывает существенное влияние на их структуру. Превышение вариабельности красных волокон по диаметру данного показателя в белых волокнах обусловлено величиной соотношения крайних по размерам максимальных и минимальных медленных волокон. Особенностью быстрых волокон рыб является уменьшение этого соотношения с увеличением массы особей (с 8.6 до 4.3). Аналогичные гипертрофированные волокна отмечены у арктических видов рыб подотряда нототениевые Notothenioidei [43–46]. Большинство рыб этого подотряда (около 120 видов) обладают лабриформным способом локомоции (за счет вращения грудных плавников) и отличаются невысокой плавательной активностью [47, 48].
У пресноводных медленно растущих видов, к которым относятся ротан Perccottus glehni, обыкновенный хулиган Gobiomorphus cotidianus, толстоголовый гольян Pimephales notatus, крупных мышечных волокон, характерных для морских глубоководных рыб не отмечено [34, 49–51]. Причем подобные различия не связаны с размерами, поскольку у мелких глубоководных светящихся анчоусов (сем. Myctophidae) диаметр, прежде всего, белых мышечных волокон достигает значительных размеров [36].
Сведения об особенностях локомоции и скорости передвижения окуня-клювача отрывочны. Результаты наблюдений за распределением и поведением окуня в пелагиали моря Ирмингера из подводного аппарата [2] свидетельствуют о перемещении отдельных особей со скоростью 1.5–2 м/с. Благодаря активной нагульной и нерестовой миграциям, обитанию в пелагиали над большими глубинами [2, 3], а также некоторым морфологическим особенностям строения тела [16], плавательная активность этого вида может быть относительно высокой.
Степень развития красных мышц на протяжении длины тела достаточно высока. У окуней соотношение красных мышц и площади поперечного среза тела составляет: за головой – 10.9 ± 1.0; под спинным плавником – 10.6 ± 1.2; в хвосте – 14.1 ± 0.7. Эта величина существенно выше, чем у таких подвижных рыб, обитающих на течении пресноводных видов, как чехонь Pelecus cultratus, жерех Aspius aspius и форель Parasalmo mikiss [52, 30 ]. При этом у некоторых активных видов антарктических нототениевых рыб Notothenia gibberitrons и Pselograco breviceps относительная площадь красных мышц составляет 22–31% [60].
По-видимому, размеры мышечных волокон также связаны с температурными условиями жизни. У видов рыб, обитающих при очень низкой температуре воды (–1.86°С), размеры волокон увеличиваются независимо от обитания в различных широтах [53–55]. При этом диаметр волокон у белокровных видов (ледяные рыбы семейства Chaenichthyidae) также больше, чем у рыб, в эритроцитах которых содержится гемоглобин [48, 56–58].
Гистоструктура локомоторной мускулатуры непосредственно приурочена к определенной части тела рыб. Процессы роста мышечной ткани, изменения диаметра волокон определяются дорсо-вентральными и кранио-каудальными градиентами [59–61]. По нашим данным, у большинства размерных групп окуня-клювача диаметр белых мышечных волокон уменьшается в каудальном направлении. Диаметр красных волокон, напротив, имеет тенденцию к увеличению в хвосте. Исследования, проведенные ранее, носят противоречивый характер. У радужной форели Parasalmo mikiss в мышцах, взятых на исследование под жировым плавником, исчезают мелкие волокна всех типов [62]. В то же время у атлантического лосося Salmo salar, независимо от режима плавания, белые волокна под спинным плавником крупнее, чем под жировым. Красные волокна, напротив, в передней части тела мельче расположенных каудальнее [63]. Два вида ледяных рыб семейства Chaenichthyidae и семь видов семейства Nototheniidae имеют характер распределения диаметров белых и красных волокон подобный тому, что отмечен для окуня-клювача. При этом считается, что наиболее вероятным фактором, влияющим на размеры мышечных волокон, являются метаболические процессы. При низком уровне обмена веществ образование молочной кислоты невелико, так что не требуется обширного развития кровеносных сосудов, как при высоком, вероятно, лимитирующем рост волокон [43]. По-видимому, это прежде всего касается белых мышечных волокон, диаметр которых в каудальном направлении уменьшается. Напротив, красные мышцы, относительная площадь которых в хвосте выше, чем в передней части тела рыб, состоят из более крупных волокон, что соответствует их энергетическим возможностям.
Наличие нетипичных по строению крупных красных волокон (двойных) у исследуемых рыб, по-видимому, не связано с нарушением условий фиксации и техникой получения гистологических срезов. Пока неясна природа подобного явления. Возможность нарушения морфогенеза может быть связана с достижением красными волокнами большого диаметра и нарушения определенного соотношения их структурных элементов. Однако у ряда видов нототениевых рыб (Сhampsocephalus gunnari, Pagothenia hansoni), отдельные красные волокна которых обладают более крупным диаметром (>150 мкм), имеют вполне типичную форму [45]. Относительно невысокая вариабельность таких волокон по периферическому и внутреннему диаметрам свидетельствует об определенной закономерности формирования подобного типа волокон. К этому подводит нас и представленный наглядный материал по этапному образованию волокон двойного строения у окуня-клювача. Достаточно ровные границы образованных структур наводят на мысль, с одной стороны, о физическом характере этого явления, а с другой – о биологическом, связанном с возможным проникновением под кожные покровы паразитических организмов.
Гистологическое строение скелетной мускулатуры окуня-клювача, в целом, подобно таковой других представителей глубоководной ихтиофауны (например, миктофовых и нототениевых). Они обладают хорошо развитыми поверхностными боковыми мышцами в каудальной части тела, что позволяет причислить их к видам рыб с достаточно высокой плавательной активностью. Условия местообитания окуня-клювача, такие как большая глубина и давление, низкие температура и содержание кислорода в воде, оказывают влияние на развитие различных систем органов и определяют скорость обменных веществ и, соответственно, процессы роста. Данный вид, как медленно растущий, обладает особенностями, характерными для других представителей ихтиофауны с невысокой скоростью роста. В состав его соматической мускулатуры входят крупные как красные, так и белые волокна, отмеченные у многих антарктических видов рыб. Наблюдаются также и общие черты по размерному распределению волокон в кранио-каудальном направлении, в зависимости от их типа, с другими глубоководными видами. Главным образом, в красных мышцах присутствуют преобразованные волокна, отличительной чертой которых является разделение их саркоплазмы на два слоя: внешний и внутренний (“двойные” волокна), что пока не получает однозначного объяснения. В связи с тем, что окунь-клювач является ценным промысловым объектом, исследования, направленные на выяснение различных сторон биологии этого вида, являются актуальными и нуждаются в дальнейшем развитии.
ЗАКЛЮЧЕНИЕ
Морфофункциональное состояние окуня-клювача, как и других пелагических глубоководных видов рыб, определяется условиями существования на большой глубине. Температурный фактор, давление, трофика, существование без света оказывают влияние на все структуры организма и, безусловно, на локомоторную функцию, что определяется развитием мышечной системы. Гистоструктура соматической мускулатуры изменяется в процессе роста окуня-клювача и проявляется на каждом этапе развития характерными чертами в виде формы, размеров, вариабельности и соотношения волокон мышц различных морфофункциональных типов. Глубоководные рыбы отличаются важной особенностью, которая выражается в высокой степени гипертрофии мышечных волокон обоих типов: белых и красных. Окунь-клювач не является исключением из этого правила (белые и красные волокна достигают в диаметре более 300 и 100 мкм соответственно). При этом достаточно хорошо выраженной особенностью этого вида является высокая степень вариабельности красных волокон по сравнению с белыми (57.0 ± 3.41 и 30.6 ± 0.89 соответственно). В отличие от других пелагических глубоководных видов рыб и прежде всего в красных мышцах, отмечены специфические структурные изменения в волокнах, выраженные в разделении саркоплазмы на два слоя. Выявленный артефакт пока носит описательный характер, но причина подобного явления неясна и требует дальнейшего исследования.
Список литературы
Павлов А.И., Мамылов В.С., Носков А.С. Распределение, особенности биологии, состояние запасов окуня-клювача (Sebastes mentella Travin) в море Ирмингера. Биоресурсы мезо- и батипелагиали открытой части Северной Атлантики. Сб. научн. трудов ПИНРО. Мурманск. 166–198. 1989. [Pavlov A.I., Mamylov V.S., Noskov A.S. Distribution, peculiarities of biology, state of stocks of beaked redfish (Sebastes mentella Travin) in the Irminger Sea. Bioresources of the meso- and bathypelagic zone of the open part of the North Atlantic. Collection of scientific works of PINRO. Murmansk. 166–198. 1989. (In Russ)].
Павлов А.И., Шибанов В.Н. Исследования биологических ресурсов пелагиали и талассобатиали открытой части Северной Атлантики. Комплексные рыбохозяйственные исследования ПИНРО на Северном бассейне: итоги и перспективы. Сб. научн. трудов ПИНРО. Мурманск. 104–117. 1991. [Pavlov A.I., Shibanov V.N. Research of biological resources of the pelagic and thalassobathials of the open part of the North Atlantic. Integrated fishery research of PINRO in the Northern basin: results and prospects. Collection Scient. Works of PINRO. Murmansk. 104–117. 1991. (In Russ)].
Мельников С.П. Океанический окунь-клювач Северной Атлантики. Мурманск. ПИНРО. 2006. [Melnikov S.P. Oceanic beaked redfish of the North Atlantic. Murmansk. PINRO. 2006. (In Russ)].
Planque B., Kristinsson K., Astakhov A., Bernreuther M., Bethke E., Drevetnyak K., Nedreaas K., Reinert J., Rolskiy A., Sigurðsson T., Stransky C. Monitoring beaked redfish (Sebastes mentella) in the North Atlantic, current challenges and future prospects. Aquatic Living Resources. 26: 293–306. 2013. https://doi.org/10.1051/alr/2013062
Барсуков В.В., Литвиненко Н.И., Серебряков В.П. Методические указания по определению видов морских окуней северной части Атлантического океана и прилегающих морей. Калининград. АтлантНИРО. 1984. [Barsukov V.V., Litvinenko N.I., Serebryakov V.P. Methodological guidelines for determining the species of redfishes in the North Atlantic Ocean and adjacent seas. Kaliningrad. AtlantNIRO. 1984. (In Russ)].
Барсуков В.В., Оганин И.А., Павлов А.И. Морфологические и экологические особенности различия S. fasciatus и S. mentella на Ньюфаулендском шельфе и банке Флемин-Кан. Вопр. ихтиол. 30(5): 791–803. 1990. [Barsukov V.V., Oganin I.A., Pavlov A.I. Morphological and ecological features of the difference between S. fasciatus and S. mentella on the Newfauland shelf and the Flemin-Kahn Bank. J. Ichthyol. 30(5): 791–803. 1990. (In Russ)].
Hureau J.P., Litvinenko N.I. Scorpaenidae. In: Fishes of the North-eastern Atlantic and the Mediterranean. UNESCO. 3: 1211–1229. 1986.
Павлов А.И. Распределение и поведение клюворылого морского окуня (Sebastes mentella Travin) на хребте Рейкъянес по наблюдениям из подводного аппарата “Север-2". Биологические ресурсы талассобатиальной зоны Мирового океана. Тезисы докл. Всесоюзн. совещания. Москва. 54–55. 1988. [Pavlov A.I. Distribution and behavior of the beaked seabass (Sebastes mentella Travin) on the Reykjanes Ridge as observed from the underwater vehicle “North-2”. Biological resources of the thalassobathial zone of the World Ocean. Theses of the Reports of the All-Union Meeting. Moscow. 54–55. 1988. (In Russ)].
Magnússon J., Magnússon J.V., Sigurdsson T. On the distribution and biology of the oceanic redfish in March 1995. ICES. C.M. G40. 1995.
Saborido-Rey F., Garabana D., Cerviño S. Age and growth of redfish (Sebastes marinus, S. mentella, and S. fasciatus) on the Flemish Cap (Northwest Atlantic). ICES J. Mar. Sci. 61(2): 231–242. 2004. https://doi.org/10.1016/j.icesjms.2003.11.003
Травин В.И. Новый вид морского окуня в Баренцевом море (Sebastes mentella, Travin sp. nov.). Докл. АН СССР. 77(4): 741–744. 1951. [Travin V.I. A new species of seabass in the Barents Sea (Sebastes mentella, Travin sp.nov.). Dokl. AS SSSR. 77(4): 741–744. 1951. (In Russ)].
Шестова Л.М. О наступлении половой зрелости окуня-клювача Баренцева и Норвежского морей. Труды ПИНРО. 37: 35–42. 1976. [Shestova L.M. On the onset of sexual maturity of the beak perch in the Barents and Norwegian Seas. Tr. PINRO. 37: 35–42. 1976. (In Russ)].
Haunscild G. Method of age determination of redfish used G.D.R. and result. ICES. C.M. G47. 1978.
Melnikov S.P. Intraspecific structure of beaked redfish Sebastes mentella of the Atlantic and Arctic oceans. J. Ichthyol. 56(1): 52–71. 2016.
Power D.J., Ni I.H. Morphometric differences between golden redfish (Sebastes marinus) and beaked redfishes (S. mentella and S. fasciatus). J. Northwest. Atl. Fish. Sci. 6: 1–7. 1985. https://doi.org/10.2960/J.V6.A1
Garabana D. The genus Sebastes Cuvier, 1829 (Pisces, Scorpaenidae) in the North Atlantic: Species and stock discrimination using traditional and geometric morphometrics. PhD Thesis. Spain. University of Vigo. 2005.
Nathanailides C., Lopez-Albors O., Abellan E., Vazquez J.M.,Tyler D.D., Rowlerson A., Stickland N.C. Muscle cellularity in relation to somatic growth in the European sea bass Dicentrarchus labrax (L.). Aquac. Res. 27: 885–889. 1996. https://doi.org/10.1046/j.1365-2109.1996.t01-1-00819.x
Patruno M., Radaelli G., Mascarello F., Candia Carnevali M.D. Muscle growth in response to changing demands of functions in the teleost during development from hatching to juvenile. Anat. Embryol. 198: 487–504. 1998. https://doi.org/10.1007/s004290050199
Galloway T.F., Kjersvik E., Kryvi H. Muscle growth and development in Atlantic cod larvae (Gadus morhua L.) related to different somatic growth rates. J. Exp. Biol. 202: 2111–2120. 1999.
Koumoundouros G., Divanach P., Kentouri M. Ontogeny and allometric plasticity of (Osteichthyes: Sparidae) in rearing conditions. Mar. Biol. 135: 561–572. 1999. https://doi.org/10.1007/s002270050657
Periago M.J., Ayala M.D., Lopez-Albors O., Abdel I., Martınez C., Garcıa-Alcazar A., Ros G., Gil F. Muscle cellularity and flesh quality of wild and farmed sea bass. Aquaculture. 249: 175–188. 2005. https://doi.org/10.1016/j.aquaculture.2005.02.047
Лав Р.М. Химическая биология рыб. Пищевая промышленность. 1976. [Lav R.M. Chemical Biology of Fish. Food Industry. 1976. (In Russ)].
Greene C.W. An undescribed longitudinal differentiation of the great lateral muscle of the king salmon. Anat. Rec. 7: 99–101. 1913.
Boddeke R., Slijpear B.J., van der Stelt. Histological characteristics of the body musculature of fishes in connection with their mode of life. Wetenschappen. Koninklijke Ned. Acad. Ser.C. 62: 576–588. 1959.
Bone.Q. On the function of the two types of myotomal muscle fibre in elasmobranch fish. J. Mar. Biol. Assoc. UK. 46: 321–349. 1966.https://doi.org/10.1017/S0025315400027168
Матюхин В.А., Хаскин В.В., Шошенко К.А. Исследование энергетики движения рыб. Новосибирск. Наука. 1984. [Matyukhin V.A., Haskin V.V., Shoshenko K.A. Investigation of the energy of fish movement. Novosibirsk. Nauka. 1984. (In Russ)].
Rome L.C., Loughna P.T., Goldspink G. Muscle fiber recruitment as a function of swim speed and muscle temperature in carp. Am. J. Physiol. 247: 272–279. 1984. https://doi.org/10.1152/ajpregu.1984.247.2.r272
Jayne B.C., Lauder G.V. How swimming fish use slow and fast muscle fibers: implications for models of vertebrate muscle recruitment. J. Compar. Physiol. 175: 123–131. 1994. https://doi.org/10.1007/BF00217443
Вракин В.Ф., Сидорова М.В., Панов В.П. Сезонные изменения и половые различия морфологического состава тела рыб некоторых видов семейства карповых. Известия ТСХА. 3: 136–145. 1981. [Vrakin V.F., Sidorova M.V., Panov V.P. Seasonal changes and sexual differences in the morphological body composition of fish species of the carp family. Izvestiya TSHA. 3: 136–145. 1981. (In Russ)].
Панов В.П. Некоторые особенности распределения красных мышц в теле карповых рыб. Интенсификация прудового рыбоводства. Сб. научн. трудов. Москва. 121–125. 1982. [Panov V.P. Some features of the distribution of red muscles in the body of cyprinids. Intensification of pond fish farming. Collected papers. Moscow. 121–125. 1982. (In Russ)].
Pankhurst N.W. Changes in body musculature with sexual maturation in the European eel, Anguilla anguilla (L.). J. Fish Biol. 21: 417–428. 1982. https://doi.org/10.1111/j.1095-8649.1982.tb02847.x
Литвер Г.М. Строение скелетных мышц в связи с их физиологическими особенностями. Архив анат., гистол. и эмбриол. 33(11): 10–17. 1956. [Litver G.M. Structure of skeletal muscles in connection with their physiological features. Arch. Anat, Histol. Embryol. 33(11): 10–17. 1956. (In Russ)].
Сидорова М.В., Панов В.П. Сезонные изменения и половые различия в гистологическом строении мышц некоторых видов рыб семейства карповых. Известия ТСХА. 1: 159–168. 1982. [Sidorova M.V., Panov V.P. Seasonal changes and sex differences in the histological structure of the muscles of some species of fish of the carp family. Izvestiya TSHA. 1: 159–168. 1982. (In Russ)].
Панов В.П., Смирнов А.Н. Гистологическое строение осевой мускулатуры ротана (Perccottus glehni Dybowski, 1877). Известия ТСХА. 3: 191–201. 1996. [Panov V.P., Smirnov A.N. The histological structure of the axial muscles of the Amur sleeper (Perccottus glehni Dybowski, 1877). Izvestiya TSHA. 3: 191-201. 1996. (In Russ)].
Greer-Walker M., Pull G.M. A survey of red and white muscle in marine fish. J. Fish Biol. 7: 295–300. 1975. https://doi.org/10.1111/j.1095-8649.1975.tb04602.x
Panov V.P., Falii S.S., Orlov A.M., Artemenkov D.V. Histostructure of the locomotor apparatus in the three deep-water species of lanternfishes (Myctophidae): Myctophum punctatum, Notoscopelus kroyeri and Lampanytus macdonaldi. J. Ichthyol. 59(6): 928–937. 2019. https://doi.org/10.1134/S0032945219060092
Manual for the International Deep Pelagic Ecosystem Survey in the Inninger Sea and Adjacent Waters. Series of ICES Survey Protocols SISP 11. IDEEPS VI. ICES. 2015.
Аппельт Г. Введение в методы микроскопического исследования. М. МЕДГИЗ. 1959. [Appelt G. Introduction to methods of microscopic examination. M. MEDGIZ. 1959. (In Russ)].
Автандилов Г.Г. Морфометрия в патологии. М. Медицина. 1973. [Avtandilov G.G. Morphometry in Pathology. M. Medicine. 1973. (In Russ)].
Johnston I.A., Moon T.W. Fine structure and metabolism of multiply innervated fast muscle fibres in teleost fish. Cell Tissue Res. 219: 93–109. 1981. https://doi.org/10.1007/BF00210021
Johnston I.A., Bernard L.M. Ultrastructure and metabolism of skeletal muscle fibres in the tench: Effects of long-term acclimation to hypoxia. Cell Tissue Res. 227: 179–199. 1982. https://doi.org/10.1007/BF00206340
Sanger A.M., Kim Z.S., Adam H. The fine structure of muscle fibres of roach, Rutilus rutilus (L), and chub, Leuciscus cephalus (L.), Cyprinidae, Teleostei: interspecific differences and effects of habitat and season. J. Fish Biol. 36: 205–213. 1990. https://doi.org/10.1111/j.1095-8649.1990.tb05596.x
Smialowska E., Kilarski W. Histological analysis of fibers myotomes of Antarctic fish (Admiralty Bay, King George Island, South Shetland Island) I. Comparative analisis of muscle fiber size. Pol. Polar Res. 2: 109–129. 1981.
Davison W., Macdonald J.F. A histochemical study of swimming musculature of Antarctic fish. New Zealand J. Zool. 12: 473–483. 1985. https://doi.org/10.1080/03014223.1985.10428299
Dunn J.E., Archer S.D., Johnston I.A. Muscle Fibre Types and Metabolism in Post-Larval and Adult Stages of Notothenioid. Polar Biol. 9: 213–223. 1989. https://doi.org/10.1007/BF00263769
Battram J.C., Johnston I.A. Muscle growth in the Antarctic teleost Notothenia neglecta (Nybelin). Antarct. Sci. 3: 29–33. 1991. https://doi.org/10.1017/S0954102091000068
Archer S.D., Johnston I.A. Kinematics of labriform and subcarangiform swimming in the Antarctic fish Notothenia neglecta. J. Exp. Biol. 143: 195–210. 1989.
Brien K.M., Skilbeck C., Sidell B.D., Egginton S. Muscle fine structure may maintain of oxidative fibres in haemoglobinless Antarctic fishes. J. Exp. Biol. 206: 411–421. 2003. https://doi.org/10.1242/jeb.00088
Gill H.S., Weatherley A.H., Bresania T. Histochemical characterization of myotomal muscle in the bluntnose minnow, Pimephales notatus Rafinesque. J. Fish Biol. 21: 205–214. 1982. https://doi.org/10.1111/j.1095-8649.1982.tb04000.x
Davison W. The lateral musculature of the common bully, Gobiomorphus cotidianus, a freshwater fish from New Zealand. J. Fish Biol. 23: 143–151. 1983. https://doi.org/10.1111/j.1095-8649.1983.tb02889.x
Weatherley A.H., Gill H.S. Growth dynamics of white myotomal muscle fibres in the bluntnose minnow, Pimephales notatus Rafinesque, and comparison with rainbow trout, Salmo gairdneri Richardson. J. Fish Biol. 25: 13–24. 1984. https://doi.org/10.1111/j.1095-8649.1984.tb04846.x
Gatz Jr. A.J. Speed, Stamina, and Muscles in Fishes. J. Fish Res. Board Can. 30: 325–328. 1973.
Egginton S., Johnston I.A. Effects of acclimation temperature on routine metabolism muscle mitochondrial volume density and capillary supply in the elver (Anguilla anguilla L.). J. Thermal Biol. 9(3): 165–170. 1984. https://doi.org/10.1016/0306-4565(84)90016-0
Egginton S., Sidell B.D. Thermal acclimation induces adaptive changes in subcellular structure of fish skeletal muscle. Am. J. Physiol. 256(1): 1–9. 1989. https://doi.org/10.1152/ajpregu.1989.256.1.r1
Rodnick K.J., Sidell B.D. Structural and biochemical analyses of cardiac ventricular enlargement in cold-acclimated striped bass. Am. J. Physiol. 273: 252–258. 1997. https://doi.org/10.1152/ajpregu.1997.273.1.R252
Fitch N.A., Johnson I.A., Wood R.E. Skeletal muscle capillary supply in a fish that lacks respiratory pigments. Resp. Physiol. 57: 201–211. 1984. https://doi.org/10.1016/0034-5687(84)90093-8
Archer S.D., Johnston I.A. Density of cristae and distribution of mitochondria in the slow muscle fibres of Antarctic fish. Physiol. Zool. 64: 242–258. 1991.
Johnston I.A., Calvo J., Guderley H., Fernandes D., Palmer L. Latitudinal variation in the abundance and oxidative capacities of muscle mitochondria in perciform fish. J. Exp. Biol. 201: 1–12. 1998.
Stickland N.C. Growth and development of muscle fibres in the rainbow trout (Salmo gairdneri). J. Anat. 137: 323–333. 1983. PMCID: PMC1171824
Kiessling A., Storebakkenc T., Asgard T., Kiessling K.-H. Changes in the structure and function of the epaxial muscle of rainbow trout (Oncorhynchus mykiss) in relation to ration and age I. Growth dynamics. Aquaculture. 93: 335–356. 1991. https://doi.org/10.1016/0044-8486(91)90226-W
Abdel I., Lopez-Albors O., Ayala M.D., Garcıa-Alcazar A., Abellan E., Latorre R., Gil F. Muscle Cellularity at Cranial and Caudal Levels of the Trunk Musculature of Commercial Size Sea Bass, Dicentrarchus labrax (Linnaeus, 1758). Anat. Histol. Embryol. 34: 280–285. 2005. https://doi.org/10.1111/j.1439-0264.2005.00613.x
Johnston I.A., Ward P.S., Goldspink G.J. Studies on the swimming musculature of the rainbow trout I. Fibre types. J. Fish Biol. 7: 451–458. 1975. https://doi.org/10.1111/j.1095-8649.1975.tb04620.x
Totland G.K., Kryvi H., Jodestol K.A., Christiansen E.N., Tangeras A., Slinde E. Growth and composition of the swimming muscle of adult Atlantic salmon (Salmo salar L.) during long-term sustained swimming. Aquaculture. 66: 299–313. 1987. https://doi.org/10.1016/0044-8486(87)90115-3
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


