Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 2, стр. 243-257
Сравнительная характеристика аминокислотного состава и активности ферментов аминокислотного обмена в гемохориальной плаценте разных видов животных и человека
Т. Н. Погорелова 1, *, В. О. Гунько 1, А. А. Никашина 1, И. А. Аллилуев 2
1 Ростовский государственный медицинский университет
Ростов-на-Дону, Россия
2 Южный Федеральный университет
Ростов-на-Дону, Россия
* E-mail: tnp.rniiap@yandex.ru
Поступила в редакцию 29.09.2020
После доработки 26.11.2020
Принята к публикации 17.12.2020
Аннотация
Изучен аминокислотный состав и активность ферментов аминокислотного обмена тканей плаценты. Объектом исследования являлись морские свинки (Cavia porcellus) и макаки-резус (Macaca mulatta), имеющие, подобно человеку, гемохориальный тип плаценты. В исследование были также включены женщины с неосложненным течением беременности и срочными родами (39–40 нед.). Установлено, что во всех исследованных тканях наибольшее количество свободных и связанных аминокислот содержится в плодовой части плаценты. В плодовой части плаценты обнаружена и максимальная активность ферментов аминокислотного обмена: аминотрансфераз, дезаминаз, аминосинтетаз. Общим для плаценты морских свинок, обезьян и человека является также высокий уровень дикарбоновых аминокислот и глутамина. Наряду с общими чертами, в аминокислотном обмене плаценты разных видов животных и человека выявлены некоторые различия, обусловленные эволюционными особенностями развития органа, спецификой сложившихся материнско-плодовых взаимоотношений. Межвидовые отличия однотипных частей плаценты касаются отдельных аминокислот, содержание большинства из которых в плаценте грызунов превышает аналогичные показатели у приматов. Между плацентами человека и обезьяны различия изученных биохимических показателей менее выражены. Еще одним отличием плаценты морской свинки от плаценты человека и обезьяны является неодинаковое нековалентное связывание аминокислот с биополимерами, модифицирующее состояние акцепторных групп белков. Аналогичные ткани последа разных видов животных и человека отличаются и активностью ферментов аминокислотного обмена. Между содержанием свободных аминокислот и показателями активности ферментов имеется тесная корреляционная зависимость, свидетельствующая об их важной роли в формировании плацентарного аминокислотного фонда.
Определяющей чертой эволюционного процесса явилось усиление независимости развивающегося организма от внешних условий, поэтому появление плацентарных млекопитающих стало вершиной филогенетического развития. Относительное постоянство и необходимый состав внутренней среды организма высших животных и человека в процессе пренатального онтогенеза обеспечивается в основном плацентой, осуществляющей взаимосвязь между организмом матери и плодом и создающей оптимальные условия для его роста и развития. Плацента – самый молодой в эволюционном ряду орган, отличающийся прежде всего тем, что за относительно небольшой период времени претерпевает быстрое развитие и достигает полной зрелости. Это предъявляет повышенные требования к метаболическим процессам, лежащим в основе функционирования плаценты. В процессе эволюции становление плацентарного барьера шло по пути наиболее тесного контакта между кровью матери и плода. Оптимальные условия в этом отношении характерны для гемохориального типа плаценты (приматы, грызуны), в которой кровотоки плода и матери наиболее сближены и разделены лишь эндотелием плодовых капилляров, стромой и эпителиальным покровом хориальных ворсин. Гемохориальная плацента представляет собой одну из наиболее сложных тканей организма. Уникальная структура плаценты определяет ее чрезвычайную полифункциональность: она выполняет трофическую, дыхательную, защитную, транспортную, гормонпродуцирующую и другие функции [1–3].
В числе многочисленных функций плаценты важная роль принадлежит снабжению эмбриона и плода питательными веществами. Среди этих веществ одно из ведущих мест занимают свободные аминокислоты, прежде всего, как структурные составляющие белковых молекул, поскольку плацента, являясь быстро развивающимся органом, характеризуется чрезвычайно высокой скоростью синтеза белков [4, 5]. Помимо участия в биосинтезе плацентарных белков, аминокислоты включаются в энергетический обмен, служат предшественниками многих биоактивных компонентов, таких как вазоактивные соединения, полиамины, структурные компоненты нуклеиновых кислот [6, 7]. Некоторые из них выполняют самостоятельные функции, в частности, как индукторы синтеза гормонов, регуляторы иммунного ответа, активаторы клеточной дифференциации и пролиферативных процессов, интенсивно протекающих в фетоплацентарном комплексе [8, 9]. Кроме того, исследования последних лет позволили установить, что трансплацентарный переход аминокислот от матери к плаценте и от плаценты к плоду влияет на “внутриутробное программирование” постнатальной патологии [10]. Многочисленные химические реакции, в которых участвуют аминокислоты, перерабатывая и реализуя внешнюю информацию, осуществляются с помощью различных ферментов, нередко соединяющих аминокислотный метаболизм с другими видами обмена.
В настоящее время известно, что фонд аминокислот различных тканей складывается из двух фракций – свободных и нековалентно связанных с белками. Впервые сообщение о связанных аминокислотах было опубликовано в статье Elliott [11]. Связи этих аминокислот – ионные, водородные, гидрофобные и другие – менее прочные, чем пептидные. Они разрушаются при сдвиге pH, изменении ионного состава среды, обработке гипотоническими растворами [12]. Связанные аминокислоты, являясь регуляторами вторичной и третичной структур белков, могут стабилизировать или, напротив, модифицировать белковую молекулу. Для нормального функционирования органов, очевидно, важен не только абсолютный уровень аминокислот, но и соотношение свободных и связанных форм. Однако сведения о них немногочисленны, особенно это касается плаценты [13].
Исходя из вышеизложенного, настоящая работа посвящена изучению содержания свободных и связанных аминокислот, а также активности некоторых ферментов аминокислотного обмена в тканях гемохориальной плаценты разных видов животных и человека с целью выяснения возможных различий и сходства между ними.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служили 36 морских свинок (Cavia porcellus) с датированным сроком беременности (точность установления начала беременности 6 ч, роды в 59–60 дней), находящихся в обычных условиях вивария на стандартном пищевом рационе и 9 макак-резус (Macaca mulatta) с датированным сроком беременности (точность установления начала беременности 2–3 дня, роды в 161–164 дня), находящихся в вольерах МБУ “Ростовский-на-Дону зоопарк”. В исследование были также включены 32 клинически здоровые женщины с неосложненным течением беременности и своевременными родами (39–40 нед.). Обследованные женщины наблюдались и были родоразрешены в Ростовском НИИ акушерства и педиатрии в рамках программы “Акушерский мониторинг”.
Материалом исследования служили плодовая и материнская части плацент. Плодовая часть плаценты у человека и обезьяны представлена ворсистым хорионом, материнская – децидуальной оболочкой. У морской свинки плодовая часть – лабиринтные и внелабиринтные отделы трофобласта, а материнская – тонкий слой децидуальных клеток, прилегающих к эндометрию матки. Плаценты брали сразу после родов при соблюдении холодового режима (4°С). Вырезанные образцы (10 г) промывали охлажденным физиологическим раствором и гомогенизировали (при 2–4°С) с помощью гомогенизатора Ultra-Turrax (IKA, Германия) в PBS-буфере.
В безбелковых экстрактах тканей определяли содержание свободных аминокислот на автоматическом анализаторе ААА-400 (Microtechno, Чехия). Подготовку тканей и анализ проводили согласно инструкции к анализатору по стандартной программе с использованием трех натрий-цитратных буферных растворов pH 3.25, 4.25 и 5.28. Идентификацию аминокислот, расчет площади пиков и определение концентрации осуществляли по результатам анализа соответствующих стандартов (Sigma-Aldrich, США) для калибровки анализатора.
Аминокислоты, нековалентно связанные с белками (или белково-липидными комплексами), определяли после многоступенчатой обработки гомогенатов солевыми растворами [12]. Для этого навески тканей плаценты гомогенизировали в 4-х объемах солевой смеси, содержащей 0.15 М растворы NaCl, KCl, H2SO4 и 0.11 M раствор фосфатного буфера (рН 7.6). Гомогенат после повторного замораживания и оттаивания центрифугировали при 0°С в течение 15 мин при 20 000 g (центрифуга Avanti J-30I Beсkman Coulter, США). Осадок I промывали дважды указанной солевой смесью и центрифугировали при тех же условиях. Двукратное промывание осадка достаточно, поскольку последующие элюаты не содержали свободных аминокислот. Полученный осадок II суспендировали в дистиллированной воде и добавляли 10%-ный раствор сульфосалициловой кислоты, при этом осаждались белки и одновременно освобождались связанные аминокислоты. После отделения белков 10-минутным центрифугированием при 6000 g в надосадочной жидкости определяли связанные аминокислоты, количественную оценку содержания которых также проводили на анализаторе.
Активность аспартат- (АСТ, КФ 2.6.1.1), аланин- (АЛТ, КФ 2.6.1.2), цистеин- (Цис-Т, КФ 2.6.1.3), тирозин- (Тир-Т, КФ 2.6.1.5) аминотрансфераз определяли по приросту глутаминовой кислоты после инкубации соответствующей аминокислоты с α-кетоглутаровой кислотой. Об активности фосфат-активируемой глутаминазы (ФАГ; КФ 3.5.1.2) и активности глутаминсинтетазы (ГС; КФ 6.3.1.2) судили по снижению количества глутамина или соответственно по его приросту. Содержание глутаминовой кислоты и ее амида глутамина измеряли на аминокислотном анализаторе. Активность глутамин-кетокислотной аминотрансферазы (ГКТ, КФ 2.6.1.15) определяли по накоплению количества аммиака, оцененного спектрофотометрически с помощью реакции несслеризации после инкубации глутамина с щавелевоуксусной кислотой. Активность глутаматдегидрогеназы (ГДГ, КФ 1.4.13) оценивали по приросту восстановленного никотинамидадениндинуклеотида при длине волны 340 нм. При проведении ферментативных реакций использовали известные инкубационные смеси [14].
Статистическую обработку данных проводили с помощью лицензионного пакета программ Statistica 6.0. (StatSoft Inc.). Оценка характера распределения данных с помощью критерия Шапиро–Уилка свидетельствует об их нормальном распределении. Данные представлены как среднее ± стандартная ошибка среднего (M ± SEM). Статистическая обработка выполнена с помощью дисперсионного анализа (ANOVA) и теста Тьюки (Tukey) для множественного сравнения средних величин. Корреляционный анализ выполнен с использованием критерия Пирсона и расчетом коэффициента корреляции r. Результаты оценивали как статистически значимые при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о том, что у всех взятых объектов содержание свободных аминокислот в плодовой части плаценты выше, чем в материнской (табл. 1).
Таблица 1.
Содержание свободных аминокислот в плаценте разных видов животных и человека Table 1. Content of free amino acids in placenta of different animal and human species
| Амино кислоты, мкмоль/г ткани Amino acids, µmol/g of tissue |
Морская свинка
Guinea pig n = 36 |
Обезьяна
Monkey n = 9 |
Человек
Human n = 32 |
|||
|---|---|---|---|---|---|---|
| плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
|
| Лиз/Lys | 0.46 ± 0.03 | 0.38 ± 0.03 | 0.31 ± 0.02 p1 < 0.001 |
0.26 ± 0.02 p1 < 0.01 |
0.34 ± 0.03 р2 < 0.01 |
0.29 ± 0.02 р2 < 0.05 |
| Арг/Arg | 0.44 ± 0.04 | 0.34 ± 0.03 | 0.29 ± 0.02 p1 < 0.001 | 0.20 ± 0.01 p1 < 0.001 |
0.31 ± 0.03 р2 < 0.001 | 0.24 ± 0.02 р2 < 0.01 |
| Асп/Asp | 1.29 ± 0.08 | 0.74 ± 0.05 | 0.77 ± 0.05 p1 < 0.001 | 0.51 ± 0.04 p1 > 0.05 |
0.98 ± 0.06 р2 < 0.001 | 0.59 ± 0.04 р2 > 0.05 |
| Тре/Thr | 0.27 ± 0.02 | 0.20 ± 0.01 | 0.36 ± 0.03 p1 = 0.01 | 0.25 ± 0.02 p1 > 0.05 |
0.42 ± 0.03 р2 < 0.001 |
0.30 ± 0.03 р2 < 0.001 |
| Сер/Ser | 0.38 ± 0.03 | 0.19 ± 0.02 | 0.54 ± 0.03 p1 < 0.001 |
0.32 ± 0.03 p1 < 0.01 |
0.58 ± 0.04 р2< 0.001 |
0.36 ± 0.03 р2 < 0.001 |
| Глу/Glu | 2.55 ± 0.19 | 1.61 ± 0.11 | 1.53 ± 0.10 p1 < 0.001 |
1.02 ± 0.07 p1 < 0.001 |
1.92 ± 0.16 р2 < 0.001 |
1,27 ± 0.07 р2 < 0.05 |
| Глн/Gln | 0.40 ± 0.03 | 0.25 ± 0.02 | 0.56 ± 0.03 p1 < 0.001 |
0.34 ± 0.03 p1 < 0.05 |
0.70 ± 0.05 р2 < 0.001 |
0.43 ± 0.03 р2 < 0.001 |
| Ала/Ala | 0.50 ± 0.04 | 0.33 ± 0.02 | 0.65 ± 0.04 p1 < 0.01 |
0.43 ± 0.03 p1 > 0.05 |
0.87 ± 0.06 р2 < 0.001 |
0.54 ± 0.05 р2 < 0.001 |
| Вал/Val | 0.62 ± 0.05 | 0.44 ± 0.03 | 0.34 ± 0.02 p1 < 0.001 |
0.32 ± 0.03 p1 < 0.01 |
0.43 ± 0.04 р2 < 0.001 |
0.28 ± 0.03 р2 < 0.001 |
| Мет/Met | 0.27 ± 0.02 | 0.16 ± 0.01 | 0.15 ± 0.01 p1 < 0.001 |
0.10 ± 0.01 p1 < 0.01 |
0.17 ± 0.01 р2 < 0.001 |
0.12 ± 0.01 р2 < 0.05 |
| Лей/Leu | 0.56 ± 0.05 | 0.32 ± 0.02 | 0.38 ± 0.03 p1 < 0.001 |
0.23 ± 0.02 p1 < 0.05 |
0.46 ± 0.04 р2 < 0.01 |
0.27 ± 0.02 р2 > 0.05 |
| Тир/Tyr | 0.41 ± 0.04 | 0.34 ± 0.03 | 0.29 ± 0.02 p1 < 0.001 |
0.27 ± 0.02 p1 < 0.05 |
0.31 ± 0.02 р2 < 0.01 |
0.24 ± 0.02 р2 < 0.01 |
Здесь и в табл. 2 и 3: статистическая значимость между показателями морской свинки и обезьяны – р1, морской свинки и человека – р2. Данные представлены как M ± SЕМ. Here and in table 2 and table 3: statistical significance between indicators of guinea pig and monkey – p1, guinea pig and human – p2. Data presented as M ± SEM.
Суммарное содержание свободных аминокислот в плодовой части плаценты морской свинки превышает аналогичные величины в материнской части в 1.54 раза. Для плаценты обезьян это отличие составляло 1.45, а для плаценты человека – 1.52 раза. Межтканевые различия имеют место и для связанных аминокислот, содержание которых в плодовой части плаценты морской свинки, обезьяны и человека выше, чем в материнской соответственно в 1.55, 1.62 и 1.57 раз (табл. 2). Во всех изученных объектах уровень связанных аминокислот ниже, чем свободных. Коэффициенты отношения свободных аминокислот к их связанным фракциям в разных частях плаценты животных и человека колеблются в среднем от 4.7 до 5.4. Данные отличия в аминокислотном обмене тканей плаценты, очевидно, зависят от своеобразия их морфофункциональных характеристик в связи с неодинаковой ролью в процессе внутриутробного развития плода. О высокой метаболической активности фетальной части плаценты по сравнению с материнской свидетельствует также значительная концентрация в ней нуклеиновых кислот, белков, наибольшая скорость синтеза белков [15]. Эти метаболические “преимущества” ворсистого хориона, по-видимому, связаны с его центральной ролью в обмене веществ между материнским организмом и плодом.
Таблица 2.
Содержание связанных аминокислот в плаценте разных видов животных и человека Table 2. The content of bound amino acids in the placenta of different animal and human species
| Амино кислоты, мкмоль/г ткани Amino acids, µmol/g of tissue |
Морская свинка
Guinea pig n = 36 |
Обезьяна
Monkey n = 9 |
Человек
Human n = 32 |
|||
|---|---|---|---|---|---|---|
| плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
|
| Лиз/Lys | 0.093 ± 0.007 | 0.059 ± 0.003 | 0.151 ± 0.009 p1 < 0.001 |
0.087 ± 0.005 p1 < 0.05 |
0.158 ± 0.011 р2 < 0.001 |
0.091 ± 0.006 р2 < 0.05 |
| Гис/His | 0.061 ± 0.004 | 0.043 ± 0.003 | 0.088 ± 0.005 p1 < 0.001 |
0.062 ± 0.004 p1 < 0.05 |
0.102 ± 0.006 р2 < 0.001 |
0.058 ± 0.004 р2 > 0.05 |
| Асп/Asp | 0.371 ± 0.027 | 0.191 ± 0.011 | 0.199 ± 0.012 p1 < 0.001 |
0.117 ± 0.007 p1 < 0.01 |
0.240 ± 0.015 р2 < 0.001 |
0.139 ± 0.009 р2 < 0.05 |
| Тре/Thr | 0.021 ± 0.002 | 0.015 ± 0.001 | 0.029 ± 0.002 p1 < 0.05 |
0.022 ± 0.001 p1 < 0.05 |
0.033 ± 0.002 р2 < 0.001 |
0.025 ± 0.002 р2 < 0.05 |
| Сер/Ser | 0.058 ± 0.004 | 0.042 ± 0.003 | 0.083 ± 0.005 p1 < 0.01 |
0.056 ± 0.004 p1 < 0.05 |
0.096 ± 0.006 р2 < 0.001 |
0.066 ± 0.004 р2 < 0.01 |
| Глу/Glu | 0.741 ± 0.049 | 0.505 ± 0.046 | 0.381 ± 0.028 p1 < 0.001 |
0.216 ± 0.019 p1< 0.001 |
0.455 ± 0.035 р2 < 0.001 |
0.298 ± 0.083 р2 < 0.001 |
| Глн/Gln | 0.072 ± 0.005 | 0.051 ± 0.003 | 0.094 ± 0.005 p1 < 0.05 |
0.068 ± 0.002 p1 > 0.05 |
0.106 ± 0.007 р2 < 0.001 |
0.076 ± 0.006 р2 < 0.01 |
| Ала/Ala | 0.077 ± 0.005 | 0.040 ± 0.003 | 0.099 ± 0.005 p1 < 0.05 |
0.052 ± 0.004 p1 > 0.05 |
0.107 ± 0.007 р2 < 0.001 |
0.057 ± 0.005 р2 < 0.05 |
| Вал/Val | 0.067 ± 0.005 | 0.044 ± 0.003 | 0.049 ± 0.004 p1 < 0.001 |
0.032 ± 0.002 p1 < 0.05 |
0.052 ± 0.004 р2 < 0.01 |
0.035 ± 0.002 р2 > 0.05 |
| Мет/Met | 0.032 ± 0.002 | 0.024 ± 0.002 | 0.023 ± 0.001 p1 < 0.01 |
0.017 ± 0.001 p1 < 0.05 |
0.025 ± 0.001 р2 < 0.05 |
0.015 ± 0.001 р2 < 0.001 |
| Лей/Leu | 0.075 ± 0.006 | 0.051 ± 0.004 | 0.056 ± 0.004 p1 < 0.05 |
0.035 ± 0.002 p1 < 0.05 |
0.060 ± 0.004 р2 < 0.05 |
0.043 ± 0.003 р2 > 0.05 |
| Тир/Tyr | 0.044 ± 0.003 | 0.037 ± 0.002 | 0.031 ± 0.001 p1 < 0.01 |
0.026 ± 0.001 p1 < 0.01 |
0.034 ± 0.002 р2 < 0.05 |
0.029 ± 0.002 р2 < 0.05 |
Помимо межтканевых вариаций, для содержания аминокислот однотипных частей плаценты характерны существенные межвидовые отличия. Плацента морской свинки отличается более высоким уровнем многих аминокислот по сравнению с таковым в тканях человека и обезьяны. Это различие может быть связано с особенностями анте- и пренатального развития плодов морской свинки, рождающихся более зрелыми. Между суммарным уровнем свободных аминокислот в плаценте человека и обезьяны различия менее выражены.
Сопоставление содержания отдельных аминокислот выявило более значимые как межтканевые, так и межвидовые отличия. В плодовой и материнской частях плаценты обезьяны содержание свободных фракций лизина, аргинина, аспарагиновой и глутаминовой кислот, тирозина, метионина, валина ниже, чем соответствующие величины в тканях морской свинки (в среднем на 20.6–45.2%, рис. 1).
Рис. 1.
Отличия содержания свободных аминокислот в тканях плаценты приматов относительно показателей у морской свинки. Здесь и на рис. 2 и 3: для плодовой и материнской частей плаценты обезьян n = 9; для плодовой и материнской частей плаценты человека n = 32. Обозначения: здесь и на рис. 2 и 3: * – различия между показателями морской свинки и обезьяны статистически значимы при p < 0.05, # – различия между показателями морской свинки и человека статистически значимы при p < 0.05. Принятые на рис. 1 и 2 сокращения: Лиз – лизин, Арг – аргинин, Гис – гистидин, Асп – аспарагиновая кислота, Тре – треонин, Сер – серин, Глу – глутаминвоая кислота, Глн – глутамин, Ала – аланин, Вал – валин, Мет – метионин, Лей – лейцин, Тир – тирозин. Fig. 1. Differences in the content of free amino acids in Primate placental tissues relative to those in guinea pigs. Here and in Figs. 2 and 3: for the fetal and maternal parts of the placenta of monkeys n = 9; for fruit and motherpart of the human placenta n = 32.Note: * – the differences between the indicators of the guinea pig and the monkey are statistically significant at p < 0.05, # – the differences between the indicators of the guinea pig and the human are statistically significant at p < 0.05. Abbreviations in Fig. 1 and 2: Lys – lysine, Arg – arginine, His – histidine, Asp – aspartic acid, Tre – threonine, Ser – serine, Glu – glutamic acid, Gln – glutamine, Ala – alanine, Val – valine, Met – methionine, Leu – leucine, Tyr – tyrosine.

Особый интерес представляет более высокий уровень аргинина в плаценте морской свинки. Эта аминокислота играет важную роль в развитии беременности как предшественник биосинтеза оксида азота и полиаминов. Повышенное содержание аргинина приводит к увеличению продукции полиаминов, необходимых для поддержания синтеза макромолекул и пролиферации клеток, значительная активность которой характерна для плаценты [16]. В экспериментальных исследованиях на мышах с гемохориальной плацентой показано позитивное влияние полиаминов на процесс развития беременности [17]. Известная способность полиаминов усиливать процессы фосфорилирования (особенно циклонуклеотидзависимого) в плаценте обеспечивает посттрансляционную модификацию белков, направленную на повышение их функциональной активности [18]. Кроме того, увеличение содержания полиаминов может приводить к относительной дезактивации транскрипционного фактора NF-kB, уменьшению экспрессии белка p53 [19] и, как следствие, снижению интенсивности апоптоза. Не менее важное значение имеет усиление плацентарной продукции оксида азота, сопровождающееся улучшением процессов гемодинамики и поддержанием полноценного кровотока во всей биологической системе мать–плацента–плод.
Более высокий показатель содержания лизина в плаценте морской свинки, очевидно, создает оптимальные условия для метаболических процессов, протекающих с его участием, в частности, синтеза карнитина, оксилизина, митохондриального окисления жирных кислот. Определенное позитивное влияние на развитие плаценты морской свинки по сравнению с плацентой приматов может также оказывать более высокий уровень метионина, который служит источником метильных групп биосинтеза нуклеотидов, ДНК, фосфолипидов [20].
Дополнительную роль в развитии плаценты морских свинок, вероятно, играет и повышенный уровень дикарбоновых аминокислот – глутаминовой и аспарагиновой, которые участвуют в синтезе других аминокислот, нуклеиновых кислот, ряда биоактивных соединений, в регуляции ферментативных реакций, сопряженных с циклом трикарбоновых кислот. Дикарбоновые аминокислоты участвуют также в регуляции буферных систем, в которых они выполняют функции анионов [12]. Можно предположить, что эти отличия вносят определенный вклад в обеспечение полноценного развития плаценты и внутриутробного развития плода морской свинки за весьма короткую длительность гестации.
Уровень содержания свободных треонина, глутамина, аланина, серина в разных частях плаценты обезьяны, напротив, превышает аналогичные величины у морской свинки (на 30.0–42.1% и 30.0–68.4% соответственно). Сходные отличия в содержании указанных аминокислот установлены и для тканей человека по сравнению с соответствующими показателями у морской свинки. Более высокие концентрации четырех аминокислот в плацентах обезьяны и человека, особенно в плодовой части, по сравнению с таковыми в плаценте морской свинки с учетом их метаболических функций [5, 8], по-видимому, могут оказывать некоторое положительное влияние на общий азотистый обмен в ворсинах трофобласта, являющихся основной структурной составляющей гемохориальной плаценты приматов.
Рис. 2.
Отличия содержания связанных аминокислот в тканях плаценты приматов относительно показателей у морской свинки. Fig. 2. Differences in the content of bound amino acids in Primate placental tissues relative to those in guinea pigs.

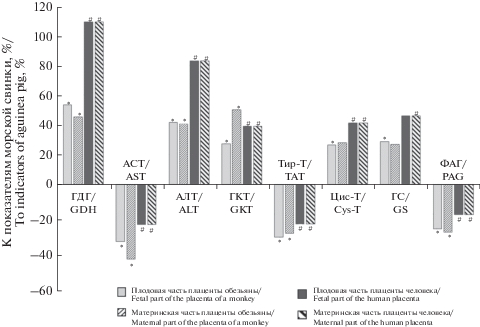
Рис. 3.
Отличия активности ферментов аминокислотного обмена плаценты приматов относительно показателей у морской свинки. Принятые на рис. 3 сокращения: ГДГ – глутаматдегидрогеназа, АСТ –аспартатаминотрансфераза, АЛТ – аланинаминотрансфераза, ГКТ – глутамин-кетокислотная аминотрансфераза, Тир-Т – тирозинаминотрансфераза, Цис-Т – цистеинаминострансфераза, ГС – глутаминсинтетаза, ФАГ – фосфат-активируемая глутаминаза. Fig. 3. Differences in the activity of enzymes of amino acid metabolism of the placenta of primates relative to those in the guinea pig. Abbreviations in Fig. 3: GDH – glutamatedehydrogenase, AST – aspartate aminotransferase, ALT – alanine aminotransferase, GKT – glutamine-ketoacid transaminase, Tyr-T – tyrosine transaminase, Cys-T – cysteine transaminase, GS – glutamine synthetase, PAG – phosphate-activated glutaminase.
Статистически значимые отличия в тканях плаценты человека и животных характерны также для содержания связанных фракций некоторых аминокислот (рис. 2). Так, в плодовой и материнской частях плаценты обезьяны и человека доля связанных диаминокислот от общего их уровня выше, чем в аналогичных тканях морской свинки. Величины связанного лизина в плодовой части плаценты обезьяны и человека превышают таковые у морской свинки на 62.4 и 69.9%, в а материнской части – на 47.5 и 54.2% соответственно. Для связанного гистидина в плодовой части плаценты обезьяны и человека увеличение составляет соответственно 44.3 и 67.2%, в материнской части – 44.2 и 34.9% относительно его показателей у морской свинки. Более низкий уровень у морской свинки гистидина, содержащего имидазольную группу, может понижать защищенность ряда участков полипептидной цепи к действию протеолитических ферментов, повреждающих структуру белков. Для связанных дикарбоновых аминокислот наблюдается противоположная направленность различий. Так, концентрация связанной формы аспарагиновой кислоты в плодовой части плаценты обезьяны на 46.4%, а у человека на 35.3% ниже, чем у морской свинки. Уровень этой аминокислоты в материнской части плаценты обезьяны и человека снижен на 38.7 и 27.2% соответственно относительно аналогичной величины у морской свинки. Отличие в содержании противоположно заряженных связанных аминокислот, возможно, обусловлено особенностями структуры белков в указанных тканях. Следует отметить, что, в свою очередь, даже незначительные модификации в содержании связанных аминокислот могут отражаться на различных уровнях структуры белков. В частности, отличия в содержании связанных форм незаряженных полярных аминокислот – треонина, серина, глутамина, а также гидрофобных – метионина, аланина, валина и лейцина, по-видимому, по-разному влияют на степень электростатических взаимодействий и количество водородных связей в белках [21]. Эти особенности сказываются на степени спирализации и растворимости белков [22] и, следовательно, их функциональной активности, отражаясь на всем метаболизме плацент исследованных объектов.
Общим для всех тканей последа является высокий уровень глутаминовой кислоты, особенно ее свободной формы. Этот факт, очевидно, обусловлен важной ролью глутаминовой кислоты в метаболизме трофобласта. Установлено, что 25% дыхания митохондрий плаценты человека поддерживается за счет ее окисления [23]. Кроме того, для глутаминовой кислоты в отличие от других аминокислот обнаружено интенсивное поглощение плацентой из крови пуповины. Высоким содержанием отличается также аспарагиновая кислота, выполняющая важные функции в аминокислотном обмене.
Что касается активности изученных ферментов, то для большинства из них она отличается в разных тканях плаценты животных и человека (табл. 3, рис. 3). Максимальная активность изученных ферментов, как и аминокислот, обнаруживается в фетальной части плаценты.
Таблица 3.
Активность ферментов аминокислотного обмена в плаценте разных видов животных и человека Table 3. Activity of amino acid metabolism enzymes in the placenta of different animal and human species
| Ферменты,
нмоль/мин мг белка Enzymes, nmol/min mg of protein |
Морская свинка
Guinea pig n = 36 |
Обезьяна
Monkey n = 9 |
Человек
Human n = 32 |
|||
|---|---|---|---|---|---|---|
| плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
плодовая часть плаценты fetal part of placenta |
материнская часть плаценты maternal part of placenta |
|
| Глутаматдегидрогеназа Glutamatedehydrogenases | 2.36 ± 0.12 | 1.79 ± 0.08 | 3.62 ± 0.23 р1 < 0.001 | 2.61 ± 0.16 р1 < 0.05 | 4.94 ± 0.54 р2 < 0.001 | 3.51 ± 0.36 р2 < 0.001 |
| Аспартатаминотрансфераза Aspartate aminotransferase | 5.73 ± 0.39 | 4.05 ± 0.33 | 3.52 ± 0.25 р1 < 0.001 | 2.02 ± 0.15 р1 < 0.05 | 4.18 ± 0.27 р2 < 0.001 | 2.74 ± 0.16 р2 < 0.05 |
| Аланинтрансфераза Alanine aminotransferase | 0.77 ± 0.04 | 0.42 ± 0.02 | 1.09 ± 0.06 р1 < 0.001 | 0.59 ± 0.04 р1 < 0.05 | 1.41 ± 0.11 р2 < 0.001 | 0.78 ± 0.04 р3 < 0.001 |
| Глутамин-кетокислотная аминотрансфераза Glutamine-ketoacid transaminase | 0.59 ± 0.04 | 0.38 ± 0.02 | 0.75 ± 0.04 р1 < 0.05 | 0.57 ± 0.04 р1 < 0.01 | 0.82 ± 0.05 р2< 0.001 | 0.61 ± 0.04 р2 < 0.001 |
| Тирозинаминотрансфераза Tyrosine aminotransferases | 0.79 ± 0.05 | 0.52 ± 0.03 | 0.51 ± 0.04 р1 < 0.001 | 0.35 ± 0.02 р1 < 0.01 | 0.58 ± 0.04 р2 < 0.001 | 0.38 ± 0.02 р2 < 0.05 |
| Цистеинаминотрансфераза Cysteine transaminase | 0.34 ± 0.02 | 0.25 ± 0.02 | 0.43 ± 0.03 р1 < 0.05 | 0.32 ± 0.02 р1 > 0.05 | 0.48 ± 0.03 р2 < 0.001 | 0.39 ± 0.03 р2 < 0.001 |
| Глутаминсинтетаза Glutamine synthetase | 1.39 ± 0.11 | 1.16 ± 0.07 | 1.79 ± 0.12 р1 < 0.05 | 1..47 ± 0.09 р1 > 0.05 | 2.03 ± 0.12 р2 > 0.05 | 1.60 ± 0.11 р2< 0.05 |
| Фосфат-активируемая глутаминаза Phosphate-activated glutaminase | 1.78 ± 0.11 | 1.43 ± 0.09 | 1.25 ± 0.07 р1 < 0.001 | 0.97 ± 0.06 р1 < 0.001 | 1.42 ± 0.10 р2 < 0.05 | 1.07 ± 0.06 р2 < 0.05 |
Наряду с межтканевыми различиями ферментативной активности определенные отличия имеют место и для аналогичных тканей разных видов животных и человека. Уровень активности ГДГ, АЛТ, Цис-Т, ГКТ, ГС увеличен в тканях плаценты обезьяны и человека относительно таких же частей плаценты морской свинки. Очевидно высокая активность ГС в плаценте приматов, особенно человека, способствуют более эффективной детоксикации аммиака – процесса важного для всего азотистого обмена. Активность АСТ, Тир-Т, ФАГ, напротив, выше в тканях последа морской свинки. Определенную взаимосвязь между показателями активности ферментов и содержанием свободных аминокислот подтверждают результаты корреляционного анализа. Позитивная корреляционная зависимость выявлена между активностью АСТ, АЛТ и уровнем свободных аспарагиновой аминокислоты (r = 0.83; 0.81; 0.80) и аланина (r = 0.85; 0.83; 0.81) соответственно в тканях плаценты человека, обезьяны и морской свинки (во всех случаях статистическая значимость связи p < 0.01). Негативная зависимость выявлена для глутаминовой кислоты и активности ГДГ. Коэффициенты корреляции между ними находятся в пределах от –0.83 до –0.86, p < 0.01.
Более низкая активность в тканях последа морской свинки ГДГ, катализирующей окислительное дезаминирование глутаминовой кислоты, очевидно, является основной причиной повышенного уровня этой аминокислоты по сравнению с аналогичными тканями у других объектов. Еще одной причиной, объясняющей высокий уровень глутаминовой кислоты, по-видимому, является повышенная активность в плаценте морской свинки глутаминазы (ФАГ), параллельно приводящей к уменьшению количества глутамина. Помимо этого фермента в регуляции содержания глутамина принимают участие реакции, связанные с его синтезом и трансаминированием (ГС и ГКТ), активность которых у морской свинки снижена относительно таковых у обезьяны и человека. Важно подчеркнуть, что поскольку глутамин более необходим для роста клеток, чем любая другая аминокислота [24], в плаценте человека с наиболее высоким его уровнем создаются оптимальные условия для трофики плода. Около 20% азота плода приходится именно на глутамин [25].
Что касается активности других аминотрансфераз: АСТ, АЛТ, Цис-Т и Тир-Т, то, судя по прямой корреляционной зависимости между ними и уровнем аминокислот-субстратов, можно полагать наличие причинно-следственных взаимоотношений между этими показателями. Однако следует учитывать, что наряду с модификациями активности ферментов, различия в содержании аминокислот у представителей гемохориального типа плаценты зависят также от интенсивности плацентарного транспорта, степени анаболизма и катаболизма белков и других причин [28, 29 ] .
Резюмируя полученные данные, следует подытожить, что гемохориальная плацента разных видов животных и человека имеет как межвидовые и межтканевые отличия в аминокислотном обмене, так и сходные особенности в содержании и активности изученных показателей, определяющие специфику органа независимо от межвидовых особенностей. Во всех исследованных объектах наибольшим содержанием свободных и связанных аминокислот характеризуется плодовая часть плаценты, играющая ведущую роль во взаимосвязи между организмами матери и плода. Такая же ситуация имеет место и для активности ферментов аминокислотного обмена. Кроме того, максимальная концентрация аминокислот во всех случаях приходится на долю дикарбоновых аминокислот, в значительной степени ответственных за особенности азотистого метаболизма и реакции, связывающие его с другими видами обмена.
Межвидовые отличия аналогичных частей плаценты касаются содержания отдельных аминокислот. Более высокий уровень большинства аминокислот, особенно свободных, установлен в плаценте морской свинки. Между плацентами человека и обезьяны различия изученных биохимических показателей менее выражены и зачастую статистически не значимы. В связи с этим на рисунках приведено сопоставление содержания аминокислот и активности ферментов только между морской свинкой и приматами. Важным отличием плаценты морской свинки (от других объектов исследования) является неодинаковое связывание аминокислот с биополимерами, меняющее состояние акцепторных групп белков. В зависимости от физико-химических свойств аминокислот: полярности, гидрофильности или гидрофобности, заряженности, они по-разному влияют на различные уровни структуры белков и, следовательно, на их регуляторные возможности. Аналогичные ткани последа разных видов животных и человека отличаются и активностью ферментов аминокислотного обмена: для некоторых из них она максимальна у человека, а для других – у морской свинки. Между активностью ферментов и содержанием соответствующих свободных аминокислот имеется тесная корреляционная зависимость, свидетельствующая об их роли в формировании плацентарного аминокислотного фонда и, следовательно, в обеспечении трофических потребностей плода и всего фетоплацентарного комплекса.
Список литературы
Burton G.J., Jauniaux E. What is the placenta? Am. J. Obstet, Gynecol. 213(4 Suppl): S6.e1–S8. 2015. https://doi.org/10.1016/j.ajog.2015.07.050
Maltepe E., Fisher S.J. Placenta: the forgotten organ. Annu. Rev. Cell Dev. Biol. 31: 523–552. 2015. https://doi.org/10.1146/annurev-cellbio-100814-125620
Costa M.A. The endocrine function of human placenta: an overview. Reprod. Biomed. Online. 32(1): 14–43. 2016.https://doi.org/10.1016/j.rbmo.2015.10.005
Kalhan S.C. Protein metabolism in pregnancy. Am. J. Clin. Nutr. 71(5 Suppl): 1249S–1255S. 2000. https://doi.org/10.1093/ajcn/71.5.1249s
Duggleby S.L., Jackson A.A. Protein, amino acid and nitrogen metabolism during pregnancy: how might the mother meet the needs of her fetus? Curr. Opin. Clin. Nutr. Metab. Care. 5(5): 503–509. 2002. https://doi.org/10.1097/00075197-200209000-00008
Sladek S.M., Magness R.R., Conrad K.P. Nitric oxide and pregnancy Am. J. Physiol. 272(2 Pt 2): R441–R463. 1997. https://doi.org/10.1152/ajpregu.1997.272.2.R441
Cohen S.S. A guide to the polyamines. New York. Oxford Univers. Press. 1998.
Bröer S., Bröer A. Amino acid homeostasis and signaling in mammalian cells and organisms. Biochem. J. 474(12): 1935–1963. 2017. https://doi.org/10.1042/BCJ20160822
Manta-Vogli P.D., Schulpis K.H., Dotsikas Y., Loukas Y.L. The significant role of amino acids during pregnancy: nutritional support. J. Matern. Fetal. Neonatal. Med. 33(2): 334–340. 2020. https://doi.org/10.1080/14767058.2018.1489795
Barker D.J., Thornburg K.L. Placental programming of chronic diseases, cancer and lifespan: a review. Placenta. 34(10): 841–845. 2013. https://doi.org/10.1016/j.placenta.2013.07.063
Elliott K.A., Khan R.T., Bilodeau F., Lovell R.A. Bound gamma-aminobutyric and other amino acids in brain. Can. J. Biochem. 43: 407–416. 1965. https://doi.org/10.1139/o65-048
Sanderson C., Murphy S. Glutamate binding in the rat cerebral cortex during ontogeny. Brain Res. 254 (3): 329–339. 1981. https://doi.org/10.1016/0165-3806(81)90042-0
Погорелова Т.Н., Гунько В.О., Никашина А.А., Каушанская Л.В., Аллилуев И.А., Ларичкин А.В. Модификация связывания аминокислот с цитоплазматическими белками плаценты при осложненной беременности. Рос. вестник акушера-гинеколога. 19(6): 5–10. 2019. [Pogorelova T.N., Gunko V.O., Nikashina A.A., Kaushanskaya L.V., Alliluev I.A., Larichkin A.V. Modification of binding of amino acids with placental cytoplasmic proteins in complicated pregnancy. Ross. Vestnik Akushera-Ginekologa. 19(6): 5–10. 2019. (In Russ)]. https://doi.org/10.17116/rosakush2019190615
Methods of Enzymatic Analysis, V.2. Ed. H.U. Bergmeyer. New York. Acad. Press. 2012.
Погорелова Т.Н., Линде В.А., Крукиер И.И., Гунько В.О., Друккер Н.А. Молекулярные механизмы регуляции метаболических процессов в плаценте при физиологически протекающей и осложненной беременности. Санкт-Петербург. Гиппократ. 2012. [Pogorelova T.N., Linde V.A., Krukier I.I., Gunko V.O., Drukker N.A. Molekuljarnye mehanizmy reguljacii metabolicheskih processov v placente pri fiziologicheski protekajushhej i oslozhnennoj beremennosti [Molecular mechanisms of regulation of metabolic processes in the placenta with physiologically occurring and complicated pregnancy]. Saint-Petersburg. Hippocrates. 2012. (In Russ)].
Morgan D.M. Polyamines. An overview. Mol. Biotechnol. 11(3): 229–250. 1999. https://doi.org/10.1007/BF02788682
Zwierzchowski L., Członkowska M., Guszkiewicz A. Effect of polyamine limitation on DNA synthesis and development of mouse preimplantation embryos in vitro. J. Reprod. Fertil. 76(1): 115–121. 1996. https://doi.org/10.1530/jrf.0.0760115
Moore J.J., Cardaman R.C., Lundgren D.W. Spermine-enhanced protein phosphorylation in human placenta. Proc. Soc. Exp. Biol. Med. 176(3): 313–321. 1984. https://doi.org/10.3181/00379727-176-41877
Li L., Rao J.N., Bass B.L., Wang J.Y. NF-kappaB activation and susceptibility to apoptosis after polyamine depletion in intestinal epithelial cells. Am. J. Physiol. Gastrointest. Liver. Physiol. 280(5): G992–G1004. 2001. https://doi.org/10.1152/ajpgi.2001.280.5.G992
Dasarathy J., Gruca L.L., Bennett C., Parimi P.S., Duenas C., Marczewski S., Fierro J.L., Kalhan S.C. Methionine metabolism in human pregnancy. Am. J. Clin. Nutr. 91(2): 357–365. 2010. https://doi.org/10.3945/ajcn.2009.28457
Proteins: Structure and function. Ed. J.J. L`Italien. New York. Plenum press. 2012.
Kessel A., Ben-Tal N. Introduction to proteins: structure, function, and motion. Boca Raton: CRC Press. 2010.
Broeder J.A., Smith C.H., Moe A.J. Glutamate oxidation by trophoblasts in vitro. Am. J. Physiol. 267(1 Pt 1): C189–C194. 1994. https://doi.org/10.1152/ajpcell.1994.267.1.C189
Погорелова Т.Н., Гунько В.О., Линде В.А. Дисбаланс системы глутамин-глутаминовая кислота в плаценте и околоплодных водах при плацентарной недостаточности. Биомед. химия. 60 (5): 596–601. 2014. [Pogorelova T.N., Gunko V.O., Linde V.A. Imbalance of system of glutamin – glutamic acid in the placenta and amniotic fluid at placental insufficiency. Biomed. Khim. 60(5): 596–601. 2014. (In Russ)]. https://doi.org/0.18097/pbmc20146005596
Lager S., Powell T.L. Regulation of nutrient transport across the placenta. J. Pregnancy. 2012: 179827. 2012. https://doi.org/10.1155/2012/179827
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


