Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 2, стр. 232-242
Экспрессия генов глутаматных рецепторов в гиппокампе и лобной коре у крыс линии ГК с генетической кататонией
В. С. Плеканчук 1, 2, *, М. А. Рязанова 1
1 Институт цитологии и генетики Сибирского отделения Российской академии наук
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: lada9604@mail.ru
Поступила в редакцию 21.10.2020
После доработки 25.11.2020
Принята к публикации 04.12.2020
Аннотация
Линия крыс ГК (аббревиатура от слов “генетическая” и “кататония”) была получена в Институте цитологии и генетики СО РАН путем селекции на усиление реакции пассивно-оборонительного застывания в ответ на слабый стрессорный стимул. Крысы линии ГК имеют предрасположенность к кататоническим реакциям, а также ряд поведенческих и биохимических особенностей, соответствующих аналогичным характеристикам больных при шизофрении и депрессии. В основе кататонического синдрома, как и при шизофрении, предполагают наличие комплексного нарушения в работе нейротрансмиттерных систем мозга, при этом в последнее время особое внимание уделяется дисфункции глутаматергической системы мозга, в рамках развития глутаматной гипотезы психопатологий. Глутамат является главным возбуждающим медиатором в ЦНС и опосредует свои физиологические эффекты через ионотропные (AMPA-, NMDA-, каинатные) и метаботропные (mGlu) глутаматные рецепторы. Есть множество исследований, указывающих на изменение экспрессии генов рецепторов глутамата и состава их субъединиц при шизофрении и биполярных расстройствах, а также указывающих на вовлеченность NMDA-рецепторов глутамата в проявление кататонического синдрома. В связи с этим целью работы было исследование экспрессии генов глутаматной системы в гиппокампе и лобной коре крыс линии ГК с генетической кататонией. Методом ПЦР в реальном времени показана низкая экспрессия гена Grm3, кодирующего метаботропный глутаматный ауторецептор, в гиппокампе крыс с генетической кататонией. Экспрессия генов Grin1, Grin2A, Grin2B, Gria1, Grm2, Slc17a6 в лобной коре и гиппокампе, а также гена Grm3 в лобной коре не отличалась от контроля. Таким образом, выявленная низкая экспрессия мРНК гена Grm3 в гиппокампе может влиять на нейротрансмиссию глутамата в этой структуре, и в том числе, способствовать повышению нервной возбудимости у крыс линии ГК.
Линия крыс ГК (аббревиатура от слов “генетическая” и “кататония”) получена путем селекции на усиление реакции пассивно-оборонительного застывания в ответ на слабый стрессорный стимул [1]. Крысы этой линии имеют ряд поведенческих и биохимических особенностей, соответствующих клиническим проявлениям у больных шизофренией и депрессией [2, 3]. В частности, отмечаются застывания и гиперкинетические поведенческие реакции, что сходно с проявлением кататонического синдрома, который наблюдается у больных шизофренией кататонического типа [4], биполярных расстройствах [5] и других заболеваниях. В основе кататонического синдрома, как предполагают, лежат комплексные нарушения функции нейротрансмиттерных систем мозга, включая глутаматергическую, дофаминергическую и норадренергическую [6]. В этиологию кататонии, по-видимому, вовлечена дисфункция ряда структур мозга, связанных с двигательной активностью, а также лобная кора, структуры лимбической системы (в том числе гиппокамп), промежуточный мозг и базальные ганглии, однако точный механизм этих дисфункций неизвестен [6]. В последнее время особое значение в развитии кататонии и шизофрении уделяют глутаматергической системе мозга, предлагая глутаматную гипотезу психопатологий [7, 8]. Глутамат является главным возбуждающим медиатором в ЦНС и опосредует свои физиологические эффекты через ионотропные (AMPA-, NMDA-, каинатные) и метаботропные (mGlu) глутаматные рецепторы. На сегодняшний день получены данные об изменении экспрессии генов субъединиц рецепторов глутамата при шизофрении и биполярных расстройствах. Так, показано снижение количества мРНК GRIN1 и GRIA1 во фронтальной коре у людей с шизофренией [9]; снижение экспрессии генов GRIN1, GRIN2A в гиппокампе людей с биполярными расстройствами, шизофренией и депрессией [10, 11]. Кроме того, сообщается о положительных генетических ассоциациях между полиморфизмами генов GRIN1, GRIN2B и шизофренией [12, 13], а в некоторых случаях была показана связь NMDA-рецепторов с проявлением кататонического синдрома [14, 15], что указывает на важную роль рецепторов глутамата и их субъединиц в проявлении кататонии и шизофрении. Метаботропные рецепторы глутамата группы II (mGluR) включают mGluR2 и mGluR3 и также представляют интерес при исследовании генетико-физиологических механизмов шизофрении, так как GRM3 может быть геном восприимчивости к шизофрении; экспрессия mGluR3 изменяется в головном мозге при шизофрении; и клинические испытания агониста mGluR группы II имели положительный антипсихотический эффект [16].
Кроме того, все перечисленные гены рецепторов входят в базу данных RGD (Rat Genome Database) в качестве генов, связанных с шизофренией и психопатологиями.
Транспорт глутамата важен для нормального функционирования нервной системы и осуществляется специальными везикулярными транспортерами глутамата – VGLUT [17]. Условный нокаут гена, кодирующего переносчик глутамата, Vglut2, у мышей в коре, гиппокампе и миндалине приводил к увеличению двигательной активности, изменению социальной доминантности, а также нарушению долгосрочной пространственной памяти. Кроме того, у них наблюдалось изменение фильтрации сенсомоторной информации – снижение реакции престимульного торможения (prepulse inhibition – PPI) [18, 19]. Такой дефицит PPI имеется у крыс линии ГК [3] и является одним из важных индикаторов нарушения обработки сенсомоторной информации при психопатологиях, в частности, при шизофрении [20, 21]. Учитывая то, что до настоящего времени исследования глутаматной системы и, в частности, оценки транскрипционной активности генов рецепторов и переносчиков глутамата в мозге у крыс линии ГК не проводилось, данная работа представляется актуальной.
Цель работы – исследовать экспрессию генов субъединиц NR1, NR2A, NR2B глутаматных NMDA-рецепторов (гены Grin1, Grin2A, Grin2B), субъединицы GluR1 глутаматных AMPA-рецепторов (ген Gria1), метаботропных глутаматных mGlu2 и mGlu3 рецепторов и везикулярного транспортера глутамата (гены Grm2, Grm3, Slc17a6 соответственно) в гиппокампе и лобной коре у крыс инбредной линии ГК с генетической кататонией.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные
Работа выполнена на 7-месячных крысах-самцах инбредной линии ГК и WAG (Wistar Albino Glaxo), которые, как и крысы линии ГК, были получены из популяции Wistar. В каждой группе было по 6 животных. Крысы содержались в стандартных условиях вивария Института цитологии и генетики СО РАН со свободным доступом к воде и сбалансированному корму. Все опыты на животных выполнены в соответствии с порядком проведения процедур на животных согласно приказу № 755 от 12 августа 1977 г. и по международным рекомендациям (Этический кодекс от 1985 г.) и одобрены биоэтической комиссией Института цитологии и генетики СО РАН (протокол № 34 от 15.06.2016).
Тест на кататоническое застывание
Для определения наличия или отсутствия застывания и его продолжительности крысу за передние лапы приподнимали палочкой-тестером в углу клетки. Регистрировали время, в течение которого животное сохраняло приданную ему позу после того, как убрали палочку. Крыс тестировали 2 раза в разные дни. Данные тестирования усредняли по каждой крысе.
Оценка экспрессии генов методом ПЦР в реальном времени
Биологический материал (гиппокамп, лобная кора) быстро выделяли и помещали в жидкий азот, а затем хранили при – 70°C до выделения РНК. Выделение суммарной РНК из структур мозга проводилось с использованием “Tри-реагент” (RNA/DNA/Protein isolation agent, Molecular research center, США) согласно рекомендациям производителя. Примеси геномной ДНК удаляли с помощью ДНКазы (Promega, США) согласно рекомендациям производителя. Концентрацию РНК измеряли в водном растворе с помощью спектрофотометра Nanodrop 2000 (Thermo Scientific, США) по поглощению при длине волны 260 нм. Качественными считали образцы РНК, для которых D260/D280 ≈2.0. Для получения кДНК смешивали 3 мкг РНК и 0.25 нмоль “случайных” (random N9) праймеров-наномеров (Биосинтез, Россия). Конечный раствор смеси реакции обратной транскриции объемом 50 мкл содержал: 3 мкг РНК и 0.25 нмоль “случайных” праймеров-наномеров (Биосинтез, Россия), 5 мкл буфера F2, 5 мкл 4 мM dNTP, 25 мкл 40%-ного раствора трегалозы, 1 мкл BSA (10 мг/мл) и 5 мкл 40 ед. акт. обратной транскриптазы MoMLV (реактивы производства Вектор-Бест, Россия). Синтез кДНК проводили при 37°С – 1 ч, 42°С – 50 мин, 50°С – 10 мин. Фермент инактивировали при 75°С в течение 5 мин.
Для проверки отсутствия геномной ДНК в полученных растворах проводили ПЦР с раствором РНК и праймерами на ген Adra2A [3]. Для оценки качества реакции обратной транскрипции каждый образец полученной кДНК проверяли с постановкой ПЦР в реальном времени с праймерами на референсный ген Ppia.
ПЦР в реальном времени осуществлялась на амплификаторе LightCycler® 96 System (Roche) в следующем температурном режиме: предварительный прогрев при 94°С – 2 мин; затем 38–45 циклов: денатурация при 94°С – 15 с, отжиг – 20 с, элонгация при 72°С – 20 с, сбор данных по флуоресценции – 10 с (табл. 1). Реакционная смесь объемом 20 мкл содержала буфер F2 для ПЦР (Вектор-Бест, Россия), 0.2 мM dNTPs, SYBR Green I (Медиген, Россия) в разведении 1 : 20 000, по 150 нМ прямого и обратного праймеров и 1 ед. акт. Hot-Start полимеразы (Вектор-Бест, Россия) и раствор исследуемой кДНК. После окончания ПЦР снимали кривые плавления для контроля специфичности реакции.
Таблица 1.
Праймеры, используемые для ПЦР в реальном времени Table 1. Gene-specific primers used for RT-PCR
| Ген Gene |
Праймеры Primer sequence |
Т, °С | Длина продукта, п.н. Amplificate fragment, bp. | |
|---|---|---|---|---|
| отжиг annealing |
регистрация detection |
|||
| Grin1 | F: 5'-GAT ACC AGA TGT CCA CCA G -3' R: 5'-GTA CAG ATC ACC TTC TTC ACT-3' |
64 | 87 | 140 |
| Grin2A | F: 5′- CCA TTG CTG TCT TCG TTT T -3′ R: 5′-TGC TGG TTG TGC CTT TA-3′ |
62 | 87 | 178 |
| Grin2B | F: 5'-AGTTTCATCCCTGAGCC -3' R: 5'-TTCCATTTCCCCACCCT-3' |
64 | 87 | 208 |
| Gria1 | F: 5'-GGGAGGGAAGACCAAATCTA -3' R: 5'-ACAAAGCAAACCTAAAAGCCG-3' |
62 | 87 | 201 |
| Grm2 | F: 5'- TCTATGCCTTCAAGACCC -3' R: 5'- CTGCACCCGATAATCACT -3' |
61 | 88 | 141 |
| Grm3 | F:5'- CCA AGC TCT GTG ATG CAA -3' R: 5'- TCT TCC CAT CCC GTC TC -3' |
64 | 85 | 152 |
| Slc17a6 | F: 5'- ACATCCATGCCCGTCTA-3' R: 5'- AAGTCTGCAATTTGCCCC-3' |
64 | 88 | 196 |
| Hprt1 | F: 5'-CATTGTGGCCCTCTGTGTG-3' R: 5'-AACTTTTATGTCCCCCGTTGA-3' |
61–64 | 86 | 166 |
| Ppia | F: 5'-TTCCAGGATTCATGTGCCAG-3' R: 5'-CTTGCCATCCAGCCACTC-3' |
61–64 | 88 | 206 |
| Gapdh | F: 5'- GTGCCAGCCTCGTCTCATA-3' R: 5'-TCGTTGATGGCAACAATG TCC-3' |
61–64 | 89 | 123 |
Полуколичественную оценку экспрессии мРНК исследуемых генов осуществляли относительно количества мРНК 3-х референсных генов: Hprt1, Gapdh, Ppia методом среднего геометрического [22]. Расчет относительной экспрессии генов производили с использованием метода стандарных кривых [23]. Из полученных образцов кДНК для каждой структуры мозга делали “усредненный” раствор кДНК, который использовали для построения калибровочных кривых. В эксперименте образцы кДНК с праймерами для целевого гена (три повтора на образец кДНК) были отнесены к стандартным разведениям “усредненного” раствора кДНК с теми же праймерами (в двух повторах). Аналогично поступали с генами сравнения. Затем эксперимент повторяли, меняя положение образцов на планшете. Таким образом, всего делали 6 повторов на образец. Далее значение целевого гена нормализовали относительно среднего геометрического уровня референсных генов.
Праймеры, используемые для определения экспрессии генов (табл. 1), были подобраны авторами с использованием онлайн-олигоанализатора с сайта www.eu.idtdna.com и проверены в базе данных Blast (Basic Local Alignment Search Tool) на специфичность. В качестве дополнительной проверки праймеров оценивали длину продукта ПЦР с помощью электрофореза ДНК в 1.5%-ном агарозном геле. Для исследуемых генов праймеры подбирались для всех сплайс-вариантов при их наличии.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Средняя длительность кататонического застывания крыс линии ГК значительно выше, чем у крыс контрольной линии (p < 0.001 по критерию Манн–Уитни) (рис. 1).
Рис. 1.
Длительность кататонического застывания крыс линий ГК и WAG; *** – p < 0.001 по критерию Манн–Уитни. Fig. 1. Duration of catatonic freezing of GC and WAG rats; *** – p < 0.001, Mann–Whitney U-test.

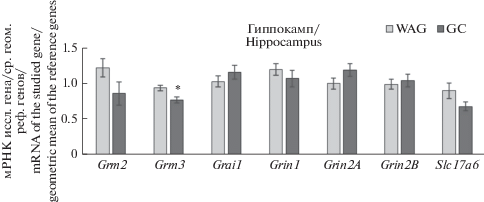
Исследование генов глутаматной системы в лобной коре и гиппокампе у крыс линии ГК показало достоверно сниженную экспрессию мРНК гена Grm3 в гиппокампе относительно контрольной линии WAG (p < 0.05) (рис. 2). Кроме того, в гиппокампе у крыс ГК была показана тенденция (p = 0.08) к увеличению экспрессии мРНК гена Grin2A, который кодирует NR2A субъединицу NMDA-рецептора.
Рис. 2.
Содержание мРНК генов глутаматной системы в гиппокампе крыс линий ГК и WAG; * – p < 0.05 по критерию Манн–Уитни. Fig. 2. Glutamate system gene expression in the hippocampus of GC and WAG rats; * – significantly different from comparison group p < 0.05, Mann–Whitney U-test.
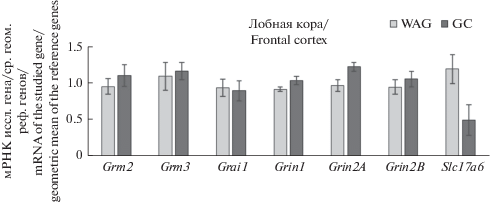
В лобной коре статистически значимых отличий по экспрессии генов глутаматергической системы не обнаружено (рис. 3), однако была показана тенденция (p = 0.07 по критерию Манн–Уитни) к увеличению содержания мРНК гена Grin 1 у крыс линии ГК.
Рис. 3.
Содержание мРНК генов глутаматной системы в лобной коре крыс линий ГК и WAG. Fig. 3. Glutamate system gene expression in the frontal cortex of GC and WAG rats.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Метаботропный глутаматный рецептор 3 (mGluR3) кодируется геном Grm3, и его активация ограничивает высвобождение глутамата в синаптическую щель [24]. Важно отметить, что ген Grm3, как и остальные гены рецепторов глутамата, исследованные в данной работе, входит в базу данных Rat Genome Database как ген-кандидат, ассоциированный с шизофренией. Показана связь полиморфных вариантов рецептора mGluR3, изменяющих его активность, и когнитивной функции при шизофрении у человека [25]; кроме того, агонист, действующий на mGluR3- и mGluR2-рецепторы, приводит к уменьшению как позитивных, так и негативных симптомов у больных шизофренией [26]. Функциональная роль mGluR3 исследована у мышей-нокаутов по Grm3, которые имели нарушение рабочей памяти и проявляли гиперактивность, что является эндофенотипом шизофрении [27].
Выявленное снижение экспрессии мРНК гена метаботропного рецептора Grm3 в гиппокампе крыс ГК хорошо укладывается в пресинаптическую гипотезу патогенеза психопатологий, которая предполагает увеличение высвобождения глутамата в синаптическую щель вследствие нарушения функции ауторецепторов отрицательной обратной связи. Повышенный уровень глутамата приводит, как было показано, к апоптотической потере дендритов и синапсов и даже к апоптозу нейронов [28]. Такая гиперфункция глутаматной передачи может иметь разнообразные симптоматические проявления – многочисленные данные показывают, что высокий уровень глутамата в разных областях мозга связан с позитивными, негативными, а также когнитивными симптомами шизофрении (цит. по [29]). В лобной коре не было обнаружено достоверных различий по экспрессии Grm3 и Grm2. Однако тот факт, что снижение экспрессии гена Grm3 выявлено в гиппокампе – структуре, играющей существенную роль в когнитивной деятельности [30] и вовлеченной в патологический процесс при шизофрении [31], представляется особенно важным. Найденные различия по уровню мРНК Grm3 в гиппокампе крыс ГК интересны и в том плане, что гиппокамп участвует в регулировании эмоциональных реакций [32] и в формировании депрессивноподобного и тревожного поведения [33]. Ранее проделанные исследования выявили, что крысы линии ГК имеют реакции повышенной нервной возбудимости [34], повышенный уровень беспокойства и страха [35]. В данной работе также показано, что у крыс ГК длительность кататонического застывания значительно выше, чем у контроля (рис. 1), что согласуется с имеющимися данными [34]. Помимо вклада других нейромедаторных систем, описанные выше особенности поведения могут быть связаны с изменениями в трансмиссии глутамата, на что может указывать сниженное содержание мРНК гена метаботропного mGlu3 рецептора у крыс ГК.
Кроме того, у крыс линии ГК показана тенденция к увеличению уровня мРНК Grin2A в гиппокампе и тенденция к увеличению уровня мРНК Grin1 в лобной коре по сравнению с крысами WAG. Указанные гены, как и Grin2B, который также был исследован в работе, кодируют субъединицы рецепторов N-метил-D-аспартата (NMDA-рецепторов). Известно, что глутаматный NMDA-рецептор представляет собой гетеротетрамерный рецептор, состоящий из субъединицы NR1 (кодируется геном Grin1), которая имеет домен связывания с глицином и одной из субъединиц NR2: NR2A, NR2B, NR2C, NR2D [24]. Субъединицы NR2, которые кодируются генами Grin2A, Grin2B, Grin2C, Grin2D, связываются с глутаматом, при этом различные сочетания этих субъединиц обеспечивают большую структурную и функциональную гетерогенность NMDA-рецепторов [36].
NR2A и NR2B, исследуемые в работе – это субъединицы, которые различаются по структуре и определяют биофизические, фармакологические и сигнальные свойства NMDA-рецепторов [37], при этом соотношение экспрессии мРНК генов NR2A/NR2B в лобной коре и в гиппокампе у крыс не отличались – 1.23 ± 0.16 (ГК) и 1.09 ± 0.17 (WAG), 1.13 ± 0.05 (ГК) и 1.02 ± 0.05 (WAG) соответственно. Изменение экспрессии NR2A- или NR2B-субъединиц в гиппокампе отмечается при различных психических расстройствах, таких как шизофрения и биполярное расстройство [9, 29], что, вероятно, указывает на вовлеченность этих субъединиц в развитие психопатологии. Кроме того, у линии мышей, имеющих гипоморфную мутацию гена субъединицы NR1, имеются нарушения социального и полового поведения, а также дефицит престимульного торможения [38], что говорит о вероятном вкладе NR1-субъединицы NMDA-рецепторов в данные процессы. Ранее было показано, что у крыс лини ГК нарушено престимульное торможение в ЦНС [3], однако результаты, полученные по экспрессии мРНК субъединицы NR1, не подтверждают ее вовлечение в процесс фильтрации сенсомоторной информации у крыс ГК. Показанные тенденции к изменению экспрессии генов NR1- и NR2A-субъединиц глутаматных рецепторов в исследованных структурах мозга крыс ГК, как и другие субъединицы NMDA-рецепторов, которые не были исследованы в рамках данной работы, требуют дальнейшего изучения, поскольку вопрос изменений глутаматной нейротрансмиссии у крыс линии ГК на уровне инотропных рецепторов остается открытым.
ЗАКЛЮЧЕНИЕ
Таким образом, в гиппокампе крыс линии ГК выявлено снижение экспрессии мРНК гена Grm3 метаботропных глутаматных пресинаптических рецепторов, осуществляющих по механизму отрицательной обратной связи регуляцию выхода глутамата в синаптическую щель, что может влиять на нейротрансмиссию глутамата в этой структуре, и, в том числе, способствовать повышению возбудимости у крыс ГК.
Список литературы
Kolpakov V.G., Barykina N.N., Alekhina T.A. Some genetic animal models for comparative psychology and biological psychiatry. Novosib. Inst. 1996.
Колпаков В.Г., Куликов А.В., Алехина Т.А., Чугуй В.Ф. Кататония или депрессия? Линия крыс ГК – генетическая животная модель психопатологии. Генетика. 40(6): 1–7. 2004.[Kolpakov V.G., Kulikov A.V., Alekhina T.A., CHuguj V.F. Katatoniya ili depressiya? Liniya krys GK–geneticheskaya zhivotnaya model' psihopatologii. Genetika. 40(6): 1–7. 2004. (In Russ)].
Рязанова M.A., Прокудина O.И., Алехина T.A. Экспрессия генов системы катехоламинов в среднем мозге и реакция престимульного торможения у крыс с генетической кататонией. Вавиловский журн. генетики и селекции. 21(7): 798–803. 2017. [Ryazanova M.A., Prokudina O.I., Alekhina T.A. Ekspressiya genov sistemy katekholaminov v srednem mozge i reakciya prestimul’nogo tormozheniya u krys s geneticheskoj katatoniej. Vavilovskij Zhurn. Genetiki i Selekcii. 21(7): 798–803. 2017. (In Russ)]. https://doi.org/10.18699/VJ17.296
Wong E., Ungvari G.S., Leung S.-K., Tang W.-K. Rating catatonia in patients with chronic schizophrenia: Rasch analysis of the Bush–Francis Catatonia Rating Scale. Int. J. Methods Psychiatr. Res. 16(3): 161–170. 2007. https://doi.org/10.1002/mpr.224
Medda P., Toni C., Luchini F., Mariani M.G., Mauri M., Perugi G. Catatonia in 26 patients with bipolar disorder: clinical features and response to electroconvulsive therapy. Bipolar Disord. 17(8): 892–901. 2015. https://doi.org/10.1111/bdi.12348
Northoff G. Catatonia and neuroleptic malignant syndrome: psychopathology and pathophysiology. J. Neural Transm. 109(12): 1453–1467. 2002. https://doi.org/10.1007/s00702-002-0762-z
Moghaddam B., Javitt D. From revolution to evolution: The glutamate hypothesis of schizophrenia and its implication for treatment. Neuropsychopharmacology. 37(1): 4–15. 2012. https://doi.org/10.1038/npp.2011.181
Hirjak D., Kubera K.M., Wolf R.C., Northoff G. Going Back to Kahlbaum’s Psychomotor (and GABAergic) Origins: Is Catatonia More Than Just a Motor and Dopaminergic Syndrome? Schizophr. Bull. 46(2): 272–285. 2020. https://doi.org/10.1093/schbul/sbz074
Sokolov B.P. Expression of NMDAR1, GluR1, GluR7, and KA1 Glutamate Receptor mRNAs Is Decreased in Frontal Cortex of “Neuroleptic-Free” Schizophrenics: Evidence on Reversible Up-Regulation by Typical Neuroleptics. J. Neurochem. 71(6): 2454–2464. 2002. https://doi.org/10.1046/j.1471-4159.1998.71062454.x
Law A.J., Deakin J.F.W. Asymmetrical reductions of hippocampal NMDARI glutamate receptor mRNA in the psychoses. Neuroreport. 12(13): 2971–2974. 2001. https://doi.org/10.1097/00001756-200109170-00043
McCullumsmith R.E., Kristiansen L.V., Beneyto M., Scarr E., Dean B., Meador-Woodruff J.H. Decreased NR1, NR2A, and SAP102 transcript expression in the hippocampus in bipolar disorder. Brain Res. 1127(1): 108–118. 2007. https://doi.org/10.1016/j.brainres.2006.09.011
Martucci L., Wong A.H.C., De Luca V., Likhodi O., Wong G.W.H., King N., Kennedy J.L. N-methyl-d-aspartate receptor NR2B subunit gene GRIN2B in schizophrenia and bipolar disorder: Polymorphisms and mRNA levels. Schizophr. Res. 84(2–3): 214–221. 2006. https://doi.org/10.1016/J.SCHRES.2006.02.001
Qin S., Zhao X., Pan Y., Liu J., Feng G., Fu J., Bao J., Zhang Zh., He L. An association study of the N-methyl-D-aspartate receptor NR1 subunit gene (GRIN1) and NR2B subunit gene (GRIN2B) in schizophrenia with universal DNA microarray. Eur. J. Hum. Genet. 13(7): 807–814. 2005. https://doi.org/10.1038/sj.ejhg.5201418
Bota R., Groysman L., Momii A. Catatonia as a Syndrome Characterized by GABAergic Interneuronal Dysfunction Mediated by NMDA Receptors. Br. J. Med. Med. Res. 19(11): 1–6. 2017. https://doi.org/10.9734/bjmmr/2017/30718
Rogers J.P., Pollak T. A., Blackman G., David A.S. Catatonia and the immune system: a review. The Lancet Psychiatry. 6(7): 620–630. 2019. https://doi.org/10.1016/S2215-0366(19)30190-7
Harrison P.J., Burnet P. The group II metabotropic glutamate receptor 3 (mGluR3, mGlu3, GRM3): expression, function and involvement in schizophrenia. J. Psychopharmacol. 22(3):308–322. 2008. https://doi.org/10.1177/0269881108089818
Takamori S., Rhee J.S., Rosenmund C., Jahn R. Identification of Differentiation-Associated Brain-Specific Phosphate Transporter as a Second Vesicular Glutamate Transporter (VGLUT2). J. Neurosci. 21(22): RC182. 2001. https://doi.org/10.1523/JNEUROSCI.21-22-j0002.2001
Wallen-Mackenzie A., Nordenankar K., Fejgin K., Lagerström M.C., Emilsson L., Fredriksson R., Wass C., Andersson D., Egecioglu E., Andersson M., Strandberg J., Lindhe Ö., Schiöth H.B., Chergui K., Hanse E., Långström B., Fredriksson A., Svensson L., Roman E., Kullander K. Restricted Cortical and Amygdaloid Removal of Vesicular Glutamate Transporter 2 in Preadolescent Mice Impacts Dopaminergic Activity and Neuronal Circuitry of Higher Brain Function. J. Neurosci. 29(7): 2238–2251. 2009. https://doi.org/10.1523/JNEUROSCI.5851-08.2009
Nordenankar K., Smith-Anttila C.J.A., Schweizer N., Viereckel T., Birgner C., Mejia-Toiber J., Morales M., Leao R.N., Wallén-Mackenzie Å. Increased hippocampal excitability and impaired spatial memory function in mice lacking VGLUT2 selectively in neurons defined by tyrosine hydroxylase promoter activity. Brain Struct. Funct. 220. 2171–2190. 2015. https://doi.org/10.1007/s00429-014-0778-9
Martinez-Gras I., Rubio G., del Manzano B.A., Rodriguez-Jimenez R., Garcia-Sanchez F., Bagney A., Carlos Leza J., Borrell J. The relationship between prepulse inhibition and general psychopathology in patients with schizophrenia treated with long-acting risperidone. Schizophr. Res. 115(2–3): 215–221. 2009. https://doi.org/10.1016/j.schres.2009.09.035
García-Sánchez F., Martínez-Gras I., Rodríguez-Jiménez R., Rubio G. [Prepulse inhibition of the startle response/reflex in neuropsychiatric disorders]. Rev. Neurol. 53(7): 422–32. 2011.
Vandesomlele J. Accurate normalization of real-time quantitative RT-PCR data.pdf. Genome Biol. 3(7): 1–12. 2002. https://doi.org/10.1186/gb-2002-3-7-research0034
Larionov A., Krause A., Miller W.R. A standard curve based method for relative real time PCR data processing. BMC Bioinformatics. 6(1): 1–16. 2005. https://doi.org/10.1186/1471-2105-6-62
Kew J.N.C., Kemp J.A. Ionotropic and metabotropic glutamate receptor structure and pharmacology. Psychopharmacology. 179(1): 4–29. 2005. https://doi.org/10.1007/s00213-005-2200-z
Mössner R., Schuhmacher A., Schulze-Rauschenbach S., Kühn K.-U., Rujescu D., Rietschel M., Zobel A., Franke P., Wölwer W., Gaebel W., Häfner H., Wagner M., Maier W. Further evidence for a functional role of the glutamate receptor gene GRM3 in schizophrenia. Eur. Neuropsychopharmacol. 18(10): 768–772. 2008. https://doi.org/10.1016/j.euroneuro.2008.05.007
Patil S.T., Zhang L., Martenyi F., Lowe S.L., Jackson K.A., Andreev B.V., Avedisova A.S., Bardenstein L.M., Gurovich I.Y., Morozova M.A., Mosolov S.N., Neznanov N.G., Reznik A.M., Smulevich A.B., Tochilov V.A., Johnson B.G., Monn J.A., Schoepp D.D. Activation of mGlu2/3 receptors as a new approach to treat schizophrenia: a randomized Phase 2 clinical trial. Nat. Med. 13(9): 1102–1107. 2007. https://doi.org/10.1038/nm1632
Fujioka R., Nii T., Iwaki A., Shibata A., Ito I., Kitaichi K., Nomura M., Hattori S., Takao K., Miyakawa T., Fukumaki Y. Comprehensive behavioral study of mGluR3 knockout mice: implication in schizophrenia related endophenotypes. Mol. Brain. 7(1): 31. 2014. https://doi.org/10.1186/1756-6606-7-31
Stone J.M., Morrison P.D., Pilowsky L.S. Glutamate and dopamine dysregulation in schizophrenia – A synthesis and selective review. J. Psychopharmacol. 21(4): 440–452. 2007. https://doi.org/10.1177/0269881106073126
Merritt K., McGuire P., Egerton A. Relationship between Glutamate Dysfunction and Symptoms and Cognitive Function in Psychosis. Front. Psychiatry. 4: 151. 2013. https://doi.org/10.3389/fpsyt.2013.00151
Sweatt J. D. Hippocampal function in cognition. Psychopharmacology (Berl). 174(1): 99–110. 2004. https://doi.org/10.1007/s00213-004-1795-9
Harrison P.J. The hippocampus in schizophrenia: A review of the neuropathological evidence and its pathophysiological implications. Psychopharmacology. 174(1): 151–162. 2004. https://doi.org/10.1007/s00213-003-1761-y
Schumacher A., Villaruel F.R., Riaz S., Lee A.C.H., Ito R. Ventral hippocampal CA1 and CA3 differentially mediate learned approach-avoidance conflict processing. Curr. Biol. 28(8): 1318. 2018. https://doi.org/10.1101/180513
McEwen B.S., Nasca C., Gray J.D. Stress Effects on Neuronal Structure: Hippocampus, Amygdala, and Prefrontal Cortex. Neuropsychopharmacology. 41(1): 3–23. 2016. https://doi.org/10.1038/npp.2015.171
Рязанова М.А., Игонина Т.Н., Алехина Т.А., Прокудина О.И., Рязанова М.А. Увеличение доли “нервных” животных в ходе селекции на кататонию: участие в кататонических реакциях центральных адренорецепторов. Генетика. 48(11): 1–8. 2012. [Ryazanova M.A., Igonina T.N., Alekhina T.A., Prokudina O.I., Ryazanova M.A. Uvelichenie doli “nervnyh” zhivotnyh v hode selekcii na katatoniyu: uchastie v katatonicheskih reakciyah central’nyh adrenoreceptorov. Genetika. 48(11): 1–8. 2012. (In Russ)].
Петрова Е.В. Особенности изменения врожденных и приобретенных форм поведения крыс с генетической каталепсией. Журн. высшей нервн. деятельности. 40 (3): 475–480. 1990. [Petrova E.V. Osobennosti izmeneniya vrozhdennyh i priobretennyh form povedeniya krys s geneticheskoj katalepsiej. Zhurn. Vysshej Nervn. Deyatel’nosti. 40 (3): 475–480. 1990. (In Russ)].
Lynch D.R., Guttmann R.P. NMDA receptor pharmacology: perspectives from molecular biology. Curr. Drug. Targets. 2(3): 215–231. 2001.
Wyllie D.J.A., Livesey M.R., Hardingham G.E. Influence of GluN2 subunit identity on NMDA receptor function. Neuropharmacology. 74: 4–17. 2013. https://doi.org/10.1016/J.NEUROPHARM.2013.01.016
Duncan G.E., Moy S.S., Perez A., Eddy D.M., Zinzow W.M., Lieberman J.A., Snouwaert J.N., Koller B.H. Deficits in sensorimotor gating and tests of social behavior in a genetic model of reduced NMDA receptor function. Behav. Brain Res. 153(2): 507–519. 2004. https://doi.org/10.1016/J.BBR.2004.01.008
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


