Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 3, стр. 288-311
Физиологические механизмы действия салицилатов на сердечно-сосудистую систему
Е. Н. Чуян 1, *, И. С. Миронюк 1, И. В. Черетаев 1, М. Ю. Раваева 1, Т. В. Гришина 1
1 Таврическая академия (структурное подразделение) “Крымский федеральный университет
им. В.И. Вернадского”
Симферополь, Республика Крым, Россия
* E-mail: elena-chuyan@rambler.ru
Поступила в редакцию 17.12.2020
После доработки 14.01.2021
Принята к публикации 14.01.2021
Аннотация
В современной литературе четко прослеживается возросший интерес к изучению биологических и терапевтических эффектов салицилатов. Крупные клинические испытания продемонстрировали эффективность ацетилсалициловой кислоты (АСК) и ее комплексных соединений в лечении и профилактике ишемической болезни сердца, хронической сердечной недостаточности, гипертонии и других заболеваний, что позволяет оценить широту благоприятных эффектов, оказываемых АСК на функционирование сердечно-сосудистой системы (ССС) и констатировать отсутствие в ближайшие годы других равноценных лекарственных средств. Важнейшим направлением остается расширение и усиление известной терапевтической активности (антипиретическая, анальгезирующая, противовоспалительная, антиоксидантная, антидепрессантная, противомигренозная, анксиолитическая и др.) на фоне снижения и/или ликвидации побочных эффектов, поскольку АСК занимает лидирующее положение среди всех нестероидных противовоспалительных препаратов по объемам применения и одно из первых мест по количеству побочных эффектов. Перспективным для решения этой проблемы является создание комплексных соединений салицилатов, поскольку при образовании новых координационных соединений на их основе возможно возникновение новых полезных биологических свойств, а также усиление физиологических эффектов, характерных для АСК, что поможет решить проблему снижения побочных эффектов, резистентности к терапии аспирином и повышения терапевтического потенциала исходного соединения для получения эффективных лекарственных препаратов нового поколения. В статье обобщены и проанализированы обширные сведения о физиологических и молекулярных механизмах действия АСК и ее производных на ССС в норме и патологии, в том числе на различные физиологические и биохимические звенья гомеостаза организма: вазорегулирующую функцию эндотелия сосудов, сосудисто-тромбоцитарный гемостаз; фибринолиз; процессы свободнорадикального окисления и антиоксидантной защиты; циклооксигеназный и липоксигеназный пути окисления арахидоновой кислоты; молекулярные маркеры процессов воспаления (простагландины; про- и противовоспалительные цитокины; противовоспалительные липидные медиаторы). Подробно изложены и проанализированы имеющиеся данные литературы и результаты собственных экспериментальных исследований о влиянии салицилатов на центральную гемодинамику и тканевую микроциркуляцию. Сделан вывод о перспективности исследований количественных и качественных изменений микроциркуляторных процессов под влиянием АСК и ее производных, что позволит уточнить механизмы биологического действия этих соединений на ССС.
Распространенной проблемой современности являются патологии сердечно-сосудистой системы (ССС), что является причиной поиска и разработки новых лекарственных препаратов, механизм действия которых направлен на борьбу с сердечно-сосудистыми патологиями. Повышенное внимание исследователей привлекает и возможность использования традиционных лекарственных препаратов для создания на их основе новых, более эффективных (менее токсичных) биологически активных форм или же выявления новых видов активности таких соединений. В рамках такого научного поиска актуален и интересен подход, основанный на изобретении новых лекарственных форм и средств, являющихся производными ацетилсалициловой кислоты (АСК) с различными металлами [1, 2].
Аспирин как лекарственное средство применяется уже более 100 лет, относится к группе нестероидных противовоспалительных препаратов (НПВП) и обладает широким спектром терапевтических эффектов. Однако несмотря на длительное и широкое использование, в конце 20-го–начале 21-го веков к АСК и ее производным заметно возрос интерес как со стороны исследователей, так и в медицинской практике, что нашло свое отражение в современной отечественной и зарубежной литературе.
Одним из важнейших направлений исследований АСК остается расширение и усиление известной терапевтической активности (антипиретическая, анальгезирующая, противовоспалительная, антиагрегантная, антиоксидантная, антидепрессантная, противомигренозная, анксиолитическая и др.) [2–9].
Аспирин способен влиять на нервные клетки и центры. Так, жаропонижающий эффект обусловлен влиянием на гипоталамические центры терморегуляции. АСК и ее производные способны непосредственно изменять возбудимость нервных клеток, влиять на нейромедиаторы и процессы проведения импульса в нервных отростках [10]. Эта кислота и ее метаболиты способны непосредственно изменять функционирование ионных каналов [10, 11], влиять на концентрацию синаптических медиаторов [12].
В последнее время появились указания на возможность использования салицилатов в роли перспективных препаратов, обладающих противовоспалительной, противомикробной, противоопухолевой активностями [13–15]. Так, в литературе активно обсуждается антинеопластическое действие аспирина. Есть данные, что аспирин способен оказывать протекторное воздействие и снижать риск возникновения онкологических заболеваний [16–18]. Отмечен выраженный эффект аспирина в отношении опухолей желудочно-кишечного тракта, в особенности, ободочной и прямой кишки [18–20]. Вместе с тем совместное рандомизированное двойное слепое плацебо-контролируемое исследование американских и австралийских ученых на более чем 19-ти тысячах пациентов старше 65 лет из США и Австралии показало, что ежедневный прием низких доз аспирина (100 мг) среди здоровых пожилых людей без сердечно-сосудистых заболеваний, деменции и других серьезных патологий может ускорить прогрессирование рака [21]. Безусловно, этот вопрос еще далек от решения, требует дополнительных исследований, однако указывает на широкий спектр возможного применения салицилатов и нуждается в дальнейших крупных исследованиях.
Не меньший интерес вызывают и широкие возможности применения АСК при сердечно-сосудистой патологии. Многочисленные крупные клинические испытания продемонстрировали эффективность АСК и ее комплексных соединений в лечении и профилактике ишемической болезни сердца, хронической сердечной недостаточности, гипертонии и других, что позволяет оценить широту благоприятных эффектов, оказываемых АСК на функционирование ССС, и констатировать отсутствие в ближайшие годы других лекарственных средств, равноценных АСК.
Необходимо отметить, что наряду с целой плеядой положительных терапевтических эффектов, АСК занимает лидирующее среди всех НПВП положение в Российской Федерации не только по объемам применения, но и совокупному количеству побочных эффектов, среди которых негативные воздействия на иммунную и пищеварительную системы, а также кожу и подкожные ткани, а именно: ангионевротический отек, крапивница и эрозийный гастрит [22].
АСК и некоторые ее производные провоцируют гастропатии, язвообразование, поражают клетки печени, угнетают кишечную микрофлору. Также салицилаты способствует развитию синдрома Рейе [23], нарушают функционирование митохондрий, вмешиваясь в цикл Кребса [24], ингибируют синтез АТФ и оказывают влияние на фактор транскрипции простагландинов [25]. В частности, отмечается, что длительный прием аспирина вызывает увеличение числа больших кровотечений в 1.6 раза [26], в том числе, желудочно-кишечных. Причем основными факторами риска развития кровотечений являются совместное применение нестероидных противовоспалительных препаратов, антикоагулянтов, кортикостероидов, возраст старше 60–75 лет [26], наличие Helicobacter pylori [27], предшествующий анамнез желудочно-кишечных кровотечений [28].
Таким образом, учитывая клиническую эффективность АСК и ее производных в отношении сердечно-сосудистых патологий на фоне нежелательных последствий данной терапии, крайне важной задачей остается не только расширение и усиление терапевтического потенциала АСК (аспирина), но и снижение, а, по возможности, ликвидация максимального количества побочных эффектов. По мнению ряда авторов, перспективным способом для реализации этой цели является создание комплексных соединений салицилатов, в частности, с двухвалентными металлами [1, 22], с редкоземельными элементами [29, 30].
Первым комплексом металла и АСК, который показал свою бóльшую противовоспалительную активность и меньший вред для ЖКТ, нежели аспирин, был ацетилсалицилат (АСТ) меди [31]. С тех пор стало ясно, что подобные соединения могут иметь клиническую значимость.
Важно отметить, что у координационных солей – производных АСК – происходит не только возникновение новых, полезных свойств и биологических эффектов, но и усиление уже существующих, характерных непосредственно для самой АСК [30, 32]. Так, установлено, что АСТ меди превосходит АСК по всем основным свойствам – антитромботическому, анальгетическому, противораковому и т.д., имея при этом значительно меньшую токсичность [33] и в 7 раз большую селективность к циклооксигеназе (ЦОГ)-2 [34].
В экспериментальных исследованиях, выполненных в разных лабораториях, установлено, что АСТ цинка проявляют более выраженный, чем АСК противовоспалительный эффект. Также было обнаружено, что двухъядерные комплексы проявляли большую противовоспалительную активность, чем одноядерные АСТ металлов [35]. Причем, данный эффект увеличивался в ряду АСТ никель–кобальт–цинк–медь. При этом биодоступность и концентрация салициловой кислоты в плазме крови кроликов [36] и людей (перорально, таблетка в оболочке, 50 мг) [33] была выше при применении АСТ цинка, чем АСК. Также было установлено, что АСТ цинка обладает значительно меньшим эрозивным влиянием на слизистую оболочку желудка [37].
Нейротропные, психоактивные и анальгетические эффекты производных АСК с кобальтом и цинком были установлены в многочисленных экспериментальных исследованиях на моллюсках и крысах [38–44].
Даже этот небольшой перечень позволяет оценить широту эффектов, оказываемых салицилатами, а учитывая большие синтетические возможности при модифицировании производных АСК, перспективным является синтез и биоскрининг ее новых производных, что поможет решить проблему снижения побочных эффектов, резистентности к терапии аспирином и повышения терапевтического потенциала исходного соединения для получения эффективных лекарственных препаратов нового поколения. Однако применение ацетилсалицилатов для лечения заболеваний ССС крайне ограничено, что связано в том числе и с недостаточным количеством экспериментальных и клинических исследований, проводимых в данной области.
Целью данного обзора явилось обобщение современных сведений о физиологических и молекулярных механизмах действия АСК и ее производных на ССС в норме и патологии.
ВЛИЯНИЕ НА СИСТЕМУ ГЕМОСТАЗА. АНТИАГРЕГАНТНОЕ (АНТИТРОМБОТИЧЕСКОЕ) ДЕЙСТВИЕ
Многочисленные крупные клинические испытания продемонстрировали эффективность АСК в лечении и профилактике ишемической болезни сердца, гипертонии, инфаркта, инсульта и прочих сердечно-сосудистых заболеваний [44]. Как показано еще в исследовании [45], применение АСК при инфаркте миокарда необходимо для сохранения жизни, т.к. вдвое снижает частоту нефатальных рецидивов инфаркта и инсульта и летальных исходов. По способности снижать риск смерти от инфаркта миокарда АСК сопоставима с таким тромболитическим препаратом как стрептокиназа, а при совместном их использовании риск смертности снижается еще значительней.
Активация тромбоцитов и последующее тромбообразование играют ведущую роль в развитии большинства сердечно-сосудистых патологий [18], а терапевтические эффекты аспирина связаны, прежде всего, с его антиагрегантным (антитромботическим) действием. В настоящее время эффективность аспирина подтверждена многочисленными клиническими, экспериментальными исследованиями и метаанализами [46, 47]. Этот препарат является “золотым стандартом” антитромбоцитарной терапии и единственным из антитромботических препаратов, который рекомендован для использования в целях первичной профилактики сердечно-сосудистых патологий (инфаркта миокарда, внезапная смертность от коронарных причин, ишемический инсульт). А согласно [46], при вторичной профилактике сердечно-сосудистых патологий аспирин еще более эффективен, чем при первичной.
Отдельно следует отметить большой резонанс, который вызвало пилотное ретроспективное обсервационное когортное исследование 412-ти взрослых пациентов, госпитализированных с COVID-19 в несколько больниц США в период с марта по июль 2020 г., проведенное учеными Мэрилендского университета (University of Maryland College Park) и направленное на изучение влияния коронавирусной болезни на гиперкоагуляцию и повышение риска тромбоза у тяжелобольных пациентов. В результате специалисты показали прямую связь между приемом аспирина и уменьшением вероятности развития тяжелых симптомов заболевания (применения ИВЛ, поступления в отделение интенсивной терапии) и уровня внутрибольничной смертности, хотя подчеркнули необходимость в проведении рандомизированного контролируемого исследования, которое позволило бы установить связь между применением аспирина и снижением повреждения легких у пациентов с коронавирусом [48].
Аспирин может принципиально модифицировать все три компонента системы гемостаза, то есть функцию тромбоцитов, плазматическую коагуляцию и фибринолиз, хотя ингибирование функции тромбоцитов, несомненно, является наиболее значительным и наиболее интенсивно изучаемым явлением. Активация тромбоцитов также является триггерным событием, по крайней мере с двумя компонентами, чувствительными к аспирину: биосинтез тромбоксана и образование тромбина на поверхности тромбоцитов. По формальным причинам эти эффекты аспирина на тромбоциты, плазматическую коагуляцию и фибринолиз рассматриваются поочередно. Однако in vivo они образуют функциональную единицу, и отдельные изменения только одного компонента без изменения других обычно не происходят [49]. Следовательно, с точки зрения влияния АСК на ССС наиболее важным является антитромботическое действие аспирина, из чего следует и его терапевтическая эффективность.
Основной механизм действия салицилатов связан с угнетением системы циклооксигеназ, синтеза простагландинов, торможением факторов свертывания крови. На рис. 1 представлена схема основных фармакологических эффектов аспирина. АСК оказывает свое действие, главным образом, путем влияния на биосинтез циклических простаноидов, т.е. тромбоксана A2 (ТХА2), простациклина и других простагландинов. Данные молекулы способны появляться в результате ферментативного каскада окислительных реакций арахидоновой кислоты (АК), источниками которой служат мембранные фосфолипиды (рис. 2).
Рис. 1.
Механизмы действия аспирина. AA – арахидоновая кислота, ASA – ацетилсалициловая кислота, AC – ацетилирование, GC – гранулоциты, MF – макрофаги, COX – циклооксигеназа, AIL – аспирин-индуцированные липоксины, 5-LOG – 5-липоксигеназа, 15-R-HETE – 15-гидрокси-5,8,11,13-эйкозатетраеновая кислота, e-NOS – эндотелиальная синтаза оксида азота, NF-κB – транскрипционный фактор, C/EBpβ – CCAAT-энхансер-связывающий белок, m-RNA – м-РНК (по [49] с модификациями). Fig. 1. Mechanisms of action of aspirin AA – arachidonic acid, AC – acetylation, ASA – acetylsalicylic acid, GC – granulocytes, MF – macrophages, COX – cyclooxygenase, AIL – aspirin-induced lipoxins, 5-LOG – 5-lipoxygenase, 15-R-HETE – 15R-hydroxy-5,8,11,13-eicosatetraenoic acid, e-NOS – endothelial nitric oxide synthase, NF-κB – transcription factor, C/EBpβ – CCAAT-enhancer-binding protein, m-RNA – matrix RNA (after [49] with modifications).
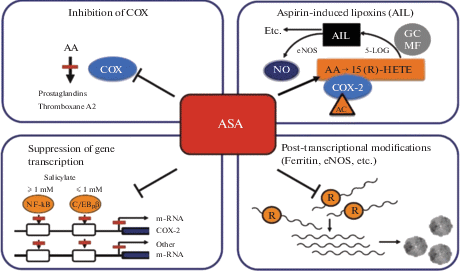
Рис. 2.
Схема метаболизма арахидоновой кислоты (+) – вазоконстрикция; (–) – вазодилатация, PGE2 – простагландин E2, PGF2α – простагландин F2α, PGI2 – простагландин I2, ТХА2 – тромбоксан А2, LTC4 – лейкотриен C4, 5-HPETE – 5-гидропероксиэйкозатетраеновая кислота (по [50] с модификациями). Fig. 2. Arachidonic acid metabolism scheme (+) – vasoconstriction, (–) – vasodilation, PGE2 – prostaglandin E2, PGF2α – prostaglandin F2α, PGI2 – prostaglandin I2, THA2 – thromboxaneA2, LTC4 – leukotriene C4, 5‑HPETE-5 – 5-hydroperoxyeicosatetraenoicacid ( after [50] with modifications).
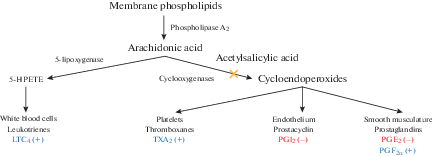
АК метаболизируется простагландин-Н-синтазой, которая с помощью ЦОГ и пероксидазы приводит к производству соответственно простагландинов PGG2 и PGH2. PGH2 затем модифицируется специфическими синтазами до простагландинов D2, E2, F2α, FI2 и ТХА2, которые опосредуют специфические клеточные функции [3].
PGH-синтаза, также известная как ЦОГ, существует в двух изоформах (ЦОГ-1 и ЦОГ-2), которые имеют значительную степень гомологии их аминокислотных последовательностей. Единственное замещение аминокислоты в каталитическом сайте фермента – в 523 положении у ЦОГ-1 находится изолейцин, а у ЦОГ-2 – валин, определяет селективность к ингибиторам изоформ ЦОГ. ЦОГ-1 присутствует в эндоплазматическом ретикулуме подавляющего числа клеток и кровяных пластинок. Именно она способствует синтезу простагландинов, определяющих протекторные свойства слизистой оболочки желудка, нормальный почечный кровоток, процессы активации и агрегации тромбоцитов. ЦОГ-2 присутствует у млекопитающих в ограниченном числе клеток. Производство данной изоформы ЦОГ активируется воспалительными стимулами и факторами роста, способствует образованию простагландинов и последующему развитию воспалительной реакции [3].
Основной механизм антитромботического эффекта АСК реализуется благодаря ингибированию ЦОГ. При этом данный эффект в 170 раз более мощный для ЦОГ-1 по сравнению с ЦОГ-2. ЦОГ-1 полностью инактивируется АСК, а ЦОГ-2 превращает АК не в PGH2, а в 15-R-гидроксиэйкозотетраеновую кислоту (15-R-НЕТЕ). Обе изоформы ЦОГ способны превращать АК в PGH2, что является обязательным условием для образования простаноидов.
Из-за эффектов аспирина блокируется синтез PGF2 и PGE2 клетками гладкой мускулатуры кровеносных сосудов. PGF2 является простаноидом с сосудосуживающими свойствами, а PGE2, напротив, вызывает вазодилатацию, увеличивает проницаемость сосудов, способствуя экстравазации жидкости [51], и играет решающую роль в развитии пяти основных признаков воспаления: отека, эритемы, боли, лихорадки и потери функции [50].
Изменение метаболизма арахидоновой кислоты под влиянием аспирина влияет и на продукцию эндотелием сосудов простациклина PGI2 (рис. 2), который является сильнодействующим вазодилататором и ингибитором адгезии тромбоцитов к эндотелию и действует через Gs-белок, что аналогично действию эндотелиального оксида азота. Благодаря этому аспирин предотвращает повреждение эндотелия, которое возникает, например, при атеросклерозе, вызывая спазм сосудов и тромбоз [50].
Тромбоциты продуцируют тромбоксан TXA2, который является одним из основных индукторов агрегации тромбоцитов и мощным вазоконстриктором, действующим через путь Gq-белка. Его синтез усиливается во время воспаления и повреждения тканей, а также после активации тромбоцитов. Это важно для сужения артериальных сосудов при повреждении сосуда и кровотечении (гемостатическая функция) [50]. Как видно из рис. 2, антитромбоцитарный эффект АСК связан с уменьшением образования TXA2 вследствие ингибирования ЦОГ-1 тромбоцитов.
Индуцированное АСК ингибирование TXA2 и PGI2 оказывает противоположные эффекты на гемостаз, однако антитромботические эффекты ингибирования TXA2 преобладают [3, 51]. При этом снижение выработки простагландинов и ТХА2 может предопределять как терапевтические, так и токсические свойства аспирина.
При сосудисто-тромбоцитарном гемостазе (СТГ) активация тромбоцитов коллагеном или аденозиндифосфатом (АДФ) сопровождается стимуляцией функции гранулоцитов, их адгезией и агрегацией. При этом агрегация гранулоцитов находится в прямой зависимости от числа тромбоцитов, а оптимальный ее уровень достигается при количественном соотношении тромбоциты/лейкоциты как 46/1. В результате стимуляции тромбоциты выделяют факторы с выраженным хемотаксисом относительно гранулоцитов – антигепариновый фактор (Р4), тромбоцитарный фактор роста (PDGF) и β-тромбоглобулин (β-TG) [53].
Существуют утверждения, что молекулярный механизм активации СТГ осуществляется с помощью провоспалительных (усиливают агрегацию и адгезию тромбоцитов и агрегацию гранулоцитов) и противовоспалительных (подавляют агрегацию) цитокинов [52, 53]. Сразу после активации тромбоцитов происходит секреция IL-1, IL-6 и GM–CSF. IL-1, выделяясь из тромбоцитов, стимулирует синтез и секрецию других провоспалительных цитокинов (IL-6, IL-8, TNF-α), стимулируя воспалительные реакции. Так, повышение концентрации TNF-α, IL-1, IL-6 в крови приводит к увеличению содержания фактора Виллебранда [53], а повышение IL-1 и IL-8 – к увеличению количества белков клеточной адгезии P-селектина (CD62P) и CD63 (TSPAN30), а также тромбоцитарных микровезикул [54]. IL-6, TNF-α и IFNγ также дозозависимо снижают концентрацию (или активность) металлопротеиназы ADAMTS-13, которая разрывает гигантские мультимеры фактора Виллебранда, играющего важную роль в свертываемости крови [55, 56]. Также IL-8 и TNF-α дозозависимо стимулируют образование эндотелиальными клетками “необычно крупных” мультимеров фактора Виллебранда (UL-vWF) [57]. Были выявлены и другие предположения по поводу механизма усиления СТГ провоспалительными цитокинами. Например, TNF-α может участвовать в этом процессе путем увеличения секреции катепсина G из нейтрофилов и активации тромбоцитов [58], IL-2 – способствовать агрегации, а затем и адгезии тромбоцитов с помощью белка LFA-1 [51]. Gori и соавт. указывают на немаловажный факт того, что агрегация тромбоцитов зависит не столько от какого-то конкретного цитокина, сколько от общего баланса между про- и противовоспалительными цитокинами. Они установили, что TNF-α и IL-4 играют значимую роль в обеспечении такого баланса и снижения риска остаточной реактивности тромбоцитов при остром коронарном синдроме [59].
Поскольку АСК подавляет активность тромбоцитов, препятствуя образованию TХA2, то увеличение процессов адгезии и агрегации нейтрофилов не наблюдается [60] и соответственно данный механизм СТГ, реализуемый с участием провоспалительных цитокинов, выключается. В открытом проспективном рандомизированном исследовании АSCET было показано снижение маркеров воспаления С-реактивного белка, TNF-α, IL-6, IL-10, MCP-1, CD40L, P-селектина и TGF-β после года терапии АСК [61]. Нужно отметить, что именно с высокой концентрацией TNF-α в сыворотке крови у 8% пациентов с метаболическим синдромом связывают резистентность к антитромботической терапии АСК [61, 62].
Следовательно, аспирин, подавляя секрецию провоспалительных и усиливая выработку противовоспалительных цитокинов, оказывает антиагрегантное, антиадгезивное и противотромбическое действие.
АСК может оказывать дополнительный антитромботический эффект за счет образования резольвинов – гидроперекисей полиненасыщенных жирных кислот (ПНЖК), потенцирующих ее противовоспалительное действие вследствие ингибирования синтеза PGE2, PGF2, TXA2 и LT серии 4, снижения экспрессии генов IL-1β, -2, -6, -8, -12, IFN-γ, TNFα, ЦОГ-2 [63, 64]. Так, под влиянием АСК эндотелиоциты преобразуют эйкозопентаеновую кислоту (ЭПК) в 18R-гидроксиэйкозапентаеновую кислоту (18R-гидрокси-ЭПК) при непосредственном участии ЦОГ-2. АСК ацетилирует ЦОГ-2 и данный фермент утрачивает способность принимать участие в образовании простагландинов, но способен влиять на каталитическую реакцию преобразования ЭПК в 18R-гидрокси-ЭПК, которая является основным предшественником так называемого резольвина Е1 (РЕ1). Далее 18R-гидрокси-ЭПК высвобождается из эндотелиоцитов и с участием фермента 5-липоксигеназы нейтрофилов преобразуется в 5S,12R,18R-тригидрокси-ЭПК, которая и является РE1 [65, 66]. Энзимы микросомальной системы окисления в организме человека преобразуют ЭПК в 18R-гидрокси ЭПК, далее нейтрофилы трансформируют ее в резольвины РE1 и РE2 [65]. Установлено, что содержание РЕ1 в плазме и сыворотке крови повышается в случае терапевтического применения АСК и/или приема ЭПК [66].
РE1 препятствует активации и трансэндотелиальной миграции нейтрофилов, что достигается за счет противовоспалительной активности данного липидного медиатора [65]. РE1 также тормозит активацию NF-kB и снижает образование супероксид-аниона, препятствуя благодаря этим механизмам развития функционального ответа полиморфно-ядерных лейкоцитов на воспалительные стимулы. РE1 понижает уровень L-селектина и CD-18, способствующих процессу клеточной адгезии, а также продукции тромбоксанов и процессам агрегации тромбоцитов, стимулируемой посредством АДФ, тормозит высвобождение IL-12 из дендритных клеток, увеличивает экспрессию апоптотическими лейкоцитами рецептора к хемокинам CCR5, стимулирует фагоцитоз полиморфно-ядерных лейкоцитов, подвергшихся апоптозу [67, 68]. Таким образом, биологические эффекты РE1 обусловливают как противовоспалительную активность, так и работу молекулярных механизмов, обеспечивающих разрешение воспалительного процесса.
Физиологические эффекты РE1 реализуются посредством G-белок-сопряженных рецепторов ChemR 23 и BLT1 [66, 68]. Первый рецептор присутствует на мембране моноцитов, дендритных клеток и тромбоцитов, а второй – на мембране нейтрофилов. Первый молекулярный механизм действия РE1 основан на взаимодействии с рецептором ChemR23, приводящем к ингибированию активации фактора NF-kB на поверхности макрофагов, активации фосфатидилинозитол-3-киназного/Akt-киназного каскада внутриклеточной сигнализации, и как следствие – значительному росту фагоцитоза полиморфно-ядерных лейкоцитов макрофагами [69]. Второй молекулярный механизм действия РE1 основан на антагонистическом взаимодействии с BLT1 – рецептором лейкотриена B4 и торможении физиологических эффектов лейкотриенов, обладающих провоспалительной активностью [68]. РE2 обладает сходными с РE1 биологическими эффектами, но рецепторы, на которые он способен воздействовать, пока неизвестны [70]. В условиях применения АСК из докозагексаеновой кислоты (ДГК) образуются эпимеры резольвинов D (РD), например, 7S,8R,17R-тригидрокси-ДГК – эпимер РD1. G-белок-сопряженные рецепторы ALX и GPR32 способны взаимодействовать с РD1 [71]. РD1 в значительной степени ингибирует миграцию нейтрофилов через эндотелий, а в клетках микроглии блокирует транскрипцию IL-1β. В обзорах [72, 73] отмечается, что разработка и использование препаратов, способствующих разрешению воспалительного процесса, в частности, комбинированное использование АСК и ω-3 полиненасыщенных жирных кислот и/или синтетических резольвинов перспективна для борьбы с воспалительными заболеваниями, в том числе и сосудистыми патологиями.
Фермент 5-липоксигеназа активированных нейтрофилов преобразует 15R-HETE (рис. 1), образовавшуюся ранее при участии изоформы ЦОГ-2 под влиянием АСК, и превращается в 15-эпи-липоксин A4 (AIL) [74]. AIL и РE1 могут препятствовать при стимуляции PDGF миграции гладкомышечных клеток большой подкожной вены человека и снижать фосфорилирование рецептора βPDGF. Рецептор ALX и рецептор ChemR23 были обнаружены в сосудистых гладкомышечных клетках человека. Эти результаты позволяют рассматривать периферическое заболевание сосудов как патологическое состояние, связанное с нарушением баланса в организме про- и противовоспалительных молекулярных механизмов, и предполагают возможность лечения и коррекции сосудистых поражений путем восстановления данного баланса.
Следует отметить, что ни одна другая проблема в исследованиях аспирина не обсуждалась так интенсивно, как вопрос об его оптимальной антитромботической дозе – часто, хотя и не обязательно правильно, считающейся равной антиагрегантной дозе.
Эффективность АСК для лечения и профилактики сердечно-сосудистых заболеваний установлена для достаточно широкого диапазона доз – от 30–50 до 1500 мг/сутки. Общепринято, что регулярные суточные дозы аспирина от 75 до 100 мг или однократный прием препарата в дозе 160 мг достаточны для ингибирования функции тромбоцитов и образования тромбоксана посредством ацетилирования ЦОГ-1 [75].
Следует обратить внимание, что в отличие от ТХА2, в синтезе которого основную роль играет ЦОГ-1, в образовании PGI2 принимают участие обе изоформы ЦОГ [76, 77]. Именно поэтому в малых дозах АСК (30–100 мг) блокируется преимущественно ЦОГ-1, приводя к уменьшению синтеза ТХА2, тогда как активность ЦОГ-2 сохраняется, а, следовательно, уровень простациклина PGI2 остается достаточно высоким [76].
Аспирин подвергается быстрому всасыванию в верхних отделах желудочно-кишечного тракта и нарушает функции тромбоцитов уже в течение одного часа, что связано с торможением TXA2-зависимой агрегации тромбоцитов. Эти явления наблюдаются еще до того момента, когда АСК обнаруживается в периферической крови, поскольку АСК воздействует на тромбоциты еще в портальном кровотоке, поэтому антитромбоцитарный эффект препарата не зависит от его распределения в системном кровотоке. Именно с этим связана эффективность малых доз АСК, поскольку больший ингибирующий эффект оказывается на тромбоциты, а не на сосудистую стенку, где происходит образование простациклина [10].
В плазме крови обычно время полураспада АСК занимает около 20 мин. Но из-за того, что тромбоциты не способны образовывать новую ЦОГ, эффект АСК длится значительно дольше – до 10 сут, что сопоставимо с длительностью полного жизненного цикла этих форменных элементов [3]. Для максимального ингибирования ЦОГ необходимо не менее суток, затем при ежедневном употреблении низких доз АСК наблюдается ее кумулятивный эффект. In vivo почти полное торможение образования тромбоксана и тромбоцитарных функций достигается всего через несколько минут при условии, что циркулирующие уровни неметаболизированного аспирина, способного к целевому ацетилированию, достаточно высоки. Почти полное ингибирование образования тромбоксана и агрегации тромбоцитов, вызванное арахидоновой кислотой, наблюдается в течение 5 мин после внутривенного введения 250 и 500 мг растворимого аспирина. После перорального приема 500 мг требуется 20 мин для достижения максимального эффекта и гораздо более продолжительное время для более низких доз [78]. Это и является основной причиной, по которой аспирин вводится внутривенно в случае необходимости немедленного ингибирования функции тромбоцитов, например, в качестве неотложной терапии первой линии при острых коронарных синдромах.
При этом существуют данные о том, что АСК не влияет непосредственно на коагуляцию в антиагрегантных дозах (300 мг) у здоровых людей [79]. Однако есть доказательства того, что аспирин может косвенно влиять на систему свертывания путем ингибирования образования тромбина. Является ли эта деятельность, главным образом, тромбоксан-зависимой или нет, еще предстоит определить. Напротив, эффект ингибирования коагуляции аспирином в высоких антиревматических дозах (3–4 г) известен давно. Это обусловлено угнетением печеночного синтеза витамин К-зависимых факторов свертывания крови.
Несмотря на неоспоримую пользу терапевтического применения АСК, данная кислота – условно оптимальный антитромбоцитарный препарат, так как у пациентов, регулярно принимающих АСК, могут возникать тромботические осложнения [80, 81]. Так, в ряде клинических исследований курсового применения АСК у пациентов с острым коронарным синдромом был обнаружен более высокий риск осложнений [81]. У больных с ишемическими осложнениями во время длительного приема АСК клинические признаки аспиринорезистентности могут достигать в разных группах от 5 до 40% [82].
Аспирин все чаще используется совместно с другими антитромботическими препаратами – двойная антитромбоцитарная терапия (ДАТ), в том числе и с более эффективными, чем АСК [83, 84]. Наиболее ярким и известным примером ДАТ является одновременное использование АСК и клопидогреля [63]. В исследовании CURE у пациентов с нестабильной стенокардией и инфарктом миокарда без элевации сегмента ST показано 20%-ное снижение относительного риска в группе лечения комбинацией клопидогреля с аспирином по сравнению с назначением плацебо с аспирином [72]. При этом главный принцип ДАТ основан на максимально раннем применении обоих указанных препаратов и их комбинаций [85].
В настоящее время, согласно данным обзора [86], ДАТ доказала свою эффективность и безопасность по сравнению с изолированной терапией АСК в случае развития острого коронарного синдрома, при профилактическом лечении тромбозов и т.д. Оптимальная продолжительность ДАТ определяется особенностями каждого отдельного клинического случая. В 2017 г. рабочая группа кардиологов по ДАТ ЕОК, ESC и EACTS издала обновленную версию клинических рекомендаций по использованию ДАТ [87]. Согласно этим рекомендациям, АСК остается основным препаратом в различных клинических протоколах ДАТ.
ВЛИЯНИЕ НА ФИБРИНОЛИЗ
АСК прямо и косвенно оказывает влияние и на процессы фибринолиза через разные механизмы. Двумя наиболее важными мишенями этого процесса являются тромбоциты и их медиаторы, способствующие выработке прокоагулянтных и антифибринолитических факторов, а также эндотелий сосудов, генерирующий антикоагулянтные и профибринолитические факторы. Итоговый эффект зависит от взаимодействия между этими процессами. При этом аспирин не изменяет уровни производного эндотелия – тканевого активатора плазминогена или ингибитора активатора плазминогена-1 (PAI-1) в плазме крови.
Показано, что АСК не влияет на усиление фибринолиза после физических упражнений. Тем не менее, несколько исследований на здоровых добровольцах продемонстрировали ингибирование аспирином индуцированного ишемией фибринолиза. Предполагаемый механизм действия заключался в ингибировании высвобождения эндотелиального tPA при неизменной активности PAI. Авторы делают вывод, что простациклин предотвращал ингибирование фибринолиза аспирином [88].
Таким образом, АСК оказывает выраженное влияние на процессы гемостаза, обладая, в первую очередь, антиагрегантным действием. Однако клинические испытания продемонстрировали, что положительные эффекты АСК нельзя полностью объяснить исключительно ее антиагрегантными свойствами, поскольку не было обнаружено, что другие агенты, ингибирующие тромбоцитарную функцию, являются такими же эффективными, как АСК.
Накопленные данные свидетельствуют о том, что окислительный стресс как результат увеличения выработки свободных радикалов и снижения уровня антиоксидантов в миокарде может играть важную роль в патогенезе и/или прогрессировании сердечно-сосудистых заболеваний, особенно при атеросклерозе и гипертонии.
АНТИОКСИДАНТНОЕ ДЕЙСТВИЕ
Отмечается [3, 6], что клиническая эффективность АСК и ее производных в отношении сердечно-сосудистых заболеваний часто связаны с антиоксидантными свойствами, которые основаны на мембранопротекторном и антиапоптотическом эффектах. Существует несколько гипотез молекулярного механизма антиоксидантных эффектов аспирина. В частности, было показано [44], что АСК и ее метаболиты могут тормозить цитокин-зависимую индукцию экспрессии гена NOS-II благодаря эффекту активации ядерного фактора NF-κB. Данный эффект направлен на снижение нитрозирующего стресса, сопровождающего выработку цитокинов. В модели гипоксии in vitro в экспериментальной работе на переживающих срезах головного мозга крыс было также показано [89], что АСК и ее основной метаболит салициловая кислота снижают окислительный стресс и активность iNOS. Поэтому в одной из основных гипотез антиоксидантного действия АСК его физиологический механизм связывают с препятствованием нитрозирующему стрессу, который часто наблюдается при выработке воспалительных цитокинов [3, 6].
В ходе экспериментального исследования Wu c соавт. было показано, что АСК при хроническом введении (перорально 12 и 56 дней по 100 мг/кг) оказывает антиоксидантный эффект, снижая уровень активных форм кислорода в аорте, а также снимая вызванную ангиотензином II гипертонию у крыс [44]. АСК уменьшает прогрессирование атеросклероза, защищая липопротеины низкой плотности от окислительной модификации, а также снижает эндотелиальную дисфункцию в атеросклеротических сосудах [3].
Аспирин может поглощать гидроксильные радикалы с образованием производных 2,3- и 2,5-дигидроксибензоата и может ацетилировать ε-аминогруппы остатков лизина в белках, препятствуя их окислению. Такой механизм представляется особенно важным при предотвращении свободнорадикального окисления липопротеинов и фибриногена. Вполне вероятно, что подобные эффекты аспирина способны снижать патологические воспалительные реакции у больных с ишемической болезнью сердца [3].
В последние годы установлено, что комплексные соединения АСК с металлами, а именно цинксодержащие, зарекомендовали себя как клинически значимые антиоксиданты. Например, в экспериментах Korkmaz и соавт. на крысах показано, что аспиринат цинка (5 дней, 100 мг/кг) оказывает кардиопротективное действие в модели изопреналинового инфаркта за счет предотвращения снижения уровня мРНК супероксиддисмутазы 1 (СОД 1) [90]. Последний эффект связан со строением СОД1, которая содержит в активном центре атом меди, и для стабилизации структуры белка ей необходим цинк [91]. Установлено, что не только СОД1, но и многие другие ферменты имеют в своей структуре атомы металлов и/или способны связываться с ними: никель (СОД, глиоксилаза I и др.) [92], марганец (СОД, каталаза, аргиназа и др.) [93], кобальт (карбоксипептидаза, карбоангидраза, алкогольдегидрогеназа и др.) [94], а цинк регулирует активность более 300 различных ферментов (оксидоредуктазы, лиазы, гидролазы, трансферазы и т.д.) [95]. Некоторые из указанных ферментов принимают важное участие в функционировании антиоксидантной и ССС систем организма, среди которых можно отметить аргиназу II как перспективную фармакологическую мишень в коррекции эндотелиальной дисфункции и целого ряда сердечно-сосудистых заболеваний. Возможность комплексообразования салициловой кислоты с переходными металлами позволяет предположить, что определенные биологические эффекты салицилатов могут быть связаны с взаимодействием с металлоферментами [96]. Было установлено, что салицилаты и АСК способны изменять активность ряда ферментов [97], в том числе и аргиназы [98].
Все эти сведения могут служить фундаментальной основой для дальнейших, более глубоких, и прикладных исследований терапевтического потенциала перспективных координационных солей АСК.
ИЗМЕНЕНИЯ ВЕГЕТАТИВНОЙ АКТИВНОСТИ, ПОКАЗАТЕЛЕЙ РАБОТЫ СЕРДЦА И ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ
Нарушение вегетативного баланса, характеризующееся повышенной симпатической активностью и сниженной вагусной активностью, является основным фактором риска сердечно-сосудистых заболеваний. Кардиопротекторные свойства аспирина и его производных реализуются через множество различных физиологических процессов, в частности, посредством влияния на основные показатели деятельности сердца.
В ходе исследования на здоровых людях были установлены благоприятные изменения вегетативной активности после применения аспирина (7 капсул по 325 мг в течение 60 ч): наблюдалось повышение HF, снижение LF и отношения LF/HF по сравнению с группой плацебо [99]. Авторы исследования связывают эти эффекты со свойством АСК ингибировать простагландины. В то же время не было обнаружено влияния аспирина на частоту дыхания, сердечных сокращений (ЧСС) и артериальное давление. В другом плацебо-контролируемом двойном слепом исследовании хроническое ежедневное введение 500 мг АСК (7 дней) не повлияло на вариабельность сердечного ритма у 16 здоровых мужчин-добровольцев в возрасте 22–28 лет [100]. В эксперименте Furuno и соавт. на 11 здоровых мужчинах (23–39 лет) не было зарегистрировано действие аспирина (дозы от 81 до 660 мг, каждые 3 дня в течение 13 дней) на ЧСС, однако доза в 162 и 660 мг АСК увеличивала вазодилатацию плечевой артерии [101].
Данные, полученные у здоровых людей в состоянии покоя, свидетельствуют о том, что АСК не влияет на сердечный ритм. При этом предварительный прием 81 мг аспирина при кардионагрузке (наклон головы на 60 градусов) улучшал показатели ВСР волонтеров [102].
В исследованиях, проведенных на крысах линии Вистар, внутрибрюшинное введение АСК в дозах 5 и 10 мг/кг привело к уменьшению ЧСС, причем данный эффект не зависел от дозы [90, 103]. В процессе комплексообразования АСК с металлами кобальта (АСCo2+), цинка (АСZn2+), марганца (АСMn2+), никеля (АСNi2+) отмечалось изменение эффекта, свойственного молекуле предшественнице – АСК: АСCo2+ и АСZn2+в обеих тестируемых дозах снижали отрицательный хронотропный эффект, характерный для АСК; АСMn2+ вызывал противоположный эффект, связанный с увеличением ЧСС, а АСNi2+ не влиял на регистрируемый показатель.
В экспериментах на крысах в модели изопреналинового инфаркта показано, что аспиринат цинка (5 дней, 100 мг/кг) оказывал кардиопротективное действие: улучшалась сократительная функция сердца, значительно увеличились ударный объем и сердечный выброс, уменьшалась элевация сегмента ST на ЭКГ, снижалось количество воспалительного инфильтрата в тканях, а также происходило предотвращение снижения уровня мРНК супероксиддисмутазы 1 (СОД 1). В более позднем исследовании этих авторов показано, что АСТ цинка (100 мг/кг, перорально, 5 дней) не влияет на ЧСС, давление и ЭКГ, однако снижает системное сосудистое сопротивление по сравнению с контрольной группой. В следующем исследовании эта группа ученых, в целом, подтвердила свои предыдущие результаты, однако, выявила, что АСТ цинка удлиняет комплекс QRS ЭКГ на 2 мс по сравнению с контрольной группой [104]. Необходимо отметить, что указанные изменения в данном эксперименте могут быть связаны как с нарушением функционального состояния организма животных (инфаркт), так и с применением комплексного соединения АСК с цинком, что, как отмечалось выше, может значительно усиливать эффективность АСК.
Влияние АСК на артериальное давление (АД) у здоровых людей было изучено в нескольких исследованиях. Так, Boger и соавт. в исследовании на 13 здоровых женщинах (24.9 ± 0.5 г.), которые были рандомизированы для приема аспирина (100 мг/день) в течение одной недели, значимых влияний препарата на АД не было обнаружено [105].
Вместе с тем, Hermida с соавт. в первом исследовании на 55-ти здоровых людях (20.9 ± 1.8 лет, 35 мужчин и 20 женщин) после приема аспирина (500 мг/день) в течение одной недели при пробуждении, днем или перед сном зарегистрировали значимое снижение АД только при приеме аспирина днем, спустя 7–9 ч после пробуждения [106]. Во втором исследовании при использовании двух доз аспирина (100 и 500 мг/кг) и большей выборки (73 человека) предыдущие результаты были воспроизведены: дозы в 100 и 500 мг/кг приводили к небольшому, но статистически значимому снижению САД и ДАД на 2 мм рт. ст. Более выраженный эффект оказал аспирин в дозе 100 мг/кг перед сном [106]. Тем не менее, все эти эффекты были внутригрупповыми, т.е. достоверные статистические отличия были зафиксированы между группами добровольцев, получавших разные дозы АСК и в разное время суток, однако отличий от группы плацебо не наблюдалось.
Аналогичные результаты получены и в экспериментальных исследованиях при кардионагрузке у здоровых волонтеров (наклон головы на 60 градусов): после применения аспирина изменения уровня АД не обнаружено [102]. АСК (0.01 мM/кг, 14 дней, интрагастрально) не влиял на АД и ЧСС и у крыс линии Вистар [107]. Наши исследования на крысах линии Вистар (внутрибрюшинное введение АСК в дозах 5 и 10 мг/кг) также продемонстрировали отсутствие изменений со стороны АД [103].
Таким образом, на основании имеющихся данных можно заключить, что АСК не влияет на АД у здоровых людей и интактных животных.
При этом в экспериментальном исследовании Wu с соавт. показано, что АСК снимает вызванную ангиотензином II гипертонию у крыс – наблюдалось снижение систолического артериального давления в среднем на 15% (30–35 мм рт. ст.). Стоит отметить, что эти эффекты проявлялись только при хроническом введении аспирина (перорально, 12 и 56 дней по 100 мг/кг) [44].
Однако, в целом, большинство исследований, оценивающих влияние аспирина на АД при гипертонической болезни, показывают, что при использовании в низких дозах аспирин сам по себе не влияет на значения АД и не противодействует снижению АД антигипертензивными препаратами, однако улучшает их эффект [99, 102].
Комплексообразование АСК с металлами приводит к появлению новых свойств, отличных от АСК. Так, внутрибрюшинное введение крысам АСMn2+, АСNi2+ (10 мг/кг) в отличие от исходного соединения вызывает изменение АД, связанное прежде всего с увеличением диастолического АД, а АСZn2+в дозе 10 мг/кг –увеличение диастолического АД на фоне снижения систолического и пульсового [103].
Изменение АД под влиянием салицилатов может являться следствием изменения тонуса гладкой мускулатуры в стенках кровеносных сосудов.
В частности, Leithäuser с соавт. показали, что 7-дневное употребление аспирина здоровыми людьми (500 мг/день) увеличивает скорость движения эритроцитов (мм/с) по капиллярам безымянного пальца левой руки [108]. По результатам эксперимента Buchanec и соавт. установлено, что однократная доза АСК (10 мг/кг) спустя 1–2 ч улучшает кровоток в сосудах среднего пальца у детей [109]. В то же время, по данным Dahmus и соавт., аспирин (81 мг/кг, 7 дней, перорально) не влияет на микроциркуляцию в коже у взрослых здоровых людей (56 ± 1 г.) [110], однако другое исследование с применением аспирина в той же дозе (81 мг/кг, 7 дней, перорально) продемонстрировало ослабление рефлекторной вазодилатации в коже здоровых людей (53 ± 2 г.) [111], что, по мнению авторов исследования, предполагает участие тромбоцитов в рефлекторной вазодилатации за счет высвобождения вазодилатирующих факторов.
Исследования влияния АСК и ее производных на периферическую микрогемодинамику проводились и в экспериментах на животных. Было показано, что аспирин (3 дня, 100 мг/кг, перорально) улучшает показатели периферического кровотока у мышей в холодовой и тепловой пробах. В исследовании Bulckaen и соавт. установлено, что хроническое введение аспирина (перорально 90–120 мкг АСК/день, мыши, 8 или 16 недель) вызывало не только антиоксидантный эффект, но и улучшение функционирования эндотелия кровеносных сосудов, восстанавливая нормальный процесс их дилатации [112].
Методом лазерной допплеровской флоуметрии показано, что введение аспирина (5 мг/кг, внутримышечно) крысам спустя 30 мин увеличивает среднее квадратичное отклонение и значения амплитуд нейрогенного и мышечного генеза, снижает амплитуды эндотелиального генеза; спустя 60 мин наблюдается снижение скорости кровотока и амплитуд эндотелиального генеза. Интересно отметить, что такой эффект оказался статистически значимым только для участков кожи на правой стороне тела крыс, но не для симметричных участков слева [113].
Наши исследования подтвердили и дополнили эти данные. При внутрибрюшинном введении АСК в дозах 5, 10, 40, 80, 120 мг/кг крысам линии Вистар наблюдалось достоверное изменение активности практически всех компонентов регуляции микрососудистого тонуса, зарегистрированного методом лазерной допплеровской флоуметрии, что выражалось в увеличении эндотелий-зависимой вазодилатации, снижении периферического сопротивления, увеличении притока крови в нутритивное микрососудистое русло, улучшении венулярного оттока. Указанные изменения максимально проявлялись при введении животным АСК в дозе 80 мг/кг [103]. Данные изменения в целом могут свидетельствовать о развитии гиперемии, которая является одним из видов проявления фармакологического действия АСК, связанного с его жаропонижающим действием. Причем результаты исследования показали, что действие АСК реализуется прежде всего на микроциркуляторном уровне и в меньшей степени на уровне центральной гемодинамики.
Введение металлов-комплексообразователей Co2+, Zn2+, Mn2+ и Ni2+ в структуру АСК изменило способность молекулы-предшественницы влиять на периферическую микроциркуляцию, что является существенным свойством для соединений, применяемых с целью профилактики и лечения сердечно-сосудистых заболеваний. При этом введение животным АСCo2+ и АСZn2+ привело к развитию вазодилатации и гиперемии, которая по некоторым параметрам превосходит таковую при АСК, а АСMn2+ и АСNi2+, наоборот, к значительно менее выраженной вазодилатации, чем при введении АСК, что можно расценивать как предотвращение развития гиперемии, вызываемой АСК [114].
Вероятно, что данный эффект связан со способностью АСК блокировать ЦОГ тромбоцитов с последующим блокированием синтеза из арахидоновой кислоты простагландинов. Следствие ингибирования ЦОГ – угнетение функции тромбоксан-синтетазы и в результате уменьшение образования активного проагреганта тромбоксана А2, в то время как уровень простациклина, мощного естественного вазодилататора и антиагреганта, сохраняется достаточно высоким. Вероятно, что АСК в исследованном диапазоне доз вызывает подавление ЦОГ-1, что отражается в изменениях микрогемодинамики – развитии гиперемии кожи.
ЗАКЛЮЧЕНИЕ
Таким образом, в современной литературе четко прослеживается возросший интерес к изучению биологических и терапевтических эффектов салицилатов. Одним из важнейших направлений остается расширение и усиление известной терапевтической активности на фоне снижения и/или ликвидации побочных эффектов. Приведенный обзор данных литературы позволяет оценить широту эффектов, оказываемых АСК на функционирование ССС. Однако применение этого препарата для лечения сердечно-сосудистых заболеваний ограничено, что связано как со множеством побочных нежелательных эффектов, так и с недостаточным количеством экспериментальных и клинических исследований, проводимых в данной области.
Учитывая большие синтетические возможности при модифицировании производных АСК, перспективным является синтез и биоскрининг ее новых производных, что поможет решить проблему снижения побочных эффектов и повышения терапевтического потенциала исходного соединения для получения эффективных лекарственных препаратов нового поколения, обладающих низкой токсичностью и высокой безопасностью для пациентов.
Очевидным также является незначительное количество исследований влияния АСК и ее производных на периферическую микрогемодинамику, что не дает полной информации о количественных и качественных изменениях микроциркуляторных процессов, не позволяет вскрыть механизмы биологического действия этих соединений на ССС. Вместе с тем, такие исследования капиллярного кровотока являются крайне актуальными особенно в условиях сложившейся эпидемиологической обстановки, поскольку установленным фактом является то, что основные нарушения при COVID-19 развиваются именно на уровне микрососудистого русла с развитием системной дисфункции эндотелия (вазомоторной и обменной) и активацией тромбоцитарно-сосудистого звена гемостаза, вовлекая в патологический процесс все органы и системы организма, что открывает новые перспективы экспериментальных исследований АСК и ее соединений.
Список литературы
Григорьева А.С. Оптимизация фармакотерапевтической активности биометаллов при комплексообразовании с НПВП. Микроэлементы в медицине. 2(1): 17–22. 2000. [Grigorieva A.S. The optimization of farmacotherapeutic activity upon the complex formation between biometals and non-steroid anti- inflammatory compounds. Trace Elements in Medicine. 2(1): 17–22. 2000. (In Russ)].
Bica K., Rijksen C., Nieuwenhuyzena M., Rogers R.D. In search of pure liquid salt forms of aspirin: ionic liquid approaches with acetylsalicylic acid and salicylic acid. Phys. Chem. 12: 2011–2017. 2010. https://doi.org/10.1039/b923855g
Awtry E.H., Loscalzo J. Aspirin. Circulation. 101(10): 1206–1218. 2000.
Rainsford K.D. Aspirin and related drugs. Sheffield. UK. CRC Press. 2004.
Guan X., Shao F., Xie X., Chen L., Wang W. Effects of aspirin on immobile behavior and endocrine and immune changes in the forced swimming test: comparison to fluoxetine and imipramine. Pharmacol. Biochem. Behav. 124: 361–366. 2014. https://doi.org/10.1016/j.pbb.2014.07.002
Bayram F., Reis R., Tunçer B., Sipahi H. The importance of the structural similarity of drugs used for depression and inflammation. Two comorbid diseases. Curr. Topics Med. Chem. 18(16): 1416–1421. 2018. https://doi.org/10.2174/1568026618666180821144704
Tauseef M., Sharma K.K., Fahim M. Aspirin restores normal baroreflex function in hypercholesterolemic rats by its antioxidative action. Eur. J. Pharmacol. 556(1–3): 136–143. 2007. https://doi.org/10.1016/j.ejphar.2006.11.029
Brunello N., Alboni S., Capone G., Benatti C., Blom J.M., Tascedda F., Kriwin P., Mendlewicz J. Acetylsalicylic acid accelerates the antidepressant effect of fluoxetine in the chronic escape deficit model of depression. Internat. Clin. Psychopharmacol. 21(4): 219–225. 2006. https://doi.org/10.1097/00004850-200607000-00004
Almeida O.P., Flicker L., Yeap B.B., Alfonso H., McCaul K., Hankey G.J. Aspirin decreases the risk of depression in older men with high plasma homocysteine. Translat. Psychiatry. 2(8): 151. 2012. https://doi.org/10.1038/tp.2012.79
Черетаев И.В., Хусаинов Д.Р., Коренюк И.И., Чуян Е.Н., Раваева М.Ю., Шульгин В.Ф., Гусев А.Н. Нейротропные эффекты салицилатов: физиологические механизмы. Ученые записки Крымского федер. универ. им В.И. Вернадского. Биология. Химия. 5(4): 201–213. 2019. [Cheretaev I.V., Khusainov D.R., Koreniuk I.I., Chuyan E.N., Ravaeva M.Yu., Shulgin V.F., Gusev A.N. Neurotropic effects of salycylates: physiological mechanism. Scientific Notes of Taurida V.I. Vernadsky National Univer. Series: Biology. Chemistry. 5(4): 201–213. 2019 (In Russ)].
Arkhipova O.V., Grishin S.N., Sitdikova G.F., Zefirov A.L. The presynaptic effects of arachidonic acid and prostaglandin E2 at the frog neuromuscular junction. Neurosci. Behav. Physiol. 36(3): 307–312. 2006. https://doi.org/10.1007/s11055-006-0017-9
Angelova P., Müller W. Oxidative modulation of the transient potassium current IA by intracellular arachidonic acid in rat CA1 pyramidal neurons. Eur. J. Neurosci. 23(9): 2375–2384. 2006. https://doi.org/10.1111/j.1460-9568.2006.04767.x
Rubner G., Bensdorf K., Wellner A., Bergemann S., Gust R. Synthesis, Characterisation and Biological Evaluation of Copper and Silver Complexes based on Acetylsalicylic Acid. Arch. Pharm. Chem. Life Sci. 344: 684–688. 2010
Gilligan M.M, Gartung A., Sulciner M.L., Norris P.C., Huang S., Kieran M.W., Serhan C.N. Aspirin-triggered proresolving mediators stimulate resolution in cancer. Proc. Natl. Acad. Sci. 116(13): 6292–6297. 2019. https://doi.org/10.1073/pnas.1804000116
Altinoz M.A., Elmaci I., Cengiz S., Emekli-Alturfan E., Ozpinar A. From epidemiology to treatment: Aspirin’s prevention of brain and breast-cancer and cardioprotection may associate with its metabolite gentisic acid. Chemico-Biol. Interact. 291: 29–39. 2018. https://doi.org/10.1016/j.cbi.2018.05.016
Rolka D.B., Fagot-Campagna A., Narayan K.M. Aspirin use among adults with diabetes: estimates from the Third National Health and Nutrition Examination Survey. Diabetes Care. 24(2): 197–201. 2001. https://doi.org/10.1001/archinte.164.22.2492
Terry M.B., Gammon M.D., Zhang F.F., Tawfik H., Teitelbaum S.L., Britton J.A., Subbaramaiah K., Dannenberg A.J., Neugut A.I. Association of frequency and duration of aspirin use and hormone receptor status with breast cancer risk. J.A.M.A. 291(20): 2433–2440. 2004. https://doi.org/10.1001/jama.291.20.2433
Doutremepuich C., Aguejouf O, Desplat V., Eizayaga F.X. Aspirin therapy: an attempt to explain the events of prothrombotic complications after treatment discontinuation. Thrombosis and Haemostasis. 103(1): 171–180. 2010. https://doi.org/10.1160/TH09-07-0506
Patrignani P., Patrono C. Aspirin and cancer. J. Am. College Cardiol. 68(9): 967–976. 2016. https://doi.org/10.1016/j.jacc.2016.05.083
Jacobs E.J., Newton C.C., Gapstur S.M., Thun M.J. Daily aspirin use and cancer mortality in large US cohort. J. Natl. Cancer Inst. 104(16): 1208–1217. 2012. https://doi.org/10.1093/jnci/djs318
McNeil J.J., Gibbs P., Orchard S.G., Lockery J.E., Bernstein W.B., Cao Y., Ford L., Haydon A., Kirpach B., Macrae F., McLean C., Millar J., Murray A.M., Nelson M.R., Polekhina G., Reid C.M., Richmond E., Rodríguez L.M., Shah R.C., Tie J., Umar A., van Londen G.J., Ronaldson K., Wolfe R., Woods R.L., Zalcberg J., Chan A.T., ASPREE Investigator Group. Effect of aspirin on cancer incidence and mortality in older adults. J. Natl. Cancer Inst. 1–24. 2020. https://doi.org/10.1093/jnci/djaa114
Вельц Н.Ю., Журавлева Е.О., Букатина Т.М., Кутехова Г.В. Нестероидные противовоспалительные препараты: проблемы безопасности применения. Безопасность и риск фармакотерапии. 6(1): 11–18. 2018. [VeltsN.Yu., Zhuravleva E.O., Bukatina T.M., Kutekhova G.V. Non steroidalanti-inflammatory drugs: problems of safe use. Safety and Risk Pharmacother. 6(1): 11–18. 2018. (In Russ)]. https://doi.org/10.30895/2312-7821-2018-6-1-11-18
Венгеровский А.И., Батурина Н.О., Саратиков А.С. Синдром Рейе – тяжелое осложнение терапии салицилатами. Экспер. и клин. фармакол. 63(2): 76–80. 2000. [Vengerovsky A.I., Baturina N.O., Saratikov A.C. Reye’s Syndrome – a serious complication of treatment with salicylates. Exp. and Clin. Pharmacol. 63(2): 76–80. 2000. (In Russ)].
Mogilevskaya E., Demin O., Goryanin I. Kinetic model of mitochondrial krebs cycle: unraveling the mechanism of salicylate hepatotoxic effects. J. Biol. Physics. 32(3–4): 245–271. 2006. https://doi.org/10.1007/s10867-006-9015-y
Sanderson S., Emery J., Baglin T., Kinmonth A.L. Narrative review: Aspirin resistance and its clinical implications. Ann. Int. Med. 142(5): 370–380. 2005.
Lanza F.L. A guide line for the treatment and prevention of NSAID–inducedulcers. Am. J. Gastroent. 93: 2037–2046. 1998.
Chan F.K., Chung S.C., Suen B.Y., Lee Y.T., Leung W.K., Leung V.K., Wu J.C., Lau J.Y., Hui Y., Lai M.S., Chan H.L., Sung J.J. Preventing recurrent upper gastrointestinal bleeding in patient with Helicobacter pylori infection who are taken low dose aspirin or naproxen. N. Engl. J. Med. 344(13): 967–973. 2001. https://doi.org/10.1056/nejm200103293441304
Lai K.C., Lam S.K., Chu K.M., Wong B.C., Hui W.M., Hu W.H., Lau G.K., Wong W.M., Yuen M.F., Chan A.O., Lai C.L., Wong J. Lansoprazole for the prevention of recurrences of ulcer complications from long term low dose aspirin use. N. Engl. J. Med. 346(26): 2033–2038. 2002. https://doi.org/10.1056/NEJMoa012877
Fadeyi O.O., Obafemi C.A., Adewunmi C.O., Iwalewa E.O. Antipyretic, analgesic, anti-inflammatory and cytotoxic effects of four derivatives of salicylic acid and anthranilic acid in mice and rats. African J. Biotechnol. 3(8): 426–431. 2004. https://doi.org/10.5897/AJB2004.000-2081
Будрицкий А.М., Ивкин Д.Ю., Оковитый С.В., Ивкина А.С., Суханов Д.С., Дзюба А.С. Составление обзоров по доклиническим исследованиям лекарственных средств на примере висмута субсалицилата. Вестник ВГМУ. 18(3): 16–31. 2019. [Budritsky A.M., Ivkin D.Y., Okovitiy S. V., Ivkina A.S., Sukhanov D.S., Dziuba A.S. Drawing up reviews on preclinical trials of medicines on the example of bismuth subsalicylate. Vestnik VGMU. 18(3): 16–31. 2019. (In Russ)]. https://doi.org/10.22263/2312-4156.2019.3.16
Lewis A.J., Cottney J., Sugrue M.F. The spontaneously contracting pregnant rat uterus as a model for anti-inflammatory drug activity. J. Pharmacy and Pharmacol. 27(5): 375–376. 1975. https://doi.org/10.1111/j.2042-7158.1975.tb09461.x
Ignatyev I., Kondratenko Y., Fundamensky V., Kochina T. Synthesis and characterization of cobalt (II) complexes with triethanolamine and succinate and/or nitrate anions. Transition Metal Chem. 43(2): 127–136. 2018. https://doi.org/10.1007/s11243-017-0199-8
Jiang Q.Y., Zhang Y.Z., Lei D.W., Zhong G.Q. Synthesis and application research situation of aspirin complexes. Chem. Intermediates.8: 26–30. 2007.
Yun Y., Chen P., Zheng C.L., Yang Y., Duan W.G., Wang L., He B., Ma J.Q., Wang D.H., Shen Z.Q. Copper-aspirin complex inhibits cyclooxygenase-2 more selectively than aspirin. Yakugaku Zasshi. 127(11): 1869–1875. 2007. https://doi.org/10.1248/yakushi.127.1869
Chohan Z.H., Iqbal M.S., Iqbal H.S., Scozzafava A., Supuran C.T. Transition metal acetylsalicylates and their anti-inflammatory activity. J. Enzyme Inhibition and Med. Chemi. 17(2): 87–91. 2002. https://doi.org/10.1080/14756360290030734
Mohamed F.A., Aly S.A., Abdel-Rahman H.M. Pharmacokinetics and pharmacodynamics evaluation of prepared zinc aspirin suppositories. Bull. Pharm. Sci. 26(2): 187–199. 2003. https://doi.org/10.21608/BFSA.2003.65483
Xue S., Chen S., Wang M., Chen J. Antipyretic and analgesic effects of zinc acetylsalicylate. J. Shenyang Pharmac. Univer. 12(2): 133. 1995.
Korenyuk I.I., Husainov D.R., Shulgin V.F. Effects of Salicylic Acid and Its Salts on Electrical Activity of Neurons of Helix albescens. Neurophysiology. 37: 127–134. 2005. https://doi.org/10.1007/s11062-005-0054-y
Korenyuk I.I., Khusainov D.R., Shulgin V.F. Cobalt and Zinc Salicylates as Functional Analogs of an Initiating Factor in the Molluscan Nervous System. Neurophysiology. 38(1): 9–14. 2006. https://doi.org/10.1007/s11062-006-0020-3
Черетаев И.В., Коренюк И.И., Хусаинов Д.Р. Анализ АТФ-зависимых и кальциевых механизмов в реализации нейротропного действия аспирина и его производных. Успехи совр. естествознания. 4: 64–69. 2013. [Cheretaev I.V., Korenyuk I.I., Husainov D.R. Analysis of ATP dependent and calcium mechanisms in implementation neurotropic action of aspirin and its derivatives. Uspehi Sovr. Estestvoznanija. 4: 64–69. 2013. (In Russ)].
Yakovchyuk T.V., Katiushyna O.V., Koreniuk I.I., Khusainov D.R., Gamma T.V. Psychotropic effects of aspirin, acetylsalicylate cobalt and acetylsalicylate zinc at various doses. Health. 4(11): 1041–1045. 2012. https://doi.org/10.4236/health.2012.411159
Cheretaev I.V., Korenyuk I.I., Khusainov D.R. ATP-Dependent and Calcium Mechanisms of the Effects of Salicylates on Electrical Potentials in Neurons in the Mollusk Helix Albescens. Neurosci. Behav. Physiol. 46(6): 644–651. 2016. https://doi.org/10.1007/s11055-016-0291-0
Чуян Е.Н., Миронюк И.С., Раваева М.Ю., Черетаев И.В., Гришина Т.В. Показатели кардиореспираторной системы крыс при действии ацетилсалициловой кислоты и ее комплексных соединений с металлами. Ученые записки Крымского федер. универ. им. В.И. Вернадского. Биология. Химия. 6(2): 267–280. 2020. [Chuyan E.N., Mironyuk I.S., Ravaeva M.Yu., Cheretaev I.V., Grishina T.V. Indicators of the rat cardiorespiratory system under the action of acetylsalicylic acid and its complex compounds with metals. Scient. notes of the Crimean Feder. Univer. after V.I. Vernadsky. Biology. Chemistry. 6(2): 267–280. 2020. (In Russ)]. https://doi.org/10.37279/2413-1725-2020-6-2-267-280
Wu R., Lamontagne D., Champlain J. Antioxidative properties of acetylsalicylic acid on vascular tissues from normotensive and spontaneously hypertensive rats. Circulation. 105(3): 387–392. 2002. https://doi.org/10.1161/hc0302.102609
ISIS-2 (Second International Study of Infarct Survival) Collaborative Group: Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. Lancet. 2(8607): 349–360. 1988.
Остроумова О.Д. Ацетилсалициловая кислота – препарат номер один для лечения сердечно–сосудистых заболеваний: основные показания к применению, клинические преимущества, эффективные дозы и пути повышения переносимости. Рус. мед. журн. 11(5): 275–281. 2003. [Ostroumova O.D. Acetylsalicylic acid-the number one drug for the treatment of cardiovascular diseases: the main indications for use, clinical benefits, effective doses and ways to increase tolerability. Russ. Med. J. 11(5): 275–281. 2003. (In Russ.)].
Antithrombotic Trialists (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 373(9678): 1849–1860. 2009. https://doi.org/10.1016/S0140-6736(09)60503-1
Jonathan H.C., Ashish K.K., Shravan K., Yamane D., Levine A., Jackson A.M., McCurdy M., Tabatabai A., Kumar G., Park P., Benjenk I., Menaker J., Ahmed N., Glidewell E., Presutto E., Cain S., Haridasa N., Field W., Fowler J.G., Trinh D., Johnson K.N., Kaur A., Lee A., Sebastian K.M., Ulrich A., Peña S., Carpenter R., Sudhakar S., Uppal P., Fedeles B.T., Sachs A., Dahbour L., Teeter W., Tanaka K., Galvagno S.M., Herr D.L., Scalea T.M., Mazzeffi M.A. Aspirin Use is Associated with Decreased Mechanical Ventilation, ICU Admission, and In Hospital Mortality in Hospitalized Patients with COVID-19. Anesthesia & Analgesia. J. Publ. Ahead of Print. 1–41. 2020. https://doi.org/10.1213/ANE.0000000000005292
Schrör K. Acetylsalicylic acid. Second Edition. John Wiley & Sons. 459. 2016.
Klabunde R. Cardiovascular physiology concept. Lippincott Williams & Wilkins. 243. 2011.
Hybiak J., Broniarek I., Kiryczyński G., Los L.D., Rosik J., Machaj F., Sławiński H., Jankowska K., Urasińska E. Aspirin and its pleiotropic application. Eur. J. Pharmacol. 866: 172–762. 2020. https://doi.org/10.1016/j.ejphar.2019.172762
Dudzinski D.M., Serhan C.N., Golan D.E., Armstrong E.J., Galanter J.M. Pharmacology of eicosanoids. Principles of pharmacology: the pathophysiologic basis of drug therapy. Philadelphia. Lippincott Williams & Wilkins. 627–646. 2004.
Hirashima Y., Nakamura S., Endo S., Kuwayama N., Naruse Y., Takaku A. Elevation of platelet activating factor, inflammatory cytokines, and coagulation factors in the internal jugular vein of patients with subarachnoid hemorrhage. Neurochem. Res. 22(10): 1249–1255. 1997. https://doi.org/10.1023/a:1021985030331
Nomura S., Kagawa H., Ozaki Y., Nagahama M., Yoshimura C., Fukuhara S. Relationship between platelet activation and cytokines in systemic inflammatory response syndrome patients with hematological malignancies. Thrombosis Res. 95(5): 205–213. 1999. https://doi.org/10.1016/s0049-3848(99)00024-9
Nguyen T.C., Liu A., Liu Li., Ball C., Choi H., May W.S., Aboulfatova K., Bergeron A.L., Dong J.F. Acquired ADAMTS-13 deficiency in pediatric patients with severe sepsis. Haematologica. 92 (1): 121–124. 2007. https://doi.org/10.3324/haematol.10262
Cao W.J., Niiya M., Zheng X.W., Shang D.Z., Zheng X.L. Inflammatory cytokines inhibit ADAMTS-13 synthesis in hepatic stellate cells and endothelial cells. J. Thromb. Haemost. 6(7): 1233–1235. 2008. https://doi.org/10.1111/j.1538-7836.2008.02989.x
Bernando A., Ball C., Nolasco L., Moake J., Dong J. Effect of inflammatory cytokines on the release and cleavage of the endothelial cell-derived ultra large von Willebrand factor multimers under flow. Blood. 104(1): 100–106. 2004. https://doi.org/10.1182/blood-2004-01-0107
Owen C.A., Campbell M.A., Boukedes S.S., Campbell E.G. Inducible binding of bioactive cathepsin G to the cell surface of neutrophils. J. Immunol. 155(12): 5803–5810. 1995.
Gori A.M., Cesari F., Marcucci R., Giusti B., Paniccia R., Antonucci E., Gensini G.F., Abbate R. The balance between pro- and anti-inflammatory cytokines is associated with platelet agreeability in acute coronary syndrome patients. Atherosclerosis. 202(1): 255–262. 2009. https://doi.org/10.1016/j.atherosclerosis.2008.04.001
Кузник Б.И. Цитокины и система гемостаза I. Цитокины и сосудисто-тромбоцитарный гемостаз. Тромбоз, гемостаз и реология. 2: 12–23. 2012. [Kuznik B.I. Cytokines and haemostasis and vascular platelet haemostasis. Thrombosis, hemostasis and rheology. 2: 12–23. 2012. (In Russ)].
Solheim S., Pettersen A.A., Arnesen H., Seljeflot I. No difference in the effects of clopidogrel and aspirin on inflammatory markers in patients with coronary heart disease. Thromb. Haemost. 96(5): 660–664. 2006.
Генадинник А.Г., Нелаева А.А. Влияние аспирина на тромбоцитарное звено гемостаза у пациентов с метаболическим синдромом. Сахарный диабет. (4): 32–34. 2005. [Genadinnik A.G., Nelaeva A.A. Effect of aspirin on platelet hemostasis in patients with metabolic syndrome. Diabetes. (4): 32–34. 2005. (In Russ)]. https://doi.org/10.14341/2072-0351-5963
Sternberg Z., Chichelli T., Sternberg D., Sawyer R., Ching M., Janicke D., Ambrus J.L., Yu J., Munschauer F. Relationship between inflammation and aspirin and clopidogrel antiplatelet responses in acute ischemic stroke. J. Stroke Cerebrovasc. Diseases. 25(2): 327–334. 2016. https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.10.001
Рождественский Д.А. Клиническая фармакология омега-3 полиненасыщенных жирных кислот. Междунар. обзоры: клин. практика и здоровье. 4: 121–134. 2014. [Rozhdestvensky D.A. Clinical pharmacology of omega-3 polyunsaturated fatty acids. Internat. Rev.: Clinical Practice and Health. 4: 121–134. 2014. (In Russ)].
Serhan C.N., Hong S., Gronert K., Colgan S.P., Devchand P.R., Mirick G., Moussignac R.L. Resolvins: a family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals. J. Exp. Med. 196(8): 1025–1037. 2002. https://doi.org/10.1084/jem.20020760
Arita M., Bianchini F., Aliberti J., Sher A., Chiang N., Hong S., Yang R., Petasis N.A., Serhan C.N. Stereochemical assignment, antiinflammatory properties, and receptor for the omega-3 lipid mediator resolving. J. Exp. Med. 201(5): 713–722. 2005. https://doi.org/10.1084/jem.20042031
Schwab J.M., Chiang N., Arita M., Serhan C.N. Resolvin E1 and protectin D1 activate inflammation resolution programmes. Nature. 447(7146): 869–874. 2007. https://doi.org/10.1038/nature05877
Arita M., Ohira T., Sun Y.P., Elangovan S., Chiang N., Serhan C.N. Resolvin E1selectively interacts with leukotriene B4 receptor BLT1 and ChemR23 to regulate inflammation. J. Immunol. 178(6): 3912–3917. 2007. https://doi.org/10.4049/jimmunol.178.6.3912
Fredman G., Serhan C.N. Specialized proresolving mediator targets for RvE1 and RvD1 in peripheral blood and mechanisms of resolution. Biochemistry. 437(2): 185–197. 2011. https://doi.org/10.1042/BJ20110327
Tjonahen E., Oh S.F., Siegelman J., Elangovan S., Percarpio K.B., Hong S., Arita M., Serhan C.N. Resolvin E2: identification and anti-inflammatory actions: pivotal role of human 5-lipoxygenase in resolvin E series biosynthesis. J. Chem. Biol. 13(11): 1193–1202. 2006. https://doi.org/10.1016/j.chembiol.2006.09.011
Cherhan C.N. Novel lipid mediators and resolution mechanism in acute inflammation. Am. J. Pathol. 177: 1576–1591. 2010. https://doi.org/10.2353/ajpath.2010.100322
Куликов В.А., Гребенников И.Н. Резольвины, протектины и марезины– новые медиаторы воспаления. Вестник ВГМУ. 11(1): 25–30. 2012. [Kulikov V.A., Grebennikov I.N. Resolvins, protectins and maresins-new inflammatory mediators. Bull. VSMU. 11(1): 25–30. 2012. (In Russ)].
Сорокин А.В., Лазаренко В.А., Прибылов С.А. Омега-3 полиненасыщенные жирные кислоты и аспирин как источники нового класса биологически активных веществ: теория и практика. Курский научно-практ. вестник “Человек и его здоровье”. 3: 114–122. 2013. [Sorokin A.V., Lazarenko V.A., Pribylov S.A. Omega-3 polyunsaturated fatty acids and aspirin as sources of a new class of biologically active substances: theory and practice. Kursk. Scient. and Pract. Bull. “Man and his health”. 3: 114–122. 2013. (In Russ)].
Merched A.J., Ko K., Gotlinger K.H., Serhan C.N., Chan L. Atherosclerosis: evidence for impairment of resolution of vascular inflammation governed by specific lipid mediators. FASEB. 22(10): 3595–3606. 2008. https://doi.org/10.1096/fj.08-112201
Patrono C., Coller B., Dalen J.E., Hirsh J., Roth G. Platelet-active drugs: the relationships among dose, effectiveness, and side effects. Chest. 119(1): 39–63. 2001. https://doi.org/10.1378/chest.119.1_suppl.39s
Clarke R.J., Mayo G., Price P., FitzGerald G.A. Suppression of thromboxane A2 but not systemic prostacyclin by controlled-release aspirin. N. Engl. J. Med. 325: 1137–1141. 1991. https://doi.org/10.1056/NEJM199110173251605
Mc Adam B.F., Catella–Lawson F., Mardini I.A., Kapoor S., Lawson J.A., FitzGerald G.A. Systemic biosynthesis of prostacyclin by cyclooxygenase-2: the human pharmacology of a selective inhibitor of cyclooxygenase-2. Proc. Natl. Acad. Sci. USA. 96(10): 272–277. 1999. https://doi.org/10.1073/pnas.96.1.272
Nagelschmitz J., Blunck M., Kraetzschmar J., Ludwig M., Wensing G., Hohlfeld T. Pharmacokinetics and pharmacodynamics of acetylsalicylic acid after intravenous and oral administration to healthy volunteers. Clin. Pharmacol. Advances and Applications. 6: 51–59. 2014. https://doi.org/10.2147/CPAA.S47895
Fiore L.D. Brophy M.T., Lopez A., Janson P., Deykin D. The bleeding time response to aspirin: identifying the hyperresponder. Am. J. Clin. Pathol. 94(3): 292–296. 1990. https://doi.org/10.1093/ajcp/94.3.292
Bhatt D.L., Topol E.J. Scientific and Therapeutic Advances in Antiplatelet Therapy. Nature Rev. Drug Discovery. 2: 15–28. 2003. https://doi.org/10.1038/nrd985
Alexander J.H., Harrington J.H., Harrington R.A., Tuttle R.H., Berdan L.G., Lincoff A.M., Deckers J.W., Simoons M.L., Guerci A., Hochman J.S., Wilcox R.G., Kitt M.M., Eisenberg P.R., Califf R.M., Topol E.J., Karsh K., Ruzyllo W., Stepinska J., Widimsky P., Boland J.B., Armstrong P.W. Prior aspirin use predicts worse outcomes in patients with non-ST-elevation acute coronary syndromes. PURSUIT Investigators. Platelet IIb/IIIa in Unstable angina: Receptor Suppression Using Integrilin Therapy. Am. J. Cardiol. 83(8): 1147–1151. 1999. https://doi.org/10.1016/s0002-9149(99)00049-1
Gum P.A., Kottke-Marchant K., Poggio E.D., Gurm H., Welsh P.A., Brooks L., Sapp S.K., Topol E.J. Profile and prevalence of aspirin resistance in patients with cardiovascular disease. Am. J. Cardiol. 88(3): 230–235. 2001. https://doi.org/10.1016/s0002-9149(01)01631-9
Moshfegh K., Redondo M., Julmy F., Wuillemin W.A., Gebauer M.U., Haeberli A., Meyer B.J. Antiplatelet effects of clopidogrel compared with aspirin after myocardial infarction: enhanced inhibitory effects of combination therapy. J. Am. Coll. Cardiol. 36: 699–705. 2000. https://doi.org/10.1016/s0735-1097(00)00817-2
Yusuf S., Zhao F., Mehta S.R., Chrolavicius S., Tognoni G., Fox K.K. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N. Engl. J. Med. 345(7): 494–502. 2001. https://doi.org/10.1056/NEJMoa010746
Steinhubl S.R., Berger P.B., Mann J.T., Fry E.T., DeLago A., Wilmer C., Topol E.J., CREDO Investigators. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 288(19): 2411–2420. 2002. https://doi.org/10.1001/jama.288.19.2411
Кулаков В.В., Хохлунов С.М. Двойная антитромбоцитарная терапия: современные представления по назначению, прерыванию и возобновлению. Изв. Самарск. научн. центра Рос. акад. наук. 17(2): 331–336. 2015. [Kulakov V.V., Khokhlunov S.M. Double antiplatelet therapy: current views on prescription, interruption and resumption. Proc. Samara Scient. Center of the Rus. Acad. Sci. 17(2): 331–336. 2015. (In Russ)].
Valgimigli M., Bueno H., Byrne R.A., Collet J.P., Costa F., Jeppsson A., Jüni P., Kastrati A., Kolh P., Mauri L., Montalescot G., Neumann F.J., Petricevic M., Roffi M., Steg P.G., Windecker S., Zamorano J.L., Levine G.N., ESC Scientific Document Group, ESC Committee for Practice Guidelines (CPG), ESC National Cardiac Societies. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur. Heart J. 39(3): 213–254. 2018. https://doi.org/10.1093/eurheartj/ehx419
Iacoviello L., Curtis A., D’Adamo M.C. Prostacyclin is required for t-PA release after venous occlusion. Am. J. Physiol. Heart and Circul. Physiol. 266(2): 429–434. 1994. https://doi.org/10.1152/ajpheart.1994.266.2.H429
De La Cruz J.P., Guerrero A., Gonzalez-Correa J.A., Arrebola M.M., de la Cuesta S.F. Antioxidant Effect of Acetylsalicylic and Salicylic Acid in Rat Brain Slices Subjected to Hypoxia. J. Neurosci. Res. 75(2): 280–290. 2004. https://doi.org/10.1002/jnr.10851
Korkmaz S., Atmanli A., Li S., Radovits T., Hegedűs P., Barnucz E., Hirschberg K., Loganathan S., Yoshikawa Y., Yasui H., Karck M., Szabó G. Superiority of zinc complex of acetylsalicylic acid to acetylsalicylic acid in preventing postischemic myocardial dysfunction. Exp. Biol. Med. (Maywood). 240(9): 1247–1255. 2015. https://doi.org/10.1177/1535370215570184
Sea K., Sohn S.H., Durazo A., Sheng Y., Shaw B.F., Cao X., Taylor A.B., Whitson L.J., Holloway S.P., Hart P.J., Cabelli D.E., Gralla E.B., Valentine J.S. Insights into the role of the unusual disulfide bond in copper-zinc superoxide dismutase. J. Biol. Chemi. 290(4): 2405–2418. 2015. https://doi.org/10.1074/jbc.M114.588798
De Boer M.W., Le Blanc S.J., Dubuc J., Meier S, Heuwieser W, Arlt S, Gilbert R.O., McDougall S. Invited review: Systematic review of diagnostic tests for reproductive-tract infection and inflammation in dairy cows. J. Dairy Sci. 97(7): 3983–3999. 2014. https://doi.org/10.3168/jds.2013-7450
Christianson D.W. Structural chemistry and biology of manganese metalloenzymes. Progress Biophys. Mol. Biol. 67(2–3): 217–252. 1997. https://doi.org/10.1016/s0079-6107(97)88477-5
Lindskog S. Cobalt (II) in metalloenzymes. A reporter of structure-function relations. Biochemistry. Berlin, Heidelberg. Springer. 153–196. 1970.
Mc Call K.A., Huang C., Fierke C.A. Function and mechanism of zinc metalloenzymes. J. Nutrition. 130(5S): 1437–1446. 2000. https://doi.org/10.1093/jn/130.5.1437S
Foye W.O., Baum M.D., Williams D.A. Stability of metal complexes of salicylic acid derivatives and analogs III. 3, 6-dialkyl derivatives and pyridine analogs. J. Pharm. Sci. 56(3): 332–336. 1967.
Grisolia S., Mendelson J., Diederich D. Inactivation of metalloenzymes by salicylate. FEBS Letters. 11(2): 140–143.1970. https://doi.org/10.1016/0014-5793(70)80512-9
Belhassena I., Nouari W., Messaoud A., Nouar M., Brahimi M., Lamara S.C., Aribi M. Aspirin enhances regulatory functional activities of monocytes and downregulates CD16 and CD40 expression in myocardial infarction autoinflammatory disease. Internat. Immunopharmacol. 83: 106349. 2020. https://doi.org/10.1016/j.intimp.2020.106349
De Meersman R.E., Zion A.S., Lieberman J.S., Downey J.S. Acetylsalicylic acid and autonomic modulation. Clin. Autonomic Res. 10(4): 197–201. 2000. https://doi.org/10.1007/BF02291356
Siepmann M., Rauh R., Spanos E., Dill O., Mueck H., Mueck-Weymann M. The effects of acetylic salicylic acid on heart rate variability in healthy subjects. Clin. Autonomic Res. 17(2): 115–117. 2007. https://doi.org/10.1007/s10286-007-0408-1
Furuno T., Yamasaki F., Yokoyama T., Sato K., Sato T., Doi Y., Sugiura T. Effects of various doses of aspirin on platelet activity and endothelial function. Heart and Vessels. 26(3): 267–273. 2011. https://doi.org/10.1007/s00380-010-0054-8
Yasumasu T., Takahara K., Otsuji Y. Low-dose Aspirin Inhibits Cardiac Sympathetic Activation and Vagal Withdrawal Response to Morning Rising. J. Cardiovasc. Pharmacol. 70(4): 239–244. 2017. https://doi.org/10.1097/FJC.0000000000000509
Ravaeva M.Yu., Chuyan E.N., Cheretaev I.V. Coordinating metal Co2+ and Zn2+ compounds with acetylsalicylic acid: the influence on the cardiorespiratory system. IOP Conference Series: Materials Science and Engineering. 889(1): 012030. 2020. https://doi.org/10.1088/1757-899X/889/1/012030
Korkmaz-Icöz S., Atmanli A., Radovits T., Li S., Hegedüs P., Ruppert M., Brlecic P., Yoshikawa Y., Yasui H., Karck M., Szabó G. Administration of zinc complex of acetylsalicylic acid after the onset of myocardial injury protects the heart by upregulation of antioxidant enzymes. J. Physiol. Sci. 66(2): 113–125. 2016. https://doi.org/10.1007/s12576-015-0403-6
Böger R.H., Bode-Böger S.M., Kramme P., Tsikas D., Gutzki F.M., Frölich J.C. Effect of captopril on prostacyclin and nitric oxide formation in healthy human subjects: interaction with low dose acetylsalicylic acid. Br. J. Clin. Pharmacol. 42(6): 721–727. 1996. https://doi.org/10.1046/j.1365-2125.1996.00480.x
Hermida R.C., Fernández J.R., Ayala D.E., Mojón A., Iglesias M. Influence of aspirin usage on blood pressure: dose and administration-time dependencies. Chronobiol. Internat. 14(6): 619–637. 1997. https://doi.org/10.3109/07420529709001452
Сонин Д.Л., Дементьева Д.Л., Чефу С.Г. Влияние препарата Нотромбел на системную гемодинамику и толерантность к тромбину в эксперименте. Регионарн. кровообращение и микроциркуляция. 16(4): 65–72. 2017. [Sonin D.L., Dementieva D.L., Chefu S.G. Effect of the drug Notrombel on systemic hemodynamics and thrombin tolerance in the experiment. Regional Blood Circulation and Microcirculation. 16(4): 65–72. 2017. (In Russ)]. https://doi.org/10.24884/1682-6655-2017-16-4-65-72
Leithäuser B., Mrowietz C., Park J.W., Jung F. Influence of acetylsalicylic acid (Aspirin) on cutaneous microcirculation. Clin. Hemorheol. Microcirculat. 50(1–2): 25–34. 2012. https://doi.org/10.3233/CH-2011-1440
Buchanec J., Visnovský P., Buchancová J., Cervenáková E. The effect of acetylsalicylic acid on some parameters of peripheral circulation in children (author’s transl). Klin. Pediatrie. 191(3): 301–304. 1979.
Dahmus J.D., Bruning R.S., Larry K.W., Alexander L.M. Oral clopidogrel improves cutaneous microvascular function through EDHF-dependent mechanisms in middle-aged humans. Am. J. Physiol. Regulatory, Integrative and Compar. Physiol. 305(4): 452–458. 2013. https://doi.org/10.1152/ajpregu.00366.2012
Holowatz L.A., Jennings J.D., Lang J.A., Kenney W.L. Systemic low-dose aspirin and clopidogrel independently attenuate reflex cutaneous vasodilation in middle-aged humans. J. Appl. Physiol. 108(6): 1575–1581. 2010. https://doi.org/10.1152/japplphysiol.01362.2009
Bulckaen H., Prévost G., Boulanger E., Robitaille G., Roquet V., Gaxatte C., Garçon G., Corman B., Gosset P., Shirali P., Creusy C., Puisieux F. Low-dose aspirin prevents age-related endothelial dysfunction in a mouse model of physiological aging. Am. J. Physiol. Heart Circ. Physiol. 294(4): H1562–H1570. 2008. https://doi.org/10.1152/ajpheart.00241.2007
Mikhailichenko L.A., Tikhomirova I.A. Parameters of microcirculation in paired formations after single aspirin administration: laser Doppler flowmetry data. Bull. Exp. Biol. Med. 151(1): 16–21. 2011. https://doi.org/10.1007/s10517-011-1249-4
Раваева М.Ю., Чуян Е.Н., Миронюк И.С., Черетаев И.В., Гришина Т.В. Показатели тканевой микрогемодинамики крыс при действии ацетилсалициловой кислоты и ее комплексных соединений с металлами. Журн. эвол. биох. физиол. 57(1): 71–82. 2021. [Ravaeva M.Yu., Chuyan E.N., Mironyuk I.S., Cheretaev I.V., Grishina T.V. Indicators of tissue microhemodynamics in rats exposed to acetylsalicylic acid and metal salicylates. J. Evol. Biohim. Phys. 57(1): 71–82. 2021. (In Russ)]. https://doi.org/10.31857/S0044452921010083
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


