Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 3, стр. 352-373
Влияние малых доз L-тироксина на устойчивость к стрессу животных с экспериметально вызванным дефицитом симпатических нервных влияний
Е. А. Гусакова 1, *, И. В. Городецкая 1
1 Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: elena-gusakova83@mail.ru
Поступила в редакцию 30.10.2020
После доработки 11.01.2021
Принята к публикации 17.01.2021
Аннотация
Умеренное повышение уровня катехоламинов оказывает адаптивный эффект при стрессе. Доказана и роль тиреоидной оси в адаптации к стрессу. Однако остается неясным, является ли защитное действие йодсодержащих тиреоидных гормонов (ЙТГ) при стрессе опосредованным катехоламинами или прямым. Цель работы – исследовать выраженность антистрессорного эффекта малых доз L-тироксина у животных с вызванным в эксперименте дефицитом симпатических нервных влияний. Работа выполнена на 270 белых беспородных крысах-самцах массой 220–240 г. Стресс моделировали по методике “дефицита времени”. L-тироксин вводили в малых, близких к физиологическим, дозах (внутрижелудочно от 1.5 до 3 мкг/кг в течение 28 дней). Гуанетидин вводили внутрибрюшинно (30 мг/кг в течение 28 дней). Интенсивность стресс-реакции исследовали по изменениям: 1) относительной массы надпочечников, тимуса и селезенки; 2) уровня кортикостерона и инсулина в крови, величины кортикостерон-инсулинового коэффициента; 3) состояния слизистой оболочки желудка. Двигательную активность крыс оценивали в тесте “открытое поле”. Физическую выносливость животных изучали по времени их нахождения на вращающемся валике. Полученные результаты обработаны непараметрическими методами с использованием программы Statistica 10.0 (StatSoftinc., STA999K347156-W). Химическая десимпатизация предупреждает стимуляцию тиреоидной функции при стрессе и, вместе с тем, определяет бóльшее снижение устойчивости организма в этих условиях. Сочетанное введение L-тироксина и гуанетидина оказывает защитное действие при стрессе, как это имеет место и у крыс с интактной нервной системой. Однако по сравнению с ними данный эффект выражен в меньшей степени, это указывает на то, что катехоламины играют роль в его реализации, но определяющее значение имеют ЙТГ. Таким образом, защитный эффект L-тироксина в малых дозах при стрессе частично опосредован катехоламинами, но в бóльшей степени – самими ЙТГ.
Известно значение активации симпатоадреналовой системы в формировании стресс-реакции [1]. Долговременное повышение уровня катехоламинов оказывает значительный повреждающий эффект [2] за счет активации перекисного окисления липидов [3] и снижения активности антиоксидантной системы [4], нарушения динамического равновесия в системе протеолитические ферменты и их ингибиторы [5], ухудшения митохондриального дыхания [6], дисбаланса механизмов гуморального [7] и клеточного [8] иммунитета. Однако умеренные количества катехоламинов оказывают адаптивный эффект, поскольку: 1) повышают уровень глюкозы в крови (непосредственно – за счет стимуляции гликогенолиза и глюконеогенеза [9] и опосредованно – через усиление секреции глюкагона α-клетками [10] и ингибирования секреции инсулина β-клетками [11] островков Лангерганса поджелудочной железы). Это 1) обеспечивает процессы адаптации легкодоступным источником энергии; 2) стимулируют гликолиз [12], а гликолитический механизм синтеза АТФ более устойчив [13], чем окислительное фосфорилирование, что позволяет клеткам поддерживать функции, требующие значительных энергетических затрат в условиях стресса; 3) активируют липолиз [14], что приводит к увеличению уровня свободных жирных кислот в плазме, которые используются мышцами в качестве источника энергии; 4) увеличивают концентрацию ионов кальция в миокарде [15], которые оказывают стабилизирующее действие на белки и липиды мембраны, активируют фосфолипазы; 5) стимулируют функцию сердца, оказывая положительные ино-, батмо-, дромо- и хромотропные эффекты [16, 17].
Установлено и значение тиреоидной оси в стресс-реакции: введение малых доз тироксина оказывает стресс-протекторное действие, связанное со стимуляцией локальных стресс-лимитирующих систем – адениннуклеотидов [18], простагландинов [19], белков теплового шока [20], антиоксидантных ферментов [21]. Йодсодержащие тиреоидные гормоны (ЙТГ) повышают активность ингибиторов протеиназ в крови и печени [22], экспрессию ранних генов c-fos и c-jun в миокарде [23]. Защитное действие ЙТГ было установлено, в том числе, и при стрессе “дефицита времени” [24]. Однако до сих пор остается неисследованным, участвуют ли катехоламины в осуществлении стресс-протекторного действия ЙТГ или главенствующее значение имеют сами ЙТГ.
Цель исследования: выяснить выраженность антистрессорного эффекта малых доз L-тироксина у животных с вызванным в эксперименте дефицитом симпатических нервных влияний.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 270 белых половозрелых беспородных крысах-самцах. В опыт брали 3-месячных животных, масса тела которых составляла 220–240 г. Эксперименты проводили в одно и то же время суток с соблюдением требований гуманного обращения с экспериментальными животными, изложенных в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе учреждения образования “Витебский государственный ордена Дружбы народов медицинский университет” и мерах по реализации требований биомедицинской этики”.
Было сформировано 9 групп животных: “Интактные”, “Контроль”, “Стресс”, “Тироксин”, “Тироксин + стресс”, “Десимпатизация”, “Десимпатизация + стресс”, “Тироксин + десимпатизация”, “Тироксин + десимпатизация + стресс”.
Для воспроизведения эмоционального стресса использовали моделирование ситуации “дефицита времени” [24]. Для этого крыс помещали в нижнюю часть спиралевидного тоннеля, который быстро заполняли холодной водой. Животное, стремясь избежать контакта с ней, вынуждено было быстро перемещаться вверх по установке и не могло избежать ситуации, в которой оказалось. Крыс тестировали по одной особи, после окончания теста помещали в индивидуальные клетки.
L-тироксин (Berlin-Chemie AG, Менарини Групп, Германия) вводили в малых, близких к физиологическим дозах, внутрижелудочно в 1%-ном крахмальном клейстере, еженедельно наращивая дозу от 1.5 до 3 мкг/кг в течение 28 дней.
Для моделирования дефицита симпатических нервных влияний использовали химическую десимпатизацию с помощью введения гуанетидина, который оказывает периферическое действие, подавляя выделение норадреналина в адренергических синапсах путем экзоцитоза, не влияя при этом на входящий ток ионов кальция через потенциал-зависимые Са2+-каналы пресинаптической мембраны [25]. Гуанетидин (Guanethidine monosulfate, Sigma) вводили внутрибрюшинно в физиологическом растворе в дозе 30 мг/кг массы в течение 28 дней. Стресс в группах животных, получавших указанные препараты, воспроизводили на следующие сутки после окончания их введения. Всем крысам за исключением интактных, внутрижелудочно вводили 1%-ный крахмальный клейстер в течение 28 дней.
Забой животных осуществляли под уретановым наркозом (внутрибрюшинно 1 г/кг) через 1 ч после стресса (группы “Стресс”, “Тироксин + стресс”, “Десимпатизация + стресс”, “Тироксин + десимпатизация + стресс”) или на следующие сутки после окончания введения крахмального клейстера (группа “Контроль”) или препаратов (группы “Тироксин”, “Десимпатизация”).
Интенсивность общего адаптационного синдрома исследовали по изменениям: 1) относительной массы надпочечников, тимуса и селезенки (отношение их абсолютной массы к массе тела); 2) уровня кортикостерона и инсулина в крови (иммуноферментным методом, используя наборы Rat corticosterone (ELISA kit, Shanghai, Китай) и Insulin Тest System (Monobind Inc. Accu-Bind, California, США) и величины кортикостерон-инсулинового (К/И) коэффициента, который рассчитывали по соотношению медиан концентраций указанных гормонов в каждой группе: чем он выше, тем интенсивнее напряженность компенсаторных механизмов и меньше резервные возможности организма [26]; 3) состояния слизистой оболочки желудка (СОЖ).
Для исследования СОЖ крыс подвергали суточной пищевой депривации при свободном доступе к воде. После извлечения желудок вскрывали вдоль большой кривизны и промывали 0.9%-ным раствором NaCl. В отраженном свете под малым увеличением изучали частоту поражения СОЖ (отношениe числа животных, имевших кровоизлияния в слизистой, к общему количеству крыс в группе, выраженное в %), тяжесть (в баллах: 0 – отсутствие кровоизлияний; 0.5 – гиперемия; 1 – единичные (1 или 2) точечные кровоизлияния; 2 – множественные (более 3) незначительные (площадью около 1 мм2) кровоизлияния; 3 – множественные значительные (площадью более 1 мм2) кровоизлияния; 4 – массивные кровоизлияния, охватывающие практически всю поверхность слизистой) [27, в нашей модификации]. Рассчитывали индекс поражения СОЖ как произведение частоты и средней тяжести поражения (общее число баллов в группе, деленное на количество животных в ней), деленное на 100. Частоту поражения СОЖ исследовали у 30 крыс, тяжесть – у 10, остальные показатели стресс-реакции – у 6 животных, выбранных случайным образом из каждой экспериментальной группы.
Двигательную активность крыс оценивали в затененной комнате с помощью теста “открытое поле” в течение 3 мин. Использовали видеосистему SMART и программное обеспечение SMART 3.0. Для характеристики горизонтальной двигательной активности изучали общую дистанцию перемещения животных, расстояние перемещения на периферии и в центре “открытого поля”, максимальную скорость движения. Вертикальную локомоторную активность, характеризующую также исследовательское поведение, определяли по количеству стоек. Исследовательскую активность оценивали по соотношению продолжительности пребывания и замирания крыс в центральной и периферической зонах, общей длительности замирания, числу входов и латентному периоду входа в центр, параллельному индексу (по изменению угла пути между текущим и предыдущим направлениями движения животного: чем ближе данный параметр к 1, тем больше перемещений по прямой; чем ближе к –1, тем больше изменений в направлении смещений). После проведения теста “открытое поле” с целью оценки физической выносливости животное помещали на валик ротарода (LE 8300), который вращался со скоростью 30–35 оборотов/мин.
Уровень ЙТГ – трийодтиронина (Т3) и тироксина (Т4) (нмоль/л), их свободных фракций (Т3св и Т4св) (пмоль/л), тиреотропного гормона (ТТГ) (мкМЕ/мл) в сыворотке крови определяли иммуноферментным методом. Применяли набoры реактивов ДС-ИФА-Тироид-Т3общий, ДС-ИФА-Тироид-Т4общий, ДС-ИФА-Тироид-Т3свободный, ДС-ИФА-Тироид-Т4свободный, ДС-ИФА-ТИРОИД-ТТГ. Измерение оптической плотности проб проводили на фотометре универсальном Ф 300 ТП (Беларусь).
Статистическую обработку результатов проводили с помощью программы Statistica 10.0 (StatSoftinc., STA999K347156-W). Для проверки соответствия данных закону распределения случайных величин применяли W-критерий Шапиро–Уилка. Полученные нами данные отличались от нормального распределения, поэтому для их статистического анализа использовали непараметрические критерии. При межгрупповом сравнении для анализа различий по количественным параметрам применяли U-критерий Манна–Уитни. Данные по частоте поражения СОЖ, являющиеся качественными бинарными признаками, обрабатывали с использованием модулей “Непараметрические статистики”, “Таблицы 2 × 2” (точный критерий Фишера). Критическим уровнем значимости был принят p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У интактных крыс сывороточный уровень Т3 составил 1.69 (1.39; 1.82) нмоль/л, Т4 – 48.39 (41.96; 52.12) нмоль/л, Т3св – 3.29 (2.99; 3.57) пмоль/л, Т4св – 11.95 (10.25; 14.15) пмоль/л, ТТГ – 0.18 (0.09; 0.23) мкМЕ/мл. Величина относительной массы надпочечников была равна 0.20 (0.16; 0.27) мг/г, тимуса – 2.09 (1.98; 2.31) мг/г, селезенки – 4.10 (3.85; 4.18) мг/г. Содержание кортикостерона в крови составило 3.86 (3.42; 4.16) нг/мл, инсулина – 1.33 (1.16; 1.48) мкМЕ/мл. Поражение СОЖ отсутствовало.
У контрольных животных, которым вводили 1%-ный крахмальный клейстер, все изученные показатели не отличались от таковых у интактных, за исключением незначительного повреждения СОЖ (при этом ни один из параметров, характеризующих состояние СОЖ, достоверно не отличался от их величины у интактных животных). С нашей точки зрения, это связано с самой процедурой введения крахмального клейстера.
Введение гуанетидина снизило сывороточную концентрацию ЙТГ: Т3 на 21%, Т4 на 15%, Т3св на 28%, Т4св на 33%. В ответ на это содержание ТТГ в крови возросло – на 33% (рис. 1).
Рис. 1.
Влияние введения L-тироксина или (и) гуанетидина на изменение сывороточного уровня общего трийодтиронина (А), общего тироксина (В), свободного трийодтиронина (С), свободного тироксина (D) и тиреотропного гормонов (Е) при стрессе. Здесь и на рис. 2, 3 : 1) каждая экспериментальная группа состояла из 6 животных; 2) ◻ – медиана; ◻ – верхняя граница нижнего квартиля и нижняя граница верхнего квартиля (LQ; UQ); $\mathop \top \limits_ - $ – минимальное и максимальное значения показателя; 3) группы животных: С – “Контроль”; S – “Стресс”; Т – “Тироксин”; ТS – “Тироксин + стресс”; D – “Десимпатизация”; DS – “Десимпатизация + стресс”; ТD – “Тироксин + десимпатизация”; ТDS – “Тироксин + десимпатизация + стресс”; 4) р < 0.05 по отношению: * – к группе “Контроль”; # – к группе “Стресс”; + – к группам “Контроль” и “Стресс”; о – к группе “Тироксин”; ^ – к группе “Десимпатизация”; $^{\bigvee }$ – к группе “Тироксин + десимпатизация”; Δ – к группе “Тироксин + стресс”; X – к группе “Десимпатизация + стресс”. Fig. 1. Effect of injection of L-thyroxine or (and) guanetidine on changes in serum levels of total triiodothyronine (A), total thyroxine (B), free triiodothyronine (C), free thyroxine (D) and thyroid stimulating hormones (E) under stress Here and in the figures 2, 3 : 1) each experimental group consisted of 6 animals; 2) ◻ – median; ◻ – lower quartile and upper quartile (LQ; UQ); $\mathop \top \limits_ - $ – minimum and maximum values; 3) groups of animals: С – “Control”; S – “Stress”; T – “Thyroxine”; TS – “Thyroxine + stress”; D – “Desympatisation”; DS – “Desympatisation + stress”; TD – “Thyroxine + desympatisation "; TDS – "Thyroxine + desympatisation + stress” ; 4) p < 0.05 comparison with:* – “Control”; # – “Stress”; + – “Control” and “Stress” ; o – “Thyroxine”; ^ – “Desympatisation”; $^{\bigvee }$ – “Thyroxine + desympatisation”; Δ – “Thyroxine + stress”; X – “Desympatisation + + stress”.
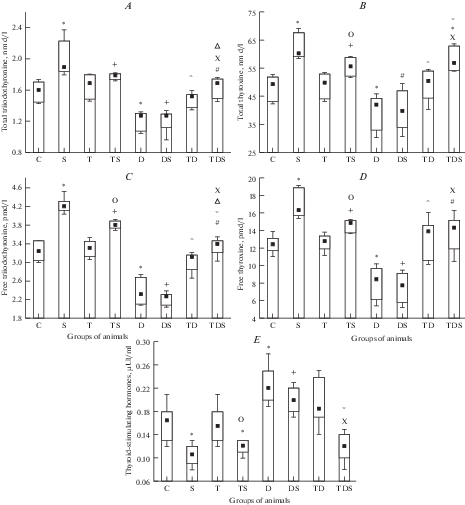
Рис. 2.
Изменения относительной массы надпочечников (А), тимуса (В) и селезенки (С) при стрессе у крыс, получавших гуанетидин и(или) L-тироксин. Обозначения те же, что на рис. 1. Fig. 2 . Changes of relative mass of the adrenal glands (А), thymus (В) and spleen (С) under stress in rats injected with guanethidine and (or) L-thyroxine.The designations are the same as in Fig. 1.
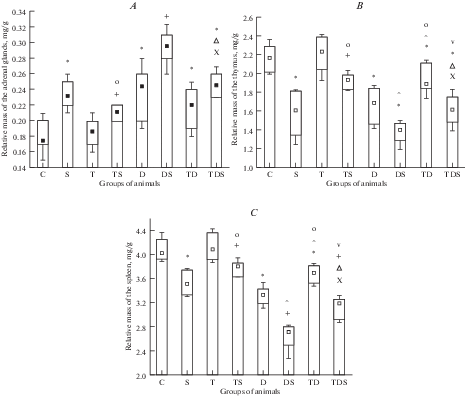
Относительная масса надпочечников у животных, подвергнутых химической десимпатизации, повысилась на 36%, а таковая тимуса и селезенки упала на 22 и 17% (рис. 2 ).
Сывороточная концентрация кортикостерона увеличилась на 49%, инсулина – снизилась на 14% (рис. 3).
Рис. 3.
Влияние десимпатизации на изменения сывороточного содержания кортикостерона (А), инсулина (В) и кортикостерон/инсулинового коэффициента (С) в условиях стресса без и на фоне введения малых доз L-тироксина. Обозначения те же, что на на рис. 1. Fig. 3. Тhe effect of desympatisation of sympathetic nervous influences on the changes of serum corticosterone (А), insulin (В) levels and corticosteroid/insulin coefficient (С) under stress conditions with and without injection of small doses of L-thyroxine. The designations are the same as in Fig. 1.
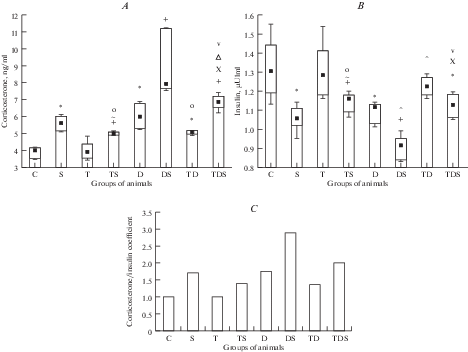
Вследствие описанных изменений содержание кортикостерона и инсулина, а также значение К/И коэффициента возросло в 1.74 раза. Параметры, характеризующие состояние СОЖ, не отличались от таковых в группе “Контроль” (табл. 1).
Таблица 1.
Повреждение СОЖ при стрессе у крыс, подвергнутых химической десимпатизации, без и на фоне введения L-тироксина Table 1. Damage to the gastric mucosa under stress in rats subjected to chemical desympatisation without and with injected of L-thyroxine
| Группы животных Groups of animal |
Частота поражения, % Damage frequency, % (n = 30) |
Тяжесть поражения,
баллы Damage severity, scores (n = 10) |
Индекс поражения Damage index (n = 30) |
|---|---|---|---|
| 1. Контроль Control | 10 | 1 у 10% | 0.01 |
| 2. Cтресс Stress | 80 | 1 у 20%; 2 у 30%; 3 у 30% |
1.36 |
| p 1–2 | p < 0.01 | p < 0.01 | |
| 3. Тироксин Thyroxine | 10 | 1 у 10% | 0.01 |
| p 1–3 | p > 0.05 | p > 0.05 | |
| 4. Тироксин + стресс Thyroxine + stress | 30 | 1 у 20%; 2 у 10% | 0.12 |
| p 3–4 | p > 0.05 | p > 0.05 | |
| p 1–4 | p > 0.05 | p > 0.05 | |
| p 2–4 | p < 0.01 | p < 0.05 | |
| 5. Десимпатизация Desympatisation |
40 | 1 у 20%; 2 у 20% | 0.24 |
| р 1–5 | p > 0.05 | p > 0.05 | |
| 6. Десимпатизация + стресс Desympatisation + stress | 90 | 2 у 50%; 3 у 40% | 1.98 |
| р 5–6 | р < 0.01 | р < 0.01 | |
| р 1–6 | р < 0.01 | р < 0.01 | |
| р 2–6 | p > 0.05 | p > 0.05 | |
| 7. Тироксин + десимпатизация Thyroxine + desympatisation | 30 | 1 у 20%; 2 у 10% | 0.12 |
| р 3–7 | p > 0.05 | p > 0.05 | |
| р 5–7 | p > 0.05 | p > 0.05 | |
| р 1–7 | p > 0.05 | p > 0.05 | |
| 8. Тироксин + десимпатизация + cтресс Thyroxin + desympatisation + stress |
50 | 1 у 10%; 2 у 30%; 3 у 10% |
0.5 |
| р 7–8 | 0.05 < р < 0.1 | p > 0.05 | |
| р 1–8 | р < 0.01 | р < 0.05 | |
| р 4–8 | 0.05 < р < 0.1 | p > 0.05 | |
| р 6–8 | р < 0.01 | р < 0.01 | |
| р 2–8 | p > 0.05 | p > 0.05 |
Здесь и в табл. 2–3: p – обозначение достоверности различий, n – число животных в группе. Here and in the tables 2–3: p – difference between statistical significance, n – number of animals in the group.
Физическая выносливость животных с дефицитом симпатических нервных влияний существенно уменьшилась, в связи с чем время их удержания на вращающемся валике ротарода упало на 53% (табл. 2). Общая дистанция перемещения имела тенденцию к снижению. Общая длительность замирания и параллельный индекс, напротив, имели тенденцию к увеличению (табл. 3). Остальные параметры, характеризующие локомоторную активность и исследовательское поведение животных, не изменялись (табл. 2 и 3).
Таблица 2.
Изменение физической выносливости и двигательной активности животных с дефицитом симпатических нервных влияний после стресса без и на фоне введения малых доз L-тироксина Table 2. Changes in physical endurance and locomotor activity of animals with a deficit of sympathetic nervous influences under stress without and with injection of L-thyroxine in small doses
| Группы животных Groups of animal |
Время удержания на
валике ротарода, c Retention time on the rotating roller of the rotarod, s |
Общая дистанция, м Total distance, m |
Дистанция на периферии, % Distance in the periphery, % |
Дистанция в центре,% Distance in the center, % |
Максимальная скорость
перемещения, см/с Maximum speed, cm/s |
Количество
вертикальных стоек Number of racks |
|---|---|---|---|---|---|---|
| 1. Контроль Control | 8.5 (5.0; 9.0) | 14.18 (12.66; 16.12) | 81.30 (73.19; 86.07) | 18.71 (13.93; 26.81) | 57.62 (45.44; 90.27) | 11.5 (9.00; 14.00) |
| 2. Cтресс Stress | 11.5 (10.0; 14.0) | 18.27 (17.57; 19.53) | 82.11 (72.66; 83.52) | 17.90 (16.48; 27.34) | 95.22 (85.71; 111.1) | 6.5 (5.0; 8.0) |
| p 1–2 | p < 0.01 | p < 0.01 | р > 0.05 | р > 0.05 | 0.05 < р < 0.1 | р < 0.05 |
| 3. Тироксин (Thyroxine) | 10.5 (10.0; 11.0) | 20.66 (20.16; 20.98) | 56.40 (40.11; 64.18) | 43.60 (35.82; 59.89) | 91.85 (65.78; 97.56) | 15.5 (13.0; 19.0) |
| p 1–3 | p < 0.05 | p < 0.01 | р < 0.05 | р < 0.05 | р > 0.05 | р < 0.05 |
| 4. Тироксин + стресс Thyroxine + stress | 11.0 (9.0; 12.0) | 19.74 (18.28; 20.33) | 54.57 (44.08; 55.11) | 45.44 (44.89; 55.92) | 84.58 (56.17; 115.15) | 10.5 (9.0; 14.0) |
| p 3–4 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | 0.05 < р < 0.1 |
| p 1-4 | р < 0.05 | p < 0.05 | p < 0.01 | p < 0.01 | р > 0.05 | р > 0.05 |
| p 2-4 | p > 0.05 | р > 0.05 | р < 0.01 | р < 0.05 | р > 0.05 | р < 0.05 |
| 5. Десимпатизация Desympatisation | 4.0 (3.0; 6.0) | 11.06 (9.30; 13.87) | 83.73 (76.29; 90.63) | 16.27 (9.37; 23.71) | 47.75 (40.33; 63.11) | 9.5 (7.0; 11.0) |
| р 1–5 | p < 0.05 | p < 0.1 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 |
| 6.Десимпатизация + стресс Desympatisation + stress | 2.0 (0.0; 3.0) | 6.02 (5.12; 7.47) | 86.26 (82.11; 90.25) | 13.75 (9.75; 17.89) | 40.79 (30.07; 48.33) | 5.5 (5.0; 7.0) |
| р 5–6 | p > 0.05 | р < 0.01 | р > 0.05 | р > 0.05 | > 0.05 | 0.05 < р < 0.1 |
| р 1–6 | р < 0.01 | р < 0.01 | р > 0.05 | р > 0.05 | р < 0.05 | р < 0.05 |
| р 2–6 | р < 0.01 | p < 0.01 | р > 0.05 | р > 0.05 | p < 0.01 | р > 0.05 |
| 7. Тироксин + десимпатизация Thyroxine + desympatisation | 6.5 (6.0; 8.0) | 15.08 (13.49; 16.22) | 70.63 (65.12; 74.27) | 29.38 (25.73; 34.88) | 61.72 (53.15; 74.29) | 13.5 (10.00; 16.00) |
| р 3–7 | p < 0.01 | p < 0.05 | p < 0.05 | p < 0.05 | p < 0.05 | p > 0.05 |
| р 5–7 | p < 0.05 | p < 0.01 | 0.05 < р < 0.1 | 0.05 < р < 0.1 | p > 0.05 | 0.05 < р < 0.1 |
| р 1–7 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 |
| 8.Тироксин + десимпатизация + cтресс Thyroxine + desympatisation + stress | 7.5 (6.0; 10.0) | 11.79 (10.71; 14.84) | 76.19 (70.18; 82.21) | 23.81 (17.79; 29.82) | 57.20 (48.32; 68.29) | 10.0 (8.0; 14.0) |
| р 7–8 | p > 0.05 | 0.05 < р < 0.1 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 |
| р 1–8 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 | p > 0.05 |
| р 4–8 | р < 0.05 | р < 0.01 | р < 0.05 | р < 0.05 | p > 0.05 | p > 0.05 |
| р 6–8 | p > 0.05 | р < 0.01 | р < 0.05 | р < 0.05 | р < 0.05 | р < 0.05 |
| р 2–8 | p < 0.05 | р < 0.01 | p > 0.05 | p > 0.05 | р < 0.05 | 0.05 < р < 0.1 |
Здесь и в табл. 3: n = 6
Таблица 3.
Изменение исследовательской активности животных, перенесших химическую десимпатизацию, после стресса без и на фоне введения малых доз L-тироксина Table 3. Changes in the research activity of animals under chemical desympatisation after stress without and with injected small doses of L-thyroxine
| Группы животных Groups of animal |
Время пребывания
на периферии, % Time in periphery, % |
Время пребывани
в центре, % Time in center, % |
Общая длительность
замирания, % Resting Time, % |
Длительность замирания
на периферии, % Resting Time in periphery, % |
Длительность замирания
в центре, % Resting Time in center, % |
Число входов в центр Entries in the center |
Латентный период
входа в центр, с Latency entrance to the center, s |
Параллельный индекс Parallel Index |
|---|---|---|---|---|---|---|---|---|
| 1. Контроль Control | 85.89 (78.97; 93.25) |
14.11 (6.75; 21.03) |
43.63 (35.70; 49.29) |
38.60 (34.67; 49.19) |
1.86 (1.03; 8.28) |
12.5 (9.0; 18.0 |
9.81 (4.85; 11.48) |
–0.16 (–0.34; –0.11) |
| 2. Cтресс Stress | 88.43 (79.79; 92.21) |
11.57 (7.79; 20.21) |
64.93 (61.75; 70.84) |
63.81 (61.09; 67.49) |
1.22 (1.00; 3.35) |
7.5 (5.0; 12.0) |
14.55 (11.55; 19.35) |
0.03 (–0.03; 0.06) |
| p 1–2 | р > 0.05 | р > 0.05 | р < 0.05 | р < 0.01 | р > 0.05 | 0.05 < р < 0.1 | р < 0.05 | р < 0.05 |
| 3. Тироксин Thyroxine | 55.29 (44.53; 68.05) |
44.72 (31.95; 55.47) |
50.80 (46.83; 57.12) |
32.70 (24.54; 40.20) |
19.14 (9.76; 23.44) |
20.5 (17.0; 23.0) |
3.25 (0.42; 7.97) |
–0.40 (–0.59; –0.35) |
| p 1–3 | p < 0.01 | p < 0.01 | р > 0.05 | р > 0.05 | р < 0.05 | 0.05 < р < 0.1 | p < 0.1 | р < 0.01 |
| 4. Тироксин + стресс Thyroxine + stress | 60.12 (53.58; 69.50) |
39.88 (30.50; 46.42) |
58.60 (48.34; 73.43) |
32.56 (27.30; 39.21) |
17.96 (12.60; 29.74) |
15.5 (12.0; 23.0) |
4.62 (1.18; 7.50) |
–0.30 (–0.36; –0.14) |
| p 3–4 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 |
| p 1–4 | р < 0.01 | р < 0.01 | р > 0.05 | р > 0.05 | p < 0.05 | р > 0.05 | 0.05 < р < 0.1 | р > 0.05 |
| p 2–4 | р < 0.01 | р < 0.01 | р > 0.05 | р < 0.05 | р < 0.05 | р < 0.05 | р < 0.01 | р < 0.05 |
| 5. Десимпатизация Desympatisation | 81.77 (74.12; 92.19) |
18.24 (7.81; 25.88) |
57.96 (50.52; 63.73) |
50.44 (43.45; 57.10) |
7.16 (6.27; 9.13) |
8.5 (7.0; 11.0) |
10.98 (8.36; 13.02) |
–0.01 (–0.05; 0.03) |
| р 1–5 | р > 0.05 | р > 0.05 | 0.05 < р < 0.1 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | 0.05 < р < 0.1 |
| 6. Десимпатизация + стресс Desympatisation + stress | 86.89 (83.54; 91.39) |
13.11 (8.61; 16.46) |
72.86 (66.21; 79.09 |
66.75 (58.96; 68.20) |
8.30 (5.38; 12.34) |
3.50 (2.0; 5.0) |
13.77 (9.17; 18.35) |
0.10 (0.1; 0.16) |
| р 5–6 | р > 0.05 | р > 0.05 | р < 0.05 | р < 0.05 | р > 0.05 | р < 0.01 | р > 0.05 | р > 0.05 |
| р 1–6 | р > 0.05 | р > 0.05 | p < 0.01 | p < 0.01 | 0.05 < р < 0.1 | р < 0.01 | р > 0.05 | р < 0.05 |
| р 2–6 | р > 0.05 | р > 0.05 | р > 0.05 | р > 0.05 | р < 0.05 | р < 0.05 | р > 0.05 | р > 0.05 |
| 7. Тироксин + десимпатизация Thyroxine + desympatisation | 72.75 (69.74; 76.93) |
27.26 (23.07; 30.26) |
45.10 (42.59; 53.68) |
37.67 (33.03; 38.18) |
10.66 (7.34; 16.32) |
13.0 (10.0; 15.0) |
6.26 (5.25; 8.24) |
–0.36 (–0.43; –0.27) |
| р 3–7 | p > 0.05 | p > 0.05 | p > 0.05 | p < 0.05 | p > 0.05 | p < 0.05 | р < 0.05 | p > 0.05 |
| р 5–7 | p < 0.05 | p < 0.05 | p > 0.05 | p > 0.05 | 0.05 < р < 0.1 | p < 0.05 | p > 0.05 | p > 0.05 |
| р 1–7 | p < 0.05 | p < 0.05 | p > 0.05 | p > 0.05 | p < 0.05 | p > 0.05 | p > 0.05 | p < 0.05 |
| 8. Тироксин + десимпатизация + + cтресс Thyroxine + desympatisation + + stress | 73.81 (69.57; 82.38) |
26.20 (17.62; 30.43) |
56.97 (51.55; 61.85) |
44.55 (39.27; 53.04) |
11.18 (8.73; 13.29) |
9.5 (8.0; 11.0) |
7.30 (6.24; 8.22) |
–0.25 (–0.31; –0.22) |
| р 7–8 | p > 0.05 | p > 0.05 | р < 0.05 | р < 0.05 | p > 0.05 | 0.05 < р < 0.1 | p > 0.05 | p > 0.05 |
| р 1–8 | р < 0.05 | р < 0.05 | р < 0.05 | p > 0.05 | р < 0.05 | p > 0.05 | p > 0.05 | p > 0.05 |
| р 4–8 | р < 0.05 | р < 0.05 | p > 0.05 | 0.05 < р < 0.1 | p > 0.05 | р < 0.05 | p > 0.05 | p > 0.05 |
| р 6–8 | р < 0.05 | р < 0.05 | р < 0.05 | р < 0.01 | p > 0.05 | р < 0.01 | р < 0.05 | р < 0.01 |
| р 2–8 | р < 0.05 | р < 0.05 | р < 0.05 | р < 0.05 | р < 0.05 | p > 0.05 | р < 0.01 | р < 0.01 |
Стресс у десимпатизированных животных, в отличие от аналогичного воздействия у крыс, не получавших гуанетидин, не вызвал повышения концентрации ЙТГ и снижения содержания ТТГ в крови (по отношению к их значениям в группе “Десимпатизация”). В результате, по сравнению с ее величиной в группе “Контроль”, концентрация ЙТГ в крови была ниже: Т3 на 21%, Т3 св на 31%, Т4 св на 37%. Сывороточный уровень Т4 имел тенденцию к уменьшению (0.05 < р <0.1). Содержание ТТГ в крови, напротив, было выше на 21%. По отношению к значению аналогичных параметров в группе “Стресс” концентрация всех форм ЙТГ в крови была меньше: Т3 на 39%, Т4 на 41%, Т3 св на 61%, Т4 св на 69%, а ТТГ – больше на 57%.
После стресса у крыс, которым вводили гуанетидин, относительная масса тимуса снижалась менее значительно – на 13%, тогда как масса надпочечников и селезенки изменялась в такой же степени, как и у животных с интактной симпатической нервной системой в аналогичных условиях: по сравнению с их величиной в группе “Десимпатизация” относительная масса надпочечников повышалась на 28%, селезенки падала на 16%. Однако содержание кортикостерона в крови симпатэктомированных крыс, подвергнутых стрессу, возрастало более существенно, чем после стресса у животных, не получавших гуанетидин, – на 52%, тогда как концентрацияинсулина снижалось практически в такой же степени – на 16%. В результате величина К/И коэффициента существенно увеличилась – до 2.87 (в 1.67 раза). Повреждение СОЖ хотя и наблюдалось у такого же количества животных, но имело бóльший индекс поражения, величина которого составила 1.98.
Вследствие указанных изменений по отношению к их значениям у контрольных животных относительная масса надпочечников была выше на 64%, таковая тимуса и селезенки – ниже на 35 и 33%. Уровень кортикостерона в крови был больше на 101%, инсулина – меньше на 30%, поэтому значение К/И коэффициента было существенно выше – в 2.87 раза. Частота поражения СОЖ была больше на 80%, как и тяжесть и индекс поражения.
По сравнению с аналогичными показателями у крыс группы “Стресс” относительная масса надпочечников была выше на 33%, селезенки – ниже на 19%, тимуса – такой же. Сывороточное содержание кортикостерона было больше на 61%, инсулина – меньше на 11%. Вследствие этого величина К/И коэффициента была выше в 1.67 раза. Тяжесть и частота поражения СОЖ были такими же, однако индекс поражения был больше – в 1.46 раза.
Физическая выносливость животных группы “Десимпатизация + стресс” не повышалась, как в группе “Стресс” (по отношению к группе “Десимпатизация”). Горизонтальная двигательная активность в отличие от крыс, перенесших стресс без введения гуанетидина, также не возрастала, а, напротив, падала: общая дистанция перемещения в тесте “открытое поле” снижалась на 36% (по отношению к группе “Десимпатизация”). Вертикальная локомоторная активность, в отличие от животных группы “Стресс” не уменьшалась, а имела лишь тенденцию к снижению. Как и в указанной группе сравнения, не наблюдалось изменения структуры поведения: соотношение дистанций перемещения крыс и продолжительности их пребывания в разных зонах “открытого поля” не изменялось.
Максимальная скорость движения животных была такой же, как в группе “Десимпатизация”, т.е. не имела тенденции к увеличению, как у крыс группы “Стресс”.
Исследовательская активность симпатэктомированных животных после стресса снижалась, как это имело место и в группе “Стресс”, однако несколько более значительно: общая длительность замирания и таковая в периферической зоне повышались на 34 и 46%, число входов в центральную зону уменьшалось на 40%. Параллельный индекс становился положительным (0.10), хотя и не отличался статистически достоверно от его величины в группе “Десимпатизация”. Остальные изученные нами параметры поведенческой активности крыс были такими же, как у симпатэктомированых животных.
В результате отмеченных сдвигов по отношению к их значениям у контрольных крыс были ниже: время удержания животных на вращающемся валике ротарода на 76%, общая дистанция перемещения на 58%, максимальная скорость движения на 29%, число входов в центр на 72%, количество вертикальных стоек на 52%. Дистанция перемещения и продолжительность пребывания крыс на периферии и в центре поля, латентный период входа в центр были такими же, как в контроле. Общая длительность замирания и таковая в периферической зоне были выше – на 67 и 77%, как и параллельный индекс – на 0.26. Время неподвижности крыс в центре поля имело тенденцию к увеличению.
По сравнению с величиной аналогичных параметров в группе “Стресс” у десимпатизированных животных, подвергнутых стрессу, были ниже: время удержания крыс на валике ротарода на 111%, общая дистанция и максимальная скорость перемещения на 87 и 74%, число входов в центральную зону на 32%. Длительность замирания в центре “открытого поля” была, напротив, больше – в 6.8 раза. Остальные параметры двигательной и исследовательской активности животных были такими же.
Введение малых доз L-тироксина симпатэктомированным крысам привело к повышению содержания ЙТГ в крови до его величины в группах “Тироксин” и “Контроль”: по сравнению с ее значением в группе “Десимпатизация” концентрация Т3 увеличивалась на 15%, Т4 на 17%, Т3св на 24%, Т4св на 44%. Содержание ТТГ не изменялось. Следовательно, введение L-тироксина нормализует функцию щитовидной железы у десимпатизированных животных.
Относительная масса тимуса и селезенки у крыс группы “Десимпатизация + тироксин” несколько возрастала по отношению к ее величине в группе “Десимпатизация” – на 6 и 9%, надпочечников – не изменялась. Сывороточный уровень кортикостерона снижался на 22%, а содержание инсулина повышалось на 8%, поэтому значение К/И коэффициента падало – в 1.28 раза. Повреждение СОЖ было таким же.
В результате описанных сдвигов по отношению к группе “Тироксин” относительная масса тимуса и селезенки была меньше на 16 и 10%. Сывороточный уровень кортикостерона был выше на 29%, инсулина – таким же, вследствие чего значение К/И коэффициента было больше в 1.39 раза. Параметры повреждения СОЖ были такими же.
По сравнению с величиной аналогичных показателей в группе “Контроль” относительная масса надпочечников была выше на 22%, тимуса и селезенки – меньше на 13 и 8%. Уровень кортикостерона в крови был больше на 27%, а инсулина – таким же. Величина К/И коэффициента была выше в 1.36 раза.
Введение L-тироксина десимпатизированным крысам несколько повысило их физическую выносливость, двигательную и исследовательскую активность: по сравнению с их значениями в группе “Десимпатизация” время удержания животных на вращающемся валике ротарода увеличилось на 29%, общая дистанция перемещения на 28%. Вертикальная локомоторная активность (количество стоек) и дистанция движения в центре имели тенденцию к увеличению, расстояние перемещения на периферии – к укорочению.
Число входов в центральную зону возросло на 36% (по сравнению с группой “Десимпатизация”). Латентный период входа в центр и длительность замирания в периферической зоне, напротив, снизились на 48 и 33%. Значение параллельного индекса стало более отрицательным и составило –0.36, вследствие чего он был меньше, чем в группе “Десимпатизация”, на 0.35. Это подтверждает стимуляцию интенсивности исследовательских реакций у десимпатизированных крыс под влиянием L-тироксина.
По отношению к их значениям в группе “Тироксин” были меньшими: время удержания животных на валике ротарода на 48%, общая дистанция перемещения на 40%, максимальная скорость движения на 52%, расстояние перемещения в центральной зоне и продолжительность пребывания в ней на 76 и 124%, как и число входов в центр – на 60%. Дистанция движения в периферической зоне и время пребывания в ней, напротив, были бóльшими – на 18 и 21%. Остальные параметры двигательной и исследовательской активности крыс были такими же.
По сравнению с их величинами у контрольных животных, у симпатэктомированых крыс, получавших L-тироксин, время пребывания и неподвижности в центре “открытого поля” было больше на 93% и в 5.7 раза, а продолжительность нахождения животных на периферии, напротив, меньше на 15%, как и параллельный индекс – на 0.20.
Введение L-тироксина крысам с дефицитом симпатических влияний оказало стресс-протекторное действие, как это имело место и у животных с интактной симпатической нервной системой.
У десимпатизированных крыс, получавших L-тироксин и подвергнутых стрессу, уровень ЙТГ в крови не снижался, как после стресса у симпатэктомированных животных. По отношению к его значению в группе “Тироксин + десимпатизация” сывороточное содержание Т4 и Т3св незначительно повышалось – на 14 и 8%. Концентрация Т3 и Т4св не изменялась. Уровень ТТГ в крови, в отличие от указанной группы сравнения, падал на 39%. Вследствие описанных изменений, по отношению к группе “Контроль” содержание Т4 в крови было больше на 16%, остальных фракций ЙТГ – таким же. По сравнению с ее величиной в группе “Десимпатизация + + стресс”, сывороточная концентрация ЙТГ была выше: Т3 на 27%, Т4 и Т3св на 35%, Т4св на 52%. Содержание ТТГ в крови, напротив, было ниже на 48%. По отношению к его значениям в группах “Тироксин + стресс” и “Стресс”, сывороточный уровень Т3 был меньше на 7 и 13%, Т3св на 13 и 26%. Концентрация Т4св в крови была ниже только по сравнению с таковой в группе “Стресс” – на 17%. Содержание Т4 и ТТГ было таким же, как в обеих указанных группах сравнения.
В отличие от десимпатизированных крыс, подвергнутых стрессу без введения L-тироксина, относительная масса надпочечников не повышалась (по сравнению с группой “Тироксин + десимпатизация”). Относительная масса тимуса и селезенки снижалась в той же мере – на 12 и 13%. Концентрация кортикостерона в крови возрастала менее значительно – на 44%, а сывороточное содержание инсулина уменьшалось менее существенно – только на 8%. Поэтому К/И коэффициент повышался всего в 1.46 раза. Это свидетельствует о снижении напряжения компенсаторных процессов при стрессе у десимпатизированных животных под влиянием L-тироксина. Повреждение СОЖ характеризовалось меньшими частотой и тяжестью.
По отношению к их величинам в группе “Контроль”, относительная масса надпочечников и уровень кортикостерона в крови были больше на 36 и 71%, относительная масса тимуса, селезенки и содержание инсулина – ниже на 25, 21 и 14%. Величина К/И коэффициента была выше в 1.99 раза. Частота, тяжесть и индекс повреждения СОЖ были бóльшими.
По сравнению с их значениями в группе “Тироксин + стресс”, относительная масса надпочечников и сывороточная концентрация кортикостерона были выше на 16 и 46%, относительная масса тимуса и селезенки – ниже на 14 и 15%, содержание инсулина – таким же. Значение К/И коэффициента и индекс повреждения СОЖ были больше в 1.42 и 4.17 раза.
По отношению к их величине в группе “Десимпатизация + стресс”, относительная масса надпочечников и содержание кортикостерона в крови были меньше на 28 и 30%, относительная масса тимуса, селезенки и сывороточный уровень инсулина – больше на 10, 12 и 16%. Величина К/И коэффициента была ниже в 1.44 раза. Частота повреждения СОЖ была меньше – на 40%, как и тяжесть, и индекс поражения (в 3.96 раза).
По сравнению с таковыми в группе “Стресс”, относительная масса селезенки и концентрация кортикостерона были выше на 7 и 31%. Значение К/И коэффициента было больше в 1.16 раза. Остальные изученные нами параметры стресс-реакции не отличались от их величины в указанной группе сравнения.
В отличие от группы “Десимпатизация + стресс” общая дистанция перемещения, число входов в центр поля, вертикальная двигательная активность не уменьшались. Общая длительность неподвижности и таковая на периферии, хотя и увеличивались, однако менее существенно, чем после стресса у крыс с дефицитом симпатических влияний, которым не вводили L-тироксин, – на 29 и 17%. Число входов в центральную зону не падало, как у животных этой группы сравнения, а имело только тенденцию к уменьшению. Другие показатели физической выносливости, локомоторной и исследовательской активности животных не отличались от их значений в группе “Тироксин + десимпатизация”, как и параллельный индекс, который также имел отрицательное значение (–0.25).
В результате по отношению к их величинам в группе “Десимпатизация + стресс” были бóльшими: общая дистанция движения на 41%, расстояние и продолжительность нахождения в центральной зоне “отрытого поля” на 54 и 93%, максимальная скорость перемещения на 28%, количество вертикальных стоек на 39%, число входов в центр на 48%. Дистанция перемещения и продолжительность нахождения крыс на периферии поля, напротив, были ниже – на 12 и 15%, как и общая длительность замирания, таковая в периферической зоне, латентный период входа в центр и параллельный индекс – на 36, 62, 72 и 0.15.
По сравнению с их величинами в группах “Стресс” и “Тироксин + стресс” были ниже: время удержания животных на вращающемся валике родарода – на 47 и 41%, общая дистанция перемещения – на 46 и 56%. По отношению к их значениям в группе “Тироксин + стресс” расстояние движения и продолжительность пребывания крыс на периферии поля были больше на 27 и 16%, а дистанция и время нахождения в центре, напротив, меньше – на 116 и 79%, как и число входов в центр “открытого поля” – на 48%. По сравнению с их величинами в группе “Стресс” были меньшими: время пребывания животных на периферии – на 17%, максимальная скорость перемещения – на 46%, общая длительность замирания и таковая в периферической зоне – на 20 и 50%, латентный период входа в центр – на 74%, параллельный индекс – на 0.28. Продолжительность нахождения и длительность замирания крыс в центральной зоне поля по отношению к их значениям в группе “Стресс”, напротив, были больше – на 104% и в 9.2 раза.
По сравнению с их величинами в контроле время нахождения животных на периферии “открытого поля” в группе “Тироксин + десимпатизация + стресс” было меньше на 14%, а время нахождения их в центральной зоне, наоборот, больше – на 86%, как и общая длительность неподвижности, и таковая в центре – на 31% и в 6.0 раз.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
“Выключение” симпатических нервных влияний, достигнутое в наших опытах введением гуанетидина, подавляет функцию щитовидной железы, увеличивает относительную массу надпочечников, концентрацию кортикостерона в крови, снижает относительную массу тимуса и селезенки, сывороточное содержание инсулина и физическую выносливость животных, определяет поражение СОЖ с более высоким индексом. Высокая величина К/И коэффициента (1.74) свидетельствует о существенном напряжении компенсаторных механизмов у таких крыс, степень которого практически сопоставима с таковой при стрессе (1.72).
Уменьшение уровня ЙТГ в крови после введения симпатолитиков было обнаружено и другими авторами [28] и может быть связано с морфометрическими (снижение массы щитовидной железы [29]) и функциональными (увеличение периода полураспада изотопов йода [29] и захвата их щитовидной железой [30, 31]) изменениям.
Возрастание относительной массы надпочечников после фармакологической симпатэктомии согласуется с данными, полученными Vavřínová с соавт. [32], и может являться результатом показанных другими исследователями: 1) стимуляции экспрессии генов ферментов, участвующих в биосинтезе катехоламинов в мозговом веществе надпочечников, приводящей к возрастанию уровня адреналина и метадреналина в плазме крови [32]; 2) увеличением площади среза коркового и мозгового вещества надпочечников [33].
Падение относительной массы тимуса и селезенки после устранения симпатических нервных влияний было установлено и другими авторами [34], и, вероятно, обусловлено показанными ими: 1) стимуляцией апоптоза в клетках тимуса в этих условиях [34]; 2) атрофией тимуса (опустошение коркового вещества и инверсия слоев) [35] и селезенки [36] под действием глюкокортикоидов, повышение уровня которых в крови обнаружено в наших опытах. В свою очередь, это может быть вызвано ростом относительной массы надпочечников, обнаруженным нами.
Падение сывороточного содержания инсулина, возможно, обусловлено показанным другими исследователями уменьшением экспрессии гена этого гормона в островках поджелудочной железы у животных, подвергнутых фармакологической симпатэктомии [37].
Повреждение СОЖ может быть связано с тем, что химическая десимпатизация вызывает: 1) вазоконстрикцию в СОЖ [38]; 2) существенное повышение экспрессии генов индуцибельной NO-синтазы и циклооксигеназы-2, содержания в сыворотке крови факторов, играющих роль в развитии патологических процессов в СОЖ – интерлейкинов 6 и 12, фактора некроза опухоли-α; мотилина и субстанции Р, стимулирующих секрецию желудочного сока, и, напротив, снижение уровня соматостатина и вазоактивного интестинального пептида, обладающих ингибирующим эффектом на последний процесс [39]; 3) активацию ПОЛ (рост концентрации малонового диальдегида), связанную с падением активности супероксиддисмутазы и глутатионперексидазы, а также концентрации NO в СОЖ [39].
Падение двигательной активности и физической выносливости может являться следствием изменений, развивающихся у животных с дефицитом симпатических нервных влияний. Возможные причины – изменения, развивающиеся в скелетных мышцах после симпатэктомии:
1) изменение интенсивности протеолиза: гуанетидин (подкожно 100 мг/кг) – увеличение общей и кальций-зависимой протеолитической активности в камбаловидной мышце крыс после 2 дней, и, напротив, их снижение после 4 дней. Эти же виды активности в длинном разгибателе пальцев, как и интенсивность АТФ-зависимого протеолиза в обеих указанных мышцах уменьшались во все указанные сроки исследования [40];
2) снижение интенсивности гликогенолиза: pезерпин (внутривенно 5 мг/кг) или гуанетидин (внутривенно 35 мг/кг) – уменьшение лактацидемии и интенсивности гликогенолиза в четырехглавой мышце бедра крыс, индуцированных фентоламином (внутривенно 25 мг/кг) [41].
3) структурные изменения и нарушение энергообеспечения сократительного акта: гуанетидин (подкожно 200 мг/кг) – ограничение увеличения константы скорости поглощения глюкозы в камбаловидных мышцах и длинных разгибателях пальцев, белых и красных мышечных волокнах четырехглавой и икроножной мышц крыс при электростимуляции вентромедиального ядра гипоталамуса [42]; резерпин (подкожно крысам в течение 3 дней в конечной дозе 1 мг/кг) – значительное снижение диаметра мышечных волокон, экспрессии миогенина, маркеров митохондриальной функции, изменение длины саркомеров, гетерогенность и повреждения в межфибриллярном пространстве и субсарколеммальных митохондриях, расширение и деформация саркоплазматического ретикулума в икроножных мышцах, значительное снижение их массы [43, 44];
4) изменение экспрессии маркеров воспалительной реакции и оксидативного стресса: резерпин (подкожно 1 мг/кг) – увеличение таковой NLRP3 (nucleotide oligomerization domain like receptor 3) (участвует в воспалении, оксидативном стрессе и клеточной гибели через активацию каспазы 1 и каспазы 5) и, напротив, уменьшение экспрессии циклооксигеназы-1 (изоформа фермента, участвующая в регуляции микроциркуляции, базального обмена и в разных этапах миогенеза) и сиртуина 3 (участвует в регуляции окислительно-восстановительных реакций) в икроножных мышцах. Развитие оксидативного стресса может быть связано со снижением экспрессии антиоксидантных ферментов (супероксиддисмутазы и каталазы), а также с падением уровня общих тиолов [43].
Следовательно, дефицит симпатических нервных влияний предупреждает активацию функции щитовидной железы при стрессе и, вместе с тем, определяет более выраженные рост концентрации кортикостерона в крови, снижение физической выносливости, горизонтальной двигательной и исследовательской активности крыс, отягощает повреждение СОЖ в этих условиях. Химическая десимпатизация не влияет на изменение относительной массы надпочечников, селезенки и уровня инсулина в крови при стрессе. Однако по сравнению с их величиной у животных с интактной нервной системой, подвергнутых стрессу, относительная масса надпочечников была больше, тогда как относительная масса селезенки и концентрация инсулина в крови, напротив, меньше. Более выраженной общей реакции организма у подвергнутых стрессу животных со сниженным уровнем адренергических влияний соответствовал более низкий по сравнению с таковым в группе “Стресс” уровень ЙТГ в крови. Существенная величина К/И коэффициента (2.87) у крыс группы “Десимпатизация + стресс” свидетельствует о более значительном напряжении компенсаторных механизмов, чем у крыс, перенесших стресс без введения гуанетидина (1.72).
Введение L-тироксина в малых дозах десимпатизированным крысам ограничивает стимуляцию тиреоидной функции, повышение сывороточного уровня кортикостерона и К/И коэффициента, снижение относительной массы тимуса и содержания инсулина в крови, предупреждает рост относительной массы надпочечников и повреждение СОЖ, падение вертикальной двигательной активности животных при стрессе. L-тироксин не влияет на изменение относительной массы селезенки при стрессе, однако обеспечивает ее более высокое значение по сравнению с таковым в группе “Десимпатизация + стресс”. L-тироксин, хотя и предупреждает рост физической выносливости, горизонтальной и исследовательской активности крыс при стрессе, обеспечивает их более высокий уровень по сравнению с таковым у животных, не получавших указанный препарат и подвергнутых стрессу. Меньшей напряженности общего адаптационного синдрома в группе “Тироксин + десимпатизация + стресс” соответствовала более высокая концентрация ЙТГ в крови, чем в группе “Десимпатизация + стресс”. Следовательно, по сравнению с таковым у крыс с интактной симпатической нервной системой, у которых стресс сопровождался более существенной активацией тиреоидной функции, стресс-протекторный эффект тироксина у животных с дефицитом симпатических нервных влияний был выражен в меньшей степени.
Прямая зависимость между уровнем йодтиронинов в крови и резистентностью организма была обнаружена и в условиях воздействия других стрессоров, в том числе и антагонистических (холодового и теплового) [45]. В настоящей работе впервые установлено, что химическая десимпатизация ограничивает выраженность защитного эффекта малых доз L-тироксина при стрессе, но не “выключает” его полностью.
Полученные данные свидетельствуют о функциональной взаимосвязи симпатоадреналовой и тиреоидной осей в процессах гормональной регуляции реакций общего адаптационного синдрома и указывают на то, что антистрессорный эффект ЙТГ частично опосредован катехоламинами, но в значительно бóльшей мере определяется прямым действием ЙТГ.
Список литературы
Godoy L.D., Rossignoli M.T., Delfino-Pereira P., Garcia-Cairasco N., de Lima Umeoka E.H. A comprehensive overview on stress neurobiology: Basic concepts and clinical implications. Front. Behav. Neurosci. 12(3): 127. 2018. https://doi.org/10.3389/fnbeh.2018.00127
Rizoli S.B., Jaja B.N., Di Battista A.P., Rhind S.G., Neto A.C., da Costa L., Inaba K., da Luz L.T., Nascimento B., Perez A., Baker A.J., de Oliveira Manoel A.L. Catecholamines as outcome markers in isolated traumatic brain injury: the COMA-TBI study. Crit. Care. 21(1): 37. 2017. https://doi.org/10.1186/s13054-017-1620-6
Мещанинов В.Н. Влияние нейромедиаторов на перекисное окисление липидов при иммобилизационном стресс-воздействии у крыс разного возраста. Казанский мед. журн. 96(5): 843–849. 2015. [Meshchaninov V.N. Effect of neurotransmitters on lipid peroxidation during immobilization stress in rats of different ages. Kazan. Med. J. 96(5): 843–849. 2015. (In Russ)]. https://doi.org/10.17750/KMJ2015-843
Feng Y., Feng Q., Lv Y., Song X., Qu H., Chen Y. The relationship between iron metabolism, stress hormones, and insulin resistance in gestational diabetes mellitus. Nutr. Diabetes. 10(1): 17. 2020. https://doi.org/10.1038/s41387-020-0122-9
Булатецкий C.В., Бяловский Ю.Ю. Реакция систем организма на увеличенное сопротивление дыханию в группах с разным уровнем адаптационных возможностей. Центр. науч. вестник. 1(4): 7–11. 2016. [Bulatetsky C.V., Byalovsky Yu.Yu. Reaction of body systems to increased breathing resistance in groups with different levels of adaptive capabilities. Central Sci. Bull. 1(4): 7–11. 2016. (In Russ)].
Porta F., Bracht H., Weikert C., Beck M., Takala J., Brandt S., Hiltebrand L.B., Jakob S.M. Effects of endotoxin and catecholamines on hepatic mitochondrial respiration. Inflammation. 32(5): 315–321. 2009. https://doi.org/10.1007/s10753-009-9138-y
Узбекова Н.Р., Хужамбердиев М.А., Таштемирова И.М. К вопросу о взаимосвязи активности симпатико-адреналовой системы и медиаторов иммунных нарушений у больных метаболическим синдромом. Рос. кардиол. журн. 107(3): 72–75. 2014. [Uzbekova N.R., Khuzhamberdiev M.A., Tashtemirova I.M. On the relationship between the activity of the sympathetic-adrenal system and mediators of immune disorders in patients with metabolic syndrome. Russ. Сardiol. J. 107(3): 72–75. 2014. (In Russ)].
Борщикова Т.И., Епифанцева Н.Н., Кан С.Л., Филимонов С.Н. Роль катехоламинов в развитии иммуносупрессии при тяжелой черепно-мозговой травме. Медицина в Кузбассе. 18 (1): 5–10. 2019. [Borshchikova T.I., Epifantseva N.N., Kan S.L., Filimonov S.N. The role of catecholamines in the development of immunosuppression in severe traumatic brain injury. Medicine in Kuzbass. 18(1): 5–10. 2019. (In Russ)].
Barth E., Albuszies G., Baumgart K., Matejovic M., Wachter U., Vogt J., Calzia E. Glucose metabolism and catecholamines. Crit. Care. Med. 35: 508–518. 2007. https://doi.org/10.1097/01.CCM.0000278047.06965.20
Jones B.J., Tan T., Bloom S.R. Minireview: Glucagon in stress and energy homeostasis. Endocrinol. 153(3): 1049–1054. 2012. https://doi.org/10.1210/en.2011-1979
Borelli M.I., Gagliardino J.J. Possible modulatory effect of endogenous islet catecholamines on insulin secretion. BMC Endocr. Disord. 1(1): 1. 2001. https://doi.org/10.1186/1472-6823-1-1
Dienel G.A., Cruz N.F. Aerobic glycolysis during brain activation: adrenergic regulation and influence of norepinephrine on astrocytic metabolism. J. Neurochem. 138(1): 14–52. 2016. https://doi.org/10.1111/jnc.13630
Bonora M., Patergnani S., Rimessi A., De Marchi E., Suski J.M., Bononi A., Giorgi C., Marchi S., Missiroli S., Poletti F., Wieckowski M. R., Pinton P. ATP synthesis and storage. Purinergic Signaling. 8(3): 343–357. 2012. https://doi.org/10.1007/s11302-012-9305-8
Mullins G.R., Wang L., Raje V., Sherwood S.G., Grande R.C., Boroda S., Eaton J.M., Blancquaert S., Roger P.P., Leitinger N., Harris T.E. Catecholamine-induced lipolysis causes mTOR complex dissociation and inhibits glucose uptake in adipocytes. Proc. Natl. Acad. Sci. 111(49): 17450–17455. 2014. https://doi.org/10.1073/pnas.1410530111
Adameova A., Abdellatif Y., Dhallaa N.S. Role of the excessive amounts of circulating catecholamines and glucocorticoids in stress-induced heart disease. Can. J. Physiol. Pharm. 87(7): 493–514. 2009. https://doi.org/10.1139/y09-042
Чинкин А.С. Соотношение адреналин:норадреналин и альфа-:бета-адренорецепторы в миокарде и адренергические хроно- и инотропные реакции при экстремальных состояниях и адаптации. Наука и спорт: соврем. тенденции. 4(3): 10–18. 2014. [Chinkin A.S. The ratio of epinephrine: norepinephrine and alpha-:beta-adrenoreceptors in the myocardium and adrenergic chrono- and inotropic reactions in extreme conditions and adaptation. Science Sport: Current Trends. 4(3): 10–18. 2014. (In Russ)].
Коротаева Ю.В., Ноздрачёв А.Д., Циркин В.И. Влияние адреналина на сократимость и возбудимость миокарда правого желудочка крысы в зависимости от фаз эстрального цикла и наличия беременности. Вестник Санкт-Петерб. Универ. Серия 3. 4: 76–98. 2016. [Korotaeva Yu. V., Nozdrachev A.D., Tsirkin V.I. The effect of epinephrine on the contractility and excitability of the rat right ventricle myocardium depending on the phases of the estral cycle and the presence of pregnancy. Bull. St. Petersburg Univer. Ser. 3. 4: 76–98. 2016. (In Russ)].
Божко А.П., Сухорукова Т.А. Нарушения сократительной функции сердца и адренореактивность миокарда при стрессе в зависимости от уровня тиреоидных гормонов. Пробл. эндокринол. 35(6): 71–75. 1989. [Bozhko A.P., Sukhorukova T.A. Violations of the contractile function of the heart and adrenergic reactivity of the myocardium under stress, depending on the level of thyroid hormones. Endocrinol. Problems. 35(6): 71–75. 1989. (In Russ)].
Божко А.П., Солодков А.П. Предупреждение стрессорных изменений коронарной ауторегуляции, расширительного резерва коронарных сосудов и сократительной функции изолированного сердца малыми дозами тиреоидных гормонов. Рос. физиол. журн. им. И.М. Сеченова. 36(1): 30–35. 1990. [Bozhko A.P., Solodkov A.P. Prevention of stressful changes in coronary autoregulation, expansion reserve of coronary vessels and contractile function of an isolated heart with small doses of thyroid hormones. Russ. J. Physiol. 36(1): 30–35. 1990. (In Russ)]. https://doi.org/10.14341/probl12471
Малышев И.Ю., Голубева Л.Ю., Божко А.П., Городецкая И.В. Роль локальных стресс-лимитирующих систем миокарда в протекторном кардиальном эффекте малых доз тиреоидных гормонов при иммобилизационном стрессе у крыс. Рос. физиол. журн. им. И.М. Сеченова. 86(1): 62–67. 2000. [Malyshev I.Yu., Golubeva L.Yu., Bozhko A.P., Gorodetskaya I.V. The Role of local stress-limiting myocardial systems in the protective cardiac effect of small doses of thyroid hormones in immobilization stress in rats. Russ. J. Physiol. 86(1): 62–67. 2000. (In Russ)].
Масюк Н.Ю., Городецкая И.В. Анализ корреляционной связи концентрации йодсодержащих гормонов щитовидной железы в крови, интенсивности кариеса и активности перекисного окисления липидов в слюне крыс. Вестн. ВГМУ. 17 (3):38–43. 2018. [Masyuk N.Yu., Gorodetskaya I.V. Analysis of the correlation between the concentration of iodine-containing thyroid hormones in the blood, the intensity of caries and the activity of lipid peroxidation in the saliva of rats. Bull. VSMU. 17 (3): 38–43. 2018. (In Russ)]. https://doi.org/10.22263/2312-4156.2018.3.38
Городецкая И.В. Гусакова Е.А. Влияние тиреоидного статуса на систему протеолиза при стрессе. Рос. физиол. журн. им. И.М. Сеченова. 99(12): 1378–1388. 2013. [Gorodetskaya I.V., Gusakova Ye.A. Effect of thyroid status on the proteolysis system under stress. Russ. J. Physiol. 99(12): 1378–1388. 2013. (In Russ)]. https://doi.org/10.18097/PBMC20156103389
Евдокимова О.В. Зависимость изменения экспрессии ранних генов c-fos и c-jun в миокарде крыс при кратковременном действии стрессоров от тиреоидного статуса организма. Журн. ГрГМУ .2 (46): 32–36. 2014. [Evdokimova O.V. Dependence of changes in the expression of early c-fos and c-jun genes in the myocardium of rats with a short-term effect of stressors on the thyroid status of the organism. J. GSMU. 2(46): 32–36. 2014. (In Russ)].
Гусакова Е.А., Городецкая И.В. Способ моделирования эмоционального стресса “дефицита времени”. Рос. физиол. журн. им. И. М. Сеченова. 105(4): 520–530. 2019. [Gusakova Ye.A., Gorodetskaya I.V. A method of modeling the emotional stress of “time deficiency”. Russ. J. Physiol. 105(4): 520–530. 2019. (In Russ)]. https://doi.org/10.1134/S0869813919040010
Whalen K., Feild C., Radhakrishnan R. Lippincott illustrated reviews: Pharmacology. Philadelphia. Wolters Kluwer. 2019.
Панин Л.Е. Биохимические механизмы стресса. Новосибирск. Наука. 1983. [Panin L. Biohimicheskie mehanizmyi stressa [Biochemical mechanisms of stress]. Novosibirsk. Nauka. 1983. (In Russ)].
Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. М. Гриф и К. 2012. [Mironov A.N. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv [Guidelines for the pre-clinical studies of drugs]. Moscow. Grief and K. 2012. (In Russ)].
Parikh R., Pilo B. Effect of chemical sympathectomy on serum levels of thyroid hormones and the biochemical profile of domestic pigeons. J. Auton. Nerv. Syst. 53(2-3): 87–94. 1995. https://doi.org/10.1016/0165-1838(94)00170-o
Coleoni A.H. Effects of the administration of catecholamine-depleting drugs on the thyroid function of the rat. Pharmacology. 8 (4–6): 300–310. 1972. https://doi.org/10.1159/000136346
Goodman J.R., Florsheim W.H., Tempereau C.E. Reserpine and thyroid function. Exp. Biol. Med. 90 (1): 196–198. 1955.
Young J.B., Bürgi-Saville M.E., Bürgi U., Landsberg L. Sympathetic nervous system activity in rat thyroid: potential role in goitrogenesis. Am. J. Physiol. Endocrinol. Metab. 288(5): 861–867. 2005. https://doi.org/10.1152/ajpendo.00292.2004
Vavřínová A., Behuliak M., Bencze M., Vodička M., Ergang P., Vaněčková I., Zicha J. Sympathectomy-induced blood pressure reduction in adult normotensive and hypertensive rats is counteracted by enhanced cardiovascular sensitivity to vasoconstrictors. Hypertens. Res. 42: 1872–1882. 2019. https://doi.org/10.1038/s41440-019-0319-2
Студеникина Т.М., Слука Б.А., Богданова М.И. Морфологические изменения надпочечников крыс в условиях химической десимпатизации гуанетидином. Морфология. 117(3): 116. 2000. [Studenikina T.M., Sluka B.A., Bogdanova M.I. Morphological changes of the adrenal glands of rats in the conditions of a chemical desympathization by guanethidine. Morphology. 117(3): 116. 2000. (In Russ)].
Kendall M.D., Al-Shawaf A.A. Innervation of the rat thymus gland. Brain Behav. Immun. 5(1): 9–28. 1991. https://doi.org/10.1016/0889-1591(91)90004-t
Старская И.С., Гурова О.В., Зассеева М.Д., Кудрявцев И.В., Полевщиков А.В. Роль апоптоза и экстратимической миграции в развитии атрофии тимуса при стрессе. Цитокины и воспаление. 13(4): 29–33. 2014. [Starskaya I.S., Gurova O.V., Zaseeva M.D., Kudryavtsev I.V., Polevshchikov A.V. Role of apoptosis and extratim migration in the development of thymus atrophy under stress. Cytokines and Inflammation. 13(4): 29–33. 2014. (In Russ)].
Orzechowski A., Ostaszewski P., Wilczak J., Jank M., Bałasińska B., Wareski P., Fuller J. Rats with a glucocorticoid-induced catabolic state show symptoms of oxidative stress and spleen atrophy: the effects of age and recovery. J. Vet. Med. A. Physiol. Pathol. Clin. Med. 49(5): 256–263. 2002. https://doi.org/10.1046/j.1439-0442.2002.00443.x
Kvist-Reimer M., Sundler F., Bo A. Effects of chemical sympathectomy by means of 6-hydroxydopamine on insulin secretion and islet morphology in alloxan-diabetic mice. Cell Tissue Res. 307 (2): 203–209. 2002. https://doi.org/10.1007/s00441-001-0496-5
Salim A.S. Mechanism of reserpine-induced acute gastric mucosal injury in the rat: role of endogenous 5-hydroxytryptamine. Clin. Sci. 80(1): 59–64. 1991. https://doi.org/10.1042/cs0800059
Zhou Y.L., Wang R., Feng X., Zhao X. Preventive effect of insect tea against reserpine-induced gastric ulcers in mice. Exp. Ther. Med. 8(4): 1318–1324. 2014. https://doi.org/10.3892/etm.2014.1859
Navegantes L.C., Resano N.M., Migliorini R.H., Kettelhut I.C. Effect of guanethidine-induced adrenergic blockade on the different proteolytic systems in rat skeletal muscle. Am. J. Physiol. 277(5): 883–889. 1999. https://doi.org/10.1152/ajpendo.1999.277.5.E883
Salvador R.A., April S.A., Lemberger L. Phentolamine activation of glycogenolysis in rat skeletal muscle. Biochem. Pharmacol. 17(3): 395–402. 1968. https://doi.org/10.1016/0006-2952(68)90249-9
Minokoshi Y., Okano Y., Shimazu T. Regulatory mechanism of the ventromedial hypothalamus in enhancing glucose uptake in skeletal muscles. Brain Res. 649(1-2): 343–347. 1994. https://doi.org/10.1016/0006-8993(94)91085-5
Favero G., Trapletti V., Bonomini F., Stacchiotti A., Lavazza A., Rodella L.F., Rezzani R. Oral supplementation of melatonin protects against fibromyalgia-related skeletal muscle alterations in reserpine-induced myalgia rats. Int. J. Mol. Sci. 18(7): 1389. 2017. https://doi.org/10.3390/ijms18071389
Franco L.M., Gadkari M., Howe K. N., Sun J., Kardava L., Kumar P., Kumari S., Hu Z., Fraser I., Moir S., Tsang J.S., Germain R.N. Immune regulation by glucocorticoids can be linked to cell type-dependent transcriptional responses. Exp. Med. 216(2): 384–406. 2019. https://doi.org/10.1084/jem.20180595
Городецкая И.В. Влияние тиреоидных гормонов на интенсивность стресс-синдрома в эксперименте. Здравоохранение. 7: 25–28. 2000. [Gorodetskaya I.V. The influence of thyroid hormones on the intensity of stress syndrome in the experiment. Healthcare. 7: 25–28. 2000. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


