Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 403-416
Каналоблокаторы ионотропных рецепторов глутамата
Д. Б. Тихонов *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: denistikhonov2002@yahoo.com
Поступила в редакцию 15.01.2021
После доработки 26.01.2021
Принята к публикации 26.01.2021
Аннотация
Глутаматергическая передача отвечает за большинство возбуждающих синаптических процессов ЦНС позвоночных. Глутаматергические синапсы участвуют в подавляющем большинстве физиологических и патологических процессов, и их модуляция оказывает непосредственное влияние практически на все функции мозга. Неудивительно, что разработка и исследования действия препаратов, способных воздействовать на глутаматергический синапс, являлась и является одной из приоритетных задач нейрофармакологии. Дать даже краткий обзор по этой комплексной проблеме – задача, не решаемая в рамках одной статьи, поэтому в обзоре представлены данные только по одной из тем, а именно по лигандам ионотропных рецепторов глутамата, которые непосредственно блокируют ионные поры этих каналов.
СТРОЕНИЕ ИОННЫХ КАНАЛОВ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ
Семейство ионотропных рецепторов глутамата делится на три основных подтипа по названию избирательных агонистов, это NMDA-рецепторы, активируемые N-метил-D-аспарагиновой кислотой, АМРА-рецепторы, активируемые α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислотой и каинатные рецепторы, активируемые каиновой кислотой [1]. Все эти типы глутаматных рецепторов представляют из себя тетрамеры, состоящие из гомологичных субъединиц. Особенностью NMDA-рецепторов является высокая проницаемость для кальция и блокада поры канала магнием, что обуславливает особую роль NMDA-рецепторов в процессах синаптической пластичности [2]. Каналообразующий домен функционального тетрамера образован всеми четырьмя субъединицами, окружающими ионную пору. Этот домен гомологичен и структурно подобен каналообразующим доменам других каналов, относящихся к суперсемейству P-loop каналов (рис. 1a), в которое входят также калиевые каналы, потенциал-управляемые натриевые и кальциевые каналы, каналы TRP-рецепторов и каналы, управляемые циклическими нуклеотидами [3].
Рис. 1.
Принципиальное строение ионтропных рецепторов глутамата. (a) трансмембранная укладка субъединиц потенциал-управляемых каналов (слева) и каналов глутаматных рецепторов (справа). Консервативный каналообразующий мотив спираль–петля–спираль показан серым цветом. (b) и (c) строение каналообразующего домена глутаматного рецептора. (b) вид в плоскости мембраны, (c) “боковая” проекция, параллельная оси канала. Показано расположение трансмембранных спиралей, ворот канала, селективного фильтра и N/Q/R сайта.
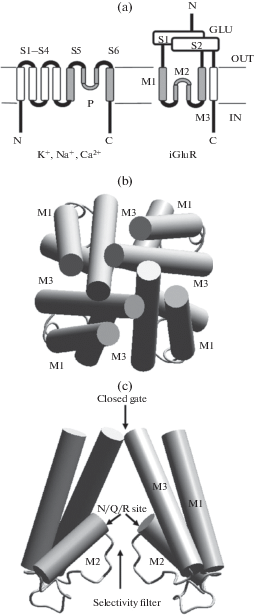
Пространственная организация ионных каналов глутаматных рецепторов (рис. 1b, c) интенсивно изучалась на протяжении трех последних десятилетий. В 90-е годы 20-го века развитие представлений об их строении было связано с молекулярно-биологическими подходами. Была установлена тетрамерная организация, трансмембранная топология субъединиц, выявлены каналообразующие сегменты и конкретные остатки, формирующие селективный фильтр каналов, который играет ключевую роль и в связывании каналоблокаторов [4–11]. К концу десятилетия была окончательно верифицирована концепция структурной гомологии каналов глутаматных рецепторов и других членов семейства P-loop каналов [12]. Каналообразующая часть каждой субъединицы состоит из двух трансмембранных альфа-спиралей (М1 и М3), между которыми расположена внутримембранная М2 петля (P-loop), N-концевая часть которой также имеет спиральное строение, а С‑концевая часть образует селективный фильтр. Наиболее важным является позиция вблизи изгиба М2 сегмента (рис. 1c). Данную позицию называют “N/Q/R” сайтом. Каналы NMDA-рецепторов имеют в этом сайте остаток аспарагина (N), который и отвечает за высокую проницаемость для кальция и чувствительность к магнию. Свойства АМРА и каинатных каналов зависят от субъединичного состава: в части субъединиц остаток глутамина (Q) определяет умеренную проводимость и кальциевую проницаемость, а присутствие субъединиц, содержащих остаток аргинина (R), резко уменьшает проводимость и кальциевую проницаемость [1].
В 2000-е годы публикация рентгеновских структур калиевых каналов [13] открыла возможность для широкого использования гомологического моделирования всех каналов Р-loop семейства и, в частности, каналов глутаматных рецепторов [14–17]. Использование этого подхода заключается не только в непосредственном построении молекулярных моделей с использованием структур калиевых каналов в качестве структурного шаблона, но, в более широком смысле, в интерпретации разнообразных данных о каналах глутаматных рецепторов с точки зрения вероятных сходств и различий с уже известными структурами. Активно обсуждался вопрос о том, насколько велики различия в структурных деталях между калиевыми каналами и каналами глутаматных рецепторов, несмотря на принципиальную общность пространственной архитектуры. Наличие ряда консервативных остатков в гомологичных положениях указывало на то, что каналы глутаматных рецепторов должны быть весьма близки по строению к калиевым каналам. Однако ряд косвенных данных указывал на значительные различия [18–21].
Первые структуры глутаматных рецепторов [22–25] свидетельствовали в пользу предположения об их существенных структурных особенностях. Однако технические трудности препятствовали высокому разрешению структур, особенно с области М2 петли и входящего в нее селективного фильтра. Усовершенствование методик, применение криоэлектронной микроскопии и исследования комплексов АМРА-каналов со вспомогательными субъединицами (старгазин и др.) постепенно привели к появлению более точных и надежных структур [26–28], которые оказались гораздо ближе к калиевым каналам, чем предполагалось в более ранних работах. Так, в первых структурах отклонения С-альфа атомов в М2- и М3-спиралях от гомологичных им атомов в калиевых каналах составляло 3–5 Å и достигало 10 Å в области селективного фильтра. А для структур, полученных в последних работах, соответствующие значения лежат в пределах 1–3 Å [3]. Таким образом, в настоящее время можно считать доказанным, что каналы глутаматных рецепторов по своей структуре близки именно к калиевым каналам, несмотря на функциональные различия.
Детали структурных перестроек, связанных с активацией каналов, также крайне важны для исследований действия блокаторов [29]. Открытие калиевых каналов происходит за счет излома спиралей, гомологичных М3-сегментам глутаматных рецепторов в области консервативного остатка глицина [30]. Хотя рецепторы глутамата не имеют остатка глицина в гомологичном положении, многочисленные работы с использованием точечных мутаций свидетельствовали, что перестройки в М3-сегменте играют ключевую роль [31–34]. В то же время ряд данных указывал на роль селективного фильтра в активации каналов глутаматных рецепторов [35]. У других представителей семейства P-loop каналов селективный фильтр обычно участвует в медленной инактивации [36, 37], однако есть и примеры “двойных ворот” [38]. Несмотря на то, что в ряде недавних структур [39, 40] были зафиксированы конформационные изменения в М3-сегменте и селективном фильтре [40], ассоциированные с активаций каналов АМРА-рецепторов, вопрос о конкретных механизмах остается открытым.
БЛОКАТОРЫ КАНАЛОВ NMDA-РЕЦЕПТОРОВ
В настоящее время известно множество блокаторов каналов NMDA-рецепторов. Некоторые представители этого семейства представлены на рис. 2. Наиболее известны МК-801, фенциклидин, кетамин и мемантин [41, 42]. Все эти соединения имеют гидрофобное или ароматическое ядро и протонируемую аминогруппу. Трехмерные структуры также весьма сходны, их можно представить как конус, в вершине которого расположен положительный заряд аминогруппы (рис. 2). Данная общая структура активных NMDA-блокаторов подтверждается рядом структурно-функциональных исследований [43, 44]. Множество других соединений сходной структуры также являются активными блокаторами NMDA-каналов [45]. Такая общность подразумевает строение сайта связывания в виде гидрофобной воронки, в узкой части которой находятся катионофильные полярные или заряженные группы [46]. Поликатионные соединения с вытянутой пространственной структурой также блокируют NMDA-каналы [47–49], но их активность не превосходит активность монокатионов.
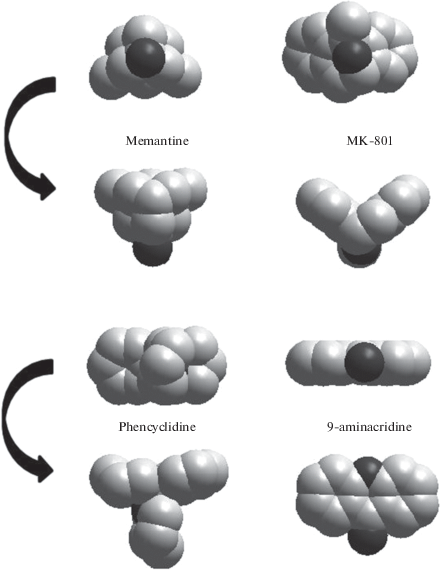
Рис. 2.
Пространственные структуры типичных блокаторов NMDA-каналов. Для каждой молекулы даны две проекции. Стрелками показан поворот структур. Мемантин, МК-801 и фенциклидин в одной из проекций имеют конусообразную форму с аминогруппой в вершине. У 9-аминоакридина плоская структура за счет сопряженных ароматических колец.
Катионные блокаторы, связывающиеся внутри поры канала, находятся под воздействием мембранного поля. При входе в пору с наружной стороны, связывание катионных блокаторов усиливается за счет воздействия поля, чем глубже в поле сайт связывания, тем выше потенциалозависимость связывания, которую принято выражать величиной δ, безразмерной долей мембранного поля, которую пересекает заряд блокатора между наружной поверхностью и сайтом связывания [50]. Особо сильную потенциалозависимость имеет блокада ионами магния в силу их удвоенного заряда. В результате вольт-амперная характеристика NMDA-активируемых токов в присутствии физиологических концентраций магния имеет участок “отрицательного сопротивления”, то есть при потенциалах –30 мВ и ниже ток ослабляется при гиперполяризации за счет блокады ионами магния [51, 52]. Именно этот эффект определяет специфическую роль NMDA-рецепторов в процессах синаптической передачи и синаптической пластичности. Поскольку органические блокаторы связываются в канале с тем же сайтом, они конкурируют за связывание с магнием. Это приводит к тому, что активность и потенциалозависимость действия блокаторов, измеренные в безмагниевой среде, не соответствуют тому, что наблюдается в физиологических условиях [53–55].
Еще одна сложность, выявляющаяся при изучении действия блокаторов NMDA-каналов, состоит в их неоднозначном взаимодействии с воротным механизмом канала. Поскольку сайт связывания находится в глубине канала в области селективного фильтра (N/Q/R сайт), доступ с наружной стороны возможен только в состоянии, когда канал открыт. Внутренняя полость между селективным фильтром и воротами достаточно велика, чтобы канал мог закрыться, когда блокатор находится внутри. Молекула блокатора, таким образом, оказывается в “ловушке” (trapping) и не может покинуть канал, пока он не откроется снова. Действительно, ряд блокаторов, таких как МК-801, кетамин и фенциклидин, действуют по механизму “ловушки” [41]. Однако и для блокаторов этого типа наблюдается влияние на воротный механизм [56]. Есть совершенно другой тип взаимодействия, при котором связывание блокатора препятствует закрытию ворот. Такой механизм получил название “foot-in-the-door”. К таким “неловушковым” блокаторам относятся тетраалкиламмониевые соединения больших размеров [57], которые просто стерически не помещаются в полость закрытого канала. Длинные дикатионные блокаторы, терминальные группы которых не могут пройти внутрь селективного фильтра, также препятствуют закрытию ворот [58]. Наиболее интересным представляется “неловушковый” механизм действия 9-аминоакридина, такрина и ряда их производных [59–62]. Их стерический размер не превосходит размеров классических ловушковых блокаторов, но они имеют плоскую структуру из сопряженных ароматических колец. Возможно, такие молекулы связываются с каналом в виде димеров, образуемых за счет стекинг взаимодействия. Описаны и промежуточные случаи “частичной ловушки”, когда связывание блокатора затрудняет закрытие канала, но не препятствует ему полностью [63]. Классическим представителем этой группы является мемантин [64]. Блокаторы “foot-in-the-door” имеют важную особенность действия. За счет того, что блокированный канал не может перейти в закрытое состояние, равновесие между закрытыми и открытыми каналами в реакции активации смещается в сторону открытых каналов. Этот эффект снижает действие блокаторов, определяемое по уменьшению ионных токов. Данный компенсаторный эффект тем меньше, чем больше каналов уже открыто, то есть ингибирование токов усиливается при увеличении концентрации агониста.
Таким образом, действие блокаторов NMDA каналов определяется не только их сродством, но и рядом тонких характеристик механизма действия, которые по-разному проявляются в экспериментах разных типов, а также в физиологических и патологических условиях.
БЛОКАТОРЫ КАНАЛОВ АМРА- И КАИНАТНЫХ РЕЦЕПТОРОВ
Ионные каналы рецепторов АМРА- и каинатного типов резко отличаются от NMDA-каналов по чувствительности к каналоблокаторам. Кальций-непроницаемые каналы, в состав которых входят субъединицы, имеющие остаток аргинина в селективном фильтре, практически не блокируются органическими катионами. Известные блокаторы этих каналов электронейтральны, как, например, пентобарбитал [65, 66]. Это неудивительно, поскольку боковая цепь аргинина заряжена положительно и отталкивает катионные частицы. Однако и каналы, в селективном фильтре которых содержатся остатки глутамина, также не блокируются большинством активных блокаторов NMDA-каналов. Это относится прежде всего к соединениям, имеющим компактное пространственное строение. Напротив, соединения с удлиненной пространственной структурой (рис. 3), такие как полиамины, полиамин-содержащие токсины и дикатионные аналоги блокаторов NMDA-каналов являются эффективными АМРА-блокаторами [45–47, 67, 68]. Очевидно, что сайт связывания блокаторов в каналах АМРА-рецепторов отличается от аналогичного сайта в каналах NMDA-рецепторов. Гидрофобный и катион-связывающий компоненты пространственно разнесены [46]. Поэтому наиболее эффективны те соединения, у которых гидрофобная “голова” и терминальная аминогруппы расположены на определенном расстоянии.
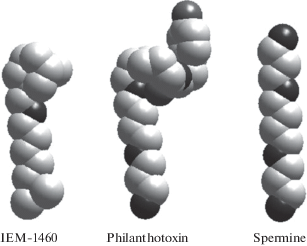
Рис. 3.
Пространственные структуры типичных блокаторов АМРА- и каинатных каналов. Все они имеют вытянутую форму, что позволяет им входить в селективный фильтр и взаимодействовать с пространственно разнесенными гидрофобной и катионсвязывающей частями.
Блокаторы каналов АМРА- и каинатных рецепторов действуют по механизму “ловушки”, то есть остаются в полости после закрытия. Однако у них есть своя особенность. Просвет канала в АМРА- и каинатных рецепторах существенно шире, чем в каналах NMDA-рецепторов. Поэтому многие блокаторы могут проходить канал насквозь, то есть после связывания они могут диссоциировать как наружу, так и вовнутрь клетки [69–71]. Такое проваливание приводит к ряду интересных феноменов. Во-первых, потенциалозависимость блокирующего действия становится немонотонной. При потенциале покоя и при гиперполяризации электрическое поле мембраны проталкивает молекулу блокатора внутрь, тем самым ослабляя связывание. Эффект проваливания сказывается и на механизме ловушки. При закрытии каналов выход блокатора наружу становится невозможным, но блокатор может покинуть сайт связывания за счет проникновения внутрь клетки. В результате, доля каналов, остающихся блокированными после и закрытия, уменьшается со временем. Тот же самый эффект может приводить к зависимости блокирующего действия от концентрации агониста. За счет того, что доступ блокатора из наружной среды к сайту связывания возможен только в открытом состоянии, а диссоциация внутрь клетки сохраняется и в закрытом состоянии, блокирующее действие может усиливаться при полном открытии каналов высокими концентрациями агониста [72]. Конкретные величины эффектов сильно зависят от структур блокаторов. Очевидно, что сравнительно компактные молекулы проходят сквозь канал легче, и для них эффекты проваливания более выражены, чем для соединений с крупными гидрофобными группами.
Еще одной особенностью кальций-проницаемых АМРА- и каинатных каналов является блокада внутриклеточными полиаминами [73], в частности, эндогенным спермином, потенциалозависимое действие которого определяет эффект входного выпрямления. Вытянутые и тонкие молекулы полиаминов при действии изнутри клетки также могут проходить через канал.
В целом, как и в случае блокады NMDA-каналов, действие блокаторов на АМРА- и каинатные каналы зависят от деталей механизма действия и по-разному проявляются в разных условиях. Это создает значительные трудности при попытках предсказать действие блокаторов в сложных физиологических и патологических условиях in vivo, опираясь на результаты экспериментов in vitro. Необходимо учитывать, как активность зависит от мембранного потенциала и от паттерна активации канала.
СТРОЕНИЕ САЙТОВ СВЯЗЫВАНИЯ КАНАЛОБЛОКАТОРОВ
Существенные различия в действии блокаторов на подтипы глутаматных рецепторов порождают вопрос о соответствующих различиях в строении сайта связывания вблизи селективного фильтра. При общности архитектуры каналов эти различия порождаются, главным образом, остатками N/Q/R сайта, что было неоднократно подтверждено исследованиями с использованием точечных мутаций. На связывание блокаторов также влияют остатки в М3 спирали и ряд остатков в М2 петле. Однако только для остатков N/Q/R сайта замены аминокислот приводят к изменениям в чувствительности, которые полностью или частично воспроизводят свойства каналов, для которых эти аминокислоты являются природными [74–76]. Почему присутствие остатка аспарагина обеспечивает чувствительность к компактным монокатионным блокаторам, а при замене на глутамин (который всего на одну метиленовую группу длиннее) эта чувствительность утрачивается? Почему более длинным остаткам глутамина соответствует более широкий просвет канала? Почему при более широком просвете канала в случае глутамина кальциевая проницаемость ниже?
Для решения этих парадоксов была предложена модель циклических водородных связей в N/Q/R сайте [14, 15, 77]. Согласно этой модели, терминальные аминогруппы боковых цепей в N/Q/R сайте образуют водородные связи со свободными карбонильными группами в соседней субъединице (рис. 4a). В этом случае более длинные боковые цепи остатков глутамина формируют цикл с большим диаметром, чем короткие остатки аспарагина. Ориентация карбонильных групп боковых цепей при этом оказывается различной. В случае остатков аспарагина они обращены в просвет канала и образуют катион-связывающее кольцо, обеспечивающее высокую кальциевую проницаемость и эффективное связывание аминогрупп блокаторов. А у остатков глутамина карбонильные группы боковых цепей ориентированы во вне поры и катион-связывающего кольца не образуют. Для эффективной блокады этих каналов необходимы более длинные молекулы с аминогруппой на конце. Эти аминогруппы проникают через достаточно широкий селективный фильтр и достигают более глубоких колец, которые, как и в калиевых каналах, образованы карбонильными группами главной цепи последующих остатков. На основании этих моделей были объяснены многие закономерности структурно-функциональных отношений в рядах каналоблокаторов [45, 78–80].
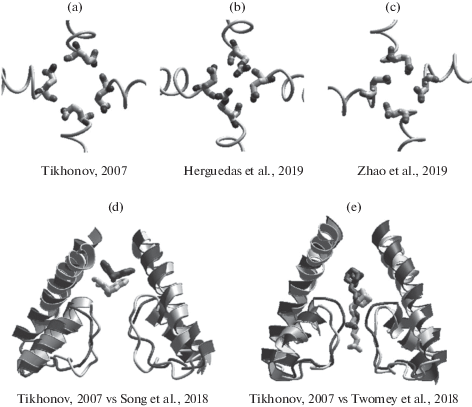
Рис. 4.
Строение N/Q/R сайта и связывание каналоблокаторов. (a) и (b), остатки N/Q/R сайта в модели АМРА-канала и в криоэлектронной структуре (PDB код 6qkc). (c), гомологичные N/Q/R сайту остатки в кальциевом канале (PDB код 6kzp). Вид в плоскости мембраны. Во всех структурах наличествует циклическая организация водородных связей. d и e, сравнение связывания МК-801 в канале NMDA-рецептора (d) и IEM-1460 в канале АМРА-рецептора (e) в модели (серый цвет) и в современных экспериментальных структурах (черный цвет) их комплексов с каналами (PDB коды 5un1 и 6dm0). Вид параллельный оси канала (сбоку).
Проверка данной гипотезы могла бы быть осуществлена за счет структур высокого разрешения, получаемых методами ренгеноструктурного анализа и криоэлектронной микроскопии. К сожалению, как уже упоминалось выше, даже современные структуры не дают точного ответа на вопрос о деталях строения N/Q/R сайта глутаматных рецепторов. Специфические водородные связи остатков в данном положении действительно обнаруживаются (рис. 4b, c) и в глутаматных каналах [27] и в других представителях семейства P-loop [81], но их точный характер продолжает оставаться предметом дискуссий и дальнейших структурных исследований. Что касается общих черт связывания каналоблокаторв, то в современных экспериментальных структурах [26, 82] они соответствуют более ранним предсказаниям, сделанным на основании анализа экспериментов с использованием точечных мутаций, структурно-функциональных отношений и их анализа при помощи компьютерного моделирования (рис. 4d, e).
ЗАКЛЮЧЕНИЕ
Современная фармакология располагает достаточно большим набором блокаторов ионных каналов ионотропных рецепторов глутамата, характеристики действия которых надежно изучены. Тем не менее, большинство каналоблокаторов не нашли практического применения в медицине. Основная причина в том, что блокада глутаматных рецепторов, осуществляющих основную возбуждающую передачу в ЦНС, сильно влияет на нормальные нейрофизиологические процессы и, следовательно, вызывают неприемлемые побочные эффекты. Классический пример – диссоциативные анестетики, являющиеся активными блокаторами NMDA-каналов. Одним из исключений является мемантин, который не вызывает серьезных побочных эффектов и используется для улучшения когнитивных способностей при болезни Альцгеймера и других нарушений [83]. Кетамин был первоначально разработан и использовался как анестетик, однако в последнее время считается перспективным как быстрый антидепрессант [84].
Несмотря на большое количество исследований остается неизвестным, какие особенности определяют специфику действия разных каналоблокаторов. Простой перенос данных, получаемых в экспериментах in vitro, на сложные переменные условия, в которых каналы глутаматных рецепторов работают in vivo в норме и патологии, не представляется возможным. Поэтому в последнее время значительное внимание исследователей уделяется изучению действия блокаторов каналов и иных лигандов в моделях различных состояний и процессов [53, 85–87], в том числе патологических. Данные исследования помогают выявить особенности действия фармакологических модуляторов глутаматергической передачи, которые могут обеспечить клиническую толерантность и эффективность.
Список литературы
Traynelis S.F., Wollmuth L.P., McBain C.J., Menniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J., Dingledine R. (2010) Glutamate receptor ion channels: structure, regulation, and function. Pharmacol. Rev. 62(3): 405–496. https://doi.org/10.1124/pr.109.002451
Hansen K.B., Yi F., Perszyk R.E., Furukawa H., Wollmuth L.P., Gibb A.J., Traynelis SF (2018) Structure, function, and allosteric modulation of NMDA receptors. J. Gen. Physiol. 150(8): 1081–1105. https://doi.org/10.1085/jgp.201812032
Tikhonov D.B., Zhorov B.S. (2020) The pore domain in glutamate-gated ion channels: Structure, drug binding and similarity with potassium channels. Bioch. Biophys. Biomembr. 1862(10): 183401. https://doi.org/10.1016/j.bbamem.2020.183401
Bennett J.A., Dingledine R. (1995) Topology profile for a glutamate receptor: three transmembrane domains and a channel-lining reentrant membrane loop. Neuron. 14(2): 373–384. https://doi.org/10.1016/0896-6273(95)90293-7
Hollmann M., Maron C., Heinemann S. (1994) N-glycosylation site tagging suggests a three transmembrane domain topology for the glutamate receptor GluR1. Neuron. 13(6): 1331–1343. https://doi.org/10.1016/0896-6273(94)90419-7
Kuner T., Wollmuth L.P., Karlin A., Seeburg P.H., Sakmann B. (1996) Structure of the NMDA receptor channel M2 segment inferred from the accessibility of substituted cysteines. Neuron. 17(2): 343–352. https://doi.org/10.1016/s0896-6273(00)80165-8
Laube B., Kuhse J., Betz H. (1998) Evidence for a tetrameric structure of recombinant NMDA receptors. J. Neurosci. 18(8): 2954–2961. https://doi.org/10.1523/JNEUROSCI.18-08-02954.1998
Mano I., Teichberg V.I. (1998) A tetrameric subunit stoichiometry for a glutamate receptor-channel complex. Neuroreport. 9(2): 327–331. https://doi.org/10.1097/00001756-199801260-00027
Panchenko V.A., Glasser C.R., Mayer M.L. (2001) Structural similarities between glutamate receptor channels and K(+) channels examined by scanning mutagenesis. J. Gen. Physiol. 117(4): 345–360. https://doi.org/10.1085/jgp.117.4.345
Rosenmund C., Stern-Bach Y., Stevens C.F. (1998) The tetrameric structure of a glutamate receptor channel. Science. 280(5369): 1596–1599. https://doi.org/10.1126/science.280.5369.1596
Wo Z.G., Oswald R.E. (1995) Unraveling the modular design of glutamate-gated ion channels. Trends Neurosci. 18(4): 161–168. https://doi.org/10.1016/0166-2236(95)93895-5
Zhorov B.S., Tikhonov D.B. (2004) Potassium, sodium, calcium and glutamate-gated channels: pore architecture and ligand action. J. Neurochem. 88(4): 782–799. https://doi.org/10.1111/j.1471-4159.2004.02261.x
Doyle D.A., Morais Cabral J., Pfuetzner R.A, Kuo A., Gulbis J.M., Cohen S.L., Chait B.T., MacKinnon R. (1998) The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science. 280(5360): 69–77. https://doi.org/10.1126/science.280.5360.69
Tikhonov D.B., Mellor J.R., Usherwood P.N., Magazanik L.G. (2002) Modeling of the pore domain of the GLUR1 channel: homology with K+ channel and binding of channel blockers. Biophys. J. 82(4): 1884–1893. https://doi.org/10.1016/S0006-3495(02)75538-0
Tikhonov D.B. (2007) Ion channels of glutamate receptors: structural modeling. Mol. Membr. Biol. 24(2): 135–147. https://doi.org/10.1080/09687860601008806
Kaczor A.A., Kijkowska-Murak U.A., Kronbach C., Unverferth K., Matosiuk D. (2009) Modeling of glutamate GluR6 receptor and its interactions with novel noncompetitive antagonists. J. Chem. Informat. Modeling. 49(4): 1094–1104. https://doi.org/10.1021/ci900033m
Kaczor A.A., Kijkowska-Murak U.A., Matosiuk D. (2008) Theoretical studies on the structure and symmetry of the transmembrane region of glutamatergic GluR5 receptor. J. Med. Chem. 51(13): 3765–3776. https://doi.org/0.1021/jm7011694
Sobolevsky A.I., Yelshansky M.V., Wollmuth L.P. (2003) Different gating mechanisms in glutamate receptor and K+ channels. J. Neurosci. 23(20): 7559–7568. https://doi.org/10.1523/JNEUROSCI.23-20-07559.2003
Sobolevsky A.I., Rooney L., Wollmuth L.P. (2002) Staggering of subunits in NMDAR channels. Biophys. J. 83(6): 3304–3314. https://doi.org/10.1016/S0006-3495(02)75331-9
Sobolevsky A.I., Beck C., Wollmuth L.P. (2002) Molecular rearrangements of the extracellular vestibule in NMDAR channels during gating. Neuron. 33(1): 75–85. https://doi.org/10.1016/s0896-6273(01)00560-8
Hoffmann J., Villmann C., Werner M., Hollmann M. (2006) Investigation via ion pore transplantation of the putative relationship between glutamate receptors and K+ channels. Mol. Cell. Neurosci. 33(4): 358–370. https://doi.org/10.1016/j.mcn.2006.08.004
Sobolevsky A.I., Rosconi M.P., Gouaux E. (2009) X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor. Nature. 462(7274): 745–756. https://doi.org/10.1038/nature08624
Yelshanskaya M.V., Li M., Sobolevsky A.I. (2014) Structure of an agonist-bound ionotropic glutamate receptor. Science. 345(6200): 1070–1074. https://doi.org/10.1126/science.1256508
Karakas E., Furukawa H. (2014) Crystal structure of a heterotetrameric NMDA receptor ion channel. Science. 344(6187): 992–997. https://doi.org/10.1126/science.1251915
Durr K.L., Chen L., Stein R.A., De Zorzi R., Folea I.M., Walz T., McHaourab H.S., Gouaux E. (2014) Structure and dynamics of AMPA receptor GluA2 in resting, pre-open, and desensitized states. Cell. 158(4): 778–792. https://doi.org/10.1016/j.cell.2014.07.023
Twomey E.C., Yelshanskaya M.V., Vassilevski A.A,. Sobolevsky A.I. (2018) Mechanisms of Channel Block in Calcium-Permeable AMPA Receptors. Neuron. 99(5): 956–968 e4. https://doi.org/10.1016/j.neuron.2018.07.027
Herguedas B., Watson J.F., Ho H., Cais O., Garcia-Nafria J., Greger I.H. (2019) Architecture of the heteromeric GluA1/2 AMPA receptor in complex with the auxiliary subunit TARP gamma8. Science. 364(6438) https://doi.org/10.1126/science.aav9011
Zhao Y., Chen S., Swensen A.C, Qian W.J., Gouaux E. (2019) Architecture and subunit arrangement of native AMPA receptors elucidated by cryo-EM. Science. 364(6438): 355–362. https://doi.org/10.1126/science.aaw8250
Phillips M.B., Nigam A., Johnson J.W. (2020) Interplay between Gating and Block of Ligand-Gated Ion Channels. Brain Sci. 10(12). https://doi.org/10.3390/brainsci10120928
Jiang Y., Lee A., Chen J., Cadene M., Chait B.T., MacKinnon R. (2002) The open pore conformation of potassium channels. Nature. 417(6888): 523–526. https://doi.org/10.1038/417523a
Chang H.R., Kuo C.C. (2008) The activation gate and gating mechanism of the NMDA receptor. J. Neurosci. 28(7): 1546–1556. https://doi.org/10.1523/JNEUROSCI.3485-07.2008
Zuo J., De Jager P.L., Takahashi K.A., Jiang W., Linden D.J, Heintz N. (1997) Neurodegeneration in Lurcher mice caused by mutation in delta2 glutamate receptor gene. Nature. 388(6644): 769–773. https://doi.org/10.1038/42009
Kashiwagi K., Masuko T., Nguyen C.D., Kuno T., Tanaka I., Igarashi K., Williams K. (2002) Channel blockers acting at N-methyl-D-aspartate receptors: differential effects of mutations in the vestibule and ion channel pore. Mol. Pharmacol. 61(3): 533–545. https://doi.org/10.1124/mol.61.3.533
Yuan H., Erreger K., Dravid S.M., Traynelis S.F. (2005) Conserved structural and functional control of N-methyl-D-aspartate receptor gating by transmembrane domain M3. J. Biol. Chem. 280(33): 29708–29716. https://doi.org/10.1074/jbc.M414215200
Sobolevsky A.I., Yelshansky M.V., Wollmuth L.P. (2005) State-dependent changes in the electrostatic potential in the pore of a GluR channel. Biophys. J. 88(1): 235–242. https://doi.org/10.1529/biophysj.104.049411
Berneche S., Roux B. (2005) A gate in the selectivity filter of potassium channels. Structure. 13(4): 591–600. https://doi.org/10.1016/j.str.2004.12.019
Liu Y., Jurman M.E., Yellen G. (1996) Dynamic rearrangement of the outer mouth of a K+ channel during gating. Neuron. 16(4):859–867. https://doi.org/10.1016/s0896-6273(00)80106-3
Cao E., Liao M., Cheng Y., Julius D. (2013) TRPV1 structures in distinct conformations reveal activation mechanisms. Nature. 504(7478): 113–118. https://doi.org/10.1038/nature12823
Chen S., Zhao Y., Wang Y., Shekhar M., Tajkhorshid E., Gouaux E. (2017) Activation and Desensitization Mechanism of AMPA Receptor-TARP Complex by Cryo-EM. Cell. 170(6): 1234–1246 e1214. https://doi.org/10.1016/j.cell.2017.07.045
Twomey E.C., Yelshanskaya M.V., Grassucci R.A., Frank J., Sobolevsky A.I. (2017) Channel opening and gating mechanism in AMPA-subtype glutamate receptors. Nature. 549(7670): 60–65. https://doi.org/10.1038/nature23479
MacDonald J.F., Bartlett M.C., Mody I., Pahapill P., Reynolds J.N., Salter M.W., Schneiderman J.H., Pennefather P.S. (1991) Actions of ketamine, phencyclidine and MK-801 on NMDA receptor currents in cultured mouse hippocampal neurones. J. Physiol. 432: 483–508. https://doi.org/10.1113/jphysiol.1991.sp018396
Bormann J. (1989) Memantine is a potent blocker of N-methyl-D-aspartate (NMDA) receptor channels. Eur. J. Pharmacol. 166(3): 591–592. https://doi.org/10.1016/0014-2999(89)90385-3
Kroemer R.T., Koutsilieri E., Hecht P., Liedl K.R., Riederer P., Kornhuber J. (1998) Quantitative analysis of the structural requirements for blockade of the N-methyl-D-aspartate receptor at the phencyclidine binding site. J. Med. Chem. 41(3): 393–400. https://doi.org/10.1021/jm9704412
Manallack D.T., Wong M.G., Costa M., Andrews P.R., Beart P.M. (1998) Receptor site topographies for phencyclidine-like and sigma drugs: predictions from quantitative conformational, electrostatic potential, and radioreceptor analyses. Mol. Pharmacol. 34(6): 863–879.
Bolshakov K.V., Kim K.H., Potapjeva N.N., Gmiro V.E., Tikhonov D.B., Usherwood P.N.R., Mellor I.R., Magazanik L.G. (2005) Design of antagonists for NMDA and AMPA receptors. Neuropharmacology. 49(2): 144–155. https://doi.org/10.1016/j.neuropharm.2005.02.007
Bolshakov K.V., Tikhonov D.B., Gmiro V.E, Magazanik L.G. (2000) Different arrangement of hydrophobic and nucleophilic components of channel binding sites in N-methyl-D-aspartate and AMPA receptors of rat brain is revealed by channel blockade. Neurosci. Lett. 291(2): 101–104. https://doi.org/10.1016/s0304-3940(00)01386-0
Brackley P.T., Bell D.R., Choi S.K., Nakanishi K., Usherwood P.N. (1993) Selective antagonism of native and cloned kainate and NMDA receptors by polyamine-containing toxins. J. Pharmacol. Exp. Ther. 266(3): 1573–1580.
Antonov S.M., Johnson J.W., Lukomskaya N.Y., Potapyeva N.N., Gmiro V.E., Magazanik L.G. (1995) Novel adamantane derivatives act as blockers of open ligand-gated channels and as anticonvulsants. Mol. Pharmacol. 47(3): 558–567.
Bolshakov V., Gapon S.A., Magazanik L.G. (1991) Different types of glutamate receptors in isolated and identified neurones of the mollusc Planorbarius corneus. J. Physiol. 439: 15–35. https://doi.org/10.1113/jphysiol.1991.sp018654
Tikhonov D.B., Magazanik L.G. (1998) Voltage dependence of open channel blockade: onset and offset rates. J. Membr. Biol. 161(1): 1–8. https://doi.org/10.1007/s002329900309
Nowak L., Bregestovski P., Ascher P., Herbet A., Prochiantz A. (1984) Magnesium gates glutamate-activated channels in mouse central neurones. Nature. 307(5950): 462–465. https://doi.org/10.1038/307462a0
Mayer M.L., Westbrook G.L., Guthrie P.B. (1984) Voltage-dependent block by Mg2+ of NMDA responses in spinal cord neurones. Nature. 309(5965): 261–263. https://doi.org/10.1038/309261a0
Kotermanski S.E., Johnson J.W. (2009) Mg2+ imparts NMDA receptor subtype selectivity to the Alzheimer’s drug memantine. J. Neurosci. 29(9): 2774–2779. https://doi.org/10.1523/JNEUROSCI.3703-08.2009
Nikolaev M.V., Magazanik L.G., Tikhonov D.B. (2012) Influence of external magnesium ions on the NMDA receptor channel block by different types of organic cations. Neuropharmacology. 62(5–6): 2078–2085. https://doi.org/10.1016/j.neuropharm.2011.12.029
Otton H.J., Lawson McLean A., Pannozzo M.A., Davies C.H., Wyllie D.J. (2011) Quantification of the Mg2+-induced potency shift of amantadine and memantine voltage-dependent block in human recombinant GluN1/GluN2A NMDARs. Neuropharmacology. 60(2–3): 388–396. https://doi.org/10.1016/j.neuropharm.2010.10.008
Blanpied T.A., Clarke R.J., Johnson J.W. (2005) Amantadine inhibits NMDA receptors by accelerating channel closure during channel block. J. Neurosci. 25(13): 3312–3322. https://doi.org/10.1523/JNEUROSCI.4262-04.2005
Sobolevsky A.I, Koshelev S.G., Khodorov B.I. (1999) Probing of NMDA channels with fast blockers. J. Neurosci. 19(24): 10611–10626. https://doi.org/10.1523/JNEUROSCI.19-24-10611.1999
Antonov S.M., Johnson J.W. (1996) Voltage-dependent interaction of open-channel blocking molecules with gating of NMDA receptors in rat cortical neurons. J. Physiol. 493 (Pt 2): 425–445. https://doi.org/10.1113/jphysiol.1996.sp021394
Benveniste M., Mayer M.L. (1995) Trapping of glutamate and glycine during open channel block of rat hippocampal neuron NMDA receptors by 9-aminoacridine. J. Physiol. 483 (Pt 2): 367–384. https://doi.org/10.1113/jphysiol.1995.sp020591
Barygin O.I., Gmiro V.E., Kim K.K., Magazanik L.G., Tikhonov D.B. (2009) Blockade of NMDA receptor channels by 9-aminoacridine and its derivatives. Neurosci. Lett. 451(1): 29–33. https://doi.org/10.1016/j.neulet.2008.12.036
Vorobjev V.S., Sharonova I.N. (1994) Tetrahydroaminoacridine blocks and prolongs NMDA receptor-mediated responses in a voltage-dependent manner. Eur. J. Pharmacol. 253(1–2): 1–8. https://doi.org/10.1016/0014-2999(94)90750-1
Bolshakov K.V., Gmiro V.E., Tikhonov D.B., Magazanik L.G. (2003) Determinants of trapping block of N-methyl-D-aspartate receptor channels. J. Neurochem. 87(1): 56–65. https://doi.org/10.1046/j.1471-4159.2003.01956.x
Mealing G.A., Lanthorn T.H., Small D.L., Murray R.J., Mattes K.C., Comas T.M., Morley P. (2001) Structural modifications to an N-methyl-D-aspartate receptor antagonist result in large differences in trapping block. J. Pharmacol. Exp. Ther. 297(3): 906–914.
Blanpied T.A., Boeckman F.A., Aizenman E., Johnson J.W. (1997) Trapping channel block of NMDA-activated responses by amantadine and memantine. J. Neurophysiol. 77(1): 309–323. https://doi.org/10.1152/jn.1997.77.1.309
Taverna F.A., Cameron B.R., Hampson D.L., Wang L.Y., MacDonald J.F. (1994) Sensitivity of AMPA receptors to pentobarbital. Eur. J. Pharmacol. 267(3): R3–5. https://doi.org/10.1016/0922-4106(94)90161-9
Yamakura T., Sakimura K., Mishina M., Shimoji K. (1995) The sensitivity of AMPA-selective glutamate receptor channels to pentobarbital is determined by a single amino acid residue of the alpha 2 subunit. FEBS Lett. 374(3): 412–414. https://doi.org/10.1016/0014-5793(95)01163-9
Tikhonov D.B., Samoilova M.V., Buldakova S.L., Gmiro V.E., Magazanik L.G. (2000) Voltage-dependent block of native AMPA receptor channels by dicationic compounds. Br. J. Pharmacol. 129(2): 265–274. https://doi.org/10.1038/sj.bjp.0703043
Magazanik L.G., Buldakova S.L., Samoilova M.V., Gmiro V.E., Mellor I.R., Usherwood P.N. (1997) Block of open channels of recombinant AMPA receptors and native AMPA/kainate receptors by adamantane derivatives. J. Physiol. 505 (Pt 3): 655–663. https://doi.org/10.1111/j.1469-7793.1997.655ba.x
Bahring R., Bowie D., Benveniste M., Mayer M.L. (1997) Permeation and block of rat GluR6 glutamate receptor channels by internal and external polyamines. J. Physiol. 502 (Pt 3): 575–589. https://doi.org/10.1111/j.1469-7793.1997.575bj.x
Bahring R., Mayer M.L. (1998) An analysis of philanthotoxin block for recombinant rat GluR6(Q) glutamate receptor channels. J. Physiol. 509 (Pt 3): 635–650. https://doi.org/10.1111/j.1469-7793.1998.635bm.x
Tikhonova T.B., Barygin O.I., Gmiro V.E., Tikhonov D.B., Magazanik L.G. (2008) Organic blockers escape from trapping in the AMPA receptor channels by leaking into the cytoplasm. Neuropharmacology. 54(4): 653–664. https://doi.org/10.1016/j.neuropharm.2007.11.014
Zaitsev A.V., Kim K.K., Fedorova I.M., Dorofeeva N.A., Magazanik L.G., Tikhonov D.B. (2011) Specific mechanism of use-dependent channel block of calcium-permeable AMPA receptors provides activity-dependent inhibition of glutamatergic neurotransmission. J. Physiol. 589(7): 1587–1601.
Bowie D. (2018) Polyamine-mediated channel block of ionotropic glutamate receptors and its regulation by auxiliary proteins. J. Biol. Chem. 293(48): 18789–18802. https://doi.org/10.1113/jphysiol.2011.204362
Ferrer-Montiel A.V., Sun W., Montal M. (1995) Molecular design of the N-methyl-D-aspartate receptor binding site for phencyclidine and dizolcipine. Proc. Natl. Acad. Sci. USA 92(17): 8021–8025. https://doi.org/10.1073/pnas.92.17.8021
Burnashev N., Schoepfer R., Monyer H., Ruppersberg J.P., Gunther W., Seeburg P.H., Sakmann B. (1992) Control by asparagine residues of calcium permeability and magnesium blockade in the NMDA receptor. Science. 257(5075): 1415–1419. https://doi.org/10.1126/science.1382314
Mori H., Masaki H., Yamakura T., Mishina M. (1992) Identification by mutagenesis of a Mg(2+)-block site of the NMDA receptor channel. Nature. 358(6388): 673–675. https://doi.org/10.1038/358673a0
Tikhonov D.B., Zhorov B.S., Magazanik L.G. (1999) Intersegment hydrogen bonds as possible structural determinants of the N/Q/R site in glutamate receptors. Biophys. J. 77(4): 1914–1926. https://doi.org/10.1016/S0006-3495(99)77033-5
Nelson J.K., Frølund S.U., Tikhonov D.B., Kristensen A.S., Strømgaard K. (2009) Synthesis and biological activity of argiotoxin 636 and analogues: selective antagonists for ionotropic glutamate receptors. Angew Chem. Int. Ed. Engl. 48(17): 3087–3091. https://doi.org/10.1002/anie.200805426
Andersen T.F., Tikhonov D.B., Bolcho U., Bolshakov K., Nelson J.K., Pluteanu F., Mellor I.R., Egebjerg J., Stromgaard K. (2006) Uncompetitive antagonism of AMPA receptors: Mechanistic insights from studies of polyamine toxin derivatives. J. Med. Chem. 49(18): 5414–5423. https://doi.org/10.1021/jm060606j
Franzyk H., Grzeskowiak J.W., Tikhonov D.B., Jaroszewski J.W., Mellor I.R. (2014) The Effects of Conformational Constraints in the Polyamine Moiety of Philanthotoxins on AMPAR Inhibition. ChemMedChem. 9(8): 1725–1731. https://doi.org/10.1002/cmdc.201402109
Zhao Y., Huang G., Wu Q., Wu K., Li R., Lei J., Pan X., Yan N. (2019) Cryo-EM structures of apo and antagonist-bound human Cav3.1. Nature. 576(7787): 492–497. https://doi.org/10.1038/s41586-019-1801-3
Song X., Jensen M.O., Jogini V., Stein R.A. Lee C.H., McHaourab H.S., Shaw D.E., Gouaux E. (2018) Mechanism of NMDA receptor channel block by MK-801 and memantine. Nature. 556(7702): 515–519. https://doi.org/10.1038/s41586-019-1801-3
Alam S., Lingenfelter K.S., Bender A.M., Lindsley C.W. (2017) Classics in Chemical Neuroscience: Memantine. ACS Chem. Neurosci. 8(9): 1823–1829. https://doi.org/10.1021/acschemneuro.7b00270
Wei Y., Chang L., Hashimoto K. (2020) A historical review of antidepressant effects of ketamine and its enantiomers. Pharmacol. Biochem. Behav. 190: 172870. https://doi.org/10.1016/j.pbb.2020.172870
Povysheva N.V., Johnson J.W. (2016) Effects of memantine on the excitation-inhibition balance in prefrontal cortex. Neurobiol. Disease. 96: 75–83. https://doi.org/10.1016/j.nbd.2016.08.006
Nikolaev M.V., Chizhov A.V., Tikhonov D.B. (2020) Molecular mechanisms of action determine inhibition of paroxysmal depolarizing shifts by NMDA receptor antagonists in rat cortical neurons. Neuropharmacology. 184: 108443. https://doi.org/
Malkin S.L., Kim K.K., Tikhonov D.B., Magazanik L.G., Zaitsev A.V. (2015) Statistical models suggest presence of two distinct subpopulations of miniature epscs in fast-spiking interneurons of rat prefrontal cortex. Neuroscience. 301: 508–519. https://doi.org/10.1016/j.neuroscience.2015.06.034
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


