Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 417-435
Структуры натриевых и кальциевых каналов с лигандами
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 McMaster University
Hamilton, Canada
* E-mail: zhorov@mcmaster.ca
Поступила в редакцию 08.01.2021
После доработки 25.01.2021
Принята к публикации 26.01.2021
Аннотация
Натриевые и кальциевые каналы играют фундаментальную роль в физиологии электровозбудимых клеток. Эти каналы являются мишенями для разнообразных природных токсинов, синтетических лекарственных веществ и инсектицидов. Генетические мутации в натриевых и кальциевых каналах сопряжены с такими наследственными заболеваниями, как сердечные аритмии, эпилепсия, миотонии, повышенная или пониженная чувствительность к боли. Неудивительно, что создание селективных модуляторов натриевых и кальциевых каналов является важной задачей нейрофармакологии. В последние годы опубликованы кристаллические и крио-электронно-микроскопические структуры натриевых и кальциевых каналов и их комплексов c токсинами и лекарственными веществами. В этих работах предложено структурное объяснение многочисленным экспериментальным данным, накопленным в предыдущие десятилетия. В настоящем обзоре рассмотрены комплексы натриевых и кальциевых каналов с токсинами и лекарственными веществами. Описаны некоторые компьютерные модели таких комплексов. Обсуждается возможная роль токонесущих катионов и мест их связывания в действии некоторых лигандов.
ВВЕДЕНИЕ
Потенциал-зависимые натриевые и кальциевые каналы играют фундаментальную роль в физиологии электровозбудимых клеток. Вход ионов натрия обеспечивает восходящую фазу потенциала действия. Вход ионов кальция запускает различные процессы, включая высвобождение нейромедиаторов, секрецию гормонов, транскрипцию генов, и формирование памяти. Эти каналы являются мишенями для различных природных токсинов [1], лекарственных и наркотических веществ [2, 3] и инсектицидов [4]. Геном человека кодирует 9 изоформ натриевых каналов (Nav1.x) и 10 изоформ кальциевых каналов (Cav1.x, Cav2.x, Cav3.x). Основной мишенью для лекарств и токсинов является α-субъединица, образованная полипептидной цепью из четырех гомологичных повторов (рис. 1a), создающих пору в мембране (рис. 1b, c), которая избирательно проницаема для соответствующих ионов. Каждый повтор содержит шесть трансмембранных спиральных сегментов (S1–S6), соединенных внеклеточными и внутриклеточными петлями. Внутренняя, выстилающая пору спираль (S6), наружная спираль (S5) и частично погруженная в мембрану внеклеточная петля (P) между S5 и S6 образуют сектор (четвертую часть) порового домена (ПД). Р-петля содержит нисходящую (P1) и восходящую (P2) спирали. Заместители между Р1 и Р2 вносят вклад в селективный фильтр.
Рис. 1.
Сайты связывания лигандов натриевых и кальциевых каналов. (a) Топология каналов (оранжевые сегменты в ПЧД и голубые сегменты в ПД). Римские цифры обозначают повторы в каналах эукариот (субъединиц в каналах прокариот). Стрелки указывают места связывания лигандов натриевых и кальциевых (красный шрифт) каналов. (b) Вид сбоку канала NavAb без двух субъединиц. Красные кружки обозначают С=О группы на границе внешней поры. Спирали окрашены как на (a). (c) Вид модели (b) из цитоплазмы. На панели (c) субъединицы I, II, III и IV показаны, соответственно, розовым, желтым, зеленым и серым цветом. Такими же цветами показаны повторы I, II, III и IV на рис. 2–6.
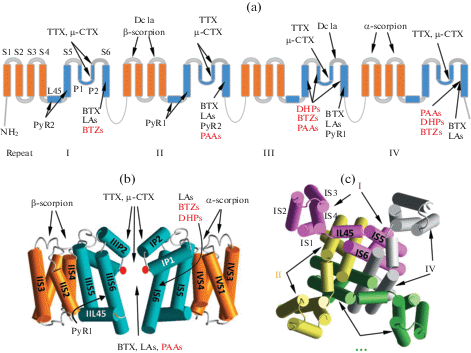
Трансмембранная топология α-субъединицы натриевых и α1-субъединицы кальциевых каналов идентична, и основные различия имеются во внеклеточной и цитоплазматических частях. В каждом повторе спирали S1–S4 образуют потенциал-чувствительный домен (ПЧД). Таким образом, α-субъединица имеет один ПД и четыре ПЧД. Непосредственно потенциал-чувствительными элементами являются спирали S4, содержащие положительно заряженные остатки аргинина или лизина. Селективный фильтр натриевых каналов образован заместителями Asp, Glu, Lys и Ala в повторах I, II, III и IV соответственно (кольцо DEKA). Второе, наружное кольцо EEDD образовано заместителями Glu, Glu, Asp и Asp в повторах I, II, III и IV соответственно. Селективный фильтр кальциевого канала образован четырьмя остатками глутамата (кольцо ЕЕЕЕ). Пора канала делится на две части, разделенные селективным фильтром: внешнюю пору, обращенную во внеклеточное пространство, и внутреннюю пору, которая в открытом канале соединена с цитоплазмой. Во внешней поре различают по крайней мере три сайта связывания токонесущих катионов: наружный сайт SI, сайт SII у селективного фильтра и сайт SIII на границе внешней и внутренней поры, образованный карбонильными группами основной цепи.
Натриевые и кальциевые каналы могут находиться в открытом, закрытом и нескольких инактивированных состояниях. В невозбужденной клетке мембрана гиперполяризована, спирали S4 электростатически притянуты к ее цитоплазме и ПД находится в закрытом состоянии. При деполяризации мембраны ПЧД переходят в энергетически предпочтительные состояния со спиралями S4, смещенными во внеклеточном направлении. Это смещение передается через линкеры S4–S5 (L45) к спиралям S5 и плотно прилегающим к ним спиралям S6. С-концевые половины последних расходятся так, что активационные ворота, образованные гидрофобными заместителями, открываются, и через пору внутрь клетки идет поток ионов. Через несколько миллисекунд после активации натриевый канал переходит в состояние быстрой инактивации благодаря тому, что трипептид IFМ в цитоплазматическом линкере между повторами III и IV связывается с гидрофобными заместителями спиралей IIIS5, IIIS6, IVS5 и IVS6. Трипептид IFM не блокирует пору [5], но смещает спирали IIIS6 и IVS6 так, что активационные ворота закрываются. При длительной деполяризации мембраны (сотни миллисекунд) натриевый канал переходит в состояние медленной инактивации, которая происходит за счет конформационных изменений вблизи селективного фильтра [6]. У кальциевых каналов наблюдаются потенциал-зависимая [7] и кальций-зависимая [8] инактивация.
Архитектура потенциал-зависимых кальциевых и натриевых каналов имеет много общего с калиевыми каналами, однако последние образованы четырьмя независимыми субъединицами. Все эти каналы относятся к суперсемейству Р-петлевых каналов, которое также включает ионотропные глутаматные рецепторы и другие тетрамерные каналы, имеющие общий фолдинг Р-петли. У всех этих каналов селективный фильтр находится в наружной поре между четырьмя Р-петлями.
В отсутствие трехмерных структур ионных каналов их взаимодействия с лекарствами и токсинами изучались с помощью таких методов, как анализ связи структура-активность лигандов, мутации белков и электрофизиологические измерения. Первая кристаллическая структура прокариотического калиевого канала KcsA, опубликованная в 1998 г. [9], показала общую архитектуру ПД у Р-петлевых каналов. За эту работу и последующие структурные исследования ионных каналов в 2003 г. Мак-Киннон получил Нобелевскую премию по химии. Первая кристаллическая структура бактериального потенциал-чувствительного канала NavAb опубликована в 2011 г. [10]. В 2015 г. опубликована первая крио-ЭМ структура эукариотического кальциевого канала [11]. За прошедшие четыре года опубликованы десятки кристаллических и крио-ЭМ структур Р-петлевых каналов с различными лекарственными веществами и токсинами. Ниже рассмотрены некоторые экспериментальные структуры и теоретическими модели натриевых и кальциевых каналов с лигандами.
1. НАТРИЕВЫЕ КАНАЛЫ
1.1. Тетродотоксин. Механизм действия ТТХ и STX рассмотрен в ряде обзоров, например [12, 13]. Исследования взаимодействий мутантов канала и производных TTX и STX позволили установить попарные контакты между химическими группами токсинов и заместителями в кольцах DEKA и EEDD внешней поры канала [14]. Используя эти данные, Lipkind и Fozzard предложили структурную модель рецепторов TTX и STX [15] за четыре года до публикации первой кристаллической структуры Р-петлевого канала КcsA [9]. В этой модели гуанидиновая группа TTX связывается с селективным фильтром, а гидроксильная группа образует Н-связь со вторым глутаматом кольца EEDD. При виде модели снаружи клетки повторы I, II, III и IV расположены по часовой стрелке. Это важное предсказание было подтверждено шесть лет спустя путем мутационного анализа парных взаимодействий остатков μ-конотоксина GIIIA и канала Nav1.4 [16]. Те же экспериментальные данные позднее были использованы для моделирования натриевых каналов с TTX и STX, основанного на кристаллических структурах калиевых каналов [17, 18]. При моделировании канала Nav1.4 с TTX, основанном на структуре канала NavAb, введены вставки-делеции в выровненные последовательности NavAb и Nav1.4 [19]. Сравнение с крио-ЭМ структурой канала NavPaS с TTX (рис. 2a) [11] показало, что модель [19] правильно предсказала общую ориентацию ТТХ в канале и конформации заместителей, образующих контакты с токсином [20].
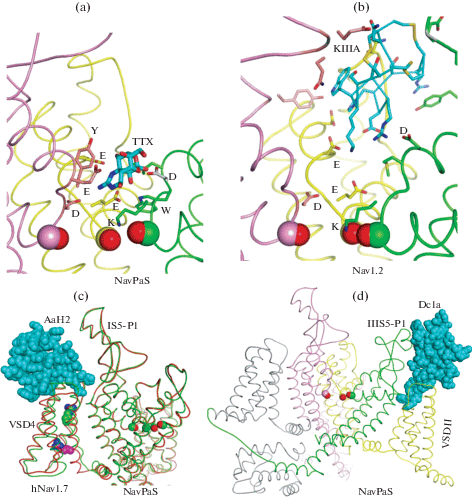
Рис. 2.
Крио-ЭМ структуры натриевых каналов с токсинами. C=O группы на границе внешней поры показаны сферами. (a) Канал NavPaS с ТТХ [30]. Сα атомы боковых цепей могут отклоняться от линий, обозначающих основные цепи. (b) μ-Конотоксин КIIIA в канале Nav1.2 связан со многими заместителями, в том числе двумя карбоксилатами кольца EEDD [29]. (c) Гибридный канал NavPaS/Nav1.7 без токсина (красные цепи) и в комплексе с α-токсином скорпиона АаН2, стабилизирующем деактивированное состояние ПЧД-4, в котором спираль IVS4, смещена к цитоплазме. Один из аргининов в IVS4 показан сферами. (d) Канал NavPaS с паучьим токсином Dc1a, стабилизирующем активированное состояние ПЧД-2 [31].
1.2. μ-Конотоксины. Модель рецептора ТТХ [19] использована для докинга пептидных токсинов GIIIA, PIIIA и KIIIA в канал Nav1.4 [21]. При докинге GIIIA использованы энергии парных взаимодействий между заместителями канала и токсина [22, 23]. В модели GIIIA связывается с карбоксилатами кольца EEDD, которые в отсутствие токсина взаимодействуют с ионами натрия [24]. В модели [21] энергии парных взаимодействий GIIIA с Nav1.4, а также глубины погружения остатков GIIIA во внешнюю пору коррелируют с экспериментальными данными [25].
Некоторые нативные и мутантные μ-конотоксины не полностью блокируют ток [25–27]. Согласно модели [21], токсины полностью блокируют ток, если их остатки Arg и Lys образуют солевые мостики со всеми карбоксилатами кольца EEDD. Токсины с малым числом остатков Arg и Lys образуют солевые мостики не со всеми карбоксилами кольца EEDD, и ионы натрия могут проходить через внешнюю пору, хотя медленнее, чем в канале без токсина. Парадоксальны данные, что TTX и KIIIA могут одновременно связываться с натриевым каналом [28]. Согласно модели [21], TTX может “обойти” связанный в канале KIIIA и достичь рецептора во внешней поре.
Опубликованная в 2019 г. крио-ЭМ структура канала Nav1.2 c KIIIA [29] (рис. 2b) лишь частично подтвердила модель [21]. Правильно предсказано связывание токсина между внеклеточными петлями повторов I, II и III, путь для ионов натрия между токсином и повтором IV, глубина погружения токсина во внешнюю пору и ряд специфических контактов токсина и канала. Однако в модели и крио-ЭМ структуре ориентации токсина отличаются. Причина в разном фолдинге наружной части внешней поры каналов Nav1.2 и NavAb. Последний был шаблоном для построения модели Nav1.4. Близкое сходство модели ТТХ:Nav1.4 с крио-ЭМ структурой ТТХ:NavPaS объясняется идентичным фолдингом этих каналов на уровне колец DEKA и EEDD.
1.3. Пептидные токсины из яда пауков и скорпионов. Многие их этих токсинов связываются с внеклеточными петлями ПЧД, являясь тонкими инструментами исследований потенциал-чувствительных каналов. α-Токсины скорпионов [32–34], пауков [35, 36] и морских анемонов [37] замедляют инактивацию, тогда как β-токсины скорпионов фиксируют ПЧД-2 в активированном состоянии, замедляя деактивацию канала [38–40]. Мутационные и электрофизиологические исследования позволили построить модели, в которых α-токсин LqhII связывается в ПЧД-4 между внеклеточными петлями IVS1–S2 и IVS3–S4 [32], а β-токсин CssIV связывается между петлями IIS1–S2 и IIS3–S4 в ПЧД-4 и петлей IIIP2–S6 в ПД [34].
В крио-ЭМ структуре гибридного канала hNav1.7/NavPaS с α-токсином из яда скорпиона АаН2 [41] последний связывается между внеклеточными петлями IVS1–S2, IVS3–S4 и IS5–P1, фиксируя ПЧД-4 в деактивированном состоянии (рис. 2c), которое энергетически невыгодно при отсутствии мембранного потенциала. Связывание токсина существенно смещает спираль IVS4 к цитоплазме (рис. 2c). При этом наблюдается значительное изменение геометрии петли IVS3–S4. Подобные перемещения спирали IIS4 видны при связывании гибридного канала NavAb/hNav1.7 с токсинами из яда пауков-птицеедов Pro-Tx2 [42] и m3-HwTx-IV [43], которые фиксируют ПЧД-2 в деактивированном состоянии.
В крио-ЭМ структуре канала NavPaS c паучьим токсином Dc1a [31] последний связывается между активированным ПЧД-2 и внеклеточной петлей IIIS5–P1, препятствуя деактивации канала и, таким образом, его нормальному гэйтингу (рис. 2d).
1.4. Низкомолекулярные блокаторы. Во внутренней поре связываются различные по структуре блокаторы, включая местные анестетики, противосудорожные и антиаритмические вещества. Катионные блокаторы включают лидокаин и объемные полужесткие молекулы, такие как кокаин и хинидин [44, 45]. Мутационный анализ показал, что рецептор этих веществ содержит фенилаланин в спирали IVS6 [46–48], остатки в спиралях IS6, IIIS6, IVS6 [49] и P1 [50], а также в кольце DEKA. Типичные противосудорожные средства, например, фенитоин и карбамазепин – это электронейтральные молекулы с ароматическими и полярными группами [51]. Несмотря на принципиально разные химические структуры, катионные и электронейтральные вещества имеют общую область связывания во внутренней поре [44, 52] и сходные механизмы действия [53, 54]. Модели канала Nav1.4 с катионным лидокаином и электронейтральным бензокаином позволили предположить, что последний связывается с ионом натрия в поре, который не имеет прямых контактов с каналом [55]. Полностью гидратированный ион натрия в кольце из четырех карбонильных групп (С=О) на границе внешней поры виден в кристаллической структуре прокариотического канала NavMs [56, 57] (рис. 3a).
Рис. 3.
Лиганды во внутренней поре натриевых каналов. (a) Кристаллическая структура (PDB ID:5hvx) прокариотического канала NavMs [57]. Ионы натрия показаны желтыми сферами. Один из ионов находится в электроотрицательном сайте SIII, образованном кольцом С=О групп на границе внешней поры. Боковые цепи заместителей T, V и F создают гидрофобную область во внутренней поре. (b) Схема связывания лигандов. Сайт SIII притягивает аммониевые группы катионных лигандов (верхний ряд) или ион натрия, который, в свою очередь, притягивает полярные группы электронейтральных лигандов (нижний ряд). Гидрофобная область во внутренней поре (серый прямоугольник) притягательна для гидрофобных групп лигандов. Воспроизведено с изменениями из [58]. (c) Модель связывания хинидина в канале Nav1.4 [58]. Аммониевая группа находится в сайте SIII, а гидрофобная группа связывается с фенилаланином в спирали IVS6. (d) Крио-ЭМ структура канала rNav1.5 c флекаинидом [62]. Аммониевая группа связывается в сайте SIII.
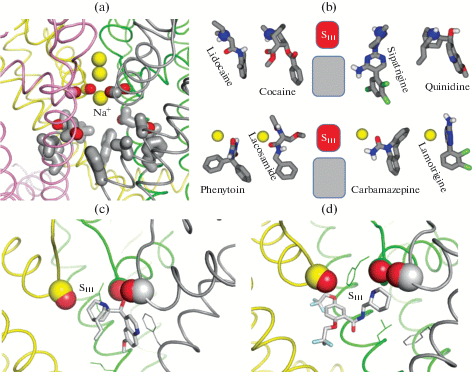
По результатам компьютерного докинга лигандов в основанную на NavMs модель Nav1.4 предложена схема общего рецептора катионных и электронейтральных блокатов, содержащая электроотрицательную и гидрофобную области (рис. 3b) [58]. Первая представляет собой вакантный сайт связывания иона натрия (SIII) а вторая образована фенилаланином в спирали IVS6 и другими гидрофобными группами внутренней поры. Аммониевая группа катионных блокаторов связывается с сайтом SIII, а полярные группы электронейтральных лигандов – с ионом натрия в сайте SIII. Связывание катионных лигандов с сайтом SIII показано в последующих расчетах методом молекулярной динамики [59, 60]. Аммониевая группа флекаинида в кристаллической структуре с каналом NavAb [61] и крио-ЭМ структуре с каналом hNav1.5 [62] также связывается с вакантным сайтом SIII (рис. 3c, d).
Другим примером электронейтральных блокаторов внутренней поры являются относительно новые инсектициды – метафлумизон, индоксакарб и его активный метаболит DCJW [63]. В модели открытого натриевого канала таракана эти соединения связываются во внутренней поре, взаимодействуют с ионом натрия в фокусе спиралей P1, выставляя ароматические группы в интерфейс III/IV [64]. Направляемый моделями мутагенез позволил выявить новые остатки, в том числе, специфичные для каналов насекомых [64].
В настоящее время отсутствуют экспериментальные подтверждения или опровержения модели связывания электронейтральных дигандов с ионом натрия в сайте SIII. Однако непрямое подтверждение этой концепции есть в работе [65], где отрицательно заряженные агонисты калиевых каналов связываются с ионом калия в месте, аналогичном сайту SIII в натриевых каналах.
1.5. Низкомолекулярные вещества в терапии натриевых каналопатий. Известны тысячи мутаций в каналах Nav1.х, которые связаны с различными заболеваниями [66, 67]. Такие мутации найдены во всех сегментах каналов [3, 11]. Для большинства мутаций атомные механизмы дисфункции канала неизвестны. При лечении многих каналопатий применяют лекарства [68, 69], в том числе описанные в разделе 1.4. Например, сердечные аритмии связаны с мутациями в канале Nav1.5. При лечении синдрома удлиненного интервала QT иногда используют блокаторы канала Nav1.5, включая ранолазин [70] и мексилетин [71]. Карбамазепин, фенитоин, ламотриджин и другие противосудорожные вещества, используемые при терапии эпилептических синдромов, подавляют повышенную возбудимость нейронов, которая связана с дисфункцией нейрональных каналов Nav1.1, Nav1.2, Nav1.3 или Nav1.6. Эти же или подобные вещества применяют для лечения мигрени (мутации в Nav1.1), каналопатий скелетных мышц (мутации в Nav1.4), повышенной или пониженной чувствительности к боли (мутации в Nav1.7, Nav1.8 или Nav1.9). Экспериментальные структуры и модели комплексов каналов с лигандами используют при разработке лекарств на этапах поиска и оптимизации структур потенциальных кандидатов. Так, in silico скрининг миллионов химических структур [72] используют при отборе молекул для последующего экспериментального тестирования. Возможное участие иона натрия в связывании электронейтральных лигандов (рис. 3b) означает, что модели каналов для компьютерного скрининга электронейтральных молекул должны включать ионы, которые часто не видны в структурах низкого разрешения. Перепрофилирование известных лекарств – еще один подход к лечению каналопатий. Такие лекарства не нуждаются в дорогостоящих тестах на токсичность и другие побочные эффекты, а их структурную комплементарность к известным рецепторам в ионных каналах можно проверить на компьютерных моделях.
1.6. Стероидные и синтетические агонисты. Природный стероидный агонист (активатор) натриевых каналов, батрахотоксин (BTX), много лет используется в электрофизиологических исследованиях. Считалось, что объемная стероидная молекула связывается на границе раздела канал–липид и аллостерически активирует канал. Однако заместители, мутации которых влияют на действие BTX, были обнаружены во всех четырех спиралях S6, частично перекрываясь с рецептором местных анестетиков [73]. Согласно расчетам, BTX и другие стероидные агонисты натриевых каналов (вератридин и аконитин) могут связываться во внутренней поре, предотвращать закрытие активационных ворот, но не препятствовать ионам натрия проходить между гидрофильными группами агониста и канала [74]. Модель предсказала остатки, связывающие BTX в поре, и эксперименты подтвердили этот прогноз [75–77]. Позднее были обнаружены дополнительные остатки в спиралях S6, чувствительные к BTX, и была разработана модель [78], в которой подковообразный BTX связывается с остатками во всех четырех повторах (рис. 4a). Ионы натрия могут проходить через гидрофильную внутреннюю поверхность подковы, в то время как объемная молекула BTX препятствует закрытию активационных ворот. В этом смысле модель ВТХ в канале напоминает хирургический стент в кровеносном сосуде. Недавние эксперименты с BTX в прокариотическом натриевом канале позволили сделать аналогичные выводы [79]. Это свидетельствует о том, что относительно простые каналы прокариот могут быть полезны в исследованиях веществ, действующих на эукариотические каналы.
Рис. 4.
Модели открытого натриевого канала с агонистами. (a) Вид из цитоплазмы на батрахотоксин (BTX) во внутренней поре. Показаны только средние части спиралей S5 и S6. Полупрозрачные поверхности спиралей и BTX окрашены серым и желтым соответственно. Оранжевый ион натрия взаимодействует с атомами кислорода BTX и остатком серина в IS6. Первоначально опубликовано в [78] © The American Society for Biochemistry and Molecular Biology. (b) Вид сбоку на поровый домен с двумя молекулами пиретроида дельтаметрина в рецепторах PyR1 и PyR2. Каждый лиганд связывается между четырьмя спиралями (L45, S5 и две S6). Спираль IIS6 вносит вклад как в PyR1, так и в PyR2. Первоначально опубликовано в [84]; воспроизведено с разрешения ASPET.

Вератридин (VTD) – токсичный стероидный алкалоид из семян некоторых растений – используется в электрофизиологических исследованиях. Мутации в спиралях IS6, IIIS6 и IVS6 влияют на действие VTD [80]. Эти данные использованы при построении модели, в которой VTD образует гидрофобные контакты с рядом заместителей в поре канала Nav1.4, включая F1579 в спирали IVS6 и F1236 (N-концевой сосед DEKA лизина), а ион натрия может проходить между полярными группами токсина и аспарагина N784 в спирали IIS6 [74]. Недавний мутационный и электрофизиологический анализ подтвердил связывание VTD в поре и образование контактов с F1579 и F1236. Упомянуто взаимодействие VTD с аспарагином N784, однако о мутирования этого остатка не сообщается. Такие данные были бы интересны, поскольку ВТХ блокирует канал Nav1.5 в котором гомологичный аспарагин замещен лизином [75].
Пиретроидные инсектициды (синтетические аналоги натуральных пиретринов, выделяемых из цветков ромашки пиретрума) являются избирательными агонистами натриевых каналов насекомых. Пиретроиды широко используют в борьбе с вредными членистоногими и комарами, переносящими малярию и лихорадку денге [81]. Интенсивное использование ДДТ (1,1,1-трихлор-2,2-бис(4-хлорфенилэтан)) и пиретроидов, привело к развитию устойчивости к этим инсектицидам у многих насекомых [4]. Этот факт стимулирует разработку новых инсектицидов. На основании экспериментальных данных построены модели натриевых каналов насекомых с двумя рецепторами пиретроидов (PyR1 и PyR2) в интерфейсах между липидами мембраны и повторами II/III и I/II соответственно [82–84]. Вероятно, для активации канала необходимо связывание лигандов как с PyR1, так и с PyR2 (рис. 4b). Также предложена модель связывания ДДТ в двух сайтах, которые перекрываются с PyR1 и PyR2 [85]. Направляемый моделями мутагенез позволил обнаружить новые остатки, чувствительные к пиретроидам и ДДТ [84, 85].
1.7. Пути доступа лигандов во внутреннюю пору. Многие лиганды попадают во внутреннюю пору натриевых каналов из цитоплазмы, и их эффект возрастает с числом и продолжительностью открытых состояний канала (частотно-зависимое действие). Однако такой путь исключен при тоническом блоке, когда уменьшенный ток наблюдается уже после первого импульса деполяризации мембраны. Анализ структурно-функциональных отношений местных анестетиков и родственных соединений позволил предположить, что некоторые соединения проникают в пору закрытого канала через гидрофобный путь, минуя цитоплазму [86]. Например, постоянно заряженные четвертичные соединения, которые не проходят сквозь мембрану, блокируют натриевые каналы сердца [87, 88]. На основании этих данных предложено, что гидрофобный путь проходит между спиралями IIIS6, IVS6 и IIIP [17]. “Протягивание” молекулы тетракаина между этими спиралями позволило построить модель тонического блока [89], при котором аммониевая группа лиганда блокирует ток, а его длинная часть остается в интерфейсе между спиралями IIIS6, IVS6 и IIIP (рис. 5a, b). В кристаллической структуре канала NavAb [10] видны широкие интерфейсы между спиралями Р1 и двумя соседними спиралями S6, которые могут служить гидрофобным путем для лигандов. В последующих кристаллических структурах натриевых каналов прокариот видны молекулы физиологически активных веществ, которые частично [61] или почти полностью [90] находятся в таких интерфейсах (рис. 5c, d).
Рис. 5.
Гидрофобный путь доступа лигандов в натриевый канал проходит через интерфейсы между повторами (субъединицами). (a, b) Виды снаружи клетки (a) и со стороны мембраны (b) на модель канала Nav1.5 с тетракаином в интерфейсе между повторами III и IV [89]. (c) Вид снаружи клетки на кристаллическую структуру канала NavMs с четырьмя молекулами каннабидиола в интерфейсах между субъединицами [90]. (d) Вид со стороны мембраны на эту же структуру (три лиганда удалены для ясности). На (c) и (d) не показаны ионы натрия во внешней поре, которые видны в кристаллической структуре.
2. ЛИГАНДЫ КАЛЬЦИЕВЫХ КАНАЛОВ
Фенилалкиламины, бензотиазепины и дигидропиридины используют при лечении сердечно-сосудистых заболеваний и в физиологических исследованиях. Ранее выявлены аминокислотные остатки канала Cav1.2, мутации которых влияют на действие этих веществ [91, 92]. Эти данные использованы для построения моделей канала Cav1.2 с лигандами [93–98]. Однако точность моделей, основанных на кристаллических структурах калиевых каналов, ограничена.
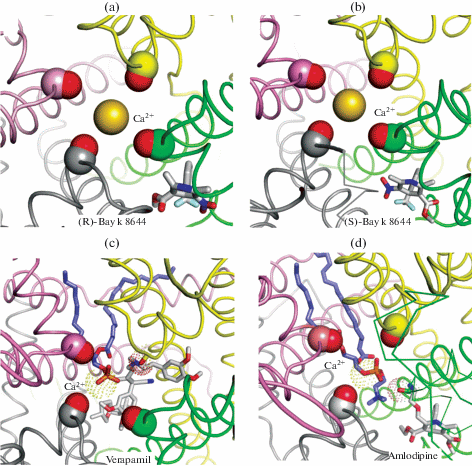
Интересным парадоксом в действии дигидропиридинов является тот факт, что энантиомеры (R)-Bay k 8644 и (S)-Bay k 8644 блокируют и активируют кальциевый канал соответственно [99]. Докинг дигидропиридинов в модель канала Cav1.2 позволил предположить, что антагонисты и агонисты связываются в интерфейсе III/IV и выставляют в пору канала гидрофобную и гидрофильную группу соответственно [96]. Подобные ориентации гидрофобной и гидрофильной групп видны в крио-ЭМ структурах канала Cav1.1 c (R)-Bay k 8644 и (S)-Bay k 8644 (рис. 6a, b) [100]. Однако в моделях лиганды находятся дальше от оси поры, чем в крио-ЭМ структурах, и ориентация дигидропиридинового кольца в моделях и крио-ЭМ структурах отличается.
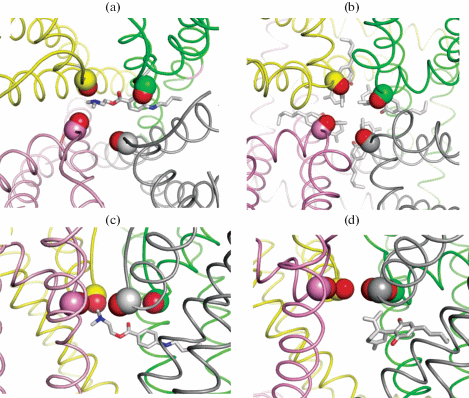
Рис. 6.
Вид снаружи клетки на крио-ЭМ структуры канала Cav1.1 с дигидропиридинами и верапамилом. (a) У антагониста (R)-Bay k 8644 (PDB: ID 7jpw) к поре приближена гидрофобная метокси группа. (b) У агонста (S)-Bay k 8644 (PDB ID: 7jpl) к поре приближена полярная нитро группа. У обоих лигандов эти группы не образуют контактов с аминокислотами, но могут воздействовать на вторую гидратную оболочку иона кальция во внутренней поре. (c, d) Аммониевые группы верапамила (c) и амлодипина (d) образуют солевые мостики с фосфатной группой липида (сиреневые углероды) у сайта SIII, где находится ион кальция (показан точками). Ближайшие к лигандам С=О группы сайта SIII также показаны точками для ясности.
В кристаллах канала CavAb с дигидропиридиновыми антагонистами нимодипином (PDB ID: 5kmf) и амлодипином (PDB ID: 5kmd) лиганды связываются в интерфейсе между субъединицами, у N-концов спиралей Р1 и S6, значительно смещая ион кальция в сайте SI по сравнению с положением в канале без дигидропиридинов [101]. Предполагается, что подобная деформация селективного фильтра объясняет аллостерический механизм модуляции кальциевых каналов дигидропиридинами [101].
Место связывания дигидропиридина UK59811 в канале CavAb зависит от его концентрации. При низкой концентрации UK59811 связывается там же, где другие антагонисты (PDB ID: 5kls). Однако при высокой концентрации UK59811 стерически блокирует пору, а его аммониевая группа находится у С-конца спирали Р1 (PDB ID: 5klg), вблизи вакантного сайта SIII. Кристаллическая структура CavAb с эфонидипином (PDB: ID 6juh) [102] является другим примером стерического блока канала производным дигидропиридина. Однако в этом комплексе у сайта SIII находится сложноэфирная группа, что энергетически невыгодно, а ближайший ион кальция находится в сайте SII. Не исключено, что при разрешении 3 Å ион кальция не виден в низкоафинном сайте SIII.
Подобная ситуация видна в кристаллической структуре канала CavAb с дилтиаземом (PDB ID: 6keb) [103], где лиганд стерически блокирует пору, но у сайта SIII находится его карбонильная группа, в то время как ближайший ион кальция виден в сайте SII. В крио-ЭМ структуре канала Cav1.1 дилтиазем имеет существенно иную ориентацию, чем в CavAb. Его аммониевая группа находится на оси поры, ниже сайта SIII (РDB ID: 6jpb) [104], а выше сайта SIII виден ион кальция. Известно по меньшей мере четырнадцать заместителей, мутации которых влияют на связывание бензотиазепинов [97]. В крио-ЭМ структуре четыре из них находятся пределах 5 Å от дилтиазема, а в модели [97] таких заместителей восемь. Одно из отличий в положениях лиганда в модели [97] и крио-ЭМ структуре состоит в ориентации метоксифенильного фрагмента: в крио-ЭМ структуре он приближается со стороны поры к интерфейсу I/IV, а в модели он глубоко проникает в интерфейс III/IV, где находятся четыре аминокислотных заместителя, мутации которых влияют на действие дилтиазема и его аналогов. Вероятно, этот интерфейс является частью гидрофобного пути для четвертичных аналогов дилтиазема, которые не могут проходить в пору со стороны цитоплазмы. Модель канала Cav1.2, построенная на основании кристаллической структуры канала NavAb, в которой производные дилтиазема ориентированы как в работе [97], объясняет действие фоточувствительного блокатора кальциевого канала [105].
В кристалле кальциевого канала CavAb с бром-верапамилом [101] лиганд принимает “горизонтальную” ориентацию, аммониевая группа приближается к иону кальция в сайте SIII (что энергетически невыгодно), а нитрильная группа, являющаяся неотъемлимой частью многих фенилалкиламинов [94], не образует специфических контактов с каналом. Наблюдаемая в кристалле ориентация лиганда больше согласутся с моделью, в которой сайт SIII заселен не ионом кальция, а молекулой воды [106].
В крио-ЭМ структурах канала Cav1.1 с верапамилом [104] (PDB ID: 6jpa) в области сайта SIII находятся ион кальция и фосфатная группа липида, образующая солевой мостик с аммониевой группой верапамила (рис. 6c). Аналогичное взаиморасположение у сайта SIII иона кальция, фосфатной группы липида и аммониевой группы лиганда (рис. 6c) видно в крио-ЭМ структурах канала Cav3.1 с селективным блокатором Z944 [107] (PDB ID: 6kzp) и канала Cav1.1 с амлодипином [100] (рис. 6d; PDB ID: 5kmd). И хотя последняя структура получена в нанодисках, которые в определенной мере имитируют физиологические условия, маловероятно, что в живой клетке липиды могут проникать столь глубоко в пору канала и принимать непосредственное участие в блокаде тока. Такой сценарий не согласуется с многочисленными данными о связи структуры и активности лигандов кальциевых каналов.
ЗАКЛЮЧЕНИЕ
Тетродотоксин, сакситоксин и пептидные токсины образуют множественные специфические контакты с каналами, и поэтому крио-ЭМ структуры, вероятно, близки таковым in vivo. Однако для низкомолекулярных лигандов возможны различные позы связывания [104]. Поэтому не исключены отличия экспериментальных структур и структур in vivo. Молекулы липидов и детергентов видны во многих кристаллических и крио-ЭМ структурах, однако в физиологических условиях связывание этих молекул в поре маловероятно: такие каналы не проводили бы ток.
Несмотря на сравнительно низкое разрешение и возможные артефакты, кристаллические и крио-ЭМ структуры значительно продвигают понимание механизмов действия лигандов в ионных каналах. Будущие структуры более высокого разрешения и основанные на них компьютерные модели лиганд-рецепторных комплексов будут способствовать созданию новых лекарственных веществ и инсектицидов.
Список литературы
Stevens M., Peigneur S., Tytgat J. (2011) Neurotoxins and their binding areas on voltage-gated sodium channels. Front. Pharmacol. 2: 71. https://doi.org/10.3389/fphar.2011.00071
Catterall W.A., Swanson T.M. (2015) Structural Basis for Pharmacology of Voltage-Gated Sodium and Calcium Channels. Mol. Pharmacol. 88: 141–150.https://doi.org/10.1124/mol.114.097659
Catterall W.A. (2014) Sodium channels, inherited epilepsy, and antiepileptic drugs. Annu. Rev. Pharmacol. Toxicol. 54: 317–338. https://doi.org/10.1146/annurev-pharmtox-011112-140232
Silver K.S., Du Y., Nomura Y., Oliveira E.E., Salgado V.L., Zhorov B.S., Dong K. (2014) Voltage-Gated Sodium Channels as Insecticide Targets. Adv. In. Insect. Phys. 46: 389–433. https://doi.org/10.1016/B978-0-12-417010-0.00005-7
Pan X., Li Z., Zhou Q., Shen H., Wu K., Huang X., Chen J., Zhang J., Zhu X., Lei J., Xiong W., Gong H., Xiao B., Yan N. (2018) Structure of the human voltage-gated sodium channel Nav1.4 in complex with beta1. Science. 362. https://doi.org/10.1126/science.aau2486
Chatterjee S., Vyas R., Chalamalasetti S.V., Sahu I.D., Clatot J., Wan X., Lorigan G.A., Deschenes I., Chakrapani S. (2018) The voltage-gated sodium channel pore exhibits conformational flexibility during slow inactivation. J. Gen. Physiol.150: 1333–1347. https://doi.org/10.1085/jgp.201812118
Stotz S.C., Jarvis S.E., Zamponi G.W. (2004) Functional roles of cytoplasmic loops and pore lining transmembrane helices in the voltage-dependent inactivation of HVA calcium channels. J. Physiol. 554: 263–273. https://doi.org/10.1113/jphysiol.2003.047068
Abderemane-Ali F., Findeisen F., Rossen N.D., Minor D.L., Jr. (2019) A Selectivity Filter Gate Controls Voltage-Gated Calcium Channel Calcium-Dependent Inactivation. Neuron. 101: 1134–1149 e1133. https://doi.org/10.1016/j.neuron.2019.01.011
Doyle D.A., Morais Cabral J., Pfuetzner R.A., Kuo A., Gulbis J.M., Cohen S.L., Chait B.T., MacKinnon R. (1998) The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science. 280: 69–77. https://doi.org/10.1126/science.280.5360.69
Payandeh J., Scheuer T., Zheng N., Catterall W.A. (2011) The crystal structure of a voltage-gated sodium channel. Nature. 475: 353–358. https://doi.org/10.1038/nature10238
Shen H., Zhou Q., Pan X., Li Z., Wu J., Yan N. (2017) Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science. 355. https://doi.org/10.1126/science.aal4326
Moczydlowski E.G. (2013) The molecular mystique of tetrodotoxin. Toxicon. 63: 165–183. https://doi.org/10.1016/j.toxicon.2012.11.026
Thottumkara A.P., Parsons W.H., Du Bois J. (2014) Saxitoxin. Angew. Chem. Int. Ed. Engl. 53: 5760–5784. https://doi.org/10.1002/anie.201308235
Terlau H., Heinemann S.H., Stuhmer W., Pusch M., Conti F., Imoto K., Numa S. (1991) Mapping the site of block by tetrodotoxin and saxitoxin of sodium channel II. FEBS Lett. 293: 93–96. https://doi.org/10.1016/0014-5793(91)81159-6
Lipkind G.M., Fozzard H.A. (1994) A structural model of the tetrodotoxin and saxitoxin binding site of the Na+ channel. Biophys. J. 66: 1–13. https://doi.org/10.1016/S0006-3495(94)80746-5
Dudley S.C., Jr., Chang N., Hall J., Lipkind G., Fozzard H.A., French R.J (2000) mu-conotoxin GIIIA interactions with the voltage-gated Na(+) channel predict a clockwise arrangement of the domains. J. Gen. Physiol. 116: 679–690. https://doi.org/10.1085/jgp.116.5.679
Tikhonov D.B., Zhorov B.S. (2005) Modeling P-loops domain of sodium channel: homology with potassium channels and interaction with ligands. Biophys. J. 88: 184–197. https://doi.org/10.1529/biophysj.104.048173
Lipkind G.M., Fozzard H.A. (2000) KcsA crystal structure as framework for a molecular model of the Na(+) channel pore. Biochemistry. 39: 8161–8170. https://doi.org/10.1021/bi000486w
Tikhonov D.B., Zhorov B.S. (2012) Architecture and pore block of eukaryotic voltage-gated sodium channels in view of NavAb bacterial sodium channel structure. Mol. Pharmacol. 82: 97–104. https://doi.org/10.1124/mol.112.078212
Tikhonov D.B., Zhorov B.S. (2018) Predicting Structural Details of the Sodium Channel Pore Basing on Animal Toxin Studies. Front. Pharmacol. 9: 880. https://doi.org/10.3389/fphar.2018.00880
Korkosh V.S., Zhorov B.S., Tikhonov D.B. (2014) Folding similarity of the outer pore region in prokaryotic and eukaryotic sodium channels revealed by docking of conotoxins GIIIA, PIIIA, and KIIIA in a NavAb-based model of Nav1.4. J. Gen. Physiol. 144: 231–244. https://doi.org/10.1085/jgp.201411226
Choudhary G., Aliste M.P., Tieleman D.P., French R.J., Dudley S.C., Jr. (2007) Docking of mu-conotoxin GIIIA in the sodium channel outer vestibule. Channels (Austin). 1: 344–352. https://doi.org/10.4161/chan.5112
Chang N.S, French R.J., Lipkind G.M., Fozzard H.A., Dudley S., Jr. (1998) Predominant interactions between mu-conotoxin Arg-13 and the skeletal muscle Na+ channel localized by mutant cycle analysis. Biochemistry. 37: 4407–4419. https://doi.org/10.1021/bi9724927
Khan A., Romantseva L., Lam A., Lipkind G., Fozzard H.A. (2002) Role of outer ring carboxylates of the rat skeletal muscle sodium channel pore in proton block. J. Physiol. 543: 71–84. https://doi.org/10.1113/jphysiol.2002.021014
McArthur J.R., Ostroumov V., Al-Sabi A., McMaster D., French R.J. (2011) Multiple, distributed interactions of mu-conotoxin PIIIA associated with broad targeting among voltage-gated sodium channels. Biochemistry. 50: 116–124. https://doi.org/10.1021/bi101316y
Wilson M.J., Yoshikami D., Azam L., Gajewiak J., Olivera B.M., Bulaj G., Zhang M.M. (2011) mu-Conotoxins that differentially block sodium channels NaV1.1 through 1.8 identify those responsible for action potentials in sciatic nerve. Proc. Natl. Acad. Sci. USA. 108: 10302–10307. https://doi.org/10.1073/pnas.1107027108
Hui K., Lipkind G., Fozzard H.A., French R.J. (2002) Electrostatic and steric contributions to block of the skeletal muscle sodium channel by mu-conotoxin. J. Gen. Physiol. 119: 45–54. https://doi.org/10.1085/jgp.119.1.45
Zhang M.M., McArthur J.R., Azam L., Bulaj G., Olivera B.M., French R.J., Yoshikami D. (2009) Synergistic and antagonistic interactions between tetrodotoxin and mu-conotoxin in blocking voltage-gated sodium channels. Channels (Austin). 3: 32–38.https://doi.org/10.4161/chan.3.1.7500
Pan X., Li Z., Huang X., Huang G., Gao S., Shen H., Liu L., Lei J., Yan N. (2019) Molecular basis for pore blockade of human Na(+) channel Nav1.2 by the mu-conotoxin KIIIA. Science. 363 :1309–1313. https://doi.org/10.1126/science.aaw2999
Shen H., Liu D., Wu K., Lei J., Yan N. (2019) Structures of human Nav1.7 channel in complex with auxiliary subunits and animal toxins. Science. 363: 1303–1308. https://doi.org/10.1126/science.aaw2493
Shen H., Li Z., Jiang Y., Pan X., Wu J., Cristofori-Armstrong B., Smith J.J., Chin Y.K.Y., Lei J., Zhou Q., King G.F., Yan N. (2018) Structural basis for the modulation of voltage-gated sodium channels by animal toxins. Science. 362. https://doi.org/10.1126/science.aau2596
Wang J., Yarov-Yarovoy V., Kahn. R, Gordon D., Gurevitz M., Scheuer T., Catterall WA (2011) Mapping the receptor site for alpha-scorpion toxins on a Na+ channel voltage sensor. Proc. Natl. Acad. Sci. USA. 108: 15426–15431. https://doi.org/10.1073/pnas.1112320108
Zhang J.Z., Yarov-Yarovoy V., Scheuer T., Karbat I., Cohen L., Gordon D., Gurevitz M., Catterall W.A. (2011) Structure-function map of the receptor site for beta-scorpion toxins in domain II of voltage-gated sodium channels. J. Biol. Chem. 286: 33641–33651. https://doi.org/10.1074/jbc.M111.282509
Zhang J.Z., Yarov-Yarovoy V., Scheuer T., Karbat I., Cohen L., Gordon D., Gurevitz M., Catterall W.A. (2012) Mapping the interaction site for a beta-scorpion toxin in the pore module of domain III of voltage-gated Na(+) channels. J. Biol. Chem. 287: 30719–30728. https://doi.org/10.1074/jbc.M112.370742
Bosmans F., Swartz K.J. (2010) Targeting voltage sensors in sodium channels with spider toxins. Trends Pharmacol. Sci. 31:175–182. https://doi.org/10.1016/j.tips.2009.12.007
Minassian N.A., Gibbs A., Shih A.Y., Liu Y., Neff R.A., Sutton S.W., Mirzadegan T., Connor J., Fellows R., Husovsky M., Nelson S., Hunter M.J., Flinspach M., Wickenden A.D. (2014) Analysis of the structural and molecular basis of voltage-sensitive sodium channel inhibition by the spider toxin huwentoxin-IV (mu-TRTX-Hh2a). J. Biol. Chem. 288: 22707–22720.https://doi.org/10.1074/jbc.M113.461392
Xiao Y., Blumenthal K., Cummins T.R. (2014) Gating-pore currents demonstrate selective and specific modulation of individual sodium channel voltage-sensors by biological toxins. Mol. Pharmacol. 86: 159–167. https://doi.org/10.1124/mol.114.092338
Thomsen W.J., Catterall W.A. (1989) Localization of the receptor site for alpha-scorpion toxins by antibody mapping: implications for sodium channel topology. Proc. Natl. Acad. Sci. USA. 86: 10161–10165. https://doi.org/10.1073/pnas.86.24.10161
Rogers J.C., Qu Y., Tanada T.N., Scheuer T., Catterall W.A. (1996) Molecular determinants of high affinity binding of alpha-scorpion toxin and sea anemone toxin in the S3–S4 extracellular loop in domain IV of the Na+ channel alpha subunit. J. Biol. Chem. 271: 15950–15962. https://doi.org/10.1074/jbc.271.27.15950
Cestele S., Yarov-Yarovoy V., Qu Y., Sampieri F., Scheuer T., Catterall W.A. (2006) Structure and function of the voltage sensor of sodium channels probed by a beta-scorpion toxin. J. Biol. Chem. 281: 21332–21344. https://doi.org/10.1074/jbc.M603814200
Clairfeuille T., Cloake A., Infield D.T., Llongueras J.P., Arthur C.P., Li Z.R., Jian Y., Martin-Eauclaire M.F., Bougis P.E., Ciferri C., Ahern C.A., Bosmans F., Hackos D.H., Rohou A., Payandeh J. (2019) Structural basis of alpha-scorpion toxin action on Nav channels. Science. 363. https://doi.org/10.1126/science.aav8573
Xu H., Li T., Rohou A., Arthur C.P., Tzakoniati F., Wong E., Estevez A., Kugel C., Franke Y., Chen J., Ciferri C., Hackos D.H., Koth C.M., Payandeh J. (2019) Structural Basis of Nav1.7 Inhibition by a Gating-Modifier Spider Toxin. Cell. 176:702–715 e714. https://doi.org/10.1016/j.cell.2018.12.018
Wisedchaisri G., Tonggu L. Gamal El-Din T.M., McCord E., Zheng N., Catterall W.A. (2020) Structural Basis for High-Affinity Trapping of the NaV1.7 Channel in Its Resting State by Tarantula Toxin. Mol. Cell. https://doi.org/10.1016/j.molcel.2020.10.039
Ragsdale D.S., McPhee J.C., Scheuer T., Catterall W.A. (1996) Common molecular determinants of local anesthetic, antiarrhythmic, and anticonvulsant block of voltage-gated Na+ channels. Proc. Natl. Acad. Sci.U S A. 93:9270–9275. https://doi.org/10.1073/pnas.93.17.9270
O'Leary M.E., Chahine M. (2002) Cocaine binds to a common site on open and inactivated human heart (Na(v)1.5) sodium channels. J. Physiol. 541: 701–716. https://doi.org/10.1113/jphysiol.2001.016139
Yarov-Yarovoy V., McPhee J.C., Idsvoog D., Pate C., Scheuer T., Catterall W.A. (2002) Role of amino acid residues in transmembrane segments IS6 and IIS6 of the Na+ channel alpha subunit in voltage-dependent gating and drug block. J. Biol. Chem. 277: 35393–35401. https://doi.org/10.1074/jbc.M206126200
Ragsdale D.S., McPhee J.C., Scheuer T., Catterall W.A. (1994) Molecular determinants of state-dependent block of Na+ channels by local anesthetics. Science. 265: 1724–1728. https://doi.org/10.1126/science.8085162
Ahern C.A., Eastwood A.L., Dougherty D.A., Horn R. (2008) Electrostatic contributions of aromatic residues in the local anesthetic receptor of voltage-gated sodium channels. Circ. Res. 102: 86–94. https://doi.org/10.1161/CIRCRESAHA.107.160663
Mike A., Lukacs P. (2010) The enigmatic drug binding site for sodium channel inhibitors. Curr. Mol. Pharmacol. 3: 129–144. https://doi.org/10.2174/1874467211003030129
Yamagishi T., Xiong W., Kondratiev A., Velez P., Mendez-Fitzwilliam A., Balser J.R., Marban E., Tomaselli G.F. (2009) Novel molecular determinants in the pore region of sodium channels regulate local anesthetic binding. Mol. Pharmacol. 76: 861–871. https://doi.org/10.1124/mol.109.055863
Liu G., Yarov-Yarovoy V., Nobbs M., Clare J.J., Scheuer T., Catterall W.A. (2003) Differential interactions of lamotrigine and related drugs with transmembrane segment IVS6 of voltage-gated sodium channels. Neuropharmacology. 44: 413–422. https://doi.org/10.1016/s0028-3908(02)00400-8
Kuo C.C. (1998) A common anticonvulsant binding site for phenytoin, carbamazepine, and lamotrigine in neuronal Na+ channels. Mol. Pharmacol. 54: 712–721.
Catterall W.A. (1987) Common modes of drug action on Na+ channels: local anesthetics, antiarrhythmics and anticonvulsants. Trends Pharmacol. Sci. 8: 57–65. https://doi.org/10.1016/0165-6147(87)90011-3
Catterall W.A. (2012) Voltage-gated sodium channels at 60: structure, function and pathophysiology. J. Physiol. 590: 2577–2589. https://doi.org/10.1113/jphysiol.2011.224204
Tikhonov D.B., Bruhova I., Zhorov B.S. (2006) Atomic determinants of state-dependent block of sodium channels by charged local anesthetics and benzocaine. FEBS Lett. 580: 6027–6032. https://doi.org/10.1016/j.febslet.2006.10.035
Naylor C.E., Bagneris C., DeCaen P.G., Sula A., Scaglione A., Clapham D.E., Wallace B.A. (2016) Molecular basis of ion permeability in a voltage-gated sodium channel. EMBO J. 35: 820–830. https://doi.org/10.15252/embj.201593285
Sula A., Booker J., Ng L.C., Naylor C.E., DeCaen P.G., Wallace B.A. (2017) The complete structure of an activated open sodium channel. Nat. Commun. 8: 14205. https://doi.org/10.1038/ncomms14205
Tikhonov D.B., Zhorov B.S. (2017) Mechanism of sodium channel block by local anesthetics, antiarrhythmics, and anticonvulsants. J. Gen. Physiol. 149:465–481. https://doi.org/10.1085/jgp.201611668
Nguyen P.T., DeMarco K.R., Vorobyov I., Clancy C.E., Yarov-Yarovoy V. (2019) Structural basis for antiarrhythmic drug interactions with the human cardiac sodium channel. Proc. Natl. Acad. Sci. USA. 116: 2945–2954. https://doi.org/10.1073/pnas.1817446116
Buyan A., Sun D., Corry B. (2018) Protonation state of inhibitors determines interaction sites within voltage-gated sodium channels. Proc. Natl. Acad. Sci. USA. 115: E3135–E3144. https://doi.org/10.1073/pnas.1714131115
Gamal El-Din T.M., Lenaeus M.J., Zheng N., Catterall W.A. (2018) Fenestrations control resting-state block of a voltage-gated sodium channel. Proc. Natl. Acad. Sci. U S A. 115: 13111–13116. https://doi.org/10.1073/pnas.1814928115
Jiang D., Shi H., Tonggu L., Gamal El-Din T.M., Lenaeus M.J., Zhao Y., Yoshioka C., Zheng N., Catterall W.A. (2020) Structure of the Cardiac Sodium Channel. Cell. 180: 122–134 e110. https://doi.org/10.1016/j.cell.2019.11.041
Silver K., Dong K., Zhorov B.S. (2017) Molecular Mechanism of Action and Selectivity of Sodium Ch annel Blocker Insecticides. Curr. Med. Chem. 24: 2912–2924. https://doi.org/10.2174/0929867323666161216143844
Zhang Y., Du Y., Jiang D., Behnke C., Nomura Y., Zhorov B.S., Dong K. (2016) The Receptor Site and Mechanism of Action of Sodium Channel Blocker Insecticides. J. Biol. Chem. 291: 20113–20124. https://doi.org/10.1074/jbc.M116.742056
Schewe M., Sun H., Mert U., Mackenzie A., Pike A.C.W., Schulz F., Constantin C., Vowinkel K.S., Conrad L.J., Kiper A.K., Gonzalez W., Musinszki M., Tegtmeier M., Pryde D.C., Belabed H., Nazare M., de Groot B.L., Decher N., Fakler B., Carpenter E.P., Tucker S.J., Baukrowitz T. (2019) A pharmacological master key mechanism that unlocks the selectivity filter gate in K(+) channels. Science. 363: 875–880. https://doi.org/10.1126/science.aav0569
Huang W., Liu M., Yan S.F., Yan N. (2017) Structure-based assessment of disease-related mutations in human voltage-gated sodium channels. Protein Cell. 8(6): 401–438. https://doi.org/10.1007/s13238-017-0372-z
Landrum M.J., Lee J.M., Benson M., Brown G.R., Chao C., Chitipiralla S., Gu B., Hart J., Hoffman D., Jang W., Karapetyan K., Katz K., Liu C., Maddipatla Z., Malheiro A., McDaniel K., Ovetsky M., Riley G., Zhou G., Holmes J.B., Kattman B.L., Maglott D.R. (2018) ClinVar: improving access to variant interpretations and supporting evidence. Nucleic Acids Res. 46: D1062–D1067. https://doi.org/10.1093/nar/gkx1153
Imbrici P., Liantonio A., Camerino G.M., De Bellis M., Camerino C., Mele A., Giustino A., Pierno S., De Luca A., Tricarico D., Desaphy J.F., Conte D. (2016) Therapeutic Approaches to Genetic Ion Channelopathies and Perspectives in Drug Discovery. Front. Pharmacol. 7: 121. https://doi.org/10.3389/fphar.2016.00121
El-Sherif N., Boutjdir M. (2015) Role of pharmacotherapy in cardiac ion channelopathies. Pharmacol. Ther. 155: 132–142.https://doi.org/10.1016/j.pharmthera.2015.09.002
Antzelevitch C., Burashnikov A., Sicouri S., Belardinelli L. (2011) Electrophysiologic basis for the antiarrhythmic actions of ranolazine. Heart Rhythm. 8: 1281–1290. https://doi.org/10.1016/j.hrthm.2011.03.045
Zhu W., Mazzanti A., Voelker T.L., Hou P., Moreno J.D., Angsutararux P., Naegle K.M., Priori S.G., Silva J.R. (2019) Predicting Patient Response to the Antiarrhythmic Mexiletine Based on Genetic Variation. Circ. Res. 124: 539–552. https://doi.org/10.1161/CIRCRESAHA.118.314050
Irwin J.J., Sterling T., Mysinger M.M., Bolstad E.S., Coleman R.G. (2012) ZINC: a free tool to discover chemistry for biology. J. Chem. Inf. Model. 52: 1757–1768. https://doi.org/10.1021/ci3001277
Wang S.Y., Wang G.K. (2003) Voltage-gated sodium channels as primary targets of diverse lipid-soluble neurotoxins. Cell Signal.15: 151–159. https://doi.org/10.1016/s0898-6568(02)00085-2
Tikhonov D.B., Zhorov B.S. (2005) Sodium channel activators: model of binding inside the pore and a possible mechanism of action. FEBS Lett. 579: 4207–4212. https://doi.org/10.1016/j.febslet.2005.07.017
Wang S.Y., Tikhonov D.B., Mitchell J., Zhorov B.S., Wang G.K. (2007) Irreversible block of cardiac mutant Na+ channels by batrachotoxin. Channels (Austin). 1: 179–188. https://doi.org/10.4161/chan.4437
Wang S.Y., Tikhonov D.B., Zhorov B.S., Mitchell J., Wang G.K. (2007) Serine-401 as a batrachotoxin- and local anesthetic-sensing residue in the human cardiac Na+ channel. Pflugers Arch. 454: 277–287. https://doi.org/10.1007/s00424-006-0202-2
Wang S.Y., Mitchell J., Tikhonov D.B., Zhorov B.S., Wang G.K (2006) How batrachotoxin modifies the sodium channel permeation pathway: computer modeling and site-directed mutagenesis. Mol. Pharmacol. 69: 788–795. https://doi.org/10.1124/mol.105.018200
Du Y., Garden D.P., Wang L., Zhorov B.S., Dong K. (2011) Identification of new batrachotoxin-sensing residues in segment IIIS6 of the sodium channel. J. Biol. Chem. 286: 13151–13160. https://doi.org/10.1074/jbc.M110.208496
Finol-Urdaneta R.K., McArthur J.R., Goldschen-Ohm M.P., Gaudet R., Tikhonov D.B., Zhorov B.S., French R.J. (2019) Batrachotoxin acts as a stent to hold open homotetrameric prokaryotic voltage-gated sodium channels. J. Gen. Physiol. 151: 186–199. https://doi.org/10.1085/jgp.201812278
Wang G.K., Wang S.Y. (2003) Veratridine block of rat skeletal muscle Nav1.4 sodium channels in the inner vestibule. J. Physiol. 548: 667–675. https://doi.org/10.1113/jphysiol.2002.035469
Dong K., Du Y., Rinkevich F., Nomura Y., Xu P., Wang L., Silver K., Zhorov B.S. (2014) Molecular biology of insect sodium channels and pyrethroid resistance. Insect Biochem. Mol. Biol. 50: 1–17. https://doi.org/10.1016/j.ibmb.2014.03.012
O'Reilly A.O., Khambay B.P., Williamson M.S., Field L.M., Wallace B.A., Davies T.G. (2006) Modelling insecticide-binding sites in the voltage-gated sodium channel. Biochem. J. 396: 255–263. https://doi.org/10.1042/BJ20051925
Du Y., Nomura Y., Satar G., Hu Z., Nauen R., He S.Y., Zhorov B.S., Dong K. (2013) Molecular evidence for dual pyrethroid-receptor sites on a mosquito sodium channel. Proc N.atl. Acad. Sci. U S A 110: 11785–11790. https://doi.org/10.1073/pnas.1305118110
Du Y., Nomura Y., Zhorov B.S., Dong K. (2015) Rotational symmetry of two pyrethroid receptor sites in the mosquito sodium channel. Mol. Pharmacol. 88: 273–280. https://doi.org/10.1124/mol.115.098707
Du Y., Nomura Y., Zhorov B.S., Dong K. (2016) Evidence for Dual Binding Sites for 1,1,1-Trichloro-2,2-bis(p-chlorophenyl)ethane (DDT) in Insect Sodium Channels. J. Biol. Chem. 291: 4638–4648. https://doi.org/10.1074/jbc.M115.678672
Hille B. (1977) Local anesthetics: hydrophilic and hydrophobic pathways for the drug-receptor reaction. J. Gen. Physiol. 69: 497–515. https://doi.org/10.1085/jgp.69.4.497
Alpert L.A., Fozzard H.A., Hanck D.A. Makielski J.C. (1989) Is there a second external lidocaine binding site on mammalian cardiac cells? Am. J. Physiol. 257: H79–84. https://doi.org/10.1152/ajpheart.1989.257.1.H79
Qu Y., Rogers J., Tanada T., Scheuer T., Catterall W.A. (1995) Molecular determinants of drug access to the receptor site for antiarrhythmic drugs in the cardiac Na+ channel. Proc. Natl. Acad. Sci. U S A. 92: 11839–11843. https://doi.org/10.1073/pnas.92.25.11839
Bruhova I., Tikhonov D.B., Zhorov B.S. (2008) Access and binding of local anesthetics in the closed sodium channel. Mol. Pharmaco. 74: 1033–1045. https://doi.org/10.1124/mol.108.049759
Sait L.G., Sula A., Ghovanloo M.R., Hollingworth D., Ruben P.C., Wallace B.A. (2020) Cannabidiol interactions with voltage-gated sodium channels. Elife. 9. 9: e58593.https://doi.org/10.7554/eLife.58593
Hockerman G.H., Peterson B.Z., Johnson B.D., Catterall W.A. (1997) Molecular determinants of drug binding and action on L-type calcium channels. Annu. Rev. Pharmacol. Toxicol. 37: 361–396.
Godfraind T. (2017) Discovery and Development of Calcium Channel Blockers. Front. Pharmacol. 8: 286. https://doi.org/10.3389/fphar.2017.00286
Cosconati S., Marinelli L., Lavecchia A., Novellino E. (2007) Characterizing the 1,4-dihydropyridines binding interactions in the L-type Ca2+ channel: model construction and docking calculations. J. Med. Chem. 50:1 504–1513. https://doi.org/10.1021/jm061245a
Cheng R.C., Tikhonov D.B., Zhorov B.S. (2009) Structural model for phenylalkylamine binding to L-type calcium channels. J. Biol. Chem. 284: 28332–28342. https://doi.org/10.1074/jbc.M109.027326
Lipkind G.M., Fozzard H.A. (2003) Molecular modeling of interactions of dihydropyridines and phenylalkylamines with the inner pore of the L-type Ca2+ channel. Mol. Pharmacol. 63: 499–511. https://doi.org/10.1124/mol.63.3.499
Tikhonov D.B., Zhorov B.S. (2009) Structural Model for Dihydropyridine Binding to L-type Calcium Channels. J. Biological Chemistry. 284: 9006–19017. https://doi.org/10.1074/jbc.M109.011296
Tikhonov D.B., Zhorov B.S. (2008) Molecular modeling of benzothiazepine binding in the L-type calcium channel. J. Biological Chemistry. 283: 17594–17604. https://doi.org/10.1074/jbc.M800141200
Li W., Shi G. (2019) How CaV1.2-bound verapamil blocks Ca(2+) influx into cardiomyocyte: Atomic level views. Pharmacol. Res. 139: 153–157. https://doi.org/10.1016/j.phrs.2018.11.017
Schramm M., Thomas G., Towart R., Franckowiak G. (1983) Novel dihydropyridines with positive inotropic action through activation of Ca2+ channels. Nature. 303: 535–537. https://doi.org/10.1038/303535a0
Gao S., Yan N. (2020) Structural Basis of the Modulation of the Voltage-Gated Calcium Ion Channel Cav 1.1 by Dihydropyridine Compounds*. Angew Chem Int. Ed. Engl. https://doi.org/10.1002/anie.202011793
Tang L., Gamal El-Din T.M., Swanson T.M., Pryde D.C., Scheuer T., Zheng N., Catterall W.A. (2016) Structural basis for inhibition of a voltage-gated Ca(2+) channel by Ca(2+) antagonist drugs. Nature. 537:.117–121. https://doi.org/10.1038/nature19102
Xu F., Xiong W., Huang Y., Shen J., Zhou D., Tang L. (2019) Structural basis for efonidipine block of a voltage-gated Ca(2+) channel. Biochem. Biophys. Res. Commun. 513: 631–634. https://doi.org/10.1016/j.bbrc.2019.03.176
Tang L., Gamal El-Din T.M., Lenaeus M.J., Zheng N., Catterall W.A. (2019) Structural Basis for Diltiazem Block of a Voltage-Gated Ca(2+) Channel. Mol. Pharmacol. 96: 485–492. https://doi.org/10.1124/mol.119.117531
Zhao Y., Huang G., Wu J., Wu Q., Gao S., Yan Z., Lei J., Yan N. (2019) Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca(2+) Channel. Cell. 177: 1495–1506 e1412. https://doi.org/10.1016/j.cell.2019.04.043
Fehrentz T., Huber F.M.E., Hartrampf N., Bruegmann T. Frank J.A., Fine N.H.F., Malan D., Danzl J.G., Tikhonov D.B., Sumser M., Sasse P., Hodson D.J., Zhorov B.S., Klocker N., Trauner D. (2018) Optical control of L-type Ca(2+) channels using a diltiazem photoswitch. Nat. Chem. Biol. 14:764–767. https://doi.org/10.1038/s41589-018-0090-8
Tikhonov D.B., Lin L., Yang D.S.C., Yuchi Z., Zhorov B.S. (2020) Phenylalkylamines in calcium channels: computational analysis of experimental structures. J. Comput Aided. Mol. Des. 34: 1157–1169. https://doi.org/10.1007/s10822-020-00330-0
Zhao Y., Huang G., Wu Q., Wu K., Li R., Lei J., Pan X., Yan N. (2019) Cryo-EM structures of apo and antagonist-bound human Cav3.1. Nature. 576: 492–497.https://doi.org/10.1038/s41586-019-1801-3
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


