Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 842-853
Ограничение двигательной активности и синтез белка в постуральных и локомоторных мышцах
С. П. Белова 1, *, С. А. Тыганов 1, Е. П. Мочалова 1, Б. С. Шенкман 1
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: Swetbell@mail.ru
Поступила в редакцию 05.02.2021
После доработки 12.02.2021
Принята к публикации 12.02.2021
Аннотация
В связи с урбанизацией, автоматизацией и механизацией труда, тяжелой эпидемиологической обстановкой и самоизоляцией у современного человека снижается уровень ежедневной физической активности. Цель исследования состояла в изучении влияния ограничения двигательной активности на процессы синтеза белка в постуральных и локомоторных мышцах. Проведен эксперимент с ограничением двигательной активности продолжительностью 21 день на крысах линии Вистар. Интенсивность синтеза белка и анаболические сигнальные пути исследовались на камбаловидной мышце (m. soleus), преимущественно состоящей из медленных волокон, и длинном разгибателе пальцев (m. EDL), преимущественно состоящим из быстрых волокон. Масса m. soleus и m. EDL была снижена, а достоверное снижение интенсивности синтеза белка наблюдалось только в m.EDL. Также наблюдалось снижение фосфорилирования S6 рибосомального белка только в быстрой мышце. При этом в m. soleus наблюдалось достоверное снижение фосфорилирования GSK3β в отличие от m. EDL. Кроме того, были изучены маркеры распада белка. В эксперименте наблюдалось снижение экспрессии MuRF-1 в m. soleus и Atrogin-1/MAFbx в m. EDL, а также рост экспрессии кальпаинов в m. soleus. Таким образом, атрофические процессы при ограничении активности в быстрой и медленной мышце определяются разными сигнальными механизмами.
Скелетные мышцы образованы “медленными” (I тип) и “быстрыми” (II тип) волокнами, которые располагаются мозаичным образом и различаются функциональными свойствами [1]. Мышцы с преобладанием медленных волокон активны при работе низкой интенсивности и большой продолжительности, например, при поддержании позы (постуральные мышцы). Быстрые мышцы участвуют в действиях высокой интенсивности и короткой продолжительности (локомоторные мышцы). Недостаток нагрузки на скелетные мышцы при космическом полете или вывешивании (модель функциональной разгрузки постуральных мышц) оказывает значительное влияние на механические, биохимические и морфологические свойства мышц. Длительная разгрузка вызывает атрофию всех типов волокон, в большей степени медленных волокон I типа, сдвиг миозинового фенотипа в сторону быстрых волокон, усиление протеолиза и снижение синтеза белка. Эти эффекты при разгрузке хорошо выражены в медленных мышцах.
Для изучения функциональной разгрузки скелетных мышц существуют также подходы, при которых изучается не полная механическая разгрузка тех или иных групп мышц, а частичное снижение мышечной активности. Так, проводились эксперименты, в которых испытуемые снижают количество ежедневной ходьбы (при этом каждый шаг измеряется с помощью шагомера) до минимальных значений (750–5000 шагов) [2, 3]. Нижний порог количества шагов (~750) примерно соответствует активности амбулаторных больных [4]. Снижение физической активности до таких низких значений не приводит к полной мышечной разгрузке, однако имеет серьезные физиологические последствия [3]. Ограничение подвижности на 91% (с 13054 до 1192 шагов в день) снижает синтез белка в волокнах скелетных мышц на 22% [5]. Физиологические последствия даже коротких периодов снижения активности с помощью модели SR приводят к снижению силы и массы скелетных мышц, а также к снижению инсулиновой чувствительности. Снижение количества шагов до <1500 в день в течение двух недель приводит к снижению максимального потребления кислорода [2], существенному снижению максимальной произвольной силы нижних конечностей [6, 7].
В работе Козловской и соавт. было показано, что макаки-резусы в условиях космического полета при нахождении в капсуле демонстрируют значительное снижение размеров волокон локомоторной мышцы m. vastus lateralis, которое также наблюдалось и при нахождении животных в этой капсуле на земле, в то время как размеры волокон медленной m. soleus снижались только при полете [8, 9]. Из этого следует, что данный эффект связан не только с невесомостью, но и с ограничением двигательной активности в космической капсуле. При ограничении двигательной активности сохраняется необходимость в поддержании позы, следовательно, медленные мышцы не инактивируются полностью, в то время как работа быстрых мышц минимальна. Проведенные раннее эксперименты показывают, что ограничение двигательной активности безусловно оказывает большое влияние на состояние скелетной мышцы. Однако в литературе отсутствуют данные о молекулярных механизмах, контролирующих эти изменения. В связи с этим, цель данного исследования заключалась в исследовании особенностей анаболического и катаболического сигналинга постуральных и локомоторных мышц в ответ на ограничение двигательной активности.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные и ограничение двигательной активности. Был проведен эксперимент с моделированием ограниченной двигательной активности [10] продолжительностью 21 день на крысах линии Вистар. Для выполнения эксперимента 16 крыс в возрасте 10 нед. и массой 200–220 г были распределены на 2 группы по 8 животных в каждой. Контрольная группа (С) содержалась в индивидуальных клетках (30.0 × 40.0 см, 34 см высотой) в течение 21 сут; группа крыс, двигательная активность которой была ограничена (R), содержалась в маленьких клетках (17.0 × 9.6 см и 13.0 см в высоту) также 21 сут. Величина перемещений животных с ограничением двигательной активности, согласно данным Ishihara, составляет 0.5% от дистанции перемещений крыс, содержащихся в больших клетках [10]. Все животные имели неограниченный доступ к еде и воде на всем протяжении эксперимента. По окончании эксперимента крысы анестезировались внутрибрюшинной инъекцией трибромэтанола (240 мг/кг), затем выделялась камбаловидная мышца (m. soleus) и длинный разгибатель пальцев (m. EDL). Животных забивали введением летальной дозы трибромэтанола (480 мг/кг). Все процедуры с животными одобрены Комиссией по биомедицинской этике Института медико-биологических проблем РАН (протокол № 508 от 7 мая 2019 г.).
Интенсивность синтеза белка. Для определения общего синтеза белка применялась методика SUnSET [11]. За полчаса до введения наркоза животным вводили внутрибрюшинно 500 мкл 0.8%-ного раствора пуромицина, который ингибирует рост полипептидной цепи на рибосоме. При этом содержание пуромицина в скелетной мышце коррелирует с интенсивностью синтеза белка. Включение пуромициновой метки оценивалось с помощью вестерн-блоттинга.
Содержание анаболических маркеров методом вестерн-блоттинга. С каждого образца m. soleus и m. EDL были сделаны срезы толщиной 20 мкм (10–15 мг) на микротоме и немедленно прогомогенизированы в течение 25 мин в 100 мкл лизирующего буфера RIPA, содержащего (в мМ) 50 Tris (pH 7.4), 150 NaCl, 0.1% Triton X-100, 0.1% SDS, 5 EDTA (pH 8.0) 1 DTT, 1 PMSF, 1 Na3VO4, 1 PMSF, апротинин (10 мкг/мл), леупептин (10 мкг/мл), пепстатин А (10 мкг/мл), протеазный ингибиторный коктейль и фосфатазный ингибиторный коктейль. Затем образцы центрифугировали при 12 000 g в течение 15 мин. После этого отбирали супернатант и определяли концентрацию белка на планшетном спектрофотометре Epoch (Bio-Tek Instruments, США), измеряя поглощение при длине волны 595нм.
Для проведения электрофореза с последующим вестерн-блоттингом мышечные лизаты разводили в 2-кратном Laemly буфере для образцов, содержащем 5.4 мМ Tris-HCl (pH 6.8), 4% Ds-Na, 20% глицерина, 10% β-меркаптоэтанола, 0.02% бромфенолового синего. Электрофорез проводили в 5%-ном концентрирующем ПААГ (0.2% метилбисакриламида, 0.1% Ds-Na, 125 мМ Tris-HCl (pH 6.8), 0.05% аммония персульфата, 0.1% ТЕМЕД) и в 10%-ном разделяющем полиакриламидном геле (ПААГ) (0.2% метилбисакриламида, 0.1% Ds-Na, 375 мМ Tris-HCl (pH 8.8), 0.05% персульфата аммония, 0.1% ТЕМЕД). Для проведения электрофореза использовали трис-глициновый буфер (192 мМ Tris-глицина (pH 8.6), 0.1% Ds-Na). Образцы загружали из расчета 20 мкг общего белка в каждой пробе на дорожку и нормировали относительно уровня Gap dh, содержащегося в той же пробе.
Электрофорез проводили при 15 мА на гель в мини-системе (Bio-Rad Laboratories) при комнатной температуре. Электроперенос белков проводился в буфере (25 мМ Tris (pH 8.3), 192 мМ глицина, 20% этанола, 0.04% Ds-Na) на нитроцеллюлозную мембрану при 100 V и температуре 4°C в течение 2 ч. После электропереноса мембраны инкубировали в течение 5 мин в 0.3%-ном растворе Ponceau Red в 5%-ной уксусной кислоте, затем отмывали в PBS (Биолот) с 0.1%-ным Tween 20 (PBST) до появления четких белковых полос на мембране. Этот этап проводился для контроля эффективности переноса. Мембраны блокировали в 5%-ном растворе сухого молока в PBST при комнатной температуре в течение 1 ч, затем помещали в раствор первичных антител на ночь при 4°С. Для выявления белковых полос использовали первичные антитела против p-Akt(Ser473) (1 : 1000), Akt (1 : 1000), p-GSK-3β (Ser9) (1 : 1000), GSK-3β (1 : 2000), p-eEF2(Thr56) (1 : 1000), eEF2 (1 : 2000), S6-белку (1 : 2000), pS6(Ser240/ Ser244) (1 : 1000) фирмы Cell Signaling (США), p-p70S6K(Thr389) (1 :1 000), p70S6K (1 : 1000) фирмы Santa Cruz Biotechology (США) и пуромицина фирмы MERCK (США). Затем мембрану отмывали от первичных антител в PBST 3 раза по 5 мин на шейкере и инкубировали 1 ч с вторичными антителами goat-anti-rabbit (1: 30 000; Jackson Immuno Research, США) и goat-anti-mouse (1 : 20 000; Bio-Rad Laboratories, США). Далее мембрану отмывали от вторичных антител в PBST 3 раза по 5 мин на шейкере. Выявление проводили с помощью ECL Clarity HRP substrate (Bio-Rad Laboratories, США), хемилюминесцентный сигнал детектировали с помощью сканера C-DiGit Blot Scanner (LI-COR, США). Белковые полосы анализировали с использованием Image Studio Software (LI-COR).
Анализ экспрессии генов. Тотальную РНК выделяли из 6 мг m. soleus и m. EDL при помощи RNeasy Micro Kit фирмы QIAGEN. Для обратной транскрипции использовали 1 мкг РНК, олиго(dT)15, гексануклеотиды d(N)6, обратную транскриптазу MMLV. Обратную транскрипцию проводили при 37°C в течение 60 мин согласно стандартному протоколу. ПЦР в реальном времени проводили с использованием интеркалирующего красителя SYBR Green I. Использовали следующие праймеры: 5'-gccaatttggtgctttttgt-3' и 5'-aaattcagtcctctccccgt-3' для MuRF-1, 5'-ctacgatgttgcagccaaga-3' и 5'-ggcagtcgagaagtccagtc-3' для Atrogin-1/MAFbx, 5'-catggctaagagcaggaagg-3' и 5'-cgaagtctgcaggtctaggg-3' для кальпаина-1.
Статистическая обработка. Достоверность отличий между группами определялась с помощью непараметрического критерия Манна–Уитни. Результаты анализа относительного содержания белков с помощью вестерн-блоттинга представлены в виде среднего значения и ошибки среднего. Рядом с гистограммами содержания белков представлены фрагменты анализируемых изображений, полученных с помощью блот-сканера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса мышц и животных. Масса животных достоверно не различалась между группами (табл. 1). При этом масса m. soleus и m. EDL достоверно снизилась в группе с ограничением двигательной активности.
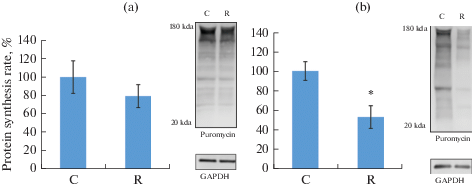
Интенсивность синтеза белка. В группе ограничения двигательной активности интенсивность синтеза белка была достоверно снижена на 47% в m. EDL, в то время как в медленной m. soleus снижение не было статистически значимым (рис. 1).
Рис. 1.
Интенсивность синтеза белка в m. soleus (a) и m. EDL (b) при ограничении двигательной активности. * – достоверное отличие от контроля (p < 0.05).
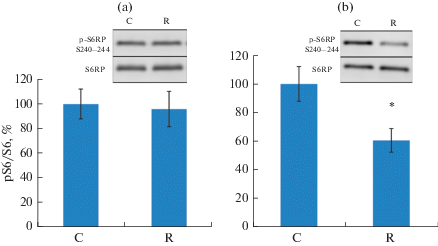
Маркеры активности анаболических сигнальных путей. Уровень фосфорилирования маркера активности mTORC1 – рибосомальной киназы p70 (p70S6k) – в группе с ограничением двигательной активности достоверно не отличался от контроля ни в m. soleus, ни в m. EDL (рис. 2), фосфорилирование Akt (Ser473) также не изменялось. При этом фосфорилирование по Ser240/244 рибосомального белка S6 (rpS6), являющегося субстратом p70S6k, в группе ограничения активности было достоверно снижено только в m. EDL (рис. 3).
Рис. 2.
Уровень фосфорилирования P70 в m. soleus (a) и m. EDL (b) при ограничении двигательной активности в течение 21 сут.
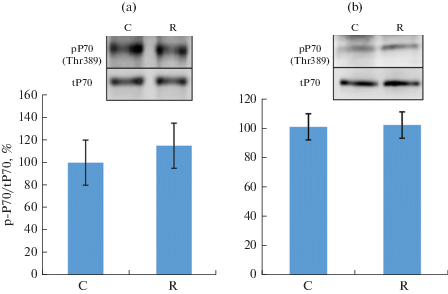
Рис. 3.
Уровень фосфорилирования rpS6 в m. soleus (a) и m. EDL (b) при ограничении двигательной активности в течение 21 сут. * – достоверное отличие от контроля, p ≤ 0.05.
Несмотря на отсутствие изменений в уровне фосфорилирования Akt, фосфорилирование киназы гликогенсинтазы GSK3β снижалось при ограничении двигательной активности, причем только в медленной m. soleus (рис. 4). Содержание фосфорилированной eEF2 увеличивалось в m. EDL, однако в медленной m. soleus наблюдалось снижение фосфорилирования eEF2 (рис. 5).
Рис. 4.
Уровень фосфорилирования GSK3β в m. soleus (a) и m. EDL (b) при ограничении двигательной активности в течение 21 сут. * – достоверное отличие от контроля, p ≤ 0.05.
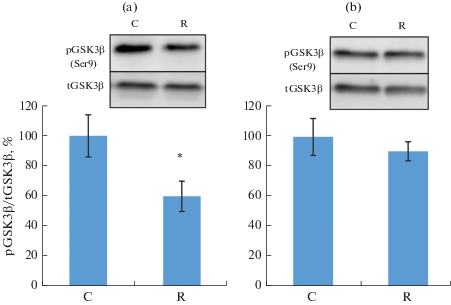
Рис. 5.
Уровень фосфорилирования eEF2 в m. soleus (a) и m. EDL (b) при ограничении двигательной активности в течение 21 сут. * – достоверное отличие от контроля, p ≤ 0.05.

Маркеры катаболических сигнальных путей. Мышечноспецифические E3-убиквитинлигазы MuRF-1 и Atrogin-1/MAFbx являются ключевыми компонентами убиквитин-протеасомной системы, экспрессия которых увеличивается в m. soleus уже на первые сутки функциональной разгрузки [12]. В нашем исследовании увеличения экспрессии MuRF-1 и Atrogin-1/MAFbx не наблюдалось, причем MuRF-1 в m. soleus и Atrogin-1/MAFbx в m. EDL были даже снижены относительно контрольных значений (табл. 2). При этом экспрессия цистеиновой протеазы кальпаина-1 увеличивалась только в m. soleus (табл. 2).
Таблица 2.
Экспрессия маркеров катаболических сигнальных путей
| МАРКЕРЫ | m. soleus | m. EDL | ||
|---|---|---|---|---|
| C | R | C | R | |
| MuRF-1 | 100 (90.5–132.1) | 83.8 (74.8–85.1)* | 100 (88.8–110.8) | 91.8 (87.3–98.7) |
| Atrogin-1/MAFbx | 100 (89.3–120.0) | 118 (108.1–134.1) | 100 (93.7–102.6) | 71.1 (64.1–80.6)* |
| Calpain-1 | 100 (97.1–108.7) | 118.9 (113.5–122.3)* | 100 (93.5–111.8) | 105.6 (99.4–110.3) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Развитие атрофии – сложный многостадийный процесс, на каждом этапе которого одна сигнальная система сменяется или дополняется другой. Целью данного исследования было изучение особенностей анаболического и катаболического сигналинга постуральных и локомоторных мышц в ответ на ограничение двигательной активности.
Различные виды механической разгрузки приводят к различному снижению массы скелетных мышц, в зависимости от снижения нагрузки. Так, в экспериментах с антиортостатическим вывешиванием грызунов снижение массы камбаловидной мышцы на 10–15% наблюдается уже на 3-е сут разгрузки [13]. К 7-м суткам вывешивания снижение массы камбаловидной мышцы уже достигает 32% [14]. После 16-суточного вывешивания абсолютная масса камбаловидной мышцы снижалась на 50 и 65%, а размер волокон на 66% [15]. При использовании гипсовой иммобилизации в течение 7 дней на грызунах также наблюдалось снижение массы камбаловидной мышцы на 34% [16]. В нашем эксперименте использовался метод снижения активности голени животных, при этом не исключалась постуральная, поддерживающая масса тела функция. У крыс, содержавшихся в маленьких клетках в течение 21 сут, наблюдалось снижение массы как медленной m. soleus, так и быстрой m. EDL на 10 и 6% соответственно. Аналогичным образом изменялась масса m. soleus после ограничения двигательной активности в работах A. Takemura и соавт. и E. Marmonti и соавт. [10, 17], масса локомоторной m. plantaris снижалась достоверно по данным работы. [10], снижение в m. EDL было незначительным в работе [17].
Потеря массы скелетных мышц после снижения активности задних конечностей объясняется увеличением протеолиза и снижением скорости синтеза мышечного белка [18, 19]. После 3-, 4- и 28-суточного антиортостатического вывешивания наблюдалось снижение синтеза белка, измеренного с помощью радиоактивного метода [20–22]. Кроме того, с помощью in vivo методики SUnSET, было показано достоверное снижение уровня синтеза белка после 7-ми суточного вывешивания мышей [23]. В работах нашей лаборатории с помощью SUnSET-методики мы наблюдали достоверное снижение синтеза белка уже к 3-м сут вывешивания крыс, и это снижение прогрессировало к 7-м сут [14, 24]. Интересно, что большую часть всех белковых потерь составляет миофибриллярный белок [25]. После 4-недельного вывешивания миофибриллярный белок в m. soleus снижался на 50%, в то время как в m. plantaris (быстрая мышца) снижения не происходило. А после 7-ми дней вывешивания снижение содержания миофибриллярного белка в m. EDL было значительно ниже по сравнению с m.soleus [26]. Ограничение двигательной активности снижает нагрузку на локомоторные мышцы, тогда как постуральные остаются нагруженными, в связи с чем в данной работе наблюдалось закономерное падение синтеза белка в m. EDL при отсутствии значимого снижения в постуральной m. soleus (рис. 1). Данных по синтезу белка в условиях разгрузки локомоторных мышц очень мало. В работе Ferrando и др. [27] скорость синтеза белка снижалась в m. vastus lateralis человека после 15-ти дней антиортостатической гипокинезии.
Одним из основных сигнальных путей, регулирующих синтез белка в скелетной мышце, является Akt/mTOR/p70S6k. Работа этого сигнального пути хорошо изучена в m. soleus при функциональной разгрузке, вызванной вывешиванием или космическим полетом, однако совсем не изучена при ограничении двигательной активности. Отсутствие изменений в уровне фосфорилирования Akt и p70S6k согласуется с имеющимися в литературе данными. Так, в работе Kobayashi и соавт. [28] показано, что содержание крыс в маленьких клетках в течение 28 дней не отражается на фосфорилировании Akt, mTOR и p70S6K в m. tibialis anterior. У человека после 24-х дней антиортостатической гипокинезии фосфорилирование Akt и p70S6K также не изменяется [29]. Несмотря на отсутствие изменений фосфорилирования Akt, фосфорилирование GSK3β после 21-го дня ограничения двигательной активности было снижено (рис. 4), что сопровождалось снижением мышечной массы. В литературе нет данных по изменению GSK3β в условиях ограничения двигательной активности, однако снижение массы m. soleus при функциональной разгрузке часто сопровождается снижением фосфорилирования GSK3β [12, 30, 31]. Наряду с Akt, активность GSK3β может регулироваться протеинкиназами A и C, а также P90RSK [32]. Кроме того, на уровень фосфорилирования GSK3β может оказывать влияние содержание оксида азота в волокне через цГМФ-зависимые протеинкиназы [33]. В m. soleus при функциональной разгрузке снижается уровень фосфорилирования P90RSK [34], с этим может быть связано снижение фосфорилирования GSK3b при ограничении двигательной активности в нашем эксперименте. Данный сигнальный путь, по-видимому, не задействован в m. EDL.
В последнее время увеличивается количество работ, посвященных изучению регуляции элонгации трансляции в скелетных мышцах, скорость которой существенно падает при функциональной разгрузке мышц [35–37]. eEF2 (Eukaryotic elongation factor 2) фосфорилируется eEF2-киназой (eEF2k), что приводит к снижению скорости элонгации трансляции [38]. Было показано, что при снижении активности скелетной мышцы происходит быстрое увеличение фосфорилирования eEF2 [36], это может быть причиной снижения белкового синтеза. Мы проанализировали содержание фосфорилированного eEF2 и обнаружили увеличение фосфорилирования eEF2 в m. EDL, что действительно соотносится со снижением белкового синтеза, в то время как фосфорилирование eEF2 в медленной m. soleus снижалось при отсутствии значимых изменений в белковом синтезе.
Известно, что p70S6K фосфорилирует белки S6, а также ингибирует eEF2k [39]. В нашем эксперименте мы наблюдали снижение фосфорилирования белка S6 и увеличение фосфорилирования eEF2 в m. EDL (рис. 2), однако фосфорилирование p70S6K не отличалось от контроля. При функциональной разгрузке m. soleus, вызванной вывешиванием, наблюдается сложная динамика фосфорилирования p70S6K [14], в связи с чем возникает предположение, что наблюдаемые изменения могут быть результатом деятельности p70S6K на более ранних этапах ограничения двигательной активности.
Мышечная атрофия является результатом снижения синтеза белка и усиления протеолиза. В нашем эксперименте мы не наблюдаем роста экспрессии ключевых Е3-убиквитинлигаз MuRF-1 и Atrogin-1/MAFbx. Эти данные согласуются с работой Brocca и соавт. [29]. Кроме того, некоторые авторы указывают на активацию аутофагии при антиортостатической гипокинезии [29, 40], что также может происходить и при ограничении двигательной активности. Атрофические процессы в m. soleus при разгрузке сопровождаются увеличением экспрессии кальпаина-1 [34, 41]. Фосфорилирование десмина с помощью GSK3-β предшествует и способствует убиквитинированию при участии Trim32 и деполимеризации десминовых филаментов с помощью кальпаина-1, что в конечном итоге приводит к потере миофибрилл и атрофии [42]. В нашем эксперименте снижение массы m. soleus может быть связано с увеличением экспрессии кальпаина-1.
В результате проведенной работы можно сделать выводы: интенсивность синтеза белка снижалась в быстрой m. EDL, работа которой минимальна при ограничении двигательной активности, в то время как в m. soleus синтез белка не изменялся; изменение массы m. soleus предположительно связано с ростом экспрессии кальпаинов; изменение синтеза белка в m. EDL связано со снижением фосфорилирования рибосомального белка S6 и увеличением фосфорилирования eEF2.
Список литературы
Shenkman BS (2020) How Postural Muscle Senses Disuse? Early Signs and Signals. Int J Mol Sci 21(14): 10. https://doi.org/3390/ijms21145037
Krogh-Madsen R, Thyfault JP, Broholm C, Mortensen OH, Olsen RH, Mounier R, Plomgaard P, van Hall G, Booth FW, Pedersen BK (2010) A 2-wk reduction of ambulatory activity attenuates peripheral insulin sensitivity. J Appl Physiol 108(5): 1034–1040. https://doi.org/10.1152/japplphysiol.00977.2009
Oikawa SY, Holloway TM, Phillips SM (2019) The Impact of Step Reduction on Muscle Health in Aging: Protein and Exercise as Countermeasures. Front Nutrit 6(75). https://doi.org/10.3389/fnut.2019.00075
Fisher SR, Goodwin JS, Protas EJ, Kuo YF, Graham JE, Ottenbacher KJ, Ostir GV (2011) Ambulatory activity of older adults hospitalized with acute medical illness. J Am Geriatr Soc 59(1): 91–95. https://doi.org/10.1111/j.1532-5415.2010.03202.x
Shad BJ, Thompson JL, Holwerda AM, Stocks B, Elhassan YS, Philp A, van Loon LJC, Wallis GA (2019) One Week of Step Reduction Lowers Myofibrillar Protein Synthesis Rates in Young Men Med Sci Sports Exerc 51(10): 2125–2134. https://doi.org/1249/MSS.0000000000002034
Reid KF, Pasha E, Doros G, Clark DJ, Patten C, Phillips EM, Frontera WR, Fielding RA (2014) Longitudinal decline of lower extremity muscle power in healthy and mobility-limited older adults: influence of muscle mass, strength, composition, neuromuscular activation and single fiber contractile properties. Eur J Appl Physiol 114(1): 29–39. https://doi.org/10.1007/s00421-013-2728-2
Devries MC, Breen L, Von Allmen M, MacDonald MJ, Moore DR, Offord EA, Horcajada MN, Breuille D, Phillips SM (2015) Low-load resistance training during step-reduction attenuates declines in muscle mass and strength and enhances anabolic sensitivity in older men. Physiol Rep 3(8): e12493. https://doi.org/10 14814/phy2.12493
Belozerova IN, Nemirovskaya TL, Shenkman BS, Kozlovskaya IB (2003) Characteristic of changes in the structure and metabolism of the vastus lateralis muscles in monkeys after space flight. Neurosci Behav Physiol 33 (7): 735–740. https://doi.org/10.1023/a:1024429311622
Shenkman BS, Belozerova IN, Lee P, Nemirovskaya TL, Kozlovskaya IB (2003) Effects of weightlessness and movement restriction on the structure and metabolism of the soleus muscle in monkeys after space flight. Neurosci Behav Physiol 33(7): 717–722. https://doi.org/10.1023/a:1024473126643
Takemura A, Roy RR, Edgerton VR, Ishihara A (2016) Biochemical Adaptations in a Slow and a Fast Plantarflexor Muscle of Rats Housed in Small Cages. Aerospace Med Human Perform 87(5): 443–448. https://doi.org/10.3357/AMHP.4436.2016
Goodman CA, Mabrey DM, Frey JW, Miu MH, Schmidt EK, Pierre P, Hornberger TA (2011) Novel insights into the regulation of skeletal muscle protein synthesis as revealed by a new nonradioactive in vivo technique. FASEB 25(3): 1028–1039. https://doi.org/10.1096/fj.10-168799
Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova II, Mirzoev TM, Shenkman BS (2019) Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Phys 10: 1252. https://doi.org/10.3389/fphys.2019.01252
Belova SP, Mochalova EP, Kostrominova TY, Shenkman BS, Nemirovskaya TL (2020) P38alpha-MAPK Signaling Inhibition Attenuates Soleus Atrophy during Early Stages of Muscle Unloading. IJMS 21(8): 2756. https://doi.org/10.3390/ijms21082756
Mirzoev T, Tyganov S, Vilchinskaya N, Lomonosova Y, Shenkman B (2016) Key Markers of mTORC1-Dependent and mTORC1-Independent Signaling Pathways Regulating Protein Synthesis in Rat Soleus Muscle During Early Stages of Hindlimb Unloading. Cell Physiol Biochem 39(3): 1011–1020. https://doi.org/10.1159/000447808
Wang XD, Kawano F, Matsuoka Y, Fukunaga K, Terada M, Sudoh M, Ishihara A, Ohira Y (2006) Mechanical load-dependent regulation of satellite cell and fiber size in rat soleus muscle. AJP 290(4): C. 981–989. https://doi.org/10.1152/ajpcell.00298.2005
da Silva CA, Guirro RR, Polacow ML, Cancelliero KM, Durigan JL (2006) Rat hindlimb joint immobilization with acrylic resin orthoses. Braz J Med Biol Res 39(7): 979–985. https://doi.org/10.1590/s0100-879x2006000700016
Marmonti E, Busquets S, Toledo M, Ricci M, Beltra M, Gudino V, Oliva F, Lopez-Pedrosa JM, Manzano M, Rueda R, Lopez-Soriano FJ, Argiles JM (2017) A Rat Immobilization Model Based on Cage Volume Reduction: A Physiological Model for Bed Rest? Front Phys 8: 184. https://doi.org/10.3389/fphys.2017.00184
Phillips SM, Glover EI, Rennie MJ (2009) Alterations of protein turnover underlying disuse atrophy in human skeletal muscle. J Appl Phys 107(3): 645–654. https://doi.org/10.1152/japplphysiol.00452.2009
Bodine SC, Baehr LM (2014) Skeletal muscle atrophy and the E3 ubiquitin ligases MuRF1 and MAFbx/atrogin-1. Am J Phys Endocrin Metab 307(6): E469–E484. https://doi.org/10.1152/ajpendo.00204.2014
Loughna P, Goldspink G, Goldspink DF (1986) Effect of inactivity and passive stretch on protein turnover in phasic and postural rat muscles. J Appl Phys 61(1): 173–179. https://doi.org/10.1152/jappl.1986.61.1.173
Fluckey JD, Dupont-Versteegden EE, Montague DC, Knox M, Tesch P, Peterson CA, Gaddy-Kurten D (2002) A rat resistance exercise regimen attenuates losses of musculoskeletal mass during hindlimb suspension. Acta Phys Scand 176(4): 293–300. https://doi.org/10.1046/j.1365-201X.2002.01040.x
Fluckey JD, Dupont-Versteegden EE, Knox M, Gaddy D, Tesch PA, Peterson CA (2004) Insulin facilitation of muscle protein synthesis following resistance exercise in hindlimb-suspended rats is independent of a rapamycin-sensitive pathway. Am J Phys Endocrin Metab 287(6): E1070–1075. https://doi.org/10.1152/ajpendo.00329.2004
You JS, Anderson GB, Dooley MS, Hornberger TA (2015) The role of mTOR signaling in the regulation of protein synthesis and muscle mass during immobilization in mice. Disease Models Mechanisms 8(9): 1059–1069. https://doi.org/10.1242/dmm.019414
Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova II, Mirzoev TM, Shenkman BS (2019) Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Phys 10: 1252. https://doi.org/10.3389/fphys.2019.01252
Munoz KA, Satarug S, Tischler ME (1993) Time course of the response of myofibrillar and sarcoplasmic protein metabolism to unweighting of the soleus muscle. Metab Clin Exp 42(8): 1006–1012. https://doi.org/10.1016/0026-0495(93)90014-f
Wineski LE, von Deutsch DA, Abukhalaf IK, Pitts SA, Potter DE, Paulsen DF (2002) Muscle-specific effects of hindlimb suspension and clenbuterol in mature male rats. Cells, Tissues, Organs 171(2–3): 188–198. https://doi.org/10.1159/000063712
Ferrando AA, Lane HW, Stuart CA, Davis-Street J, Wolfe RR (1996) Prolonged bed rest decreases skeletal muscle and whole body protein synthesis. Am J Phys 270 (4 Pt 1): E627–E633. https://doi.org/10.1152/ajpendo.1996.270.4.E627
Kobayashi Y, Watanabe N, Kitakaze T, Sugimoto K, Izawa T, Kai K, Harada N, Yamaji R (2020) Oleamide rescues tibialis anterior muscle atrophy of mice housed in small cages. Br J Nutr 1–35. https://doi.org/10.1017/S0007114520004304
Brocca L, Cannavino J, Coletto L, Biolo G, Sandri M, Bottinelli R, Pellegrino MA (2012) The time course of the adaptations of human muscle proteome to bed rest and the underlying mechanisms. J Phys 590(20): 5211–5230. https://doi.org/10.1113/jphysiol.2012.240267
Sharlo K, Paramonova I, Turtikova O, Tyganov S, Shenkman B (2019) Plantar mechanical stimulation prevents calcineurin-NFATc1 inactivation and slow-to-fast fiber type shift in rat soleus muscle under hindlimb unloading. J Appl Phys 126(6): 1769–1781. https://doi.org/10.1152/japplphysiol.00029.2019
Yokoyama S, Ohno Y, Egawa T, Yasuhara K, Nakai A, Sugiura T, Ohira Y, Yoshioka T, Okita M, Origuchi T, Goto K (2016) Heat shock transcription factor 1-associated expression of slow myosin heavy chain in mouse soleus muscle in response to unloading with or without reloading. Acta Phys 217(4): 325–337. https://doi.org/10.1111/apha.12692
Jope RS, Johnson GV (2004) The glamour and gloom of glycogen synthase kinase-3. Trends Biochem Sci 29(2): 95–102. https://doi.org/10.1016/j.tibs.2003.12.004
Drenning JA, Lira VA, Simmons CG, Soltow QA, Sellman JE, Criswell DS (2008) Nitric oxide facilitates NFAT-dependent transcription in mouse myotubes. Am J Phys 294(4): C1088–C1095. https://doi.org/10.1152/ajpcell.00523.2007
Shenkman BS, Belova SP, Lomonosova YN, Kostrominova TY, Nemirovskaya TL (2015) Calpain-dependent regulation of the skeletal muscle atrophy following unloading. Arch Biochem Biophys 584: 36–41. https://doi.org/10.1016/j.abb.2015.07.011
Hornberger TA, Hunter RB, Kandarian SC, Esser KA (2001) Regulation of translation factors during hindlimb unloading and denervation of skeletal muscle in rats. Am J Phys 281(1): C179–C187. https://doi.org/10.1152/ajpcell.2001.281.1.C179
Miranda L, Horman S, De Potter I, Hue L, Jensen J, Rider MH (2008) Effects of contraction and insulin on protein synthesis, AMP-activated protein kinase and phosphorylation state of translation factors in rat skeletal muscle. Pflugers Arch Eur J Phys 455(6): 1129–1140. https://doi.org/10.1007/s00424-007-0368-2
Lomonosova YN, Belova SP, Mirzoev TM, Kozlovskaya IB, Shenkman BS (2017) Eukaryotic elongation factor 2 kinase activation in M. soleus under 14-day hindlimb unloading of rats. Dokl Biochem Biophys 474(1): 165–167. https://doi.org/10.1134/S1607672917030048
Carlberg U, Nilsson A, Nygard O (1990) Functional properties of phosphorylated elongation factor 2. Eur J Biochem 191(3): 639–645. https://doi.org/10.1111/j.1432-1033.1990.tb19169.x
Roux PP, Topisirovic I (2018) Signaling Pathways Involved in the Regulation of mRNA Translation. Mol Cell Biol 38(12): e 00070-18. https://doi.org/10.1128/MCB.00070-18
de Boer MD, Selby A, Atherton P, Smith K, Seynnes OR, Maganaris CN, Maffulli N, Movin T, Narici MV, Rennie MJ (2007) The temporal responses of protein synthesis, gene expression and cell signalling in human quadriceps muscle and patellar tendon to disuse. J Phys 585(Pt 1): 241–251. https://doi.org/10.1113/jphysiol.2007.142828
Huang J, Zhu X (2016) The molecular mechanisms of calpains action on skeletal muscle atrophy Phys Res 65(4): 547–560. https://doi.org/10 33549/physiolres.933087
Aweida D, Rudesky I, Volodin A, Shimko E, Cohen S (2018) GSK3-beta promotes calpain-1-mediated desmin filament depolymerization and myofibril loss in atrophy. J Cell Biol 10: 3698–3714. https://doi.org/10.1083/jcb.201802018
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


