Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 828-841
Стабильный уровень гигантских белков саркомерного цитоскелета в поперечнополосатых мышцах сони-полчка Glis glis при гибернации
С. С. Попова 1, Д. А. Юршенас 1, Г. З. Михайлова 1, Л. Г. Бобылёва 1, Н. Н. Салмов 1, О. В. Тяпкина 2, 3, Л. Ф. Нуруллин 2, 3, Г. Р. Газизова 4, И. Р. Нигметзянов 4, О. А. Гусев 4, Н. М. Захарова 5, И. М. Вихлянцев 1, *
1 Институт теоретической и экспериментальной биофизики Российской академии наук
Пущино, Россия
2 Казанский институт биохимии и биофизики Российской академии наук
Казань, Россия
3 Казанский государственный медицинский университет
Казань, Россия
4 Казанский Федеральный Университет, Институт фундаментальной медицины и биологии
Казань, Россия
5 Институт биофизики клетки Российской академии наук
Пущино, Россия
* E-mail: ivanvikhlyantsev@gmail.com
Поступила в редакцию 18.01.2021
После доработки 23.02.2021
Принята к публикации 23.02.2021
Аннотация
Исследованы изменения содержания гигантских белков саркомерного цитоскелета титина (м.м. 3000–3700 кДа) и небулина (м.м. 770 кДа) в скелетных мышцах (m. soleus, m. gastrocnemius), титина в миокарде левого желудочка сердца, а также белка примембранного цитоскелета дистрофина (м.м. 427 кДа) в m. soleus и m. extensor digitorum longus сони-полчка (Glis glis) двух экспериментальных групп: “Летняя активность” и “Гипотермия” (спячка). Обнаружено, что развитие атрофических изменений в скелетных мышцах сони-полчка при гибернации сопровождается уменьшением содержания дистрофина. В частности, интенсивность флуоресценции на поперечных срезах скелетных мышц, окрашенных первичными антителами к дистрофину и вторичными антителами, конъюгированными с флуорохромом Alexa488, уменьшилась в 2.7 раза (p < 0.05) и в 2.0 раза (p < 0.05) в m. soleus и m. EDL соответственно у животных группы “Гипотермия”. ДСН-электрофорез белков в крупнопористом 2.2%-ном полиакриламидном геле, укрепленном агарозой, выявил незначительное уменьшение (на 15%, p ≤ 0.01) содержания титина по отношению к содержанию тяжелых цепей миозина в m. gastrocnemius животных группы “Гипотермия”. Содержание титина в m. soleus и сердечной мышце, а также содержание небулина в исследованных скелетных мышцах не уменьшалось в период гибернации. Эти результаты согласуются с полученными нами ранее данными для других гибернантов: длиннохвостого суслика, бурого и гималайского медведей. Можно предположить, что в процессе эволюции у зимнеспящих животных были выработаны молекулярные механизмы, отвечающие за поддержание стабильного уровня гигантских белков саркомерного цитоскелета в период гибернации.
Гибернация (зимняя спячка) – это эволюционно закрепленная способность у некоторых млекопитающих выживать в экстремальных условиях (при низких температурах и отсутствии пищи) за счет обратимого подавления метаболизма, сопровождающегося снижением температуры тела. Соня-полчок (Glis glis, семейство Gliridae) – гибернант, обитающий в широколиственных и смешанных лесах Европы. Активный период у этих животных составляет всего 4–5 мес. в году. С сентября по ноябрь сони начинают залегать в спячку, которая длится до конца мая–начала июня [1, 2]. Эти животные интересны и тем, что способны впадать в спячку не только зимой, но и летом [3]. Баут зимней спячки (т.е., период пребывания в состоянии гипотермии) у этих животных длится от 3–4 сут (39 ч в лабораторных условиях) до двух–трех недель, прерываясь периодами активности (эутермии) [3, 4]. Температура тела у сони-полчка во время зимней спячки не опускается ниже 0°С [3, 5]. Это является отличительной особенностью сони-полчка в сравнении с другими гибернантами, например, длиннохвостым сусликом (Urocitellus undulatus), температура тела у которого в период спячки снижается до –2°С [6]. Другой отличительной особенностью сони-полчка является то, что, несмотря на значительную потерю (до 30%) массы тела за время гибернации, уровень атрофических изменений в мышцах этих животных менее выраженный, чем у других гибернантов [7]. В связи с этим соня-полчок является интересным объектом для изучения не только молекулярных механизмов развития мышечной атрофии, но и механизмов, лежащих в основе поддержания мышечной массы у гибернантов.
Показано, что развитие мышечной атрофии как вследствие пребывания в условиях моделируемой [8] или реальной [9] невесомости, так и в период зимней спячки [10] сопровождается уменьшением содержания полноразмерных (интактных) молекул титина (Т1) [11], перекрывающих расстояние от М-линии до Z-диска в саркомерах поперечнополосатых мышц позвоночных. В частности, в ряде скелетных мышц, а также в сердечной мышце длиннохвостого суслика в период спячки (гипотермии) наблюдалось уменьшение в 1.2–1.3 раза содержания Т1 относительно содержания тяжелых цепей миозина [11–13] – белка, формирующего толстые нити и взаимодействующего в А-зоне саркомера с титином. В периоды эутермии между баутами спячки (когда температура тела суслика поднимается до нормальной) наблюдалось восстановление содержания Т1 в сердечной и скелетных мышцах [12, 13]. При этом содержание небулина (белка тонких нитей скелетных мышц) относительно содержания ТЦМ не изменялось в период гибернации [12, 13], что свидетельствует о поддержании стабильного уровня этого белка в мышцах длиннохвостого суслика. Поддержание константного соотношения Т1/ТЦМ и небулин/ТЦМ наблюдалось в поперечнополосатых мышцах и трех видов медведей в период зимнего сна [14, 15].
В доступной нам литературе данных об изменении содержания дистрофина в мышцах зимнеспящих животных мы не обнаружили. Однако известны данные об уменьшении содержания этого белка у крыс в скелетной мышце m. soleus при развитии атрофии, индуцируемой гравитационной разгрузкой [16].
В данной работе исследованы изменения содержания гигантских белков саркомерного цитоскелета титина и небулина в скелетных мышцах (m. soleus, m. gastrocnemius), титина в миокарде левого желудочка сердца, а также белка примембранного цитоскелета дистрофина в m. soleus и m. extensor digitorum longus сони-полчка двух экспериментальных групп: “Летняя активность” и “Гипотермия”. Рабочая гипотеза была следующей: на фоне развития атрофии поперечнополосатых мышц сони-полчка в период гибернации не будет наблюдаться уменьшение содержания трех вышеуказанных цитоскелетных белков.
Поскольку в мышцах гибернантов в период спячки наблюдается увеличение доли мышечных волокон, экспрессирующих “медленную” изоформу I ТЦМ [10], отдельной нашей задачей было выяснение изменений изоформного состава ТЦМ в m. soleus и m. gastrocnemius сони-полчка двух экспериментальных групп. Подобных исследований на этих мышцах для данного вида животных не проводилось.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были сони-полчки (Glis glis), отловленные в период с 3 по 15 августа 2015 г. в Волгоградской области (приобретены у ООО “Зоо-ЭКЗО”, Волгоград, РФ). Животных содержали по 3–4 особи в клетках размером 260 × 476 × 203 мм с пластиковым поддоном. В качестве подстилки использовали древесные пеллеты. В клетки животным ставили картонные коробочки размером 20 × 10 × 15 см, которые служили укрытием для животных. Животных содержали в условиях вивария Казанского государственного медицинского университета. Корм (Padovan Grandmix Criceti для хомяков и мышей) и воду животные получали ad libitum. В рацион питания также входили семена подсолнечника, орехи (лесные, грецкие), арахис, яблоки, морковь, бананы, мясной фарш и вареное яйцо. Все процедуры с животными проводили в соответствии с международными биоэтическими нормами (протокол № 319 от 4.04.2013 г., принятый Физиологической секцией Российского национального комитета по биологической этике). Эксперименты на животных были одобрены Локальным этическим комитетом федерального государственного бюджетного образовательного учреждения высшего образования Казанский государственный медицинский университет Министерства здравоохранения Российской Федерации (выписка из протокола заседания №10 от 22 декабря 2020 г.).
В экспериментах исследовали животных обоих полов, находящихся в состоянии активности (группа “Летняя активность”, июнь–июль 2015 г., средняя масса животных 122.5 ± 3.2 г, n = 4) и в состоянии спячки (группа “Гипотермия”, январь-февраль 2016 г., средняя масса животных 111.0 ± 12.5 г, n = 4). Животных группы “Летняя активность” содержали в клетках в условиях вивария при температуре окружающей среды 21–25°С и искусственном освещении (свет/темнота) – 12 ч/12 ч. Животных группы “Гипотермия” (рис. 1) содержали в специальном помещении, где поддерживали температуру окружающей среды 4–5°С. В помещении также поддерживали режим искусственного освещения (свет/темнота) – 12ч/12ч. Продолжительность спячки животных составляла 14 сут. Температуру тела животных измеряли в области лба бесконтактным инфракрасным термометром B. Well WF-5000 (B. Well Swiss, Швейцария). Температура тела животных группы “Летняя активность” составляла 35–36°С, животных группы “Гипотермия” – 7–9°С.
Рис. 1.
Соня-полчок (Glis glis) в состоянии гибернации. У животного отсутствует реакция на внешние раздражители во время глубокой спячки.

Животных обеих групп под глубоким ингаляционным эфирным наркозом декапитировали и проводили экстирпацию мышц. Были взяты следующие образцы мышечных тканей: миокард левого желудочка сердца, m. soleus, m. extensor digitorum и обе головки m. gastrocnemius. Скелетные мышцы были взяты с обеих конечностей. Мышцы замораживали в жидком азоте и хранили при температуре –75°С в лаборатории экстремальной биологии Казанского федерального университета. Для исследований содержания и изоформного состава титина, небулина и ТЦМ образцы мышц в жидком азоте были транспортированы в Пущино в Институт теоретической и экспериментальной биофизики РАН и в Институт биофизики клетки РАН.
Для измерения площади поперечного сечения мышечных волокон, а также содержания дистрофина образцы мышц m. soleus и m. EDL (целая мышца от одного сухожильного конца до другого сухожильного конца) в течение 12 ч фиксировали в 4%-ном растворе параформальдегида (рН 7.2), приготовленного на 0.1 М фосфатном буфере (PBS, Sigma, США). Для криопротекции фиксированные ткани мышц помещали на 24 ч в 30%-ный раствор сахарозы (Хеликон, Россия), приготовленный на фосфатно-солевом буфере (Биолот, Россия) с добавлением 0.1% азида натрия (Sigma, США). Затем мышцы погружали в специальную водорастворимую среду (Tissue-Tek, Нидерланды) и замораживали для изготовления поперечных срезов на криостате HM 560 Cryo-Star (Carl Zeiss, Германия). Поперечные серийные срезы мышц толщиной 9 мкм монтировали на предметные стекла с полилизиновым покрытием (Thermo Fisher Scientific, США). Серийные срезы окрашивали первичными поликлональными антителами к дистрофину (1 : 250, ab15277, Abcam Plc, Великобритания) в течение 12 ч при температуре 4°С. Затем использовали вторичные антитела (IgG козлиные против кролика, 1 : 1000, Invitrogen, США), конъюгированные с флуорохромом Alexa488. Изображения микропрепаратов получали на конфокальном сканирующем микроскопе Leica TCS SP5 MP с помощью фотоэлектронного умножителя (Leica Microsystems, Германия). Использовали масляный иммерсионный объектив 10× и 63×. На полученных изображениях поперечных срезов мышц анализировали интенсивность флуоресцентного свечения, полученную после проведения иммунной реакции, а также площади поперечного сечения отдельных мышечных волокон, попавших в поле зрения с применением программы ImageJ (NIH, США). При одинаковых условиях приготовления препаратов интенсивность иммунофлуоресценции в сарколемме мышцы оценивали по интенсивности свечения с учетом базового фона.
ДСН-гель-электрофорез высокомолекулярных N2B, N2BA, N2A и NT-изоформ интактного титина-1 (Т1, м.м. ~3000–3700 кДа), протеолитических Т2-фрагментов (м.м. ~2100–2200 кДа) этого белка в исследуемых поперечнополосатых мышцах, а также небулина (м.м. ~770 кДа) в скелетных мышцах проводили по методу [17] с нашими модификациями [18]. В частности, мы использовали крупнопористый 2.2%-ный полиакриламидный гель с содержанием агарозы 0.5%. Подготовку проб проводили в соответствии с нашими рекомендациями, исключающими нагревание проб выше 40°С с целью предотвращения разрушения титина под действием более высоких температур. Для электрофоретического разделения изоформ I и IIa ТЦМ использовали 7%-ный полиакриламидный гель, приготовленный по методу [19]. Экстракцию белков из мышечной ткани проводили в лизирующем буфере (12 мM трис-HCl, 1.2% ДСН, 5 мM ЭГTA, 10% глицерина, 2% β-меркаптоэтанола, 5 мгк/мл леупептина и E64, pH 7.0). Концентрацию общего белка перед проведением гель-электрофореза определяли спектрофотометрическим методом, используя NanoDrop ND-1000 (NanoDrop Technologies, США). На дорожки в геле наносили одинаковое количество общего белка. Электрофорез проводили в аппаратах с вертикальным расположением геля (ООО Хеликон, Россия), размер пластинки геля 8 × 10 см, толщина геля 1 мм. Для разделения титина и небулина электрофорез проводили в течение 1.5–2 ч при силе тока 3–8 мА, для разделения ТЦМ – в течение 6–8 ч при силе тока 10–12 мА. Гели, окрашенные Coomassie Brilliant Blue G-250 и R-250, смешанными в пропорции 1 : 1, оцифровывали, а затем проводили денситометрический анализ сканов с помощью компьютерной программы Total Lab v1.11 (Newcastle Upon Tyne, Великобритания). Содержание титина и небулина оценивали по отношению к содержанию ТЦМ (крупнопористые гели, укрепленные агарозой). Данный способ оценки содержания титина и небулина широко используется и является более точным, чем способ оценки содержания этих белков по отношению к содержанию общего белка в пробе. Содержание изоформ тяжелых цепей миозина (7%-ные полиакриламидные гели) оценивали в процентах от общего содержания ТЦМ.
Статистический анализ изменений площадей поперечного сечения мышечных волокон, а также интенсивности флуоресценции при определении содержания дистрофина проводили с помощью программы Origin 7.5. Результаты представлены как среднее значение ± стандартная ошибка. Достоверность различий оценивали с помощью t-критерия Стьюдента; значимыми считали различия при p < 0.05. Статистический анализ изменений массы тела и массы сердца животных, а также изменений содержания титина, небулина и ТЦМ проводили с использованием непараметрического U-критерия Манна–Уитни. Этот критерий предназначен для оценки количественных различий признака между двумя малыми выборками, когда выборка 1 и выборка 2 равны трем или больше значениям n, или выборка 1 равна двум, а выборка 2 равна пяти или больше значениям n. Таким образом, при отсутствии резких отклонений тестируемых показателей в выборках U-критерий Манна–Уитни позволяет выявить статистически значимые различия между двумя малыми выборками. В нашей работе значимыми считали различия при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение уровня атрофических изменений в поперечнополосатых мышцах сони-полчка в период спячки
В табл. 1 представлены данные о массе сердца, массе тела животных, а также соотношение вышеуказанных масс, указывающее на развитие атрофических (при уменьшении соотношения) или гипертрофических (при увеличении соотношения) изменений. Не выявлено статистически значимых различий в параметре “отношение массы сердца к массе тела животного” у сонь двух групп. Однако наблюдалась выраженная тенденция к увеличению этого параметра в группе “Гипотермия”, что свидетельствует о тенденции к развитию гипертрофии миокарда у сони-полчка в период гибернации.
На рис. 2 показаны данные, свидетельствующие об уменьшении площади поперечного сечения (ППС) мышечных волокон m. soleus и m. EDL у сонь-полчков из группы “Гипотермия”. В частности, статистический анализ результатов показал достоверное уменьшение (в 1.25 раза, p < 0.05) ППС в m. soleus, а также тенденцию к уменьшению (в 1.13 раза, p > 0.05) ППС в m. EDL животных группы “Гипотермия”. Таким образом, полученные результаты свидетельствуют о развитии атрофических изменений в m. soleus и m. EDL у сонь-полчков в период гибернации.
Рис. 2.
Площадь поперечного сечения (ППС) мышечных волокон m. soleus и m. EDL сонь-полчков из групп “Летняя активность” и “Гипотермия”. Среднее значение ППС мышечных волокон составило: в m. soleus 1123 ± 42 мкм2 (“Летняя активность”, n = 100) против; 898 ± 65 мкм2 (“Гипотермия”, n = 100); в m. EDL 862 ± 91 мкм2 (“Летняя активность”, n = 100) против 764 ± 26 мкм2 (“Гипотермия”, n = 100). *p ≤ 0.05 в сравнении с группой “Летняя активность”.

Уменьшение содержания дистрофина в скелетных мышцах сони-полчка при гибернации
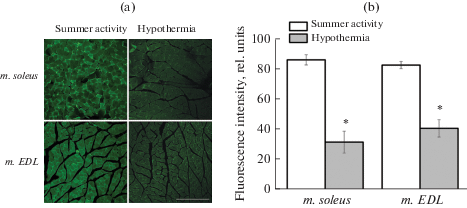
На рис. 3 показаны данные, свидетельствующие об уменьшении интенсивности флуоресценции на поперечных срезах m. soleus и m. EDL, окрашенных первичными антителами к дистрофину и вторичными антителами, конъюгированными с флуорохромом Alexa488, у животных группы “Гипотермия”. В частности, среднее значение флуоресценции для m. soleus животных группы “Летняя активность” составило 86.8 ± 27.5 отн. ед., для m. soleus животных группы “Гипотермия” – 31.8 ± ± 7.3 отн. ед. (p < 0.05) (рис. 3). Для m. EDL эти значения составили 83.3 ± 2.4 и 41.0 ± 5.8 отн. ед. (p < 0.05) соответственно. Полученные результаты свидетельствуют об уменьшении содержания дистрофина в m. soleus и m. EDL сони-полчка при гибернации.
Рис. 3.
Интенсивность флуоресценции на поперечных срезах мышц, окрашенных антителами к дистрофину. (a) – поперечные срезы m. soleus и m. EDL, окрашенные антителами к дистрофину, сонь-полчков из групп “Летняя активность” и “Гипотермия” (масштабный отрезок 250 мкм). (b) – средние значения интенсивности флуоресценции после окраски поперечных серийных срезов антителами к дистрофину. Анализировали по 3 произвольно выбранных области размером 1024 × 1024 пикселей на одном срезе и по 3–4 среза для каждого животного. Интенсивность свечения оценивали относительно базового уровня. Количество измерений для каждой мышцы составляло не менее 48. * p ≤ 0.05 в сравнении с группой “Летняя активность”.
Содержание титина и небулина в поперечнополосатых мышцах сони-полчка при гибернации
Статистически значимых различий в содержании изоформ интактного Т1 (NT, N2A, N2BA, N2B), а также в содержании протеолитических Т2-фрагментов титина в миокарде и m. soleus животных двух экспериментальных групп обнаружено не было (рис. 4). Также не обнаружено различий в содержании небулина в скелетных мышцах (m. soleus, m. gastrocnemius) сонь-полчков из двух исследуемых групп (рис. 4). Статистически значимое уменьшение (на ~15%, p ≤ 0.01) содержания Т1 относительно содержания ТЦМ зарегистрировано в m. gastrocnemius животных группы “Гипотермия” (рис. 4). При этом наблюдалось увеличение в 1.51 раза (p ≤ 0.01) содержания Т2-фрагментов, что свидетельствует о повышенной протеолитической деградации интактных молекул Т1 в этой мышце в период гибернации.
Рис. 4.
Содержание титина и небулина в поперечнополосатых мышцах сони-полчка. 1 – “Летняя активность”, 2 – “Гипотермия”. Указаны полосы NT, N2A, N2BA и N2B изоформ интактного титина-1 (Т1), протеолитических Т2-фрагментов, небулина и тяжелых цепей миозина (MHC). Электрофорез проведен в 2.2%-ном полиакриламидном геле, укрепленном агарозой. Обнаружено уменьшение в 1.17 раза (на ~15%, p ≤ 0.01) содержания Т1 и увеличение в 1.51 раза (p ≤ 0.01) содержания Т2-фрагментов относительно содержания ТЦМ в m. gastrocnemius сонь группы “Гипотермия”. В частности, соотношения Т1/ТЦМ и Т2/ТЦМ составили: 0.187 ± 0.007 и 0.078 ± 0.011 соответственно в группе “Летняя активность”, 0.160 ± 0.012 и 0.118 ± 0.014 соответственно в группе “Гипотермия”. Статистически значимых различий в содержании небулина в икроножной мышце, а также исследуемых белков в m. soleus и миокарде сони-полчка двух экспериментальных групп не выявлено (данные не показаны).

Изменения изоформного состава тяжелых цепей миозина в скелетных мышцах сони-полчка при гибернации
Обнаружено статистически значимое (p ≤ 0.01) увеличение доли “медленной” изоформы I ТЦМ и уменьшение доли “быстрой” изоформы IIa ТЦМ в двух скелетных мышцах животных группы “Гипотермия” (рис. 5). В частности, содержание изоформы I ТЦМ выросло с 56.9 ± 3.3 до 81.0 ± 2.4% в m. soleus и с 6.3 ± 1.4 до 12.6 ± 1.1% в m. gastrocnemius животных в период гибернации.
Рис. 5.
Изоформный состав ТЦМ в m. soleus и m. gastrocnemius сони-полчка. 1 – “Летняя активность”, 2 – “Гипотермия”. Указаны полосы I и IIa изоформ ТЦМ. Электрофорез проведен в 7%-ном полиакриламидном геле. Обнаружено достоверное увеличение (с 56.9 до 81.0% и с 6.3 до 12.6%, p ≤ 0.01) доли “медленной” изоформы I ТЦМ и уменьшение доли “быстрой” IIa изоформы ТЦМ в m. soleus и m. gastrocnemius соответственно у животных группы “Гипотермия”.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что длительное пребывание гибернанта в состоянии оцепенения в период спячки приводит к атрофии скелетных мышц [10, 13]. Проведенные нами ранее исследования [11–13] показали, что развитие атрофических изменений в скелетных мышцах длиннохвостого суслика сопровождается уменьшением в 1.2–1.3 раза содержания интактного Т1 относительно содержания тяжелых цепей миозина – белка толстых нитей с которым взаимодействуют молекулы титина в А-диске саркомера. Уменьшение (в 1.2–1.25 раза) соотношения Т1/ТЦМ мы наблюдали и в сердечной мышце длиннохвостого суслика в период гипотермии, несмотря на тенденцию к развитию гипертрофии миокарда [13]. Титин – субстрат для кальций-активируемых протеаз кальпаинов [13]. Уменьшение содержания Т1 в период гипотермии, по всей вероятности, является следствием протеолиза титина этими ферментами, для которых миозин не является субстратом. В периоды эутермии (зимней активности между баутами спячки) содержание Т1 в поперечнополосатых мышцах суслика восстанавливалось [12, 13]. При этом нерадиоактивным методом измерения скорости синтеза белка (SUnSET) мы показали, что на фоне снижения синтеза общего белка наблюдается преимущественный синтез гигантских белков саркомерного цитоскелета титина и небулина [13]. Полученные результаты позволили сделать заключение о поддержании константного уровня этих гигантских белков в поперечнополосатых мышцах длиннохвостого суслика в период гибернации. Поддержание стабильного уровня титина и небулина мы также наблюдали в миокарде и скелетных мышцах (m. longissimus dorsi, m. gastrocnemius, m. biceps) бурого (Ursus arctos) и гималайского (Ursus thibetanus ussuricus) медведей в период зимнего сна [15].
Учитывая вышеуказанные данные, мы предположили, что адаптационная особенность, заключающаяся в поддержании стабильного уровня белков саркомерного цитоскелета, присуща всем гибернантам и может распространяться и на другие цитоскелетные белки. Для проверки этого предположения мы исследовали изменение содержания титина и небулина, а также дистрофина – структурного белка костамера (дистрофин-ассоциированного гликопротеинового комплекса) в поперечнополосатых мышцах сони-полчка в период спячки. Предполагалось обнаружить константное содержание вышеуказанных белков или незначительное уменьшение их содержания в мышцах сони-полчка в период гибернации. Экспериментальные исследования подтвердили не все наши ожидания.
Атрофические изменения в m. soleus и m. EDL животных в период гибернации сопровождались значительным уменьшением содержания дистрофина (рис. 3). При этом в m. soleus не наблюдалось уменьшения содержания небулина и Т1 (рис. 4). Стабильное содержание Т1 наблюдалось и в миокарде сонь-полчков двух исследуемых групп. В икроножной мышце содержание небулина не изменялось при гибернации, однако наблюдалось уменьшение на ~15% содержания Т1 относительно содержания ТЦМ (рис. 4). Увеличенное (в 1.51 раза) содержание Т2-фрагментов титина свидетельствует о повышенной протеолитической деградации интактных молекул Т1 в m. gastrocnemius сони-полчка в период гибернации.
Известно, что полноразмерные молекулы Т1, перекрывающие расстояние от М-линии до Z-диска, участвуют в поддержании высокоупорядоченной саркомерной структуры, а также регуляции актин-миозинового взаимодействия. Предполагается, что на одну миозиновую нить в половине А-диска саркомера приходится шесть молекул титина. Обнаруженное нами 15%-ное уменьшение содержания Т1 может соответствовать гипотетическому уменьшению количества интактных молекул титина с 6 до 5 на миозиновую нить. Будут ли подобные изменения приводить к негативным последствиям для мышцы, в частности, сопровождаться нарушениями саркомерной структуры и, вследствие этого, ухудшением сократительной способности мышцы? Можно предположить, что нет, учитывая полученные нами ранее результаты. Аналогичное уменьшение содержания Т1 не приводило к нарушению саркомерной структуры в m. gastrocnemius мышей после 30-суточного космического полета [9], а также в миокарде длиннохвостого суслика в период гибернации [13]. Можно предположить, что обнаруженное нами относительно незначительное уменьшение содержания Т1 в m. gastrocnemius сони-полчка во время спячки не будет иметь выраженных негативных последствий.
Значительное уменьшение содержания дистрофина (который, как и титин, является субстратом кальпаинов [20]), напротив, может иметь негативные последствия для мышцы. По последним данным дистрофин и связанные с ним белки дистрофинового гликопротеинового комплекса участвуют не только в формировании примембранного цитоскелета, но и в регуляции активности ионных каналов, а также процессов внутриклеточной сигнализации [21]. Известны результаты исследований о снижении электрогенеза мышечных волокон диафрагмы мышей mdx (экспериментальной модели миодистрофии Дюшенна) [22]. Авторы предположили, что это снижение может быть из-за повреждения сарколеммальной мембраны вследствие дефицита полноразмерных молекул этого белка. Учитывая вышеуказанные данные, можно предположить, что обнаруженное нами уменьшение содержания дистрофина будет сопровождаться снижением электрогенеза и ухудшением сократительной активности мышечных волокон скелетных мышц сони-полчка после выхода из спячки. Однако в случае быстрого восстановления содержания дистрофина в период эутермии, как это наблюдается в случае с титином в мышцах длиннохвостого суслика [13], предполагаемые нарушения в значительной мере могут быть нивелированы.
Таким образом, в поперечнополосатых мышцах сони-полчка, как и у других видов гибернантов (длиннохвостого суслика, бурого и гималайского медведей), в период гибернации наблюдается поддержание стабильного уровня гигантских белков саркомерного цитоскелета титина и небулина. Можно предположить, что в процессе эволюции у зимнеспящих животных были выработаны соответствующие молекулярные механизмы, отвечающие как за уменьшение протеолиза вышеуказанных белков при спячке/зимнем сне, так и за преимущественный синтез этих белков в периоды эутермии. Анализируя полученные данные, можно предположить, что сохранение стабильного уровня белков саркомерного цитоскелета более значимо для поддержания структуры саркомеров и мышечных волокон, а также для функционирования мышцы в целом, чем сохранение других цитоскелетных мышечных белков, например, дистрофина. В поддержку этого предположения можно привести следующие данные. Общеизвестно, что одним из признаков выраженной атрофии мышц является изменение формы мышечных волокон с ортогональной на округлую, что выявляется на поперечных срезах. Подобные морфологические изменения могут быть следствием значительных нарушений структуры атрофированного мышечного волокна. В наших исследованиях на поперечных срезах m. soleus и m. EDL животных группы “Гипотермия”, несмотря на уменьшение содержания дистрофина, наблюдалось сохранение ортогональной формы мышечных волокон (данные не показаны).
Обсуждая результаты по изменению изоформного состава ТЦМ в мышцах сони-полчка, необходимо отметить следующее. В скелетных мышцах млекопитающих синтезируются четыре изоформы тяжелых цепей миозина: IIa, IIb, IIx/d и I [23, 24]. Показано, что величина миофибриллярной АТФ-азной активности уменьшается в ряду изоформ ТЦМ следующим образом: IIb > IIx/d > IIa > I [23, 24]. Мышечные волокна, содержащие миозин с высокой активностью АТФ-азы, называют “быстрыми” (гликолитическими, окислительно-гликолитическими – изоформы II ТЦМ), а те волокна, которые содержат миозин с более низкой активностью АТФ-азы, – “медленными” (окислительными – изоформа I ТЦМ). Известно, что в скелетных мышцах гибернантов в период зимней спячки наблюдается увеличение доли волокон, экспрессирующих “медленную” изоформу I ТЦМ [10, 25]. Аналогичные изменения изоформного состава ТЦМ были обнаружены и в скелетных мышцах сони-полчка в период спячки (рис. 5). Увеличение доли “медленных” мышечных волокон, более выносливых и энергетически более выгодных, чем “быстрые” волокна, по-видимому, также является эволюционно закрепленной адаптационной особенностью у гибернирующих животных, способствующей экономии энергетических ресурсов и выживанию животного в суровых условиях.
Список литературы
Ruf T, Bieber C (2020) Physiological, behavioral, and life-history adaptations to environmental fluctuations in the edible dormouse. Front Physiol 11: 423. https://doi.org/10.3389/fphys.2020.00423
Vogel P (1997) Hibernation of recently captured Muscardinus, Eliomys and Myoxus: a comparative study. Nat Croat 6(2): 217–231.
Wiltz M, Heldmaier G (2000) Comparison of hibernation, estivation and daily torpor in the edible dormouse, Glis glis. J Compar Physiol B 170: 511–521. https://doi.org/10.1007/s003600000129
French AR (1982) Effects of temperature on the duration of arousal episodes during hibernation. J Appl Physiol Respir Environ Exerc Physiol 52(1): 216–220. https://doi.org/10.1152/jappl.1982.52.1.216
Bieber C, Lebl K, Stalder G, Geiser F, Ruf T (2014) Body mass dependent use of hibernation: why not prolong the active season, if they can? Funct Ecol 28: 167–177. https://doi.org/10.1111/1365-2435.12173
Ануфриев АИ, Охлопков ИМ (2015) Зимняя спячка трех видов Sciuridae в Якутии с температурой тела ниже нуля. Экология 2: 125–133. [Anufriev AI, Okhlopkov IM (2015) Hibernation of three species of the Sciuridae family in Yakutia with a body temperature below zero. Russ J Ecol 46(2): 167–174. (In Russ)]. https://doi.org/10.1134/S1067413615010026
Malatesta M, Perdoni F, Battistelli S, Muller S, Zancanaro C (2009) The cell nuclei of skeletal muscle cells are transcriptionally active in hibernating edible dormice. BMC Cell Biology 10: 19. https://doi.org/10.1186/1471-2121-10-19
Belova SP, Mochalova EP, Kostrominova TY, Shenkman BS, Nemirovskaya TL (2020) P38α-MAPK signaling inhibition attenuates soleus atrophy during early stages of muscle unloading. Int J Mol Sci 21(8): 2756. https://doi.org/10.3390/ijms21082756
Ulanova A, Gritsyna Y, Vikhlyantsev I, Salmov N, Bobylev A, Abdusalamova Z, Rogachevsky V, Shenkman B, Podlubnaya S (2015) Isoform composition and gene expression of thick and thin filament proteins in striated muscles of mice after 30-day space flight. Biomed Res Int Article ID 104735. https://doi.org/10.1155/2015/104735
Cotton C (2016) Skeletal muscle mass and composition during mammalian hibernation. J Exp Biol 219: 226–234. https://doi.org/10.1242/jeb.125401
Vikhlyantsev IM, Podlubnaya ZA (2012) New titin (connectin) isoforms and their functional role in striated muscles of mammals: facts and suppositions. Biochemistry (Moscow) 77(13): 1515–1535. https://doi.org/10.1134/S0006297912130093
Vikhlyantsev IM, Karaduleva EV, Podlubnaya ZA (2008) Seasonal changes in the composition of titin isoforms in muscles of hibernating ground squirrels. Biophysics 53: 598–603. https://doi.org/10.1134/S0006350908060249
Popova S, Ulanova A, Gritsyna Yu, Salmov N, Rogachevsky V, Mikhailova G, Bobylev A, Bobyleva L, Yutskevich Ya, Morenkov O, Zakharova N, Vikhlyantsev I (2020) Predominant synthesis of giant myofibrillar proteins in striated muscles of the long-tailed ground squirrel Spermophilus undulatus during interbout arousal. Sci Rep 10: 15185. https://doi.org/10.1038/s41598-020-72127-y
Nelson OL, Robbins CT, Wu Y, Granzier H (2008) Titin isoform switching is a major cardiac adaptive response in hibernating grizzly bears. Am J Physiol Heart Circ Physiol 295(1): H366–H371. https://doi.org/10.1152/ajpheart.00234.2008
Salmov NN, Vikhlyantsev IM, Ulanova AD, Gritsyna YV, Bobylev AG, Saveljev AP, Makariushchenko VV, Maksudov GY, Podlubnaya ZA (2015) Seasonal changes in isoform composition of giant proteins of thick and thin filaments and titin (connectin) phosphorylation level in striated muscles of bears (Ursidae, Mammalia). Biochemistry (Moscow) 80(3): 343–355. https://doi.org/10.1134/S0006297915030098
Lomonosova YN, Kalamkarov GR, Bugrova AE, Shevchenko TF, Kartashkina NL, Lysenko EA, Shenkman BS, Nemirovskaya TL (2012) Role of NO-synthase in regulation of protein metabolism of stretched rat m. soleus muscle during functional unloading. Biochemistry (Moscow) 77(2): 208–216. https://doi.org/10.1134/S0006297912020137
Tatsumi R, Hattori A (1995) Detection of giant myofibrillar proteins connectin and nebulin by electrophoresis in 2% polyacrylamide slab gels strengthened with agarose. Anal Biochem 224(1): 28–31. https://doi.org/10.1006/abio.1995.1004
Vikhlyantsev IM, Podlubnaya ZA (2017) Nuances of electrophoresis study of titin/connectin. Biophys Rev 9(3): 189–199. https://doi.org/10.1007/s12551-017-0266-6
Tikunov BA, Sweeney HL, Rome LC (2001) Quantitative electrophoretic analysis of myosin heavy chains in single muscle fibers. J Appl Physiol 90(5): 1927–1935. https://doi.org/10.1152/jappl.2001.90.5.1927
Cottin P, Poussard S, Mornet D, Brustis J, Mohammadpour M, Leger J, Ducastaing A (1992) In vitro digestion of dystrophin by calcium-dependent proteases, calpains I and II. Biochimie 74(6): 565–570. https://doi.org/10.1016/0300-9084(92)90156-9
Dowling P, Gargan S, Murphy S, Zweyer M, Sabir H, Swandulla D, Ohlendieck K (2021) The Dystrophin Node as Integrator of Cytoskeletal Organization, Lateral Force Transmission, Fiber Stability and Cellular Signaling in Skeletal Muscle. Proteomes 9(1): 9. https://doi.org/10.3390/proteomes9010009
Kravtsova VV, Shenkman BS, Mikhailov VM Nikol’skiĭ EE, Krivoĭ II (2010) Effect of functional unloading and the deficit of dystrophin on the local hyperpolarization of the postsynaptic membrane of a skeletal muscle fiber. Biophysics 55: 740–744. https://doi.org/10.1134/S000635091005009X
Bottinelli R, Canepari M, Reggiani C, Stienen GJ (1994) Myofibrillar ATPase activity during isometric contraction and isomyosin composition in rat single skinned muscle fibres. J Physiol 481(3): 663–675. https://doi.org/10.1113/jphysiol.1994.sp020472
Sieck GC, Zhan WZ, Prakash YS, Daood MJ, Watchko JF (1995) SDH and actomyosin ATPase activities of different fiber types in rat diaphragm muscle. J Appl Physiol 79(5): 1629–1639. https://doi.org/10.1152/jappl.1995.79.5.1629
Lazareva MV, Trapeznikova KO, Vikhlyantsev IM, Bobylev AG, Klimov AA, Podlubnaia ZA (2012) Seasonal changes in the isoform composition of the myosin heavy chains in skeletal muscles of hibernating ground squirrels Spermophilus undulatus. Biophysics 57(6): 764–768. https://doi.org/10.1134/S0006350912060085
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


