Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 669-694
Как мышечная активность контролирует экспрессию медленного миозина
Б. С. Шенкман 1, *, К. А. Шарло 1
1 Институт Медико-биологических проблем РАН
Москва, Россия
* E-mail: bshenkman@mail.ru
Поступила в редакцию 19.02.2021
После доработки 25.03.2021
Принята к публикации 28.03.2021
Аннотация
Одной из главных гравитационно-обусловленных функций двигательной системы является поддержание вертикальной стойки. Эти функции по представлениям школы профессора И.Б. Козловской обеспечиваются тонической мышечной системой. Под термином “тоническая система” И.Б. Козловская понимала все структуры и регуляторные механизмы, способные длительное время поддерживать базальное механическое напряжение (тонус). У млекопитающих к тонической системе она относила медленные волокна с преобладающей экспрессией медленной изоформы тяжелых цепей миозина типа I(β) – MyHC I(β) и все контролирующие их нервные механизмы. Понятно, что от интенсивности экспрессии медленного миозина зависит способность мышцы длительно поддерживать тоническое напряжение. Поэтому не будет большим преувеличением, если мы назовем ген медленного миозина myh7 истинным геном мышечного тонуса. В последние годы в целом стало понятно, каким образом на фоне длительной повышенной сократительной активности мышцы запускается повышение экспрессии медленной изоформы тяжелых цепей миозина – MyHC I(β) и снижение экспрессии его быстрых изоформ. Гораздо меньше известно о механизмах снижения экспрессии MyHC I(β) при снижении сократительной активности мышцы. Этот феномен наблюдали после экспозиции в реальной невесомости, после постельной гипокинезии (bedrest), “сухой” иммерсии, а также при использовании стандартной модели вывешивания задних конечностей грызунов. Многочисленные исследования пластичности миозинового фенотипа, как правило, сосредоточены на поисках механизмов, связывающих изменения экспрессии миозиновых генов с характером сократительной активности мышечного волокна. Данные, обсужденные в обзоре, свидетельствуют о том, что постоянная экспрессия медленного миозина контролируется тонической активностью и, в свою очередь, является необходимым условием поддержания такой активности. Когда такая активность значительно снижается или прекращается, то исчезают метаболические и механические стимулы, запускающие сигнальные пути, обеспечивающие экспрессию гена myh7. Именно этот феномен и был предметом обсуждения в настоящей работе.
ВВЕДЕНИЕ
По представлениям школы профессора И.Б. Козловской, стабильное положение тела и локомоции животных на суше обеспечиваются существованием двух функциональных компонентов двигательной системы: тоническим (медленным) и фазным (быстрым). Одной из главных гравитационно-обусловленных функций двигательной системы является поддержание в гравитационном поле вертикальной стойки и положения отдельных частей тела. Эти функции обеспечиваются тонической мышечной системой. Под термином “тоническая система” И.Б. Козловская понимала не только волокна с полинейрональной иннервацией (как это принято в классической физиологии), но все структуры и регуляторные механизмы, способные длительное время поддерживать базальное механическое напряжение (тонус) [1]. У млекопитающих к тонической системе она относила медленные волокна с преобладающей экспрессией медленной изоформы тяжелых цепей миозина типа I(β) – MyHC I(β) и все контролирующие их нервные механизмы двигательного управления. Медленный миозин характеризуется, прежде всего, своей способностью длительное время находиться во взаимодействии с актином в саркомере, поддерживая существование поперечных мостиков [2]. Медленные волокна высоко-устойчивы к утомлению, что позволяет, например, преимущественно медленной камбаловидной мышце демонстрировать механическую активность в течение 12–16 ч в сутки [3]. Постоянное поддержание базального механического напряжения является не только необходимой предпосылкой нормальной работы любой мышцы, но и обязательным условием существования и двигательной деятельности животного в гравитационном поле Земли [4].
Понятно, что от интенсивности экспрессии медленного миозина зависит количество мышечных волокон первого, медленного типа и, соответственно, способность мышцы поддерживать тоническое напряжение. Поэтому, на наш взгляд, не будет большим преувеличением, если мы назовем ген медленного миозина myh7 истинным геном мышечного тонуса.
К 10-м годам XXI века в общих чертах стало понятно, каким образом на фоне длительной повышенной сократительной активности мышцы (моделируемой путем хронической низкочастотной электростимуляции – CLFS) запускается повышение экспрессии медленной изоформы тяжелых цепей миозина – MyHC I(β) и снижение экспрессии быстрых изоформ MyHC IId/x и MyHC IIb.
Гораздо меньше известно о механизмах снижения экспрессии MyHC I(β) при снижении сократительной активности мышцы [5]. Такое снижение, как правило, приводит к уменьшению доли медленных волокон в медленной камбаловидной мышце m. soleus и в смешанных мышцах конечностей. Этот феномен наблюдали у человека и животных после экспозиции в реальной невесомости в условиях космического полета [6–8], после постельной гипокинезии (bedrest) [9], “сухой” иммерсии [10], а также при использовании стандартной модели вывешивания задних конечностей грызунов [11, 12]. Аналогичную трансформацию миозинового фенотипа в направлении “от медленных к быстрым” наблюдали при гипсовой иммобилизации сустава, денервации, спинальных травмах (цит. по [13]).
Наша лаборатория вот уже 15 лет пытается расшифровать механизмы такой трансформации. Эти исследования пластичности миозинового фенотипа, проводимые как в нашей лаборатории, так и в других лабораториях мира, сосредоточены на поисках механизмов, связывающих изменения экспрессии миозиновых генов с характером сократительной активности мышечного волокна. Анализируемая ситуация представляет собой уникальную возможность проследить влияние функциональной активности ткани на механизмы регуляции экспрессии одного или немногих генов. Не исключено, что на этом примере удастся выявить некоторые общие закономерности функционально-зависимого контроля активности генов. Как будет видно из настоящего обзора, многое в этой области уже известно. Однако общая непротиворечивая картина миозиновой трансформации как от быстрых к медленным, так и обратно, пока не складывается.
Данная проблема представляет не только теоретический интерес. Мышечные волокна, в которых преобладает экспрессия медленной изоформы тяжелых цепей миозина, характеризуются не только меньшей скоростью и силой сокращения, но и высокой устойчивостью к утомлению, большей выносливостью. Поэтому раскрытие механизмов, контролирующих экспрессию гена медленного миозина, несомненно, позволит приблизиться к разработке средств и методов преодоления утомляемости в спорте, в реабилитационной, космической и экстремальной медицине.
Нам представляется интересным и важным описать как историю исследований в этой области, так и перспективы, новые подходы и неожиданные гипотезы. Именно этому и посвящена настоящая работа.
1. ТИПЫ МЫШЕЧНЫХ ВОЛОКОН. ГЕННЫЕ КЛАСТЕРЫ
С глубокой древности известно, что мышцы бывают темные и светлые, красные и белые. Луи Антуан Ранвье в 1873 г. впервые показал, что красные и белые мышцы обладают разной силой и скоростью. “Красные” – более медленные, обладают меньшей силой сокращения, но также менее утомляемые; “белые” – наоборот, более быстрые, сильные, но высоко утомляемые [14]. Некоторые авторы считают, что эта дата – начало науки о клеточных и молекулярных основах сократительной функции мышц [15]. В наше время преобладание той или иной изоформы тяжелых цепей миозина – главный критерий классификации мышечных волокон. Оно определяет не только сократительные свойства (скорость и силу), но и общий характер метаболизма и структуры волокна. Например, если “быстрая” изоформа миозина осуществляет быстрое и мощное сокращение с высокой скоростью расхода АТФ, то АТФ должна быстро синтезироваться. Синтез АТФ путем окислительного фосфорилирования для такого режима сократительной активности оказывается слишком медленным. Поэтому в волокнах с преимущественной экспрессией быстрых изоформ миозина должны доминировать анаэробные пути энергопродукции: анаэробный гликолиз и креатин-фосфатный путь. Сигнал на такое “быстрое” сокращение должен тоже подаваться быстро, соответственно вся система регуляции мышечного сокращения должна поддерживаться соответствующими “быстрыми” изоформами соответствующих ферментов. Для медленных изоформ тяжелых цепей миозина все наоборот. Таким образом, преобладание той или иной изоформы тяжелых цепей миозина в волокне определяет почти все его характеристики. Весь метаболизм, как оркестр под дирижера, выстраивается под изоформы тяжелых цепей миозина [16].
Каждая изоформа тяжелых цепей миозина является продуктом отдельного гена. Гены тяжелых цепей миозина сгруппированы в геноме в отдельные кластеры (см. обзор [13]). У крыс на хромосоме 15 расположен так называемый “сердечный” кластер генов тяжелых цепей миозина. В этом кластере два гена тяжелых цепей миозина α (myh6) и β (myh7). α – сердечный миозин, β – одновременно самая медленная изоформа сердечного миозина и медленный миозин скелетной мышцы. В скелетной мышце β-миозин принято обозначать как тяжелые цепи миозина I типа. У позвоночных животных кроме основного гена тяжелых цепей миозина Iβ (ген myh7) имеется ген myh7b (myh14) (3-я хромосома), который у взрослых млекопитающих экспрессируется в скелетной мышце в виде мРНК; на уровне белка он реализуется только в глазодвигательной (экстраокулярной) мышце и в волокнах мышечных веретен. В обычных (экстрафузальных) волокнах скелетных мышц млекопитающих этот ген экспрессируется только в эмбриогенезе. Белковый продукт этого гена (медленный “тонический” миозин) обнаруживают в ряде медленных мышечных волокон представителей Anamnia, рептилий и птиц. В хромосоме 10 у крыс и в хромосоме 17 у человека расположены гены “скелетно-мышечного” кластера, продукты которых делятся на типы: IIA, IId/x, IIB. Быстрые миозины объединяются в изоформы II типа (табл. 1 ). У них скорость сокращения выше, чем у медленных и у α-миозинов. Самые быстрые волокна – те, в которых преобладают изоформы IIB тяжелых цепей миозина. А самый медленный тип волокон – это волокна, содержащие I-й тип изоформ миозина. У волокон IIA типа из всех быстрых волокон самая высокая устойчивость к утомлению, но она не сопоставима с таковой у волокон первого типа. В этом типе волокон наиболее активны митохондриальные ферменты, здесь больше митохондрий, чем в волокнах, экспрессирующих другие быстрые изоформы тяжелых цепей миозина (IId/x и IIb), но не больше, чем в волокнах первого типа (у человека, мыши, собаки и кролика). У крупных млекопитающих, включая человека, есть изоформы I, IIA, IId/x. Самых быстрых форм миозина IIB у крупных животных нет. А у мелких – мышей и крыс, они есть [16].
В “скелетно-мышечном” кластере миозиновых генов также расположены гены эмбрионального миозина, неонатального миозина и миозина глазодвигательных мышц – экстраокулярного миозина. Все эти гены можно считать генами “быстрых” миозинов. Итак, промежуточных волокон не существует, но есть гибридные. Гибридные волокна – это те волокна, в которых экспрессируются, то есть имеются в наличии в форме белка, а не мРНК, две сопоставимые по объему изоформы миозина. Известны волокна, содержащие одновременно I и IIA, I и IId/x, IIA и IId/x изоформы миозина. Таких волокон у новорожденных примерно 5–6%. У взрослых животных и у человека – не более 2%.
Экспрессия каждой из изоформ миозина детерминируется иннервацией волокон. Волокна, иннервированные одним мотонейроном, составляют двигательную единицу и в подавляющем большинстве случаев характеризуются единым миозиновым фенотипом [17]. Позно-тонические, или постуральные мышцы (например, камбаловидная мышца), имеющие высокий тонус и поддерживающие позу организма в условиях нормального гравитационного поля, содержат наибольшее количество волокон медленного типа I [18]. Мотонейрон управляет волокнами за счет паттерна импульсации (10 Гц для “медленных” и 50–60 Гц для “быстрых” двигательных единиц), который влияет на экспрессию миозиновых генов, т.е. на миозиновый фенотип волокна. Миозиновый фенотип весьма стабилен, однако существуют воздействия, способные существенно изменить экспрессию миозиновых генов и обусловить тем самым трансформацию медленных волокон в быстрые или наоборот. Например, низкочастотная электростимуляция в течение нескольких недель приводит к появлению около 30–40% волокон медленного типа в преимущественно “быстрых” мышцах [15]. Такой же эффект в “быстрой” мышце голени m. plantaris наблюдается у животного с удаленной или тенотомированной трехглавой мышцей голени, т.е. с компенсаторной перегрузкой [19]. Во всех этих случаях ведущую роль в изменении миозинового фенотипа приписывают изменению паттерна сократительной активности мышцы в результате изменения характера импульсации мотонейрона или в результате прямой импульсации путем электростимуляции.
2. КОГДА ЛЕНИВАЯ МЫШЦА НАЧИНАЕТ РАБОТАТЬ. ХРОНИЧЕСКАЯ СТИМУЛЯЦИЯ. КАЛЬЦИЙ “ВКЛЮЧАЕТ” ГЕН
К настоящему моменту известно, что паттерн импульсации мышечного волокна регулирует фенотип данного волокна, изменяя уровень экспрессии генов изоформ тяжелых цепей миозина. Режим низкочастотной стимуляции позволяет длительное время поддерживать сократительную активность быстрых мышечных волокон, нативная активность которых проявляется крайне редко и ограничивается несколькими минутами в сутки [3]. Именно хроническая активность этих “ленивых” мышц и приводит к повышению экспрессии ранее репрессированного гена myh7, кодирующего медленную изоформу тяжелых цепей миозина.
Тем не менее, за счет каких именно молекулярных механизмов осуществляется эта регуляция в целом, при различных режимах работы мышцы, и, в частности, при хронической низкочастотной электростимуляции, до сих пор известно не полностью. Среди пусковых механизмов, определяющих ответ мышечных волокон на низкочастотную электростимуляцию, разные авторы упоминают увеличение в миоплазме волокон скелетных мышц ионов кальция, активирующих сигнальный путь кальцинейрин/NFATc1 и кальций-кальмодулин-зависимую киназу II, и снижение соотношения ATФ/АДФ, приводящее к активации AMФ-активируемой протеинкиназы [20–22].
Различная частота генерации импульсов мотонейронами приводит к различиям в амплитуде и длительности колебаний концентрации ионов кальция внутри мышечных волокон различных типов. Развитие потенциала действия на мембране мышечного волокна приводит к открытию дигидропиридиновых рецепторов, которые в свою очередь приводят к активации рианодиновых каналов и выбросу кальция из саркоплазматического ретикулума; данный механизм является основой электромеханического сопряжения в скелетной мышце [23].
В нормальном режиме двигательной активности млекопитающего волокна постуральных мышц активны около 33% времени, тогда как скелетные волокна “быстрого” типа в зависимости от подтипа активны от 3% до 0.01% времени в течение суток [3]: таким образом, несмотря на то, что амплитуда кальциевого сигнала при активации быстрых скелетных волокон выше, чем при активации медленных, интегральная концентрация кальция в течение суток значительно больше в медленных скелетных волокнах. Концентрация кальция в покое в “медленных” мышечных волокнах также значительно выше чем в “быстрых” волокнах [16].
Содержание ионов кальция внутри волокон “быстрых” мышц extensor digitorum longus (EDL) и tibialis anterior крысы уже в первые сутки низкочастотной электростимуляции возрастает от 2.5 до 3.8 раз и остается повышенным даже спустя двое суток после прекращения стимуляции [24]. При низкочастотной стимуляции extensor digitorum longus концентрация ионов кальция в покое внутри мышечных волокон возрастала вдвое, приближаясь к значениям, характерным для “медленной” камбаловидной мышцы [25]. Низкочастотная электростимуляция “быстрых” мышц кролика приводит к возрастанию в скелетных волокнах “медленной” изоформы кальциевой АТФазы и Na/K-АТФазы, кальсеквестрина и кальретикулина, таким образом способствуя устойчивому повышению концентрации ионов кальция в саркоплазме мышечных волокон [26].
Отдельно следует отметить, что помимо классического механизма сопряжения возбуждения и сокращения существует и другой, “медленный” путь накопления ионов кальция в миоплазме в период между мышечными сокращениями. Суть этого механизма состоит в том, что в процессе работы мышцы происходит выход из мышечного волокна АДФ и АТФ, которые связываются с P2Y рецепторами и активируют их. Aктивация P2Y рецепторов, связанных с G-белками, через G-белки активирует PI3-киназу, что способствует превращению фосфатидилинозитол-бифосфата в фосфатидилинозитол-трифосфат, который при взаимодействии с фосфолипазой С приводит к расщеплению фосфатидилинозитол-бифосфата на диацилглицерол и инозитол-1,4,5-трифосфат (IP3). IP3 связывается с IP3-рецепторами, представляющими собой кальциевые каналы, располагающимися в мембранах саркоплазматического ретикулума, митохондрий и ядер, и приводит к выбросу ионов кальция из внутриклеточных депо [27]. Вполне возможно, что данный механизм играет важную роль в поддержании высокого уровня ионов кальция в миоплазме “медленных” волокон, однако пока его значение остается малоизученным.
Повышение концентрации ионов кальция покоя способствует запуску ряда молекулярных сигнальных каскадов, включающих в себя кальций-зависимые протеинкиназы, такие как кальций-кальмодулин-зависимая киназа II, и кальций-зависимая фосфатаза кальцинейрин. Данные ферменты регулируют работу транскрипционных активаторов и репрессоров, согласованное взаимодействие которых управляет экспрессией кальций-зависимых генов. Таким образом осуществляется процесс “сопряжения возбуждения и транскрипции” (excitation-transcription coupling), связывающий активность мышечного волокна и экспрессию генов в данном волокне, что в свою очередь определяет фенотип волокна и его функциональные свойства.
Рис. 1.
Схема регуляции экспрессии медленной изоформы тяжелых цепей миозина в условиях электростимуляции. CaN – кальцинейрин, NFATc1 – ядерный фактор активации Т-лимфоцитов, цитоплазматический 1, MEF-2 – миогенный регуляторный фактор, HDAC4 – гистондеацетилаза 4, MyHC I – изоформа тяжелых цепей миозина типа I, CaMK II – кальций-кальмодулин-зависимая киназа, АМPK – АМФ-зависимая протеинкиназа, GSK-3β – киназа гликогенсинтазы 3β, P – фосфорилирование, Ас – ацетилирование, nitric oxide – оксид азота.
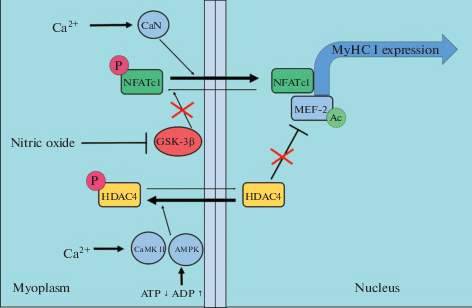
Рис. 2.
Схема регуляции экспрессии медленной изоформы тяжелых цепей миозина в условиях функциональной разгрузки. CaN – кальцинейрин, NFATc1 – ядерный фактор активации Т-лимфоцитов, цитоплазматический 1, MEF-2 – миогенный регуляторный фактор, HDAC4 – гистондеацетилаза 4, CaMK II – кальций-кальмодулин-зависимая киназа II, АМPK – АМФ-зависимая протеинкиназа, MyHC I – изоформа тяжелых цепей миозина I, GSK-3β – киназа гликогенсинтазы3β, p38 – МАП-киназа p38, calsarcin – кальсарцин-2, P – фосфорилирование, Ас – ацетилирование, nitric oxide – оксид азота.
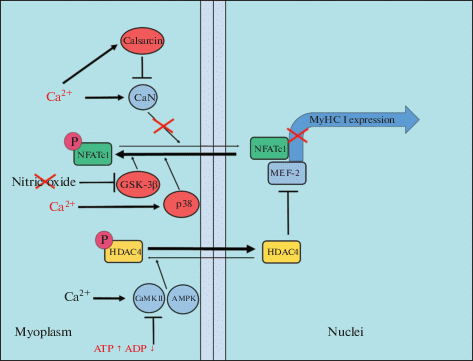
Рис. 3.
Схема микро-РНК –зависимой регуляции экспрессии генов с участием медленной изоформы тяжелых цепей миозина. MyHC I – изоформа тяжелых цепей миозина I, miR-208 – микро-РНК 208, miR-499 – микро-РНК 499, myh7b – медленная тоническая изоформа миозина 7b, SOX6 – SRY-бокс транскрипционный фактор 6, PGC1α – коактиватор гамма-рецептора, активируемого пролифератором пероксисом 1-альфа, mitochondrial biogenesis – митохондриальный биогенез.

Кальцинейрин представляет собой серин/треониновую фосфатазу, активируемую Ca2+-кальмодулиновым комплексом. Одним из субстратов кальцинейрина являются транскрипционные факторы семейства NFAT (ядерный фактор активации Т-лимфоцитов, цитоплазматический). В скелетных мышцах кальцинейрином регулируются четыре транскрипционных фактора данного семейства, NFATc1–NFATc4 [28]. Дефосфорилирование ряда сериновых остатков, расположенных у N-конца молекул NFAT в серин-пролиновом (SP) повторе приводит к изменению конформации данных молекул, экспонированию участков ядерной локализации (NLS) и транслокации в ядро [28, 29]. Внутри ядра NFATc1 связывается с промотором гена медленной изоформы MYHC myh7 и активирует транскрипцию этого гена, взаимодействуя с другими транскрипционными коактиваторами, включая транскрипционные факторы семейства MEF-2. В экспериментах с флуоресцентными репортерами транскрипционной активности NFATc1 in vivo в скелетных мышцах крыс показано, что NFATc1 является сенсором нервно-мышечной активности скелетных мышц: уровень NFATс1-зависимой транскрипции был выше в медленных мышцах в сравнении с быстрыми, при этом в денервированных медленных мышцах его транскрипционная активность снижалась, а при низкочастотной электростимуляции денервированных мышц восстанавливалась. При этом при высокочастотной электростимуляции, соответствующей режиму работы быстрых скелетных мышц, восстановления NFATc1-зависимой транскрипции не происходило [30]. В опытах с флуоресцентным мечением самой молекулы NFATc1 показано, что в камбаловидной мышце NFATc1 локализован преимущественно в мышечных ядрах; при этом уже 2 ч полной неподвижности камбаловидной мышцы приводят к его экспорту из ядер. При низкочастотной электростимуляции “быстрых” мышц, NFATc1, в быстрых мышцах локализованный преимущественно в цитоплазме, перемещается в мышечные ядра [31]. В экспериментах Calabria и соавт., в которых изучалось перемещение в ядро различных изоформ NFAT в зависимости от вида электростимуляции в волокнах преимущественно “быстрой” мышцы extensor digitorium longus, было показано, что в покое в ядрах мышечных волокон данной мышцы находится только изоформа NFATc4. При низкочастотной электростимуляции в ядрах локализуются все четыре изоформы NFAT, тогда как при высокочастотной стимуляции, моделирующей активность быстрых двигательных единиц, в ядрах локализуются NFATc3, NFATc4 и, в меньшей степени, NFATc2 [32]. Таким образом, транскрипционные факторы NFAT совместно управляют экспрессией различных миозиновых изоформ в соответствии с режимом сократительной активности скелетной мышцы.
Вклад кальций-кальмодулин-зависимой киназы II в регуляцию экспрессии медленного миозина на фоне низкочастотной электростимуляции изучен в меньшей степени, несмотря на то, что чувствительность кальций-кальмодулин-зависимой киназы II к колебаниям уровня ионов кальция и ее способность активировать экспрессию генов медленного фенотипа скелетного волокна хорошо изучена на других моделях [33, 34]. Тем не менее, показано, что специфическое ингибирование кальций-кальмодулин-зависимой киназы II при электростимуляции культуры миотуб flexor digitorum brevis приводит к частичному предотвращению трансформации мышечных волокон в “медленную” сторону [35]. Кальций-кальмодулин-зависимая киназа II наряду с АМФ-активируемой протеинкиназой (AMPK) регулирует активность транскрипционного репрессора гена медленного миозина, гистондеацетилазы 4, и, опосредованно, активность транскрипционного фактора MEF-2D, который блокирует гистондеацетилаза 4 [36, 37]. При этом кальцинейрин, обеспечивающий транслокацию в ядро транскрипционных факторов NFAT, также способен повышать транскрипционную активность факторов семейства MEF-2 [38–40]. Гистондеацетилаза 4 располагается преимущественно в цитоплазме “медленных” скелетных волокон окислительного типа, тогда как в “быстрых” скелетных волокнах HDAC4 локализуется преимущественно в мышечных ядрах [37]. Повышение уровня ионов кальция блокирует репрессорную активность гистондеацетилазы 4: выброс ионов кальция приводит к связыванию кальций-кальмодулинового комплекса с кальций-кальмодулин-зависимой киназой (CaMK), которая активируется и фосфорилирует гистондеацетилазу 4, что приводит к ее экспорту из мышечных ядер [41, 42 ] . Низкочастотная электростимуляция приводит к CaMK-зависимому фосфорилированию HDAC4 и удалению ее из мышечных ядер, а также к усилению MEF-2 зависимой транскрипции [43].
Кальций-зависимый путь регуляции экспрессии медленной изоформы MYHC является наиболее изученным. Тем не менее, ряд исследований позволяет прийти к выводу, что паттерн иннервации регулирует экспрессию гена myh7 не только с помощью кальций-зависимых механизмов. В частности, транслокация гистондеацетилазы 4 в мышечные ядра регулируется не только кальций-зависимым образом, но также с помощью AMPK [44]. Соотношение уровня макроэргических фосфатов в скелетной мышце, т.е. энергетический потенциал мышечных волокон является важным регуляторным сигналом и запускает ряд сигнальных каскадов, направленных на обеспечение функционирования мышцы в условиях повышенного расхода энергии. АМФ-активируемая протеинкиназа представляет собой ключевой энергосенсор скелетной мышцы, активирующийся в ответ на снижение соотношения АТФ/АДФ, повышение уровня АМФ и снижение содержания гликогена в мышечных волокнах. Активация AMPK, помимо регулирования уровня белкового обмена, приводит к активации ключевых факторов биогенеза митохондрий и к трансформации миозинового фенотипа волокон в “медленную” сторону. Хроническая низкочастотная электростимуляция мышцы tibialis anterior кролика приводит к снижению уровня АТФ и фосфокреатина, что сопровождается трансформацией миозинового фенотипа в “медленную” сторону, причем снижение соотношения АТФ к АДФ предшествует трансформации волокон [45, 46]. В работе Putman и соавт. показано, что введение креатина предотвращает как снижение соотношения АТФ к АДФ в волокнах скелетных мышц, так и трансформацию миозинового фенотипа в “медленную” сторону в ответ на хроническую низкочастотную стимуляцию [47]; таким образом, активность транскрипции медленной изоформы MYHC регулируется как кальций-зависимыми, так и энерго-зависимыми механизмами.
Еще одним регуляторным сигналом при электростимуляции является оксид азота. На культуре миотуб C2C12 было показано, что оксид азота через активацию гуанилатциклазы и протеинкиназы G способствует фосфорилированию GSK-3β по 9-му остатку серина, что приводит к инактивации данной киназы. GSK-3β противодействует кальцинейрину, фосфорилируя транскрипционный фактор NFATc1 и удаляя его из мышечных ядер, таким образом, блокирование активности GSK-3β приводит к накоплению NFATc1 в мышечных ядрах и восстановлению экспрессии медленной изоформы MYHC [48]. Активность NO-синтазы возрастает как при низкочастотной электростимуляции, так и при произвольной сократительной активности скелетных мышц [49–51]. После прекращения электростимуляции активность GSK-3β является необходимой для выхода NFATc1 из мышечных ядер [52] – вероятно, после прекращения сеанса электростимуляции уровень оксида азота в мышечных волокнах падает, что приводит к активации GSK-3β, однако изменение содержания оксида азота в скелетных мышцах на фоне электростимуляции и сразу же после нее не проводилось . В работе Martins и соавт. было убедительно показано, что оксид азота играет ключевую роль в трансформации миозинового фенотипа волокон скелетных мышц при низкочастотной электростимуляции in vivo: блокирование активности NO-синтазы с помощью ингибитора L-NAME предотвращает транслокацию NFATc1 в мышечные ядра, как и увеличение экспрессии медленной изоформы MYHC [53]. На основании этих данных можно сделать вывод, что оксид азота, наряду с ионами кальция, также является одним из регуляторных сигналов, связывающих режим активности скелетного волокна с паттерном экспрессии миозиновых генов в данном волокне.
Отдельно следует рассмотреть регуляторный каскад, активирующий экспрессию гена myh7 по механизму положительной обратной связи. Ключевую роль в данном процессе играют микро-РНК. В процессе экспрессии мРНК гена myh7, кодирующего медленную изоформу MYHC, также происходит экспрессия микро-РНК 208b, закодированной в одном из интронов этого гена. В сердечной мышце экспрессируется микро-РНК 208а, закодированная в интроне сердечной изоформы MYHC myh6 [54]. Микро-РНК 208a и 208b способны индуцировать экспрессию гена myh7b, который представляет собой древний ген одной из миозиновых изоформ, у человека и у крысы практически не присутствующий в мышечном волокне постуральных мышц на уровне белка и имеющий исключительно регуляторную роль. мРНК гена myh7b кодирует регуляторную микро-РНК 499 [54]. Микро-РНК 499 и микро-РНК 208b связываются с 3'-нетранслируемой областью генов транскрипционных репрессоров, включая SOX6, блокирующий транскрипционную активность гена myh7, и блокируют их экспрессию [55–57], что приводит к активации транскрипции генов, с которыми связываются данные репрессоры, включая ген медленного миозина. Показано, что хроническая низкочастотная стимуляция активирует экспрессию микро-РНК 499 и 208 в камбаловидной мышце крыс, а также снижает содержание в ней транскрипционного репрессора SOX6 на фоне моделирования хронической болезни легких [58]. Тем не менее, роль данного механизма в трансформации фенотипа волокон на фоне электростимуляции изучена слабо.
Итак, серия классических экспериментов с низкочастотной электростимуляцией, кальциевыми ионофорами и плазмидной трансфекцией позволила сформировать более или менее целостное представление о механизмах повышения интенсивности экспрессии медленного миозина при повышении объема сократительной активности волокна. Оказалось, что в этот процесс вовлечены кальций-зависимые и энерго-зависимые механизмы ядерного траффика транскрипционных факторов (NFATc1 и Mef2D и гистондеацетилазы 4 (HDAC4). Важно и то, что эти агенты, как способствующие, так и препятствующие экспрессии MyHC I(β), могут быть устранены из ядерного пространства под действием специфических киназ. Механизмы сайт-специфичного связывания NFATc1 и HDAC4 с промотором гена myh7 изучены гораздо хуже, однако, скорее всего, они основаны на какой-либо из пост-трансляционных модификаций этих молекул-посредников. Микро-РНК-зависимые механизмы, а также механизмы метилирования/деметилирования ДНК применительно к экспрессии медленного миозина изучены пока крайне недостаточно.
То же можно сказать и про механизмы, препятствующие экспрессии медленного миозина в условиях пониженной сократительной активности или ее полного прекращения.
3. КОГДА ОТКЛЮЧАЕТСЯ ПОСТУРАЛЬНАЯ МЫШЦА. ДЕНЬ ПЕРВЫЙ. AMPK И ГИСТОНДЕАЦЕТИЛАЗЫ. GSK3Β
Исследования влияния функциональной разгрузки на скелетные мышцы проводятся как во время космических полетов (гравитационная разгрузка) [59, 60], так и с использованием наземных моделей, имитирующих гравитационную разгрузку: антиортостатической гипокинезии [61] и сухой иммерсии [62], или же модели антиортостатического вывешивания задних конечностей в экспериментах на грызунах [63, 64]. Трансформация миозинового фенотипа в быструю сторону (т.е. снижение содержания белка и мРНК медленной изоформы MYHC и увеличение содержания “быстрых” миозиновых изоформ) в той или иной степени наблюдается при использовании каждой из этих моделей [6, 8, 11, 12, 59, 65–67].
Сократительная активность постуральных мышц, прежде всего камбаловидной мышцы, определяется двумя основными биомеханическими факторами, действующими на двигательную систему животного и человека на нашей планете: осевой нагрузкой и силой реакции опоры. Оба фактора оказывают свое влияние в условиях земной гравитации и устраняются в условиях невесомости. При моделировании действия невесомости на Земле осевая нагрузка значительно снижена практически в одинаковой степени в условиях “сухой” иммерсии и постельной гипокинезии (bedrest). При этом сила реакции опоры в условиях гипокинезии перераспределена по поверхности тела и снижена, однако не устранена. В условиях иммерсии опора практически отсутствует для тела, “взвешенного” в воде [68, 69]. При моделировании невесомости у крыс методом антиортостатического вывешивания задних конечностей действие обоих факторов на заднюю часть тела животного пренебрежительно мало. Особый интерес представляют физиологические последствия устранения осевой механической нагрузки и особенно опоры. В экспериментах с вывешиванием задних конечностей, с кратковременной невесомостью при полете по параболе Кепплера у крыс, при сухой иммерсии у человека было неоднократно показано драматическое снижение, иногда вплоть до полного подавления, электрической активности камбаловидной мышцы [65, 70, 71].
Таким образом, устранение гравитационно-зависимых механических влияний приводит к “отключению” электрической и соответственно механической активности камбаловидной мышцы, основной антигравитационной мышцы млекопитающих. Это происходит уже в течение первых нескольких часов моделируемой гравитационной разгрузки. Возвращается электрическая активность камбаловидной мышцы к контрольному уровню лишь между 6-м и 9-м днями вывешивания [71]. При этом необходимо отметить, что восстановление электрической активности камбаловидной мышцы не приводит к восстановлению нормального для постуральных мышц процента “медленных” волокон. Таким образом, трансформацию миозинового фенотипа на фоне функциональной разгрузки нельзя рассматривать как процесс обратный трансформации фенотипа в “медленную” сторону на фоне хронической низкочастотной стимуляции.
Результаты исследований, проведенных как в нашей лаборатории, так и за рубежом, свидетельствуют о том, что процесс изменения миозинового фенотипа постуральных мышц при функциональной разгрузке характеризуется нелинейностью и сменой определяющих данный процесс молекулярных регуляторов в ходе функциональной разгрузки. Тем не менее, ключевыми регуляторными сигналами, связывающими активность мышечного волокна и экспрессию гена медленной изоформы MYHC являются все те же три фактора, рассмотренные нами в предыдущем разделе: ионы кальция, оксид азота и соотношение уровня АТФ к АДФ. Отдельно следует рассмотреть роль ионов кальция в изменении экспрессии медленного миозина, поскольку накопленные в последние годы экспериментальные данные свидетельствуют о двойственности эффектов данного регулятора на экспрессию медленного миозина при функциональной разгрузке.
Снижение уровня экспрессии пре-мРНК и мРНК медленной изоформы MYHC в камбаловидной мышце наблюдается уже после первых суток вывешивания [72, 73]. Данные об экспрессии мРНК медленной изоформы MYHC после третьих суток вывешивания более противоречивы: ранее в нашей лаборатории, также, как и в работе Desaphy, была показана лишь тенденция к снижению экспрессии [74, 75], однако некоторые исследователи обнаруживали достоверное снижение экспрессии мРНК медленной изоформы MYHC после вторых суток и после четвертых суток вывешивания [72, 76]. После седьмых суток вывешивания и позднее наблюдается достоверное снижение экспрессии медленной изоформы MYHC как на уровне мРНК, так и на уровне белка, что показано во множестве исследований [13, 72, 77, 78]. Причины такого нелинейного изменения экспрессии медленного миозина в ходе функциональной разгрузки непосредственно связаны с кальций-зависимой регуляцией и будут рассмотрены далее по ходу обзора.
В нашей лаборатории было показано, что энерго-зависимые сигнальные процессы играют важную роль в экспрессии медленной изоформы MYHC на раннем этапе моделируемой гравитационной разгрузки: уже после первых суток вывешивания происходит инактивация AMPK, что сопровождается значительным увеличением содержания в мышечных ядрах камбаловидной мышцы гистондеацетилазы 4, при этом введение активатора AMPK предотвращает снижение экспрессии мРНК медленной изоформы MYHC, накопление в ядре гистондеацетилазы 4 и инактивацию AMPK [73, 79]. Еще в 1990-х годах было выдвинуто предположение, что моделируемая гравитационная разгрузка ведет к нарушению баланса макроэргических фосфатов в скелетной мышце и к сдвигу равновесия в сторону более высокоэнергетических соединений [80]. Уже после первых суток вывешивания в волокнах камбаловидной мышцы достоверно повышался уровень гликогена, являющегося ингибитором активности AMPK [81, 82]. После десяти дней вывешивания крыс в камбаловидных мышцах было обнаружено накопление фосфокреатина [83]. Применение β-гуанидинпропионовой кислоты, сдвигающей соотношение АТФ/АДФ + АМФ в сторону более низкоэнергетических фосфатов и являющейся активатором AMPK, предотвращало трансформацию миозинового фенотипа камбаловидных мышц вывешенных животных в “быструю” сторону после десяти дней вывешивания [84]. Тем не менее, общие механизмы влияния накопления макроэргических соединений на экспрессию миозиновых изоформ в условиях функциональной разгрузки остаются неясными с учетом того факта, что уже после 7-ми суток вывешивания активность AMPK возвращается к контрольному уровню, а к 14-м суткам она вдвое превышает значения, характерные для группы контроля [79].
Также в нашей лаборатории было впервые обнаружено, что уже после первых суток вывешивания содержание NFATc1 в мышечных ядрах снижено вдвое в сравнении с контролем, а NFAT-зависимая транскрипционная активность, измеренная по содержанию мРНК NFAT-зависимой изоформы гена MCIP1.4, снижается более чем на 90 процентов [85, 86]. Маловероятно, что такое изменение связано с кальций-зависимыми механизмами, поскольку содержание ионов кальция в миоплазме камбаловидных мышц на первые сутки вывешивания не отличается от контроля [87]. С учетом того факта, что уже в первые сутки функциональной разгрузки активируется киназа GSK-3β [88] а также падает уровень оксида азота в миоплазме камбаловидных мышц (неопубликованные данные), можно предположить, что инактивацию NFATc1 в первые сутки функциональной разгрузки определяет именно снижение уровня оксида азота. После 7-ми суток вывешивания содержание NFATc1 в мышечных ядрах также снижено, при этом фармакологическое восполнение дефицита NO до контрольного уровня приводит к инактивации GSK-3β, увеличению содержания NFATc1 в мышечных ядрах и поддержанию экспрессии медленной изоформы MyHC [89].
Таким образом, очевидно, что уже в течение первых суток после устранения опоры и тонической электрической (и сократительной) активности камбаловидной мышцы запускается перестройка ряда сигнальных механизмов, обеспечивающая снижение экспрессии гена медленного миозина myh7. Является ли данный эффект уникальным для данной экстремальной ситуации, практически не встречающейся (в таком виде) в обычной жизни животного? Оказывается, нет. В весьма элегантном эксперименте Dyar и соавт. [90] показали, что циклические изменения двигательной активности животного, наблюдаемые в рамках суточного цикла (день/ночь), сопровождаются соответствующими изменениями ядерно-цитоплазматического траффика NFATc1. При снижении двигательной активности и соответствующем снижении сократительной активности данной мышцы содержание NFATc1 в ядрах мышечного волокна снижается, при возобновлении активности - снова повышается. Эта цикличность не обнаруживается при денервации мышцы. Поэтому мы вполне можем предположить, что наблюдаемые при хронической разгрузке изменения ядерно-цитоплазматического траффика NFATc1 являются продолжением и углублением процессов, сопровождающих периодически наступающее состояние физиологического покоя [91].
4. КАЛЬЦИЕВЫЙ РЕВАНШ И ЕГО ПОСЛЕДСТВИЯ
После 3-х суток разгрузки наблюдается временное прекращение процесса редукции экспрессии myh7 [75]. При этом содержание мРНК медленной изоформы тяжелых цепей миозина примерно соответствует уровню виварного контроля. Мы предположили, что такое временное восстановление экспрессии медленного миозина может быть следствием известного накопления ионов кальция в мышечные волокна уже после 2-х суток разгрузки (“кальций-зависимый реванш”) [67, 87, 92, 93] с последующей активацией кальцинейрина и транслокацией NFATc1 в миоядра. Для проверки этой гипотезы мы проанализировали экспрессию миозиновых генов, содержание регуляторов транскрипции данных генов в мышечных ядрах и активность киназы AMPK в эксперименте с 3-суточным вывешиванием на фоне введения блокатора кальциевых каналов L-типа нифедипина [94]. После 3-х суток вывешивания в группе “чистого” вывешивания достоверно понизилось содержание мРНК MyHC I(β) и мРНК MyHC IIa. При этом содержание зрелой мРНК медленной изоформы MyHC в этой группе не имело достоверных отличий от группы контроля. В группе с введением нифедипина содержание пре-мРНК MyHC I(β), а также экспрессия быстрых миозиновых генов не отличалась от группы “чистого” вывешивания, и имела те же отличия от контроля, однако экспрессия мРНК медленной изоформы MyHC I(β) была достоверно снижена в сравнении с группой “чистого” вывешивания. Таким образом, блокирование кальциевых каналов L-типа, препятствуя накоплению ионов кальция, приводит к снижению экспрессии медленной изоформы миозина на третьих сутках вывешивания. Данный факт подтверждает гипотезу о кальций-зависимой реактивации экспрессии медленной изоформы MyHC на третьи сутки вывешивания. Отсутствие различий в уровне экспрессии пре-мРНК MyHC I(β) при наличии различий в уровнях зрелой мРНК MyHC I(β b) в группах 3HS и 3HS + nif свидетельствует о том, что кальций-зависимая реактивация экспрессии медленного миозина носит временный характер.
Также мы проанализировали экспрессию NFAT-зависимого гена MCIP1.4 (модулирующий белок, взаимодействующий с кальцинейрином). Экспрессия MCIP1.4 была достоверно снижена в обеих вывешенных группах в сравнении с группой виварного контроля; при этом в группе “чистого” вывешивания уровень экспрессии мРНК MCIP1.4 составил 56% от группы виварного контроля, а в группе 3HS + nif – 42% от группы виварного контроля. При этом содержание NFATc1 в ядерной фракции камбаловидных мышц контрольных животных и животных из группы “чистого” вывешивания не различалось между собой, тогда как в группе вывешенных животных, получавших нифедипин, содержание NFATc1 в ядерной фракции было достоверно снижено вдвое в сравнении с группой 3HS. На основании этих данных можно сделать вывод, что транзиторное увеличение содержания NFATc1 в мышечных ядрах на третьи сутки вывешивания, показанное в более ранних работах, обусловлено кальций-зависимой реактивацией импорта NFATc1 в мышечные ядра, вероятнее всего, за счет активности кальций-зависимой фосфатазы кальцинейрина, дефосфорилирующей NFATc1, что приводит к его входу в мышечные ядра. При этом отсутствие достоверных различий между уровнем экспрессии MCIP1.4 в обеих группах вывешенных животных можно объяснить транзиторным характером этой реактивации.
Кальций-зависимая реактивация экспрессии медленной изоформы MyHC может осуществляться не только за счет восстановления ядерного NFATc1, но и за счет кальций-зависимого импорта гистондеацетилазы 4 путем ее фосфорилирования кальций-кальмодулин-зависимой киназой II. Кроме того, фосфорилирование гистондеацетилазы 4 может осуществляться с помощью АМРК, активность которой может регулироваться киназой кальций-кальмодулин-зависимой протеинкиназы бета (CaMKKβ).
Содержание гистондеацетилазы 4 в ядерной фракции в группе чистого вывешивания не отличалось от контроля. Однако в группе с введением нифедипина ядерное содержание гистондеацетилазы 4 достоверно повышено почти в три раза. Эти данные подтверждают нашу гипотезу о кальций-зависимом импорте гистондеацетилазы 4. Однако то, за счет каких киназ осуществляется данный трафик, нуждается в дальнейшем изучении. Содержание гистонацетилтрансферазы р300 в ядерной фракции в группе чистого вывешивания не отличалось от контроля. Однако в группе с введением нифедипина ядерное содержание р300 достоверно повышено почти в два раза. По-видимому, ядерный импорт р300 осуществляется также в кальций-зависимым способом. Однако молекулярные механизмы этого процесса неизвестны. На основании этих данных можно сделать вывод, что эпигенетические механизмы регуляции экспрессии MyHC I(β) также могут принимать участие в осуществлении кальций-зависимой реактивации экспрессии медленного миозина на третьи сутки вывешивания.
Следует подчеркнуть, что “кальциевый реванш” экспрессии медленного миозина является транзиторным: уже на седьмые сутки вывешивания экспрессия медленной изоформы тяжелых цепей миозина остается стабильно сниженной. В связи с этим интересны молекулярные механизмы подавления кальций-зависимого реванша. Вполне возможно, что, начиная с определенного момента, накопление ионов кальция выше контрольного уровня приводит не к активации, а к подавлению экспрессии медленного миозина. Так, оказалось, что ингибирование митоген-активируемой протеинкиназы p38 (фосфорилирование которой возрастает в этот период) приводит к повышению содержания NFATc1 в миоядрах и к повышению экспрессии медленного миозина [95]. Из ранних работ известно, что кальций может быть одним из активаторов MAPK p38 [96]. Таким образом, активность p38 может вносить вклад в кальций-зависимое подавление активности NFATc1 и экспрессии медленного миозина. Также следует обратить внимание на тот факт, что, начиная с третьих суток вывешивания, возрастает экспрессия эндогенного ингибитора кальцинейрина, кальсарцина-2 и остается повышенной минимум до 14-ти суток вывешивания [75]. Возможно, что именно кальсарцин блокирует активность кальцинейрина и это приводит к нивелированию кальций-индуцированной активации кальцинейрина. NO-зависимые механизмы регуляции экспрессии медленного миозина также вносят вклад в экспрессию медленного миозина как на 1–3, так и на 7-е сутки вывешивания: в 2021 г. в нашей лаборатории было показано, что оксид азота играет ключевую роль в эффекте механической опорной стимуляции на поддержание медленного фенотипа волокон камбаловидной мышцы на фоне 7-ми суток вывешивания, причем в этот процесс вовлечен как сигнальный путь NO/GSK-3/NFATc1, так и эпигенетические регуляторные механизмы [97]. Тем не менее, маловероятно, что данные механизмы играют ключевую роль в подавлении кальций-зависимого реванша, поскольку падение уровня оксида азота, как и активация киназы GSK-3β, наблюдается уже после первых суток вывешивания [85].
В нашей лаборатории ранее было показано, что применение нифедипина на фоне вывешивания, но при более продолжительных сроках воздействия, приводит к предотвращению трансформации медленных волокон в быстрые [98]. Эти данные свидетельствуют о том, что накопление ионов кальция может привести не только к активации сигнального пути кальцинейрин/NFATc1 и к временной реактивации экспрессии медленного миозина, но и к активации протеинкиназ, фосфорилирующих NFATc1, и тем самым способствующих его изгнанию из ядер и к блокированию экспрессии медленного миозина. К сожалению, мы еще далеки от понимания механизмов этих процессов.
Накопление ионов кальция в мышечном волокне в условиях разгрузки внешне напоминает компенсаторное событие, возвращающее волокно к его нормальному гомеостатическому состоянию. Однако это событие, по-видимому, слишком сильно влияет на сигнальные процессы, которые не приходят в равновесное состояние, а наоборот, в еще большей степени подталкивают смещение миозинового фенотипа.
5. ВТОРАЯ НЕДЕЛЯ. ВСЕ РЕГУЛЯТОРЫ В ЯДРЕ. ИНАКТИВАЦИЯ NFATC1
На данный момент мы имеем некоторое представление о регуляции экспрессии медленной изоформы тяжелой цепи миозина на сверхранних (1-е сутки), ранних и средних (3–7-е сутки) сроках вывешивания. Полученные экспериментальные данные убедительно показывают, что трансформация миозинового фенотипа в процессе функциональной разгрузки происходит нелинейно и определяется действием всех трех ключевых регуляторов (ионов кальция, оксида азота, соотношением АТФ к АДФ), причем их относительный вклад меняется в зависимости от стадии разгрузки. Исследование более поздних сроков функциональной разгрузки (14 сут) также свидетельствует о нелинейности процессов и об очередной смене механизмов контроля экспрессии медленного миозина на данном этапе: после 14-ти сут вывешивания содержание в мышечных ядрах всех ключевых транскрипционных регуляторов медленного миозина (NFATc1, MEF-2D, гистондеацетилазы 4) соответствует контрольным значениям, однако несмотря на это как экспрессия медленного миозина, так и NFAT-зависимая транскрипция (мРНК MCIP1.4) остается пониженной [86]. Контрольное (или даже повышенное) содержание NFATc1 в мышечных ядрах после 14-ти суток вывешивания на фоне пониженной экспрессии медленного миозина наблюдалось и другими авторами [99, 100]. Таким образом, после 14-ти суток функциональной разгрузки (и, возможно, на более поздних сроках) некие молекулярные механизмы супрессируют транскрипционную активность NFATc1 внутри ядра – и поиск этих механизмов представляет актуальную научную задачу.
В 2010 г. было показано, что внутриядерный NFATc1 может локализоваться в гетерохроматине, не взаимодействуя с промоторными участками медленной изоформы MYHC и с другими транскрипционными регуляторами экспрессии миозина [101]. Следовательно, наличие NFATc1 в мышечном ядре может являться необходимым, но не достаточным условием активации NFATc1-зависимой транскрипции, что подтверждается нашими данными о несоответствии содержания NFAT в ядре и его активности после 14-ти суток вывешивания. Причины скопления NFATc1 в гетерохроматиновых областях, как и механизмы, с помощью которых происходит перемещение внутриядерного NFATc1 к промоторным участкам медленной изоформы MYHC, до сих пор остаются неизученными. Тем не менее, к настоящему времени известно, что, помимо регуляции транскрипционной активности NFATc1 за счет ядерно-цитоплазматического траффика, существуют механизмы, регулирующие транскрипционную активность внутриядерного NFATc1 с помощью посттрансляционных модификаций. В частности, было показано, что ацетилирование двух консервативных участков молекулы NFATc1 ацетилтрансферазой p300 усиливает связывание NFATc1 с промотором медленной изоформы MYHC, не влияя при этом на распределение NFATc1 между ядром и цитоплазмой мышечных волокон [102]. Активность p300 в свою очередь регулируется ее фосфорилированием протеинкиназами ERK1/2 [103]. Таким образом, сигнальный путь Erk/p300 может определять внутриядерную активность NFATc1 и уровень экспрессии медленного миозина на поздних сроках функциональной разгрузки.
Другим механизмом регуляции экспрессии гена медленного миозина может быть деацетилирование гистонов в области промотора данного гена: в результате такой модификации внутриядерный NFATc1 не сможет связываться с промотором и активировать транскрипцию медленного миозина. Показано, что после 10 дней вывешивания гистоны на промоторе гена медленной изоформы MYHC деацетилированы [104]; возможно, именно деацетилирование гистонов является лимитирующим фактором для экспрессии NFAT-зависимых генов, включая ген медленного миозина, после 10-ти дней вывешивания и позднее. Особое внимание стоит обратить на сам механизм работы гистондеацетилаз: гистондеацетилазы класса IIa, к которым относится гистондеацетилаза 4, не связываются с ДНК напрямую, поэтому считается, что сайт-специфичность деацетилирования гистонов, связанных с промоторами тех или иных генов, достигается за счет взаимодействия с сиквенс-специфичными транскрипционными факторами [105]. Типичным примером такого функционирования является взаимодействие гистондеацетилаз класса IIa и транскрипционных факторов семейства MEF-2. Факторы семейства MEF-2 в ряде тканей способны выступать как в качестве активаторов транскрипции, так и в качестве репрессоров, в зависимости от их взаимодействия со специализированными факторами модификации хроматина [106, 107]. Поскольку MEF-2 способны напрямую взаимодействовать с HDAC класса IIa, и при этом данное взаимодействие не нарушает способность MEF-2 связываться с ДНК [108], можно предположить, что MEF-2 способны обеспечивать сайт-специфичность деацетилирования хроматина и точечную репрессию MEF-2 зависимой транскрипции [105]. В нашей лаборатории было обнаружено, что содержание транскрипционного фактора MEF-2D в мышечных ядрах вывешенных животных снижено после 3-х и 7-ми суток вывешивания, однако к 14-ти суткам его ядерное содержание возвращается к контрольному уровню [86]: таким образом, возвращение MEF-2D в мышечные ядра может способствовать усилению сайт-специфичного деацетилирования гистонов на промоторе гена медленного миозина и блокированию его экспрессии.
Стоит отметить, что в нашей лаборатории было показано: введение L-аргинина в течение двух недель вывешивания предотвращает снижение экспрессии медленной изоформы MYHC [78], однако из данных, полученных в этой работе, следует, что такой эффект L-аргинина на данном сроке не может объясняться исключительно его влиянием на содержание NFATc1 в ядре (которое является ключевым для эффектов L-аргинина на 7-е сутки вывешивания), так как после двух недель вывешивания содержание NFATc1 в ядрах камбаловидных мышц животных не ниже контрольного уровня. Вполне возможно, что увеличение уровня оксида азота при вывешивании регулирует экспрессию медленной изоформы MYHC через посттрансляционные модификации и/или эпигенетические эффекты: оксид азота является ингибитором различных гистондеацетилаз, включая p300, и активатором гистонацетилтрасфераз в тканях млекопитающих [109, 110].
6. РЕГУЛЯЦИЯ ЭКСПРЕССИИ MYH7 И “МЕДЛЕННО”-ОКИСЛИТЕЛЬНЫЙ ОРКЕСТР. ФУНКЦИОНАЛЬНЫЕ ПОСЛЕДСТВИЯ
К настоящему моменту известно, что уровень экспрессии медленного миозина в волокне скелетной мышцы определяет фенотип данного волокна и его сократительные свойства, и трансформация волокна из одного типа в другой осуществляется за счет изменения паттерна экспрессии миозиновых генов. Тем не менее, реализация медленного, окислительного фенотипа мышечного волокна невозможна без скоординированной экспрессии “генов медленного фенотипа”, определяющих окислительный тип метаболизма волокна и особенности его структуры. В последние годы было обнаружено, что сама по себе экспрессия мРНК медленной изоформы миозина является регуляторным сигналом, координирующим экспрессию генов медленного фенотипа волокна. По-видимому, ключевую роль в данном процессе играют микро-РНК. Оверэкспрессия микро-РНК 499 в миотубах С2С12 приводит к усилению экспрессии медленной изоформы тропонина tnni1, миоглобина и PGC1α, таким образом данная микро-РНК играет важную роль в реализации окислительного фенотипа мышечного волокна [57]. Микро-РНК 208b также способна активировать биогенез митохондрий путем экспрессии микроРНК miR-208b, ингибирующей активность белка Fnip1, что приводит к активации сигнального пути AMPK/PGС1α и активации окислительного метоболизма [111]. PGC-1α, в свою очередь, может являться коактиватором транскрипции NFAT-зависимых генов; более того, иммуногистохимический анализ мышц мышей, нокаутных по PGC-1α, показал значительное снижение процентного содержания изоформ MYHC I и IIa в скелетных мышцах: таким образом, PGC-1α и микро-РНК 499 взаимно усиливают эффекты друг друга [112, 113]. В нашей лаборатории было показано, что восстановление уровня оксида азота в скелетных мышцах вывешенных животных приводит к предотвращению снижения уровня экспрессии медленного миозина, а также экспрессии myh7b (мРНК-предшественника микро-РНК 499) и экспрессии PGC-1α, а также предотвращает рост мРНК репрессора генов медленного фенотипа SOX6 [89]. Ингибирование GSK-3β на фоне 7-суточного вывешивания также предотвращает снижение и уровня экспрессии медленного миозина, и PGC1α [114, 115]. Тем не менее, GSK-3β может регулировать экспрессию PGC1α через транскрипионный фактор TFEB – если такой механизм является ключевым для изменений, происходящих при вывешивании, корегуляция миозиновых и митохондриальных генов и формирование медленного, окислительного фенотипа мышечного волокна осуществляется за счет регуляции активности киназы GSK-3β [116]. Так или иначе, скоординированная экспрессия генов, определяющих “медленный”, окислительный и устойчивый к утомлению фенотип мышечного волокна, необходима для нормального функционирования тонической мышечной системы.
7. ЗАКЛЮЧЕНИЕ. В ПОИСКАХ ФИЗИОЛОГИЧЕСКОГО СМЫСЛА МИОЗИНОВОЙ ТРАНСФОРМАЦИИ
Анализ литературы показывает, что снижение экспрессии медленного миозина и, как правило, увеличение интенсивности экспрессии быстрых изоформ тяжелых цепей миозина наблюдается в большинстве случаев снижения или прекращения сократительной активности постуральной мышцы [см. обзор [16]]. Очевидно, постоянная экспрессия медленного миозина, контролируемая тонической активностью, в свою очередь является необходимым условием поддержания такой активности медленного волокна. Когда такая активность значительно снижается или прекращается, то исчезают метаболические и, возможно, механические стимулы, запускающие сигнальные пути, обеспечивающие постоянную экспрессию гена myh7. Именно этот феномен и был предметом обсуждения в настоящей работе. При этом взаимозависимость тонической активности и интенсивности экспрессии медленного миозина столь велика, а соответствующие сигнальные пути столь чувствительны к малейшим изменениям сократительного режима, что, вероятно, даже небольшие, сколько-нибудь продолжительные колебания сократительной активности должны сказываться на экспрессии миозиновых генов [90]. При рассмотрении этой ситуации возникает естественный вопрос о приспособительном значении трансформации части медленных волокон в быстрые при уменьшении и прекращении сократительной активности. При относительно кратковременном снижении мышечной активности в обычных условиях наземного существования (при физиологическом покое) снижение экспрессии NFATc1-зависимых генов можно считать вполне целесообразным, т.к. при этом осуществляется режим экономии энергетических и иных ресурсов мышечного волокна, что необходимо для полноценного перехода к фазе двигательной активности. При более длительном “отключении” мышечной активности обычно наблюдается не только снижение экспрессии медленного миозина, но и увеличение экспрессии быстрых изоформ тяжелых цепей миозина, не приспособленных к многочасовой генерации субмаксимальных усилий. В этой ситуации трудно оценивать биологическую целесообразность трансформации миозинового фенотипа. Очевидно, что в состоянии длительной инактивации биологическая приспособленность особей с трансформированным фенотипом не превышает таковую без него. Таким образом, мы наблюдаем всего лишь отключение функционально-зависимых сигнальных механизмов, определяющих экспрессию медленного миозина.
В настоящем обзоре мы проанализировали как хорошо изученные, так и гипотетические сигнальные механизмы, связывающие характер тонической сократительной активности, присущей мышечным волокнам медленного типа с интенсивностью экспрессии медленной изоформы тяжелых цепей миозина, которая, являясь центральным звеном так называемого “медленно-окислительного” оркестра, обеспечивает возможность длительного поддержания такой активности. Ее устранение приводит к изменению абсолютного и относительного содержания пусковых метаболических стимулов (АТФ, ионы кальция, оксид азота), последовательно нейтрализующих работу нескольких сигнальных путей, обеспечивающих экспрессию гена медленного миозина. В результате этих сложных и не до конца понятных процессов часть медленных волокон претерпевает глубокие фенотипические изменения, превращаясь в волокна быстрого типа. Таким образом, мы имеем редкую возможность наблюдать, как изменения механической активности, влияя на экспрессию ключевого гена (и его кооперацию), преобразуют целостную структуру мышечного волокна.
Список литературы
Козловская ИБ (2017) Гравитация и позно-тоническая мышечная система. Авиакосм и экол мед 51: 1021–1025 [Kozlovskaya IB (2017) Gravitatsiya i pozno-tonicheskaya myshechnaya sistema. Aviakosm i Ekol Med 51: 1021–1025 (In Russ)].
Щепкин ДВ, Набиев С, Кубасова НА, Бершицкий СЮ, Копылова ГВ (2020) Сравнение функциональных характеристик миозина быстрой и медленной скелетных мышц. Бюл эксп биол мед 169: 113–119 [Shchepkin DV, Nabiyev S, Kubasova NA, Bershitskiy SYU, Kopylova GV (2020) Sravneniye funktsional’nykh kharakteristik miozina bystroy i medlennoy skeletnykh myshts. Buul Eksp Biol Med 169: 113–119 (In Russ)].
Hodgson JA, Roy RR, Higuchi N, Monti RJ, Zhong H, Grossman E, Edgerton VR (2005) Does daily activity level determine muscle phenotype? J Exp Biol 208 (Pt 19): 3761–3770. https://doi.org/10.1242/jeb.01825
Наследов ГА (1981) Тоническая мышечная система позвоночных СпБ. Наука [Nasledov GA (1981) Tonicheskaya myshechnaya sistema pozvonochnykh. SpB Nauka (In Russ)].
Shenkman BS (2016) From Slow to Fast: Hypogravity-Induced Remodeling of Muscle Fiber Myosin Phenotype. Acta Naturae 8: 47–59. https://doi.org/10.32607/20758251-2016-8-4-47-59
Desplanches D, Mayet MH, Ilyina-Kakueva EI, Frutoso J, Flandrois R (1991) Structural and metabolic properties of rat muscle exposed to weightlessness aboard Cosmos 1887. Eur J Appl Physiol Occup Physiol 63 :288–292. https://doi.org/10.1007/BF00233864
Shenkman BS, Kozlovskaya IB, Kuznetsov SL, Nemirovskaya TL, Desplanches D (1994) Plasticity of skeletal muscle fibres in space-flown primates. J Gravit Physiol 1: 64–66. https://doi.org/10.1023/A:1024473126643
Martin TP, Edgerton VR, Grindeland RE (1988) Influence of spaceflight on rat skeletal muscle. J Appl Physiol 65: 2318–2325. https://doi.org/10.1152/jappl.1988.65.5.2318
Ohira Y, Yoshinaga T, Ohara M, Nonaka I, Yoshioka T, Yamashita-Goto K, Shenkman BS, Kozlovskaya IB, Roy RR, Edgerton VR (1999) Myonuclear domain and myosin phenotype in human soleus after bed rest with or without loading. J Appl Physiol 87: 1776–1785. https://doi.org/10.1152/jappl.1999.87.5.1776
Shenkman BS, Podlubnaya ZA, Vikhlyantsev IM, Litvinova KS, Udaltsov SN, Nemirovskaya TL (2004) Contractile characteristics and sarcomeric cytoskeletal proteins of human soleus fibers in muscle unloading: role of mechanical stimulation from the support surface. Biophysics 49: 807–815.
Desplanches D, Mayet MH, Sempore B, Flandrois R (1987) Structural and functional responses to prolonged hindlimb suspension in rat muscle. J Appl Physiol 63: 558–563.
Templeton GH, Sweeney HL, Timson BF, Padalino M, Dudenhoeffer GA (1988) Changes in fiber composition of soleus muscle during rat hindlimb suspension. J Appl Physiol 65: 1191–1195. https://doi.org/10.1152/jappl.1988.65.3.1191
Baldwin KM, Haddad F, Pandorf CE, Roy RR, Edgerton VR (2013) Alterations in muscle mass and contractile phenotype in response to unloading models: role of transcriptional/pretranslational mechanisms. Front Physiol 4: 284. https://doi.org/10.3389/fphys.2013.00284
Ranvier L (1873) De quelques faits relatifs a l’histologie et a la physiologie des muscles striaes. Arch Physiol Norm Pathol (Paris) 1: 5–15.
Pette D, Staron RS (2000) Myosin isoforms, muscle fiber types, and transitions. Microsc Res Tech 50: 500–509. https://doi.org/10.1002/1097-0029(20000915)50:6<500::AID-JEMT7>3.0.CO;2-7
Schiaffino S, Reggiani C (2011) Fiber types in mammalian skeletal muscles. Physiol Rev 1447–1531. https://doi.org/10.1152/physrev.00031.2010
Schiaffino S, Mammucari C (2011) Regulation of skeletal muscle growth by the IGF1-Akt/PKB pathway: insights from genetic models. Skelet Musc 1: 4. https://doi.org/10.1186/2044-5040-1-4
Delp MD, Duan C (1996) Composition and size of type I, IIA, IID/X, and IIB fibers and citrate synthase activity of rat muscle. J Appl Physiol (1985) 80: 261–270. https://doi.org/10.1152/jappl.1996.80.1.261
Baldwin KM, Valdez V, Schrader LF, Herrick RE (1981) Effect of functional overload on substrate oxidation capacity of skeletal muscle. J Appl Physiol Respir Environ Exerc Physiol 50: 1272–1276. https://doi.org/10.1152/jappl.1981.50.6.1272
Conjard A, Peuker H, Pette D (1998) Energy state and myosin heavy chain isoforms in single fibres of normal and transforming rabbit muscles. Pflugers Arch 436(6): 962–969. https://doi.org/10.1007/s004240050730
Ausoni S, Gorza L, Schiaffino S, Gundersen K, Lomo T (1990) Expression of myosin heavy chain isoforms in stimulated fast and slow rat muscles. J Neurosci 10: 153–160. https://doi.org/10.1523/JNEUROSCI10-01-00153.1990
Kubis HP, Scheibe RJ, Meissner JD, Hornung G, Gros G (2002) Fast-to-slow transformation and nuclear import/export kinetics of the transcription factor NFATc1 during electrostimulation of rabbit muscle cells in culture. J Physiol 541: 835–847.
Shishmarev D (2020) Excitation-contraction coupling in skeletal muscle: recent progress and unanswered questions. Biophys Rev 12: 143–153. https://doi.org/10.1007/s12551-020-00610-x
Everts ME, Lomo T, Clausen T (1993) Changes in K+, Na+ and calcium contents during in vivo stimulation of rat skeletal muscle. Acta Physiol Scand 147: 357–368. https://doi.org/10.1111/j.1748-1716.1993.tb09512.x
Carroll S, Nicotera P, Pette D (1999) Calcium transients in single fibers of low-frequency stimulated fast-twitch muscle of rat. Am J Physiol 277: C1122–C1129. https://doi.org/10.1152/ajpcell.1999.277.6.C1122
Ohlendieck K, Fromming GR, Murray BE, Maguire PB, Leisner E, Traub I, Pette D (1999) Effects of chronic low-frequency stimulation on Ca2+-regulatory membrane proteins in rabbit fast muscle. Pflugers Arch 438: 700–708. https://doi.org/10.1007/s004249900115
Casas M, Buvinic S, Jaimovich E (2014) ATP signaling in skeletal muscle: from fiber plasticity to regulation of metabolism. Exerc Sport Sci Rev 42: 110–116. https://doi.org/10.1249/JES.0000000000000017
Crabtree GR (1999) Generic signals and specific outcomes: signaling through Ca2+, calcineurin, and NFAT. Cell 96 (5): 611–614. https://doi.org/10.1016/s0092-8674(00)80571-1
Chin ER, Olson EN, Richardson JA, Yang Q, Humphries C, Shelton JM, Wu H, Zhu W, Bassel-Duby R, Williams RS (1998) A calcineurin-dependent transcriptional pathway controls skeletal muscle fiber type. Genes Dev 12: 2499–2509. https://doi.org/10.1101/gad.12.16.2499
McCullagh KJ, Calabria E, Pallafacchina G, Ciciliot S, Serrano AL, Argentini C, Kalhovde JM, Lomo T, Schiaffino S (2004) NFAT is a nerve activity sensor in skeletal muscle and controls activity-dependent myosin switching. Proc Natl Acad Sci USA 101: 10590–10595. https://doi.org/10.1073/pnas.0308035101
Tothova J, Blaauw B, Pallafacchina G, Rudolf R, Argentini C, Reggiani C, Schiaffino S (2006) NFATc1 nucleocytoplasmic shuttling is controlled by nerve activity in skeletal muscle. J Cell Sci 119: 1604–1611. https://doi.org/10.1242/jcs.02875
Calabria E, Ciciliot S, Moretti I, Garcia M, Picard A, Dyar KA, Pallafacchina G, Tothova J, Schiaffino S, Murgia M (2009) NFAT isoforms control activity-dependent muscle fiber type specification. Proc Natl Acad Sci USA 106: 13335–13340. https://doi.org/10.1073/pnas.0812911106
Eilers W, Jaspers RT, de Haan A, Ferrie C, Valdivieso P, Fluck M (2014) CaMKII content affects contractile, but not mitochondrial, characteristics in regenerating skeletal muscle. BMC Physiol 14: 7. https://doi.org/10.1186/s12899-014-0007-z
Chin ER (2004) The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis. Proc Nutr Soc 63: 279–286. https://doi.org/10.1079/PNS2004335
Mu X, Brown LD, Liu Y, Schneider MF (2007) Roles of the calcineurin and CaMK signaling pathways in fast-to-slow fiber type transformation of cultured adult mouse skeletal muscle fibers. Physiol Genomics 30: 300–312. https://doi.org/10.1152/physiolgenomics.00286.2006
Miska EA, Karlsson C, Langley E, Nielsen SJ, Pines J, Kouzarides T (1999) HDAC4 deacetylase associates with and Represses the MEF2 transcription factor. EMBO J 18: 5099–5107. https://doi.org/10.1093/emboj/18.18.5099
Cohen TJ, Choi MC, Kapur M, Lira VA, Yan Z, Yao TP (2015) HDAC4 regulates muscle fiber type-specific gene expression programs. Mol Cells 38: 343–348. https://doi.org/10.14348/molcells.2015.2278
Wu H, Rothermel B, Kanatous S, Rosenberg P, Naya FJ, Shelton JM, Hutcheson KA, DiMaio JM, Olson EN, Bassel-Duby R, Williams RS (2001) Activation of MEF2 by muscle activity is mediated through a calcineurin-dependent pathway. EMBO J 20: 6414–6423. https://doi.org/10.1093/emboj/20.22.6414
Li J, Vargas MA, Kapiloff MS, Dodge-Kafka KL (2013) Regulation of MEF2 transcriptional activity by calcineurin/mAKAP complexes. Exp Cell Res 319: 447–454. https://doi.org/10.1016/j.yexcr.2012.12.016
Lynch J, Guo L, Gelebart P, Chilibeck K, Xu J, Molkentin JD, Agellon LB, Michalak M (2005) Calreticulin signals upstream of calcineurin and MEF2C in a critical Ca(2+)-dependent signaling cascade. J Cell Biol 170 (1): 37–47. https://doi.org/10.1083/jcb.200412156
McKinsey TA, Zhang CL, Olson EN (2001) Control of muscle development by dueling HATs and HDACs. Curr Opin Genet Dev 11: 497–504.
Grozinger CM, Schreiber SL (2000) Regulation of histone deacetylase 4 and 5 and transcriptional activity by 14-3-3-dependent cellular localization. Proc Natl Acad Sci USA 97: 7835–7840. https://doi.org/10.1073/pnas.140199597
Liu Y, Randall WR, Schneider MF (2005) Activity-dependent and -independent nuclear fluxes of HDAC4 mediated by different kinases in adult skeletal muscle. J Cell Biol 168: 887–897. https://doi.org/10.1083/jcb.200408128
Zong H, Ren JM, Young LH, Pypaert M, Mu J, Birnbaum MJ, Shulman GI (2002) AMP kinase is required for mitochondrial biogenesis in skeletal muscle in response to chronic energy deprivation. Proc Natl Acad Sci USA 99: 15983–15987. https://doi.org/10.1073/pnas.252625599
Henriksson J, Salmons S, Chi MY, Hintz CS, Lowry OH (1988) Chronic stimulation of mammalian muscle: changes in metabolite concentrations in individual fibers. Am J Physiol 255: 543–551. https://doi.org/10.1152/ajpcell.1988.255.4.C543
Green HJ, Pette D (1997) Early metabolic adaptations of rabbit fast-twitch muscle to chronic low-frequency stimulation. Eur J Appl Physiol Occup Physiol 75: 418–424. https://doi.org/10.1007/s004210050182
Putman CT, Gallo M, Martins KJ, MacLean IM, Jendral MJ, Gordon T, Syrotuik DG, Dixon WT (2015) Creatine loading elevates the intracellular phosphorylation potential and alters adaptive responses of rat fast-twitch muscle to chronic low-frequency stimulation. Appl Physiol Nutr Metab 40: 671–682. https://doi.org/10.1139/apnm-2014-0300
Drenning JA, Lira VA, Simmons CG, Soltow QA, Sellman JE, Criswell DS (2008) Nitric oxide facilitates NFAT-dependent transcription in mouse myotubes. Am J Physiol Cell Physiol 294: C1088–C1095. https://doi.org/10.1152/ajpcell.00523.2007
Reiser PJ, Kline WO, Vaghy PL (1997) Induction of neuronal type nitric oxide synthase in skeletal muscle by chronic electrical stimulation in vivo. J Appl Physiol (1985)82: 1250–1255. https://doi.org/10.1152/jappl.1997.82.4.1250
Tidball JG, Lavergne E, Lau KS, Spencer MJ, Stull JT, Wehling M (1998) Mechanical loading regulates NOS expression and activity in developing and adult skeletal muscle. Am J Physiol 275: 260–266. https://doi.org/10.1152/ajpcell.1998.275.1.C260
Pearson T, McArdle A, Jackson MJ (2015) Nitric oxide availability is increased in contracting skeletal muscle from aged mice, but does not differentially decrease muscle superoxide. Free Radic Biol Med 78: 82–88. https://doi.org/10.1016/j.freeradbiomed.2014.10.505
Shen T, Cseresnyes Z, Liu Y, Randall WR, Schneider MF (2007) Regulation of the nuclear export of the transcription factor NFATc1 by protein kinases after slow fibre type electrical stimulation of adult mouse skeletal muscle fibres. J Pysiol 579: 535–551. https://doi.org/10.1113/jphysiol.2006.120048
Martins KJ, St-Louis M, Murdoch GK, MacLean IM, McDonald P, Dixon WT, Putman CT, Michel RN (2012) Nitric oxide synthase inhibition prevents activity-induced calcineurin-NFATc1 signalling and fast-to-slow skeletal muscle fibre type conversions. J Physiol 590(6): 1427–1442. https://doi.org/10.1113/jphysiol.2011.223370
van Rooij E, Quiat D, Johnson BA, Sutherland LB, Qi X, Richardson JA, Kelm RJ, Jr, Olson EN (2009) A family of microRNAs encoded by myosin genes governs myosin expression and muscle performance. Dev Cell 17: 662–673. https://doi.org/10.1016/j.devcel.2009.10.013
McCarthy JJ, Esser KA, Peterson CA, Dupont-Versteegden EE (2009) Evidence of MyomiR network regulation of beta-myosin heavy chain gene expression during skeletal muscle atrophy. Physiol Genomics 39: 219–226. https://doi.org/10.1152/physiolgenomics.00042.2009
Ji J, Tsika GL, Rindt H, Schreiber KL, McCarthy JJ, Kelm RJ, Jr, Tsika R (2007) Puralpha and Purbeta collaborate with Sp3 to negatively regulate beta-myosin heavy chain gene expression during skeletal muscle inactivity. Mol Cell Biol 27: 1531–1543. https://doi.org/10.1128/MCB.00629-06
Xu M, Chen X, Chen D, Yu B, Li M, He J, Huang Z (2018) MicroRNA-499-5p regulates skeletal myofiber specification via NFATc1/MEF2C pathway and Thrap1/MEF2C axis. Life Sci 215: 236–245. https://doi.org/10.1016/j.lfs.2018.11.020
Huang S, Jin L, Shen J, Shang P, Jiang X, Wang X (2016) Electrical stimulation influences chronic intermittent hypoxia-hypercapnia induction of muscle fibre transformation by regulating the microRNA/Sox6 pathway. Sci Rep 6: 26415. https://doi.org/10.1038/sRep26415
Fitts RH, Trappe SW, Costill DL, Gallagher PM, Creer AC, Colloton PA, Peters JR, Romatowski JG, Bain JL, Riley DA (2010) Prolonged space flight-induced alterations in the structure and function of human skeletal muscle fibres. J Physiol 588: 3567–3592. https://doi.org/10.1113/jphysiol.2010.188508
Goswami N (2017) Falls and Fall-Prevention in Older Persons: Geriatrics Meets Spaceflight! Front. Physiol 8: 603. https://doi.org/10.3389/fphys.2017.00603
Russomano T, Gustavo D, Falcuo F (2008) The Effects of Hypergravity and Microgravity on Biomedical Experiments. Biomed Eng 77. https://doi.org/10.2200/S00105ED1V01Y200801BME018
Шульженко ЕБ, Виль-Вильямс ИФ (1976) Возможность проведения длительной водной иммерсии методом “сухого” погружения. Косм биол авиакосм мед 10: 82–84 [Shulzhenko EB, Wil-Williams IF (1976) Possibility of long-term water immersion by the “dry” immersion method. Cosm Biol Aviacosm Med 10: 82–84 (In Russ)].
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: technical aspects. J Appl Physiol 92: 1367–1377. https://doi.org/10.1152/japplphysiol.00969.2001
Ilin EA, Novikov VE (1980) Stand for modelling the physiological effects of weightlessness in laboratory experiments with rats. Kosm Biol Aviakosm Med 14: 79–80.
Alford EK, Roy RR, Hodgson JA, Edgerton VR (1987) Electromyography of rat soleus, medial gastrocnemius, and tibialis anterior during hind limb suspension. Exp Neurol 96 (3): 635–649. https://doi.org/10.1016/0014-4886(87)90225-1
Fitts RH, Riley DR, Widrick JJ (2001) Functional and structural adaptations of skeletal muscle to microgravity. J Exp Biol 204: 3201–3208.
Shenkman BS, Nemirovskaya TL (2008) Calcium-dependent signaling mechanisms and soleus fiber remodeling under gravitational unloading. J Muscle Res Cell Motil 29: 221–230. https://doi.org/10.1007/s10974-008-9164-7
Gazenko OG, Grigoriev AI, Kozlovskaya IB (1987) Mechanisms of acute and chronic effects of microgravity. Physiologist 30 (1 Suppl): S1–S5.
Kozlovskaya IB, Shenkman BS (2019) Cellular Responses of Human Postural Muscle to Dry Immersion. Front Physiol 10: 187. https://doi.org/10.3389/fphys.2019.00187
Kawano F (2004) The mechanisms underlying neuromuscular changes in microgravity environment. Biol Sci Space 18(3): 104–105.
De-Doncker L, Kasri M, Picquet F, Falempin M (2005) Physiologically adaptive changes of the L5 afferent neurogram and of the rat soleus EMG activity during 14 days of hindlimb unloading and recovery. J Exp Biol 208: 4585–4592. https://doi.org/10.1242/jeb.01931
Giger JM, Bodell PW, Zeng M, Baldwin KM, Haddad F (2009) Rapid muscle atrophy response to unloading: pretranslational processes involving MHC and actin. J Appl Physiol (1985): 1204–1212. https://doi.org/10.1152/japplphysiol.00344.2009
Vilchinskaya NA, Mochalova EP, Nemirovskaya TL, Mirzoev TM, Turtikova OV, Shenkman BS (2017) Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J Physiol 595: 7123–7134. https://doi.org/10.1113/JP275184
Desaphy JF, Pierno S, Liantonio A, De Luca A, Didonna MP, Frigeri A, Nicchia GP, Svelto M, Camerino C, Zallone A, Camerino DC (2005) Recovery of the soleus muscle after short- and long-term disuse induced by hindlimb unloading: effects on the electrical properties and myosin heavy chain profile. Neurobiol Dis 18: 356–365. https://doi.org/10.1016/j.nbd.2004.09.016
Lomonosova YN, Turtikova OV, Shenkman BS (2016) Reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway. J Muscle Res Cell Motil 37: 7–16. https://doi.org/10.1007/s10974-015-9428-y
Stevens L, Gohlsch B, Mounier Y, Pette D (1999) Changes in myosin heavy chain mRNA and protein isoforms in single fibers of unloaded rat soleus muscle. FEBS Letters 463: 15–18. https://doi.org/10.1016/s0014-5793(99)01596-3
Stevens L, Sultan KR, Peuker H, Gohlsch B, Mounier Y, Pette D (1999) Time-dependent changes in myosin heavy chain mRNA and protein isoforms in unloaded soleus muscle of rat. Am J Physiol 277: 1044–1049. https://doi.org/10.1152/ajpcell.1999.277.6.C1044
Lomonosova YN, Kalamkarov GR, Bugrova AE, Shevchenko TF, Kartashkina NL, Lysenko EA, Shvets VI, Nemirovskaya TL (2011) Protective effect of L-Arginine administration on proteins of unloaded m. soleus. Biochemistry (Mosc) 76(5): 571–580. https://doi.org/10.1134/S0006297911050075
Mirzoev T, Tyganov S, Vilchinskaya N, Lomonosova Y, Shenkman B (2016) Key Markers of mTORC1-Dependent and mTORC1-Independent Signaling Pathways Regulating Protein Synthesis in Rat Soleus Muscle During Early Stages of Hindlimb Unloading. Cell Physiol Biochem 39: 1011–1020. https://doi.org/10.1159/000447808
Ohira Y, Yasui W, Kariya F, Wakatsuki T, Nakamura K, Asakura T, Edgerton VR (1994) Metabolic adaptation of skeletal muscles to gravitational unloading. Acta Astronaut 33: 113–117. https://doi.org/10.1016/0094-5765(94)90115-5
McBride A, Ghilagaber S, Nikolaev A, Hardie DG (2009) The glycogen-binding domain on the AMPK beta subunit allows the kinase to act as a glycogen sensor. Cell Metab 9: 23–34. https://doi.org/10.1016/j.cmet.2008.11.008
Henriksen EJ, Tischler ME (1988) Time course of the response of carbohydrate metabolism to unloading of the soleus. Metabolism 37: 201–208. https://doi.org/10.1016/0026-0495(88)90096-0
Wakatsuki T, Ohira Y, Yasui W, Nakamura K, Asakura T, Ohno H, Yamamoto M (1994) Responses of contractile properties in rat soleus to high-energy phosphates and/or unloading. Jpn J Physiol 44: 193–204. https://doi.org/10.2170/jjphysiol.44.193
Matoba T, Watabe Y, Ohira Y (1993) β-Guanidinopropionic acid suppresses suspension-induced changes in myosin expression in rat skeletal muscle. Med Sci Sports Exerc 25: 157.
Sharlo K, Paramonova I, Turtikova O, Tyganov S, Shenkman B (2019) Plantar mechanical stimulation prevents calcineurin-NFATc1 inactivation and slow-to-fast fiber type shift in rat soleus muscle under hindlimb unloading. J Appl Physiol 126: 1769–1781. https://doi.org/10.1152/japplphysiol.00029.2019
Paramonova II, Sharlo KA, Vilchinskaya NA, Shenkman BS (2020) The Time Course of Muscle Nuclear Content of Transcription Factors Regulating the MyHC I(β) Expression in the Rat Soleus Muscle under Gravitational Unloading. Biol Membr 37: 126–133. https://doi.org/10.31857/S0233475520020097
Ingalls CP, Wenke JC, Armstrong RB (2001) Time course changes in [Ca2+]i, force, and protein content in hindlimb-suspended mouse soleus muscles. Aviat Space Environ Med 72: 471–476.
Sharlo K, Paramonova I, Turtikova O, Tyganov S, Shenkman B (2019) Plantar mechanical stimulation prevents calcineurin/NFATc1 inactivation and slow-to-fast fiber-type shift in rat soleus muscle under hindlimb unloading. J Appl Physiol 126: 1769–1781. https://doi.org/10.1152/japplphysiol.00029.2019
Sharlo KA, Paramonova II, Lvova ID, Vilchinskaya NA, Bugrova AE, Shevchenko TF, Kalamkarov GR, Shenkman BS (2020) NO-Dependent Mechanisms of Myosin Heavy Chain Transcription Regulation in Rat Soleus Muscle After 7-Days Hindlimb Unloading. Front Physiol 11: 814. https://doi.org/10.3389/fphys.2020.00814
Dyar KA, Ciciliot S, Tagliazucchi GM, Pallafacchina G, Tothova J, Argentini C, Agatea L, Abraham R, Ahdesmaki M, Forcato M, Bicciato S, Schiaffino S, Blaauw B (2015) The calcineurin-NFAT pathway controls activity-dependent circadian gene expression in slow skeletal muscle. Mol Metab 4: 823–833. https://doi.org/10.1016/j.molmet.2015.09.004
Shenkman BS (2020) How Postural Muscle Senses Disuse? Early Signs and Signals. Int J Mol Sci 21(14): 5037. https://doi.org/10.3390/ijms1145037
Ingalls CP, Warren GL, Armstrong RB (1999) Intracellular Ca2+ transients in mouse soleus muscle after hindlimb unloading and reloading. J Appl Physiol (1985)87: 386–390. https://doi.org/10.1152/jappl.1999.87.1.386
Arutyunyan RS, Kozlovskaya IB, Nasledov GA, Nemirovskaya TL, Radzyukevitch TL, Shenkman BS (1995) The contraction of unweighted fast and slow rat muscles in calcium-free solution. Basic Appl Myol 5: 169–175.
Lvova ID, Sharlo KA, Paramonova II, Shenkman BS (2021) Transient activation of slow myosin expression after 3 days of rat hindlimb unloading is caused by calcium ions accumulation. Aviakosm Ekol Med In Press.
Sharlo KA, Mochalova EP, Belova SP, Lvova ID, Nemirovskaya TL, Shenkman BS (2020) The role of MAP-kinase p38 in the m. soleus slow myosin mRNA transcription regulation during short-term functional unloading. Archiv Biochem Biophys 695: 108–622. https://doi.org/10.1016/j.abb.2020.108622
Wright DC, Geiger PC, Han DH, Jones TE, Holloszy JO (2007) Calcium induces increases in peroxisome proliferator-activated receptor gamma coactivator-1alpha and mitochondrial biogenesis by a pathway leading to p38 mitogen-activated protein kinase activation. J Biol Chem 282: 18793–18799. https://doi.org/10.1074/jbc.M611252200
Sharlo KA, Paramonova II, Lvova ID, Mochalova EP, Kalashnikov VE, Vilchinskaya NA, Tyganov SA, Konstantinova TS, Shevchenko TF, Kalamkarov GR, Shenkman BS (2021) Plantar Mechanical Stimulation Maintains Slow Myosin Expression in Disused Rat Soleus Muscle via NO-Dependent Signaling. Int J Mol Sci 22: 10. https://doi.org/3390/ijms22031372
Мухина АМ, Алтаева ЭГ, Немировская ТЛ, Шенкман БС (2006) Роль кальциевых каналов L-типа в накоплении Са2+ в волокнах m. soleus крысы и изменении соотношения изоформ миозина и SERCA при гравитационной разгрузке. Рос физиол журн 92: 1285–1295. [Mukhina AM, Altayeva EG, Nemirovskaya TL, Shenkman BS (2006) Role of L-type Ca channels in Ca2+ accumulation and changes in distribution of myosin heavy chain and SERCA isoforms in rat M. soleus under gravitational unloading. Russ J Pysiol 92(11): 1285–1295 (In Russ)].
Xia L, Cheung KK, Yeung SS, Yeung EW (2016) The involvement of transient receptor potential canonical type 1 in skeletal muscle regrowth after unloading-induced atrophy. J Physiol 594: 3111–3126. https://doi.org/10.1113/JP271705
Dupont-Versteegden EE, Knox M, Gurley CM, Houle JD, Peterson CA (2002) Maintenance of muscle mass is not dependent on the calcineurin-NFAT pathway. Am J Physiol Cell Physiol 282: 1387–1395. https://doi.org/10.1152/ajpcell.00424.2001
Shen T, Liu Y, Contreras M, Hernandez-Ochoa EO, Randall WR, Schneider MF (2010) DNA binding sites target nuclear NFATc1 to heterochromatin regions in adult skeletal muscle fibers. Histochem Cell Biol 134: 387–402. https://doi.org/10.1007/s00418-010-0744-4
Meissner JD, Freund R, Krone D, Umeda PK, Chang KC, Gros G, Scheibe RJ (2011) Extracellular signal-regulated kinase 1/2-mediated phosphorylation of p300 enhances myosin heavy chain I/beta gene expression via acetylation of nuclear factor of activated T cells c1. Nucleic Acids Res 39: 5907–5925. https://doi.org/10.1093/nar/gkr162
Chen YJ, Wang YN, Chang WC (2007) ERK2-mediated C-terminal serine phosphorylation of p300 is vital to the regulation of epidermal growth factor-induced keratin 16 gene expression. J Biol Chem 282: 27215–27228. https://doi.org/10.1074/jbc.M700264200
Pandorf CE, Haddad F, Wright C, Bodell PW, Baldwin KM (2009) Differential epigenetic modifications of histones at the myosin heavy chain genes in fast and slow skeletal muscle fibers and in response to muscle unloading. Am J Physiol Cell Physiol 297: 6–16. https://doi.org/10.1152/ajpcell.00075.2009
Martin M, Kettmann R, Dequiedt F (2007) Class IIa histone deacetylases: regulating the regulators. Oncogene 26: 5450–5467. https://doi.org/10.1038/sj.onc.1210613
Youn HD, Grozinger CM, Liu JO (2000) Calcium regulates transcriptional Repression of myocyte enhancer factor 2 by histone deacetylase 4. J Biol Chem 275: 22563–22567. https://doi.org/10.1074/jbc.C000304200
McKinsey TA, Zhang CL, Olson EN (2001) Identification of a signal-responsive nuclear export sequence in class II histone deacetylases. Mol Cell Biol 21(18): 6312–6321.
Lu J, McKinsey TA, Zhang CL, Olson EN (2000) Regulation of skeletal myogenesis by association of the MEF2 transcription factor with class II histone deacetylases. Mol Cell 6: 233–244.
Socco S, Bovee RC, Palczewski MB, Hickok JR, Thomas DD (2017) Epigenetics: The third pillar of nitric oxide signaling. Pharmacol Res 52–58. https://doi.org/10.1016/j.phrs.2017.04.011
Nott A, Riccio A (2009) Nitric oxide-mediated epigenetic mechanisms in developing neurons. Cell Cycle 8: 725–730. https://doi.org/10.4161/cc.8.5.7805
Liu J, Liang X, Zhou D, Lai L, Xiao L, Liu L, Fu T, Kong Y, Zhou Q, Vega RB, Zhu MS, Kelly DP, Gao X, Gan Z (2016) Coupling of mitochondrial function and skeletal muscle fiber type by a miR-499/Fnip1/AMPK circuit. EMBO Mol Med 8: 1212–1228. https://doi.org/10.15252/emmm.201606372
Handschin C, Chin S, Li P, Liu F, Maratos-Flier E, Lebrasseur NK, Yan Z, Spiegelman BM (2007) Skeletal muscle fiber-type switching, exercise intolerance, and myopathy in PGC-1alpha muscle-specific knock-out animals. J Biol Chem 282: 30014–30021. https://doi.org/10.1074/jbc.M704817200
Lin J, Wu H, Tarr PT, Zhang CY, Wu Z, Boss O, Michael LF, Puigserver P, Isotani E, Olson EN, Lowell BB, Bassel-Duby R, Spiegelman BM (2002) Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature 418: 797–801. https://doi.org/10.1038/nature00904
Sharlo K, Lomonosova Y, Turtikova O, Mitrofanova O, Kalamkarov G, Bugrova A, Shevchenko T, Shenkman B (2018) The Role of GSK-3β Phosphorylation in the Regulation of Slow Myosin Expression in Soleus Muscle during Functional Unloading. Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology 12: 85–91. https://doi.org/10.1134/S1990747818010099
Theeuwes WF, Gosker HR, Langen RCJ, Verhees KJP, Pansters NAM, Schols A, Remels AHV (2017) Inactivation of glycogen synthase kinase-3beta (GSK-3beta) enhances skeletal muscle oxidative metabolism. Biochim Biophys Acta Mol Basis Dis 1863: 3075–3086. https://doi.org/10.1016/j.bbadis.2017.09.018
Theeuwes WF, Gosker HR, Schols A, Langen RCJ, Remels AHV (2020) Regulation of PGC-1alpha expression by a GSK-3beta-TFEB signaling axis in skeletal muscle. Biochim Biophys Acta Mol Cell Res 1867: 118610. https://doi.org/10.1016/j.bbamcr.2019.118610
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


