Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 876-894
Сравнительный анализ обусловленных возрастом изменений структуры митохондриального аппарата скелетных мышц видов с различной продолжительностью жизни
В. Б. Вайс 1, И. М. Вангели 1, Ч. М. Эльдаров 1, Л. Е. Бакеева 1, *
1 НИИ физико-химической биологии им. А.Н. Белозерского, МГУ им. М.В. Ломоносова
Москва, Россия
* E-mail: bakeeva@belozersky.msu.ru
Поступила в редакцию 28.01.2021
После доработки 23.03.2021
Принята к публикации 24.03.2021
Аннотация
Методами электронной микроскопии и морфометрии проведен сравнительный анализ возрастных изменений ультраструктуры митохондриального аппарата скелетной мышцы у представителей видов с различной программой старения: короткоживущих, хорошо изученных классических видов – мыши (С57BL\6), крысы Вистар; преждевременно стареющих крыс OXYS; а также животных с замедленным старением – голый землекоп (Heterocephalus glaber). Показано, что у мышей обусловленные возрастом преобразования общей организации митохондриального аппарата скелетной мышцы соответствуют изученным ранее для крыс Вистар: митохондриальный ретикулум формируется к 2.5–3-месячному возрасту, к 30-месячному возрасту происходит значительная редукция митохондриального аппарата, в результате снижения числа митохондрий, количество сечений митохондрий в мышечном волокне снижается почти в 2 раза – с 0.45 ± 0.07 до 0.23 ± 0.02 шт на мкм2. Деструктивные изменения ультраструктуры митохондрий не обнаружены, в отличие от крыс OXYS, у которых возрастные изменения хондриома затрагивают как общую структуру митохондриального аппарата мышечных волокон, так и внутреннюю ультраструктуру органелл. В то же время у схожего с мышами по размеру мелкого грызуна Heterocephalus glaber к пятилетнему возрасту количество и размер митохондрий в скелетной мышце значительно возрастает, однако митохондриальный ретикулум не формируется. Предполагается, что особая организация митохондриального аппарата скелетной мышцы голого землекопа обеспечивает необходимый уровень окислительно-восстановительных процессов в мышцах, предупреждая снижение работоспособности и развития саркопении, в отличие от мышей, крыс Вистар и OXYS, где обусловленные возрастом нарушения структурной организации митохондриального аппарата скелетной мышцы могут являться одной из основных причин развития возраст-зависимых патологий и, в частности, саркопении.
В настоящее время метаболические процессы, развивающиеся с возрастом в скелетных мышцах, достаточно хорошо изучены. Происходящее с возрастом постепенное ослабление мышечной функции (саркопения) связывают, прежде всего, с функциональными характеристиками митохондрий. Многочисленные исследования показывают, что в скелетных мышцах центральным медиатором развития патологий являются процессы, связанные с митохондриями [1–7]. С возрастом в мышечной ткани происходит общее снижение метаболизма митохондрий и уровня АТФ [8]. Уровень синтеза митохондриальных белков снижается на 40%, функциональная активность белков также снижается [9]. Возрастные изменения мышечной ткани могут быть вызваны, в том числе, и повышением продукции АФК митохондриями, что приводит к увеличению уровня окислительного стресса. В связи с ведущей ролью митохондрий в развитии возрастных изменений мышц, большой интерес представляет состояние ультраструктуры этих органелл, поскольку, как известно, важнейшей особенностью митохондрий является значительная динамичность их морфологии в ответ на различные изменения клеточного метаболизма.
Обусловленные возрастом перестройки ультраструктуры митохондрий в литературе менее известны, чем функциональные. Подробно изучена только одна модель – летательная мышца насекомых, на которой экспериментально показано возникновение уникальных, зависимых от возраста изменений организации митохондрий и установлены факторы, вызывающие эти структурные перестройки [10, 11]. В летательной мышце было обнаружено развитие с возрастом локальной перестройки отдельных зон внутренней митохондриальной мембраны в миелиноподобные структуры, которые с возрастом распространялись на все пространство митохондрий, вызывая разрушение органеллы (рис. 1) [11]. В измененных участках митохондрий цитохромоксидазная активность не выявлялась, в отличие от нативной части, где реакция была положительная.
Рис. 1.
Участок летательной мышцы D. melanogaster (36 суток после рождения). Стрелками показаны миелино-подобные образования внутри митохондрий, детали строения которых представлены на врезке [11].
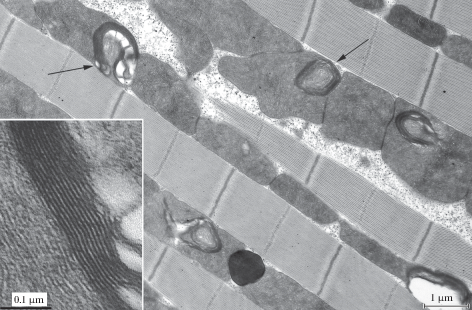
Очевидно, что эти перестройки ультраструктуры определяют дисфункцию митохондрий, влияющую на снижение летательной активности насекомых с возрастом, которое было показано еще в 1943 г. Williams с соавт. [12]. На Drosophila /штамм white1118/ экспериментально подтверждено воздействие кислородного стресса на формирование в митохондриях возникающих с возрастом структурных перестроек [13]. Так, гипероксия в течение 4-х дней у 3–4-дневных особей дрозофилы вызывала появление в 35% митохондрий летательной мышцы локальные перестройки внутренней митохондриальной мембраны. 7 дней воздействия гипероксии приводило к образованию деструктивных изменений в 62% митохондрий, у контрольных особей такие изменения практически отсутствовали или наблюдались крайне редко. Проведенные нами эксперименты на D. melanogaster показали, что антиоксидант SkQ1 поддерживает нативное состояние ультраструктуры митохондрий, снижая количество деструктивных изменений или снижая степень их выраженности и, как следствие, – поддерживает летательную активность [14]. У особей, получавших SkQ1, количество деструктивных изменений митохондрий и степень их проявления ниже, чем у мух, не получавших SkQ1.
Данные литературы об изменениях с возрастом ультраструктуры митохондрий скелетной мышцы однородны: набухание митохондрий, уменьшение числа крист, снижение плотности матрикса, нарушения митохондриальных мембран [15–19]. В проводимых исследованиях состояния ультраструктуры митохондрий скелетных мышц при старении не учитываются особенности общей структурной организации митохондриального аппарата скелетной мышцы. Согласно данным литературы, митохондриальный аппарат скелетных мышц имеет сложную структурную организацию. Еще в одном из первых электронно-микроскопических наблюдений Palade [20] показал, что в скелетных мышцах на уровне I-дисков митохондрии ветвятся между дисками соседних миофибрилл, и описал митохондрии звездчатой формы. Позднее Gauthier и Padykula [21], Bubenzer [22] на основе анализа одиночных срезов диафрагмы крысы предположили, что в скелетной мышце имеется три типа митохондрий: 1) тонкие ветвящиеся, расположенные поперек мышечного волокна; 2) более толстые, овальные, расположенные вдоль мышечного волокна; 3) сферические, расположенные у краев мышечного волокна с ответвлениями, ведущими к центру. На основе многих трехмерных реконструкций было показано, что в скелетных мышцах весь митохондриальный материал посредством специальных межмитохондриальных контактов собран в единую митохондриальную систему, образованную разветвленными гигантскими митохондриями, расположенными по обе стороны Z-линии и соединенными в единый митохондриальный каркас продольными тяжами митохондрий, расположенными вдоль пучков миофибрилл. Эта система была определена как митохондриальный ретикулум (рис. 2) [23, 24]. Методами высоковольтной электронной микроскопии на нативной ткани трех типов скелетной мышцы крыс было продемонстрировано, что митохондриальный ретикулум – это in vivo существующая структура, которая не является результатом процесса фиксации или стагнации мышечной ткани [25]. В настоящее время методами современной сканирующей микроскопии наглядно, в объеме продемонстрирована ультраструктура митохондриального ретикулума в скелетных мышцах [26]. В то же время некоторые авторы, обнаруживая на одиночных срезах скелетных мышц разветвленную сеть, образованную протяженными митохондриями, рассматривают ее как результат врожденной миопатии [27] или признак старения [28].
Рис. 2.
Ультраструктура митохондриального ретикулума на поперечном срезе изотропной зоны мышечного волокна крысы Вистар [23].

Мы провели сравнительный анализ развития изменений ультраструктуры митохондрий скелетной мышцы с возрастом у представителей видов с различной продолжительностью жизни: мыши (С57BL\6) (продолжительность жизни 2.5–3 года); крысы Вистар (продолжительность жизни до 3 лет); крысы OXYS – модель преждевременно стареющих крыс (линия крыс OXYS, выведенная в Институте цитологии и генетики Сибирского отделения Российской академии наук; характеризуется ранними инволютивными изменениями, повышенной частотой возникновения злокачественных опухолей, кардиомиопатией, нарушениями функций высшей нервной деятельности, характерными для стареющих животных и человека; продолжительность жизни до 2 лет); голый землекоп (Heterocephalus glaber) – представитель животных с замедленным старением. Это небольшой грызун, по размерам и массе тела сопоставимый с мышью, однако без шерстяного покрова с эусоциальной организацией. Ареал обитания – засушливые районы Эфиопии, Кении и Сомали. Отличительная черта этого грызуна – экстремально высокая продолжительность жизни по сравнению с ожидаемой для его массы тела. Показано, что в лабораторных условиях голые землекопы живут более 30 лет [29, 30]. У голого землекопа практически отсутствуют такие заболевания, как диабет и рак, а также сердечно-сосудистые и неврологические патологии. Инфекционные патологии крайне редки [29], также характерна высокая устойчивость к гипоксии мозга [31–33].
Полученные ранее и в рамках этого исследования результаты совместно проанализированы и представлены в данной статье.
МЕТОДЫ ИССЛЕДОВАНИЯ
Мыши С57BL\6 в возрасте 2.5 мес. (группа из 5 самцов) и 2.5 года (группа из 5 самцов) содержались при естественном свете, температуре 22 ± 2°C, при свободном доступе к воде и пище (RK-120-1; Laboratorsnab, Россия). Все манипуляции с животными проводились в соответствии с European Union Council Directive 86/609/EEC.
Голые землекопы (Heterocephalus glaber) в возрасте 6 мес. (4 рабочих самца) и 5 лет (4 рабочих самца) содержались в колониях в Институте исследований животных в зоопарке и в дикой природе им. Лейбница, в искусственной системе нор с туннелями и плексигласовыми боксами. В системе поддерживалась температура 26–29°C с высокой относительной влажностью 60–80%. В боксах была деревянная подстилка, мелкие веточки и кусочки необеленой бумаги. Свежая еда была доступна ежедневно без ограничений и включала сладкий картофель, морковь, яблоки, фенхель, крупы с витаминами и минералами и овсяные хлопья. Забор материала был одобрен этической комиссией “Landesamt für Gesundheit und Soziales”, Берлин, Германия (#ZH 156).
Для исследования ультраструктуры митохондриального аппарата скелетной мышцы забирали ткань широких мышц бедра, латеральной, медиальной и промежуточной (musculus vastus lateralis, -medius, -intermedius). Для электронно-микроскопического исследования образцы фиксировали 3%-ным раствором глутарового альдегида на фосфатном буфере (рН 7.4) в течение 2 ч при 4°С; затем дофиксировали 1%-ным раствором четырехокиси осмия в фосфатном буфере в течение 1.5 ч и обезвоживали в растворах спиртов с возрастающей концентрацией спирта – 50; 60; 70; 96 и 100%. Материал заливали в эпоксидную смолу Эпон 812. Серийные ультратонкие срезы делали алмазным ножом на ультрамикротоме Leica ULTRACUT UCT (Leica, Германия). Срезы контрастировали цитратом свинца. Полученные препараты просматривали и фотографировали в электронном микроскопе JEM-1400 (JEOL, Япония) с помощью цифровой камеры Olympus QUEMESA (Olympus Corporation, Япония).
Для морфометрического исследования хондриома скелетной мышцы было отобрано по 20 фотографий с увеличением ×1500 для каждого животного. На фотографиях продольных срезов мышечного волокна с помощью графического редактора Adobe® Photoshop®, выделялись все сечения митохондрий на срезе, а также, с помощью инструмента “Счетчик” (Count tool), подсчитывалось количество сечений. Используя полученные данные, а также известный масштаб снимка, с помощью пакета анализа Photoshop были рассчитаны необходимые параметры:
– количество сечений митохондрий на квадратный микрометр мышечного волокна;
– средняя площадь одного сечения митохондрии на срезе;
– соотношение общей площади сечений митохондрий на срезе к общей площади мышечного волокна, которое определяет объемную долю митохондрий в объеме волокна.
Для расчетов статистических показателей использовалась программа STATISTICA® 8. Данные представлены в виде средних значений, погрешности соответствуют стандартной ошибке. Для проверки нормальности распределений использовались критерии Шапиро–Уилкса и Колмогорова–Смирнова. Степень достоверности определялась с помощью критерия Манна–Уитни. При необходимости делалась поправка Бонферрони на множественное сравнение. Достоверным считалось значение p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Как показали результаты проведенного нами электронно-микроскопического исследования, ультраструктура митохондриального аппарата скелетной мышцы мышей соответствует литературным представлениям, полученным на основе трехмерных реконструкций по ультратонким серийным срезам [23, 24]. На рис. 3 – поперечный срез через изотропную зону мышечного волокна мыши C57BL\6 в возрасте 2.5 мес. Хорошо видна развитая единая сеть митохондриального ретикулума, которую составляет система нитчатых протяженных митохондрий, расположенных в изотропной области мышечного волокна. Субсарколеммальные митохондрии на уровне изотропной области входят в эту единую систему посредством ответвлений, ведущих к центру мышечного волокна.
Рис. 3.
Ультраструктура митохондриального аппарата скелетной мышцы на поперечном срезе изотропной зоны мышечного волокна мыши C57BL\6 в возрасте 2.5 мес.

На рис. 4 представлена электронно-микроскопическая картина продольного среза скелетной мышцы мыши С57BL/6 в возрасте 2.5 месяцев. Митохондриальный ретикулум, образованный системой разветвленных митохондрий, на продольном сечении мышечного волокна выглядит в виде небольших сферических или эллипсоидных органелл, расположенных попарно в изотропной области по обе стороны Z-дисков (рис. 4). Местами в изотропной зоне параллельно Z-дискам проявляются удлиненные сечения митохондрий (стрелка 1 на рис. 4). Субсарколеммальная популяция митохондрий, расположена под сарколеммой на периферии мышечного волокна (стрелка 2 на рис. 4).
Рис. 4.
Ультраструктура митохондриального аппарата скелетной мышцы на продольном срезе мышечного волокна мыши C57BL\6 в возрасте 2.5 мес. Стрелка 1 – удлиненные сечения митохондрий в изотропной зоне параллельно Z-дискам. Стрелка 2 – субсарколеммальная популяция митохондрий.

Мы обнаружили, что с возрастом структура хондриома скелетной мышцы мышей претерпевает значительные изменения по сравнению с молодыми животными. На поперечных сечениях мышечного волокна скелетной мышцы мыши C57BL\6 в возрасте 2.5 года можно видеть значительную редукцию митохондриального ретикулума (рис. 5). В изотропной зоне мышечного волокна отсутствует сеть митохондриального ретикулума – видны лишь отдельные митохондрии овальной или извитой неправильной формы.
Рис. 5.
Ультраструктура митохондриального аппарата скелетной мышцы на поперечном срезе изотропной зоны мышечного волокна мыши C57BL\6 в возрасте 2.5 года. Стрелка 1 – изотропная зона мышечного волокна; стрелка 2 – Z-диск; стрелка 3 – митохондрии.

Наиболее наглядно редукция с возрастом митохондриального аппарата волокон скелетной мышцы мыши демонстрируется на продольном сечении мышечного волокна. На рис. 6 можно видеть, что митохондриальный материал в мышечных волокнах слабо выражен и представлен мелкими митохондриями, расположенными в основном вдоль миофибрилл.
Рис. 6.
Ультраструктура митохондриального аппарата скелетной мышцы на продольном срезе мышечного волокна мыши C57BL\6 в возрасте 2.5 года. Стрелкой показана субсарколеммальная популяция митохондрий.

Сравнительная картина изменений общей структуры хондриома, развивающихся в скелетной мышце мыши с возрастом, показана на рис. 7, где на одном увеличении представлены участки мышечного волокна мыши C57BL\6 в возрасте 2.5 месяцев (рис. 7a) и в возрасте 2.5 года (рис. 7b). В то же время изменений внутренней организации митохондрий скелетной мышцы у мышей в возрасте 2.5 года нами обнаружено не было.
Рис. 7.
Сравнительная картина изменений общей структуры хондриома, развивающихся в скелетной мышце мыши с возрастом. Участок продольного среза мышечного волокна мыши C57BL\6 в возрасте 2.5 мес. (a); в возрасте 2.5 года (b).

Морфометрическое исследование возможных изменений хондриома скелетной мышцы, обусловленных возрастом, у мышей С57BL/6 было проведено на 20 электронно-микроскопических снимках для каждого животного (100 снимков на группу) (см. раздел Методы исследования).
На рис. 8 представлены результаты морфометрического анализа. У животных в возрасте 2.5 лет наблюдалось практически двукратное снижение среднего количества сечений митохондрий на 1 мкм2 мышечного волокна по сравнению с 2.5-месячными животными (0.23 ± 0.02 против 0.45 ± 0.07 шт на мкм2 соответственно) (рис. 8a) при одновременном увеличении средней площади одного сечения митохондрии — с 0.15 ± 0.01 мкм2 в 2.5 мес. до 0.22 ± 0.01 мкм2 в 2.5 года (рис. 8b). В целом, объемная доля митохондрий скелетной мышцы у мышей C57BL6 снизилась с возрастом с 6.81 ± 1.51% в 2.5 мес. до 5.44 ± 0.38% в 2.5 года (рис. 8c).
Рис. 8.
Количественная оценка динамики изменений хондриома скелетной мышцы мышей C57BL\6 в возрасте 2.5 мес. и 2.5 года. (a) – количество митохондрий (шт.) на 1 мкм2 мышечного волокна, (b) – площадь сечения одной митохондрии, (c) – объемная доля митохондрий мышечного волокна. * – различие достоверно (p < 0.05). Погрешности соответствуют стандартной ошибке среднего.

Таким образом, площадь хондриома в скелетной мышце мышей C57BL\6 снижается с возрастом за счет почти двукратного снижения количества сечений митохондрий в мышечном волокне (рис. 8). При этом объемная доля митохондрий изменяется не столь значительно. Можно предположить, что снижение числа митохондрий в некоторой степени компенсируется увеличением их размеров.
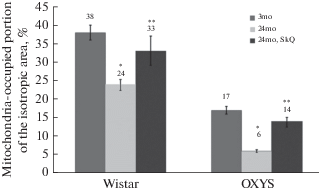
Полученные данные возрастных изменений митохондриального аппарата скелетной мышцы мышей полностью соответствуют ранее опубликованным результатам исследования возрастных нарушений структурной организации митохондриального аппарата скелетной мышцы крыс Вистар – еще одного представителя короткоживущих грызунов [34]. Морфометрические исследования показывают, что у крыс Вистар к 24-м месяцам площадь хондриома изотропной зоны значительно снижается (с 38 до 24%, р < 0.05) (рис. 9). В то же время у крыс линии OXYS, как показали опубликованные нами ранее результаты [34], к 24-ем месяцам площадь хондриома изотропной зоны снижается более значительно: с 17 до 6%, р < 0.05, т.е. у крыс OXYS площадь, занимаемая митохондриями, почти в 5 раз меньше, чем у крыс Вистар (24% для Вистар и всего 6% для OXYS, р < 0.05) (рис. 9).
Рис. 9.
Отношение суммарной площади митохондрий, расположенных в изотропной области к общей площади изотропной области у крыс Вистар и OXYS (%) [34]. * – p < 0.05 при сравнении с 3-месячными животными Вистар или OXYS соответственно; ** – p< 0.01 по сравнению с 24-месячными животными.
У крыс линии OXYS, в отличие от мышей и крыс Вистар, изменения структуры митохондриального аппарата мышечной ткани начинают развиваться уже в возрасте 3-х месяцев и затрагивают не только общую организацию хондриома, но и внутреннюю ультраструктуру митохондрий. Нами была обнаружена удивительная перестройка ультраструктурной организации митохондрий, неизвестная ранее в литературе – митохондрии в виде протяженных извитых органелл, у которых пространство матрикса представлено продольно расположенными двумя–тремя кристами, а межмембранное пространство имеет вид локальных расширений, заполненных гомогенным веществом (обычно межмембранное пространство митохондрий электронно-прозрачное) (рис. 10) [35]. Первые признаки такой перестройки в виде локальных увеличений межмембранного пространства появляются в митохондриях скелетной мышцы крыс линии OXYS еще в 3- месячном возрасте.
Рис. 10.
Скопление атипичных митохондрий в субсарколеммальной области мышечного волокна крыс OXYS в возрасте 24 мес. (a) – обзорная фотография; стрелкой показана группа митохондрий, представленная на рисунке (b) на большем увеличении [35].

Наряду с изменениями митохондриального аппарата происходят нарушения структуры мышечных волокон в целом: появляются обширные области разрушенных миофибрилл, области аутофагосомальной активности. Таким образом, у крыс OXYS степень патологических изменений мышечной ткани значительно выше, чем у крыс Вистар. Антиоксидант SkQ1 снижал степень патологических изменений митохондриального аппарата скелетной мышцы у крыс OXYS. Прием SkQ1 в течение 6 мес. (с 18 мес.) приводил к сохранению суммарной площади митохондрий изотропной зоны (этот показатель менялся с 6 до 14%, р < 0.01) (рис. 9). Поскольку ключевой характеристикой крыс OXYS является усиленная генерация радикалов кислорода митохондриями, эти данные соответствуют литературным представлениям, согласно которым митохондрии играют центральную роль в развитии возрастных патологических процессов в скелетной мышце [36]. Необходимо отметить, что и у крыс Вистар прием антиоксиданта SkQ1 в течение 5 мес. (с 19 мес.) оказывал значительный защитный эффект. Площадь хондриома изотропной зоны скелетной мышцы крыс Вистар с возрастом снижалась незначительно по сравнению с молодыми животными (3 мес.): с 38 до 33% соответственно (рис. 9). Таким образом, митохондриальный антиоксидант SkQ1, оказывая защитный эффект на уровне митохондрий, останавливает процесс деградации на органном уровне.
Наши исследования показали, что с возрастом в скелетных мышцах мышей C57BL\6 и крыс Вистар и OXYS происходят значительные нарушения общей организации и структуры митохондриального аппарата за счет уменьшения как числа митохондрий, так и размеров отдельных органелл.
С полученными нами результатами для короткоживущих грызунов полностью расходятся имеющиеся к настоящему времени предварительные данные по исследованию митохондриального аппарата голого землекопа (Heterocephalus glaber) [37, 38]. Как было показано ранее, в скелетной мышце крыс после рождения постепенно количество митохондрий значительно увеличивается, митохондрии объединяются друг с другом, шаг за шагом создавая трехмерный ретикулум. Этот процесс завершается к 1.5–2-месячному возрасту [24]. Однако у голых землекопов даже к возрасту 6 мес. митохондрии мелкие, одиночные как на поперечных, так и на продольных сечениях мышечного волокна (рис. 11a). К возрасту 5-ти лет количество и размер митохондрий значительно возрастает, однако митохондриальная сеть так и не формируется (рис. 11b).
Рис. 11.
Ультраструктура продольного среза мышечного волокна скелетной мышцы голого землекопа (Heterocephalus glaber) в возрасте: 6 мес. (a); 5 лет (b).

У голого землекопа с возрастом наблюдались следующие морфометрические изменения хондриома скелетной мышцы: число сечений митохондрий выросло вдвое и составило 0.47 ± 0.03 шт на мкм2 для пятилетних животных (0.23 ± ± 0.02 шт на мкм2 в 6 мес.) (рис. 12b). Средняя площадь сечения одной митохондрии выросла к пяти годам до 0.29 ± 0.03 c 0.21 ± 0.1 мкм2 в 6 мес. (рис. 12a). Объемная доля хондриома в 6 месяцев составила 4.77 ± 0.42% и к пяти годам увеличилась практически трехкратно – до 12.68 ± 1.81% (рис. 12c). Таким образом, у голого землекопа к 5-ти годам не только не развивается патологические изменения митохондриального аппарата скелетной мышцы, но и наоборот – происходит существенный рост, усиление хондриома, хотя при этом митохондрии так и не объединяются в ретикулум.
Рис. 12.
Количественная оценка динамики изменений хондриома скелетной мышцы голого землекопа (Heterocephalus glaber) в возрасте 6 месяцев и 5 лет. (a) – площадь сечения одной митохондрии (мкм2). (b) – количество митохондрий (в шт.) на 1 мкм2 мышечного волокна. (c) – объемная доля хондриома (%). * – различие достоверно при уровне p <0.05. Погрешности соответствуют стандартной ошибке среднего.

Эти данные позволяют предположить, что в скелетной мышце голого землекопа к возрасту 5 лет митохондриальный ретикулум все еще находится в процессе формирования, которое у крыс и мышей, как указывалось, заканчивается уже в 1.5–2 мес. В свете этих данных, атипичную модель развития ультраструктуры хондриома скелетной мышцы у голого землекопа можно рассматривать как длительную задержку развития – замедление старения. В настоящее время предполагается, что замедление старения может быть следствием неотении – сохранение ювенильных черт у половозрелой особи [38].
Можно предположить, что формирующаяся к 5-летнему возрасту в скелетной мышце голого землекопа особая организация митохондриального аппарата обеспечивает необходимый уровень окислительно-восстановительных процессов в мышцах, предупреждая снижение работоспособности и развитие саркопении.
Обнаруженные нами развивающиеся с возрастом нарушения структурной организации митохондриального аппарата скелетной мышцы как у мышей C57BL\6, так и у крыс Вистар и OXYS, очевидно, отражают нарушения в функционировании этих органелл и могут являться одной из основных причин развития возраст-зависимых патологий и, в частности, саркопении.
Список литературы
Baumann CW, Kwak D, Liu HM, Thompson VL (2016) Age-induced oxidative stress: How does it influence skeletal muscle quantity and quality? J Appl Physiol 121: 1047–1052. https://doi.org/10.1152/japplphysiol.00321.2016
Brunk UT, Terman A (2002) The mitochondrial-lysosomal axis theory of aging: accumulation of damaged mitochondria as a result of imperfect autophagocytosis. Eur J Biochem 269: 1996–2002. https://doi.org/. 1432-1033. 2002. 02869. x
Derbré F, Gratas-Delamarche A, Gómez-Cabrera MC, Viña J (2014) Inactivity-induced oxidative stress: A central role in age-related sarcopenia? Eur J Sport Sci 14: 98–108. https://doi.org/10.1080/17461391.2011.654268
Gamboa JL, Billings FT, Bojanowski MT, Gilliam LA, Yu C, Roshanravan B, Roberts LJ, Himmelfarb J, Ikizler TA, Brown NJ (2016) Mitochondrial dysfunction and oxidative stress in patients with chronic kidney disease. Physiol Rep 4(9): e12780. https://doi.org/10.14814/phy2.12780
Santos LS, Baraibar MA, Lundberg S, Eeg-Olofsson O, Larsson L, Friguet B (2015) Oxidative proteome alterations during skeletal muscle ageing. Redox Biol 5: 267–274. https://doi.org/10.1016/j.redox.2015.05.006
Moulin M, Ferreiro A (2017) Muscle redox disturbances and oxidative stress as pathomechanisms and therapeutic targets in early-onset myopathies. Semin Cell Dev Biol 64: 213–223. https://doi.org/10.1016/j.semcdb.2016.08.003
Rygiel KA, Picard M, Turnbull DM (2016) The ageing neuromuscular system and sarcopenia: a mitochondrial perspective. J Physiol 594: 4499–4512. https://doi.org/10.1113/JP271212
Dai DF, Chiao YA, Marcinek DJ, Szeto HH, Rabinovitch PS (2014) Mitochondrial oxidative stress in aging and healthspan. Longev Heal 3: 6. https://doi.org/10.1186/2046-2395-3-6
Johnson ML, Robinson MM, Nair KS (2013) Skeletal muscle aging and the mitochondrion. Trends Endocrinol Metab 24: 247–256. https://doi.org/10.1016/j.tem.2012.12.003
Sacktor B, Shimada Y (1972) Degenerative changes in the mitochondria of flight muscle from aging blowflies. J Cell Biol 52: 465–477. https://doi.org/10.1083/jcb.52.2.465
Бакеева ЛЕ, Сапрунова ВБ, Пасюкова ЕГ, Рощина НВ (2007) Митоптоз в летательной мышце Drosophila melanogaster. Докл Акад наук 413: 1–3 [Bakeeva LE, Saprunova VB, Pasyukova EG, Roshina NV (2007) Mitoptosis in the flight muscle of Drosophila melanogaster. Acad Sci Rep 413: 1–3 (In Russ)]. https://doi.org/10.1134/S0012496607020111
Williams CM, Barness LA, Sawyer WH (1943) The utilization of glycogen by flies during flight and some aspects of the physiological ageing of Drosophila. Biol Bull (Woods Hole) 84: 263–268. https://doi.org/10.2307/1538009
Walker DW, Benzer S (2004) Mitochondrial “swirls” induced by oxygen stress and in the Drosophila mutant hyperswirl. Proc Natl Acad Sci USA 101: 10290–10295. https://doi.org/10.1073/pnas.0403767101
Anisimov VN, Bakeeva LE, Egormin PA, Filenko OF, Isakova EF, Manskikh VN, Mikhelson VM, Panteleeva AA, Pilipenko DI, Piskunova TS, Popovich IG, Saprunova VB, Samoylova TA, Semenchenko AV, Skulachev MV, Tyndyk ML, Vyssokikh MY, Yurova MN, Zabezhinsky MA, Skulachev VP (2008) Mitochondria- targeted plastoquinone derivatives as tools to interrupt execution of the aging program. 5. SkQ1 prolongs lifespan and prevents development of traits of senescence. Biochemistry (Moscow) 73: 1329–1342. https://doi.org/10.1134/s0006297908120055
Beregi E, Regius O, Huttl T, Gobl Z 1988) Age-related changes in the skeletal muscle cells. Z Gerontol 21: 83–86. PMID: 2968024
Бакарев МА, Непомнящих ЛМ (2004) Структурные проявления нарушений митохондриальной функции в скелетных мышцах у преждевременно стареющих крыс OXYS. Бюлл эксп биол и мед 138: 674–679. [Bakarev MA, Nepomnyashchikh LM (2004) Structural manifestations of mitochondrial dysfunction in skeletal muscles in premature aging OXYS rats. Bull Exp Biol Med 138: 674–679 (In Russ)].
Corsetti G, Pasini E, D’Antona G, Nisoli E, Flati V, Assanelli D, Dioguardi FS, Bianchi R (2008) Morphometric changes induced by amino acid supplementation in skeletal and cardiac muscles of old mice. Am J Cardiol 101: 26E–34E. https://doi.org/. amjcard. 2008. 02. 078
Crane JD, Devries C, Safdar A, Hamadeh MJ, Tarnopolsky MA (2010) The effect of aging on human skeletal muscle mitochondrial and intramyocellular lipid ultrastructure. J Gerontol 65: 119–128. https://doi.org/10.1101/cshperspect.a029785
Orlander J, Kiessling K, Larsson L, Karlsson J, Aniansson A (1978) Skeletal muscle metabolism and ultrastructure in relation to age in sedentary men. Acta Physiol Scand 104: 249–261. https://doi.org/10.1111/j.1748-1716.1978.tb06277.x
Palade GE (1956) Electron microscopy of mitochondria and other cytoplasmic structures. In: Enzymes: Units of Biological Structure and Function. Acad Press New York 185–215.
Gauthier GF, Padykula HA (1966) Cytological studies of fiber types in skeletal muscle. A comparative study of the mammalian diaphragm. J Cell Biol 28: 333–354. https://doi.org/10.1083/jcb.28.2.333
Bubenzer HJ (1966) Die dunnen und die dicken Muskelfasern des Zwerchfells der Ratte. Z Zellforsch 69: 520–550. https://doi.org/10.1007/BF00406300
Bakeeva LE, Skulachev VP, Chentsov YS (1978) Mitochondrial framework (reticulum mitochondriale) in rat diaphragm muscle. Biochim Biophys Acta 501: 349–369. https://doi.org/10.1016/0005-2728(78)90104-4
Bakeeva LE, Chentsov YS, Skulachev VP (1981) Ontogenesis of mitochondrial reticulum in rat diaphragm muscle. Eur J Cell Biol 25: 175–181.
Kirkwood SP, Munn EA, Brooks GA (1986) Mitochondrial reticulum in limb skeletal muscle. Am J Physiol 251: 395–402. https://doi.org/10.1152/ajpcell.1986.251.3.C395
Glancy B, Hartnell LM, Malide D, Yu ZX, Combs CA, Connelly PS, Subramaniam S, Balaban RS (2015) Mitochondrial reticulum for cellular energy distribution in muscle. Nature 523: 617–620. https://doi.org/10.1038/nature14614
Pellegrini G, Barbieri S, Moggio M, Cheldi A, Scarlato G, Minetti C (1985) A case of congenital neuromuscular disease with uniform type I fibers, abnormal mitochondrial network and jagged Z-line. Neuropediatrics 16: 162–166. https://doi.org/10.1055/s-2008-1059533
Leduc-Gaudet JP, Picard M, Pelletier FSt-J, Sgarioto N, Auger MJ, Vallée J, Robitaille R, St-Pierre DH, Gouspillou G (2015) Mitochondrial morphology is altered in atrophied skeletal muscle of aged mice. Oncotarget 6: 17923–17937. https://doi.org/10.18632/oncotarget.4235
Buffenstein R (2008) Negligible senescence in the longest living rodent, the naked mole-rat: insights from a successfully aging species. Compar Physiol B №178: 439–445. https://doi.org/10.1007/s00360-007-0237-5
Orr ME, Garbarino VR, Salinas A, Buffenstein R (2015) Sustained high levels of neuroprotective, high molecular weight, phosphorylated tau in the longest-lived rodent. Neurobiol Aging 36: 1496–1504. https://doi.org/10.1016/j.neurobiolaging.2014.12.004
Larson J, Park TJ (2009) Extreme hypoxia tolerance of naked mole-rat brain. NeuroReport 20: 1634–1637. https://doi.org/10.1097/WNR.0b013e32833370cf
Maina JN, Gebreegziabher Y, Woodley R, Buffenstein R (2001) Effects of change in environmental temperature and natural shifts in carbon dioxide and oxygen concentrations on the lungs of captive naked mole-rats (Heterocephalus glaber): a morphological and morphometric study. J Zool 253: 371–382. https://doi.org/10.1017/S0952836901000346
Park TJ, Lu Y, Jüttner R, Smith EJ, Hu J, Brand A, Wetzel C, Milenkovic N, Erdmann B, Heppenstall PA, Laurito CE, Wilson SP, Lewin GR (2008) Selective Inflammatory Pain Insensitivity in the African Naked Mole-Rat (Heterocephalus glaber). PLoS Biol January 6: 13. https://doi.org/10.1371/journal.pbio.0060013
Eldarov CM, Vangely IM, Kolosova NG, Bakeeva LE, Skulachev VP (2014) Antioxidant SkQ1 delays sarcopenia- associated damage of mitochondrial ultrastructure. Aging 6: 140–148. https://doi.org/10.18632 / aging. 100636
Bakeeva LE (2015) Age-Related Changes in Ultrastructure of Mitochondria. Effect of SkQ1. Biochemistry 80: 1582–8. https://doi.org/10.1134/S0006297915120068
Marzetti E, Hwang JC, Lees HA, Wolhgemuth SE, Dupont-Versteegden EE, Carter CS, Bernabei R, Leeuwenburgh C (2010) Mitochondrial death effectors: relevance to sarcopenia and disuse muscle atrophy. Biochim Biophys Acta 1800: 235–244. https://doi.org/. bbagen. 2009. 05. 007
Holtze S, Eldarov CM, Vays VB, Vangeli IM, Vysokikh MY, Bakeeva LE, Skulachev VP, Hildebrandt TB (2016) Study of Age-Dependent Structural and Functional Changes of Mitochondria in Skeletal Muscles and Heart of Naked Mole Rats (Heterocephalus glaber). Biochemistry 81: 1703–1712. https://doi.org/10.1134/S000629791612004
Skulachev VP, Holtze S, Vyssokikh MY, Bakeeva LE, Skulachev MV, Markov AV, Hildebrandt TB, Sadovnichii VA (2017) Neoteny, prolongation of youth: from naked mole rats to “naked apes” (humans). Physiol Rev 97: 699–720. https://doi.org/10.1152/physrev.00040.2015
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


