Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 895-910
Структурно-метаболические изменения скелетных мышц у пациентов с хроническим нарушением сознания – к вопросу о полинейромиопатиях критических состояний (ПЭТ-патоморфологическое исследование)
С. А. Кондратьев 1, Е. Н. Скитева 1, Ю. М. Забродская 1, *, Д. В. Рыжкова 1, Е. А. Кондратьева 1, А. Н. Кондратьев 1
1 Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова – филиал Национального медицинского исследовательского центра им. В.А. Алмазова
Санкт-Петербург, Россия
* E-mail: zabrjulia@yandex.ru
Поступила в редакцию 10.03.2021
После доработки 07.05.2021
Принята к публикации 08.05.2021
Аннотация
Пребывание пациентов в состоянии хронического нарушения сознания (ХНС) приводит к развитию дисфункции (слабости, парезам) их скелетной мускулатуры – полинейропатии и миопатии критических состояний. Представляют интерес изучение механизмов развития патологии и оценка реабилитационного потенциала таких пациентов. Методами позитронной эмиссионной компьютерной томографии (ПЭТ/КТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) и патоморфологического исследования с иммуногистохимией получены данные о структурных и метаболических изменениях в скелетных мышцах верхних конечностей у 22 пациентов с ХНС. Проведенное исследование показало, что структурные изменения скелетных мышц имеют неспецифический дегенеративно-атрофический характер с более выраженными проявлениями на стороне пареза. Выявленные по снижению уровня метаболизма 18F-ФДГ метаболические нарушения мышц плечевого пояса у пациентов с ХНС развивались симметрично, вне зависимости от степени снижения мышечного тонуса и глубоких рефлексов. Наряду с дегенеративными изменениями, включающими повреждение сократительных элементов саркомеров, потерю десмина и дистрофина, снижение уровня метаболизма 18F-ФДГ, в скелетных мышцах пациентов наблюдались признаки адаптивных структурно-функциональных перестроек – модификация фенотипа мышечных волокон по “быстрому” типу и активация аутофагического пути.
В последние десятилетия совершенствование методов интенсивной терапии привело к увеличению количества пациентов, которые из состояния комы переходят в различные варианты хронического нарушения сознания (ХНС): синдром ареактивного бодрствования (САБ), состояние минимального сознания (СМС) “плюс” и “минус”. САБ характеризует полное отсутствие признаков сознания на фоне сохранного бодрствования, при СМС “плюс” пациент может следить взглядом за предметами и выполнять простые задания, а при СМС “минус” – только фиксировать взгляд [1]. Согласно статистике, в США число пациентов с ХНС составляет в среднем 46 на 1 млн популяции, в Великобритании – 14 [2], в Бельгии – 36 [3]; в России обобщающих статистических данных по количеству пациентов с ХНС в настоящее время нет. О распространенности патологии можно судить по данным анкетированного опроса 15 крупных стационаров различных городов, в которых общее число пациентов с ХНС за три года (2009–2012 гг.) составило 747 человек с преобладанием пациентов с последствием черепно-мозговой травмы (42%). В 35 стационарах Санкт-Петербурга число пациентов, находившихся в отделениях реанимации и интенсивной терапии более 30 сут в 2016 г., составило 705, из них 533 – в состоянии ХНС [4]. Лечение, оценка возможности восстановления сознания и реабилитационного потенциала пациентов с ХНС затрагивают не только медицинские, но и социальные, этические аспекты. Все большее внимание привлекает возникающая у получающих интенсивную терапию больных слабость скелетной мускулатуры – полинейропатия и миопатия критических состояний [5, 6]. Фундаментальные работы, обобщающие механизм нарушения функций поперечнополосатой мускулатуры у больных с тяжелым поражением ЦНС, переживших критическое состояние, возможности их восстановления, а также сопоставлений структурных изменений со степенью выраженности неврологических изменений в настоящее время имеют фрагментарный характер [7–9]. Первоначально интерес к этой проблеме был вызван наблюдениями, что мышечная слабость препятствует переводу пациента с искусственной вентиляции легких на спонтанное дыхание. Неспецифическое поражение нервов и мышц, по данным разных авторов, развивается у 50–100% больных в срок от нескольких часов до нескольких суток пребывания в палате интенсивной терапии при различных заболеваниях [8–10]. Отсутствуют исследования проявлений полинейропатии критических состояний у нейрореанимационных больных, исходно имеющих парезы и параличи вследствие очагового поражения ЦНС.
Патогенез полинейропатии критических состояний с развитием атрофии мышц остается недостаточно изученным [10, 11]. Гиподинамия, слабость – составные части синдрома “поведение при болезни” (Sickness behavior) [12]. Этот синдром рассматривается как координированный адаптивный вариант поведения индивидуума во время инфекционного заболевания или выраженного системного воспалительного ответа на действие неинфекционных факторов. С этих позиций гиподинамия и вторичная мышечная слабость рассматривается как приспособительная реакция организма. В повседневной практической работе с данной категорией пациентов мы наблюдаем, что со временем у 95% больных появляется двигательная активность в виде произвольных и непроизвольных движений, которая, на наш взгляд, косвенно демонстрирует возможный первично-приспособительный характер внутриклеточных и метаболических изменений мышечной ткани в остром периоде повреждения головного мозга различной этиологии при критических состояниях и заложенный восстановительный потенциал. Совершенствование дифференциальной диагностики, прогнозирования исхода, лечения слабости скелетной мускулатуры у нейрореанимационных пациентов является актуальной проблемой как с научной, так и с практической точек зрения. Решение данной задачи возможно с применением клинических, электрофизиологических, нейровизуализационных и патоморфологических исследований [13]. Указанные подходы необходимы для изучения морфофункциональных механизмов атрофии и возможности к регенерации поперечнополосатой мускулатуры у пациентов с мышечной слабостью, обусловленной тяжелыми поражениями головного мозга различной этиологии.
Целью исследования была характеристика структурных и метаболических изменений в скелетных мышцах у пациентов с ХНС с глубокой атрофией скелетных мышц и аналитическое сопоставление данных позитронной эмиссионной компьютерной томографии (ПЭТ/КТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) и результатов патоморфологического исследования.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование были включены 22 пациента с ХНС (САБ, СМС), лечившиеся в отделении анестезиологии и реанимации РНХИ им. проф. А.Л. Поленова. Международные критерии диагноза САБ: восстановление реакции пробуждения – открывание глаз на фоне отсутствия признаков осознания себя и окружающих (отсутствие поведенческих реакций). По преимущественному проявлению спонтанной активности выделяют пациентов с гипореактивным (патологическая поза, спастические и вялые тетрапарезы) и гиперреактивным (гиперкинезы, постгипоксические миоклонии действия, другие виды экстрапирамидных нарушений) бодрствованием. В зависимости от уровня сознания пациенты были разделены на три группы: I группа – вегетативное состояние (ВС)/САБ – 6 пациентов, средний возраст – 36 лет; II группа – СМС “минус” – 12 пациентов, средний возраст – 36 лет (от 19 до 56 лет); III группа – СМС “плюс” и “выход из состояния минимального сознания” – 4 пациента, средний возраст – 28 лет (от 22 до 32 лет). Продолжительность нарушения сознания – не менее 2 мес. на момент включения в исследование.
Всем пациентам, вошедшим в исследование, был поставлен диагноз полинейропатия критических состояний на основе клинических и/или электрофизиологических данных (рис. 1). Была определена различная степень латерализации симптоматики: неравномерное распределение и изменения мышечного тонуса, односторонние моно- или гемипарезы и/или параличи.
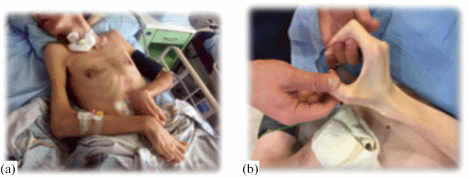
Рис. 1.
Пациент с хроническим нарушением сознания. Глубокая атрофия мышц (а), спастика верхних конечностей (b).
Все процедуры, выполненные в нашем исследованиии с участием людей, соответствуют этическим стандартам национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Так как все обследованные больные на момент принятия решения о проведении диагностической биопсии находились в малом сознании, согласие на проведение исследования во всех случаях получено от родственников пациентов. Исследование одобрено локальным этическим комитетом ФГБУ НМИЦ им. В.А. Алмазова. Всем пациентам выполнена ПЭТ/КТ с 18F-ФДГ скелетных мышц плечевого пояса, для выявления асимметрии метаболизма мышц проводилось сопоставление со шкалой мышечного тонуса. ПЭТ/КТ с 18F-ФДГ выполняли на фоне 6-часового голода, в состоянии седации (пропофол 0.5–2 мкг/кг/ч) на совмещенном сканере Discovery 710 (GeneralElectric). 18F-ФДГ вводили внутривенно струйно в дозе 125–250 МБк. ПЭТ/КТ-сканирование начинали через 40 мин после введения 18F-ФДГ в статическом режиме одной анатомической зоны (скелетных мышц плечевого пояса обеих конечностей), длительность ПЭТ/КТ-сканирования составила 3 мин на каждое положение топографического стола, ПЭТ/КТ-сканированию предшествовала низкодозная компьютерная томография для коррекции аттенюации.
Анализ ПЭТ/КТ изображений скелетных мышц плечевого пояса проводился при помощи программного пакета PET/CTReview, установленного на рабочей станции томографа в рабочей среде AdvantageWindowsWorkstation 4.6. Для расчета коэффициента дифференциального накопления (КДНскелетная мышца/жир) определяли стандартизированное накопление 18F-ФДГ и SUVсредний в регионах интереса (ROI), построенными над скелетными мышцами (дельтовидной, двуглавой, трехглавой и плечелучевой) обеих конечностей и подкожным жиром (рис. 2).
Рис. 2.
ПЭТ/КТ с 18F-ФДГ скелетных мышц. Аксиальный срез. ROI 1 – регион интереса, построенный над подкожной жировой клетчаткой правой верхней конечности; ROI 2 – регион интереса, построенный над скелетной мышцей правой верхней конечности, SUVmax (М) и SUVсредний (Av) рассчитаны автоматически в ROI 1 и ROI 2.

Для патоморфологического исследования врачом-хирургом в условиях “малой хирургической операции” осуществлялся забор исследуемой ткани под местной анестезией 1%-ным раствором новокаина, размер мышечных биоптатов составлял 1 × 1 × 1 см . Критериями исключения являлись воспаление в области забора биопсийного материала, непереносимость местных анестетиков, тяжелая сопутствующая патология (сепсис, полиорганная недостаточность, почечная недостаточность в стадии декомпенсации). Материал, биоптаты дельтовидных мышц (m. deltoideus), забирался с двух сторон, у 11 пациентов – условно здоровой (без пареза и спастики) и больной (с изменением мышечного тонуса и парезами) (22 биоптата), у 1 пациента без атрофии мышц – условно здорового (2 биоптата).
Гистологическое исследование включало в себя фиксацию биоптатов в забуференном 10%-ном растворе нейтрального формалина, проведение спиртовой проводки и заливку в парафин. На ротационном микротоме получали парафиновые срезы толщиной 5–7 мкм. Далее гистологические препараты окрашивались по стандартным протоколам с использованием окрасок гематоксилином и эозином, для изучения структуры соединительной ткани пикриновой кислотой и фуксином по методу Ван Гизона. Для 12 биоптатов процедура воспроизведена с определением среднего значения для стороны с парезом и без пареза.
Иммуногистохимические (ИГХ) реакции выполнялись на парафиновых срезах по стандартному протоколу, с демаскировкой антигена на водяной бане. Использовались первичные антитела к дистрофину – dystrophin (ab85302; 1 : 150), беклину-1 – beclin-1 (ab62557; 1 : 100), миозину – myosin (Fast, DBS; 1 : 150), десмину – desmin (DBS; 1 : 50). Система визуализации фирмы DBS. Для морфометрической оценки степени атрофии и количества быстрых мышечных волокон проводился подсчет общего количества миоцитов на поперечных срезах в пяти полях зрения с определением среднего значения. Использовался ручной алгоритм подсчета в программе ImageJ.
Производились вычисление количественных данных среднего арифметического (М) и ошибки среднего (m). Различия считались значимыми при p < 0.05. Применялся U-тест Манна–Уитни, а также критерий согласия Пирсона. Статистическая обработка полученных результатов проводилась с помощью программы Microsoft Office Excel 2010.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
ПЭТ/КТ с 18F-ФДГ
ФДГ-ПЭТ/КТ является важным гибридным методом визуализации в онкологии, кардиологии и неврологии. ФДГ, являясь аналогом глюкозы, подвергается схожим трансформациям в живых тканях. Попадая в клетку, она фосфорилируется до глюкозо-6-фосфата и далее метаболизируется. Однако ФДГ, являяcь 2-дезоксиглюкозой, не может удерживаться внутри клетки. Поглощение ФДГ клетками зависит от транспортеров глюкозы, взаимосвязанных с ее уровнем в сыворотке крови, а также других факторов [14]. Окисление жирных кислот является основным источником энергии для скелетных мышц в состоянии покоя. В норме скелетные мышцы демонстрируют мягкое гомогенное поглощение 18F-ФДГ с обычным максимальным стандартизированным значением поглощения (SUVmax мышцы/жировой клетчатки) в диапазоне от 0.5 до 2.2 [15]. Денервационные изменения мышц могут сопровождаться повышенным поглощении ФДГ. Несколько исследований на животных моделях показали, что повышенный метаболизм глюкозы в денервированной мышце можно зарегистрировать уже через 1 нед., но через 5, 8 и 10 нед. разница в поглощении ФДГ между денервированной и контрольной мышцами становится незначительной [16]. Исследования метаболизма скелетных мышц методом ФДГ-ПЭТ/КТ у пациентов с хроническим нарушением сознания, сочетаниями центральных и периферических парезов в доступных источниках нами не найдены.
Нами установлено, что уровень метаболизма глюкозы в скелетных мышцах у пациентов трех групп достоверно снижен по сравнению с контролем. Показатели между группами не имели существенной разницы, кроме пациентов II группы (СМС “минус”), в которой зарегистрированы наиболее низкие показатели. Значения коэффициента дифференциального накопления (КДН) SUVmax скелетная мускулатура /SUVmax в жировой клетчатке, среднего балла по шкале спастичности Ашфорта и бальной оценки глубоких рефлексов представлены в табл 1.
Таблица 1.
Средние значения коэффициента дифференциального накопления SUVmax скелетная мускулатура/SUVmax жировая клетчатка, средний балл по шкале Ашворда и шкале оценки глубоких рефлексов для пациентов различных групп
| Исследуемые мышцы правой и левой руки | Группы | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| I | II | III | контроль | ||||||
| Дельтовидная мышца | Левая | 2.34 ± 0.39 | 2.34 ± 0.79 | 2.13 ± 0.76 | 2.47 ± 0.51 | ||||
| Правая | 2.42 ± 1.17 | 2.05 ± 0.46 | 2.89 ± 2.30 | 4.20 ± 1.06 | |||||
| Двуглавая мышца плеча | Левая | 2.44 ± 0.94 | 1.96 ± 0.64 | 2.32 ± 0.54 | 2.97 ± 1.57 | ||||
| Правая | 2.47 ± 0.93 | 1.92 ± 0.77 | 3.10 ± 2.37 | 3.09 ± 2.36 | |||||
| Трехглавая мышца плеча | Левая | 2.31 ± 0.47 | 2.20 ± 0.70 | 2.34 ± 0.90 | 3.31 ± 1.18 | ||||
| Правая | 2.45 ± 0.67 | 1.97 ± 0.72 | 2.97 ± 2.50 | 3.98 ± 2.25 | |||||
| Плечелучевая мышца | Левая | 2.93 ± 1.22 | 2.64 ± 0.65 | 2.22 ± 0.82 | – | ||||
| Правая | 2.69 ± 0.91 | 2.06 ± 0.69 | 3.42 ± 2.36 | – | |||||
| Балл по шкале Ашворда | Левая | 2.83 ± 0.93 | 2.40 ± 0.76 | 2.66 ± 1.13 | 0 | ||||
| Правая | 2.83 ± 1.17 | 2.50 ± 0.81 | 3.00 ± 0.98 | 0 | |||||
| Балл по шкале оценки рефлексов | Левая | 1.66 ± 0.65 | 2.00 ± 0.62 | 1.66 ± 1.49 | 2 | ||||
| Правая | 1.66 ± 0.82 | 1.80 ± 0.58 | 1.66 ± 1.49 | 2 | |||||
У всех пациентов, в том числе контрольной группы, выявлена асимметрия накопления 18F-ФДГ в правой и левой руке. У пациентов I группы средние значения метаболизма 18F-ФДГ были наиболее высокими в мышцах левой руки, а у пациентов в III группы – правой.
Таблица 2.
Средние значения коэффициента дифференциального накопления SUVсредний скелетная мускулатура/SUVсредний в жировой клетчатке для пациентов различных групп
| Исследуемые мышцы правой и левой руки | Группа | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| I | II | III | контроль | ||||||
| Дельтовидная мышца | Левая | 1.21 ± 0,33 | 1.97 ± 0.70 | 1.72 ± 0.45 | 2.18 ± 0.61 | ||||
| Правая | 1.81 ± 0.89 | 1.58 ± 0.37 | 1.83 ± 1.37 | 3.08 ± 0.93 | |||||
| Двуглавая мышца плеча | Левая | 2.07 ± 0.91 | 1.57 ± 0.49 | 1.74 ± 0.34 | 1.91 ± 1.45 | ||||
| Правая | 2.04 ± 0.70 | 1.36 ± 0.518 | 1.93 ± 1.28 | 2.35 ± 1.25 | |||||
| Трехглавая мышца плеча | Левая | 1.90 ± 0.39 | 1.79 ± 0.62 | 1.60 ± 0.08 | 2.59 ± 0.98 | ||||
| Правая | 2.02 ± 0.68 | 1.69 ± 0.54 | 1.83 ± 1.26 | 3.38 ± 1.00 | |||||
| Плечелучевая мышца | Левая | 2.43 ± 1.01 | 2.02 ± 0.59 | 1.77 ± 0.58 | – | ||||
| Правая | 2.34 ± 0.86 | 1.71 ± 0.60 | 2.41 ± 1.68 | – | |||||
Гистологическое исследование
При гистологическом исследовании у больных с ХНС наблюдался разный диаметр мышечных волокон. В мышечных волокнах выявлена разная степень выраженности атрофических, дистрофических и склеротических изменений, которые имели мозаичный характер (рис. 3.) Обнаружена миграция ядер от сарколеммы в центр, что характерно для денервированных волокон. Выраженные атрофически-дистрофические изменения и склероз преобладали на стороне пареза во всех случаях. Клеточной воспалительной инфильтрации не наблюдалось.
Рис. 3.
Гистологические проявления структурных изменений в скелетной мышце верхних конечностей. Окраска гематоксилином и эозином. Увеличение ×400. (a) – разная степень атрофии мышечных волокон (1), начальные проявления миолиза (2), смещение ядер к центру (3); (b) – “змеевидная извитость” истонченных миоцитов (1), центральное положение ядер (2).

ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
Десмин. Одним из ранних миогенных маркеров скелетных мышц является белок семейства промежуточных филаментов – десмин (desmin). Известна роль белка в поддержании прочности и стабильности клеток, при недостатке десмина мышцы становятся хрупкими и дегенерируют в процессе повторных сокращений [17]. При исследовании 22 биоптатов от 11 пациентов во всех случаях обнаружено неравномерное светло-коричневое окрашивание с контрастирующими темно-коричневыми участками в области Z-полос на протяжении всей мышечной клетки. Обнаружены очаговая потеря десмина, стертый рисунок Z-дисков, что указывает на разрозненность структурной и механической целостности сократительного аппарата в мышечных тканях (рис. 4).
Рис. 4.
Очаговая потеря десмина в отдельных мышечных волокнах. Иммуногистохимическое исследование. Увеличение ×400. 1 – нормальное распределение десмина по Z-линиям, 2 – стертость и снижение интенсивности окрашивания десмином.

Миозин. Основная функция миозиновых белков в мышечных волокнах заключается в способности приводить в движение поперечнополосатые и гладкие мышцы за счет АТФазной активности миозина [18]. Известно, что при обездвиживании наблюдается трансформация медленных мышц в быстрые [19]. Именно поэтому основным критерием исследования материала от 6 пациентов послужил количественный метод оценки быстрых и медленных волокон. Для исследуемой группы на стороне без пареза отмечалась тенденция к увеличению количества быстрых мышц и еще более выраженное значимое увеличение на стороне пареза до 30%. (рис. 5). Полученные данные указывают на преобладание быстрых волокон на стороне пареза (табл. 3). Наряду с интенсивным окрашиванием цитоплазмы, часть мышечных волокон имела слабое окрашивание, что может быть связано с функциональной перестройкой мышц, находящихся в переходном состоянии от медленных к быстрым (рис. 6).
Рис. 5.
Среднее отношение быстрых мышечных волокон к медленным у пациентов с хроническим нарушением сознания (n = 6) и контролем (n = 2).

Таблица 3.
Морфометрические характеристики мышечных волокон в группе больных с хроническим нарушением сознания и контрольной группе, (M ± m)
| Контроль n = 4 N = 14 |
Группа больных с хроническим нарушением сознания n = 6 | ||
|---|---|---|---|
| cторона без пареза N = 14 | cторона пареза N = 17 |
||
| Количество миоцитов быстрого типа в поле зрения, шт. | 0.76 ± 0.05 | 0.82 ± 0.56 | 1.15 ± 0.08* |
| d, мкм | 84.56 ± 0.32 | 69.66 ± 0.61 | 57.34 ± 0.28 |
Рис. 6.
Различная интенсивность окрашивания мышечных волокон при иммуногистохимической реакции с антителами к миозину быстрых мышц. Увеличение ×400.

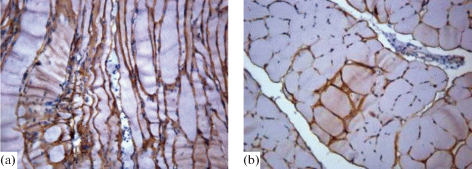
Дистрофин. Основная функция дистрофина (dystrophin) – участие в мышечном сокращении за счет формирования с другими белками мембраны и белками внеклеточного матрикса дистрофин-протеинового комплекса [20]. В роли структурного белка он обеспечивает целостность мышечных волокон, стабилизирует клеточную мембрану и увеличивает ее сопротивляемость при мышечных сокращениях [21]. При исследовании на дистрофин подчеркнуто определялась извитость и “сжатость” волокон, демонстрирующие мышечную атрофию, “затяжки” мембран миоцитов (рис. 7a). Отмечена неравномерная интенсивность накопления дистрофина в мембране мышечных волокон с появлением “изъеденных” участков вплоть до очаговой потери дистрофина, особенно ближе к сарколемме (рис. 7b). Наблюдаемые изменения носили в большей степени очаговый характер. Дефицит стабилизирующего белка мембраны скелетных клеток дистрофина приводит к повышению хрупкости сарколеммы, а также к псевдогипертрофии мышц и мышечной атрофии [22]. Так, на стороне пареза выявлялись группы крупных мышечных волокон с равномерной экспрессией дистрофина вдоль полноценной мембраны.
Рис. 7.
Иммуногистохимическая реакция к дистрофину. Увеличение ×200 (a) – на продольном срезе извитые, истонченные мышечные волокна, размытость мембран; (b) – на поперечном срезе очаговое исчезновение дистрофина в мембранах, группа крупных мышечных волокон с сохранившимся дистрофином в мембранах на стороне пареза.
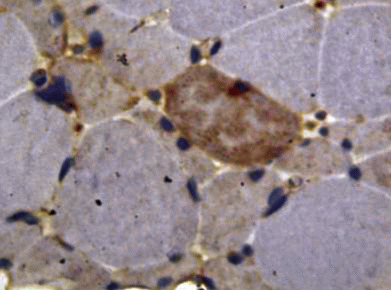
Беклин-1. Альтернативным механизмом, способствующим деградации и потере клеток под влиянием неблагоприятных факторов, является аутофагия [23]. Особую роль в координации данного процесса занимает белок беклин-1 (becline-1). В проведенном исследовании, во всех 6 случаях, наблюдалось как единичное, так и очаговое цитоплазматическое окрашивание мышечных клеток (рис. 8). Необходимо заметить, что изучаемый процесс прижизненной утилизации метаболитов клетки, подвергнувшихся изменениям, входит в естественный процесс так называемого “запрограммированного выживания клетки” [14].
Рис. 8.
Очаговая цитоплазматическая экспрессия беклина-1 в миоцитах. Иммуногистохимическая реакция. Увеличение ×200.
Морфометрическое исследование
При подсчете количества быстрых мышц в препаратах у пациентов с ХНС и контрольной группе, выявленных при иммуногистохимической реакции с миозином быстрых мышц, отмечено значимое увеличение среднего количества быстрых мышц у пациентов с ХНС более выраженными на стороне пареза. Морфометрические показатели диаметра мышечных клеток продемонстрировали уменьшения среднего значения мышечного волокна у пациентов с ХНС, подтверждающие атрофию скелетных мышц с более выраженными проявлениями на стороне пареза (табл. 3).
Таким образом, структурные изменения скелетных мышц у пациентов с длительным нарушением сознания при развитии полинейропатии и миопатии критических состояний являются неотъемлемой частью данных синдромов и носят прогрессирующий неспецифический дегенеративно-атрофический характер.
Результаты анализа метаболизма мышц плечевого пояса у пациентов с ХНС с применением ПЭТ-КТ с 18F-ДГ показал, что несмотря на наличие тетрапареза с симметричным изменением мышечного тонуса и глубоких рефлексов, у всех пациентов наблюдается отчетливая асимметрия метаболизма 18-ФДГ в правой и левой руке. Причем, у пациентов у пациентов правшей (исходя из данных анамнеза, беседы с родственниками) с устойчивыми признаками сознания активизация метаболизма отмечена в мышцах правой руки. На наш взгляд, это может являться косвенным доказательством более быстрого восстановления функций моторной коры доминантного полушария.
Метаболизм ФДГ связан с произвольной (разговор, жевание и физические упражнения) и непроизвольной мышечной активностью (одышка, спастика), которые приводят к повышенному поглощение 18F-ФДГ в мышечной ткани. В зависимости от уровня инсулина в плазме может увеличиваться накопление глюкозы мышцами, индуцируя транслокацию GLUT-4 из внутриклеточных везикул в плазматическую мембрану. GLUT-4 также может увеличить поглощение глюкозы скелетными мышцами в постпрандиальном состоянии [24]. Описывают диффузное снижение фиксации 18F-ФДГ в мышцах плечевого пояса у пациентов с умеренной активизацией метаболизма мышц, связанных с моторной корой доминантного полушария.
Результаты гистологических исследований не выявили какой-либо разницы в зависимости от уровня метаболизма. Атрофия, дистрофия и миолиз наблюдались во всех образцах мышечной ткани. В мышечных группах зон исходного пареза эти процессы были более акцентированы, но принципиальных различий мы не обнаружили.
Атрофически-дистрофические изменения сопровождались повреждением сократительного аппарата и разрушением десмина. Сигнальный белок десмин входит в состав сарколеммы мышечных волокон и обеспечивает ее стабильность. Деградация цитоскелетного белка приводит к нарушению основных его функций с последующим нарушением целостности мембраны и дегенерации мышечных волокон [17, 25]. На начальных стадиях дегенерации включаются вспомогательные и защитные функции организма, обеспечивающие активную регенерацию мышечных фибрилл. При нарушении механизма регенерации наблюдаются дистрофические изменения и фиброзирование ткани. Подобные изменения мы нашли в мышцах пациентов с ограниченной подвижностью в виде дегенеративных изменений. Полная и/или частичная потеря белка, главным образом локализующегося в районе Z-диска саркомера, свидетельствует о нарушении структурной и динамической целостности клетки во время сокращения и передачи усилия с сократительного аппарата на мембрану с подмембранным цитоскелетом [17].
Увеличение количества волокон быстрого типа указывает на уменьшение физической нагрузки. Полной атрофии мышечного аппарата препятствуют изменения миозинового фенотипа медленных волокон в быстрые, в результате чего сохраняется объем миофибриллярного аппарата. Эта реакция является приспособительной в условиях снижения физической нагрузки и измененных нейротрофических воздействий [25]. По данным литературы, перестройка скелетных мышц в быстрые происходит при нарушениях иннервации у пациентов с повреждением различной этиологии. В экспериментах при полном “отключении” спинальных мотонейронов также наблюдается сдвиг миозинового фенотипа в “быструю” сторону [26].
Проведенные ранее исследования показали, что активация некоторых маркеров клеточной аутофагии начинается уже после 24 часового обездвиживания человека [14]. Инициация такой клеточной программы связана с воздействием различных индукторов клеточного стресса, например, таких как дефицит питательных веществ и повреждение органелл [27]. Необходимо отметить, что процесс аутофагии имеет разное функциональное значение, в одних случаях он может выступать как репаративное явление и обеспечивать выживание клетки за счет мобилизации ее ресурсов [28], в других, как механизм запрограммированной клеточной гибели [29]. Центральную роль в процессе аутофагии и обеспечении секвестрации органелл играет беклин-1 [30]. Принимая во внимание цитоплазматическую экспрессию белка и регенерационную способность клеток миосателлитов и миосимпластов [19], можно говорить о роли аутофагии как механизма запрограммированного выживания клеток.
ЗАКЛЮЧЕНИЕ
Структурные изменения скелетных мышц у пациентов с длительным нарушением сознания при развитии полинейропатии и миопатии критических состояний имеют неспецифический дегенеративно-атрофический характер и более выражены на стороне пареза. Метаболические изменения, оцениваемые по уровню метаболизма 18F-ФДГ, развиваются симметрично, вне четкой зависимости от мышечного тонуса и глубоких рефлексов, с определенным приоритетом в скелетных мышцах, иннервируемых доминантным полушарием. Наблюдаемая в клинической практике возможность восстановления функций скелетных мышц с глубокими структурными и метаболическими изменениями у пациентов с ХНС указывает на их высокий регенеративный потенциал, связанный с адаптивными механизмами структурно-функциональной перестройки мышечных волокон.
Список литературы
Schnakers C, Steven Laureys (2018) Coma and Disorders of consciousness, second edition. Springer. https://doi.org/10.1007/978-3-319-55964-3
Jennett B (2005) Thirty years of the vegetative state: clinical, ethical and legal problems. Brain Res 150: 537–543. https://doi.org/10.1016/S0079-6123(05)50037-2
Bruno MA, Gosseries O, Vanhaudenhuyse A, Chatelle C, Laureys S (2010) État végétatif et état de conscience minimale : un devenir pire que la mort? In: Enjeux éthiques en réanimation. Springer, Paris. https://doi.org/10.1007/978-2-287-99072-4_13
Кондратьева ЕА, Кондратьев СА, Иванова НЕ (2016) Мышечная слабость без признаков полинейропатии у больных с длительным нарушением сознания. Случаи из практики. Анестезиология и реаниматология 61(2): 151–154. [Kondratieva EA, Kondratiev SA, Ivanova NE (2016) Muscle weakness without signs of polyneuropathy in patients with prolonged impaired consciousness. Cases from practice. Anesthesiology and Reanimatology 61(2): 151–154 (In Russ)]. https://doi.org/10.18821/0201-7563-2016-61-2-151-154
White J (1999) Consensus Conference. Rehabilitation of persons with traumatic brain injury. NIH consensus development panel on rehabilitation of persons with traumatic brain injury. JAMA 282(10): 974–983. https://doi.org/10.1001/jama.282.10.974
Joseph T, Douglas I, Nicholas I (2018) Practice guideline update recommendations summary: disorders of consciousness: report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research. Giacino 91(10): 450–460. https://doi.org/10.1212/WNL.0000000000005926
Pasternak C, Wong S, Elson EL (1995) Mechanical function of dystrophin in muscle cells. J Cell Biol 128: 355–361. https://doi.org/10.1083/jcb.128.3.355
Hermans G, De Jonghe B, Bruyninckx F (2008) Clinical review: Critical illness polyneuropathy and myopathy. Crit Care 12: 238. https://doi.org/10.1186/cc7100
Derde S, Hermans G, Derese I, Güiza F, Hedström Y, Wouters PJ, Bruyninckx F, D’Hoore A, Larsson L, Berghe G, Vanhorebeek I (2012) Muscle atrophy and preferential loss of myosin in prolonged critically ill patients. Respirat Crit Care Med 40(1): 79–89. https://doi.org/10.1097/CCM.0b013e31822d7c18
Bierbrauer J, Koch S, Olbricht C, Hamati J, Lodka D, Schneider J, Luther-Schröder A, Kleber C, Faust K, Wiesener S, Spies CD, Spranger J, Spuler S, Fielitz J, Weber-Carstens S (2012) Early type II fiber atrophy in intensive care unit patients with nonexcitable muscle membrane. Crit Care Med 40(2): 647–650.https://doi.org/10.1097/CCM.0b013e31823295e6
Shepherd S, Batra A, Lerner DP (2017) Review of Critical Illness Myopathy and Neuropathy. The Neurohospitalist 7(1): 41–48. https://doi.org/10.1177/1941874416663279
Vanhorebeek I, Latronico N, Van den Berghe G (2020) ICU-acquired weakness. Intensive Care Med 46(4): 637–653. https://doi.org/10.1007/s00134-020-05944-4
Кондратьев СА, Забродская ЮМ, Размологова ОЮ, Сафаров БИ, Жулев НИ, Никищенкова АС (2013) Патоморфологические особенности полинейромиопатии критических состояний у пациентов в персистирующем вегетативном состоянии и состоянии “малого сознания”. Рос нейрохирургическ Журн им проф АЛ Поленова 4: 46–52. [Kondrat’ev SA, Zabrodskaya YuM, Razmahova OY, Safarov BI, Zhulev N, Nikishenkov AS (2013) Pathologic features of polyneuromyopathy critical conditions of patients in persistent vegetative state and the status of the “small mind”. Rus Neurosurg J named after Prof AL Polenov 4: 46–52 (In Russ)]. https://doi.org/10.20969/VSKM.2016.9(6). 124-130
Kuballa P, Nolte WM, Castoreno AB, Xavier RJ (2012) Autophagy and the immune system. Ann Rev Immunol 30: 611–46. https://doi.org/10.1146/annurev-immunol-020711-074948
Karunanithi S, Soundararajan R, Sharma P, Nasw N, Bal Ch, Kumar R (2015) Spectrum of physiologic and pathologic skeletal muscle 18F-FDG uptake on PET/CT. Am J Roentgenol 205: W141–W149. https://doi.org/10.2214/AJR.14.13457
Pak K, Shin MJ, Hwang SJ, Shin JH, Shin HK, Kim SJ, Kim IJ (2016) Longitudinal Changes in Glucose Metabolism of Denervated Muscle after Complete Peripheral Nerve Injury. Mol Imaging Biol 18(5): 741–747. PMID: https://doi.org/10.1007/s11307-016-0948-727028758
Кубасова НФ, Цатурян ФК (2011) Молекулярный механизм работы актин-миозинового мотора в мышце. Успехи биол химии 51: 233–282. [Kubasova NF, Tsaturyan FK (2011) Molecular mechanism of the actin-myosin motor in the muscle. Adv Biol Chemi 51: 233–282(In Russ)]. https://doi.org/10.1134/S0006297911130086
Shenkman BS, Turtikova OV, Nemirovskaya TL, Grigoriev AI (2010) Contractile activity of skeletal muscle and the fate of myonuclei. Acta Naturae 2 (5): 62–69. https://doi.org/10.32607/20758251-2010-2-2-59-65
Relaix F, Zammit PS (2012) Satellite cells are essential for skeletal muscle regeneration: the cell on the edge returns centre stage. Development 139(16): 2845–2856. https://doi.org/10.1242/dev.069088
Sharma P, Basu S, Mitchel W (2014) Role of dystrophin in airway smooth muscle phenotype, contraction and lung function. PloS One 9(7): 27–37. https://doi.org/10.1371/journal.pone.0102737
Shenkman BS (2016) From slow to fast. Geographicalarea the restructuring of the myosin phenotype of muscle fibers. Acta Naturae 4 (31): 52–65. https://doi.org/10.32607/20758251-2016-8-4-47-59
Brocca L, Cannavino J, Coletto L (2012) The time course of the adaptations of human muscle proteome to bed rest and the underlying mechanisms. J Physiol 590(20): 5211–5230. https://doi.org/10.1113/jphysiol. 2012.240267
Kroemer G, Marino G, Levine B (2010) Autophagy and the Integrated Stress Response. Mol Cell 40(2): 280–293. https://doi.org/10.1016/j.molcel.2010.09.023
Abouzied MM, Crawford ES, Nabi HA (2005) 18F-FDG imaging: Pitfalls and artifacts. J Nucl Med Technol 33: 145–155.
Huey K, Roy R, Baldwin M, Edgerton R (2001) Temporal effects of inactivity on myosin heavy chain gene expression in rat slow muscle. Muscle Nerve 24(4): 517–526. https://doi.org/10.1002/mus.1035
He C, Klionsky DJ (2009) Regulation Mechanisms and Signaling Pathways of Autophagy. Ann Rev Genetics 43: 67–93. https://doi.org/10.1146/annurev-genet-102808-114910
Ravikumar B, Sarkar S, Davies JE (2010) Regulation of mammalian autophagy in physiology and pathophysiology. Physiol Rev 90(4): 1383–1435. https://doi.org/10.1152/physrev.00030.2009
Пупышев АБ (2014) Репаративная аутофагия и аутофаговая гибель клетки. Функциональные и регуляторные аспекты 56(3): 179–196. [Pupyshev AB (2014) Reparative autophagy and autophagous cell death. Function Regulator Aspects 56(3): 179–196 (In Russ)]. https://doi.org/10.1371/journal.ppat.1003287
Meijer AJ, Codogno P (2004) Regulation and role of autophagy in mammalian cells. Int J Biochem Cell Biol 36(12): 2445–2462. https://doi.org/10.1016/j.biocel.2004.02.002
Pasternak C, Wong S, Elson EL (1995) Mechanical function of dystrophin in muscle cells. J Cell Biol 128: 355–361. https://doi.org/10.1083/jcb.128.3.355
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


