Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 717-729
Сателлитные клетки скелетных мышц в условиях гравитационной разгрузки
Н. А. Вильчинская 1, *, Б. С. Шенкман 1
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: vilchinskayanatalia@gmail.com
Поступила в редакцию 15.02.2021
После доработки 11.03.2021
Принята к публикации 14.03.2021
Аннотация
Как известно, скелетная мышца обладает высокой степенью пластичности. Гравитационная разгрузка оказывает глубокое влияние на структурно-функциональную организацию постуральных мышц. Скелетные мышцы обладают уникальной способностью восстанавливаться при повреждении. Восстановление мышц (регенерация) осуществляется с помощью сателлитных клеток. Миосателлиты – это покоящиеся одноядерные клетки (фаза G0 клеточного цикла), расположенные на периферии мышечного волокна. При повреждении мышц происходит активация сателлитных клеток, они вступают в пролиферацию и дают начало новым сателлитным клеткам и миобластам. Дифференцированные миобласты могут сливаться с мышечными волокнами при гипертрофии и регенерации мышечной ткани и друг с другом, формируя новые мышечные волокна. Исследования влияния гравитационной разгрузки на состояние мышечных сателлитных клеток малочисленны. В настоящем обзоре рассматривается влияние гравитационной разгрузки на механизмы регенерации скелетных мышц при их повреждении и состояние пула мышечных сателлитных клеток. На основе данных литературы авторы обнаружили, что механизмы, лежащие в основе изменения регенераторного потенциала мышц при действии гравитационной разгрузки, мало изучены. Авторы подчеркивают необходимость дальнейших исследований регенераторного потенциала сателлитных клеток в условиях микрогравитации.
Скелетные мышцы составляют примерно 40% массы тела взрослого человека и состоят из многоядерных сократительных клеток – мышечных волокон. Их формирование происходит в процессе эмбриогенеза путем слияния мезодермальных клеток предшественников. Пополнение пула миофибрилл продолжается в течение всей жизни путем их дифференцировки из сателлитных клеток [1–4]. Скелетная мышца обладает уникальным свойством восстанавливаться после повреждения. Регенерация мышцы возможна благодаря наличию мышечных сателлитных клеток [5–7]. Миосателлиты составляют около 2–5% от всех ядер скелетных мышц. Миосателлиты – маленькие одноядерные клетки, расположенные на периферии мышечного волокна. Сателлитные клетки находятся в фазе G0 клеточного цикла до момента активации. При активации сателлитные клетки вступают в пролиферацию и дают начало новым сателлитным клеткам и миобластам. При гипертрофии и регенерации мышечной ткани дифференцированные миобласты сливаются с мышечными волокнами (являясь необходимым источником миоядер в постэмбриональном развитии) [8] и/или друг с другом, формируя новые мышечные волокна [9]. Миосателлиты являются основным источником регенерации поперечнополосатой мышечной ткани.
Скелетные мышцы являются одним из наиболее пластичных органов, который способен менять структуру и метаболизм в зависимости от предлагаемого режима сократительной активности. При действии гравитационной разгрузки происходит перестройка структуры и функции волокон постуральных мышц [10]. В частности, наблюдается снижение интенсивности синтеза белка, активация протеолитических процессов, что приводит к уменьшению белковой массы и снижению размеров мышечных волокон [11, 12]. При повреждении мышц в условиях гравитационной разгрузки происходит ослабление их регенеративного потенциала и замедляется процесс восстановления [13].
На сегодняшний день чрезвычайно мало известно о механизмах, лежащих в основе снижения регенеративного потенциала мышц в условиях гравитационной разгрузки. В настоящем обзоре будут рассматриваться механизмы регенерации скелетных мышц при их повреждении и состояние пула мышечных сателлитных клеток при действии гравитационной разгрузки.
САТЕЛЛИТНЫЕ КЛЕТКИ МЫШЦ. РАСПРОСТРАНЕНИЕ МИОСАТЕЛЛИТОВ В РАЗЛИЧНЫХ ТИПАХ МЫШЦ
Около 60 лет назад с помощью электронного микроскопа впервые была описана особая популяция одноядерных клеток в мышечном волокне лягушки. Из-за своего расположения на границе базальной мембраны мышечного волокна и окружающего его внеклеточного матрикса эти клетки были названы сателлитными [14].
На начальном этапе исследований сателлитные клетки определяли и характеризовали только с применением электронной микроскопии на основе их расположения между сарколеммой и базальной мембраной зрелого мышечного волокна, присущего этим клеткам увеличения объема ядер относительно цитоплазмы и повышенного содержания гетерохроматина [14, 15]. За последние 20 лет был идентифицирован широкий круг специфических молекулярных маркеров, позволяющий определять сателлитные клетки [16, 17]. Часть этих маркеров располагается внутри клетки и представляют собой транскрипционные факторы, такие как PAX7, PAX3, Barx2, Myf5 и белки ядерной мембраны lamin A/C (LMNA) и emerin (EMD). Другие маркеры локализованы на поверхности клеточной мембраны: синдекан 3 и 4, мышечный М-кадгерин, рецептор c-Met, a7- и b1-интегрины, NCAM1, VCAM1 и CD34 [7, 16–18].
Скелетные мышцы отличаются по количеству содержащихся в них сателлитных клеток [3, 19–22]. Ранее показали, что в медленных мышечных волокнах содержится большее количество сателлитных клеток по сравнению с быстрыми. В камбаловидной мышце крыс и мышей содержится в 2–3 раза больше сателлитных клеток, чем в быстрых m. tibialis anterior и m. extensor digitorum longus [16, 23]. Количество сателлитных клеток в мышцах меняется на протяжении жизни. В исследованиях на мышах было показано, что наиболее высокие концентрации сателлитных клеток наблюдаются сразу после рождения, а через 2 месяца их количество значительно снижено [3].
ГЕТЕРОГЕННОСТЬ ПОПУЛЯЦИИ САТЕЛЛИТНЫХ КЛЕТОК
Изначально считалось, что сателлитные клетки представляют собой однородную популяцию комитированных клеток предшественников – миобластов [24]. Более поздние исследования показали, что популяция сателлитных клеток неоднородна, сателлитные клетки различаются по набору экспрессируемых генов, по способности к немиогенной дифференцировке, по наличию признаков стволовых клеток (т.е. способности давать начало новым сателлитным клеткам и коммитированным прогениторным клеткам).
Известно, что сателлитные клетки обладают некоторой пластичностью и потенциально могут дифференцироваться в мультипотентные мезенхимальные клетки-предшественники. При культивировании in vitro сателлитых клеток, выделенных из одиночных мышечных волокон, наблюдается их спонтанная дифференцировка в миоциты, адипоциты и остеоциты [16]. В работах in vitro на клетках С2С12 и сателлитных клетках мышц мышей было показано, что применение специфических химических агентов приводит к дифференцировке этих клеток в остеоциты или адипоциты [25–27].
Белки PAX3 и PAX7 экспрессируются в ядрах сателлитных клеток. В миосателлитах взрослых животных постоянно экспрессируется PAX7 в то время, как только небольшая популяция сателлитных клеток экспрессирует Pax3 [28, 29]. Сателлитные клетки, экспрессирующие Pax3, обнаруживаются только в определенных типах скелетных мышц (диафрагме), при этом экспрессия Pax3 никак не коррелирует с эмбриональным происхождением этих мышц, типом мышечных волокон в их составе и иннервирующими их мотонейронами.
Исследование экспрессии маркеров сателлитных клеток CD34, M-cadherin и Myf5 с помощью методов иммунофлуоресцентного окрашивания показало наличие субпопуляции сателлитных клеток не экспрессирующих эти маркеры [30]. В сателлитных клетках человека наблюдается неоднородность экспрессии Pax7, молекул адгезии нейрональных клеток (NCAM), c-Met и Dlk1 [31].
В одном из исследований была обнаружена небольшая популяция сателлитных клеток, характеризующихся экспрессией поверхностных маркеров Sca-1 и CD-45, которые обычно не экспрессируются в миосателлитах [32]. Пул этих клеток был назван клетками сторонней популяции, он образуется от некоммитированных мезенхимальных клеток-предшественников костного мозга. Клетки сторонней популяции вовлечены в процессы регенерации мышцы после повреждения и трансплантации, участвуют в формировании миоцитов и пополнении пула сателлитных клеток [5, 33, 34].
В 2017 г. был обнаружен особый тип прогениторных клеток, присущий быстрым мышечным волокнам. Это мезенхимальные клетки-предшественники, экспрессирующие транскрипционный фактор Twist2 (Tw2) и расположенные снаружи мышечного волокна. Клетки Tw2+ обнаруживаются только в волокнах с быстрым миозиновым фенотипом. Как показывают данные in vitro, активированные мезенхимальные клетки-предшественники, экспрессирующие Tw2, сначала выключают экспрессию Tw2 и начинают временно экспрессировать Pax7. На сегодняшний день не определено, сливаются ли такие клетки с волокнами напрямую или сначала проходят под базальной мембраной, как вновь образованные клетки Pax7+, внося вклад в пул сателлитных клеток мышечных волокон IIx и IIb [35].
В недавних исследованиях было выявлено, что только небольшой процент миосателлитов является “настоящими” сателлитными клетками, т.е. обладают способностью давать начало миогенным клеткам-предшественникам и пополнять пул сателлитных клеток [36–38]. Для таких сателлитных клеток характерно наличие ассиметричного деления, необходимого для поддержания и обновления пула сателлитных клеток. Ассиметричное деление было выявлено лишь у небольшой части сателлитных клеток мышц [36, 38, 39].
РОЛЬ САТЕЛЛИТНЫХ КЛЕТОК В РЕГЕНЕРАЦИИ МЫШЦ
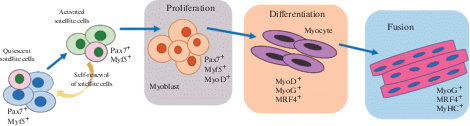
Миосателлиты являются основным источником регенерации поперечнополосатой мышечной ткани. В исследованиях на животных было показано, что удаление пула мышечных сателлитных клеток приводит к потере регенеративных способностей мышц [40]. Мыши нокауты по гену Pax7 имеют маленькие миофибриллы при рождении и не способны сформировать функциональный пул сателлитных клеток, что приводит к быстрой гибели в пределах несколько недель жизни [41]. При нокауте гена Pax7 у взрослых мышей было показано значительное снижение регенеративного потенциала скелетных мышц, т.е. Pax7 необходим для нормального функционирования сателлитных клеток [42, 43]. Однако потеря сателлитных клеток не оказывает влияния на способность неповрежденных мышц к гипертрофии [44].
Процесс регенерации мышц включает в себя три последовательные, частично перекрывающиеся стадии: 1) воспалительная реакция; 2) активация, дифференцировка и слияние сателлитных клеток (рис. 1); 3) формирование новых мышечных волокон (рис.1).
В регуляции регенеративных процессов скелетных мышц задействовано множество сигнальных путей, в том числе сигнальные пути, инициированные воспалительными цитокинами, ростовыми факторами и эволюционно консервативными сигнальными путями Notch, Wnt и Sonic Hedgehog (Shh) [39, 45–49]. Воспалительные цитокины IL-4, LIF, TGF-β, IL-6 и TNF участвуют в регуляции начальных этапов регенерации поврежденной мышцы [49].
В поврежденной мышце продуцируются хемоатрактанты для макрофагов и моноцитов [50–52], при блокировании инфильтрации макрофагов происходит ослабление регенеративных процессов вследствие снижения содержания продуцируемых ими факторов, индуцирующих пролиферацию миобластов [45, 53, 54]. В поврежденной мышце происходит высвобождение ростовых факторов [46], связанных с белками внеклеточного матрикса, происходит активация металлопротеиназ, играющих важную роль при восстановлении мышцы [55]. При повреждении мышцы мгновенно начинает продуцироваться оксид азота. В экспериментах с ингибированием NO-синтазы наблюдалось снижение немедленного ответа сателлитных клеток на повреждение мышцы [56]. NO стимулирует экспрессию металлопротеиназ и способствует высвобождению факторов роста из внеклеточного матрикса [57].
Хорошо изученные факторы роста участвуют в регенерации мышц: FGF, HGF, IGF-1 и миостатин [45, 46, 58–60]. FGF-2 и HGF способствуют пролиферации миогенных клеток-предшественников и ослабляют их дифференцировку, частично подавляя экспрессию миогенных регуляторных факторов, таких как MyoD [60, 61]. Протеогликаны синдеканы (syndecans-1, -2, -3, -4) вовлечены в работу сигнального пути FGF при восстановлении поврежденной мышцы. Синдекан-3 необходим для поддержания сателлитных клеток в неактивном состоянии [62]. Фактор роста гепатоцитов является ключевым активатором сателлитных клеток на ранних стадиях регенерации поврежденной мышцы [16]. Инсулин-зависимые ростовые факторы IGF-1 и IGF-2 играют важную роль в регуляции активности сателлитных клеток. IGF-1 способствует пролиферации и миогенной дифференцировке сателлитных клеток при повреждении мышц, усиливает синтез белка в дифференцированных миофибриллах и ингибирует процессы апоптоза [58]. IGF-2 необходим для дифференцировки миобластов [45, 63, 64].
Миогенин (GDF-8), специфичный для мышц ростовой фактор из семейства белков TGF-β (transforming growth factor-β) влияет на рост и развитие клеток миогенного ряда на ранних этапах формирования мышц, экспрессируется и во взрослых сателлитных клетках. В ходе регенерации мышц миогенин ингибирует пролиферацию сателлитных клеток [45, 65–68].
Сигнальный путь Notch поддерживает миосателлиты в состоянии покоя, ингибирует их пролиферацию и дифференцировку, способствует обновлению пула сателлитных клеток [69]. Также было показано, что сигнальный путь Notch в присутствии фактора FGF-2 направляет сателлитные клетки по пути миогенной дифференцировки [70]. Было обнаружено увеличение экспрессии мРНК и содержания белка сигнального пути Shh, активного в эмбриогенезе, при регенерации поврежденных мышц [47].
ВЛИЯНИЕ ГРАВИТАЦИОННОЙ РАЗГРУЗКИ НА САТЕЛЛИТНЫЕ КЛЕТКИ МЫШЦ
Постуральные мышцы подвержены негативным изменениям при воздействии реальной или моделируемой невесомости [71, 72]. На сегодняшний день в литературе представлено большое количество работ, демонстрирующих изменение общего числа и активности мышечных сателлитных клеток в ответ на разные виды мышечных атрофий от бездействия [5, 73–75]. Однако регенераторный потенциал сателлитных клеток мышц при действии гравитационной разгрузки до сих пор плохо изучен, и в литературе встречается ограниченное количество работ, освещающих этот процесс.
В работах ряда авторов было показано, что при действии гравитационной разгрузки снижается общее число сателлитных клеток в скелетных мышцах [17, 76].
После трех дней вывешивании происходит уменьшение количества сателлитных клеток в мышцах молодых крыс [9, 77]. Было показано, что после 7-ми суток моделируемой гравитационной разгрузки в камбаловидной мышце крыс обнаружено уменьшение числа сателлитных клеток на 30 и на 50% после 14-ти суток по сравнению с контрольным уровнем [5]. В камбаловидной мышце крыс было обнаружено снижение содержания сателлитных клеток после 14-суточного антиортостатического вывешивания [18].
После 2-недельного антиортостатического вывешивания мышей было выявлено снижение общего количества сателлитных клеток в камбаловидной мышце [7, 13]. Сниженное количество сателлитных клеток было выявлено в m. gastrocnemius и m. plantaris мыши после 14-суточного вывешивания по сравнению с мышцами контрольных животных и мышцами животных, подвергшихся восстановлению после вывешивания [7].
В исследованиях на добровольцах было показано, что уже после 5 дней гипокинезии наблюдается снижение количества сателлитных клеток в медленных мышечных волокнах m. vastus lateralis [78]. Также снижение содержания сателлитных клеток в m. vastus lateralis человека было выявлено после 14-суточной гипокинезии (бедрест) [73].
При применении модели иммобилизации мышц наблюдалось снижение общего числа миосателлитов. После 7-суточной иммобилизации у мышей выявлено значительное снижение содержания мышечных сателлитных клеток как в быстрых, так и в медленных мышцах [79].
Снижение числа сателлитных клеток мышц при денервации происходит в результате активации апоптопических процессов [51]. В ответ на атрофию мышц увеличивается экспрессия фактора TNFα, что способствует усилению апоптоза миобластов [80, 81]. После 2-х суток гравитационной разгрузки наблюдается большое число апоптотических ядер в волокнах m. soleus [82].
Митотическая активность мышечных сателлитных клеток снижена при действии гравитационной разгрузки [76, 77]. Ранее показали, что уже на 1-х сутках вывешивания в m. soleus начинает снижаться митотическая активность сателлитных клеток и полностью прекращается к 3–5-му дню вывешивания. Морфологические признаки атрофии развиваются через 48 ч [9]. В m. soleus и в m. extensor digitorum longus молодых крыс после 3-суточного вывешивания (по результатам включения BrdU) наблюдалось уменьшение их пролиферативного потенциала [9, 77]. В мышечном волокне после вывешивания было снижено количество покоящихся и митотически активных сателлитов на 57% по сравнению с контрольной группой [83].
После 14-суточного антиортостатического вывешивания крыс у животных наблюдалось снижение содержания как пролиферирующих сателлитных клеток (Pax7 +/MyoD+), так и миогенин-позитивных дифференцирующихся клеток [18]. У мышей на фоне 2-недельного антиортостатического вывешивания показано снижение способности сателлитных клеток к пролиферации и дифференцировке при повреждении мышцы, т.е. наблюдалось снижение их регенеративного потенциала [13].
Важно отметить, что наряду с данными о снижении активации и пролиферации сателлитных клеток мышц, есть данные об усилении процессов пролиферации в m. gastrocnemius мышей на начальных этапах гравитационной разгрузки [84].
Во время 30-суточного космического полета в мышцах мышей происходила активация и дифференцировка сателлитных клеток, т.е. инициировались и поддерживались регенераторные процессы мышц. Однако образующиеся в этих условиях, мышечные волокна имели ненормальный вид и сразу же начинали деградировать в условиях микрогравитации [75].
При иммобилизации мышц на фоне снижения общего числа сателлитных клеток мышц наблюдалось увеличение экспрессии Pax7 и MyoD. Таким образом, миосателлиты не находились в фазе клеточного цикла G0, а экспрессировали MyoD, т.е. находились на стадии миогенных клеток-предшественников [79].
При исследованиях in vitro было показано, что рост мышечных сателлитных клеток, выделенных из атрофированной мышцы после 14-ти суток вывешивания, наблюдался только на 3–4-й день после их изоляции, а сателлитные клетки, выделенные из контрольных мышц и мышц после восстановления, начинали активно расти уже на 1–2-й день после изоляции. Морфологические признаки дифференцировки сателлитных клеток в группе контроля и восстановления наблюдались к 3-м суткам культивирования in vitro, а после вывешивания только к 5-м. Миосателлиты, изолированные из контрольной и восстановленной мышцы, формировали полноценные большие миотубы к 5-му дню культивирования, а сателлитные клетки из атрофированной мышцы сформировали редкие небольшие миотубы лишь к 7-му дню. Таким образом, сателлитные клетки, выделенные из камбаловидной мышцы мышей после 2-недельного вывешивания, не способны нормально активироваться, пролиферировать и дифференцироваться. Интересно, что в активации, пролиферации и дифференцировке сателлитных клеток, выделенных из камбаловидной мышцы мышей, подвергшейся восстановлению после 2-недельного вывешивания, достоверных отличий от контроля не выявили [7].
Недавно, при исследовании адаптивного ответа мышц на нагрузку было установлено, что отсутствие сателлитных клеток не предотвращает рост мышцы, но значительно снижает его по сравнению с нормальной мышцей. Выявлено, что отсутствие сателлитных клеток сказывается на организации внеклеточного матрикса и негативно регулирует пути окислительного фосфорилирования и биогенез митохондрий [85]. На сегодняшний день абсолютно не изучено, влияет ли снижение содержания сателлитных клеток мышц при действии гравитационной разгрузки на компоненты внеклеточного матрикса мышц и различные метаболические пути.
Несмотря на большой интерес к проблеме механизмов атрофии скелетных мышц от бездействия, исследования регенеративных процессов атрофированной мышцы малочисленны. Регенераторный потенциал сателлитных клеток скелетных мышц при действии гравитационной разгрузки изучен недостаточно. Становится очевидным, что требуются дальнейшие исследования для выявления фундаментальных механизмов, лежащих в основе наблюдаемых изменений, и поиска путей поддержания восстановительных процессов поврежденных мышцах при действии микрогравитации.
Список литературы
Seale P, Asakura A, Rudnicki MA (2001) The potential of muscle stem cells. Dev Cell 1(3): 333–342. https://doi.org/10.1016/s1534-5807(01)00049-1
Seale P, Sabourin LA, Girgis-Gabardo A, Mansouri A, Gruss P, Rudnicki MA (2000) Pax7 is required for the specification of myogenic satellite cells. Cell 102(6): 777–786. https://doi.org/10.1016/s0092-8674(00)00066-0
Charge SB, Rudnicki MA (2004) Cellular and molecular regulation of muscle regeneration. Physiol Rev 84(1): 209–238. https://doi.org/10.1152/physrev.00019.2003
Bailey P, Holowacz T, Lassar AB (2001) The origin of skeletal muscle stem cells in the embryo and the adult. Curr Opin Cell Biol 13(6): 679–689. https://doi.org/10.1016/s0955-0674(00)00271-4
Шенкман БС, Туртикова ОВ, Немировская ТЛ, Григорьев АИ (2010) Сократительная активность скелетной мышцы и судьба миоядер. Acta naturae 2(5): 62–69. [Shenkman BS, Turtikova OV, Nemirovskaya TL, Grigor′yev AI (2010) Skeletal muscle contractile activity and the fate of myonucle. Acta Natyrae 2(5): 62–69 (In Russ)].
Гаин ЮМ, Кулинич СС, Зафранская ММ, Шахрай СВ, Гаин МЮ (2014) Морфо-фенотипическая характеристика миогенных клеток-предшественников поперечнополосатой мышечной ткани. Военная медицина (4): 80–84. [Gain YUM, Kulinich SS, Zafranskaya MM, Shakhray SV, Gain MYU (2014) Morpho-phenotypic characteristics of myogenic progenitor cells of striated muscle tissue. Voyennaya meditsina (4): 80–84 (In Russ)].
Mitchell PO, Pavlath GK (2004) Skeletal muscle atrophy leads to loss and dysfunction of muscle precursor cells. Am J Physiol Cell Physiol 287(6): C1753–1762. https://doi.org/10.1152/ajpcell.00292.2004
Hikida RS, Van Nostran S, Murray JD, Staron RS, Gordon SE, Kraemer WJ (1997) Myonuclear loss in atrophied soleus muscle fibers. Anat Rec 247(3): 350–354. https://doi.org/10.1002/(SICI)1097-0185(199703)247:3<350::AID-AR6>3.0.CO;2-Y
Schultz E, McCormick KM (1994) Skeletal muscle satellite cells. Rev Physiol Biochem Pharmacol 123: 213–257. https://doi.org/10.1007/BFb0030904
Ohira Y, Yoshinaga T, Nomura T, Kawano F, Ishihara A, Nonaka I, Roy RR, Edgerton VR (2002) Gravitational unloading effects on muscle fiber size, phenotype and myonuclear number. Adv Space Res 30(4): 777–781. https://doi.org/10.1016/s0273-1177(02)00395-2
Thomason DB, Biggs RB, Booth FW (1989) Protein metabolism and beta-myosin heavy-chain mRNA in unweighted soleus muscle. Am J Physiol 257(2 Pt 2): R300–305. https://doi.org/10.1152/ajpregu.1989.257.2.R300
Goldspink DF, Morton AJ, Loughna P, Goldspink G (1986) The effect of hypokinesia and hypodynamia on protein turnover and the growth of four skeletal muscles of the rat. Pflugers Archiv: Eur J Physiol 407(3): 333–340. https://doi.org/10.1007/BF00585311
Matsuba Y, Goto K, Morioka S, Naito T, Akema T, Hashimoto N, Sugiura T, Ohira Y, Beppu M, Yoshioka T (2009) Gravitational unloading inhibits the regenerative potential of atrophied soleus muscle in mice. Acta Physiol 196(3): 329–339. https://doi.org/10.1111/j.1748-1716.2008.01943.x
Mauro A (1961) Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol 9: 493–495. https://doi.org/10.1083/jcb.9.2.493
Katz B (1961) The terminations of the afferent nerve fibre in the muscle spindle of the frog. Philos Trans Royal Soc Lond [Biol] 243: 221–240.
Yin H, Price F, Rudnicki MA (2013) Satellite cells and the muscle stem cell niche. Physiol Rev 93(1): 23–67. https://doi.org/10.1152/physrev.00043.2011
Wang XD, Kawano F, Matsuoka Y, Fukunaga K, Terada M, Sudoh M, Ishihara A, Ohira Y (2006) Mechanical load-dependent regulation of satellite cell and fiber size in rat soleus muscle. Am J Physiol Cell Physiol 290 (4): C981–989. https://doi.org/10.1152/ajpcell.00298.2005
Nakanishi R, Hirayama Y, Tanaka M, Maeshige N, Kondo H, Ishihara A, Roy RR, Fujino H (2016) Nucleoprotein supplementation enhances the recovery of rat soleus mass with reloading after hindlimb unloading-induced atrophy via myonuclei accretion and increased protein synthesis. Nutr Res 36(12): 1335–1344. https://doi.org/10.1016/j.nutres.2016.10.007
Schmalbruch H, Hellhammer U (1977) The number of nuclei in adult rat muscles with special reference to satellite cells. Anat Rec 189(2): 169–175. https://doi.org/10.1002/ar.1091890204
Snow MH (1983) A quantitative ultrastructural analysis of satellite cells in denervated fast and slow muscles of the mouse. Anat Rec 207(4): 593–604. https://doi.org/10.1002/ar.1092070407
Gibson MC, Schultz E (1983) Age-related differences in absolute numbers of skeletal muscle satellite cells. Muscle & Nerve 6(8): 574–580. https://doi.org/10.1002/mus.880060807
Charge SB, Brack AS, Hughes SM (2002) Aging-related satellite cell differentiation defect occurs prematurely after Ski-induced muscle hypertrophy. Am J Physiol Cell Physiol 283(4): C1228–1241. https://doi.org/10.1152/ajpcell.00206.2002
Murach KA, Fry CS, Kirby TJ, Jackson JR, Lee JD, White SH, Dupont-Versteegden EE, McCarthy JJ, Peterson CA (2018) Starring or Supporting Role? Satellite Cells and Skeletal Muscle Fiber Size Regulation. Physiology 33(1): 26–38. https://doi.org/10.1152/physiol.00019.2017
Bischoff R, Heintz C (1994) Enhancement of skeletal muscle regeneration. Developmental dynamics: an official publication of the American Association of Anatomists 201(1): 41–54. https://doi.org/10.1002/aja.1002010105
Katagiri T, Yamaguchi A, Komaki M, Abe E, Takahashi N, Ikeda T, Rosen V, Wozney JM, Fujisawa-Sehara A, Suda T (1994) Bone morphogenetic protein-2 converts the differentiation pathway of C2C12 myoblasts into the osteoblast lineage. J Cell Biol 127(6 Pt 1): 1755–1766. https://doi.org/10.1083/jcb.127.6.1755
Teboul L, Gaillard D, Staccini L, Inadera H, Amri EZ, Grimaldi PA (1995) Thiazolidinediones and fatty acids convert myogenic cells into adipose-like cells. J Biol Chem 270(47): 28183–28187. https://doi.org/10.1074/jbc.270.47.28183
Озернюк НД, Балан ОВ (2007) Сателлитные клетки мышечной системы и регуляция восстановительного потенциала мышцы. Известия РАН Серия биол (6): 650–660 [Ozernyuk ND, Balan OV (2007) Satellite cells of the muscular system and the regulation of the regenerative potential of the muscle. Izvestiya RAN Seriya Biol (6): 650–660 (In Russ)].
Montarras D, Morgan J, Collins C, Relaix F, Zaffran S, Cumano A, Partridge T, Buckingham M (2005) Direct isolation of satellite cells for skeletal muscle regeneration. Science 309(5743): 2064–2067. https://doi.org/10.1126/science.1114758
Relaix F, Montarras D, Zaffran S, Gayraud-Morel B, Rocancourt D, Tajbakhsh S, Mansouri A, Cumano A, Buckingham M (2006) Pax3 and Pax7 have distinct and overlapping functions in adult muscle progenitor cells. J Cell Biol 172(1): 91–102. https://doi.org/10.1083/jcb.200508044
Beauchamp JR, Heslop L, Yu DS, Tajbakhsh S, Kelly RG, Wernig A, Buckingham ME, Partridge TA, Zammit PS (2000) Expression of CD34 and Myf5 defines the majority of quiescent adult skeletal muscle satellite cells. J Cell Biol 151(6): 1221–1234. https://doi.org/10.1083/jcb.151.6.1221
Lindstrom M, Pedrosa-Domellof F, Thornell LE (2010) Satellite cell heterogeneity with respect to expression of MyoD, myogenin, Dlk1 and c-Met in human skeletal muscle: application to a cohort of power lifters and sedentary men. Histochem Cell Biol 134(4): 371–385. https://doi.org/10.1007/s00418-010-0743-5
Tanaka KK, Hall JK, Troy AA, Cornelison DD, Majka SM, Olwin BB (2009) Syndecan-4-expressing muscle progenitor cells in the SP engraft as satellite cells during muscle regeneration. Cell Stem Cell 4(3): 217–225. https://doi.org/10.1016/j.stem.2009.01.016
Parise G, O’Reilly CE, Rudnicki MA (2006) Molecular regulation of myogenic progenitor populations. Appl Physiol Nutr Metab 31(6): 773–781. https://doi.org/10.1139/h06-055
Asakura A, Seale P, Girgis-Gabardo A, Rudnicki MA (2002) Myogenic specification of side population cells in skeletal muscle. J Cell Biol 159(1): 123–134. https://doi.org/10.1083/jcb.200202092
Goloviznina NA, Kyba M (2017) Twist of fate for skeletal muscle mesenchymal cells. Nat Cell Biol 19(3): 153–154. https://doi.org/10.1038/ncb3482
Conboy MJ, Karasov AO, Rando TA (2007) High incidence of non-random template strand segregation and asymmetric fate determination in dividing stem cells and their progeny. PLoS Biol 5(5): e102. https://doi.org/10.1371/journal.pbio.0050102
Kuang S, Kuroda K, Le Grand F, Rudnicki MA (2007) Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell 129(5): 999–1010. https://doi.org/10.1016/j.cell.2007.03.044
Shinin V, Gayraud-Morel B, Gomes D, Tajbakhsh S (2006) Asymmetric division and cosegregation of template DNA strands in adult muscle satellite cells. Nat Cell Biol 8(7): 677–687. https://doi.org/10.1038/ncb1425
Conboy IM, Rando TA (2002) The regulation of Notch signaling controls satellite cell activation and cell fate determination in postnatal myogenesis. Dev Cell 3(3): 397–409. https://doi.org/10.1016/s1534-5807(02)00254-x
Dumont NA, Bentzinger CF, Sincennes MC, Rudnicki MA (2015) Satellite Cells and Skeletal Muscle Regeneration. Compar Physiol 5(3): 1027–1059. https://doi.org/10.1002/cphy.c140068
Kuang S, Charge SB, Seale P, Huh M, Rudnicki MA (2006) Distinct roles for Pax7 and Pax3 in adult regenerative myogenesis. J Cell Biol 172(1): 103–113. https://doi.org/10.1083/jcb.200508001
Gunther S, Kim J, Kostin S, Lepper C, Fan CM, Braun T (2013) Myf5-positive satellite cells contribute to Pax7-dependent long-term maintenance of adult muscle stem cells. Cell Stem Cell 13(5): 590–601. https://doi.org/10.1016/j.stem.2013.07.016
von Maltzahn J, Jones AE, Parks RJ, Rudnicki MA (2013) Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proc Natl Acad Sci USA 110(41): 16474–16479. https://doi.org/10.1073/pnas.1307680110
McCarthy JJ, Mula J, Miyazaki M, Erfani R, Garrison K, Farooqui AB, Srikuea R, Lawson BA, Grimes B, Keller C, Van Zant G, Campbell KS, Esser KA, Dupont-Versteegden EE, Peterson CA (2011) Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development 138(17): 3657–3666. https://doi.org/10.1242/dev.068858
Wagers AJ, Conboy IM (2005) Cellular and molecular signatures of muscle regeneration: current concepts and controversies in adult myogenesis. Cell 122(5): 659–667. https://doi.org/10.1016/j.cell.2005.08.021
Husmann I, Soulet L, Gautron J, Martelly I, Barritault D (1996) Growth factors in skeletal muscle regeneration. CYTOKINE GROWTH F R 7(3): 249–258. https://doi.org/10.1016/s1359-6101(96)00029-9
Pola R, Ling LE, Aprahamian TR, Barban E, Bosch-Marce M, Curry C, Corbley M, Kearney M, Isner JM, Losordo DW (2003) Postnatal recapitulation of embryonic hedgehog pathway in response to skeletal muscle ischemia. Circulation 108(4): 479–485. https://doi.org/10.1161/01.CIR.0000080338.60981.FA
Polesskaya A, Seale P, Rudnicki MA (2003) Wnt signaling induces the myogenic specification of resident CD45+ adult stem cells during muscle regeneration. Cell 113(7): 841–852. https://doi.org/10.1016/s0092-8674(03)00437-9
Tidball JG (2005) Inflammatory processes in muscle injury and Repair. Am J Physiol Regul Integr Compar Physiol 288(2): R345–R353. https://doi.org/10.1152/ajpregu.00454.2004
Chazaud B, Sonnet C, Lafuste P, Bassez G, Rimaniol AC, Poron F, Authier FJ, Dreyfus PA, Gherardi RK (2003) Satellite cells attract monocytes and use macrophages as a support to escape apoptosis and enhance muscle growth. J Cell Biol 163(5): 1133–1143. https://doi.org/10.1083/jcb.200212046
Jejurikar SS, Kuzon WM, Jr (2003) Satellite cell depletion in degenerative skeletal muscle. Apoptosis 8(6): 573–578. https://doi.org/10.1023/A:1026127307457
Lescaudron L, Peltekian E, Fontaine-Perus J, Paulin D, Zampieri M, Garcia L, Parrish E (1999) Blood borne macrophages are essential for the triggering of muscle regeneration following muscle transplant. Neuromuscul Disord 9(2): 72–80. https://doi.org/10.1016/s0960-8966(98)00111-4
ondesen BA, Mills ST, Kegley KM, Pavlath GK (2004) The COX-2 pathway is essential during early stages of skeletal muscle regeneration. Am J Physiol Cell Physiol 287(2): C475–C483. 10.1152/ajpcell.00088.200
Robertson TA, Maley MA, Grounds MD, Papadimitriou JM (1993) The role of macrophages in skeletal muscle regeneration with particular reference to chemotaxis. Exp Cell Res 207(2): 321–331. https://doi.org/10.1006/excr.1993.1199
Carmeli E, Moas M, Reznick AZ, Coleman R (2004) Matrix metalloproteinases and skeletal muscle: a brief review. Muscle & Nerve 29(2): 191–197. https://doi.org/10.1002/mus.10529
Anderson JE (2000) A role for nitric oxide in muscle Repair: nitric oxide-mediated activation of muscle satellite cells. Mol Biol Cell 11(5): 1859–1874. https://doi.org/10.1091/mbc.11.5.1859
Tatsumi R (2010) Mechano-biology of skeletal muscle hypertrophy and regeneration: possible mechanism of stretch-induced activation of resident myogenic stem cells. Anim Sci J 81(1): 11–20. https://doi.org/10.1111/j.1740-0929.2009.00712.x
Heszele MF, Price SR (2004) Insulin-like growth factor I: the yin and yang of muscle atrophy. Endocrinology 145(11): 4803–4805. https://doi.org/10.1210/en.2004-1037
Lee SJ (2004) Regulation of muscle mass by myostatin. Annu Rev Cell Dev Biol 20(61–86). https://doi.org/10.1146/annurev.cellbio.20.012103.135836
Miller KJ, Thaloor D, Matteson S, Pavlath GK (2000) Hepatocyte growth factor affects satellite cell activation and differentiation in regenerating skeletal muscle. Am J Physiol Cell Physiol 278(1): C174–C181. https://doi.org/10.1152/ajpcell.2000.278.1.C174
Maley MA, Fan Y, Beilharz MW, Grounds MD (1994) Intrinsic differences in MyoD and myogenin expression between primary cultures of SJL/J and BALB/C skeletal muscle. Exp Cell Res 211(1): 99–107. https://doi.org/10.1006/excr.1994.1064
Pisconti A, Cornelison DD, Olguin HC, Antwine TL, Olwin BB (2010) Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol 190(3): 427–441. https://doi.org/10.1083/jcb.201003081
Downward J (2004) PI 3-kinase, Akt and cell survival. Semin Cell Dev Biol 15(2): 177–182. https://doi.org/10.1016/j.semcdb.2004.01.002
Lawlor MA, Rotwein P (2000) Coordinate control of muscle cell survival by distinct insulin-like growth factor activated signaling pathways. J Cell Biol 151(6): 1131–1140. https://doi.org/10.1083/jcb.151.6.1131
McCroskery S, Thomas M, Maxwell L, Sharma M, Kambadur R (2003) Myostatin negatively regulates satellite cell activation and self-renewal. J Cell Biol 162(6): 1135–1147. https://doi.org/10.1083/jcb.200207056
Zimmers TA, Davies MV, Koniaris LG, Haynes P, Esquela AF, Tomkinson KN, McPherron AC, Wolfman NM, Lee SJ (2002) Induction of cachexia in mice by systemically administered myostatin. Science 296(5572): 1486–1488. https://doi.org/10.1126/science.1069525
McPherron AC, Lawler AM, Lee SJ (1997) Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature 387(6628): 83–90. https://doi.org/10.1038/387083a0
Thomas M, Langley B, Berry C, Sharma M, Kirk S, Bass J, Kambadur R (2000) Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation. J Biol Chem 275(51): 40235–40243. https://doi.org/10.1074/jbc.M004356200
Wen Y, Bi P, Liu W, Asakura A, Keller C, Kuang S (2012) Constitutive Notch activation upregulates Pax7 and promotes the self-renewal of skeletal muscle satellite cells. Mol Cell Biol 32(12): 2300–2311. https://doi.org/10.1128/MCB.06753-11
Dezawa M, Ishikawa H, Itokazu Y, Yoshihara T, Hoshino M, Takeda S, Ide C, Nabeshima Y (2005) Bone marrow stromal cells generate muscle cells and Repair muscle degeneration. Science 309(5732): 314–317. https://doi.org/10.1126/science.1110364
Козловская ИБ, Григорьева ЛC, Гевлич ГИ (1984) Сравнительный анализ влияния невесомости и ее моделей на скоростно-силовые свойства и тонус скелетных мышц человека. Косм биол и авиакосм мед 18(6): 22–26. [Kozlovskaya IB, Grigor′yeva LC, Gevlich GI (1984) Comparative analysis of the influence of weightlessness and its models on the speed-power properties and tone of human skeletal muscles. Kosm Biol i Aviakosm Med 18(6): 22–26 (In Russ)].
Оганов BC, Скуратова СА, Мурашко ЛМ (1988) Влияние кратковременных космических полетов на физиологические свойства и состав миофибриллярных белков скелетных мышц крыс. Косм биол и авиакосм мед 4(4): 50–54. [Oganov BC, Skuratova SA, Murashko LM (1988) Influence of short-term space flights on physiological properties and composition of myofibrillar proteins of skeletal muscles of rats. Kosm Biol i Aviakos Med 4(4): 50–54 (In Russ)].
Arentson-Lantz EJ, English KL, Paddon-Jones D, Fry CS (2016) Fourteen days of bed rest induces a decline in satellite cell content and robust atrophy of skeletal muscle fibers in middle-aged adults. J Appl Physiol 120(8): 965–975 https://doi.org/10.1152/japplphysiol.00799.2015
Suetta C, Frandsen U, Mackey AL, Jensen L, Hvid LG, Bayer ML, Petersson SJ, Schroder HD, Andersen JL, Aagaard P, Schjerling P, Kjaer M (2013) Ageing is associated with diminished muscle re-growth and myogenic precursor cell expansion early after immobility-induced atrophy in human skeletal muscle. J Physiol 591(15): 3789–3804. https://doi.org/10.1113/jphysiol.2013.257121
Radugina EA, Almeida EAC, Blaber E, Poplinskaya VA, Markitantova YV, Grigoryan EN (2018) Exposure to microgravity for 30 days onboard Bion M1 caused muscle atrophy and impaired regeneration in murine femoral Quadriceps. Life Sci Space Res 16: 18–25. https://doi.org/10.1016/j.lssr.2017.08.005
Mozdziak PE, Truong Q, Macius A, Schultz E (1998) Hindlimb suspension reduces muscle regeneration. Eur J Appl Physiol Occup Physiol 78(2): 136–140. https://doi.org/10.1007/s004210050398
Mozdziak PE, Pulvermacher PM, Schultz E (2001) Muscle regeneration during hindlimb unloading results in a reduction in muscle size after reloading. J Appl Physiol 91(1): 183–190. https://doi.org/10.1152/jappl.2001.91.1.183
Reidy PT, McKenzie AI, Brunker P, Nelson DS, Barrows KM, Supiano M, LaStayo PC, Drummond MJ (2017) Neuromuscular Electrical Stimulation Combined with Protein Ingestion Preserves Thigh Muscle Mass But. Not Muscle Function in Healthy Older Adults During 5 Days of Bed Rest Rejuvenation Res 20(6): 449–461. https://doi.org/10.1089/rej.2017.1942
Guitart M, Lloreta J, Manas-Garcia L, Barreiro E (2018) Muscle regeneration potential and satellite cell activation profile during recovery following hindlimb immobilization in mice. J Cell Physiol 233(5): 4360–4372. https://doi.org/10.1002/jcp.26282
Dalla Libera L, Sabbadini R, Renken C, Ravara B, Sandri M, Betto R, Angelini A, Vescovo G (2001) Apoptosis in the skeletal muscle of rats with heart failure is associated with increased serum levels of TNF-alpha and sphingosine. J Mol Cell Cardiol 33(10): 1871–1878. https://doi.org/10.1006/jmcc.2001.1453
Stewart CE, Newcomb PV, Holly JM (2004) Multifaceted roles of TNF-alpha. Physiol 198(2): 237–247. https://doi.org/10.1002/jcp.10387
Smith HK, Maxwell L, Martyn JA, Bass JJ (2000) Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization. Cell Tissue Res 302(2): 235–241. https://doi.org/10.1007/s004410000280
Bruusgaard JC, Gundersen K (2008) In vivo time-lapse microscopy reveals no loss of murine myonuclei during weeks of muscle atrophy. J Clin Invest 118(4): 1450–1457. https://doi.org/10.1172/JCI34022
Ferreira R, Neuparth MJ, Ascensao A, Magalhaes J, Vitorino R, Duarte JA, Amado F (2006) Skeletal muscle atrophy increases cell proliferation in mice gastrocnemius during the first week of hindlimb suspension. Eur J Appl Physiol 97(3): 340–346. https://doi.org/10.1007/s00421-006-0197-6
Englund DA, Figueiredo VC, Dungan CM, Murach KA, Peck BD, Petrosino JM, Brightwell CR, Dupont AM, Neal AC, Fry CS, Accornero F, McCarthy JJ, Peterson CA (2021) Satellite Cell Depletion Disrupts Transcriptional Coordination and Muscle Adaptation to Exercise. Function 2(1): zqaa033. https://doi.org/10.1093/function/zqaa033
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова