Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 6-7, стр. 911-924
Мышечная пластичность в условиях функциональной разгрузки: эффекты ингибитора кислой сфингомиелиназы кломипрамина
А. В. Секунов 1, В. А. Протопопов 1, В. В. Скурыгин 2, М. Н. Шалагина 1, И. Г. Брындина 1, *
1 Ижевская государственная медицинская академия
Ижевск, Россия
2 Удмуртский государственный университет
Ижевск, Россия
* E-mail: i_bryndina@mail.ru
Поступила в редакцию 18.02.2021
После доработки 07.05.2021
Принята к публикации 11.05.2021
Аннотация
Сфинголипиды являются структурными компонентами клеток и внутриклеточными мессенджерами. Роль сфинголипидов, в том числе церамида, в регуляции мышечной пластичности не изучена. Цель работы – исследовать влияние ингибитора каталитического пути образования церамида на экспрессию тяжелых цепей миозина (ТЦМ, MyHC), атрофию и уровень протеинов mTOR/p-mTOR (Ser2484)/p70S6k (Thr389) в постуральной мышце голени (m. soleus) в условиях функциональной разгрузки. Работа выполнена на крысах-самцах Вистар массой 180–230 г. Для воспроизведения разгрузки использовали модель антиортостатического вывешивания (АОВ). Определяли признаки атрофии мышц (масса, диаметр Ферета), уровни церамида (ТСХ), протеинов сигнальной системы mTOR (вестерн-блоттинг) и экспрессию “быстрых” и “медленных” изоформ тяжелых цепей миозина (ПЦР в реальном времени, иммунофлуоресцентное исследование). Установлено, что в m. soleus при вывешивании наблюдается снижение уровней р-mTOR (Ser2484) и p70S6k (Thr389), которое предотвращается введением ингибитора кислой сфингомиелиназы (aSMase) кломипрамина. Сдвиг мышечного фенотипа в сторону экспрессии “быстрых” изоформ миозина (MyHC IIB и MyHC II d/x), характерный для АОВ, также устраняется кломипрамином, а степень атрофии мышцы под действием препарата уменьшается. Полученные результаты свидетельствуют о роли сфинголипидных механизмов в нарушении mTOR-сигналинга, регуляции экспрессии “быстрых” изоформ миозина и развитии атрофии мышц при их функциональной разгрузке.
Необходимость постоянной адаптации к повышению или снижению сократительной активности эволюционно сформировало одну из ведущих характеристик скелетных мышц – высокую степень пластичности, которая реализуется посредством реорганизации сигнальных механизмов, поддерживающих как определенный мышечный фенотип, так и баланс анаболических/катаболических и проапоптотических/антиапоптотических процессов, от которых зависит мышечная масса [1–3]. Длительная адаптация к физическим нагрузкам или, напротив, к дефициту двигательной активности (гиподинамия, невесомость, иммобилизация) изменяет структурно-функциональную организацию скелетной мышцы, максимально приспосабливая ее к изменившимся условиям [4–7]. Однако, будучи целесообразной на определенном (раннем) этапе разгрузки, такая адаптация несет и ряд негативных последствий, требующих применения профилактических мер, препятствующих переходу адаптивных перестроек в дезадаптивные.
Механизмы мышечной пластичности в условиях гравитационной разгрузки широко обсуждаются в литературе [1, 2, 6]. К настоящему времени определены некоторые звенья внутриклеточных сигнальных систем, регулирующих пластичность мышц в условиях функциональной разгрузки, а также при последующем восстановлении двигательной активности [8, 9].
Роль сфинголипидов в регуляции пластичности мышц практически не изучена. Между тем, накапливается все больше данных, свидетельствующих о том, что сфинголипиды, включая церамид, играют ключевую роль в регуляции функций скелетных мышц как структурно-функциональные компоненты клеточных мембран и внутриклеточные мессенджеры [10]. Установлено, что церамид повышает утомляемость мышц, снижает силу сокращений, усиливает прооксидантную активность, ингибирует синтез белков, негативно влияет на функции митохондрий, способствует индукции апоптоза и инсулинорезистентности [11–13]. Необходимо отметить, что эффекты функциональной разгрузки скелетных мышц при их неиспользовании, в том числе в условиях гипогравитации, во многом совпадают с действием церамида.
В исследованиях на моделях гравитационной разгрузки работ, посвященных изучению интрамускулярных эффектов церамида, немного [14–20]. Нами установлено, что при разгрузке, вызванной антиортостатическим вывешиванием (АОВ), церамид, накапливающийся в мышцах в результате каталитического расщепления сфингомиелина, модулирует состояние липидных рафтов; это приводит к формированию особых доменов (ceramide enriched membrane domains), способных к слиянию в более крупные кластеры [14–18]. Показано, что такие кластеры становятся платформами, способствующими сборке и активации мембранных белков, в том числе инициирующих проапоптотичекий сигналинг [21, 22].
Участие сфинголипидов в механизмах регуляции пластичности мышц, включая вызванную АОВ реорганизацию мышечного фенотипа постуральной мышцы в сторону снижения экспрессии “медленного” миозина, совершенно не изучено. Принимая во внимание множественность эффектов церамида как сигнальной молекулы, мы предположили, что он может оказывать влияние на регуляцию экспрессии тяжелых цепей миозина, определяющих тот или иной мышечный фенотип. Предпосылкой к данному предположению явились данные, свидетельствующие о роли aSMase и церамида в ингибировании активации транскрипционного регулятора NFATс (nuclear factor of activated T-cells) в Т-лимфоцитах [21], а также результаты исследований, указывающих на роль сфинголипидов в сигнальных механизмах, ассоциированных с MyoD (myoblast determination protein 1) как регулятором экспрессии “быстрых” изоформ миозина [23, 24]. Так, Seward с соавт. [23] обнаружили, что в камбаловидной мышце мышей с нокаутом гена белка MyoD повышение экспрессии MyHC IIB после двухнедельного АОВ было менее выражено, чем у мышей дикого типа. С другой стороны, показано, что C2-церамид и сфингомиелиназы подавляют экспрессию MyoD, индуцированную IGF-I в культуре мышиных C2C12 миобластов [24].
Учитывая вышеизложенное, в данной работе мы поставили цель выяснить влияние кломипрамина (функционального ингибитора aSMase [22]) на изменения мышечного фенотипа, атрофию и mTOR/p70S6k сигналинг в m.soleus крыс при функциональной разгрузке, вызванной АОВ.
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены на крысах-самцах Вистар массой 180–230 г (количество использованных животных дано ниже в описании каждого раздела работы). Для воспроизведения функциональной разгрузки мышц использовали модель АОВ под углом 30° к горизонтальной поверхности по Ильину-Новикову [25] в модификации Morey-Holton [26]. В данной модели у животных сохраняется возможность передвижения по клетке на передних конечностях и нормальный доступ к воде и пище. Длительность воздействия составляла 4 и 14 дней. Исследование одобрено этическим комитетом Ижевской государственной медицинской академии. При выполнении экспериментов руководствовались правилами проведения работ на экспериментальных животных (Приложение к Приказу Министерства здравоохранения РФ № 267 от 19.06.2003).
Проведены следующие серии экспериментов: 1) 4- и 14-дневное АОВ в сочетании с введением ингибитора aSMase кломипрамина; 2) АОВ в сочетании с введением растворителя – 0.9%-ного раствора NaCl. Кломипрамин (Анафранил, Novartis, Швейцария) вводили внутримышечно в дозе 10 мг/кг в следующем режиме: ежедневно в течение 5 дней до АОВ и через день во время АОВ. Контролем служили интактные крысы. После окончания воздействий у животных под золетиловым наркозом (Virbac, Франция, в дозе 10 мг/кг, 0.1 мл) выделяли камбаловидную мышцу, взвешивали и быстро замораживали в жидком азоте, после чего хранили при –80°С.
Для биохимического исследования мышцы (10 мг), полученные от интактных (n = 8), вывешенных с введением кломипрамина или 0.9%-ного раствора NaCl крыс (n = 6 и n = 5 соответственно), гомогенизировали, и в гомогенатах определяли уровень общего mTOR, фосфорилированного p-mTOR (Ser2484) и p-p70S6k (Thr389) с помощью вестерн-блоттинга. Мышечную ткань гомогенизировали в 100 мкл охлажденной буферной системы, содержащей RIPA-буфер, фенилметилсульфонила фторид (PMSF), ортованадат натрия, коктейль ингибиторов протеаз (Santa Cruz Biotechnology, США). Затем проводили гомогенизацию и инкубацию образцов в течение 30 мин при 4°С с последующим центрифугированием (15 мин при температуре 4°С, 12 000 об/мин). В полученном супернатанте содержание исследуемых белков определяли методом иммуноблоттинга. Для этого подготовленные образцы разделяли в геле SDS-PAGE по Laemmli [27] с использованием камеры Mini Protean Tetra (Bio-Rad, США), затем переносили на нитроцеллюлозную мембрану в системе Mini Trans-Blot Cell (Bio-Rad, США). Для иммуноокрашивания использовали первичные кроличьи и антивидовые козьи антитела, меченные пероксидазой (Abcam, США). Разведение первичных и вторичных антител проводили в соответствии с рекомендациями производителя. Полосы белка на нитроцеллюлозной бумаге инкубировали с первичными антителами в течение ночи (16–18 ч). После 3-кратной промывки нитроцеллюлозной бумаги по 5–10 мин в растворе TBS-T (рН 7.5) ее инкубировали с раствором вторичных антител в течение 1 ч. Проявляли полосы с помощью диаминбензидиновой реакции. Цифровые изображения полос получали с помощью сканера и затем анализировали в программе ImageLab Software (Bio-Rad, США). Минимальную интенсивность окрашивания полосы белка для анализируемого образца принимали за 1, а интенсивность окрашивания других полос на этой мембране выражали отношением к минимальной интенсивности. Статистический анализ проводили с помощью программы SPSS 22.0.
Церамид определяли в детергент-резистентной мембранной фракции (ДРМ) камбаловидных мышц (в контроле n = 6, при АОВ 4 и 14 дней n = 5 и 6 соответственно, при АОВ 4 и 14 дней с введением кломипрамина n = 8, в серии с введением кломипрамина интактным животным ежедневно в течение 5 дней n = 6). ДРМ получали путем ультрацентрифугирования в градиенте сахарозы по Радевой с соавт. [28]. С целью определения количества церамида, липиды экстрагировали из ткани мышц по Фолчу [29], хлороформенные экстракты наносили на пластины силикагеля c УФ-меткой (HPTLC Silica gel 60 F254 plates, Merck) и подвергали тонкослойной хоматографии в смеси бутанол : ледяная уксусная кислота : вода в соотношении 3 : 1 : 1 [30]. Пятна сфинголипидов проявляли в парах йода. Оценку содержания церамида проводили в сравнении со стандартом (“Avanti polar lipids”) с использованием видеоденситометра “Сорбфил”, в ультрафиолетовом диапазоне (254 нм); расчет уровня церамида производили с помощью программного обеспечения “Сорбфил”.
С целью определения экспрессии тяжелых цепей миозина (ТЦМ) использовали ПЦР в реальном времени и иммунофлуоресцентное (ИФ) исследование поперечных срезов мышц, меченных антителами к “быстрым” ТЦМ. ПЦР исследования проводили на интактных (n = 6) и вывешенных в течение 14 дней крысах, которым вводили кломипрамин (n = 6) или 0.9%-ный раствор NaCl (n = 6).
Для ПЦР анализа [31] тотальную РНК выделяли из 10 мг замороженного образца мышцы с использованием набора РНК-экстран (Синтол, Россия). Выделение проводили согласно инструкции производителя. Выделенную РНК хранили при ‒70°C до проведения ПЦР анализа. Для конструирования праймеров (табл. 1) использовали сервис Primer BLAST, находящийся в свободном доступе (https://www.ncbi. nlm.nih.gov/tools/primer-blast/). В качестве референсных генов были выбраны гены GAPDH (глицеральдегид-3-фосфатдегидрогеназы) и бета-актина. ПЦР анализ проводили в амплификаторе CFX96 (Bio Rad, США).
Таблица 1.
Праймеры для qRT-PCR исследования ТЦМ
| Ген | Прямой праймер | Обратный праймер | № по базе данных NCBI |
|---|---|---|---|
| Myh7 (ТЦМ Iβ) | 3'-CCAAGTTCCGCAAGGTGCAG-5' | 3'-ATCCTTAGGGTTGGGTAGCACA-5' | NM_017240.2 |
| Myh2 (ТЦМ IIA) | 3'-CAAGAGACAAGCTGAGGAGGCT-5' | 3'-TTCTACAGCATCAGAGCTGCCTT-5' | NM_001135157.1 |
| Myh4 (ТЦМ IIB) | 3'-ATTACAGGCGTCTCTGGAGGAAG-5' | 3'-CTCAGCGTCCAGTGTGCTTTG-5' | NM_019325.1 |
| Myh1 (ТЦМ II d/x) | 3'-AGAGACAAGCCGAGGAAGCG-5' | 3'-GGTCACTTTCCTGCTTTGGATCG-5' | NM_001135158.1 |
Использованные праймеры приведены в табл. 1.
Для оценки степени атрофии определяли относительную массу мышц (мг/г массы тела животного), а также проводили иммунофлуоресцентное исследование препаратов мышц, меченных антителами к кавеолину-3 (Cav-3). С целью определения экспрессии “быстрой” изоформы миозина проводился иммунофлуоресцентный анализ поперечных срезов мышц, меченных антителами к данной изоформе.
Для проведения иммунофлуоресцентного исследования животных перфузировали через восходящую аорту забуференным физиологическим раствором (PBS в мМ: 3.2 NaH2PO4, 0.5 K2HPO4, 1.3 KCl, 135 NaCl, pH 7.4), а затем 4%-ным раствором параформальдегида в PBS. После этого камбаловидную мышцу помещали в тот же фиксатор на 2 ч, затем переносили в 30%-ный раствор сахарозы на сутки, после чего замораживали на сухом льду. Серийные продольные и поперечные срезы мышц (14 мкм) были сделаны с помощью криостата HM525 NX и закреплены на предметных стеклах Superfrost Plus (Thermo Fisher Scientific, США). Иммунофлуоресцентное окрашивание проводили согласно методике, описанной ранее [18]. Перед окрашиванием срезы выдерживали в 3%-ном растворе перекиси водорода в течение 10 мин и после промывки в PBS инкубировали в 5%-ном растворе BSA в течение 2 ч. Для исследования атрофии мышц срезы инкубировали с антителами к Cav-3 (кроличьи IgG, 1 : 200, Abcam) в течение 24 ч при комнатной температуре. Для выявления связавшихся с Cav-3 антител использовали вторичные антикроличьи антитела (козьи IgG, 1 : 300, Abcam), конъюгированные с Alexa Fluor 488. Брали каждый 5‑й участок и проводили по 10 измерений диаметра Ферета мышечных волокон. Для выявления изменений фенотипа мышц проводили обработку срезов антителами к “быстрым” изоформам ТЦМ (Anti-Fast Myosin Skeletal Heavy chain antibody, Abcam). Экспрессия “быстрого” миозина измерялась по количеству (доле) иммунопозитивных к этой изоформе волокон по отношению ко всем волокнам в поле зрения. Анализ изображений проводился с помощью приставки DS-Fi3 EF-2E, совмещенной с микроскопом Nikon Eclipse E200, с использованием морфометрических программ Image-Pro Plus 6.0 и Image-Pro Insight (Media Cybernetics, США). Количество животных в данной серии: контроль (n = 4), АОВ 14 дней с введением кломипрамина или 0.9%-ного раствора NaCl (также по 4 крысы).
Статистическую обработку проводили в SPSS Statistica 22.0. Для оценки достоверности различий в группах и между отдельными группами применяли критерии Краскела–Уоллиса и Манна–Уитни, различия считали достоверными при р < 0.05 (с учетом поправок на множественные сравнения).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Изменение уровня церамида в детергент-резистентной мембранной фракции скелетных мышц
Установлено, что после 4- и 14-дневного АОВ количество церамида в ДРМ возрастало (в 7.3 раза, p < 0.01 и в 2.1 раза, p < 0.01 соответственно).
При введении кломипрамина вывешенным животным уровень церамида не отличался от контрольных значений. Достоверные различия с АОВ найдены в мышцах животных, вывешенных в течение 14 дней и получавших кломипрамин (рис. 1). Введение кломипрамина до начала вывешивания (эксперименты на интактных крысах, которым вводили препарат ежедневно в течение 5 дней) не сопровождалось достоверным изменением количества церамида в исследуемых мышцах (57.1 ± 11.8% при 100 ± 23.3% в контроле, p > 0.05)
Рис. 1.
Влияние ингибитора aSMase кломипрамина (Clom) на уровень церамида в m. soleus при 4-дневном (4d HS) – (a) и 14-дневном (14d HS) (b) антиортостатическом вывешивании (АОВ). Обозначения: серый столбик – контроль; черный – АОВ; темно-серый – АОВ + ингибитор; * – различия по сравнению с контрольной группой статистически значимы при p < 0.05, ** – при p < 0.01; # – различия между группами АОВ и АОВ + ингибитор (p < 0.05). Значения представлены как M ± SEM.

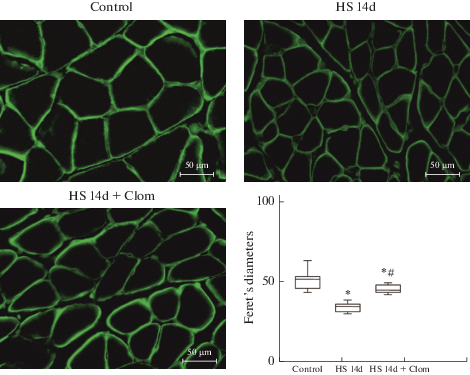
2. Оценка атрофии мышц при функциональной разгрузке
14-дневная функциональная разгрузка сопровождалась потерей массы камбаловидной мышцы на 34.8% (p < 0.05), уменьшением диаметров Ферета мышечных волокон (FDМ) на 49% (р < 0.05). Мышцы крыс, которым вводили кломипрамин, были менее атрофичными, чем мышцы крыс, не получавших препарат: масса мышц и FDМ уменьшались соответственно на 25.4% и 24.7% (p < 0.05) по сравнению с контрольными значениями и были достоверно больше, чем при АОВ (рис. 2).
Рис. 2.
Влияние ингибитора aSMase кломипрамина (Clom) на диаметр Ферета мышечных волокон (мкм) m. soleus в контроле, при 14-дневном антиортостатическом вывешивании (АОВ) (HS 14d) и при АОВ на фоне введения Clom. * – различия по сравнению с контрольной группой статистически значимы при p < 0.05; # – различия между группами АОВ и АОВ + ингибитор (p < 0.05).
3. Оценка изменений фенотипа мышечных волокон
С целью оценки особенностей экспрессии различных изоформ тяжелых цепей миозина в контрольной и вывешенной мышце (в том числе на фоне введения ингибитора aSMase), применяли ПЦР в реальном времени и иммунофлуоресцентное исследование поперечных срезов мышц, обработанных антителами к “быстрой” изоформе ТЦМ.
Как и следовало ожидать, в мышцах, подвергнутых двухнедельной функциональной разгрузке, ПЦР-анализ выявил изменения экспрессии как “быстрых”, так и “медленных” изоформ ТЦМ (рис. 3). Так, уровень мРНК “медленного” миозина (ТЦМ Iβ) уменьшился на 99.1 ± 1.3% (p<0.01), а мРНК одной из быстрых изоформ (ТЦМ IIA) – на 88.0 ± 3.7% (p < 0.01). Введение кломипрамина вывешенным животным не повлияло на экспрессию этих изоформ ТЦМ.
Рис. 3.
Влияние кломипрамина на экспрессию миозинов “медленного” (a) и “быстрого” (b–d) типов в m. soleus крыс при 14-дневном антиортостатическом вывешивании (АОВ). Обозначения: черный столбик – АОВ; темно-серый столбик – АОВ + ингибитор; * – различия по сравнению с контрольной группой статистически значимы при p < 0.05, ** – при p < 0.01; # – различия между группами АОВ и АОВ + ингибитор (p < 0.05). Значения представлены как M ± SEM, в условных единицах (a.u.). Контрольные значения приняты за ноль.

Экспрессия других изоформ “быстрого” миозина повышалась (ТЦМ IIB) или имела тенденцию к повышению (ТЦМ II d/x). Интересно, что у животных, которым вводили ингибитор сфингомиелиназы, экспрессия мРНК данных изоформ восстанавливалась до уровня контроля (ТЦМ IIB) или становилась достоверно более низкой, чем в контроле (ТЦМ II d/x).
Изучение мышечных волокон, экспрессирующих преимущественно “быстрые” изоформы ТЦМ, на поперечных срезах камбаловидных мышц, обработанных антителами к данным изоформам, показало следующее (рис. 4). В группе контроля такие волокна были немногочисленны и составляли 5.69 ± 1% (p < 0.001) от общего числа (n = 703) волокон в препарате.
Рис. 4.
Иммунофлуоресцентный анализ экспрессии быстрых изоформ тяжелых цепей миозина на поперечных срезах m.soleus. * – p < 0.05 в сравнении с контролем; # – p < 0.05 в сравнении с антиортостатическим вывешиванием. Данные представлены как число волокон (n), экспрессирующих “быстрые” изоформы миозина, в поле зрения, равном 3 мм2.
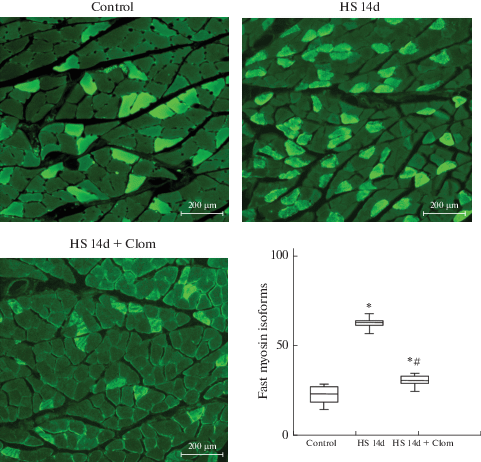
В группе, подвергнутой 14-дневной функциональной разгрузке, наблюдалось значительное увеличение количества волокон, экспрессирующих “быстрые” изоформы миозина: их доля составила 19.3 ± 1% (p < 0.01) от общего числа исследованных (n = 545); при этом прирост был равен 236 ± 6% (p < 0.01) в сравнении с контролем. В вывешенной на 14 дней группе, получавшей ингибитор aSMase кломипрамин, повышенная экспрессия “быстрых” изоформ ТЦМ сохранялась, однако прирост по сравнению с контролем был существенно меньшим (84.4 ± 6%, p < 0.01). Доля волокон, экспрессирующих “быстрые” изоформы миозина (относительно общего количества исследованных, n = 362), составляла при этом лишь 10.49 ± 1% (p < 0.01).
Таким образом, как ПЦР-анализ, так и иммунофлуоресцентное исследование мышц показали, что кломипрамин предотвращает повышение экспрессии “быстрых” изоформ ТЦМ при 14-дневном АОВ.
4. Изменения mTOR, p-mTOR (Ser2448) и р-p70S6K (Thr389)
Поскольку известно, что мышечная разгрузка сопровождается прогрессирующим снижением синтеза белка при увеличении длительности воздействия, нами были проанализированы изменения белков системы mTOR (mammalian target of rapamycin), имеющей непосредственное отношение к регуляции белково-синтетических процессов в клетках.
После 4-дневного АОВ в m. soleus крыс наблюдалось снижение уровня фосфорилирования mTOR (p-mTOR) при отсутствии изменений общего количества данного протеина (рис. 5). Показано, что p-mTOR (Ser2448) уменьшался на 79 ± 5.3%, или в 4.8 раза (р < 0.001). Параллельно наблюдалось уменьшение количества фосфорилированного p70S6K (Thr389), причем степень уменьшения данного протеина была сопоставима с дефицитом p-mTOR (Ser2448) и составляла 77.1 ± 6.2% (снижение в 4.4 раза, р < 0.001) по отношению к контролю. Введение кломипрамина предотвращало понижение обоих показателей, увеличивая уровень p-mTOR по сравнению с АОВ в 6.0 раз (p < 0.01) и р-p70S6K – в 6.7 раза соответственно (p < 0.01). При этом обнаружена тенденция к увеличению р-p70S6K (Thr389) и по сравнению с контролем (на 53.8 ± 12.8%, p = 0.048). Введение кломипрамина в течение 5 дней перед вывешиванием не изменяло уровень фосфорилированного p-mTOR (Ser2448): прирост составил 17.7 ± 4.9% (р = 0.057).
Рис. 5.
Влияние кломипрамина на уровень белков: (a) – mTOR, (b) – p-mTOR (Ser2448), (c) – р-p70S6K (Thr389) в m. soleus при 4-дневном антиортостатитическом вывешивании. Серый столбик – контроль; черный – АОВ; темно-серый – АОВ + ингибитор; * – различия по сравнению с контрольной группой статистически значимы при p < 0.05, ** – при p < 0.01; *** – при p < 0.001; ### – различия между группами АОВ и АОВ + ингибитор (p < 0.001). Значения представлены как M ± SEM, в %.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о том, что кломипрамин, ингибирующий образование церамида из сфингомиелина путем подавления активности aSMase [22], предотвращает снижение активности сигнальной системы mTOR/p70S6k и повышение экспрессии “быстрых” изоформ ТЦМ, а также уменьшает признаки атрофии, вызванной разгрузкой мышц.
Известно, что атрофия, вызванная бездействием (disuse), связана с нарушением баланса между синтезом и деградацией мышечных протеинов [4, 5]. В наших экспериментах атрофии предшествовало снижение фосфорилирования mTOR (Ser2448) и р70S6K (Thr 389). Нарушение фосфорилирования р70S6K по Thr389 может приводить к снижению эффектов данной киназы как одного из основных регуляторов белкового синтеза [32]. Имеются сведения об ингибирующем влиянии церамида на Akt/mTOR сигналинг [33]. На основании ранее опубликованных [14] и полученных в данной работе результатов, свидетельствующих о накоплении церамида в m.soleus при 4- и 14-дневной разгрузке, можно предположить участие данного сфинголипида в развитии атрофии разгруженной мышцы посредством подавлении сигнального пути Akt/mTOR. Восстановление фосфорилирования mTOR и р70S6K на фоне введения ингибитора aSMase свидетельствует о важной роли церамида, образованного путем сфингомиелиназного гидролиза, в негативном влиянии разгрузки мышц на компоненты системы Akt/mTOR/p70S6k. С другой стороны, уменьшение степени атрофии мышц на фоне применения кломипрамина также позволяет предположить, что церамид, образованный в результате усиления сфингомиелиназного гидролиза, может быть вовлечен в механизмы развития атрофии при мышечной разгрузке. Примечательно, что ингибирование мириоцином серинпальмитоилтрансферазы (SPT) – ключевого фермента, регулирующего синтез церамида de novo [34], не приводило к ослаблению атрофического процесса в разгруженной m. soleus [20].
По-видимому, возможны следующие объяснения различий результатов, полученных в работе Salaun с соавт. [20] и в нашем исследовании. Так, можно предположить, что для реализации “атрофического” эффекта церамида важно не только повышение уровня данного сфинголипида как таковое, но и механизм (путь), по которому он образуется. Местом образования церамида de novo является саркоплазматический ретикулум, откуда церамид транспортируется в комплекс Гольджи для последующего синтеза сложных сфинголипидов. Основным компартментом, где реализуются эффекты сфингомиелиназ, является клеточная мембрана, куда aSMase транспортируется из лизосом под действием ряда факторов, включая воздействие цитокинов, оксидативного стресса и др. [10]. Повышение образования церамида под действием aSMase в мембранных областях мышечных волокон приводит к дезорганизации липидных рафтов и образованию церамидных микродоменов, формирующих при слиянии более крупные структуры. Они функционируют как платформы, способные к относительно избирательной кластеризации определенных белков (рецепторов, каналов и т.п.); в такую кластеризацию могут быть вовлечены рецепторы, активирующие сигнальные пути регуляции апоптоза или подавляющие сигнализацию, связанную с белковым синтезом [22]. Также интересно отметить, что в работе [20] помимо снижающего уровень церамида действия мириоцина продемонстрировано его выраженное токсическое действие на печень; не исключено, что побочные эффекты могут быть и в мышцах. Следует упомянуть, что в наших ранее проведенных экспериментах [14] уровень SPT при АОВ понижался или достоверные изменения данного фермента отсутствовали.
Данные о влиянии ингибитора aSMase на экспрессию ТЦМ в разгруженной мышце получены нами впервые. Интересно, что в исследовании, выполненном с помощью ПЦР-анализа, кломипрамин оказывал превентивное влияние на повышение экспрессии только “быстрых” изоформ миозина (MyHC IIB и MyHC IIх), но при этом совершенно не влиял на экспрессию “медленного” миозина (MyHC Iβ). Аналогичные результаты в отношении “быстрого” миозина получены и в нашем иммуноферментном исследовании. Следует отметить, что механизмы экспрессии “быстрых” изоформ к настоящему времени являются крайне мало изученными [2]. Данных о том, какие сигнальные пути, связанные со сфингомиелиназой и церамидом, могут участвовать в усилении экспрессии MyHC IIB и MyHC IIх в разгруженной мышце, в литературе отсутствуют. Выше было упомянуто, что о такой возможности косвенно свидетельствуют работы Seward [23] и Strle [24] c соавторами. На основании этих работ можно сделать предположение о роли церамида в регуляции экспрессии “быстрых” изоформ миозина посредством MyoD.
Таким образом, впервые полученные в нашем исследовании результаты свидетельствуют о том, что в условиях функциональной разгрузки мышц кломипрамин предотвращает снижение активности сигнальной системы mTOR/p70S6k и повышение экспрессии “быстрых” изоформ ТЦМ, а также уменьшает признаки атрофии, вызванной разгрузкой. На данном этапе не представляется возможным окончательно ответить на вопрос о механизмах участия церамида в вышеупомянутых процессах. Можно предположить, что в регуляции каждого из них значимы механизмы, ассоциированные с активацией сфингомиелиназного гидролиза и образованием церамида. Более точные сведения об участии сфинголипидов в поддержании мышечной пластичности в условиях функциональной разгрузки предстоит получить в дальнейших исследованиях.
Список литературы
Baldwin KM, Haddad F (2001) Invited review: Effects of different activity and inactivity paradigms on myosin heavy chain gene expression in striated muscle. J Appl Physiol 90: 345–357. https://doi.org/10.1152/jappl.2001.90.1.345
Шенкман БС (2016) От медленных к быстрым. Гипогравитационная перестройка миозинового фенотипа мышечных волокон. Acta Naturae 8: 52–56. [Shenkman BS (2016) From slow to fast: Hypogravity-induced remodeling of muscle fiber myosin phenotype. Acta Naturae 8: 47–59 (In Russ)]. https://doi.org/10.32607/20758251-2016-8-4-47-59
Siu PM (2009) Muscle apoptotic response to denervation, disuse, and aging. Med Sci Sports Exerc 41(10): 1876–1886. https://doi.org/10.1249/MSS.0b013e3181a6470b
Fitts RH, Riley DR, Widrick JJ, Robert H, Riley DR (2000) Physiology of a microgravity environment invited review: microgravity and skeletal muscle. J Appl Physiol 89(2): 823–839. https://doi.org/10.1152/jappl.2000.89.2.823
Bodine SC (2013) Disuse-induced muscle wasting. Int J Biochem Cell Biol 45: 2200–2208. https://doi.org/10.1016/j.biocel.2013.06.011
Baldwin KM, Haddad F, Pandorf CE, Roy RR, Edgerton VR (2013) Alterations in muscle mass and contractile phenotype in response to unloading models: role of transcriptional/pretranslational mechanisms. Front Physiol 4: 284. https://doi.org/10.3389/fphys.2013.00284
Leeuwenburgh C, Gurley CM, Strotman BA, Dupont-Versteegden EE (2005) Age-related differences in apoptosis with disuse atrophy in soleus muscle. Am J Physiol Regul Integr Comp Physiol 288(5): R1288–R1296.
Ohlendieck K (2011) Proteomic profiling of skeletal muscle plasticity. Muscles Ligaments Tendons J 1: 119–126.
Cho Y, Ross RS (2018) A mini review: Proteomics approaches to understand disused vs. exercised human skeletal muscle. Physiol Genomics 50: 746–757. https://doi.org/10.1152/physiolgenomics.00043.2018
Hannun YA, Obeid LM (2008) Principles of bioactive lipid signalling: lessons from sphingolipids. Nat Rev Mol Cell Biol 9: 139–150. https://doi.org/10.1038/nrm2329
Bruni P, Donati C (2008) Pleiotropic effects of sphingolipids in skeletal muscle. Cell Mol Life Sci 65: 3725–3736. https://doi.org/10.1007/s00018-008-8236-6
Nikolova-Karakashian MN, Reid MB (2011) Sphingolipid Metabolism, Oxidant Signaling, and Contractile Function of Skeletal Muscle. Antioxid Redox Signal 15: 2501–2517. https://doi.org/10.1089/ars.2011.3940
Hyde R, Hajduch E, Powell DJ, Taylor PM, Hundal HS (2005) Ceramide downregulates System A amino acid transport and protein synthesis in rat skeletal muscle cells. FASEB J 19: 1–24. https://doi.org/10.1096/fj.04-2284fje
Брындина ИГ, Шалагина МН, Овечкин СВ, Овчинина НГ (2014) Сфинголипиды скелетных мышц у мышей C57B1/6 в условиях непродолжительной моделированной гипогравитации. Рос Физиол Журн им ИМ Сеченова 100(11): 1280–1286. [Bryndina IG, Shalagina MN, Ovechkin SV, Ovchinina NG (2014) Sphingolipids in skeletal muscles of C57B1/6 mice after short-term simulated microgravity. Russ J Physiol 100(11): 1280–1286 (In Russ)].
Брындина ИГ, Шалагина МН, Овечкин СВ, Яковлев АА (2017) Метаболизм сфинголипидов в скелетных мышцах передних и задних конечностей мышей при антиортостатическом вывешивании разной длительности. Авиакосм и эколог мед 51(7): 794–798. [Bryndina IG, Shalagina MN, Ovechkin SV, Yakovlev AA (2017) Sphingolipid metabolism in mice forelimb and hindlimb skeletal muscles under antiorthostatic suspension of different durations. Aerospace Environment Med 51(7): 794–798 (In Russ)]. https://doi.org/10.21687/0233-528X-2017-51-7-94-98
Bryndina I, Protopopov V, Sergeev V, Shalagina M, Ovechkin S, Yakovlev A (2018) Ceramide enriched membrane domains in rat skeletal muscle exposed to short-term hypogravitational unloading. Front Physiol 9. https://doi.org/10.3389/conf.fphys.2018.26.00028
Bryndina IG, Shalagina MN, Sekunov AV, Zefirov AL, Petrov AM (2018) Clomipramine counteracts lipid raft disturbance due to short-term muscle disuse. Neurosci Lett 664: 1–6. https://doi.org/10.1016/j.neulet.2017.11.009
Petrov AM, Shalagina MN, Protopopov VA, Sergeev VG, Ovechkin SV, Ovchinina NG, Sekunov AV, Zefirov AL, Zakirjanova GF, Bryndina IG (2019) Changes in Membrane Ceramide Pools in Rat Soleus Muscle in Response to Short-Term Disuse. Int J Mol Sci 20: 4860. https://doi.org/10.3390/ijms20194860
Kwon OS, Tanner RE, Barrows KM, Runtsch M, Symons JD, Jalili T, Bikman BT, McClain DA, O’Connell RM, Drummond MJ (2015) MyD88 regulates physical inactivity-induced skeletal muscle inflammation, ceramide biosynthesis signaling, and glucose intolerance. Am J Physiol Endocrinol Metab 309: E11–E21. https://doi.org/10.1152/ajpendo.00124.2015
Salaun E, Lefeuvre-Orfila L, Cavey T, Martin B, Turlin B, Ropert M, Loreal O, Derbré F (2016) Myriocin prevents muscle ceramide accumulation but not muscle fiber atrophy during short-term mechanical unloading. J Appl Physiol 120: 178–187. https://doi.org/10.1152/japplphysiol.00720.2015
Lepple-Wienhues A, Belka C, Laun T, Jekle A, Walter B, Wieland U, Welz M, Heil L, Kun J, Busch G, Weller M, Bamberg M, Gulbins E, Lang F (1999) Stimulation of CD95 (Fas) blocks T lymphocyte calcium channels through sphingomyelinase and sphingolipids. Proc Natl Acad Sci 96: 13795–13800. https://doi.org/10.1073/pnas.96.24.13795
Beckmann N, Sharma D, Gulbins E, Becker KA, Edelmann B (2014) Inhibition of acid sphingomyelinase by tricyclic antidepressants and analogons. Front Physiol 5: 331. https://doi.org/10.3389/fphys.2014.00331
Seward DJ, Haney JC, Rudnicki MA, Swoap SJ (2001) bHLH transcription factor MyoD affects myosin heavy chain expression pattern in a muscle-specific fashion. Am J Physiol Cell Physiol 280(2): C408–C413. https://doi.org/10.1152/ajpcell.2001.280.2.C408
Strle K, Broussard SR, McCusker RH, Shen WH, Johnson RW, Freund GG, Dantzer R, Kelley KW (2004) Proinflammatory cytokine impairment of insulin-like growth factor I-induced protein synthesis in skeletal muscle myoblasts requires ceramide. Endocrinology 145(10): 4592–4602. https://doi.org/10.1210/en.2003-1749
Ильин ЕА, Новиков ВЕ (1980) Стенд для моделирования физиологических эффектов невесомости в лабораторных условиях. Косм Биол и авиакосм Мед 14: 79–80. [Ilin EA, Novikov VE (1980) Stand for modelling the physiological effects of weightlessness in laboratory experiments with rats. Kosm Biol Aviakosm Med 14(3): 79–80 (In Russ)].
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: technical aspects. J Appl Physiol 92: 1367–1377. https://doi.org/10.1152/japplphysiol.00969.2001
Laemmli UK (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680–685. https://doi.org/10.1038/227680a0
Radeva G, Sharom FJ (2004) Isolation and characterization of lipid rafts with different properties from RBL-2H3 (rat basophilic leukaemia) cells. Biochem J 380: 219–230. https://doi.org/10.1042/BJ20031348
Folch J, Lees M, Sloane Stanley GH (1957) A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem 226: 497–509.
Boath A, Graf C, Lidome E, Ullrich T, Nussbaumer P, Bornancin F (2008) Regulation and traffic of ceramide 1-phosphate produced by ceramide kinase: Comparative analysis to glucosylceramide and sphingomyelin. J Biol Chem 283: 8517–8526. https://doi.org/10.1074/jbc.M707107200
Livak KJ, Schmittgen TD (2001) Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2−ΔΔCT Method. Methods 25: 402–408. https://doi.org/10.1006/meth.2001.1262
Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L, Stitt TN, Yancopoulos GD, Glass DJ (2001) Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI(3)K/Akt/GSK3 pathways. Nat Cell Biol 3: 1009–1013. https://doi.org/10.1038/ncb1101-1009
Mahfouz R, Khoury R, Blachnio-Zabielska A, Turban S, Loiseau N, Lipina C, Stretton C, Bourron O, Ferré P, Foufelle F, Hundal HS, Hajduch E (2014) Characterising the Inhibitory Actions of Ceramide upon Insulin Signaling in Different Skeletal Muscle Cell Models: A Mechanistic Insight. PLoS One 9:e101865. https://doi.org/10.1371/journal.pone.0101865
Hanada K (2003) Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism. Biochim Biophys Acta – Mol Cell Biol Lipids 1632: 16–30. https://doi.org/10.1016/S1388-1981(03)00059-3
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


