Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 8, стр. 1027-1038
Влияние ФНО-α, ИЛ-2, ИЛ-5, ИЛ-6 на сокращения мышц трахеи и бронхов крысы
Л. Е. Блажевич 1, *, О. Е. Смирнова 1, В. М. Кирилина 1, А. И. Кривченко 2
1 Петрозаводский государственный университет
Петрозаводск, Республика Карелия, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: lyu15041988@yandex.ru
Поступила в редакцию 06.04.2021
После доработки 11.05.2021
Принята к публикации 11.05.2021
Аннотация
В статье рассмотрена роль ФНО-α, ИЛ-2, ИЛ-5, ИЛ-6 в сократительной активности гладкой мускулатуры трахеи и бронхов крысы. Исследования проводились на изолированных препаратах с применением электрической стимуляции постганглионарных нервов (частота – 30 стим./с, длительность – 0.5 мс, амплитуда – 20 В, продолжительность стимуляции – 10 с). Были сформированы две группы животных: контрольная (получала внутрибрюшинную инъекцию физиологического раствора) и экспериментальная с сенсибилизацией овальбумином (получала внутрибрюшинную инъекцию овальбумина с его повторным введением через 14 дней). Далее проводилась оценка сокращения мышцы трахеи и бронхов после повторного введения овальбумина и после перфузии растворами интерлейкинов. В результате исследования выяснено, что ФНО-α, ИЛ-2, ИЛ-5, ИЛ-6 приводят к выраженному увеличению сократительных ответов гладкой мышцы трахеи и бронхов как в контрольной группе, так и в группе животных, сенсибилизированных овальбумином. Наибольшее констрикторное влияние на мышцу среди исследованных цитокинов принадлежит ФНО-α и ИЛ-6.
В данной статье рассматривается влияние ФНО-α, ИЛ-2, ИЛ-5, ИЛ-6 на сокращение мышцы трахеи и бронхов крыс. Выбор этих интерлейкинов обусловлен их большим значением в патогенезе бронхиальной астмы.
Фактор некроза опухоли-α (ФНО-α)
ФНО-α – провоспалительный цитокин, который высвобождается из различных типов клеток в дыхательных путях человека и животных (тучные клетки, макрофаги) через иммуноглобулинзависимый механизм [1]. ФНО-α активирует по крайней мере два рецептора клеточной поверхности – TNFR1 и TNFR2, которые экспрессируются в большинстве типов клеток [2].
ФНО-α продуцируется в значительных количествах в дыхательных путях при астме. Этот интерлейкин был обнаружен в бронхоальвеолярном лаваже, конденсате выдыхаемого воздуха и мокроте больных астмой во время естественного или вызванного приступа [3]. ФНО-α может участвовать в развитии гиперчувствительности бронхов, непосредственно изменяя сократительные свойства гладкой мускулатуры дыхательных путей. Основные механизмы неизвестны, но предполагается, что большинство биологических эффектов ФНО-α на гладкую мышцу респираторного тракта опосредуются рецептором этого фактора – TNFR1 [4].
Эффекты влияния ФНО-α на мышцу также связаны с возрастанием кальциевой чувствительности гладкомышечных клеток. В модели сенсибилизированных морских свинок ингибирование ФНО-α полностью устраняло развитие гиперчувствительности бронхов и воспаления дыхательных путей. Респираторные гладкомышечные клетки, подвергнутые действию ФНО-α in vitro или in vivo, становятся гиперчувствительными ко многим веществам констрикторного действия [5].
Недавно было показано, что кратковременное воздействие ФНО-α на мышцу в течение 30 мин усиливает сократительную реакцию на ацетилхолин за счет увеличения кальциевой чувствительности сократительных элементов в миоцитах трахеи крупного рогатого скота [4–6].
Secher показал, что гиперреактивность бронхов у мышей предотвращалась предварительной нейтрализацией ФНО-α специфическими антителами даже при условии воздействия на мышцу метахолином [7].
Вдыхание аэрозольного ФНО-α индуцировало гиперреактивность бронхов, сопровождающуюся воспалением дыхательных путей у здоровых людей [8], но лежащий в основе этого явления механизм полностью не изучен. Одной из видных патофизиологических особенностей воспалительной гиперреактивности бронхов является повышенная чувствительность сенсорных нервов дыхательных путей [9].
ФНО-α индуцирует мощный сенсибилизирующий эффект на дорсальный корневой ганглий и ноцицептивные нейроны тройничного ганглия, приводя к развитию длительной воспалительной боли в различных соматических тканях [10]. Этот гипералгезирующий эффект был опосредован действием на рецепторы к TNF – TNFR1 и TNFR2, расположенные на поверхности нервных клеток, что приводит к повышению чувствительности и экспрессии ваниллоидных рецепторов 1-го типа (TRPV1). Обильная экспрессия TRPV1 в нейрональной соме и сенсорных терминалях является надежным и заметным биомаркером повышения чувствительности С-волокон [11]. В иммуногистохимических исследованиях показано наличие обоих рецепторов (TNFR1 и TNFR2) на клеточной мембране блуждающих легочных сенсорных нейронов крыс. ФНО-α индуцирует отчетливое повышение чувствительности C-волокон и медленно-адаптирующихся волокон [12].
Интерлейкин-2 (ИЛ-2)
ИЛ-2 вырабатывается тучными клетками, Т-хелперами, а также некоторыми другими клетками организма и принимает участие в воспалительных и аллергических реакциях. В генетическом исследовании, проведенном Christensen, показана связь между ИЛ-2 и IgE-опосредованной аллергией и астмой [13].
Синтез ИЛ-2, а также экспрессия генов, ответственных за формирование полипептидной цепи этого цитокина в лимфоцитах периферической крови повышается в состоянии астматического статуса. Park и Lee указывают на связь повышенного содержания ИЛ-2 и рецепторов к нему в бронхоальвеолярном лаваже со снижением показателя форсированной жизненной емкости легких, снижением показателя объема форсированного выдоха за 1 с и значения пиковой скорости выдоха. Концентрация ИЛ-2 в бронхоальвеолярном лаваже у пациентов с бронхиальной астмой выше, чем у здоровых людей [14]. Аналогичные данные были обнаружены Kanagalingam в недавнем исследовании, где автор указывает на связь уровня ИЛ-2 с тяжестью протекания бронхиальной астмы у человека [15].
Уровень растворимых рецепторов к ИЛ-2 в сыворотке крови значительно повышен у пациентов детского возраста с острой и хронической астмой по сравнению с контрольной группой и у взрослых пациентов с этими же заболеваниями [15]. Аналогичные результаты о повышенном содержании сывороточного растворимого рецептора ИЛ-2 при аллергической астме у детей получили в своих исследованиях Tang и Chen [16].
Интерлейкин-5 (ИЛ-5)
ИЛ-5 выполняет важную роль в регуляции воспаления при бронхиальной астме. ИЛ-5 принимает участие в формировании поздней фазы воспаления при астме, а также играет одну из ведущих ролей в антиген-индуцированной бронхиальной астме [17].
ИЛ-5 является цитокином, секретируемым Т-клетками, тучными клетками, эозинофилами, базофилами, эпителиальными клетками [18] и рядом других клеток. ИЛ-5 способствует формированию рецепторной гиперчувствительности стенки респираторного тракта. ИЛ-5 может оказывать прямое влияние на гладкую мышцу трахеи и бронхов [19].
Концентрация ИЛ-5 увеличивается в бронхоальвеолярной жидкости у сенсибилизированных морских свинок и крыс. Сох установил высокую концентрацию ИЛ-5 в бронхоальвеолярном лаваже у человека [20]. Применение моноклональных антител к ИЛ-5 приводило к снижению гиперреактивности мышцы трахеи и бронхов у морских свинок и мышей и улучшало функцию внешнего дыхания [21]. Аналогичные результаты получены в группе пациентов с тяжелой формой бронхиальной астмы [22]. Имеются сведения о влиянии ИЛ-5 на респираторный тракт морских свинок. Введение экзогенного ИЛ-5 на изолированные препараты бронхов морских свинок приводило к увеличению сократительной активности гладкой мышцы [20].
Интерлейкин-6 (ИЛ-6)
ИЛ-6 является провоспалительным цитокином и одним из первых появляется в кровотоке в связи с острой инфекцией. ИЛ-6 является одним из наиболее активных цитокинов, участвующих в реализации иммунного ответа и воспалительной реакции [23]. В дыхательных путях при аллергическом воспалении ИЛ-6 регулирует продукцию провоспалительных и противовоспалительных факторов. ИЛ-6 ингибирует продукцию ИЛ-1 и ФНО-α и активирует противовоспалительные цитокины ИЛ-1 и ИЛ-10 [24]. Экспрессия белка ИЛ-6R наблюдается в макрофагах бронхоальвеолярного лаважа, эпителии дыхательных путей, эндотелии сосудов и гладких мышцах дыхательных путей [25]. ИЛ-6 может способствовать усугублению неблагоприятного течения астмы [26].
По данным Зенкиной у пациентов с атопической астмой регистрируется повышение уровня ИЛ-6 в сыворотке крови [27]. После вдыхания аллергена у пациентов с астмой наблюдалось значительное повышение уровня циркулирующего в крови ИЛ-6. Эти результаты предполагают, что ИЛ-6 участвует в механизмах развития бронхиальной астмы [28].
Имеются сведения о том, что ИЛ-6 синтезируется скелетными мышцами при их сокращении. ИЛ-6 индуцирует сокращение гладкой мышцы толстой кишки, воздействуя на нервные структуры и на гладкие мышцы крыс [23]. К аналогичным результатам при исследовании влияния ИЛ-6 на мышцу кишечника пришли Chang и Qin [29]. Tang и Zhou показали, что ИЛ-6 не влияет на тонус гладкой мускулатуры аорты крысы, но приводит к некоторому увеличению сократительных ответов мышцы при ее обработке адреномиметиками [30].
Таким образом, ФНО-α , ИЛ-2, ИЛ-5, ИЛ-6 могут быть рассмотрены как цитокины, играющие значительную роль в патогенезе бронхиальной астмы. Из всех выбранных нами для данного исследования цитокинов наименее изученным в плане влияния на сокращения гладкой мышцы респираторного тракта является ИЛ-2. Относительно других цитокинов – ИЛ-5, ИЛ-6, ФНО-α – имеются некоторые прямые или косвенные данные об их роли в сокращении гладкой мышцы различных органов у различных животных.
С учетом того, что большинство исследований, посвященных этим цитокинам, позволяют оценить их роль в общей воспалительной реакции при бронхиальной астме, исследования непосредственного влияния этих цитокинов на сокращение гладкой мышцы трахеи и бронхов в условиях нормы и при экспериментальной модели бронхиальной астмы могут быть особенно актуальны. Также большое значение в экспериментах на изолированных препаратах имеет электрическая стимуляция постганглионарных нервов, что максимально приближает исследуемую систему к естественным физиологическим условиям. Поэтому целью настоящего исследования являлось изучение влияния ИЛ-2, ИЛ-5, ИЛ-6, ФНО-α на сокращение гладкой мышцы, трахеи и бронхов крысы с применением электрической стимуляции постганглионарных нервов в условиях физиологической нормы и экспериментальной модели сенсибилизации овальбумином крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Процедура с животными
В эксперименте было использовано 22 крысы линии Вистар обоего пола массой тела 180–270 г. Различий в сократительных реакциях мышц самцов и самок не было, так как самки были взяты для опытов в период диэструса. Животные содержались в виварии согласно санитарно-эпидемиологическим правилам СП 2.2.1.3218-14 “Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)”. С целью получения образцов респираторного тракта производилась декапитация. Общую анестезию проводили при помощи инъекций золетила (Virbac S.A., Франция, 20 мг/кг, внутримышечно). Такой подход обеспечивал быструю эвтаназию животного (удовлетворяющий рекомендациям по эвтаназии экспериментальных животных, Европейской комиссии, Приказу Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики”) [31]. Далее животное закреплялось на столе для вскрытия. После этого вскрывали грудную клетку и затем производили операцию с извлечением дыхательных путей животного. Паренхиматозную ткань легких удаляли механически деревянным шпателем [32]. Дыхательные пути промывали в растворе Кребса–Хензелайта следующего состава (в мМ): 118 NaCl; 4.8 KCl; 1.18 MgSO4; 1.2 KH2PO4; 2.5 CaCl2; 25 NaHCO3; 5.5 глюкоза, а затем готовили препараты трахеи и бронхов. Каждый препарат представлял собой образец трахеи или бронхов длиной 0.4–0.6 см и шириной 0.5–0.7 см. Образцы трахеи и бронхов брались из области бифуркаций, поскольку в этих участках присутствуют интрамуральные ганглии. Линия разреза трахеи и бронхов проходила через хрящевые полукольца. Гладкая мышца оставалась нетронутой. Препараты трахеи и бронхов помещали в камеру с раствором Кребса–Хензелейта, где один край препарата фиксировали иглами, а второй край устанавливали крючками-держателями, прикрепленными к электромеханическому датчику, регистрирующему величину сократительной реакции (измеряемой в миллиньютонах (мн)).
Оборудование
В экспериментах использовали физиологический комплекс, поддерживающий нормальное протекание физиологических процессов в изолированных препаратах. Комплекс включал в себя специальные камеры для помещения в них препаратов трахеи и бронхов, ультратермостат, аэратор, насос перистальтический (ML0146/C-V, Multi Chamber Organ Baths, Panlab, Германия), электромеханические датчики (Grass FT-03 force displacement transducer, Astro Med, West Warwick, RI, США), электростимулятор (direct-current stimulator, Grass S44, Quincy, MA, США), персональный компьютер, специальное программное обеспечение (Chart v 4.2 software, Power Lab, AD Instruments, Colorado Springs, CO, США).
Электрофизиологические эксперименты
Во всех экспериментах использовалась стимуляция электрическим полем. Во время работы применялась электростимуляция постганглионарных нервных волокон (частота стимулов – 30 Гц, длительность – 0.5 мс, амплитуда – 20 В, длительность стимуляции – 10 с). Электростимуляция моделировала естественную проводимость электрических импульсов через постганглионарное звено рефлекторной цепи. В экспериментах изучалась сократительная реакция гладкой мускулатуры трахеи и бронхов крысы при использовании электростимуляции и фармакологических средств. Сначала проводили электростимуляцию препаратов трахеи и бронхов. Затем регистрировали сократительные реакции мышц. Эти ответы были приняты за базовый уровень (или 100%). После этого добавляли фармакологические вещества и регистрировали сократительные реакции мышц. Таким образом, регистрировали реакции трахеальной и бронхиальной мускулатуры с учетом электростимуляции и фармакологических препаратов. Величина сократительных реакций на применение препарата в значительной степени зависела от исходного тонуса гладкой мускулатуры, а также от контрольных сократительных реакций вследствие применения электростимуляции на фоне физиологического раствора. Несмотря на то, что все животные были одного возраста и выборка была однородной, вариабельность исходного тонуса и контрольных реакций (измеренных в мн) таких органов, как трахея и бронхи, была достаточно высокой, и этот факт определил учет сокращения в процентах (подсчитанных в процентах от базового уровня активности, взятого за 100%). Методы электростимуляции постганглионарных нервов взяты из методов исследования, предложенных Фединым [33].
Фармакологическая процедура
В камерах с препаратами поддерживали необходимый уровень кислорода, температуру (37°C) и рН (6.9–7.1). Приток свежего раствора Кребса–Хензелейта обеспечивался регулярно, как и отток использованного [33].
В ходе экспериментов в камеры с препаратами вводили растворы следующих веществ: ФНО-α в концентрации 50 мг/мл, ИЛ-2 – 30 нг/мл, ИЛ-5 – 20 нг/мл, ИЛ-6 – 30 нг/мл. Все интерлейкины произведены фирмой Sigma-Aldrich, США. Концентрации фармакологических веществ были подобраны в лаборатории при проведении предварительных опытов, в которых физиологический эффект действия препарата был наиболее выражен. Исследованные интерлейкины поступали в камеры с препаратами при помощи перфузии в течение 120 мин, после чего производилась регистрация сократительной активности.
Процедура сенсибилизации животных
Крысы были сенсибилизированы однократным внутрибрюшинным введением 0.2 нмоль овальбумина (Sigma-Aldrich, Германия), смешанного с 120 мкмоль гидроксида алюминия (Sigma-Aldrich, Германия) в качестве адъюванта. Через 14 дней проводилась аппликация овальбумина (1.2 нмоль/мл) в камеру с экспериментальными препаратами. Первичное введение овальбумина способствует развитию сенсибилизации организма животного. Повторная аппликация овальбумина приводит к дегрануляции тучных клеток в экспериментальных препаратах. Несенсибилизированной группе крыс в качестве контроля вводили внутрибрюшинно физиологический раствор [34].
Схема эксперимента
Были сформированы две группы животных: контрольная (получала физиологический раствор) и экспериментальная, сенсибилизированная овальбумином (получала инъекцию овальбумина с его повторным введением в камеры с препаратами через 14 дней). Далее проводилась оценка сокращения мышцы трахеи и бронхов после повторного ведения овальбумина и после перфузии растворами интерлейкинов.
Статистический анализ
Статистический анализ проводился с помощью статистического пакета SPSS, версия 10.0 (SPSS Inc., Chicago, Illinois, США). Сравнение между группами контрольных и экспериментальных результатов проводили с использованием независимых t-тестов. Значение p < 0.05 считалось статистически значимым. Данные были выражены в виде среднего значения и стандартного отклонения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На фоне физиологического раствора (контрольная группа животных) ФНО-α вызывал выраженное увеличение сократительных ответов в препаратах трахеи и бронхов (рис. 1). После сенсибилизации овальбумином сократительные ответы мышцы в присутствии физиологического раствора возрастали до патологических значений. В экспериментальной модели с сенсибилизацией животных овальбумином сократительные ответы при введении в ванночки с препаратами ФНО-α достигали высоких значений.
Рис. 1.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ФНО-α на фоне физиологического раствора (контрольная группа животных) и на фоне овальбумина (экспериментальная группа животных). * – достоверное (р < 0.05) отличие от контрольных значений, # – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина.
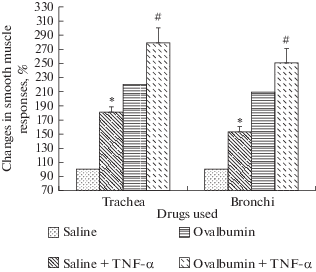
На фоне физиологического раствора, ИЛ-2 приводил к повышению сократительных ответов гладкой мышцы трахеи и мышцы бронхов (рис. 2) как у сенсибилизированных овальбумином крыс на фоне применения электрической стимуляции постганглионарных нервов, так и при перфузии раствором интерлейкина-2.
Рис. 2.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-2 на фоне физиологического раствора (контрольная группа животных) и на фоне овальбумина (экспериментальная группа животных). * – достоверное (р < 0.05) отличие от контрольных значений, # – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина.

На фоне физиологического раствора, ИЛ-5 вызывал возрастание сокращений мышцы трахеи (рис. 3). Сенсибилизация животных овальбумином с повторным его введением приводила к увеличению сократительных ответов мышцы трахеи. Поступление ИЛ-5 в камеру с препаратами способствовало увеличению сокращению трахеи и бронхов.
Рис. 3.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-5 на фоне физиологического раствора (контрольная группа животных) и на фоне овальбумина (экспериментальная группа животных). * – достоверное (р < 0.05) отличие от контрольных значений, # – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина.

На фоне физиологического раствора (контрольная группа животных), ИЛ-6 вызывал увеличение сократительных ответов в препаратах трахеи и бронхов (рис. 4). В экспериментальной модели бронхиальной астмы сократительные ответы в препаратах трахеи и в препаратах бронхов увеличивались. При поступлении в камеры с препаратами интерлейкина-6 сократительные ответы в препаратах трахеи и бронхов возрастали.
Рис. 4.
Сократительные ответы гладкой мышцы трахеи и бронхов в результате влияния ИЛ-6 на фоне физиологического раствора (контрольная группа животных) и на фоне овальбумина (экспериментальная группа животных). * – достоверное (р < 0.05) отличие от контрольных значений, # – достоверное (р < 0.05) отличие от значений ответов на фоне овальбумина.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ФНО-α достоверно увеличивал значения сократительных ответов гладкой мышцы трахеи и бронхов крыс как в норме, так и в модели сенсибилизированных животных. При сравнении констрикторного эффекта ФНО-α на мышцу с эффектами ИЛ-2, ИЛ-5 и ИЛ-6 выяснилось, что ФНО-α оказывает самое сильное констрикторное влияние в исследуемых концентрациях. Полученные нами данные на респираторном тракте крысы согласуются с данными, полученными на других животных. О констрикторном влиянии ФНО-α на гладкую мышцу респираторного тракта мышей, морских свинок и крупного рогатого скота свидетельствуют результаты ряда исследователей [4–6]. В литературе найти сведения о влиянии ФНО-α на мышцу респираторного тракта крысы нам не удалось. Также следует отметить, что наши исследования проведены с применением электрической стимуляции постганглионарных нервов, что отличает от работ Amrani, Nakatani, Secher [4, 6, 7].
Такой мощный констрикторный эффект на мышцу ФНО-α можно связать не только с механизмами воздействия этого цитокина на миоциты через рецептор TNFR1, но и с прямым воздействием цитокина на ванилоидные рецепторы С-волокон.
ИЛ-6 также давал очень выраженный констрикторный эффект на гладкую мышцу трахеи и бронхов в условиях электрической стимуляции постганглионарных нервных волокон. Большие значения сократительных ответов можно также связать с двунаправленным действием этого цитокина: прямое воздействие на мышцу через рецептор ИЛ-6R и воздействием на нервные структуры (холинергические нервные окончания, стреч-рецепторы, нервные окончания С-волокон) путем открытия натриевых каналов [28]. Полученные нами данные о влиянии ИЛ-6 на сократительные ответы гладкой мышцы получили частичное подтверждение результатов исследований Zhang и Chang, проведенных на гладкой мускулатуре кишечника крыс [29]. Аналогичных исследований на мышце респираторного тракта нам не удалось обнаружить.
Влияния ИЛ-2 и ИЛ-5 на сокращение мышцы приблизительно одинаковы в использованных в эксперименте концентрациях. ИЛ-2 увеличивал сократительные ответы мышцы трахеи сенсибилизированных крыс на 20.3% от фонового значения (217.8 ± 6.1%), а ИЛ-5 увеличивал ответы трахеи на 17.6% (от значения 201.7 ± 6.1%). Гладкая мышца бронхов под влиянием ИЛ-2 увеличивала сократительный ответ на 16.9% от фонового значения (203.2 ± 5.8%), а под влиянием ИЛ-5 сократительный ответ повышался на 15.8% от фонового значения (194.2 ± 5.4%).
Результаты исследований по ИЛ-5 согласуются с данными Сазонова, полученными в экспериментах на морских свинках [35]. Информация по влиянию ИЛ-2 на сокращения мышцы респираторного тракта практически отсутствует. Полученные данные представляют новые сведения о влиянии ИЛ-2 на гладкую мышцу и могут найти косвенное подтверждение в работе Park и Lee, доказывающей связь между высоким уровнем ИЛ-2 в бронхоальвеолярном лаваже со снижением функции внешнего дыхания [13].
Таким образом, проведенное нами исследование продемонстрировало, что ИЛ-2, ИЛ-5, ИЛ-6 и ФНО-α оказывают констрикторное влияние на гладкую мышцу трахеи и бронхов крысы на фоне применения электрической стимуляции постганглионарных нервов в условиях физиологической нормы и у сенсибилизируемых овальбумином животных. Наибольшее констрикторное влияние на мышцу среди исследованных цитокинов принадлежит ФНО-α и ИЛ-6.
Список литературы
Brightling C, Berry M, Amrani Y (2008) Targeting TNF-alpha: a novel therapeutic approach for asthma. J Allergy Clin Immunol 121: 5–10. https://doi.org/10.1016/j. jaci. 2007.10.028
Tartaglia LA, Goeddel DV (1992) Two TNF receptors. Immunol Today 13: 151–153. https://doi.org/10.1016/0167-5699(92)90116-O
Matsunaga K, Yanagisawa S, Ichikawa T, Ueshima K, Akamatsu K, Hirano T (2006) Airway cytokine expression measured by means of protein array in exhaled breath condensate: correlation with physiologic properties in asthmatic patients. J Allergy Clin Immunol 118: 84–90. https://doi.org/10.1016/j.jaci.2006.04.020
Amrani Y, Chen H, Panettieri RA (2000) Activation of tumor necrosis factor receptor 1 in airway smooth muscle: a potential pathway that modulates bronchial hyper-responsiveness in asthma? Respirat Res 1: 49–53. https://doi.org/10.1186/rr12
Amrani Y, Panettieri RA (1998) Cytokines induce airway smooth muscle cell hyperresponsiveness to contractile agonists. Thorax 53: 713–716. https://doi.org/10.1136/thx.53.8.713
Nakatani Y, Nishimura Y, Nishiumua T, Maeda H, Yokoyama M (2000) Tumor necrosis factor-a augments contraction and cytosolic Ca 2+ through phospholipase A2 in bovine tracheal smooth muscle. Eur J Pharmacol 392:175–182. https://doi.org/10.1016/S0014-2999(00)00087-X
Secher T, Coelho RF, Noulin N, Lino dos Santos Franco A, Quesniaux V, Lignon J, Mitchell J, Moser R, Gomes E, Mirotti L, Tavares-de-Lima W, Ryffel B (2012) Enhancement of Methacholine-Evoked Tracheal Contraction Induced by Bacterial Lipopolysaccharides Depends on Epithelium and Tumor Necrosis Factor. J Allergy 2012: 494085. https://doi.org/10.1155/2012/494085
Thomas PS, Yates DH, Barnes PJ (1995) Tumor necrosis factor-alpha increases airway responsiveness and sputum neutrophilia in normal human subjects. Am J Respir Crit Care Med 152: 76–80. https://doi.org/10.1164/ajrccm.152.1.7599866
Mazzone SB, Undem BJ (2016) Vagal Afferent Innervation of the Airways in Health and Disease. Physiol Rev 96: 975–1024. https://doi.org/10.1152/physrev.00039.2015
Nicol GD, Lopshire JC, Pafford CM (1997) Tumor necrosis factor enhances the capsaicin sensitivity of rat sensory neurons. J Neurosci 17: 975–982. https://doi.org/10.1523/JNEUROSCI.17-03-00975.1997
Watanabe N, Horie S, Michael GJ, Keir S, Spina D, Page CP (2006) Immunohistochemical colocalization of transient receptor potential vanilloid (TRPV)1 and sensory neuropeptides in the guinea-pig respiratory system. Neuroscience 141: 1533–1543. https://doi.org/10.1016/j.neuroscience.2006.04.073
Hu Y, Gu Q, Lin RL, Kryscio R, Lee LY (2010) Calcium transient evoked by TRPV1 activators is enhanced by tumor necrosis factor-alpha in rat pulmonary sensory neurons. Am J Physiol Lung Cell Mol Physiol 299: L483–L492. https://doi.org/10.1152/ajplung.00111.2010
Christensen U, Haagerup A, Binderup HG, Vestbo J, Kruse TA, Børglum AD (2006) Family based association analysis of the IL2 and IL15 genes in allergic disorders. Eur J Hum Genet 14(2): 227–235. https://doi.org/10.1038/sj.ejhg.5201541
Park CS, Lee SM, Uh ST, Kim HT, Chung YT, Kim YH, Choi BW, Hue SH, Lee HB (1993) Soluble interleukin-2 receptor and cellular profiles in bronchoalveolar lavage fluid from patients with bronchial asthma. J Allergy Clin Immunol 91(2): 623–633. https://doi.org/10.1016/0091-6749(93)90268-k
Kanagalingam T, Solomon L, Vijeyakumaran M, Palikhe NS, Vliagoftis H, Cameron L (2019) IL-2 modulates Th2 cell responses to glucocorticosteroid: A cause of persistent type 2 inflammation? Immunity, Inflammation and Disease. Immun Inflamm Dis 7: 112–124. https://doi.org/10.1002/iid3.249
Tang RB, Chen SJ (2001) Soluble interleukin-2 receptor and interleukin-4 in sera of asthmatic children before and after a prednisolone course. Ann Allergy Asthma Immunol 86(3): 314–317. https://doi.org/10.1016/S1081-1206(10)63305-4
Shimizu H, Obase Y, Katoh S, Mouri K, Kobashi Y, Oka M (2013) Critical role of interleukin-5 in the development of a mite antigen-induced chronic bronchial asthma model. Inflammat Res 62: 911–917. https://doi.org/10.1007/s00011-013-0651-y
Salvi S, Semper A, Blomberg A (1999) Interleukin-5 production by human airway epithelial cells. Am J Respir Cell Mol Biol 20: 984–991. https://doi.org/10.1165/ajrcmb.20.5.3463
Tominaga A, Takaki S, Koyama N, Katoh S (1991) Transgenic mice expressing a B cell growht and differentiation factor gene (IL-5) develop eosinophilia and autoantibody production. J Exp Med 173: 429–437. https://doi.org/10.1084/JEM. 173. 2.429
Cox LS (2009) How safe are the biologicals in treating asthma and rhinitis? Allergy, Asthma, Clin Immunol 5(1): 4. https://doi.org/10.1186/1710-1492-5-4
Oosterhout AJ, Lodenius AR, Savelkoul HF (1993) Effect of anti- IL-5 and IL-5 on airway hyperreactivity and eosinofils in guinea-pig. Am Rev Respir Dis 147: 548–552. https://doi.org/10.1164/ajrccm/147.3.548
Haldar P, Brightling CE, Hargadon B (2009) Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 360: 973–984. https://doi.org/10.1056/NEJMoa0808991
Ostrowski K, Schjerling P, Pedersen BK (2000) Physical activity and plasma interleukin-6 in humans: effect of intensity of exercise. Eur J Appl Physiol 83: 512–515. https://doi.org/10.1007/s004210000312
Ferrerira MA, Matheson MC, Duffy DL (2011) Identification of IL-6R and chromosome 11q13.5 as rick loci for asthma. Lancet 378: 1006–1014. https://doi.org/10.1016/S0140-6736(11)60874-X
Taga T, Hibi M, Hirata Y (1989) Interleukin-6 triggers the association of its receptor with a possible signal transducer, gp130. Cell 58.S3: 573–581. https://doi.org/10.1016/0092-8674(89)90438-8
Hawkins GA, Robinson MB, Hastie AT (2012) The IL6R variation Asp(358)Ala is a potential modifier of lung function in subjects with asthma. J Allergy Clin Immunol 130: 510–515. https://doi.org/10.1016/j.jaci.2012.03.018
Зенкина ЛВ, Смирнова СВ, Кадричева СГ (2008) Бронхиальная астма: концентрация IL-2, IL-4, IL-6, IFN и TFNA в сыворотке периферической крови и изменения в иммунном статусе при атопии и псевдоатопии. Вестник клин больницы № 51 3: 42–47. [Zenkina LV, Smirnova SV, Kadricheva SG (2008) Bronchial asthma: concentration of IL-2, IL-4, IL-6, IFN and TFNA in peripheral blood serum and changes in immune status in atopy and pseudoatopia. Clin Hospital Bull No 51 3: 42–47. (In Russ)].
Yokoyama A, Kohno N, Fujino S, Hamada H, Inoue Y, Fujioka S, Ishida S, Hiwada K (1995) Circulating interleukin-6 levels in patients with bronchial asthma. Am J Respir Crit Care Med 151(5): 1354–1358. https://doi.org/10.1164/ajrccm.151.5.7735584
Chang XW, Qin Y, Jin Z, Xi TF, Yang X, Lu ZH, Tang YP, Cai WT, Chen SJ, Xie DP (2015) Interleukin-6 (IL-6) mediated the increased contraction of distal colon in streptozotocin-induced diabetes in rats via IL-6 receptor pathway. J Clin Exp Pathol 8(5): 4514–4524.
Tang WB, Zhou YQ, Zhou T, Shan JL, Sun P, Yang TT, Chang XW, Li S, Wang PS, Xie DP (2011) Effect of interleukin-6 (IL-6) on the vascular smooth muscle contraction in abdominal aorta of rats with streptozotocin-induced diabetes. Chin J Physiol 54(5): 318–323. https://www.pubfacts.com/detail/22135910/Effect-of-interleukin-6-IL-6-on-the-vascular-smooth-muscle-contraction-in-abdominal-aorta-of-rats-wi
Close B, Banister K, Baumans V, Warwick C (1997) Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Labor Animals J 31: 1–32. https://doi.org/10.1258/002367797780600297
Hatziefthimiou A, Karetsi E, Pratzoudis E, Gourgoulianis K, Molyydas P (2005) Resting tension on airway smooth muscle: the involvement of epithelium. Respir Physiol Neurobiol J 145: 201–208. https://doi.org/10.1016/j.resp.2004.06.004
Федин АН, Алиева ЕВ, Ноздрачев АД (1997) Реакции гладкой мышцы трахеи на гистамин. Рос физиол журн им ИМ Сеченова 83:102–108. [Fedin AN, Alieva EV, Nozdrachev AD (1997) Reactions of the smooth muscle of the trachea to histamine. Russ J Physiol 83: 102–108. (In Russ)].
Masakazu Y, Osamu S, Kenji N, Tetsuji M, Koji S (2006) Propofol Attenuates Ovalbumin-Induced Smooth Muscle Contraction of the Sensitized Rat Trachea: Inhibition of Serotonergic and Cholinergic Signaling. Anesthesia & Analgesia J 3: 594–600. https://doi.org/10.1213/01.ane.0000229853.01875.60
Сазонов АЭ, Лещевой ИС, Дьяковой ЕЮ, Копьевой АП (2003) Влияние интерлейкина-5 на сократительную активность гладкомышечных препаратов бронхов морских свинок. Науки о человеке 1:161–162. [Sazonov AE, Leshchevoy IS, Dyakova EYu, Kopyevoy AP (2003) The effect of interleukin-5 on the contractile activity of smooth muscle preparations of the bronchi of guinea pigs. Human Sciences 1: 161–162. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


