Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 8, стр. 1039-1048
Механизмы ингибирования AMPA рецепторов диминазеном
А. С. Жигулин 1, М. Ю. Дронь 1, О. И. Барыгин 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Санкт-Петербург, Россия
* E-mail: Oleg_Barygin@mail.ru
Поступила в редакцию 25.02.2021
После доработки 10.05.2021
Принята к публикации 24.05.2021
Аннотация
Диминазен – это противоинфекционный препарат для животных, относящийся к группе диариламидинов. В данной работе мы впервые обнаружили его ингибирующее действие на AMPA-тип ионотропных глутаматных рецепторов. Эксперименты проводились на изолированных нейронах крыс линии Вистар, для исследования кальций-проницаемых AMPA-рецепторов использовались гигантские холинергические интернейроны стриатума, для кальций-непроницаемых AMPA-рецепторов – пирамидные клетки зоны CA1 гиппокампа. Изоляция клеток осуществлялась методом вибродиссоциации, а регистрация токов – методом фиксации потенциала в конфигурации “целая клетка”. Диминазен концентрационно-зависимым образом ингибировал токи, вызванные аппликацией каината в обоих типах нейронов. ИК50 для кальций-проницаемых и кальций-непроницаемых AMPA-рецепторов составили 60 ± 11 и 160 ± 30 мкM соответственно. Интересно, что ингибирующее действие диминазена усиливалось при увеличении концентрации агониста. Кривая потенциал-зависимости ингибирования фиксированной концентрацией диминазена для кальций-проницаемых AMPA-рецепторов имела двухфазную форму: минимальное ингибирование наблюдалось при положительных потенциалах, максимум – при –40…–60 мВ, а при дальнейшей гиперполяризации – постепенное снижение эффективности блокады. Все эти признаки свидетельствуют о блокаде диминазеном канала AMPA-рецепторов с возможностью проникновения через канал внутрь клетки.
Диминазен – это противоинфекционный препарат для животных, относящийся к группе диариламидинов [1]. Он был разработан более 60 лет назад и используется для лечения трипаносомозов и ряда других заболеваний, вызываемых простейшими, у животных [2]. В исследованиях последних 20 лет были обнаружены и другие мишени для диминазена. В частности, он способен активировать ангиотензинпревращающий фермент 2 [3] и обладает иммуномодулятоными свойствами [3, 4]. Кроме того, диминазен является блокатором протон-управляемых ионных каналов семейства ASIC [5, 6]. Новые пути применения диминазена достаточно активно обсуждаются в настоящее время, в том числе в свете эпидемии COVID-19 [7].
Нами недавно было показано, что диминазен способен ингибировать ионотропные глутаматные рецепторы NMDA-типа в микромолярных концентрациях [8]. AMPA-рецепторы – это еще один основной тип ионотропных глутаматных рецепторов [9]. Они опосредуют быструю возбуждающую синаптическую передачу в ЦНС позвоночных животных. Традиционно их делят на два основных подтипа: кальций-проницаемые и кальций-непроницаемые, отличающиеся по своим фармакологическим свойствам и физиологической роли [9]. В частности, для кальций-проницаемых AMPA-рецепторов характерна большая проводимость канала [10] и более высокая чувствительность к катионным каналоблокаторам [11, 12]. Напротив, кальций-непроницаемые и кальций-проницаемые AMPA-рецепторы одинаково чувствительны к негативным аллостерическим антагонистам, таким как антиконвульсант перампанел [13, 14]. С прикладной точки зрения поиск новых антагонистов AMPA-рецепторов среди лекарственных препаратов представляется актуальным из-за относительно недавнего введения в клиническую практику перампанела для лечения эпилепсии [15, 16]. С учетом действия диминазена на NMDA-тип ионотропных глутаматных рецепторов было интересно проверить, не будет ли он ингибировать и рецепторы AMPA-типа. Стоит отметить, что общей удлиненной формой молекулы и положительным зарядом при физиологических значениях pH диминазен напоминает классические блокаторы каналов AMPA-рецепторов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все манипуляции с животными были проведены в соответствии с принципами Базельской декларации и рекомендациями Комиссии по гуманному обращению с животными Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Крыс линии Вистар (14–19 дней) декапитировали под уретановым наркозом. Мозг быстро извлекали и охлаждали до 2–4°С. Затем на вибратоме 7000 smz2 Campden Instruments (Великобритания) приготавливали поперечные срезы гиппокампа и стриатума толщиной 250 мкм, которые сохраняли в растворе следующего состава (мМ): NaCl – 124, KCl – 5, CaCl2 – 1.3, MgCl2 –2.0, NaHCO3 – 26, NaH2PO4 – 1.24, D-глюкоза – 10. Раствор аэрировали карбогеном (95% O2, 5% СО2), pH 7.4–7.5 при комнатной температуре. Нейроны изолировали из срезов методом вибродиссоциации [17]. Для работы с кальций-непроницаемыми AMPA-рецепторами использовали пирамидные нейроны зоны CA1 гиппокампа, для работы с кальций-проницаемыми AMPA-рецепторами – гигантские холинергические интернейроны стриатума [18, 19]. Для идентификации типа клеток помимо морфологического использовали фармакологический критерий – чувствительность к избирательному блокатору кальций-проницаемых AMPA-рецепторов ИЭМ-1925 [20]. Корреляция между проницаемостью AMPA-рецепторов для кальция и чувствительностью к дикатионным каналоблокаторам была продемонстрирована ранее [19].
Для регистрации трансмембранных токов применяли метод фиксации потенциала в конфигурации “целая клетка”. Внеклеточный раствор содержал (в мМ): NaCl – 143, KCl – 5, MgCl2 – 2.0, CaCl2 – 2.5, D-глюкоза – 18, HEPES – 10 (pH подводили до 7.3 добавлением HCl). Микропипетку заполняли раствором (мМ): CsF – 100, CsCl – 40, NaCl – 5, CaCl2 – 0.5, EGTA – 5, HEPES – 10 (pH подводили до 7.2 добавлением CsOH). Для подачи веществ применяли восьмиканальную систему быстрой замены растворов с электромагнитными клапанами RSC-200 BioLogic Science Instruments (Франция). Время смены раствора составляло 50–60 мс. Регистрацию токов проводили с помощью усилителя EPC8 HEKA Elektronik (Германия). Сигнал фильтровался в полосе частот 0–5 кГц и оцифровывался с частотой дискретизации 1 кГц. Контроль поддерживаемого на мембране потенциала, управление системой аппликации, регистрацию и анализ данных осуществляли с помощью персонального компьютера. Диминазен (diminazene aceturate, D7770) был куплен в фирме Sigma Aldrich, остальные реактивы – там же или в Tocris Bioscience.
Данные о действии диминазена представлены в виде среднее ± стандартное отклонение на основе как минимум 5 экспериментов. Статистическая значимость эффектов анализировалась с помощью парного t-теста.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Аппликация каината (100 мкM) вызывала возникновение входящих токов в пирамидных клетках гиппокампа и гигантских интернейронах стриатума при потенциале на мембране –80 мВ. На рис. 1a и 1b представлены репрезентативные примеры ингибирования этих токов избирательным блокатором кальций-проницаемых AMPA-рецепторов ИЭМ-1925 в концентрации 10 мкM и диминазеном в концентрации 100 мкM. ИЭМ-1925 эффективно ингибировал ответы в гигантских интернейронах стриатума (блок 84 ± 5%, n = 7, рис. 1a) и слабо влиял на ответы в пирамидных нейронах гиппокампа (блок 10 ± 4%, n = 6, рис. 1b). Диминазен в концентрации 100 мкM также был более эффективен по отношению к кальций-проницаемым AMPA-рецепторам гигантских интернейронов стриатума (блок 64 ± 5%, n = 7), по сравнению с кальций-непроницаемыми AMPA- рецепторами пирамидных нейронов гиппокампа (блок 31 ± 7%, n = 6). Затем мы исследовали концентрационную зависимость действия диминазена на оба основных подтипа AMPA-рецепторов. Репрезентативные примеры ингибирования токов диминазеном в концентрациях 10–300 мкM для кальций-проницаемых AMPA-рецепторов и 30–300 мкM для кальций-непроницаемых AMPA-рецепторов представлены на рис. 1c и 1d соответственно. Ингибирующее действие диминазена было быстрым и обратимым. Аппликация самого диминазена в концентрациях до 300 мкM токов в нейронах не вызывала, а в более высоких концентрациях приводила к гибели клеток. ИК50, полученные с помощью аппроксимации данных уравнением Хилла, были равны 60 ± 11 (n = 7) и 160 ± 30 мкM (n = 6) для кальций-проницаемых и кальций-непроницаемых AMPA-рецепторов соответственно, а коэффициенты Хилла 1.2 ± 0.2 и 1.5 ± 0.3. Таким образом, диминазен был более активен по отношению к кальций-проницаемым AMPA-рецепторам, чем по отношению к кальций-непроницаемым, что характерно для антагонистов, действующих по механизму блокады ионного канала. Для обоих типов рецепторов форма кривой подразумевает полное ингибирование при высоких концентрациях антагониста.
Рис. 1.
Концентрационная зависимость действия диминазена на AMPA-рецепторы. (a), (b) – репрезентативные примеры ингибирования каинат-вызванных токов ИЭМ-1925 (10 мкM) и диминазеном (100 мкM) в гигантских холинергических интернейронах стриатума (A) и пирамидных нейронах зоны CA1 гиппокампа (b). (c), (d) – репрезентативные примеры ингибирования каинат-вызванных токов различными концентрациями диминазена в гигантских холинергических интернейронах стриатума (c) и пирамидных нейронах зоны CA1 гиппокампа (d). (e) – кривые концентрационной зависимости действия диминазена для кальций-проницаемых AMPA-рецепторов гигантских интернейронов стриатума и кальций-непроницаемых AMPA-рецепторов пирамидных нейронов гиппокампа.

На следующем этапе мы решили проверить, является ли ингибирование AMPA-рецепторов диминазеном конкурентным или неконкурентным. Для этого мы сравнили эффективность ингибирования фиксированной концентрацией вещества при двух разных концентрациях каината: 50 и 500 мкM (рис. 2). Амплитуда ответа на аппликацию 500 мкM каината в случае гигантских интернейронов стриатума была в среднем в 3.9 ± 0.7 раза выше, чем амплитуда ответа на аппликацию 50 мкM каината. На рис. 2a представлен репрезентативный пример ингибирования кальций-проницаемых AMPA-рецепторов гигантского интернейрона стриатума диминазеном в концентрации 60 мкM. Ответы на каинат в концентрациях 50 и 500 мкM нормированы на рисунке для наглядности. Оказалось, что диминазен достоверно более эффективно (n = 6, p < 0.001, рис. 2c) блокирует ответы, вызванные аппликацией каината 500 мкM (58 ± 5%), по сравнению с каинатом в концентрации 50 мкM (44 ± 4%). Это однозначно свидетельствует в пользу неконкурентного механизма его действия. Аналогичные данные были получены для кальций-непроницаемых AMPA-рецепторов пирамидных нейронов гиппокампа (рис. 2b, 2d, n = 7).
Рис. 2.
Неконкурентное ингибирование AMPA-рецепторов диминазеном. (a), (b) – репрезентативные примеры ингибирования кальций-проницаемых (a) и кальций-непроницаемых (b) AMPA-рецепторов фиксированной концентрацией диминазена при двух разных концентрациях каината (50 и 500 мкM). Амплитуды ответов на каинат в концентрациях 50 и 500 мкM нормированы для наглядности. (с), (d) – средние значения процента блокады диминазеном, 60 мкM для кальций-проницаемых (с) и диминазеном, 200 мкM для кальций-непроницаемых (d) AMPA рецепторов при двух разных концентрациях каината (50 и 500 мкM). Для обоих типов рецепторов диминазен более эффективен в случае высокой концентрации агониста (p < 0.001 в случае кальций-проницаемых AMPA- рецепторов и p < 0.01 в случае кальций-непроницаемых AMPA-рецепторов).

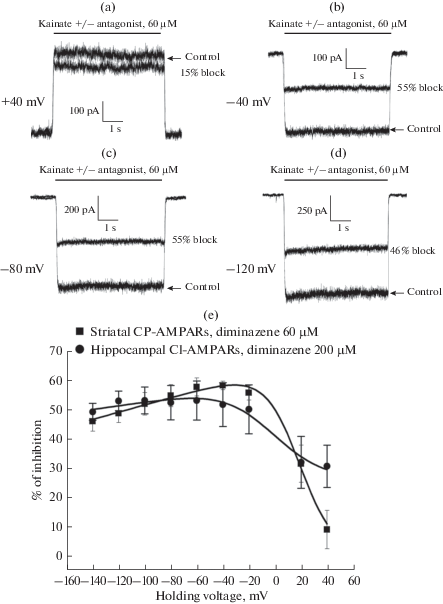
В настоящий момент известны 2 основных типа неконкурентных антагонистов AMPA-рецепторов – негативные аллостерические модуляторы, такие как G-YKI‑52466 [21] и перампанел [15], и блокаторы каналов, такие как производное адамантана ИЭМ-1460 [11, 22], производное фенилциклогексила ИЭМ-1925 [20, 23], аргиотоксины [24, 25], филантотоксины [26, 27]. Стандартным тестом на блокаду канала для заряженных веществ является исследование потенциал-зависимости их действия, позволяющее оценить глубину расположения сайта связывания в электрическом поле мембраны. Мы сравнили эффективность блокады фиксированной концентрацией диминазена в диапазоне потенциалов от +40 до –140 мВ. Репрезентативные примеры ингибирования каинат-вызванных токов диминазеном (60 мкM) в гигантских интернейронах стриатума при потенциалах +40 мВ (a), –40 мВ (b), –80 мВ (c) и –120 мВ (d) представлены на рис. 3. Эффективность ингибирования диминазеном была минимальной при потенциале +40 мВ, достигала максимума при потенциалах –40…–60 мВ и дальше снижалась с гиперполяризацией (n = 5, рис. 3e). Такая бифазная зависимость эффективности ингибирования от потенциала на мембране характерна для блокаторов, способных проникать через канал внутрь клетки [28]. Для кальций-непроницаемых AMPA-рецепторов зависимость эффективности ингибирования от потенциала на мембране также была бифазной, но наблюдался более выраженный потенциал-независимый компонент (n = 7, рис. 3e). Полученные данные были аппроксимированы с помощью формулы [29], учитывающей возможность прохождения через канал внутрь клетки и наличия потенциал-независимого компонента ингибирования:
Рис. 3.
Потенциал-зависимость ингибирования AMPA-рецепторов диминазеном. (a)–(d) – репрезентативные примеры ингибирования каинат-вызванных токов гигантских интернейронов стриатума 60 мкM диминазена при потенциалах на мембране +40 мВ (а), –40 мВ (b), –80 мВ (c) и –120 мВ (d). (e) – кривые потенциал-зависимости ингибирования диминазеном 60 мкM для кальций-проницаемых AMPA-рецепторов гигантских интернейронов стриатума и диминазеном 200 мкM для кальций-непроницаемых AMPA-рецепторов пирамидных нейронов гиппокампа.
В этой формуле B – процент блокады при потенциале V концентрацией антагониста С, A – процент потенциал-независимого ингибирования, Kb – константа диссоциации для потенциал-зависимого компонента действия при потенциале 0 мВ, δm – глубина расположения сайта связывания в электрическом поле мембраны, z – заряд блокатора, а F, R и Т – постоянная Фарадея, газовая постоянная и абсолютная температура соответственно. Параметры Kp и δp описывают прохождение через канал внутрь клетки [28].
Данные по блокаде кальций-проницаемых AMPA-рецепторов 60 мкM диминазена достаточно хорошо аппроксимировались и без учета потенциал-независимого компонента действия; δm была равна 0.9 ± 0.2, а δp = 0.06, что соответствует представлениям о глубине расположения сайта связывания классических катионных каналоблокаторов [28, 29]. Данные по блокаде кальций-непроницаемых AMPA-рецепторов 200 мкM диминазена хорошо аппроксимировались с консенсусными для этого типа рецепторов и катионных каналоблокаторов значениями δm = 0.6 и δp = 0.05 [29]. Относительно невысокие значения δp = 0.05–0.06 для обоих типов AMPA-рецепторов и слабый загиб кривых потенциал-зависимости при потенциалах –80…–140 мВ свидетельствуют о том, что диминазен хоть и способен проникать через канал внутрь клетки, но этот процесс затруднен. Стоит отметить, что в наших экспериментах мы не добавляли эндогенные полиамины во внутрипипеточный раствор, чтобы исследовать чистый эффект диминазена, а не смесь эффектов диминазена и полиаминов. В отсутствие полиаминов во внутриклеточном растворе и проведении измерений больше чем через 5 мин после установления конфигурации “целая клетка” IV кривая в гигантских интернейронах стриатума имеет линейный характер [30].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе мы впервые описали ингибирование AMPA-рецепторов диминазеном. Он более активно блокировал кальций-проницаемые AMPA-рецепторы по сравнению с кальций-непроницаемыми (рис. 1e), что характерно для катионных антагонистов, действующих по механизму блокады поры канала. Меньшая активность подобных соединений по отношению к кальций-непроницаемым AMPA-рецепторам связана с тем, что в селективном фильтре GluA2 субъединиц расположен остаток аргинина, отталкивающий положительно заряженные молекулы блокаторов. Диминазен действовал неконкурентным образом (рис. 2) и демонстрировал бифазную потенциал-зависимость эффективности блокады фиксированной концентрацией (рис. 3). Полученное при аппроксимации данных потенциал-зависимости эффективности блокады кальций-проницаемых AMPA-рецепторов значение δm = 0.9 ± 0.2 свидетельствует о глубоком расположении сайта связывания диминазена в электрическом поле мембраны, а снижение эффективности блокады при гиперполяризации – о способности проникать через канал внутрь клетки. Быстрая кинетика действия диминазена (рис. 2a, b) не позволила нам определить, способен ли он оставаться в полости закрытого канала A-MPA-рецепторов (эффект ловушки). Стоит упомянуть, что в случае NMDA-рецепторов ловушка для диминазена не наблюдалась – он действовал по механизму “foot-in-the-door” [8]. Блокаторы AMPA-рецепторов, действующие по механизму “foot-in-the-door”, неизвестны.
Интересно, что диминазен в наших экспериментах был более эффективен при активации AMPA-рецепторов высокими концентрациями агониста. Потенциально это может приводить к тому, что подобные соединения будут слабее ингибировать нормальную синаптическую передачу и сильнее ингибировать ее в условиях патологического избытка глутамата, наблюдающегося при ряде нейродегенеративных заболеваний [31]. Чем же может объясняться такая зависимость эффективности от концентрации агониста? Возможно, это связано со способностью диминазена проникать через канал внутрь клетки [32]. Действительно, если блокатор способен связываться только с открытым каналом, оставаться в поре канала после закрытия и затем диффундировать в цитоплазму клетки, то блокирующая активность будет определяться равновесием между связыванием с открытыми каналами и высвобождением из закрытых. Соответственно в условиях, способствующих нахождению каналов в открытом состоянии, в том числе в присутствии высоких концентраций агониста, блокирующая активность будет выше. Дальнейшие исследования позволят ответить на вопрос, характерна ли такая зависимость эффективности от концентрации агониста для других соединений из группы диариламидинов, а также для других блокаторов, способных проникать через канал внутрь клетки.
Список литературы
Oliveira GLD, de Freitas RM (2015) Diminazene aceturate-An antiparasitic drug of antiquity: Advances in pharmacology & therapeutics. Pharmacol Res 102: 138–157. https://doi.org/10.1016/j.phrs.2015.10.005
Peregrine AS, Mamman M (1993) Pharmacology of Diminazene – a Review. Acta Trop 54 (3–4): 185–203.https://doi.org/10.1016/0001-706x(93)90092-P
Kuriakose S, Uzonna JE (2014) Diminazene aceturate (Berenil), a new use for an old compound? Int Immunopharmacol 21(2): 342–345. https://doi.org/10.1016/j.intimp.2014.05.027
Kuriakose S, Muleme HM, Onyilagha C, Singh R, Jia P, Uzonna JE (2012) Diminazene Aceturate (Berenil) Modulates the Host Cellular and Inflammatory Responses to Trypanosoma congolense Infection. Plos One 7 (11). https://doi.org/10.1371/journal.pone.0048696
Chen XM, Qiu LY, Li MH, Durrnagel S, Orser BA, Xiong ZG, MacDonald JF (2010) Diarylamidines: High potency inhibitors of acid-sensing ion channels. Neuropharmacology 58 (7): 1045–1053. https://doi.org/10.1016/j.neuropharm.2010.01.011
Schmidt A, Rosselti G, Joussen S, Grunder S (2017) Towards the molecular basis of ASIC inhibition by Diminazene. Acta Physiol 219: 143–143.
Nicolau LAD, Noleto IRSG, Medeiros JVR (2020) Could a specific ACE2 activator drug improve the clinical outcome of SARS-CoV-2? A potential pharmacological insight. Expert Rev Clin Phar 13(8): 807–811. https://doi.org/10.1080/17512433.2020.1798760
Dron MY, Zhigulin AS, Barygin LI (2020) Mechanisms of NMDA receptor inhibition by diarylamidine compounds. Eur J Neurosci 51 (7): 1573–1582. https://doi.org/10.1111/ejn.14589
Traynelis SF, Wollmuth LP, McBain CJ, Menniti FS, Vance KM, Ogden KK, Hansen KB, Yuan HJ, Myers SJ, Dingledine R (2010) Glutamate Receptor Ion Channels: Structure, Regulation, and Function. Pharmacol Rev 62(3): 405–496. https://doi.org/10.1124/pr.109.002451
Swanson GT, Kamboj SK, CullCandy SG (1997) Single-channel properties of recombinant AMPA receptors depend on RNA editing, splice variation, and subunit composition. J Neurosci 17(1): 58–69.
Magazanik LG, Buldakova SL, Samoilova MV, Gmiro VE, Mellor IR, Usherwood PNR (1997) Block of open channels of recombinant AMPA receptors and native AMPA/kainate receptors by adamantane derivatives. J Physiol-London 505 (3): 655–663. https://doi.org/10.1111/j.1469-7793.1997.655ba.x
Mellor IR, Usherwood PNR (2004) Targeting ionotropic receptors with polyamine-containing toxins. Toxicon 43(5): 493–508. https://doi.org/10.1016/j.toxicon.2004.02.003
Barygin OI (2016) Inhibition of calcium-permeable and calcium-impermeable AMPA receptors by perampanel in rat brain neurons. Neurosci Lett 633: 146–151. https://doi.org/10.1016/j.neulet.2016.09.028
Fukushima K, Hatanaka K, Sagane K, Ido K (2020) Inhibitory effect of anti-seizure medications on ionotropic glutamate receptors: special focus on AMPA receptor subunits. Epilepsy Res 167:106452. https://doi.org/10.1016/j.eplepsyres.2020.106452
Hanada T, Hashizume Y, Tokuhara N, Takenaka O, Kohmura N, Ogasawara A, Hatakeyama S, Ohgoh M, Ueno M, Nishizawa Y (2011) Perampanel: A novel, orally active, noncompetitive AMPA-receptor antagonist that reduces seizure activity in rodent models of epilepsy. Epilepsia 52(7): 1331–1340. https://doi.org/10.1111/j.1528-1167.2011.03109.x
Rogawski MA, Hanada T (2013) Preclinical pharmacology of perampanel, a selective non-competitive AMPA receptor antagonist. Acta Neurol Scand 127: 19–24. https://doi.org/10.1111/ane.12100
Vorobjev VS (1991) Vibrodissociation of Sliced Mammalian Nervous-Tissue. J Neurosci Meth 38(2–3): 145–150. https://doi.org/10.1016/0165-0270(91)90164-U
Buldakova SL, Vorobjev VS, Sharonova IN, Samoilova MV, Magazanik LG (1999) Characterization of AMPA receptor populations in rat brain cells by the use of subunit-specific open channel blocking drug, IEM-1460. Brain Res 846(1): 52–58. https://doi.org/10.1016/S0006-8993(99)01970-8
Samoilova MV, Buldakova SL, Vorobjev VS, Sharonova IN, Magazanik LG (1999) The open channel blocking drug, IEM-1460, reveals functionally distinct alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate receptors in rat brain neurons. Neuroscience 94 (1): 261–268. https://doi.org/10.1016/S0306-4522(99)00326-7
Tikhonov DB, Samoilova MV, Buldakova SL, Gmiro VE, Magazanik LG (2000) Voltage-dependent block of native AMPA receptor channels by dicationic compounds. Brit J Pharmacol 129 (2): 265–274. https://doi.org/10.1038/sj.bjp.0703043
Donevan SD, Rogawski MA (1993) Gyki 52466, a 2,3-Benzodiazepine, Is a Highly Selective, Noncompetitive Antagonist of Ampa/Kainate Receptor Responses. Neuron 10(1): 51–59. https://doi.org/10.1016/0896-6273(93)90241-I
Twomey EC, Yelshanskaya MV, Vassilevski AA, Sobolevsky AI (2018) Mechanisms of Channel Block in Calcium-Permeable AMPA Receptors. Neuron 99 (5): 956. https://doi.org/10.1016/j.neuron.2018.07.027
Bolshakov KV, Kim KH, Potapjeva NN, Gmiro VE, Tikhonov DB, Usherwood PNR, Mellor IR, Magazanik LG (2005) Design of antagonists for NMDA and AMPA receptors. Neuropharmacology 49(2): 144–155. https://doi.org/10.1016/j.neuropharm.2005.02.007
Antonov SM, Grishin EV, Magazanik LG, Shupliakov OV, Vesselkin NP, Volkova TM (1987) Argiopin Blocks the Glutamate Responses and Sensorimotor Transmission in Motoneurons of Isolated Frog Spinal-Cord. Neurosci Lett 83(1–2): 179–184. https://doi.org/10.1016/0304-3940(87)90237-0
Barygin OI, Grishin EV, Tilchonov DB (2011) Argiotoxin in the Closed AMPA Receptor Channel: Experimental and Modeling Study. Biochemistry-Us 50 (38): 8213–8220.https://doi.org/10.1021/bi200617v
Eldefrawi AT, Eldefrawi ME, Konno K, Mansour NA, Nakanishi K, Oltz E, Usherwood PNR (1988) Structure and Synthesis of a Potent Glutamate Receptor Antagonist in Wasp Venom. Proc Natl Acad Sci USA 85(13): 4910–4913. https://doi.org/10.1073/pnas.85.13.4910
Jackson AC, Milstein AD, Soto D, Farrant M, Cull-Candy SG, Nicoll RA (2011) Probing TARP Modulation of AMPA Receptor Conductance with Polyamine Toxins. J Neurosci 31(20): 7511–7520. https://doi.org/10.1523/Jneurosci.6688-10.2011
Tikhonova TB, Barygin OI, Gmiro VE, Tikhonov DB, Magazanik LG (2008) Organic blockers escape from trapping in the AMPA receptor channels by leaking into the cytoplasm. Neuropharmacology 54(4): 653–664. https://doi.org/10.1016/j.neuropharm.2007.11.014
Barygin OI, Luchkina NV, Tikhonov DB (2010) Voltage-dependent and -independent block of alpha-amino-3-hydroxy-5-methylisoxazole-4-propionate receptor channels. J Neurochem 115(6): 1621–1632. https://doi.org/10.1111/j.1471-4159.2010.07068.x
Tikhonova TB, Tikhonov DB, Magazanik LG (2009) Common Binding Site for Externally and Internally Applied AMPA Receptor Channel Blockers. J Mol Neurosci 39(1–2): 169–174. https://doi.org/10.1007/s12031-008-9172-5
Lau A, Tymianski M (2010) Glutamate receptors, neurotoxicity and neurodegeneration. Pflug Arch Eur J Phy 460(2): 525–542. https://doi.org/10.1007/s00424-010-0809-1
Zaitsev AV, Kim KK, Fedorova IM, Dorofeeva NA, Magazanik LG, Tikhonov DB (2011) Specific mechanism of use-dependent channel block of calcium-permeable AMPA receptors provides activity-dependent inhibition of glutamatergic neurotransmission. J Physiol-London 589 (7): 1587–1601. https://doi.org/10.1113/jphysiol.2011.204362
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


