Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 8, стр. 1007-1017
Адаптивные реакции практически здоровых мужчин на пассивную гипертермию сопровождаются повышением уровня ирисина в крови
О. С. Глазачев 1, *, С. Ю. Крыжановская 1, Е. Н. Дудник 1, М. А. Запара 1, В. Г. Самарцева 1, А. Д. Лыфенко 1
1 Первый Московский государственный медицинский университет им. И.М. Сеченова
(Сеченовский университет)
Москва, Россия
* E-mail: glazachev@mail.ru
Поступила в редакцию 24.03.2021
После доработки 24.04.2021
Принята к публикации 28.04.2021
Аннотация
Цель работы: оценка адаптивных физиологических реакций на процедуры пассивной гипертермии (ПГ), включая определение сывороточных концентраций ирисина, мозгового нейротрофического фактора (МНТФ, BDNF), кортизола и инсулиноподобного фактора роста (ИФР1) у практически здоровых молодых людей в динамике двухнедельного курса процедур. Методы. 15 молодых мужчин прошли 2-недельный курс из 10 процедур ПГ: 40 мин в капсуле инфракрасного нагревания тела при 65–80°С (голова находится вне капсулы). Регистрировали ЧСС, АД, SрО2, температуру и массу тела до и после процедур ПГ. Уровень гормонов в сыворотке крови оценивали в динамике первой и десятой процедур и сравнивали с данными, полученными в ходе плацебо-процедур, проведенных с той же периодичностью и продолжительностью за 3 недели до курса ПГ. Результаты. В ходе всех процедур ПГ снижались значения систолического АД и SрО2, повышались ЧСС и температура тела в среднем на 2.0–3.2°С. Значения индекса физиологического напряжения в диапазоне 4–6 усл. ед., небольшой прирост кортизола только после 1-й процедуры свидетельствуют об умеренном тепловом стрессе при ПГ. Признак тепловой адаптации – увеличение потерь пота в течение курса. После первой и после 10-й процедур ПГ повысились концентрации ирисина (на 16 и 18.8% соответственно) и МНТФ (на 8.2 и 7%), причем после 10-й ПГ отмечена прямая связь между динамикой этих миокинов: rΔIrisin–ΔBDNF = 0.52 (р = 0.04). После плацебо-процедур изменений не наблюдалось. Вывод. Процедуры двухнедельного курса ПГ вызывают развитие умеренного теплового стресса, при котором наблюдаются адаптивные сдвиги. Концентрации ирисина и МНТФ повышались в динамике и первой и заключительной процедур. Предполагается, что ирисин и МНТФ – участники позитивных перекрестных эффектов адаптации к ПГ. Полученные результаты важны для развития технологий адаптационной медицины.
В современных условиях значительных экологических нагрузок все большую актуальность для сохранения психосоматического здоровья человека приобретает развитие технологий, основанных на тренировке естественных защитных ресурсов организма, его адаптационного потенциала [1]. Среди таких методов адаптационной медицины – контрастные температурные воздействия, гипоксические тренировки, физические нагрузки и пр. [1–3]. Адаптация к регулярным тепловым процедурам, пассивной гипертермии (ПГ) – один из распространенных подходов профилактической и реабилитационной медицины, применение которого может быть расширено при более четком методическом обосновании и раскрытии индуцируемых срочных и отсроченных эффектов [3]. Так, позитивное влияние гипертермии на результаты спортивной деятельности дискутируется [4, 5]. Согласно ранее проведенным нами исследованиям, адаптация к продолжительному курсу ПГ сопровождается ростом аэробной работоспособности и кардио-респираторной выносливости [6], повышает субъективные оценки качества жизни и уровень сывороточного мозгового нейротрофического фактора (МНТФ, brain-derived neurotrophic factor – BDNF) и белков теплового шока [7]. Одним из регуляторов синтеза МНТФ является миокин ирисин [8], что позволило предположить гипертермическую индукцию МНТФ опосредованной секрецией/высвобождением скелетными мышцами и адипоцитами этого тканевого гормона.
Интенсивно изучаемые в последнее время миокины рассматриваются как факторы, участвующие в формировании адаптивных изменений при физических тренировках, оказывая множественные ауто-, пара- и эндокринные эффекты [8–10]. Одним из наиболее известных и “привлекательных” с терапевтической точки зрения является ирисин: описаны его стимулирующие влияния на метаболизм, регенерацию мышечных и костной тканей, функцию эндотелия, антиоксидантную защиту, продукцию иных ростовых факторов (включая МНТФ) и даже замедление старения [8, 9, 11]. Пока не ясны механизмы регуляции секреции ирисина и ее взаимосвязь с другими веществами, участвующими в реакции организма на стресс, в том числе кортизолом и ростовыми факторами. Лучшее понимание интеграции между катаболическими, анаболическими гормонами и миокинами позволило бы адекватно оценивать и прогнозировать развитие перекрестных адаптивных эффектов при применении различных нелекарственных методов.
Вместе с физическими нагрузками, на образование ирисина оказывают влияние температурные воздействия. Так, обнаружена стимуляция его секреции при воздействии холодом как в эксперименте [12], так и в условиях арктического климата [13]. Этот эффект вполне логичен, учитывая активацию синтеза митохондриальных белков-разобщителей под влиянием ирисина. Предполагается, что кроме терморегуляции, такие белки важны для защиты тканей от чрезмерного окислительного стресса [11, 14].
Недавно описано повышение уровня ирисина в крови при выполнении акклиматизации спортсменов [15]. По данным других авторов, динамика содержания ирисина в сыворотке крови после физической нагрузки не зависит от температуры окружающей среды [16]. Изолированное влияние прогревания (без сочетания с упражнениями) на секрецию ирисина пока не изучено. На наш взгляд, это вполне возможно, учитывая положительные перекрестные эффекты гипертермии в отношении скелетных мышц [5]. Так, повторяющиеся тепловые воздействия поддерживают ферментативную активность митохондрий и ослабляют атрофию скелетных мышц у иммобилизованного человека [4].
Среди главных анаболических стимулов – инсулиноподобный фактор роста (ИФР1), уровень которого повышается под влиянием и физической нагрузки, и пассивного прогревания [10, 17]. ИФР1 модулирует эффекты и секрецию МНТФ [10], его связь с ирисином изучается [18].
Цель работы: оценка адаптивных “ответов” на процедуры пассивной гипертермии (ПГ), в том числе определение сывороточных концентраций ирисина, МНТФ, кортизола и ИФР1 у практически здоровых молодых людей в динамике курса двухнедельной адаптации к ПГ.
МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн исследования – сбалансированное, продольное, перекрестное. В исследование исходно было отобрано 23 относительно здоровых молодых добровольца. Все участники имели средний уровень ежедневной физической активности, оцененной применением опросника ВОЗ. Большинство имели минимальный предварительный опыт посещения сауны/бани – не регулярно и не чаще 1–2 раза в месяц (8 добровольцев сообщили о посещении сауны с частотой 2–3 раза в месяц). Сначала добровольцы прошли 10 псевдо-гипертермических (плацебо) процедур в течение 2 недель: находились в капсуле в течение 40 мин при температуре комфорта – 24–25°С. Через три недели по окончании первого этапа исследования (wash-out period) обследуемые прошли по 10 процедур ПГ, длительностью 40 мин каждая.
Гипертермические процедуры. Применялась капсула “Альфа Бэйсик” (Sybaritic Inc., Minnesota, США) инфракрасного прогревания. Во время процедуры испытуемый лежит внутри эргономичной капсулы, при этом голова находится снаружи, с возможностью обдува прохладным воздухом вентиляторами, инсталлированными в головной конец капсулы. Температуру в капсуле устанавливали в диапазоне 65–80°С, исходя из индивидуальной переносимости, определяемой̆ в тестовой̆ процедуре. Технические особенности капсул и методические детали проведения процедур описаны нами ранее [7]. Все участники были инструктированы посещать процедуры в первой половине дня, через 8–10 ч после приема пищи, в достаточно гидратированном состоянии, но не пить воду за 30 мин до и в течение всей процедуры. Участникам было рекомендовано не менять привычного режима, не заниматься интенсивными физическими тренировками.
Регистрация физиологических параметров. В динамике каждой̆ процедуры осуществляли мониторирование значений сатурации крови кислородом (SpO2) и ЧСС с помощью пульсоксиметра MD300 (BCE Tech, КНР). Температуру тела оценивали исходно, через 20 мин и по окончании процедуры (инфракрасный термометр AND DT-635, AND, Япония), учитывали усредненные данные двукратного измерения в обеих подмышечных областях. До и сразу после каждой̆ процедуры ПГ у обследуемого, находящегося в ложе капсулы, измеряли значения ЧСС, систолического и диастолического артериального давления (АД) (автоматический тонометр AND UA-767, AND, Япония). До и после каждой процедуры измеряли массу тела.
На основании регистрируемых параметров рассчитывали интегральные индексы, отражающие в целом переносимость обследуемым гипертермического стресса: индекс физиологического напряжения (ИФН) и интенсивность потоотделения за процедуру. ИФН (Physiological Strain Index – PSI) рассчитывался по следующей формуле: PSI = 5(Ts – To)/(39.5 – To) + 5(ЧССs – ЧССo)/(180 – ЧССo), где Ts и ЧССs – максимальные значения температуры тела обследуемого и ЧСС при гипертермическом стрессе, To и ЧССо – исходные значения температуры тела и ЧСС обследуемого. Диапазон вариаций ИФН от 0 (отсутствие напряжения), 4–5 – умеренное напряжение, до 10 (максимальный гипертермический стресс) [19]. Интенсивность потоотделения (ИП) определяли по формуле: ИП = Δm/ППТ, где Δm – разница массы тела, измеренной до и сразу после процедуры, ППТ – площадь поверхности тела обследуемого (формула Мостеллера Р.Д., 1987)
Забор крови и лабораторные измерения. До и после 1-й и 10-й плацебо- и ПГ процедур медицинской сестрой проводился забор 10 мл крови из вен предплечья в предварительно охлажденные пробирки объемом 10 мл, содержащие этилендиаминтетрауксусную кислоту с последующим ультрацентрифугированием (3500 об./мин при температуре 4°С, 15 мин) и сепарированием сыворотки в 4 микрокюветы по 1 мл в каждую, которые хранили затем при температуре –80°С. Определение концентраций веществ в образцах сыворотки проводили в сертифицированной лаборатории “ЭФИС” (Москва) одномоментно по всем пробам на одних планшетках.
Концентрацию МНТФ определяли методом твердофазного ИФА с использованием набора “CYT 306 BDNF Elisa Kit” фирмы Chemicon (США) согласно методике производителя на фотометре Multiskan original 352 (Labsystems, Финляндия). Полученные значения МНТФ сравнивали с нормативными показателями, отражающими интенсивность синтеза: 0–15 000 пг/мл – низкий уровень, 15 000–30 000 пг/мл – средний уровень, более 30 000 пг/мл – высокий уровень. Уровень ирисина определяли тем же методом с использованием набора “Irisin ELISA RAG018R” фирмы BioVendor RD (Чехия) согласно методике производителя, чувствительность – от 1 мкг/мл.
Уровень кортизола определяли хемилюминисцентным методом на аппарате Beckman Coulter UniCell Dxt 800 (полный автомат). Референсными данными, согласно сведениям производителя, считали концентрацию от 160 до 620 нмоль/л. Концентрацию ИФР1 в пробах сыворотки крови определяли хемилюминисцентным методом на аппарате Immulite 2000 Siemens (реагенты – Immulite 2000 IGF-1), референсные данные для обследуемой возрастной группы – 105–360 нг/мл.
Обработка данных. Данные в работе представлены как среднее и стандартное отклонение M ± SD. Проверка нормальности распределения проведена с применением критерия Колмогорова–Смирнова, для оценки достоверности внутри групп и межгрупповых различий показателей̆ в динамике использовали одновыборочный t-критерий и критерий Манна–Уитни соответственно. Корреляции между сдвигами показателей̆ в динамике наблюдений и их значимость оценены непараметрическим ранговым коэффициентом корреляции Спирмена с интерпретацией значений коэффициентов как сильные (r ≥ 0.6), средней силы (r = 0.59–0.40) и слабые (r = 0.39–0.20). Различия считали значимыми при р < 0.05. Анализ данных проводили с помощью программы Statistica 11.0.
Этические нормы. Все процедуры соответствовали этическим стандартам национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующих обновлений, одобрены локальным биоэтическим комитетом Первого МГМУ имени И.М. Сеченова (Сеченовский университет), протокол № 05-19 от 10.04.2019. От каждого из включенных в исследование участников было получено информированное добровольное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Из 23 участников, привлеченных к исследованию, 15 завершили полный̆ цикл плацебо и ПГ процедур, и только их данные включены в анализ результатов. Все обследуемые удовлетворительно переносили процедуры ПГ.
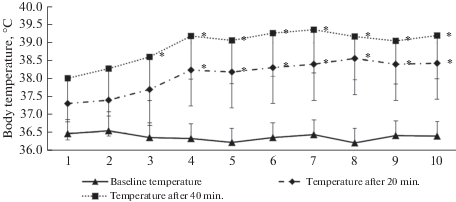
Ожидаемой̆ физиологической реакцией̆ на гипертермию было значимое повышение температуры тела в среднем на 2.0–3.2°С к концу процедур ПГ (в отличие от плацебо-процедур). Исходная температура в течение курса не изменялась, но заметна динамика ее прироста во время пребывания в капсуле (рис. 1). В конце 3-й процедуры и далее температура была значимо выше, чем по завершении первой. А начиная с 4-й процедуры, такие различия появлялись уже в середине процедур (через 20 мин от начала нагревания).
Рис. 1.
Усредненные значения температуры тела обследуемых в динамике 10 процедур пассивной гипертермии: исходно, через 20 мин от начала и в конце процедуры. По горизонтальной оси – номер процедуры; *р < 0.05 по сравнению с данными первой процедуры.
При проведении процедур ПГ отмечался типичный̆ гемодинамический̆ “ответ” в виде достоверного снижения значений систолического АД и прироста значений ЧСС (табл. 1), который описан в предыдущих исследованиях [7]. Отмечено также некоторое снижение значений SpO2 к концу процедуры ПГ.
Таблица 1.
Изменения артериального давления (АД), частоты сердечных сокращений (ЧСС) и насыщения гемоглобина кислородом (SpO2) при проведении процедур пассивной гипертермии (ПГ)
| Показатель | Этап | 1-я процедура | 5-я процедура | 10-я процедура | |||
|---|---|---|---|---|---|---|---|
| до | после | до | после | до | после | ||
| АД систолическое, мм рт. ст. | ПГ | 125.1 ± 13 | 115.5 ± 13.2 *p = 0.01 |
119.6 ± 9.0 | 113.5 ± 11 *p = 0.03 |
121.8 ± 11 | 113.5 ± 13 *p < 0.01 |
| Плацебо | 123.9 ± 11 | 118.8 ± 12 | 130.7 ± 12 **p = 0.008 |
119.9 ± 11.5 *p = 0.004 |
124.5 ± 11 | 122.1 ± 11.3 | |
| АД диастолическое, мм рт. ст. | ПГ | 69.1 ± 14.5 | 65.1 ± 13.5 | 66.9 ± 13.1 | 65.3 ± 10.5 | 69.1 ± 7.7 | 67.7 ± 11.4 |
| Плацебо | 77.6 ± 6.5 | 71.7 ± 10.9 | 82 ± 12.3 **p< 0.01 |
70.2 ± 6.7 *p = 0.002 |
75.7 ± 8 **p = 0.01 |
72.5 ± 9.3 | |
| ЧСС, уд/мин | ПГ | 81.9 ± 12.1 | 110.3 ± 17.8 *p = 0.001 |
83.9 ± 13.8 | 115.7 ± 13.1 *p < 0.001 |
80.5 ± 11.4 | 113.7 ± 9.6 *p < 0.001 |
| Плацебо | 83.8 ± 13.9 | 81.8 ± 16.7 **p=0.001 |
87.6 ± 15.1 | 82.9 ± 20.3 **p = 0.001 |
84.3 ± 12.7 | 75.4 ± 14.2 **p = 0.001 |
|
| SpO2, % | ПГ | 96.5 ± 1.2 | 96.3 ± 1.4 | 97.2 ± 0.8 | 95.9 ± 1.5 *p < 0.01 |
97.1 ± 1 | 95.9 ± 1.8 *p = 0.04 |
| Плацебо | 96.4 ± 0.9 | 96.9 ± 0.8 | 96.7 ± 1.1 | 96.5 ± 1.4 | 97.1 ± 0.8 | 96.9 ± 1.1 **p = 0.03 |
|
Значения интегративного показателя – ИФН были закономерно выше при ПГ в сравнении с плацебо (рис. 2a). Причем, они значимо повышались к пятой процедуре по отношению к значениям первой ПГ и далее стабилизировались, оставаясь на уровне индикаторов умеренного теплового стресса.
Рис. 2.
Значения индекса физиологического напряжения (a), интенсивность потопотерь (b) во время процедур пассивной гипертермии (PH) и плацебо: P1, P5, P10 – 1-я, 5-я, 10-я процедуры; *р < 0.05 по сравнению с первой процедурой; **р <0.05 по сравнению с плацебо-процедурами.
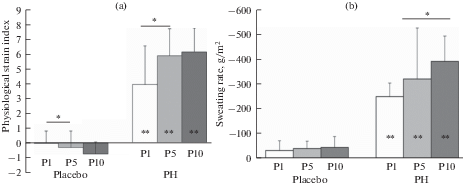
Потери пота в динамике плацебо-процедур были стабильно минимальными, в то время как в ходе адаптации к ПГ существенно увеличивались и, начиная с пятой процедуры, становились достоверно выше по отношению к первой ПГ (рис. 2b).
Из табл. 2 видно, что в динамике первой процедуры ПГ отмечается достоверное повышение концентрации в сыворотке крови значений МНТФ и ирисина, в отличие от процедуры “плацебо”, где их значения практически не изменялись. При этом значения кортизола в динамике ПГ менялись слабо, а при процедуре плацебо снижались, что можно трактовать как отсутствие чрезмерного теплового стресса (при плацебо сессии – снижение в результате релаксации). Значения ИФР1 были ниже как до, так и после первой ПГ в сравнении с плацебо процедурами.
Таблица 2.
Сывороточные концентрации мозгового нейротрофического фактора (МНТФ), ирисина, кортизола и инсулиноподобного фактора роста (ИФР-1) до и после процедур пассивной гипертермии (ПГ)
| Параметры | Этап | До 1-й процедуры | После 1-й процедуры | До 10-й процедуры | После 10-й процедуры |
|---|---|---|---|---|---|
| МНТФ, пг/мл | ПГ | 25 888 ± 4316 | 28 024 ± 5544 *р = 0.04 |
26 426 ± 4852 | 28 263 ± 4213 *р = 0.004 |
| плацебо | 27 950 ± 5121 | 27 084 ± 6487 | 25 915 ± 5867 | 24 064 ± 5600 **р = 0.035 |
|
| Ирисин, мкг/мл | ПГ | 5.0 ± 1.1 | 5.8 ± 1.3 *р = 0.001 |
5.3 ± 1.1 | 6.3 ± 1.6 *р = 0.001 |
| плацебо | 5.36 ± 1.66 | 5.33 ± 1.29 | 4.84 ± 1.74 | 5.4 ± 1.7 **р = 0.01 |
|
| Кортизол, нмоль/л | ПГ | 260.1 ± 83.2 | 277 ± 54.9 | 288.3 ± 103.4 | 270.5 ± 123.9 |
| плацебо | 305.7 ± 82.9 | 190.5 ± 70.6 **р = 0.005 |
265.8 ± 95.5 | 185.3 ± 91.0 | |
| ИФР-1, нг/мл | ПГ | 140.0 ± 49.9 | 154.7 ± 53.5 | 174.1 ± 45.3 | 164.0 ± 49.5 |
| плацебо | 211.1 ± 37.8 ** р= 0.003 |
198.33 ± 38.7 **р = 0.01 |
156.7 ± 58.2 | 150.2 ± 46.9 |
В пробах покоя до 1-й и 10-й процедур как плацебо, так и ПГ не выявлено какой-либо существенной динамики значений показателей ирисина, МНТФ, кортизола и ИФР1.
После 10-й процедуры плацебо сывороточные концентрации регистрируемых гормонов не изменялись. После ПГ вновь отмечен прирост уровней МНТФ и ирисина в том же диапазоне, что и при 1-й ПГ.
Между сдвигами анализируемых показателей во время первой процедуры ПГ связей не выявлено. В динамике 10-й процедуры отмечены значимые корреляции между ИФН и приростом значений ирисина (rИФН–Δирисин = 0.59, р = 0.03), а также между изменениями концентраций ирисина и МНТФ: (rΔИрисин–ΔМНТФ = 0.54, р = 0.04), что можно объяснить влиянием гипертермического стресса на выделение ирисина, с одной стороны, а с другой – индукцией ирисином секреции МНТФ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследовании установлено, что процедуры ПГ с применением индивидуальных инфракрасных капсул (без нагрева головы обследуемого), сопровождающиеся повышением температуры тела на 2.2–3.3°С, приводят к развитию умеренного теплового стресса, что проявлялось в повышении уровня ЧСС, гормонов, интегрального показателя ИФН. При этом, в отличие от данных других исследователей, о значительном повышении АД систолического и уровня кортизола (на 30–35%) в течение 15–20 мин пребывания в сауне (что авторы сопоставляют с эффектами интенсивных физических нагрузок) [20, 21], нами зарегистрировано снижение значений систолического АД практически в каждой из 10 процедур ПГ, а также небольшой прирост содержания кортизола, что подтверждает адекватность применяемой тепловой нагрузки. По данным [22], однократное повышение температуры ядра на 1–1.5°С (при пассивном нагревании нижних конечностей) не приводило к значимому росту уровня кортизола и АД, хотя величины ЧСС и минутный объем крови увеличивались. То есть, применяемая нами методика ПГ не вызывала чрезмерного кардиоваскулярного стресса, что важно при трансляции подходов и эффектов тепловых воздействий в прикладное русло.
В течение двух недель курса из 10 процедур ПГ выявлены адаптивные сдвиги к системной гипертермии, о которых свидетельствуют увеличение интенсивности потопотерь, стабилизация степени прироста температуры в процедурах и значений ИФН к середине курса, отсутствие повышения значений кортизола в динамике последней процедуры теплового стресса. Об адаптации системы терморегуляции говорит также динамика температуры тела в течение первых 4-х процедур: стимуляция теплоотдачи за счет увеличения величины периферического кровотока.
Представляется важной впервые выявленная динамика прироста значений миокина ирисина и МНТФ во время 1-й и 10-й процедур пассивной гипертермии. При этом в динамике заключительной процедуры ПГ выявлены значимые прямые корреляции между уровнем теплового стресса (ИФН) и степенью прироста ирисина, а также между степенью прироста ирисина и МНТФ. Ранее считалось, что температурные воздействия (акклиматизация) могут лишь потенцировать эффекты одномоментно выполняемых интенсивных физических нагрузок относительно динамики этих гормонов [12, 13, 15]. Можно предполагать, что механизм полученного нами эффекта может быть обусловлен прямым влияниям теплового стресса, оказывающего влияние на митохондриальное окисление в мышцах и экспрессию peroxisome proliferator-activated receptor coactivator 1 alpha (PGC-1α) [5]. Последний стимулирует синтез fibronectin type III domain-containing protein 5 (FNDC5), при протеолизе которого и образуется ирисин [8, 11]. Но регуляция этого процесса не изучена [9, 11]. Косвенно прямые эффекты теплового стресса подтверждает снижение значений АД и SpO2 во время ПГ, поскольку вазодилатация и снижение сродства гемоглобина к кислороду способствуют повышению утилизации кислорода тканями. Высокая эффективность воздействия высоких температур на экспрессию мРНК ростовых факторов в скелетных мышцах объясняется стимуляцией синтеза ряда белков теплового шока по данным [23].
Обнаруженная нами взаимосвязь прироста концентраций ирисина и МНТФ в определенной степени подтверждает предположение о реализации центральных эффектов ирисина через индукцию синтеза МНТФ. В пользу этого свидетельствуют данные нашего исследования о повышении фоновых значений МНТФ после длительного (10 недель) курса ПГ, что сопровождалось улучшением субъективных характеристик качества жизни, снижением уровня тревожности [7]. В настоящем исследовании фоновые концентрации МНТФ и ирисина до первой и десятой процедур ПГ не различались, что можно объяснить недостаточной продолжительностью периода адаптации к ПГ для долговременного потенцирования продукции МНТФ.
Динамику сывороточного ИФР1 под влиянием процедур гипертермии мы не обнаружили, в отличие от других авторов, например [17]. Учитывая данные литературы о связи ИФР1 с синтезом в скелетных мышцах МНТФ [10] и FNDC5 [18], а также тот факт, что эффекты ИФР1 напрямую могут не коррелировать с циркулирующим гормоном [24], роль этого фактора в адаптации еще требует изучения.
Стоит отметить, что ряд авторов указывают на взаимосвязь изменения концентрации веществ в сыворотке крови после гипертермии с изменением объема циркулирующей крови. Мы не проводили коррекцию полученных данных на объем циркулирующей крови, поэтому нельзя точно оценить вклад такого механизма в данном исследовании. Степень повышения уровня ирисина в динамике первой и заключительной процедур составляла 16–18.8% от исходных значений. Это вряд ли объясняется только уменьшением объема плазмы, учитывая динамику потопотерь. В то же время, повышение концентрации, даже за счет уменьшения объема, тем не менее приведет к изменению эффектов за счет степени связывания с рецептором [16]. Поэтому рост концентрации ирисина можно считать адаптивным эффектом ПГ.
Очевидно, требуются дополнительные исследования на здоровых участниках разного уровня физической подготовки с накоплением данных о позитивных (“острых” и долгосрочных) и негативных эффектах адаптации к периодической ПГ для “перевода” концепта “фитнес-сауны”, “бани для здоровья” в разряд превентивных и реабилитационных технологий адаптационной медицины.
ЗАКЛЮЧЕНИЕ
Процедуры ПГ с применением инфракрасных капсул приводят к развитию умеренного теплового стресса, что проявляется в динамике регистрируемых гемодинамических и гормональных показателей. В курсе процедур повторной гипертермии развиваются адаптивные перестройки, проявляющиеся в стабилизации степени терморегуляторного, кардиоваскулярного “ответа”, увеличении потоотделения на повторные тепловые процедуры. Впервые установлено повышение концентраций мышечного гормона ирисина и МНТФ при пассивной гипертермии со схожей степенью прироста показателей как в первой, так и в заключительной процедурах ПГ и значимой корреляцией между их динамикой к концу курса тренировок. Причем степень прироста ирисина достоверно связана с уровнем переносимого теплового стресса, что предполагает прямой эффект нагревания тканей на продукцию и высвобождение этого миокина. Эти факты указывают на еще один, возможно общий для раздражителей разной модальности (не только для гипертермии), путь интеграции адаптивных перестроек между периферическими тканями и ЦНС. Полученные данные помогают раскрытию физиологических основ положительной перекрестной адаптации и расширению перспектив прикладной адаптационной медицины.
Список литературы
Иванов АО, Барачевский ЮЕ, Грошилин СМ, Степанов ВА, Лобозова ОВ, Линченко СН, Караханян КС, Скокова ВЮ (2020) Неспецифические безмедикаментозные технологии для повышения устойчивости человека к переохлаждению. Экология человека 7: 51–58. [Ivanov AO, Barachevskii YuE, Groshilin SM, Stepanova VA, Lobozova OV, Linchenko SN, Karakhanyan KS, Skokova VYu (2020) Non-Specific Non-Medical Technologies to Inscrease Human Resistance to Hypothermia. Human Ecology 7: 51–58. (In Russ)]. doi:10.33396/1728-0869-2020-7-51-58
Нарыжная НВ, Воронков НС, Скрябина АА, Бушов ЮВ, Маслов ЛН (2020) Роль микроРНК, NO-синтаз, киназ, КАТФ-каналов в инфаркт-лимитирующем эффекте адаптации к гипоксии. Рос физиол журн им ИМ Сеченова 106(1): 3–16. [Naryzhnaya NV, Voronkov NS, Scriabina AA, Bushov YuV, Maslov LN (2020) The Role of microRNAs, NO Synthases, Kinases, KATP Channels in the Infarction-Limiting Effect of Adaptation to Hypoxia. Russ J Physiol 106(1): 3–16. (In Russ)]. https://doi.org/10.31857/S0869813920010112123
Hussain J, Cohen M (2018) Clinical Effects of Regular Dry Sauna Bathing: A Systematic Review. Evid Based Complement and Alternat Med 2018: 1857413https://doi.org/10.1155/2018/1857413
Hafen PS, Preece CN, Sorensen JR, Hancock CR, Hyldahl RD (2018) Repeated exposure to heat stress induces mitochondrial adaptation in human skeletal muscle. J Appl Physiol 125(5): 1447–1455. https://doi.org/10.1152/japplphysiol.00383.2018
Kim K, Monroe JC, Gavin TP, Roseguini BT (2020) Skeletal muscle adaptations to heat therapy. J Appl Physiol (1985) 128(6): 1635–1642. https://doi.org/10.1152/japplphysiol.00061.2020
Глазачев ОС, Кофлер В, Дудник ЕН, Запара МА, Самарцева ВГ (2020) Влияние адаптации к пассивной гипертермии на аэробную работоспособность и кардио-респираторную выносливость у спортсменов-любителей. Физиология человека 46(1): 66–73. [Glazachev OS, Kofler W, Dudnik EN, Zapara MA, Samartseva VG (2020) Impact of Adaptation to Passive Hyperthermia on Aerobic Performance and Cardio-Respiratory Endurance in Amateur Athletes. Human Physiology 46(1): 66–73. (In Russ)]. https://doi.org/10.1134/S0131164619060031
Глазачев ОС, Крыжановская СЮ, Дудник ЕН, Запара МА, Самарцева ВГ, Суста Д (2019) Адаптация к пассивной гипертермии: влияние на субъективные характеристики качества жизни, тревожности и уровень мозгового нейротрофического фактора (BDNF). Рос физиол журн им ИМ Сеченова 105(5): 544–555. [Glazachev OS, Kryzhanovskaya SYu, Dudnik EN, Zapara MA, Samarzeva VG, Susta D (2019) Passive Heat Acclimation: Influence on the Subjective Quality of Life, Anxiety and the Level of the Brain-Derived Neurotrophic Factor (BDNF). Rus J Physiol 105(3): 544–555. (In Russ)]. https://doi.org/10.1134/S0869813919050030
Кузник БИ, Давыдов СО, Степанов АВ (2018) Роль мышечного гормона ирисина в регуляции физиологических функций в норме и патологии. Усп физиол наук 49(4): 59–80. [Kuznik BI, Davydov SO, Stepanov AV (2018) The role of irisin hormone in the regulation of physiological functions in normal and pathological conditions. Progress Physiol Science 49(4): 59–80. (In Russ)]. https://doi.org/10.7868/S0301179818040057
Хавинсон ВХ, Кузник БИ, Рыжак ГА, Линькова НС, Салль ТС, Чалисова НИ (2018) Ирисин, бетатрофин, сахарный диабет, ожирение и метаболический синдром. Эпигенетические механизмы регуляции. Усп физиол наук 49(1): 72–86. [Khavinson VKh, Kuznik BI, Ryzhak GA, Linkova NS, Sall TS, Chalisova NI (2018) Irisin, betatrophin, diabetes, obesity, and metabolic syndrome. Epygenetic regulatory mechanisms. Progress Physiol Science 49(1): 72–86. (In Russ)].
Pinho RA, Aguiar AS, Radák Z (2019) Effects of resistance exercise on cerebral redox regulation and cognition: An interplay between muscle and brain. Antioxidants 8 (11): 529. https://doi.org/10.3390/antiox8110529
Askari H, Rajani SF, Poorebrahim M, Haghi-Aminjan H, Raeis-Abdollahi E, Abdollahi M. (2018) A glance at the therapeutic potential of irisin against diseases involving inflammation, oxidative stress, and apoptosis: An introductory review. Pharmacol Res 129: 44–55. https://doi.org/10.1016/j.phrs.2018.01.012
Lee P, Linderman JD, Smith S, Brychta RJ, Wang J, Idelson C, Celi FS (2014) Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans. Cell Metab 19(2): 302–309. https://doi.org/10.1016/j.cmet.2013.12.017
Coker RH, Weaver AN, Coker MS, Murphy CJ, Gunga HC, Steinach M (2017) Metabolic Responses to the Yukon Arctic Ultra: Longest and Coldest in the World. Med Sci Sports Exerc 49(2): 357–362. https://doi.org/10.1249/MSS.0000000000001095
Schreckenberg R, Klein J, Kutsche HS, Schulz R, Gömöri K, Bencsik P, Schlüter K (2020) Ischaemic post-conditioning in rats: Responder and non-responder differ in transcriptome of mitochondrial proteins. J Cell Mol Med 24: 5528–5541. https://doi.org/10.1111/jcmm.15209
McCormick JJ, Notley SR, Yardley JE, Sigal RJ, Kenny GP (2020) Blunted circulating irisin in adults with type 1 diabetes during aerobic exercise in a hot environment: a pilot study. Appl Physiol Nutr Metab 45(6): 679–682. https://doi.org/10.1139/apnm-2019-0624
Bubak M, Heesch M, Shute R, Dinan N, Laursen T, Slivka D (2017) Irisin and Fibronectin Type III Domain-Containing 5 Responses to Exercise in Different Environmental Conditions. Med Sci Sports Exerc 49: 287. https://doi.org/10.1249/01.mss.0000517645.29830.b5
Yoon SJ, Lee MJ, Lee HM, Lee JS (2017) Effect of low-intensity resistance training with heat stress on the HSP72, anabolic hormones, muscle size, and strength in elderly women. Aging Clin Exp Res 29(5): 977–984. https://doi.org/10.1007/s40520-016-0685-4
Srinivasa S, Suresh C, Mottla J, Hamarneh SR, Irazoqui JE, Frontera W, Makimura H (2016) FNDC5 Relates to Skeletal Muscle IGF-I and Mitochondrial Function and Gene Expression in Obese Men with Reduced Growth Hormone. Growth Horm & IGF Res 26: 36–41.https://doi.org/10.1016/j.ghir.2015.12.008
Moran DS, Shitzer A, Pandolf K (1998) A physiological strain index to evaluate heat stress. Am J Physiol Regul Integr Comp Physiol 275(1): R129–R134. https://doi.org/10.1152/ajpregu.1998.275.1.R129
Pilch W, Pokora I, Szyguła Z, Pałka T, Pilch P, Cisoń T, Malik L, Wiecha S (2013) Effect of a single finnish sauna session on white blood cell profile and cortisol levels in athletes and non-athletes. J Hum Kinet 39: 127–135. https://doi.org/10.2478/hukin-2013-0075
Ketelhut S, Ketelhut RG (2019) The blood pressure and heart rate during sauna bath correspond to cardiac responses during submaximal dynamic exercise. Compl Therap Med 44: 218–222. https://doi.org/10.1016/j.ctim.2019.05.002
Hashizaki T, Nishimura Y, Teramura K, Umemoto Y, Shibasaki M, Leicht CA, Kouda K, Tajima F (2018) Differences in serum IL-6 response after 1 °C rise in core body temperature in individuals with spinal cord injury and cervical spinal cord injury during local heat stress. Int J Hyperthermia 35(1): 541–547. https://doi.org/10.1080/02656736.2018.1511838
Kuhlenhoelter AM, Kim K, Neff DD, Nie Y, Blaize AN, Wong BJ, Roseguini BT (2016) Heat therapy promotes the expression of angiogenic regulators in human skeletal muscle. Am J Physiol-Regulatory, Integr Comp Physiol 311(2): R377–R391. https://doi.org/10.1152/ajpregu.00134.2016
Kraemer WJ, Ratamess NA, Hymer WC, Nindl BC, Fragala MS (2020) Growth Hormone(s), Testosterone, Insulin-Like Growth Factors, and Cortisol: Roles and Integration for Cellular Development and Growth with Exercise. Front Endocrinol 11: 33. eCollection. https://doi.org/10.3389/fendo.2020.00033
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


