Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 8, стр. 996-1006
Сравнительная оценка влияния основных медиаторов острофазового ответа (ИЛ-1, ФНО-α и ИЛ-6) на паттерн дыхания и выживаемость крыс при острой нарастающей гипоксии
Ж. А. Донина 1, *, Е. В. Баранова 1, Н. П. Александрова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: zdonina@mail.ru
Поступила в редакцию 27.04.2021
После доработки 27.05.2021
Принята к публикации 06.06.2021
Аннотация
Актуальной проблемой современной медицины является выявление терапевтических мишеней для подавления “цитокинового шторма” при коронавирусной болезни (COVID-19), осложненной острым респираторным дистресс-синдромом (ОРДС) с сопутствующей гипоксемией. Однако ключевой цитокин и его относительный вклад в патогенез ОРДС, приводящий к высокой смертности, до сих пор не определен. В работе проведена сравнительная оценка влияния повышенного системного уровня провоспалительных цитокинов ИЛ-1β, ФНО-1α и ИЛ-6 на основные компоненты дыхательного цикла (паттерн дыхания) и выживаемость крыс в условиях прогрессивно нарастающей острой гипоксии. Нарастание гипоксии воспроизводили методом “возвратного дыхания” (от нормоксии до апноэ), регистрировали дыхательный объем, частоту дыхания, минутный объем дыхания, оксигенацию крови (SpO2), время наступления апноэ, процент выживаемости в постгипоксический период. Cравнительный анализ проводили при легкой, умеренной и тяжелой степени гипоксии (FIO2 = 15, 12 и 8%). Показано, что нарастающая гипоксия сопровождается резким угнетением компенсаторного роста вентиляции легких у крыс с повышенным системным уровнем ИЛ-1β и ФНО-α. Внутривенное введение ИЛ-6, напротив, вызывает интенсивное повышение вентиляции легких по мере нарастания гипоксии. Острая гипоксия (FIO2 < 8%) у всех крыс сопровождалась нарушением ритмичного дыхания, переходящего в апноэ. Постгипоксическое восстановление дыхания (выживание) у групп с ИЛ-1β и ФНО-1α составляло 50%, а с введением ИЛ-6 только 10% по сравнению с контролем. Результаты свидетельствуют, что повышенный уровень ИЛ-6, несмотря на отсутствие дисфункции дыхания на начальном этапе развития патологического процесса, приводит к большей смертности крыс, чем ИЛ-1β и ФНО-1α, что позволяет считать ИЛ-6 ранним прогностическим биомаркером высокого риска летального исхода при тяжелой степени гипоксии.
Известно, что неспецифическим универсальным ответом организма на действие повреждающих экзо- и эндогенных факторов, вызванных внедрением вирусной или бактериальной инфекции, является системная воспалительная реакция [1]. Развитие системной воспалительной реакции обусловлено неконтролируемой массивной продукцией медиаторов острофазового ответа, включая провоспалительные цитокины – интерлейкин-1β (ИЛ-1β), интерлейкин-6 (ИЛ-6), фактор некроза опухоли-альфа (ФНО-α) и многие другие биологически активные вещества [2]. Выработка большого количества медиаторов воспаления приводит к активации иммунных клеток и высвобождению последними новой порции медиаторов вследствие наличия неконтролируемой положительной обратной связи между этими процессами [3]. Возникает порочный круг, который вызывает разрушение тканей очага воспаления, распространение реакции на соседние ткани, выход провоспалительных цитокинов в кровеносное русло. В результате воспаление приобретает системный, генерализованный характер, охватывая весь организм в целом.
В настоящее время доказано, что каскадное высвобождение цитокинов, именуемое “цитокиновым штормом”, ассоциируется с полиорганной недостаточностью [4, 5], где в большинстве случаев органом-мишенью являются легкие [6]. Гиперактивация иммунного ответа может вызвать развитие острого респираторного дистресс-синдрома, характеризующегося пневмонией, экссудативным поражением, снижением эластических свойств легких, тромбоэмболией легочной артерии, нарушением вентиляционно-перфузионных отношений в легких и ухудшением газообмена, что в конечном итоге грозит остановкой дыхания и летальным исходом [7]. Имеются данные, что тяжесть протекания заболевания и внутрибольничная смертность пациентов усугубляются основным проявлением острого респираторного дистресс-синдрома – быстро нарастающей гипоксемией [8, 9], вызывающей дополнительную экспрессию провоспалительных цитокинов в крови, таких как ФНО-α, ИЛ-1β и ИЛ-6 [10]. Клинические наблюдения обнаружили наличие тесной связи между степенью и продолжительностью гипоксемии и смертностью у пациентов с острым респираторным дистресс-синдромом [11].
Имеются доказательства, что среди множества высвобождающихся цитокинов при системной воспалительной реакции одним из основных медиаторов вирусной пневмонии является ИЛ-1β, используемый в качестве биомаркера при классификации тяжести заболевания [7]. ИЛ-1β – наиболее изученный плейотропный цитокин, эффекты действия которого сходны с ФНО-α, также относящегося к основным провоспалительным цитокинам, который в свою очередь способствует выработке других цитокинов, в том числе и ИЛ-6 [12]. Этот цитокин, обладающий как провоспалительными, так и противовоспалительными свойствами, экспрессируется стромальными и иммунными клетками, а его высвобождение регулируется, в частности, ИЛ-1β и фактором некроза опухолей ФНО-α [13]. Кроме того, любой воспалительный стимул увеличивает экспрессию ИЛ-6, что также может служить триггером для ИЛ-1β и ФНО-α. Масштабные клинические исследования, проведенные на госпитализированных пациентах с диагнозом COVID-19, установили, что в отличие от легкой формы тяжелое и критическое течение заболевания отличается высокой экспрессией ИЛ-6, что коррелирует с дыхательной недостаточностью, вторичными инфекциями и смертностью. Повышенный уровень ИЛ-6 был связан с риском летального исхода также у пациентов с острым респираторным дистресс-синдромом без COVID-19 [6, 14].
В настоящее время в условиях пандемии коронавирусной болезни COVID-19, интенсивно разрабатываются новые подходы к терапии системного воспаления, такие как торможение продукции и активности провоспалительных цитокинов, стимуляция синтеза антивоспалительных цитокинов, поиск терапевтических мишеней для подавления цитокинового шторма. Кроме того, учитывая высокий уровень внутрибольничной смертности, существует необходимость выявления ранних прогностических биомаркеров, позволяющих стратифицировать госпитализированных пациентов в соответствии с вероятностью риска летального исхода.
Важным критерием для диагноза, расшифровки патогенеза, определения прогноза и терапевтической тактики лечения является совокупность отдельных компонентов дыхательного цикла: глубина, частота дыхания, минутная вентиляция легких и др. (паттерн дыхания), который изменяется с началом и прогрессированием респираторных заболеваний. Однако относительный вклад ИЛ-1β, ИЛ-6 и ФНО-α в изменение паттерна дыхания на фоне прогрессивной гипоксемии практически не изучен.
В связи с вышеизложенным, целью настоящей работы явилась сравнительная оценка влияния ключевых провоспалительных цитокинов ИЛ-1β, ИЛ-6 и ФНО-α на паттерн дыхания, оксигенацию крови и уровень летальности при нарастающей гипоксии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций России. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ – Приказом Минздрава России от 01.04.2016 № 199н “Об утверждении Правил надлежащей лабораторной практики” (Зарегистрировано в Минюсте России 15.08.2016 № 43232), принципам Базельской декларации и рекомендациям биоэтического комитета ФГБУН Института физиологии им. И.П. Павлова РАН.
Исследование выполнено в острых экспериментах на 58 крысах Вистар массой 280–300 г, наркотизированных уретаном (1000 мг/кг, внутрибрюшинно). Глубина анестезии контролировалась по степени выраженности корнеального рефлекса. Крысы были разделены на 5 групп: 1-я – интактная (виварный контроль), 2-ой группе (контроль) вводили 1 мл физиологического раствора (0.9%-ный раствор NaCl), 3-ей – интерлейкин-1β (ИЛ-1β, 500 нг в 1 мл физиологического раствора, рекомбинантный ИЛ-1β человека, ФГУП Гос. НИИ ОЧБ ФМБА, Россия); 4-ой – фактор некроза опухолей-α (ФНО-α, 40 мг/кг, Sigma, США), 5-ой – интерлейкин-6 (ИЛ-6, 50 мкг/кг, Sigma, США).
После регистрации фоновых значений в условиях нормоксии в бедренную вену вводили исследуемые препараты, и через 70 мин крыс переключали на дыхание гипоксической смесью с прогрессивным снижением кислорода (от нормоксии до полной остановки дыхания), используя метод “возвратного дыхания” [15]. Фиксировали время наступления и длительность гипоксического апноэ, фракционное содержание О2 во вдыхаемой газовой смеси (FIO2), выживаемость (летальность) в постгипоксическом периоде в % по отношению к контрольной группе. Прекращение дыхательной активности в течение 1 мин приравнивали к гибели животных. В ходе эксперимента изучаемые показатели регистрировали непрерывно на каждой минуте, сравнительную оценку проводили при FIO2 = 15, 12 и 8%.
Основные показатели внешнего дыхания – объемную скорость инспираторного потока (Vi), дыхательный объем (ДО), частоту дыхания (ЧД), регистрировали пневмотахографическим методом. Минутный объем дыхания (МОД) рассчитывали как произведение ЧД и ДО. Для измерения внутригрудного (внутриплеврального) давления (ВГД) использовали баллонографический метод. Оксигенацию крови (SpO2%) определяли методом пульсоксиметрии, используя ветеринарный пульсоксиметр типа UT (Zoomed, Россия). FIO2 во вдыхаемой смеси измеряли анализатором кислорода ПГК-06 (Инсовт, Санкт-Петербург), диоксида углерода (FIСO2) – многокомпонентным газоанализатором МАГ-6П (Эксис, Москва). Эвтаназию животных после эксперимента осуществляли передозировкой уретана.
Сигналы пневмотахограммы и внутригрудного давления оцифровывались и сохранялись на твердом диске персонального компьютера при помощи аппаратно-программного комплекса, созданного на основе устройства сбора биологических данных Biograf-7 (разработка ГУАП, Санкт-Петербург, Россия).
Статистический анализ данных производился с использованием пакетов программы Statistica 10.0 (Windows) и Microsoft Office Excel 2020. Для проверки выборки на нормальность распределения использовали тест Колмогорова–Смирнова, уровень значимости составлял р ≥ 0.2, это свидетельствовало о том, что групповые выборки данных подчинялись закону нормального распределения. Затем оценивали значения до и после инъекций препаратов, используя парный критерий Стьюдента и двухфакторный дисперсионный анализ (ANOVA) для факторов “гипоксия–нормоксия” и “контроль–препарат”. Различия считали достоверными при p < 0.05, данные на рисунках и в таблице представлены в виде среднего значения ± ошибка средней (M ± SE).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как следует из табл. 1, в условиях нормоксии достоверные изменения всех исследованных показателей наблюдались только при повышении ИЛ-1β, влияние ФНО-α вызывало повышение ДО и МОД, ИЛ-6 не оказывал влияния на параметры внешнего дыхания.
Таблица 1.
Средние значения показателей внешнего дыхания и оксигенация крови у крыс после введения NaCl, ИЛ-1β, ФНО-α и ИЛ-6 в условиях нормоксии
| Показатели | Интактные (n = 10) |
Через 70 мин после введения препаратов | |||
|---|---|---|---|---|---|
| NaCl
(контроль) (n = 12) |
ИЛ-1β (n = 12) |
ФНО-α (n = 12) |
ИЛ-6 (n = 12) |
||
| Дыхательный объем, мл | 0.9 ± 0.2 | 1.0 ± 0.2 | 2.3 ± 0.4* | 1.4 ± 0.2* | 1.2 ± 0.1 |
| Частота дыхания, мин–1 | 80 ± 5 | 83 ± 4 | 93 ± 5* | 78 ± 1 | 79 ± 0.1 |
| Минутный объем дыхания, мл/мин | 90.2 ± 7.1 | 92.3 ± 6.5 | 214.9 ± 7.0** | 120.5 ± 5.4* | 95.2 ± 4.3 |
| Внутригрудное давление, см водн. ст. | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.7 ± 0.2* | 0.6 ± 0.1 | 0.6 ± 0.1 |
| Насыщение артериальной крови кислородом, % | 96 ± 1 | 95 ± 1 | 88 ± 3* | 95 ± 2 | 84 ± 4* |
При гипоксическом воздействии в контрольной группе при легкой (15% О2) и умеренной (12% О2) степени гипоксии наблюдался интенсивный прирост МОД – на 63 ± 12 и 60 ± 10% (p < 0.05 соответственно) по сравнению с нормоксией, при острой гипоксии (8% О2) МОД увеличивался в меньшей степени – на 36 ± 7% (рис. 1c).
Рис. 1.
Приросты показателей внешнего дыхания на нарастающую гипоксию у крыс с повышенным уровнем ИЛ-1β, ФНО-α и ИЛ-6. Данные представлены как среднее ± ошибка средней (M ± SE), (n = 12 в каждой группе); * р < 0.05 по сравнению с нормоксией, # р < 0.05 по сравнению с контролем (введение физиологического раствора). По оси абсцисс – исследованные группы; по оси ординат – приросты в % от нормоксии: панель (a) –дыхательный объем, (b) – частота дыхания, (c) – минутная вентиляция легких, (d) – внутригрудное давление. На рис. 1 показано, что резкое ослабление вентиляторной реакции на прогрессирующую гипоксию наблюдалось при повышении системного уровня ИЛ-1β и ФНО-α. ИЛ-6 не подавлял вентиляторную реакцию на усиление гипоксии, вызывая лишь незначительное снижение частоты дыхания, но не влияя на другие параметры по сравнению с контрольными животными.

Подобная динамика МОД при гипоксии наблюдалась и у крыс с введением ИЛ-1β и ФНО-α, различия касались степени прироста, который был значительно ниже, чем у контрольных крыс. Так, у крыс с ИЛ-1β МОД на уровне 15% О2 повышался на 20 ± 7%, при 12% О2 – на 18 ± 8%, а при 8% О2 прирост МОД отсутствовал, его величина соответствовала значениям при нормоксии (рис. 1c). В группе с ФНО-α при 15% О2 МОД повышался на 10 ± 3%, при 12% О2 – на 18 ± 4% (р > 0.05 соответственно), на уровне 8% О2 прироста МОД не происходило. Снижение приростов МОД при гипоксии у крыс с повышенным уровнем ИЛ-1β и ФНО-α происходило в результате уменьшения приростов инспираторных колебаний внутригрудного давления и ДО (рис. 1a, d). Частота дыхания при легкой и умеренной степени гипоксии изменялась незначительно. И в контрольной, и в экспериментальных группах достоверное уменьшение ЧД наблюдалось лишь при тяжелой степени гипоксии (8% О2) (рис. 1b).
У крыс с повышенным системным уровнем ИЛ-6 наблюдалась противоположная динамика изменений респираторных параметров. По мере нарастания гипоксии наблюдалось существенное увеличение прироста МОД относительно нормоксии. Так, при 15% О2 прирост МОД составлял 20 ± 3% (p > 0.05), при 12% О2 – 50 ± 9%, при 8% О2 – 72 ± 13% (p < 0.05 соответственно). При этом наблюдалось достоверное увеличение приростов ДО и ВГД, превышающее при тяжелой степени гипоксии соответствующие значения, зарегистрированные в контрольной группе (рис. 1a, d). ЧД снижалась в меньшей степени, чем у животных других групп.
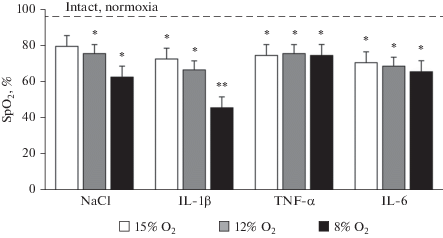
Оксигенация крови (SpO2%) по мере нарастания гипоксии уменьшалась во всех исследованных группах по сравнению с контролем при нормоксии (95%). Максимально выраженное снижение SpO2% (до 46%) наблюдалось у крыс с ИЛ-1β при острой степени гипоксии, при этом динамика падения SpO2% по мере нарастания гипоксии была сравнима с контролем. У крыс с ФНО-α SpO2 стабилизировалась на уровне 75%, независимо от степени нарастания гипоксии (рис. 2). Влияние ИЛ-6 также вызывало снижение сатурации по мере нарастания гипоксии, при максимальной степени гипоксии (FIO2 = 8%) SpO2 составляла 66%.
Рис. 2.
Влияние гипоксии различной степени на оксигенацию крови у крыс с повышенным уровнем ИЛ-1β, ФНО-α и ИЛ-6. Данные представлены как среднее ± ошибка средней (M ± SE), (n = 12 в каждой группе); * р < 0.05, ** p < 0.001 по сравнению с интактными крысами при нормоксии. По оси абсцисс – исследованные группы; по оси ординат – абсолютные значения оксигенации (SpO2), пунктирная линия соответствует исходным значениям SpO2 у контрольных крыс при нормоксии.
Нарастающая острая гипоксия (FIO2 < 8%) во всех сериях сопровождалась нарушением ритмичного дыхания, переходящего в апноэ. Однако следует отметить, что остановка дыхания у исследованных групп возникала при разной степени гипоксии: в контрольной группе апноэ наблюдалось при FIO2 3–4% О2, в группах с введением ИЛ-1β – 7–8% О2, с ФНО-α – 3–4% О2, ИЛ-6 – 6–7% О2. Постгипоксическое восстановление инспираторной активности (выживаемость) у групп с повышенным уровнем ИЛ-1β и ФНО-α уменьшалось в 2 раза по сравнению с контролем, т.е. дыхание восстанавливалось только у 50% экспериментальных животных, тогда как в контрольной группе выживаемость составляла 100%. Наибольший уровень летальности был выявлен у крыс с введением ИЛ-6, у которых спонтанное восстановление дыхания в постгипоксическом периоде наблюдалось только в 10% случаев.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сравнительный анализ респираторных эффектов трех ключевых провоспалительных цитокинов показал, что у крыс с введением ИЛ-1β и ФНО-α снижается компенсаторное увеличение легочной вентиляции на гипоксическую стимуляцию по сравнению с контролем, в то время как действие ИЛ-6 оказывает противоположный эффект, т.е. не угнетает, а повышает прирост вентиляции легких по мере усиления гипоксического воздействия. Особенно резкие различия наблюдаются при действии тяжелой степени гипоксии (8% О2).
Отрицательная динамика приростов МОД внутри отдельных исследованных групп (контроль, ИЛ-1β и ФНО-α ) наблюдалась на фоне положительной динамики ВГД и ДО и была вызвана существенным снижением частоты дыхательных движений. Наиболее резкое снижение частоты дыхания наблюдалось при тяжелой степени гипоксии. Вместе с тем, при положительной динамике ВГД и ДО в группах с повышенным системным уровнем ИЛ-1β и ФНО-α прирост этих параметров был значительно ниже, чем в контрольной группе животных. При тяжелой степени гипоксии на фоне действия ИЛ-6 частота дыхания снижалась в меньшей степени, чем в контрольной группе, а прирост ДО соответствовал контрольному уровню. В результате МОД при сочетанном воздействии тяжелой гипоксии и ИЛ-6 был выше, чем в контрольной и других экспериментальных группах.
К настоящему времени установлено, что цитокины ИЛ-1β и ФНО-α вовлечены в нейроиммунные взаимодействия в областях мозга, ответственных за центральную регуляцию дыхания. Это подтверждают данные, указывающие, что рецепторы IL-1β и ФНО-α обнаружены в ядре солитарного тракта и вентролатеральном отделе продолговатого мозга [12, 16, 17]. Также установлено, что ИЛ-1β и ФНО-α экспрессируются на сенсорных клетках каротидного тела, снижая чувствительность гломусных клеток к дефициту кислорода [18]. Следовательно, нейроиммунные взаимодействия, опосредованные ИЛ-1β и ФНО-α могут участвовать и в периферических механизмах регуляции дыхания, модулирующих реакцию на гипоксию и насыщение артериальной крови кислородом. Как было показано на модели острого воспаления легких, в бронхоальвеолярной жидкости и ткани легкого повышается уровень ИЛ-1β и ФНО-α, но не ИЛ-6 [19].
Кроме того, в отличие от ИЛ-1β и ФНО-α, ИЛ-6 обладает не только провоспалительными, но и противоспалительными свойствами [20]. Более того, ИЛ-6 классифицируется как миокин, экспрессируемый мышечными волокнами при физической нагрузке [21]. Показано, что ИЛ-6 проявляет противоспалительные свойства при сокращении мышц, а повышенный уровень ИЛ-6 в плазме дополнительно вызывает экспрессию более мощных антивоспалительных цитокинов – ИЛ-10 и антагониста рецепторов ИЛ-1β и в то же время ингибирует синтез провоспалительного цитокина ФНО-α [21]. Эти данные могут в некоторой степени объяснить полученные нами различия в реакциях внешнего дыхания на нарастающую гипоксию между группами с повышенным системным уровнем ИЛ-1β, ФНО-α и группой с повышенным уровнем ИЛ-6.
Результаты нашего исследования указывают на то, что ИЛ-6 в меньшей степени влияет на систему внешнего дыхания, чем ИЛ-1β и ФНО-α. Установлено, что он не оказывает прямого негативного воздействия на основную инспираторную мышцу – диафрагму [22]. Полученные нами результаты согласуются с этими данными, поскольку в условиях нормоксии ИЛ-6 не вызывал снижения внутригрудного давления, отражающего общее усилие инспираторных мышц. Нарастающая гипоксия на фоне действия ИЛ-6 вызывала усиление сокращений инспираторных мышц, увеличение внутригрудного давления и соответствующее повышение вентиляции легких. Однако несмотря на отсутствие дыхательной недостаточности и значительного снижения сатурации у этой группы крыс, выживаемость составляла только 10% по сравнению с контролем, т.е. была в 5 раз меньше, чем у других экспериментальных групп. Обнаруженные нами факты можно объяснить следующими причинами. Известно, что в клинической практике для выявления гипоксемии часто используется неинвазивный метод пульсоксиметрии (SpO2), который, однако, отображает не истинное напряжение кислорода в артериальной крови (PaO2), а насыщение гемоглобина кислородом. В соответствии с физиологическими принципами [23] высвобождение кислорода из гемоглобина в кровь зависит прежде всего от положения кривой диссоциации оксигемоглобина, имеющей S-образную форму. Гипокапния и респираторный алкалоз, возникающие в результате гипервентиляции, смещая кривую диссоциации влево, увеличивают сродство гемоглобина к кислороду, затрудняя его переход в кровь, что объясняет высокий уровень SpO2 при очень низком PaO2 [24]. Подобное несоответствие между тяжестью гипоксемии и незначительным дыхательным дискомфортом, так называемая “тихая гипоксия” или “счастливая гипоксия” было обнаружено у больных с COVID-19 [8], а также в условиях пребывания здоровых людей на высоте, когда гипокапния значительно сдвигает кривую диссоциации оксигемоглобина и повышает насыщение гемоглобина кислородом [25]. Исходя из этих фактов, можно предположить, что одной из вероятных причин высокой смертности у крыс с введением ИЛ-6 может являться тяжелая артериальная гипоксемия, несмотря на сохранение SpO2 и отсутствие признаков дыхательной недостаточности [26]. У крыс с повышенным уровнем ИЛ-1β и ФНО-α наблюдалось значительное угнетение легочной вентиляции при нарастающей гипоксии, в этих условиях гиповентиляция неизбежно сопровождается гиперкапнией [27]. Возможно, что отсутствие гипокапнии в этих группах способствовало более высокой выживаемости животных.
Выявленные различия в уровне насыщения артериальной крови кислородом при нарастающей гипоксии между исследуемыми группами, позволяют говорить о наличии множественных механизмов влияния исследуемых цитокинов на развитие гипоксемии. Имеются данные о том, что помимо изменения положения кривой диссоциации оксигемоглобина возможно влияние цитокинов непосредственно на гемовую группу гемоглобина [28], образование внутрилегочного шунтирования [29], нарушение вентиляционно-перфузионных отношений и диффузионной способности легких [30], появление внутрисосудистых микротромбов [31] и др.
Кроме того, более высокий уровень летальности животных при действии ИЛ-6, несмотря на отсутствие декомпенсации дыхательной функции, мог быть связан с его негативным влиянием не на дыхательную, а на сердечно-сосудистую систему. Показано, что микроинъекция ИЛ-6 непосредственно в ядро солитарного тракта модулирует входные (афферентные) сигналы от барорецепторов, участвуя в регуляции сердечно-сосудистой системы [32].
Таким образом, ИЛ-1β, ФНО-α и ИЛ-6 в условиях прогрессивно нарастающей гипоксии оказывают различное модулирующее влияние на паттерн дыхания, насыщение гемоглобина кислородом и выживаемость крыс после гипоксического апноэ. ИЛ-1β, ФНО-α вызывают острую дыхательную недостаточность, развивающуюся уже на ранней стадии развития патологического процесса, в результате угнетения компенсаторного увеличения легочной вентиляции на возрастающий гипоксический стимул, опосредованное нарушением центральных и периферических механизмов регуляции дыхания. ИЛ-6, несмотря на отсутствие явных признаков дыхательной декомпенсации, в отличие от ИЛ-1β и ФНО-α приводит к большей смертности крыс, вероятно, в результате более быстрого нарастания артериальной гипоксемии. Полученные факты могут служить основанием для оценки системного уровня ИЛ-6 в качестве раннего прогностического биомаркера вероятности (высокого риска) летального исхода при тяжелых формах острого респираторного дистресс-синдрома.
Список литературы
Симбирцев АС, Тотолян АА (2015) Цитокины в лабораторной диагностике. Инфекционные болезни: Новости Мнения Обучение 2: 82–98. [Simbircev AS, Totolyan AA (2015) Cytokines in laboratory diagnosis. Infectious diseases: News Views Education 2: 82–98. (In Russ)].
Hocker AD, Stokes AJ, Powell FL, Huxtable AG (2017) The impact of inflammation on respiratory plasticity. Exp Neurol 287: 243–253. https://doi.org/10.1016/j.expneurol.2016.07.022
Behrens EM, Koretzky GA (2017) Review: Cytokine storm syndrome: Looking toward the precision medicine era. Arthritis & Rheumatol 69: 1135–1143. https://doi.org/10.1002/art.40071
Azkur AK, Akdis M, Azkur D, Sokolowska M, Van De Veen W, Bruggen MC, O’Mahony L, Gao Y, Nadeau K, Akdis AC (2020) Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. Allergy 75: 1564–1581. https://doi.org/10.1111/all.14364
Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H, Zhi L, Wei H, Zhang Z, Qiu Y, Wang J, Wang A (2020) Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine Growth Factor Rev 53: 38–42. https://doi.org/10.1016/j.cytogfr.2020.04.002
Liu BW, Li M, Zhou ZG, Guan X, Xiang YF (2020) Can we use interleukin-6 (IL-6) blockade for coronavirus disease 2019 (COVID-19)-induced cytokine release syndrome (CRS)? J Autoimmun 111: 102452. https://doi.org/10.1016/j.jaut.2020.102452
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Han G, Xu J, Gu X, Cheng Z, Yu T, Wei Y, Wu W, Xie X, Yin W, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B (2020) Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395: 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Dhont S, Eric Derom E, Braeckel EV, Depuydt P, Lambrecht BN (2020) The pathophysiology of ‘happy’ hypoxemia in COVID-19. Respirat Res 21: 198. https://doi.org/10.1186/s12931-020-01462-5
Xie J, Covassin N, Fan Z, Singh P, Gao W, Li G, Kara T, Somers VK (2020) Association between hypoxemia and mortality in patients with COVID-19. Mayo Clin Proc 95: 1138–1147. https://doi.org/10.1016/j.mayocp.2020.04.006
Bein T, Grasso S, Moerer O, Quintel M, Guerin C, Deja M, Brondani M, Mehta S (2016) The standard of care of patients with ARDS: ventilatory settings and rescue therapies for refractory hypoxemia. Intensive Care Med 42: 699–711. https://doi.org/10.1007/s00134-016-4325-4
Gilbert JA (2018) Advancing towards precision medicine in ARDS. Lancet Respir Med 6: 494–495. https://doi.org/10.1016/S2213-2600(18)30156-5
Yee-Hsee H, Litvin DG, Abigail RZ, Nethery DE, Thomas ED, Jacono FJ (2020) Brainstem inflammation modulates the ventilatory pattern and its variability after acute lung injury in rodents. J Physiol 598: 2791–281. https://doi.org/10.1113/JP280060
Hunter CA, Jones SA (2015) IL-6 as a keystone cytokine in health and disease. Nat Immunol 16: 448–457. https://doi.org/10.1038/ni.3153
Somers EC, Eschenauer GA, Troost JP, Golob JL, Gandhi TN, Wang L, Zhou N, Petty LA, Baang JH, Dillman NO, Frame D, Gregg KS, Kaul DR, Nagel J, Patel TS, Zhou S, Lauring AS, Hanauer DA, Martin E, Sharma P, Fung CM, Pogue JM (2020) Tocilizumab for treatment of mechanically ventilated patients with COVID-19. Clin Infect Dis 2020 ciaa954 https://doi.org/10.1093/cid/ciaa954
Донина ЖА, Баранова ЕВ, Александрова НП (2019) Ингибирование гиперпродукции оксида азота в условиях прогрессивно нарастающей гипоксии на фоне действия ИЛ-1β снижает выживаемость крыс после острой гипоксии. Рос физиол журн им ИМ Сеченова 105: 1514–1525. [Donina ZhA, Baranova EV, Alexandrova NP (2019) Inhibition of the hyperproduction of nitric oxide during progressively increasing hypoxia under the action of IL-1β reduces the survival of rats after acute hypoxia. Russ J Physiol 105: 1514–1525. (In Russ)]. https://doi.org/10.1134/S0869813919120033
Probert L (2015) TNF and its receptors in the CNS: The essential, the desirable and the deleterious effects. Neuroscience 302: 2–22. https://doi.org/10.1016/j.neuroscience.2015.06.038
Baig AM, Khaleeq A, Ali U, Syeda H (2020) Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem Neuroscie 11: 995–998. https://doi.org/10.1021/acschemneuro.0c00122
Liu X, He L, Stensaas L, Dinger B, Fidone S (2009) Adaptation to chronic hypoxia involves immune cell invasion and increased expression of inflammatory cytokines in rat carotid body. Am J Physiol Lung Cell Mol Physiol 296: 158–166. https://doi.org/10.1152/ajplung.90597.2008
Jacono FJ, Mayer CA, Hsieh Y-H, Wilson CG, Dick TE (2011) Lung and brainstem cytokine levels are associated with breathing pattern changes in a rodent model of acute lung injury. Respir Physiol Neurobiol 178: 429–438. https://doi.org/10.1016/j.resp.2011.04.022
Petersen AMW, Pedersen BK (2005) The anti-inflammatory effect of exercise. J Appl Physiol 98: 1154–1162. https://doi.org/10.1152/japplphysiol.00164.2004
Pedersen BK, Akerstrom TCA, Nielsen AR, Fischer CP (2007) Role of myokines in exercise and metabolism. J Appl Physiol 103: 1093–1098. https://doi.org/10.1152/japplphysiol.00080.2007
Janssen SPM, Gayan-Ramirez G, Van den Bergh A, Herijgers P, Maes K, Verbeken E, Decramer M (2005) Interleukin-6 causes myocardial failure and skeletal muscle atrophy in rats. Circulation 111: 996–1005. https://doi.org/10.1161/01.CIR.0000156469.96135.0D
Hamilton C, Steinlechner B, Gruber E, Simon P, Wollenek G (2004) The oxygen dissociation curve: quantifying the shift. Perfusion 19: 141–144. https://doi.org/10.1191/0267659104pf734oa
Woyke S, Rauch S, Strohle M, Gatterer H (2021) Modulation of Hb-O2 affinity to improve hypoxemia in COVID-19 patients. Clin Nutr 40: 38–39. https://doi.org/10.1016/j.clnu.2020.04.036
Sainburg RL, Clark AL, Billman GE, Schlader ZJ, Mündel T, Milne K (2012) Hypoxia, focus hypobaric hypoxia. Encycl Exerc Med Heal Dis Springer Berlin Heidelberg 428–431. Epub ahead of print.
Verity R, Okell L, Dorigatti I, Winskill P, Whittaker C, Imai N, Cuomo-Dannenburg G, Thompson H, Walker P, Fu H, Dighe A, Griffin JT, Baguelin M, Bhatia S, Boonyasiri A, Cori A, Cucunubá Z, FitzJohn R, Gaythorpe K, Green W, Hamlet A, Hinsley W, Laydon D, Nedjati-Gilani G, Riley S, Elsland S, Volz E, Wang H, Wang Y, Xi X, A Donnelly C, Ghani AC, Ferguson NM (2020) Estimates of the severity of coronavirus disease 2019: a model-based analysis. Lancet Infect Dis 20: 669–677. https://doi.org/10.1016/S1473-3099(20)30243-7
Kimura D, Totapally BR, Raszynski A, Ramachandran C, Torbati D (2008) The effects of CO2 on cytokine concentrations in endotoxin-stimulated human whole blood. Crit Care Med 36: 2823–2827. https://doi.org/10.1097/CCM.0b013e318186f556
Liu W, Hualan L (2020) COVID-19: Attacks the 1-Beta chain of hemoglobin and captures the porphyrin to inhibit human heme metabolism. Chem Rxiv. Epub ahead of print. https://doi.org/10.26434/chemrxiv.11938173.v4
Komorowski M, Aberegg S (2020) Using applied lung physiology to understand COVID-19 patterns. Br J Anaesth 125: 250–253. https://doi.org/10.1016/j.bja.2020.05.019
Ottestad W, Hansen TA, Pradhan G, Stepanek J, Hoiseth LO, Kasin JL (2017) Acute hypoxia in a simulated high-altitude airdrop scenario due to oxygen system failure. J Appl Physiol 123: 1443–1450. https://doi.org/10.1152/japplphysiol.00169.2017
Jia HP, Look DC, Shi L, Hickey M, Pewe L, Netland J, Farzan M, Wolford-Lenane C, Perlam S, Paul B, McCray Jr (2005) ACE2 receptor expression and severe acute respiratory syndrome coronavirus infection depend on differentiation of human airway epithelia. J Virol 79: 14614–14621. https://doi.org/10.1128/JVI.79.23.14614-14621.2005
Takagishi M, Waki H, Bhuiyan ME, Gouraud SS, Kohsaka A, Cui H, Yamazaki T, Paton JF, Maeda M. Takagishi M, Waki H, Bhuiyan ME, Gouraud SS, Kohsaka A, Cui H, Yamazaki T, Paton JF, Maeda M (2010) IL-6 microinjected in the nucleus tractus solitarii attenuates cardiac baroreceptor reflex function in rats. Am J Physiol Regul Integr Comp Physiol 298:183–190. https://doi.org/10.1152/ajpregu.00176.2009
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


