Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 9, стр. 1162-1171
Влияние различных режимов физических нагрузок на состояние системы гемостаза и концентрацию белка ирисина в эксперименте
Ю. А. Бондарчук 1, 2, *, И. И. Шахматов 1, 2, И. Н. Манаева 1, 2, В. М. Раевских 1, П. С. Маршалкина 1, Д. А. Прокопец 1
1 Алтайский государственный медицинский университет
Барнаул, Россия
2 Научно-исследовательский институт нейронаук и медицины
Новосибирск, Россия
* E-mail: bondarchukb606@yandex.ru
Поступила в редакцию 01.12.2020
После доработки 05.02.2021
Принята к публикации 02.03.2021
Аннотация
В настоящее время актуальным является поиск немедикаментозных методов сохранения здоровья и увеличения продолжительности жизни людей. Известно, что умеренные физические нагрузки способствуют активному долголетию. Важная роль в адаптации к физическим тренировкам принадлежит системе гемостаза, изменение показателей которой может влиять на развитие осложнений со стороны сердечно-сосудистой системы в ответ на физический стресс. В 2012 г. был открыт гормон ирисин, уровень которого снижается с увеличением возраста. Белок ирисин синтезируется во время физической нагрузки и препятствует развитию возрастных заболеваний, в том числе гипертонической болезни, болезней Паркинсона и Альцгеймера. Цель исследования – разработка оптимального режима физических нагрузок, сохраняющего гемостазиологические параметры в пределах нормы и приводящего к увеличению концентрации белка ирисина в крови. Исследования выполнены на молодых крысах-самцах линии Вистар. В течение 30 дней опытные животные подвергались физическим нагрузкам в виде ходьбы в тредбане со скоростью 6–8 м/мин. Животные первой опытной группы подвергались физическим нагрузкам ежедневно в течение 2-х ч, животные второй группы подвергались 2-часовым физическим нагрузкам в режиме 3 раза в неделю (понедельник, среда, пятница). Показано, что в первой опытной группе на фоне признаков гиперкоагуляции уровень ирисина увеличивался на 130%. Во второй опытной группе признаки гиперкоагуляции отсутствовали, при этом концентрация ирисина повышалась на 225%. Таким образом, более эффективным режимом физических нагрузок для крыс является принудительная ходьба в тредбане в течение 2 ч со скоростью 6–8 м/мин 3 раза в неделю на протяжении 30 дней.
ВВЕДЕНИЕ
В связи с постоянным увеличением продолжительности жизни и, как следствие, старением общества, поиск немедикаментозных методов сохранения здоровья и продления активного долголетия людей пожилого и старческого возраста в настоящее время становится все более актуальной задачей. Известно, что физические тренировки повышают иммунитет, предотвращают развитие метаболических заболеваний и способствуют активному долголетию [1–4]. При этом выбор оптимального по интенсивности и кратности режима физических нагрузок, оказывающего максимально благотворное влияние на организм, нуждается в дополнительном обосновании, основанном, в том числе, и на данных исследования регуляторных молекул, выявленных на протяжении последнего десятилетия.
В 2012 г. группа ученых, работавшая под руководством Shpiegelman (Бостон, США), обнаружила специфический белок ирисин, вырабатывающийся при физической нагрузке, синтез которого снижается по мере старения [5]. Установлено, что под воздействием ирисина происходит переход белого жира в бурый, который, в свою очередь, связан с химической терморегуляцией [6]. Доказана тесная связь между концентрацией ирисина и длиной теломер – маркеров продолжительности жизни клетки [7–12]. Повышение концентрации белка ирисина в крови сопровождается улучшением течения “возрастных” заболеваний, в том числе, гипертонической болезни [13, 14], а также болезней Паркинсона и Альцгеймера [15]. Доказано, что выделение ирисина связано с физической работой, однако также установлено, что не любая физическая нагрузка приводит к увеличению его концентрации в крови [5].
Ирисин содержится в мышцах и крови на определенном уровне, независимо от физической работы. Так, в частности, методом вестерн-блоттинга установлено, что концентрация ирисина увеличивается сразу после однократной интенсивной принудительной физической нагрузки (бег на беговой дорожке) [16], которая, в свою очередь, может приводить к ухудшению течения заболеваний сердечно-сосудистой системы и сопутствующих патологий. Следовательно, актуальным является поиск режимов физических тренировок, которые бы сопровождались увеличением концентрации ирисина в крови, и при этом не приводили к развитию патологических состояний со стороны системной гемодинамики.
В развитии осложнений со стороны сердечно-сосудистой системы в ответ на физический стресс важная роль принадлежит системе гемостаза [17, 18], сбалансированность отдельных звеньев которой во многом обеспечивает процессы адаптации к физическим нагрузкам [19]. Система гемостаза является одной из наиболее реактивных систем организма, и ее роль в процессах адаптации не вызывает сомнения [20]. Известно, что тридцатидневные физические тренировки приводят к завершенной долговременной адаптации [20] и широко используются в клинике для профилактики риска развития сердечно-сосудистых заболеваний.
Исходя из этого, целью исследования явилась разработка оптимального режима физических нагрузок, сохраняющего гемостазиологические параметры в пределах нормы и приводящего к увеличению концентрации белка ирисина в крови.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на 54 крысах-самцах линии Вистар в возрасте 12–13 нед., массой 250–300 г. Животные были размещены в клетках с полубарьерной системой в экологически контролируемых условиях с 12-часовыми светлым и темным циклами, при комнатной температуре 22.5 ± 0.28°С и влажности воздуха 50–60%. Пресная водопроводная вода и корм находились в свободном доступе. Животные были разделены на две контрольные и две опытные группы. Крысы первой контрольной группы (n = 12) ежедневно помещались в индивидуальные отсеки неподвижного тредбана на 2 ч в течение 30 дней. Во второй контрольной группе (n = 12) крысы находились по 2 ч в отсеках неподвижного тредбана 3 раза в неделю (понедельник, среда, пятница) на протяжении 30 дней. Таким образом, животные контрольных групп не подвергались физическим нагрузкам. Крысы, составлявшие опытные группы, подвергались 2-часовой принудительной ходьбе в тредбане со скоростью 6–8 м/мин на протяжении 30 дней в двух разных режимах: животные первой опытной группы (n = 12) подвергались ежедневным физическим нагрузкам, крысы второй опытной группы (n = 18) – физическим нагрузкам в режиме 3 раза в неделю (понедельник, среда, пятница). Физические нагрузки проводили в вечернее время с 18 до 22 ч, что соответствует времени бодрствования крыс.
С целью адаптации к новому помещению, за неделю до эксперимента всех животных в виварии помещали в стандартные условия содержания. Проведение экспериментов на крысах осуществляли в соответствии с директивой 2010/63/EU Европейского парламента (Совет от 22 сентября 2010 г.) по охране позвоночных животных, используемых в эксперименте [21]. Обезболивание и умерщвление животных проводили в соответствии с “Правилами проведения работ с использованием экспериментальных животных”. Работа была одобрена этическим комитетом Алтайского государственного медицинского университета Минздрава РФ (протокол № 8 от 22.10.2018 г.).
Перед забором крови предварительно производили наркотизацию путем внутрибрюшинного введения раствора телазола из расчета 14 мг/кг массы тела животного. Для исследования системы гемостаза, кровь получали из печеночного синуса в объеме 5 мл, из которых 0.4 мл крови без добавления цитрата натрия использовали для проведения низкочастотной пьезотромбоэластографии. Остальную порцию крови помещали в полистироловые центрифужные пробирки с полихлорвиниловыми крышками, содержащими 0.11 М (3.8%) раствор цитрата натрия (соотношение крови и стабилизатора 9 : 1). Кровь центрифугировали при 1200 g в течение 15 мин для получения обедненной тромбоцитами плазмы крови.
Оценку гемостатического потенциала крови у животных производили методом НПТЭГ – низкочастотной пьезотромбоэластографии, на аппарате АРП-01М “Меднорд” (Россия) с использованием специальной компьютерной программы ИКС ГЕМО-3 [22, 23].
Оценивали следующие показатели:
t3 – время свертывания крови, мин [Blood clotting time, min].
t5 – время формирования фибрин-тромбоцитарной структуры сгустка, мин [Time of formation of the fibrin-platelet structure of the clot, min].
ИПС – интенсивность полимеризации сгустка, о.е. [ICP – Intensity of clot polymerization, r.u.].
В рамках экспериментальных исследований системы гемостаза также применяли интегральный метод калиброванной автоматизированной тромбографии по Hemker (2003) [24, 25] с использованием планшетного флуориметра Fluoroskan Ascent при длине волны 390 нм (фирма ThermoFisher SCIENTIFIC, Финляндия), с программным обеспечением Thrombinoscope®3.0.0.26 и наборами реагентов фирмы Thrombinoscope® bv (Нидерланды) (PPP-Reagent, Thrombin Calibrator, FluCa-Kit). Коагуляцию исследуемой плазмы крови осуществляли в 96-луночном планшете типа Immulon 2HB (фирма ThermoFisher SCIENTIFIC, США). Оценивали следующие показатели тромбографии:
– Lagtime, мин – время инициации образования тромбина [Lagtime, min – thrombin initiation time].
– ETP, нмоль мин – эндогенный тромбиновый потенциал [ETP, nmol min – endogenous thrombin potential].
– Peack thrombin, нмоль – пиковая концентрация тромбина [Peack thrombin, nmol – peak thrombin concentration].
– ttPeak (time to peak), мин – время достижения пиковой концентрации тромбина [ttPeak (time to peak), min – time of reaching peak thrombin concentration].
Для определения концентрации ирисина, по истечении 30 дней эксперимента осуществляли забор крови для получения сыворотки у контрольных и опытных животных. Кровь для исследования белков в объеме 2 мл получали путем забора из печеночного синуса в одноразовый полистироловый шприц с широкой иглой, не содержащий антикоагулянт. Полученную сыворотку замораживали при температуре минус 70°С. Перед процедурой анализа образцы размораживали при комнатной температуре. Содержание ирисина выявляли методом иммуноферментного анализа (ИФА) с применением специальных наборов для крыс фирмы USCN Cloud Clone Corp (США) на аппарате Chem Well (США).
Статистическую обработку данных проводили с использованием пакета статистического программного обеспечения MedCalc Version 17.9.7 (лицензия BU556-P12YT-BBS55-YAH5M-UBE51). Для статистической обработки результатов исследования применяли непараметрический U-критерий Манна–Уитни. Данные непараметрических совокупностей представлены в виде медианы (Ме) и квартилей [25 и 75%]. Для всех тестов статистически достоверными считали различия, уровень значимости которых отвечал условию р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
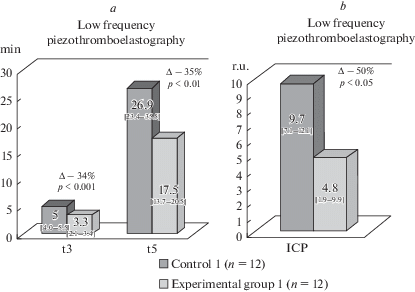
У животных, подвергавшихся ежедневным 2-часовым нагрузкам, отмечалось снижение показателей пьезотромбоэластографии по сравнению с контрольной группой. Так, время свертывания крови (t3) уменьшалось на 34%, что свидетельствовало о сдвиге точки желирования влево и характеризовало состояние хронометрической гиперкоагуляции. Параллельно с этим отмечалось снижение времени достижения максимальной амплитуды (t5) на 35%, что подтверждало гиперкоагуляционные изменения в первой опытной группе. При этом отмечалось снижение показателя ИПС (интенсивность полимеризации сгустка) на 50% в группе животных, подвергавшихся ежедневным физическим нагрузкам по сравнению с группой контроля (рис. 1). Этот показатель характеризует полимеризационный этап фибриногенеза, а именно – латеральную сборку фибрина, следовательно, можно предположить, что этот процесс у данных крыс был угнетен. Во второй опытной группе показатели пьезотромбоэластографии не имели достоверных отличий от значений, зарегистрированных у контрольных животных.
Рис. 1.
Изменение показателей гемостаза по данным пьезотромбоэластографии после 30-дневных физических нагрузок. Результаты представлены в виде (Ме [25–75%]), где Ме – медиана в выборочной совокупности; [25–75%] – 25-й и 75-й перцентиль. ∆ – статистически значимая разница опытной группы с контрольной группой при p < 0.05; р – уровень статистической значимости различий опытной группы 1 (ежедневные 2-часовые тренировки) с контрольной группой 1. (a) – время свертывания крови (t3), мин; время формирования фибрин-тромбоцитарной структуры сгустка (t5), мин; (b) – интенсивность полимеризации сгустка (ИПС), о. е.
По данным калиброванной автоматизированной тромбографии, у животных, составлявших первую опытную группу, регистрировались признаки нарастания тромбинемии, что проявлялось в увеличении эндогенного тромбинового потенциала (ЕТР) на 24%, повышении пиковой концентрации тромбина (Peak) на 13% и укорочении времени достижения максимальной концентрации тромбина (ttPeak) на 5.6% по сравнению с контролем. У крыс второй опытной группы показатели тромбографии не отличались от таковых у контрольных животных (табл. 1).
Таблица 1.
Изменение показателей гемостаза по данным калиброванной автоматизированной тромбографии у контрольных и опытных животных после 30-дневных физических нагрузок
| Показатели | Контрольная группа 1 (n = 12) |
Опытная группа 1 (n = 12) |
Контрольная группа 2 (n = 12) |
Опытная группа 2 (n = 18) |
|---|---|---|---|---|
| Lagtime, мин | 1.67 [1.57–2.00] |
2.00 [1.67–2.00] р1–2 = 0.47 |
1.67 [1.57–2.00] | 1.63
[1.46–1.80] р3–4 = 0.32 |
| ETP, нмоль мин | 326.1 [277.4–378.4] |
404.6 [380.5–453.7] р1–2 < 0.05 (∆1+24%) |
326.1 [277.4–378.4] |
348.1 [310.7–387.3] р3–4 = 0.93 |
| Peack thrombin, нмоль | 92.7 [84.6–101.3] |
105.0 [99.7–109.3] р1–2 < 0.05 (∆1+13%) |
92.0 [80.4–107.0] |
90.5 [80.8–95.4] р3–4 = 0.58 |
| ttPeak, мин | 4.24 [4.14–4.33] |
4.00 [3.92–4.00] р1–2 < 0.01 (∆1 – 5%) |
3.80 [3.67–3.90] |
3.80 [3.72–3.89] р3–4 = 0.66 |
Результаты представлены в таблице в виде (Ме [25–75%]), где Ме – медиана в выборочной совокупности; [25–75%] – 25-й и 75-й перцентиль; ∆1 – статистически значимая разница опытной группы 1 с контрольной группой 1 при p < 0.05; р1–2 – уровень статистической значимости различий опытной группы 1 (ежедневные 2-часовые физические нагрузки) с контрольной группой 1; р3–4 – уровень статистической значимости различий опытной группы 2 (физические нагрузки в режиме 3 раза в неделю) с контрольной группой 2; n – количество животных в исследуемой группе.
Результаты проведенного иммуноферментного анализа показали, что у животных 1-й и 2-й контрольных групп концентрация ирисина в сыворотке достоверно не отличалась. В первой опытной группе после ежедневных физических нагрузок уровень ирисина увеличивался на 133% (р = 0.04), в то время как у крыс второй опытной группы, тренировавшихся в режиме три раза в неделю, концентрация ирисина повышалась на 225% (р = 0.001) по сравнению с контрольной группой (рис. 2). Зафиксированное отличие концентрации ирисина между экспериментальными группами оказалось статистически значимым. Во второй опытной группе содержание ирисина было на 86% выше, чем в первой опытной группе (р = 0.03).
Рис. 2.
Изменения концентрации ирисина после 30-дневных физических нагрузок. Результаты представлены в виде (Ме [25–75%]), где Ме – медиана в выборочной совокупности; [25–75%] – 25-й и 75-й перцентиль. ∆ – статистически значимая разница опытной группы с контрольной группой при p < 0.05; р – уровень статистической значимости различий опытной группы с контрольной группой. (a) – изменение концентрации ирисина в опытной группе 1 по сравнению с контролем 1 (ежедневные 2-часовые физические нагрузки). (b) – изменение концентрации ирисина в опытной группе 2 по сравнению с контролем 2 (2-часовые физические нагрузки в режиме 3 раза в неделю).
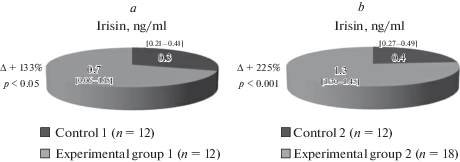
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Различные режимы физических нагрузок могут вызывать как адаптивные, так и дизадаптивные ответные реакции со стороны организма. Раскрытие закономерностей реакции системы гемостаза на различные режимы физической активности имеет существенное значение для разработки тренировочных методик и предотвращения различных проявлений внутрисосудистого свертывания крови [13, 14].
Известно, что физическая нагрузка приводит к повышению агрегационной активности тромбоцитов, увеличению экспрессии тканевого фактора и активатора плазминогена эндотелиальными клетками, в результате чего развивается гиперкоагуляция с активацией фибринолитической системы [26]. В предшествующих работах нами было показано, что многократные двухчасовые физические тренировки по сравнению с более длительными являются наиболее оптимальными, так как сопровождаются гипокоагуляционной направленностью и приводят к долговременной адаптации со стороны системы гемостаза [20]. К тридцатому дню тренировочного процесса наблюдается приближение гемостазиологических параметров к нормальным значениям, однако в наших экспериментах у животных первой опытной группы сохранялась тенденция к повышению свертывающей активности крови. Следовательно, режим физических тренировок, используемый во второй опытной группе, оказался более благоприятным и приводил к полной долговременной адаптации со стороны системы гемостаза, проявляющейся в нормализации ее параметров.
Любой стресс, в том числе и физический, активирует все защитные системы организма, такие как белки теплового шока (HSP), врожденный и приобретенный иммунитет, систему гемостаза, белки острой фазы воспаления (БОВ), а также влияет на уровень белков “молодости и старости” [27, 28]. При мышечной деятельности в скелетных мышцах повышается содержание фактора транскрипции PGC1α (Peroxisome proliferator-activated receptor gamma coactivator 1α), что приводит к появлению мембранного белка FNDC5, который расщепляется с образованием ирисина, выделяемого в кровь [29]. Вместе с коактиватором PPAR-γ (Peroxisome proliferator-activated receptor gamma) PGC1α в бурых жировых клетках активирует производство белка термогенина (UCP1). Ирисин, взаимодействуя с белыми жировыми клетками, также индуцирует экспрессию термогенина, который, в свою очередь, расщепляет протеин 1-UCP-1 (uncoupling protein-1) и запускает процесс перехода белых адипоцитов в бурые [5]. Бурая жировая ткань оказывает существенное влияние на обмен веществ, и ее количество обратно коррелирует с индексом массы тела [30]. Таким образом, физическая нагрузка приводит к увеличению в мышцах PGC1α, а, следовательно, и к повышению концентрации ирисина [5, 31].
Последующие исследования [32] показали, что регулярные тренировки повышали уровень ирисина в плазме крови в определенный момент, однако при дальнейшем продолжении тренировок роста концентрации ирисина в крови не наблюдалось. Возможно, что в процессе тренировок формируется адаптивный механизм, в результате которого постоянно тренирующиеся люди становятся менее зависимыми от содержания ирисина, либо более чувствительными к его действию. Интенсивная физическая работа сопровождается увеличением производства свободных радикалов и окислительным стрессом, с вовлечением в процесс эндоплазматического ретикулума, что при чрезмерной нагрузке может приводить к повреждению и гибели мышечных волокон. С другой стороны, переходные стадии процесса перекисного окисления и стресса эндоплазматического ретикулума необходимы для полноценной адаптации при регулярных физических нагрузках. Митохондрии играют основную роль в генерации энергии и тесно связаны со стрессом эндоплазматического ретикулума и окислительным стрессом. В то же время экспрессия гена FNDC5 и повышение концентрации ирисина при физических нагрузках связаны с транскрипционным фактором PGClα и практически не зависят от стресса эндоплазматического ретикулума [33].
По данным литературы [34], особенно много ирисина содержится в сердечной мышце, а также в перикарде как до, так и после физической нагрузки. В скелетных мышцах мышей концентрация ирисина незначительна. Данный факт говорит о том, что при физической нагрузке ирисин выделяется в кровь основном из сердечной мышцы.
Возможно, что при ежедневных физических нагрузках, несмотря на более интенсивное образование ирисина, происходит его расход в больших количествах на местную регуляцию метаболических процессов. Следовательно, концентрация ирисина в крови после ежедневных нагрузок может быть ниже, чем после нагрузок в режиме 3 раза в неделю.
Режим ежедневных физических тренировок не может предоставить организму достаточного времени для полноценного восстановления в мышцах общих запасов энергетических веществ, служащих субстратами анаэробных биохимических реакций. В то же время физические тренировки в режиме 3 раза в неделю увеличивают степень совершенства компенсаторных механизмов, которые обеспечивают поддержание гомеостаза при мышечной деятельности в анаэробных условиях. Данный режим ускоряет процесс развития тканевой адаптации, что позволяет выполнять мышечную работу даже при выраженных изменениях внутренней среды (накопление лактата, кетоновых тел, сдвиг рН, снижение содержания углеводов).
Существенное превышение уровня ирисина в крови, обнаруженное нами по окончании курса физических нагрузок, получаемых трижды в неделю, по сравнению с ежедневными нагрузками, является еще одним подтверждением вышеизложенной концепции. Определение уровня ирисина в крови можно рассматривать в качестве маркера, позволяющего мониторить оптимальный уровень физических нагрузок.
Таким образом, экспериментальным путем установлено, что для сохранения показателей системы гемостаза в пределах нормальных значений наиболее эффективным режимом физических нагрузок для крыс является принудительная ходьба в тредбане в течение 2 ч со скоростью 6–8 м/мин 3 раза в неделю на протяжении 30 дней. При этом данный режим тренировок сопровождается существенным повышением концентрации белка ирисина в плазме крови.
Список литературы
Reimers CD, Knapp G, Reimers AK (2012) Does physical activity increase life expectancy? A review of the literature. J Aging Res 12: 243–258. https://doi.org/10.1155/2012/243958
Samitz G, Egger M, Zwahlen M (2011) Domains of physical activity and all-cause mortality: systematic review and dose-response meta-analysis of cohort studies. Int J Epidemiol 40(5): 1382–400. https://doi.org/10.1093/ije/dyr112
Warburton DE, Charlesworth S, Ivey A, Nettlefold L, Bredin SS (2010) A systematic review of the evidence for Canada’s physical activity guidelines for adults. Int J Behav Nutr Phys Act 7: 39. https://doi.org/10.1186/1479-5868-7-39
Pesce M, Ballerini P, Paolucci T, Puca I, Hosein Farzaei M, Patruno A (2020) Irisin and Autophagy: First Update. Int J Mol Sci 21: 7587. https://doi.org/10.3390/ijms21207587
Belviranli M, Okudan N, Kabak B, Erdogan M, Karanfilci M (2016) The relationship between brain-derived neurotrophic factor, irisin and cognitive skills of endurance athletes. Phys Sportsmed 44(3): 290–296. https://doi.org/10.1080/00913847.2016.1196125
Jeremic N, Chaturvedi P, Tyagi SC (2017) Browning of white fat: novel insight into factors, mechanisms, and therapeutics. J Cell Physiol 232(1): 61–68.
Rana KS, Arif M, Hill EJ, Aldred S, Nagel D, Nevill A, Randeva HS, Bailey CJ, Bellary S, Brown JE (2014) Plasma irisin levels predict telomere length in healthy adults. Age (Dordr) 36(2): 995–1001. https://doi.org/10.1007/s11357-014-9620-9
Brailoiu E, Deliu E, Sporici RA, Brailoiu GC (2015) Irisin evokes bradycardia by activating cardiac-projecting neurons of nucleus ambiguous. Physiol Rep 3(6): e12419. https://doi.org/10.14814/phy2.12419
Salpea KD, Humphri SE (2010) Telomere length in atherosclerosis and diabetes. Atherosclerosis 209(1): 35–38. https://doi.org/10.1016 / j.atherosclerosis.2009.12.021
Vera E, Bernardes de Jesus B, Foronda M, Flores JM, Blasco MA (2013) Telomerase reverse transcriptase synergizes with calorie restriction to increase health span and extend mouse longevity. PLoS One 8(1): e53760. https://doi.org/10.1371/journal.pone.0053760
Хавинсон ВХ, Кузник БИ, Тарновская СИ, Линькова НС (2015) Короткие пептиды и регулятор длины теломер гормон ирисин. Бюлл эксп биол мед 9: 332–336. [Khavinson VKH, Kuznik BI, Tarnovskaya SI, Linkova NS (2015) Short peptides and the telomere length regulator hormone irisin. Bull Exp Biol Med 9: 332–336. (In Russ)].
Аронов ДМ (2019) Возможная связь реабилитационных аэробных тренировок и увеличения длины теломер хромосом. Рос кардиол журн 24(3): 82–89. [Aronov DM (2019) Possible associations between recovery aerobic training and increasing the length of telomeres. Russ J Cardiol 24(3): 82–89 (In Russ)]. https://doi.org/10.15829/1560-4071-2019-3-82-89
Кузник БИ, Давыдов СО, Степанов АВ, Морарь НВ (2016) Влияние кинезитерапевтических процедур на содержание ирисина у женщин с заболеваниями сердечно сосудистой системы в зависимости от массы тела и гормонального статуса. Патол физиол эксп терапия 60(4): 47–51. [Kuznik BI, Davydov SO, Stepanov A, Morar NV (2016) The effect of kinesitherapy procedures on the content of irisin in women with diseases of the cardiovascular system, depending on body weight and hormonal status. Pathol Physiol ExpTtherapy 60(4): 47–51. (In Russ)].
Кузник БИ, Давыдов СО, Степанов АВ, Морарь НВ (2017) Изменение концентрации ирисина в крови больных гипертонической болезнью после физической нагрузки. Кардиология 57(4): 77–78. [Kuznik BI, Davydov SO, Stepanov AV, Morar NV (2017) Changes in the concentration of irisin in the blood of patients with hypertension after exercise. Kardiologiia 57(4): 77–78. (In Russ)]. https://doi.org/10.18565/cardio.2017.4.77-78
Wang S, Pan J (2016) Irisin ameliorates depressive-like behaviors in rats by regulating energy metabolism. Biochem Biophys Res Commun 474(1): 22–28. https://doi.org/10.1016/j.bbrc.2016.04.047
Brenmoehl J, Albrecht E, Komolka K, Schering L, Langhammer M, Hoeflich A, Maak S (2014) Irisin is elevated in skeletal muscle and serum of mice immediately after acute exercise. Int J Biol Sci 10(3): 338–349. https://doi.org/10.7150/ijbs.7972
Von Känel R, Bellingrath BM, Kudielka S (2009) Association of vital exhaustion and depressive symptoms with changes in fibrin D-dimer to acute psychosocial stress. J Psychosom Res 67(1): 93–101. https://doi.org/10.1016/j.jpsychores.2008.12.009
Von Känel R, Kudielka BM, Haeberli A, Stutz M, Fischer JE, Patterson SM (2009) Prothrombotic changes with acute psychological stress: combined effect of hemoconcentration and genuine coagulation activation. Throb Res 123(4): 622–630. https://doi.org/10.1016/j.thromres.2008.05.014
Lippi G, Maffulli N (2009) Biological influence of physical exercise on hemostasis. Semin Thromb Hemost 3(35): 269–276. https://doi.org/10.1055/s-0029-1222605
Шахматов ИИ, Носова МН, Вдовин ВМ, Бондарчук ЮА, Киселев ВИ (2011) Особенности реакции гемостаза при стрессе у лиц с разным уровнем тренированности. Рос физиол журн им ИМ Сеченова 97(11): 1254–1261. [Shakhmatov II, Nosova MN, Vdovin VM, Bondarchuk Yu A, Kiselev VI (2011) Features of hemostasis under stress in individuals with different levels of fitness. Russ J Physiol 97 (11): 1254–1261. (In Russ)].
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. (2010) Council of the European Union, European Parliament. Offic J Eur Union 276: 33–80.
Тютрин ИИ, Удут ВВ, Шписман МН (2018) Низкочастотная пьезотромбоэластография в диагностике гемостазиологических расстройств: методическое руководство. Томск. Меднорд-Техника. [Tyutrin II, Udut VV, Shpisman MN (2018) Low-frequency piezothromboelastography in the diagnosis of hemostatic disorders: a methodological guide. Tomsk. Mednord-Technique. (In Russ)].
Тютрин ИИ, Удут ВВ (2016) Низкочастотная пьезотромбоэластография цельной крови: алгоритмы диагностики и коррекции гемостазиологических расстройств. Томск. Изд дом Томского гос универ [Tyutrin II, Udut VV (2016) low-Frequency piezotromboelastography of whole blood: algorithms for diagnostics and correction of hemostatic disorders. Tomsk. Publ House of Tomsk state Univer. (In Russ)].
Hemker H, Giesen P, Al Dieri R, de Smedt E, Wagenvoord R, Lecompte T, Beguin S (2003) Calibrated automated thrombin generation measurement in clotting plasma. Pathophysiol Haemost Thromb 33: 4–15. https://doi.org/10.1159/000071636
Hemker HC, Al Dieri R, De Smedt E, Beguin S (2006) Thrombin generation, a function test of the haemostatic-thrombotic system. Thromb Haemost 96(5): 553–561. https://doi.org/10.1160/th06-07-0408
Кузник БИ, Чалисова НИ, Цыбиков НН, Линькова НС, Давыдов СО (2020) Стресс, старение и единая гуморальная защитная система организма. Эпигенетические механизмы регуляции. Успехи физиол наук 51(3): 51–68. [Kuznik BI, Chalisova NI, Tsybikov NN, Lin′kova NS, Davydov SO (2020) Stress, aging and united humoral protective system of the organism. epigenetic mechanisms of regulation. Adv Physiol Sci 51(3): 51–68. (In Russ)]. https://doi.org/10.31857/S030117982002006X
Хавинсон ВХ, Кузник БИ, Рыжак ГА, Линькова НС, Салль ТС, Чалисова НИ (2018) Ирисин, бетатрофин, сахарный диабет, ожирение и метаболический синдром. Эпигенетические механизмы регуляции. Успехи физиол наук 49(1): 72–86. [Khavinson VKH, Kuznik BI, Ryzhak GA, Lin′kova NS, Sall′ TS, Chalisova NI (2018) Irisin, betatrophin, diabetes, obesity, and metabolic syndrome. Epigenetic mechanisms of regulation. Adv Physiol Sci 49(1): 72–86. (In Russ)].
Кузник БИ, Давыдов СО, Чалисова НИ (2019) Роль белков MANF, TIMP-2 и ирисина в старении организма. Успехи соврем биол 139(6): 540–552. [Kuznik BI, Davydov SO, Chalisova NI (2019) The role of MANF, TIMP-2 and irisin proteins in the aging of the body. Biol Bull Rev 139(6): 540–552. (In Russ)]. https://doi.org/10.1134/S0042132419060048
Lee P, Linderman JD, Smith S, Brychta RJ, Wang J, Idelson C, Perron RM, Werner CD, Phan GQ, Kammula US, Kebebew E, Pacak K, Chen KY, Celi FS (2014) Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans. Cell Metab 19(2): 302–309. https://doi.org/10.1016/j.cmet.2013.12.017
Кузник БИ, Давыдов СО, Степанов АВ (2018) Роль мышечного гормона ирисина в регуляции физиологических функций в условиях нормы и патологии. Успехи физиол наук 49(4): 59–80. [Kuznik BI, Davydov SO, Stepanov AV (2018) The role of the muscle hormone irisin in the regulation of physiological functions in normal and pathological conditions. Adv Physiol Sci 49(4): 59–80. (In Russ)]. https://doi.org/10.7868/S0301179818040057
Murawska-Cialowicz E, Wolanski P, Zuwala-Jagiello J, Feito Y, Petr M, Kokstejn J, Stastny P, Golinski D (2020) Effect of HIIT with Tabata protocol on serum Irisin, physical performance, and body composition in men. Int J Environ Res Public Health 17: 3589. https://doi.org/10.3390/ijerph17103589
Tsuchiya Y, Ando D, Takamatsu K, Goto K (2015) Resistance exercise induces a greater irisin response than endurance exercise. Metabolism 64(9): 1042–1050. https://doi.org/10.1016/j.metabol.2015.05.010
Ost M, Coleman V, Kasch J, Klaus S (2016) Regulation of myokine expression: Role of exercise and cellular stress. Free Radic Biol Med 98: 78–89. https://doi.org/. 02.018https://doi.org/10.1016/j.freeradbiomed.2016
Aydin S, Aydin S, Kobat MA, Kalayci M, Eren MN, Yilmaz M, Kuloglu T, Gul E, Secen O, Alatas OD, Baydas A (2014) Decreased saliva/serum irisin concentrations in the acute myocardial infarction promising for being a new candidate biomarker for diagnosis of this pathology. Peptides 56: 141–145. https://doi.org/10.1016/j.peptides.2014.04.002
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


