Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 9, стр. 1150-1161
Изменение вклада КАТФ-каналов в поддержание базального тонуса и дилатацию пиальных артериальных сосудов крыс после ишемии
О. П. Горшкова 1, *, И. Б. Соколова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: o_gorshkova@inbox.ru
Поступила в редакцию 06.11.2020
После доработки 01.07.2021
Принята к публикации 09.07.2021
Аннотация
Изучалось изменение вклада АТФ-чувствительных калиевых каналов (КАТФ) в поддержание базального тонуса и опосредованной ацетилхолином (АХ) дилатации пиальных артериальных сосудов крыс Вистар после перенесенной однократной ишемии/реперфузии коры головного мозга. Ишемию моделировали посредством пережатия обеих сонных артерий с одновременным снижением и строгим поддержанием среднего артериального давления на уровне 45 ± 2 мм рт. ст. на 12 мин. Исследование сосудов проводили через 7, 14 и 21 день после ишемии/реперфузии. С использованием метода прижизненной микрофотосъемки оценивали реакции пиальных артерий у крыс, перенесших ишемию, и у ложнооперированных животных. Об изменении вклада КАТФ-каналов в поддержание базального тонуса судили по изменению числа сосудов, сузившихся в ответ на воздействие блокатора КАТФ-каналов (глибенкламид, 10 мкМ). Изменение вклада каналов в дилатацию сосудов оценивали путем сравнения числа и степени дилатации артерий в ответ на действие ацетилхолин хлорида (АХ, 10–7 М, 5 мин) до и после применения блокатора КАТФ-каналов. Установлено, что ишемия/реперфузия приводит к снижению вклада АТФ-чувствительных калиевых каналов в поддержание базального тонуса пиальных артериальных сосудов на протяжении 14 дней после ишемического воздействия. Одновременно с этим снижается роль КАТФ-каналов в осуществлении АХ-опосредованных дилататорных реакций пиальных сосудов. И к 21-му дню после ишемии КАТФ-каналы практически не участвуют в осуществлении дилататорного ответа на АХ.
Реперфузия ишемизированной ткани имеет решающее значение для восстановления нормального функционирования пораженного органа, но она также парадоксальным образом может привести к вторичному повреждению. Вопросы взаимосвязи между первичными и повторными ишемическими поражениями головного мозга в настоящее время изучены недостаточно полно. Исход и отдаленные последствия ишемии/реперфузии (И/Р) головного мозга во многом определяются изменениями, происходящими в церебральном сосудистом русле. Важнейшими элементами, обеспечивающими нормальное функционирование сосудистой сети, являются ионные каналы, экспрессируемые как в эндотелиальных, так и в сосудистых гладкомышечных клетках [1–4]. Значительную роль в регуляции тонуса мозговых сосудов играют АТФ-чувствительные калиевые каналы (КАТФ) [1, 5, 6]. Их активация вызывает гиперполяризацию сосудистых миоцитов и вазодилатацию [3, 7, 8]. Связанное с изменением функционирования КАТФ-каналов постишемическое нарушение дилататорных механизмов сосудов головного мозга может приводить к локальному сужению или закрытию мелких церебральных сосудов и развитию эпизодов повторной очаговой ишемии. Целью данной работы было изучение изменения вклада КАТФ-каналов гладкомышечных клеток церебральных артерий в регуляцию их тонуса на разных сроках постишемического периода. В задачи исследования входило изучение изменения вклада КАТФ-каналов в поддержание базального тонуса и осуществлении опосредованной ацетилхолином (АХ) дилатации пиальных артериальных сосудов у крыс через 7, 14 и 21 день после перенесенной глобальной транзиторной ишемии коры головного мозга.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на 4-месячных самцах крыс Вистар (n = 74) массой 250–320 г из ЦКП “Биоколлекция Института физиологии им. И.П. Павлова РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятыми Европейской конвенцией 19.07.2014, и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
Ишемия коры головного мозга воспроизводилась с использованием техники окклюзии двух сосудов с управляемой гипотензией, известной в англоязычной литературе как “2-vessel occlusion + hypotention model” [9], с авторскими модификациями. У наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс производилась 12-минутная окклюзия обеих сонных артерий с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45 ± 2 мм рт. ст. путем забора/реинфузии крови в гепаринизированный шприц). Прямое измерение АД производилось через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур, https://www.argonmedical.com), подключенным к АЦП, входящему в состав микроконтроллера фирмы STMicroelectronics (США, https://www.st.com), выход которого был подключен к компьютеру через порт USB. Для работы устройства с компьютером в нашей лаборатории была разработана оригинальная программа визуализации значений АД. Расчет среднего АД в реальном времени производился программой по классической формуле:
По окончании периода ишемии производилась полная реинфузия забранной крови и ушивание операционных ран. До выхода из наркоза крысы содержались на электрогрелках (S315, EcoSapiens, Россия) при температуре 38°С. После выхода из наркоза животные возвращались в клетки своего обычного содержания.
Постишемические изменения исследовались в отдельных группах крыс: на 7-й, 14-й и 21-й день после ишемии. Контролем служили ложнооперированные животные (ЛО), которые подвергались аналогичному оперативному вмешательству, но без проведения ишемии, через 7, 14 и 21 день после операции соответственно.
Для проведения прижизненного исследования реакций пиальных артерий, крыс наркотизировали золетилом (внутрибрюшинно, 20 мг/кг, Virbac, Франция). В теменной области черепа животного высверливалось отверстие (S ≈ 1 см2), твердая мозговая оболочка в пределах отверстия удалялась, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошалась раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержался в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре 37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого в течение всего эксперимента оставались примерно на одном уровне и составляли 134 ± 5 мм рт. ст. Температура тела животного поддерживалась на уровне 38°C. Контроль за ректальной температурой осуществлялся с помощью лабораторного термометра ТТЖ-М, ОАО Стеклоприбор, Украина. Визуализация пиальных артерий проводилась с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (Микромед, Россия), цветную камеру-видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер.
При проведении эксперимента крысы разделялись на 12 отдельных групп. У первых 6-ти групп: крысы через 7 (n = 8), 14 (n = 8) и 21 (n = 6) день после перенесенной ишемии и ложнооперированные крысы через 7 (n = 6), 14 (n = 5) и 21 (n = 6) день после оперативного вмешательства, исследовали реакции сосудов на орошение поверхности головного мозга раствором АХ (Acetylcholine chloride, Sigma-Aldrich, 10–7 М [10], 8 мин). Исследование проводили в отсутствие и на фоне блокады КАТФ-каналов глибенкламидом (Glybenclamide, Sigma-Aldrich, 10 мкМ, в растворе диметилсульфоксида (DMSO), предварительное орошение поверхности мозга в течение 10 мин с последующим добавлением АХ в раствор блокатора). Концентрация DMSO в применяемом растворе глибенкламида не превышала 0.1%. Ранее проведенные исследования показали, что DMSO в такой концентрации не оказывает влияние на тонус церебральных артерий [11]. В 6-ти других группах: крысы через 7 (n = 6), 14 (n = 6) и 21 (n = 7) день после перенесенной ишемии и ложнооперированные крысы через 7 (n = 5), 14 (n = 6) и 21 (n = 5) день после оперативного вмешательства, исследовали реакции сосудов на воздействие активатора АТФ-чувствительных калиевых каналов – пинацидила (Pinacidil monohydrate, Sigma-Aldrich, 200 мкМ, в растворе DMSO). Для активации каналов поверхность мозга в течение 5 мин предварительно орошали раствором пинацидила. Фоновую реакцию на воздействие АХ в каждой группе анализировали по всему массиву сосудов и принимали за 100%. Проверка по критерию Краскела–Уоллеса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие АХ внутри каждой из исследованных групп. Общая продолжительность эксперимента составляла 60–90 мин, после чего животных усыпляли передозировкой раствора золетила (60 мг/кг).
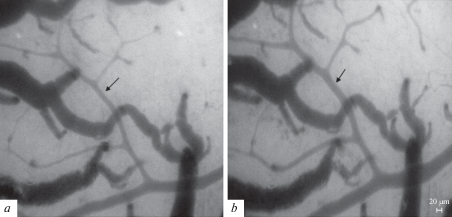
Диаметр сосудов измеряли на статических изображениях (рис. 1) с помощью компьютерной программы для цитофотометрии “Photo M 1.21” (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru), осуществляющей расчет оптической плотности фотографий, определение расстояния между объектами и площади области на фотографии. В программе предусмотрен режим увеличения изображения и калибровки для пересчета всех координат в метрические единицы. С использованием программы, вручную измерялась ширина потока эритроцитов, соответствующая внутреннему диаметру сосуда. Об изменении вклада КАТФ-каналов в поддержание базального тонуса сосудов судили по изменению числа сосудов, сузившихся в ответ на воздействие блокатора КАТФ-каналов глибенкламида. Изменение вклада каналов в дилатации сосудов оценивали путем сравнения числа дилатированных сосудов и степени их дилатации в ответ на воздействие АХ до и после применения блокатора.
Рис. 1.
Микрофотографии пиальных сосудов, ×140. a – исходное состояние; b – реакция на орошение поверхности головного мозг раствором АХ (10–7 М, 8 мин). Стрелками указан артериальный участок пиальной сосудистой сети.
Изменение количества расширившихся и сузившихся сосудов на воздействие выражалось в процентах относительно общего числа исследованных сосудов в группе. Степень дилатации ΔД оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия АХ относительно диаметра сосуда Д1 перед воздействием АХ, %:
Изменения диаметра в покое не превышали 5.0 ± 0.5%, поэтому при таких значениях считали, что реакция на воздействие отсутствует.
У каждой крысы было измерено от 40 до 60 участков сосудов. Для последующего анализа измеренные сосуды были разделены на группы в соответствии с их диаметрами: мелкие сосуды (диаметром от 9 до 20 мкм), сосуды среднего диаметра (от 20 до 40 мкм) и крупные сосуды (более 40 мкм). Данные по отдельной группе сосудов усреднялись для каждого животного и использовались для статистических сравнений. Статистический анализ данных проводили с использованием пакета статистических программ Microsoft Excel 2019 и программы InStat 3.02 (GraphPad Software Inc., США). Данные представляли в виде среднего арифметического значения и его ошибки. Применяли U-критерий Манна–Уитни (при сравнении 2-х групп) и критерий Краскела–Уоллиса (при сравнении более 2-х групп). Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ишемия изменяла характер дилататорной реакции пиальных артериальных сосудов на воздействие АХ. Через 7 дней после воздействия у крыс, перенесших ишемию, по сравнению с ложнооперированными животными во всех группах исследованных сосудов число АХ-опосредованных дилатаций было меньше в среднем на 35% (рис. 1a). Изменение амплитуды дилататорной реакции отмечалось только на сосудах крупных диаметров (рис. 1b). На 14-й день число дилататорных реакций на воздействие АХ сосудов всех диаметров оставалось меньше в среднем на 40–45% (рис. 1a). Через 21 день число вызванных АХ дилатаций у животных, перенесших ишемию, по сравнению с ложнооперированными животными в группе крупных сосудов было меньше в среднем на 60% (p = 0.14, U = 794, критерий Манна–Уитни), а в группах мелких и средних диаметров – на 38.4 ± 9.1 (p = 0.04, U = 711.5, критерий Манна–Уитни) и 20.1 ± 4.7% (p = 0.03, U = 135.5, критерий Манна–Уитни) соответственно (рис. 1). Достоверных изменений амплитуды дилататорной реакции на АХ в период с 14-го по 21-й день после ишемии не наблюдалось (рис. 1a, b).
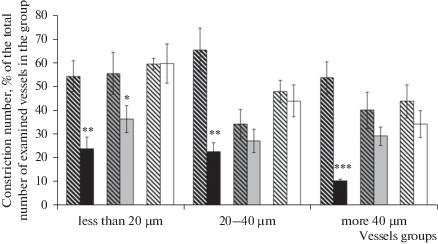
Аппликация глибенкламида у ложнооперированных крыс через 7 дней после оперативного вмешательства вызывала констрикцию в среднем около 60% исследованных сосудов всех диаметров (рис. 2). Число дилататорных реакции на воздействие АХ на фоне предварительного введения глибенкламида уменьшалось: в группе артерий среднего диаметра на 40.6 ± 8.1% (p = 0.01, U = 207.5, критерий Манна–Уитни), в остальных группах сосудов – в среднем на 65–70% (рис. 3a). В группе мелких артерий глибенкламида также достоверно снижал степень дилататорной реакции (рис. 3b). У крыс, перенесших ишемию, через 7 дней после И/Р, аппликация глибенкламида вызывала констрикцию 10.6 ± 0.8% крупных сосудов и 23.5% артерий мелких и средних диаметров (рис. 2). Число и амплитуда АХ-опосредованных дилатаций сосудов всех диаметров на фоне предварительного воздействия глибенкламида достоверно увеличивались (рис. 3).
Рис. 2.
Дилататорная реакция пиальных артериальных сосудов различных диаметров на воздействие АХ: a – число дилатаций (% от общего числа исследованных сосудов); b – диаметр артерий после воздействия АХ (% относительно их диаметра до воздействия АХ). Косая штриховка – ложнооперированные крысы; темная заливка – 7 дней после ишемии; серая заливка – 14 дней после ишемии; белая заливка – 21 день после ишемии. * – азличия достоверны по отношению к соответствующим значениям у ложнооперированных крыс данной группы; *p < 0.05; **p < 0.01 (U-критерий Манна–Уитни).
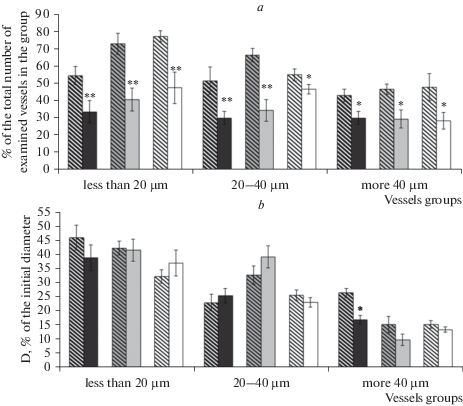
Рис. 3.
Констрикторная реакция пиальных артериальных сосудов различных диаметров на воздействие глибенкламида. Косая штриховка – ложнооперированные крысы; темная заливка – 7 дней после ишемии; серая заливка – 14 дней после ишемии; белая заливка – 21 день после ишемии. * – различия достоверны по отношению к соответствующим значениям у ложнооперированных крыс данной группы; * p < 0.05; ** p < 0.01; *** p < 0.001 (U-критерий Манна–Уитни).
Применение пинацидила у ложнооперированных крыс приводило к вазодилатации 90.8 ± 0.8% мелких сосудов, в группах артерий средних и крупных диаметров расширилось в среднем 65–80%. У крыс, перенесших ишемию, в ответ на воздействие пинацидила расширилось в среднем около 65% сосудов всех исследованных групп (рис. 4).
Рис. 4.
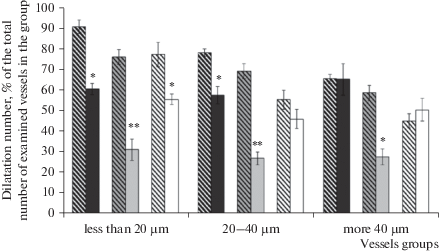
Изменение дилататорной реакции пиальных артериальных сосудов различных диаметров на воздействие АХ на фоне блокады КАТФ-каналов: a – число дилатаций (% от общего числа исследованных сосудов); b – диаметр артерий после воздействия АХ (% относительно их диаметра до воздействия АХ). Горизонтальная линия – дилататорная реакция сосудов в группе на введение АХ без применения блокатора, принятая за 100%. Косая штриховка – ложнооперированные крысы; темная заливка – 7 дней после ишемии; серая заливка – 14 дней после ишемии; белая заливка – 21 день после ишемии. * – изменения значимы по сравнению с соответствующими данными при воздействии АХ без применения блокаторов; * p < 0.05; ** p < 0.01; *** p < 0.001 (U-критерий Манна–Уитни).
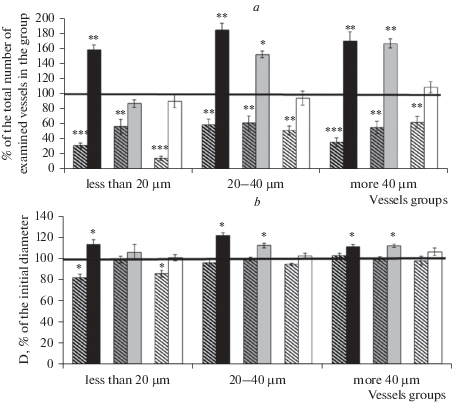
Аппликация глибенкламида у ложнооперированных крыс через 14 дней после операции вызывала констрикцию 55.9 ± 8.9% мелких сосудов и около 35.5% артерий средних и крупных диаметров (рис. 2). Глибенкламид уменьшал число АХ-опосредованных дилатаций пиальных артериальных сосудов всех диаметров (в среднем на 45%) без достоверного изменения амплитуды дилататорной реакции (рис. 3). У крыс, перенесших ишемию, через 14 дней после И/Р орошение поверхности головного мозга раствором глибенкламида приводило к констрикции около 30–35% сосудов всех исследованных групп (рис. 2). Число дилатаций на воздействие АХ на фоне введения глибенкламида в группах сосудов средних и крупных диаметров увеличивалось на 27.2 ± 2.2 (p = 0.04, U = 11, критерий Манна–Уитни) и 42.0 ± 1.1% (p = 0.01, U = 2553, критерий Манна–Уитни) соответственно, а в группе мелких сосудов незначительно снижалось (рис. 3a). В группах средних и крупных артерий также увеличивалась амплитуда дилататорной реакции (рис. 3b). Пинацидил у ложнооперированных крыс этой группы расширял в среднем 60–75% сосудов всех исследованных групп. У крыс, перенесших ишемию, через 14 дней после И/Р в ответ на воздействие пинацидила расширилось в среднем около 30% исследованных сосудов всех диаметров (рис. 4).
Применение глибенкламида у ложнооперированных крыс через 21 день после операции приводило к констрикции 60.1 ± 2.2% мелких сосудов и около 45% артерий средних и крупных диаметров (рис. 2). Число дилататорных реакций на воздействие АХ у ложнооперированных животных на фоне применения глибенкламида в группах сосудов мелких, средних и крупных диаметров уменьшалось (рис. 3a). Амплитуда дилататорной реакции снижалась только в группе мелких артерий – в среднем на 14.7 ± 2.7% (p = 0.05, U = 151, критерий Манна–Уитни, рис. 3b). У животных, перенесших ишемию, реакция пиальных артериальных сосудов всех исследованных диаметров на аппликацию глибенкламида достоверно не отличалась от реакции сосудов ложнооперированных крыс (рис. 2). Характер дилататорных реакций на воздействие АХ на фоне предварительного введения глибенкламида у крыс, перенесших ишемию, через 21 день после воздействия во всех группах сосудов достоверно не изменялся (рис. 3). Аппликация пинацидила у ложнооперированных крыс приводила к расширению 77.3 ± 5.9% мелких пиальных артерий. В группах артерий средних и крупных диаметров расширилось в среднем 55–45% исследованных сосудов. У крыс, перенесших ишемию, пинацидил вызывал дилатацию 55.6 ± 2.6% мелких пиальных артерий, с увеличением диаметра сосудов число вазодилатаций в ответ на воздействие пинацидила снижалось и в группе крупных артерий составило 40.5 ± 5.6% (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что однократная глобальная И/Р коры головного мозга крыс, вызванная окклюзией обеих сонных артерий с управляемой гипотензией, приводила к угнетению АХ-опосредованной дилатации пиальных артериальных сосудов, которое сохранялось на протяжении 21-го дня после восстановления кровотока. Развитие сосудистой дисфункции после ишемии и последующей реперфузии может быть связано с нарушением активности ионных каналов. Важным механизмом, обеспечивающим вазодилатацию мозговых сосудов, является активация АТФ-чувствительных калиевых каналов [3, 4]. Хорошо известно, что ишемия запускает каскад биохимических процессов, протекающих на клеточном и субклеточном уровнях, который приводит к метаболическим нарушениям в ткани мозга [6, 12]. Ишемический каскад обычно продолжается часами, но может длиться и более продолжительное время после восстановления кровотока. КАТФ-каналы играют значительную роль в регулировании клеточных функций в ответ на изменение клеточного метаболизма [6, 13].
Применение глибенкламида, являющегося селективным ингибитором всех видов КАТФ каналов [13], у ложнооперированных животных в наших экспериментах приводило к констрикции в среднем 50–60% пиальных артериальных сосудов всех диаметров. Число и амплитуда АХ-опосредованных дилататорных реакций сосудов, предварительно подвергнутых воздействию глибенкламида, в группах артерий всех диаметров у ложнооперированных крыс достоверно уменьшались. Эти данные показывают, что в физиологических условиях КАТФ-каналы участвуют в поддержании базального тонуса и обеспечении вазодилататорных реакций пиальных артериальных сосудов на воздействие АХ. Механизм АХ-опосредованной активации КАТФ-каналов остается не до конца изученным. Высказывается предположение, что вызванная АХ вазодилатация сопровождается выработкой оксида азота, который, воздействуя на эндотелий сосудистой стенки, моделирует сигнальный каскад, активирующий каналы: NO → растворимая гуанилатциклаза → циклический гуанозинмонофосфат → КАТФ-каналы [14, 15].
У крыс, перенесших ишемию, через 7 дней после ишемического воздействия роль КАТФ-каналов в поддержании базального тонуса пиальных артерий снижалась, на что указывало уменьшение числа констрикторных реакций на аппликацию глибенкламида в группах артерий всех диаметров, по сравнению с реакциями сосудов в соответствующих группах ложнооперированных животных. Одним из компонентов, влияющих на активность АТФ-чувствительных каналов, является NO [14]. Ранее нами было показано, что в первые 7 дней после однократной кратковременной ишемии головного мозга у крыс происходит изменение вазомоторной функции эндотелия пиальных артериальных сосудов, связанное с нарушением продукции оксида азота [15], это может являться причиной ослабления активации АТФ-чувствительных K+-каналов. Уменьшение числа сузившихся на воздействие глибенкламида сосудов после ишемии также может быть связано со снижением плотности KАТФ-каналов в клетках. Косвенным доказательством этому может служить тот факт, что применение в наших экспериментах открывателя KАТФ-каналов пинацидила, снижающего чувствительность каналов к АТФ и приводящего к увеличению их открытия при существующем уровне АТФ в клетке [13], у крыс, перенесших ишемию, по сравнению с ложнооперированными животными вызывало расширение меньшего числа сосудов мелких и средних диаметров. Хотя нельзя исключать и тот факт, что изменение реакции сосудов на воздействие пинацидила после И/Р, может быть следствием того, что большое количество КАТФ-каналов мембраны гладкомышечных клеток пиальных артериальных сосудов у крыс, перенесших ишемию, еще до воздействия пинацидила находятся в открытом состоянии. Известно, что основным последствием ишемических состояний является уменьшение уровня митохондриального АТФ [6, 12, 17]. Снижение соотношения ATФ/AДФ может являться одной из причин открытия КАТФ-каналов [13]. Также открытию каналов могут способствовать и другие последствия И/Р, такие как клеточный ацидоз, оксидативный стресс, изменение продукции аденозина, содержания фосфолипидов, которые могут снижать чувствительность канала к АТФ [1, 13, 18].
На протяжении последующего постишемического периода в наших экспериментах различия в реакциях пиальных артериальных сосудов на воздействие глибенкламида у крыс, перенесших ишемию, и ложнооперированных животных уменьшались. Через 14 дней после И/Р достоверные отличия наблюдались только в группе сосудов мелких диаметров, а через 21 день реакции сосудов всех исследованных диаметров на аппликацию глибенкламида достоверно не отличались от реакций сосудов у ложнооперированных крыс. В ответ на применение пинацидила через 14 дней после И/Р число расширившихся артерий всех диаметров оставалось меньше, чем у ложнооперированных крыс, а через 21 день достоверные отличия наблюдались только в группах мелких сосудов. Следовательно, можно утверждать, что к 21-му дню после И/Р активность КАТФ-каналов и их роль в поддержании базального тонуса пиальных артериальных сосудов восстанавливается.
Характер дилататорной реакции пиальных артериальных сосудов на воздействие АХ на фоне предварительной блокады КАТФ-каналов у крыс, перенесших ишемию, так же, как и у ложнооперированных животных, менялся. В первые 14 дней после И/Р предварительное введение глибенкламида достоверно усиливало дилатацию. Через 7 дней после ишемии на фоне введения глибенкламида достоверно увеличивалось число и амплитуда АХ-опосредованных дилатаций пиальных сосудов всех диаметров. Через 14 дней увеличение числа и амплитуды дилатации на фоне блокады КАТФ-каналов отмечалось только в группе сосудов средних и крупных диаметров. Число дилатаций мелких артерий незначительно снижалось. В литературе имеются сведения о том, что эффективность ингибиторов КАТФ-каналов зависит от уровня внутриклеточных нуклеотидов, при этом особенно важную роль играет Mg-AДФ, уровень которого значительно возрастает при ишемии и гипоксии [19]. Поэтому существует потенциальная возможность возникновения проблем при использовании этих соединений в условиях измененного постишемического метаболического статуса и повышения уровня внутриклеточного АТФ. Глибенкламид в этих условиях может, напротив, усиливать калиевый ток [5, 13, 19], что, вероятно, и является причиной извращения АХ-опосредованных сосудистых реакций в течение первых 14 дней после И/Р. Через 21 день после ишемии глибенкламид не изменял характер АХ-опосредованных дилататорных реакций сосудов всех диаметров.
Рис. 5.
Дилататорная реакция пиальных артериальных сосудов различных диаметров на воздействие пинацидила. Косая штриховка – ложнооперированные крысы; темная заливка – 7 дней после ишемии; серая заливка – 14 дней после ишемии; белая заливка – 21 день после ишемии. * – различия достоверны по отношению к соответствующим значениям у ложнооперированных крыс данной группы; * p < 0.05; ** p < 0.01 (U-критерий Манна–Уитни).
Таким образом, нами было установлено, что однократная кратковременная глобальная ишемия коры головного мозга крыс приводит к снижению вклада КАТФ-каналов в поддержание базального тонуса пиальных артериальных сосудов, которое сохраняется на протяжении 14-ти дней после ишемического воздействия. Одновременно с этим снижается роль АТФ-чувствительных калиевых каналов в осуществлении АХ-опосредованных дилататорных реакций пиальных сосудов. И к 21-му дню после ишемии KАТФ-каналы практически не участвуют в дилататорном ответе на АХ. АТФ-чувствительные калиевые каналы служат ключевыми модуляторами сосудистой гладкомышечной активности, регулирующей спонтанные вазомоции [20, 21]. Поэтому постишемическое нарушение процессов KАТФ-сигнализации и снижение вклада АТФ-чувствительных калиевых каналов в регуляции сосудистого тонуса может приводить к возникновению периодических эпизодов вазоспазма и являться причиной возникновения повторных ишемических состояний. Полученные нами результаты могут лечь в основу нового, перспективного подхода к лечению патологического ухудшения церебрального кровотока после перенесенных ишемических состояний.
Список литературы
Huang Y, Hu D, Huang C, Nichols CG (2019) Genetic discovery of ATP-sensitive K+ channels in cardiovascular diseases. Circ Arrhythm Electrophysiol 12(5): e007322. https://doi.org/10.1161/CIRCEP.119.007322
Lorigo M, Oliveira N, Cairrao E (2020) Clinical importance of the human umbilical artery potassium channels. Cells 9(9): 1956. https://doi.org/10.3390/cells9091956
Tykocki NR, Boerman EM, Jackson WF (2017) Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol 7(2): 485–581. https://doi.org/10.1002/cphy.c160011
Shekhar S, Liu R, Travis OK, Roman RJ, Fan F (2017) Cerebral autoregulation in hypertension and ischemic stroke: a mini review. J Pharm Sci Exp Pharmacol (1): 21–27.
Syed AU, Koide M, Brayden JE, Wellman GC (2019) Tonic regulation of middle meningeal artery diameter by ATP-sensitive potassium channels. J Cereb Blood Flow Metab 39(4): 670–679. https://doi.org/10.1177/0271678X17749392
Szeto V, Chen NH, Sun HS, Feng ZP (2018) The role of KATP channels in cerebral ischemic stroke and diabetes. Acta Pharmacol Sin 39(5): 683–694. https://doi.org/10.1038/aps.2018.10
Armstead WM, Riley J, Cines DB, Higazi AA-R (2011) tPA contributes to impairment of ATP and Ca sensitive K channel mediated cerebrovasodilation after hypoxia/ischemia through upregulation of ERK MAPK. Brain Res 28: 1376: 88–93. https://doi.org/10.1016/j.brainres.2010.12.052
Lakhan SE, Kirchgessner A, Hofer M (2009) Inflammatory mechanisms in ischemic stroke: therapeutic approaches. J Transl Med 7: 97. https://doi.org/10.1186/1479-5876-7-97
Smith ML, Bendek G, Dahlgren N, Rosen I, Wieloch T, Siesjo BK (1984) Models for studying long-term recovery following forebrain ischemia in the rat: 2. A 2-vessel occlusion model. Acta Neurol Scan 69: 385–401.
Шуваева ВН, Горшкова ОП (2018) Модуляция тонуса церебральных артерий ацетилхолином у крыс разных линий. Рос физиол журн им ИМ Сеченова 104(7): 807–816. [Shuvaeva VN, Gorshkova OP (2018) Modulation of the tone of the cerebral arteries with acetylcholine in rats of different lines. Russ J Physiol 104(7): 807–816. (In Russ)]. https://doi.org/10.7868/S0869813918070067
Soltani N, Mohammadi E, Allahtavakoli M, Shamsizadeh A, Roohbakhsh A, Haghparast A (2016) Effects of dimethyl sulfoxid on neuronal response characteristics in deep layers of rat barrel cortex. Basic Clin Neurosci 7(3): 213–220. https://doi.org/10.15412/J.BCN.03070306
Findlay I (1993) Sulphonylurea drugs no longer inhibit ATP-sensitive K+ channels during metabolic stress in cardiac muscle. J Pharmacol Exp Ther 266: 456–467.
Foster MN, Coetzee WA (2016) K+ATP Channels in the cardiovascular system. Physiol Rev 96(1): 177–252. https://doi.org/10.1152/physrev.00003.2015
Gendron ME, Thorin E, Perrault LP (2004) Loss of endothelial KATP channel-dependent, NO-mediated dilation of endocardial resistance coronary arteries in pigs with left ventricular hypertrophy. Br J Pharmacol 143(2): 285–291. https://doi.org/10.1038/sj.bjp.0705937
Zhang DM, Chai Y, Erickson JR, Brown JH, Bers DM, Lin YF (2014) Intracellular signalling mechanism responsible for modulation of sarcolemmal ATP-sensitive potassium channels by nitric oxide in ventricular cardiomyocytes. J Physiol 592(5): 971–990. https://doi.org/10.1113/jphysiol.2013.264697
Горшкова ОП, Шуваева ВН, Ленцман МВ, Артемьева АИ (2016) Постишемические изменения вазомоторной функции эндотелия. Совр пробл науки образов 5. [Gorshkova OP, Shuvaeva VN, Lentsman MV, Artemyeva AI (2016) Postischemic changes in the vasomotor function of the endothelium. Modern problems of science and education 5. (In Russ)]. http://science-education.ru/ru/ a-rticle/view?id=25270 (accessed: 09.06.2021)
Yang JL, Mukda S, Chen SD (2018) Diverse roles of mitochondria in ischemic stroke. Redox Biol 16: 263–275. https://doi.org/10.1016/j.redox.2018.03.002
Dunn KM, Nelson MT (2014) Neurovascular signaling in the brain and the pathological consequences of hypertension. Am J Physiol 306(1): H1–H14. https://doi.org/10.1152/ajpheart.00364.2013
Venkatesh N, Lamp ST, Weiss JN (1991) Sulfonylureas, ATP-sensitive K+ channels, and cellular K+ loss during hypoxia, ischemia, and metabolic inhibition in mammalian ventricle. Circul Res 69: 623–637. https://doi.org/10.1161/01.res.69.3.623
Chutkow WA, Pu J, Wheeler MT, Wada T, Makielski JC, Burant CF, McNally EM (2002) Episodic coronary artery vasospasm and hypertension develop in the absence of Sur2 K(ATP) channels. J Clin Invest 110(2): 203–208. https://doi.org/10.1172/JCI15672
Palygin O, Miller BS, Nishijima Y, Zhang DX, Staruschenko A, Sorokin A (2019) Endothelin receptor A and p66Shc regulate spontaneous Ca2+ oscillations in smooth muscle cells controlling renal arterial spontaneous motion. FASEB J 33(2): 2636–2645. https://doi.org/10.1096/fj.201800776RR
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


