Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 1, стр. 121-128
Эффекты аналога гонадотропин-рилизинг гормона сурфагона на болевую чувствительность у крыс
И. И. Бобынцев 1, *, А. О. Ворвуль 1, М. Е. Долгинцев 1, А. А. Крюков 1
1 Курский государственный медицинский университет
Курск, Россия
* E-mail: bobig@mail.ru
Поступила в редакцию 23.10.2021
После доработки 16.11.2021
Принята к публикации 17.11.2021
- EDN: RNWPUY
- DOI: 10.31857/S0869813922010034
Аннотация
Исследовано влияние внутрибрюшинного введения синтетического аналога-агониста гонадотропин-рилизинг гормона сурфагона на спинальные и супраспинальные механизмы формирования болевой чувствительности у интактных и кастрированных крыс-самцов Вистар. Болевое раздражение наносили переменным электрическим током на основание хвоста и регистрировали (в мA) пороги болевой чувствительности и эмоционально-аффективных реакций на боль. Введение сурфагона за 12 мин до начала эксперимента в дозах от 0.004 до 150 мкг/кг оказывало альгическое действие и усиливало вызванное болью эмоционально-аффективное поведение в дозах 0.004; 0.02 и 150 мкг/кг в тесте электрокожного раздражения хвоста. У гонадэктомированных животных через 12 дней после кастрации наблюдалось повышение большинства порогов болевых реакций. При введении пептида кастрированным крысам направленность отмеченных у интактных животных эффектов сохранялась, что свидетельствует об их стероидонезависимом характере. Полученные данные свидетельствуют о наличии как спинальных, так и супраспинальных механизмов алгического действия сурфагона при электроболевом раздражении у крыс.
Регуляторные пептиды обладают свойством физиологической полифункциональности и могут оказывать значительное влияние на болевую реакцию организма на всех уровнях ее формирования. К их числу относится гонадотропин-рилизинг гормон (Гн-РГ), для которого кроме эндокринного действия установлен целый ряд “неклассических” (неэндокринных) нейротропных эффектов: влияние на тревожность [1], агрессивно-оборонительное поведение [2], болевую чувствительность [3]. В выполненных ранее нами исследованиях с использованием различных способов введения, моделей оценки боли и вызванного ею поведения было показано влияние синтетического аналога-агониста Гн-РГ сурфагона на болевую чувствительность и болевые агрессивно-оборонительные реакции, а также зависимость его эффектов от функционального состояния гипоталамо-гипофизарно-гонадальной системы [2, 3]. Однако до настоящего времени оставался невыясненным вопрос о значении спинальных и супраспинальных механизмов в реализации эффектов сурфагона на формирование боли. Актуальность данного исследования также обусловлена достаточно широким практическим использованием синтетических аналогов Гн-РГ, в том числе при заболеваниях с болевым синдромом [4–7].
Целью работы являлось выяснение уровней локализации механизмов влияния аналога-агониста Гн-РГ сурфагона на болевую чувствительность у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена с использованием интактных и кастрированных крыс-самцов Вистар массой 180–200 г, которые содержались при режиме 12 ч – свет, 12 ч – темнота и температуре 22 ± 2°С. Подопытные животные были разделены на 7 групп по 10 особей. Двухстороннюю орхидэктомию выполняли за 12 дней до начала тестирования.
Аналог-агонист Гн-РГ сурфагон (синтезирован в НМИЦ кардиологии МЗ РФ) растворяли в физиологическом растворе NaCl и вводили внутрибрюшинно за 12 мин до начала опыта в дозах 0.004; 0.02; 0.01; 1.5; 15 и 150 мкг/кг. Контрольные группы получали эквивалентные объемы физиологического раствора.
Исследования проводили с 9 до 15 ч. Для определения порогов электрокожной болевой чувствительности крысам на основание хвоста накладывали пластинчатые электроды и наносили раздражение переменным электрическим током с помощью установки Shocker LE 100-26 (Panlab, Испания). Пороги болевых реакций у крыс регистрировали в мA с помощью цифрового мультиметра UT804 (Uni-Trend, КНР). На каждом животном проводили 2 испытания с интервалом 1 мин.
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, директиве 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, принципам Базельской декларации и рекомендациям Регионального этического комитета при Курском государственном медицинском университете (протокол № 3 от 16.11.2020).
Статистическую обработку полученных данных проводили с использованием интегрированной среды разработки для языка R “RStudio Desktop 1.4.1717” (RStudio, PBC, США, https://www.rstudio.com). Полученные результаты представлены в виде диаграмм boxplot. Достоверность выявленных различий между двумя группами определяли с помощью U-критерия Манна–Уитни (пакет “coin”), тремя и более – критерия Краскела–Уоллиса с post hoc анализом Данна (пакет “dunn.test”). Различия считались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Сурфагон в использованных дозах оказывал существенное алгическое влияние на болевую чувствительность у крыс (рис. 1), выраженность которого зависела от дозы. При введении в дозе 0.004 мкг/кг пептид вызывал значительное снижение порогов как собственно болевых (напряжение хвоста, поворот головы к электродам), так и эмоционально-аффективных реакций (вращение, вокализация, кусание электродов) на 31–37% (р < 0.05).
Рис. 1.
Величина порогов болевых реакций у крыс в тесте электрокожного раздражения хвоста после внутрибрюшинного введения сурфагона (в мA). (a) – напряжение хвоста, (b) – повороты головы, (c) – вокализация, (d) – повороты тела, (e) – кусание электродов. Полужирная черта – медиана, ящик – межквартильный размах, усы – крайние значения вариационных рядов, полужирная точка – выброс. * – p < 0.05 в сравнении с контрольной группой (по критерию Краскела–Уоллиса с post hoc анализом Данна), ** – p < 0.01 в сравнении с контрольной группой (по критерию Краскела–Уоллиса с post hoc анализом Данна).

При повышении дозы препарата до 0.02 мкг/кг отмечалось ослабление его эффектов: снижение порогов реакции напряжения хвоста составляло в среднем 17% и не достигало достоверно значимых различий. При этом снижение порогов реакций поворота головы, вокализации и вращения на 21–27% (р < 0.05) имело менее выраженный характер, чем в предыдущей группе. Однако эмоционально-аффективная реакция кусания электродов имела самые низкие пороги среди всех подопытных групп.
Увеличение вводимой дозы сурфагона до 0.1 мкг/кг не вызывало значимых изменений исследованных показателей. При этом проявилась тенденция к повышению порогов проявления эмоционально-аффективных реакций на фоне снижения болевой чувствительности. Дальнейшее увеличение дозы пептида до 1.5 мкг/кг, как и в предыдущей подопытной группе, не вызывало достоверно значимых сдвигов.
В то же время у крыс, получавших сурфагон в дозе 15 мкг/кг, вновь проявилось алгическое действие, по выраженности сравнимое после введения пептида в минимальных дозах (на 27–36%, р < 0.05). Однако в наибольшей дозе – 150 мкг/кг, эффекты пептида вновь нивелировались.
Кастрация вызвала статистически достоверное повышение порогов большинства исследованных реакций на болевое раздражение на 25–33% (р < 0.05), кроме реакции поворота головы.
Эффекты пептида у кастрированных животных, как и у контрольных, имели алгическую направленность (рис. 2) с наибольшей выраженностью в наименьшей использованной дозе 0.004 мкг/кг, при которой пороги большинства реакций снижались на 23–30% (р < 0.05). При этом следует отметить отсутствие достоверно значимых изменений реакции поворота головы во всех подопытных группах кастрированных крыс. Увеличение вводимой дозы до 0.02 мкг/кг сопровождалось снижением эффектов пептида в отношении эмоционально-аффективных реакций вращения и кусания электродов при выраженном снижении порогов напряжения хвоста (на 38%, р < 0.05).
Рис. 2.
Величина порогов болевых реакций у кастрированных крыс в тесте электрокожного раздражения хвоста после внутрибрюшинного введения сурфагона (в мA). (a) – напряжение хвоста, (b) – повороты головы, (c) – вокализация, (d) – повороты тела, (e) – кусание электродов. Полужирная черта – медиана, ящик – межквартильный размах, усы – крайние значения вариационных рядов, полужирная точка – выброс. ORX – кастрация, х – p < 0.05–0.01 в сравнении с контрольными животными (по U-критерию Мана–Уитни). * – p < 0.05 в сравнении с контрольной группой кастрированных животных (по критерию Краскела–Уоллиса с post hoc анализом Данна). ** – p < 0.001 в сравнении с контрольной группой кастрированных животных (по критерию Краскела–Уоллиса с post hoc анализом Данна).
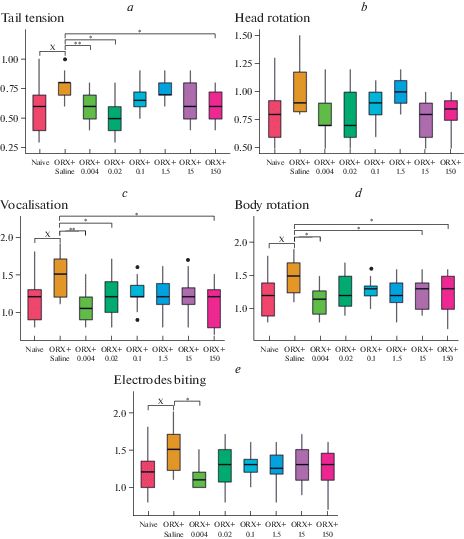
В подопытных группах, которым вводили сурфагон в дозах 0.1 и 1.5 мкг/кг, изменения всех исследованных реакций были слабовыраженными и не достигали достоверных различий.
Дальнейшее увеличение вводимой дозы сурфагона вновь сопровождалось проявлением его статистически значимых эффектов. Так, после введения сурфагона в дозе 15 мкг/кг наблюдалось снижение порогов реакции вращения (на 13%, р < 0.05), а в дозе 150 мкг/кг снижение порогов как спинальной реакции напряжения хвоста, так и супраспинальных эмоционально-аффективных проявлений в виде вокализации и вращения (на 13–25%, р < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в работе результаты показали алгическое действие сурфагона как у интактных, так и у кастрированных крыс, которое имело выраженный дозозависимый характер. Установленное наличие действия пептида в наименьших и наибольших использованных дозах при отсутствии в промежуточных является проявлением U-эффекта, характерного для регуляторных пептидов. Данный эффект связывают с активацией при различных дозах разных систем вторичных мессенджеров [8, 9] и, следовательно, с возможностью активации различных нервных структур.
Использованная модель боли при раздражении путем фиксации электродов на хвост позволяет в одном опыте оценить спинальные (сегментарные) и супраспинальные (надсегментарные) болевые реакции, тогда как при температурном воздействии подобные результаты можно получить только при использовании двух тестов – “горячая пластина” и “отдергивание хвоста” [10]. Механизмы реакции напряжения хвоста локализованы на спинальном (сегментарном) уровне, остальные проявления болевого поведения имеют супраспинальное происхождение [11]. В выполненном нами ранее исследовании сурфагон в аналогичном интервале доз в тесте “горячая пластина” оказывал у интактных мышей-самцов преимущественно анальгетическое действие [3]. В основе этих различий могут находиться данные о том, что механизмы формирования боли имеют ряд нейрохимических особенностей на сегментарном уровне в зависимости от вида раздражителя. Так, при температурном воздействии в передаче болевых импульсов на нейроны задних рогов спинного мозга принимают участие соматостатин, нейрокинин А и нейрокинин2-рецепторы [12, 14]. При электрокожном раздражении происходит возбуждение механических ноцицепторов [13] и на спинальном уровне в болевой трансмиссии участвуют вещество Р и нейрокинин1-рецепторы [12, 14]. Данные особенности сегментарных ноцицептивных механизмов могут являться основой различий эффектов сурфагона при электрокожном и температурном раздражении, а также свидетельствовать о наличии сложного пептидергического механизма болевой нейротрансмиссии на спинальном уровне. Согласно представлениям о континууме регуляторных пептидов как функционально-непрерывной совокупности [15], Гн-РГ может иметь иерархические взаимоотношения с участвующими в спинальной болевой нейротрансмиссии пептидами (соматостатин, вещество Р, нейрокинин А, кальцитонин-ген родственный пептид), а его аналоги-агонисты – влиять на данные процессы. Также необходимо учитывать, что входящая в структуру молекулы сурфагона аминокислота L-аргинин является источником оксида азота, который участвует в болевой нейротрансмиссии в спинном мозге [16].
При анализе полученных данных обращает внимание недостоверное ослабление спинального болевого рефлекса после введения сурфагона интактным животным в дозе 0.02 мкг/кг на фоне ярко выраженных эмоционально-аффективных реакций. Подобный характер действия пептида позволяет заключить, что механизмы их реализации находятся преимущественно на супраспинальном уровне и согласуется с описанной ранее активацией агрессивно-оборонительного поведения при неизбегаемом электроболевом раздражении [2] и анксиогенным действием сурфагона [1]. Отмеченное при этом усиление спинальных болевых рефлексов может проявляться как вследствие действия пептида непосредственно на сегментарном уровне, так и за счет ослабления нисходящих антиноцицептивных влияний из головного мозга. Известно, что в центральном сером веществе среднего мозга установлено связывание Гн-РГ и его аналогов со специфическими рецепторами [17, 18], поэтому изменение функционального состояния нейронов данной структуры может оказывать существенное влияние на болевые реакции. Кроме того, рецепторы к Гн-РГ локализованы в гиппокампе и миндалевидном комплексе [19] и связывание с ними может оказывать влияние на супраспинальные механизмы формирования боли.
Повышение порогов болевых реакций после кастрации во многом может быть связано с усилением активности серотонинергической системы [20], которая играет важную роль в активации сегментарных антиноцицептивных механизмов. О стероидонезависимом характере действия сурфагона свидетельствует сохранение направленности и выраженности его алгического действия после кастрации. Обращает внимание изменение болевых реакций после введения сурфагона в дозе 0.02 мкг/кг кастрированным животным (значительное повышение болевой чувствительности на фоне ослабления эмоционально-аффективных поведенческих реакций), противоположное эффекту пептида в данной дозе у интактных животных. Преобладание ослабления супраспинальных реакций отмечалось и после введения кастрированным крысам пептида в дозе 150 мкг/кг. Полученные на кастрированных животных данные показывают значение функционального состояния гипоталамо-гипофизарно-гонадальной системы в реализации эффектов сурфагона в отношении ноцицептивной чувствительности и вызванного болью поведения, а также свидетельствуют об участии пептида в данных процессах как на спинальном, так и супраспинальном уровнях. Следует отметить, что сурфагон у кастрированных мышей в тесте “горячая пластина” также оказывал алгическое действие [3].
ЗАКЛЮЧЕНИЕ
Таким образом, аналог-агонист Гн-РГ сурфагон при внутрибрюшинном введении в интервале доз от 0.004 до 150 мкг/кг оказывал у крыс алгическое действие и усиливал вызванное болью эмоционально-аффективное поведение в дозах 0.004; 0.02 и 150 мкг/кг в тесте электрокожного раздражения хвоста. У гонадэктомированных животных наблюдалось повышение большинства порогов болевых реакций. При введении пептида через 12 дней после кастрации направленность отмеченных у интактных животных эффектов сохранялась, что свидетельствует об их стрероидонезависимом характере. Полученные данные свидетельствуют о наличии как спинальных, так и супраспинальных механизмов алгического действия сурфагона при электроболевом раздражении у крыс.
Результаты проведенных исследований расширяют представления о физиологических эффектах регуляторных пептидов и их полифункциональности, а данные о повышении болевой чувствительности и усилении эмоционально-аффективных реакций на боль необходимо учитывать при клиническом применении аналогов-агонистов Гн-РГ.
Список литературы
Masalova OO, Kazakova SB, Savateeva-Lyubimova TN, Sivak KV, Sapronov NS, Shabanov PD (2019) Effect of Surfagon on Open Field and Elevated Plus Maze Behavior of Gonadectomized and Non-Gonadectomized Male Rats. Bull Exp Biol Med 168(1): 52–54. https://doi.org/10.1007/s10517-019-04644-4
Severianova LA, Bobyntsev II (1995) Neurotropic effects of an luliberin analog administered intraventricularly to rats with varying sensitivity to ethanol. Bull Exp Biol Med 119(2): 120–123. https://doi.org/10.1007/BF02445854
Bobyntsev II, Sever’yanova LA, Kryukov AA (2006) Effect of gonadotropin-releasing hormone analogue on thermal nociception in mice. Bull Exp Biol Med 141(2): 193–196. https://doi.org/10.1007/s10517-006-0125-0
Della Corte L, Barra F, Mercorio A, Evangelisti G, Rapisarda AMC, Ferrero S, Bifulco G, Giampaolino P (2020) Tolerability considerations for gonadotropin-releasing hormone analogues for endometriosis. Expert Opin Drug Metab Toxicol 16(9): 759–768. https://doi.org/10.1080/17425255.2020.1789591
Rossi L, Pagani O (2018) The role of gonadotropin-releasing-hormone analogues in the treatment of breast cancer. J Womens Health (Larchmt) 27(4): 466–475. https://doi.org/10.1089/jwh.2017.6355
Ortmann O, Weiss JM, Diedrich K (2002) Gonadotrophin-releasing hormone (GnRH) and GnRH agonists: mechanisms of action. Reprod Biomed Online 5(1): 1–7. https://doi.org/10.1016/s1472-6483(11)60210-1
Bereket A (2017) A critical appraisal of the effect of gonadotropin-releasing hormon analog treatment on adult height of girls with central precocious puberty. J Clin Res Pediatr Endocrinol 9(2): 33–48. https://doi.org/10.4274/jcrpe.2017.S004
Konda Y, Gantz I, DelValle J, Shimoto Y, Miwa H, Yamada T (1994) Interaction of dual intracellular signaling pathways activated by the melanocortin-3 receptor. J Biol Chem 269(18): 13162–13166.
Buggy JJ (1998) Binding of alpha-melanocyte-stimulating hormone to its G-protein-coupled receptor on B-lymphocytes activates the Jak/STAT pathway. Biochem J 331(Pt 1): 211–226. https://doi.org/10.1042/bj3310211
Воронина ТА, Гузеватых ЛС (2012) Методические рекомендации по изучению анальгетической активности лекарственных средств. В кн.: Миронов АН (отв ред) Руководство по проведению доклинических исследований лекарственных средств. Часть 1. М. Гриф и К. 197–218. [Voronina TA, Guzevatykh LS (2012) Methodological recommendations for the study of analgesic activity of drugs. In: Guidelines for conducting preclinical studies of medicines. Mironov AN (ed) Vol 1. M. Grif and K. 197–218. (In Russ)].
Severyanova LA, Lazarenko VA, Plotnikov DV, Dolgintsev ME, Kriukov AA (2019) L-Lysine as the molecule influencing selective brain activity in pain-induced behavior of rats. Int J Mol Sci 20(8): 1899. https://doi.org/10.3390/ijms20081899
Zieglgänsberger W (2019) Substance P and pain chronicity. Cell Tissue Res 375(1): 227–241. https://doi.org/10.1152/10.1007/s00441-018-2922-y
Treede RD, Margel W (1995) Modern concepts of pain and hyperalgesia beyond the polymodal C-nociceptor. Physiology 10(5): 216–228. https://doi.org/10.1152/physiologyonline.1995.10.5.216
Harris JA, Faust B, Gondin AB, Dämgen MA, Suomivuori CM, Veldhuis NA, Cheng Y, Dror RO, Thal DM, Manglik A (2021) Selective G protein signaling driven by substance P-neurokinin receptor dynamics. Nat Chem Biol. https://doi.org/10.1038/s41589-021-00890-8
Koroleva SV, Nikolaeva AA, Ashmarin IP (2012) Types of bioinformatic programs in the continuum of regulatory peptides and non-peptide mediators. Traits of interaction of dopamine and serotonin systems. Neurochem J 6(2): 132–143.
Severyanova LA, Bobyntsev II, Plotnikov DV, Lyashev YD (2001) Nitric oxide synthesis in the brain mediates neuro-peptide effects on pain sensitivity and pain-induced aggression. Analgesia 5(3/4): 223–237.
Jennes L, Conn PM (1994) Gonadotropin-releasing hormone and its receptors in rat brain. Front Neuroendocrinol 15(1): 51–77. https://doi.org/10.1006/frne.1994.1003
Jennes L, Eyigor O, Janovick JA, Conn PM (1997) Brain gonadotropin releasing hormone receptors: localization and regulation. Recent Prog Horm Res (52): 475–491.
Leblanc P, Crumeyrolle M, Latouche J, Jordan D, Fillion G, L’Heritier A, Kordon C, Dussaillant M, Rostène W, Haour F (1988) Characterization and distribution of receptors for gonadotropin-releasing hormone in the rat hippocampus. Neuroendocrinology 48(5): 482–488. https://doi.org/10.1159/000125053
Nayebi AR, Ahmadiani A (1999) Involvement of the spinal serotonergic system in analgesia produced by castration. Pharmacol Biochem Behav 64(3): 467–471. https://doi.org/10.1016/s0091-3057(99)00113-6
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


