Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 1, стр. 109-120
Участие глутаминсинтетазы в развитии гипербарических кислородных судорог
О. С. Алексеева 1, 2, *, С. Ю. Жиляев 1, Т. Ф. Платонова 1, Д. Л. Цыба 2, О. В. Кирик 2, Д. Э. Коржевский 2, И. Т. Демченко 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: osa72@inbox.ru
Поступила в редакцию 19.10.2021
После доработки 16.11.2021
Принята к публикации 17.11.2021
- EDN: QWLGRS
- DOI: 10.31857/S0869813922010022
Аннотация
Гипербарический кислород (ГБО2) оказывает токсическое действие на ЦНС, механизмы которого изучены недостаточно. Целью настоящей работы явилась проверка гипотезы о том, что ГБО2 ингибирует активность глутаминсинтетазы (GS) в головном мозге и повышает уровень глутаматергической нейропередачи, что приводит к развитию эпилептиформной активности на ЭЭГ и тонико-клонических моторных судорог. В опытах на бодрствующих крысах, находящихся в кислородной барокамере под давлением 5 АТА, определяли латентное время появления судорог у животных с интактной и ингибированной GS. Ферментативную активность GS необратимо подавляли с помощью селективного ингибитора L-Methionine sulfoximine (MSO). Установлено, что развитие судорог в гипербарической гипероксии коррелировало с понижением содержания GS в мозге. MSO ускорял развитие кислородных судорог. Полученные данные свидетельствуют о том, что проявление судорожного синдрома в экстремальной гипероксии зависит от ферментативной активности GS, ключевого фермента, регулирующего глутаматергическую нейропередачу.
Использование кислорода под повышенным давлением в клинике и при подводных погружениях сопряжено с риском его токсического действия на ЦНС, проявляющегося в виде эпилептиформной активности на электроэнцефалограмме (ЭЭГ) и мышечных судорог по типу эпилептического припадка. По современным представлениям, ключевая роль в инициировании кислородных судорог принадлежит интенсивно образующимся при экстремальной гипероксии редокс-молекулам – реактивным формам кислорода (ROS) и азота (RNS), способными через окислительно-восстановительные реакции изменять молекулярную структуру и функции клеток и нарушать межклеточное синаптическое взаимодействие. Одной из причин развития кислородных судорог может быть нарушение баланса между глутаматергической и ГАМК-ергической медиаторными системами [1, 2]. Поскольку развитию судорог в гипербарическом кислороде (ГБО2) сопутствует выраженная активность ЦНС в виде эпилептиформных паттернов на ЭЭГ и высокой биоэлектрической активности симпатических нервов, логично допустить, что сдвиг баланса медиаторных процессов происходит в сторону возбуждения за счет повышения глутаматергической нейромедиации и/или понижения активности ГАМК-ергической системы. Угнетение функции ГАМК-ергической системы подтверждено многими исследованиями, показавшими уменьшение количества тормозного медиатора в мозге животных во время ГБО2-экспозиции [3–5]. Причиной снижения мозговой ГАМК в экстремальной гипероксии является инактивация фермента глутаматдекарбоксилазы (ГДК), катализирующего синтез тормозного медиатора [6]. Следовательно, низкий уровень продукции ГАМК в ГБО2 ослабляет тормозную функцию и сдвигает нейромедиаторный баланс в сторону возбуждения. Вместе с тем, сдвигу медиаторного баланса в гипероксии может способствовать также активация глутаматергической системы, происходящая за счет нарушения регуляции глутаматергической передачи, связанной с выделением и удалением нейропередатчика из синаптической щели.
Глутамат является основным возбуждающим медиатором в нервной системе млекопитающих. После квантового выделения глутамата в синаптическую щель с последующей активацией постсинаптических рецепторов неиспользованная часть медиатора удаляется транспортерами обратно в пресинаптический нейрон и в глию, где происходит его конвертирование в глутамин с участием фермента глутаминсинтетазы (GS) [7]. Этот фермент локализован преимущественно в цитоплазме астроглиальных клеток и максимальное его количество выявляется в отростках астроцитов, прилегающих к глутаматергическим синапсам [8, 9].
Многочисленные исследования показали, что у больных с патологическими расстройствами, такими как шизофрения, болезнь Альцгеймера, депрессия и эпилепсия, экспрессия гена или активность GS в мозге достоверно ниже нормальных значений, а уровень глутамата повышен [10–12]. Пониженная активность GS в головном мозге обнаружена также у животных с моделью абсансной эпилепсии [13]. Хотя метаболические и функциональные изменения GS в головном мозге при гипероксии не изучались, можно полагать, что активность фермента, регулирующего цикл глутамат/глутамин, может играть значительную роль в нарушении нейротрансмиттерной передачи и развитии судорожного синдрома в гипероксии. Если допустить снижение ферментативной активности GS под влиянием гипербарического кислорода, то вполне ожидаемо повышение содержания глутамата в астроцитах, во внеклеточной среде и уменьшение его клиренса из синаптической щели, а значит и гиперактивацию глутаматергической нейропередачи, приводящую к развитию судорожного синдрома. Одним из способов проверки высказанного предположения может быть использование ингибитора GS с известным механизмом действия. При изучении действия такого ингибитора и гипербарического кислорода можно определить аддитивный или другой вид синергичного действия этих двух факторов, а значит прояснить механизм инактивации фермента в ГБО2. Наиболее известным селективным ингибитором GS является метионинсульфоксимин (L-Methionine sulfoximine, MSO), широко используемый в научных исследованиях. Целью настоящей работы явилось изучение совместного действия гипербарического кислорода и ингибирования глутаминсинтетазы на скорость развития кислородных судорог.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на бодрствующих половозрелых крысах-самцах линии Вистар массой 200–250 г. Протокол опытов одобрен Комиссией по этике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН и соответствует этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации, а также “Международным рекомендациям по проведению медико-биологических исследований с использованием животных” (CIOMS, Geneva, 1985). Всего в опытах было использовано 20 животных, разделенных на четыре группы. Группа 1 – интактные животные (контроль, n = 5), группа 2 – животные, подвергнутые воздействию повышенного давления кислорода (n = 5), группы 3 и 4 – животные, которым за 6 ч до ГБО2-экспозиции внутрибрюшинно вводили ингибитор GS – L-Methionine sulfoximine (L-S-(3-Amino-3-carboxypropyl)-S-methylsulfoximine, M5379; Sigma-Aldrich, США) в дозе 50 мг/кг (n = 5) или 100 мг/кг (n = 5) соответственно. Опыты проводили в кислородной барокамере объемом 107 л. Компрессия осуществлялась газовой смесью (93% О2 + 7% N2) до давления в камере 5 АТА (атмосфер абсолютных) со скоростью 1 АТА/мин. ГБО2-экспозиция при парциальном давлении кислорода в барокамере 4.65 АТА продолжалась до появления у животных клонических или тонических судорог. При отсутствии судорожных признаков экспозиция продолжалась 100 мин. Время декомпрессии составляло 7 мин. Во время ГБО2-экспозиции проводилась видео-регистрация поведенческих реакций животных.
После окончания декомпрессии, согласно утвержденному протоколу, крыс усыпляли изофлураном, декапитировали, извлекали и фиксировали в цинк-этанол-формальдегиде головной мозг, затем обезвоживали и заливали в парафин по общепринятой методике [14]. Для иммуноцитохимического анализа готовили серийные фронтальные срезы мозга толщиной 5 мкм. Выявление GS в структурах мозга осуществляли при помощи ее иммуноцитохимического маркирования. Для этого после стандартной процедуры депарафинирования и регидратации проводили высокотемпературное демаскирование с последующим блокированием эндогенной пероксидазы в модифицированном цитратном буфере S1700 (Dako, Дания). Иммуноцитохимическое выявление GS проводили с использованием мышиных моноклональных антител (клон GS-6, разведение 1 : 400; Chemicon, США). Для выявления первичных антител при световой микроскопии использовали набор MACH2 Mouse HRP Polymer (MHRP520 G, H, L; Biocare medical, США) c добавлением крысиной сыворотки для блокировки перекрестной иммунореактивности вторичных антител с иммуноглобулинами крысы. Пероксидазную метку выявляли с использованием диаминобензидинового хромогена (DAB+; Dako, Дания). Часть срезов подкрашивали квасцовым гематоксилином. Анализ препаратов для микроскопии в проходящем свете и фотосъемку выполняли, используя микроскоп Leica DM750 и цифровую фотокамеру Leica ICC50 (Leica, Германия).
Для статистического анализа использовали результаты измерений латентного периода (в минутах) появления различных типов моторных судорожных реакций у животных от начала кислородной экспозиции под давлением 5 АТА. Для количественной оценки развития судорог у крыс в барокамере мы адаптировали известную шкалу судорожных состояний, позволяющую разделить тяжесть приступов на стадии: движение рта и мышц мордочки, кивание головой, клонус передних конечностей, подъем с клонусом передних конечностей и подъем и падение с клонусом передних конечностей [15]. В тех случаях, когда у животных не наблюдалось никаких судорожных проявлений за все время ГБО2-экспозиции, за латентный период принимали время окончания эксперимента, равное 100 мин. Данные анализировали с помощью дисперсионного анализа SigmaPlot 13.0 (Systat Software, Inc., San Jose, CA, США). Однофакторный дисперсионный анализ применяли для сравнения латентных периодов судорожных реакций при введении искусственного ликвора и препаратов.
Анализ изображений, полученных при микроскопическом исследовании, проводили в программе ImageJ (NIH, США). При этом делали по 5 микрофотографий каждой исследуемой зоны мозга. Для дальнейшего анализа изображений использовали следующий подход.
На каждой фотографии с помощью инструмента “прямоугольник” с высокой степенью увеличения (объектив ×100, иммерсия) методом случайной выборки отбирали по 10 участков для дальнейшего анализа. В каждом участке средствами программы ImageJ определяли интенсивность окраски элементарной составляющей изображения – пикселя – в градациях белого цвета со значениями от 0 (самый черный) до 255 (самый белый), основываясь на методе использования оттенков белого цвета для визуального отображения диапазона интенсивности [16–18].
Статистическую обработку выполненных измерений осуществляли с использованием программы Rstudio [19]. Для сравнения интенсивности иммуноцитохимической реакции на глутаминсинтетазу в экспериментальных группах был проведен дисперсионный анализ с использованием ANOVA. Оценка значимости различий дисперсий двух случайных выборок проводилась с использованием критерия Фишера. Для оценки величины различий между средними применяли пост-хок тест Тьюки. Достоверность выявляли по парному t-критерию Стьюдента. Все данные представлены как М ± SD, при этом в качестве статистически значимых принимали значения р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У крыс контрольной группы в ГБО2 наблюдались различные паттерны моторной судорожной активности, проявляющиеся в определенной стадийной последовательности, подробно описанной нами ранее [20]. Кратко, первые признаки судорожной активности начинались с появления интенсивного груминга, легкого потряхивания головы и передних лап (стадия 1). На стадии 2 наблюдались локальные миоклонии продолжительностью от 5–15 с, которые могли повторяться через несколько минут. При продолжающейся ГБО2-экспозиции у крыс появлялись ритмические сокращения мышц всего тела продолжительностью от 10–25 с, при этом животные вставали на задние лапы и пятились назад (стадия 3). На стадии 4 у животных наблюдались генерализованные клонические или тонические конвульсии. Последняя стадия судорожного синдрома сопровождалась тахикардией, гипервентиляцией и другими признаками расстройств вегетативной нервной системы.
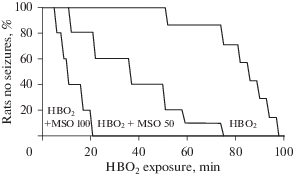
У крыс, которым вводили препарат МSО в дозах 50 или 100 мг/кг за 6 ч до ГБО2, в течение всего периода наблюдения до начала компрессии кислородом в барокамере нарушений поведения и рефлексов позы выявлено не было. При экспозиции под повышенным давлением кислорода 4.65 АТА наибольший просудорожный эффект вызывал МSО в дозе 100 мг/кг. Развитие судорожной активности у крыс c ингибированной GS происходило в той же стадийной последовательности, что и у контрольных животных. Однако выделенные нами стадии развития судорожного синдрома заметно ускорялись по отношению к контрольным значениям (рис. 1).
Время наступления судорог в контрольной группе (четвертая стадия тонико-клонических судорог) составляло 87 ± 8.2 мин, а при дозировке MSO 100 мг/кг было в 8 раз короче (рис. 2).
Рис. 2.
Латентный период развития кислородных судорог у животных после введения MSO в дозах 50 и 100 мг/кг. * p < 0.05 от ГБО2, ** p < 0.001 от ГБО2.

Распределение глутаминсинтетазы изучалось в головном мозге крыс после их экспонирования под давлением кислорода 4.65 АТА в течение 100 мин. Исследованными областями мозга являлись гиппокамп, область СА1 (stratum radiatum), поясная кора (cortex cingularis) и стриатум (corpus striatum). В указанных зонах мозга были выявлены многочисленные глутаминсинтетаза-иммунопозитивные (GluS+) клетки, которые имели морфологические признаки астроцитов (рис. 3). При визуальном анализе препаратов мозга с помощью световой микроскопии выявляются различия между плотностью распределения GluS+ клеток в контроле (рис. 3a и 3b), где их присутствовало больше, чем при воздействии ГБО2 (рис. 3c–h). На всех исследованных срезах плотность распределения GluS+ клеток было больше в коре, чем в гиппокампе. Интенсивность иммуноцитохимической реакции на GS астроцитов варьировала в разных областях мозга, причем наибольшая ее степень отмечена в гиппокампе и поясной коре, а наименьшая – в стриатуме. Плотность распределения GluS+ клеток хорошо коррелировала с распределением нейронов, особенно в зоне СА1 гиппокампа (рис. 3).
Рис. 3.
Распределение GluS+ клеток на срезах гиппокампа и поясной коры. a, b –контроль; c, d – ГБО2 4.65 АТА; e, f – ГБО2 + MSO 50 мг/кг; g, h – ГБО2 + MSO 100 мг/кг. Масштабный отрезок – 100 мкм.

Для количественной оценки полученных морфологических данных были проведены измерения интенсивности окраски пикселя на срезах мозга крыс с иммуноцитохимической реакцией на GS (рис. 4). На срезах оценивались области мозга, содержащие только GluS+ клетки (астроциты), неокрашенные области не учитывались. Дисперсионный анализ показал, что средняя интенсивность пикселя в окрашенных участках (иммуноцитохимическая реакция на GS) в исследованных областях мозга крыс зависела от экспериментального воздействия. Попарное сравнение экспериментальных и контрольной групп с использованием пост-хок теста Тьюки показало достоверно значимые различия средней окраски пикселя между интактными животными и животными, подвергавшимися воздействию гипероксии 4.65 АТА, как с предварительным введением MSO, так и без него (табл. 1). Во всех этих случаях контрольные значения превышали данные экспериментальных групп (рис. 4).
Рис. 4.
Содержание глутаминсинтетазы (по интенсивности окрашивания препаратов) в клетках поясной коры и гиппокампа (СА1) мозга крыс. Иммуноцитохимическая реакция на глутаминсинтетазу проводилась у контрольных животных (дыхание воздухом), при ГБО2 4.65 АТА и при ГБО2 с предварительным введением MSO в дозах 50 и 100 мг/кг. Звездочкой показаны достоверные отличия от контрольных значений, *p < 0.05.
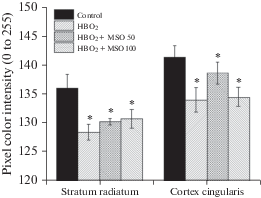
Таблица 1.
Результаты попарного сравнения содержания GluS+ клеток в мозге крыс контрольной и экспериментальных групп с применением пост-хок теста Тьюки
| Область мозга | ГБО2 | ГБО2 + MSO 50 | ГБО2 + MSO 100 | Степени свободы |
|---|---|---|---|---|
| Поясная кора | F = –7.68 p < 0.001 |
F = –3.17 p < 0.001 |
F = –6.89 p < 0.001 |
1297 |
| Гиппокамп | F = –7.48 p < 0.001 |
F = –5.6 p < 0.001 |
F = –5.26 p < 0.001 |
909 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выполненные исследования свидетельствуют, что развитие судорожного синдрома в экстремальной гипероксии зависит от активности глутаминсинтетазы – ключевого фермента, вовлекаемого в процесс глутаматергической нейропередачи. Данный вывод базируется на 2-х экспериментальных находках: (1) развитие судорог в гипербарической гипероксии коррелирует с понижением содержания GS в мозге, (2) экзогенный селективный ингибитор глутаминсинтетазы, метионинсульфоксимин, ускоряет появление кислородных судорог.
Эпилептиформные судороги у интактных крыс (контрольная группа) в барокамере начинались с локальных миоклоний и заканчивались генерализованными конвульсиями. Продолжительность ГБО2-экспозиции до начала судорог составляла 87 мин, что в 2 раза больше ранее найденных нами величин латентного периода появления конвульсий у такой же линии крыс при 5 АТА чистого кислорода [20]. Причина этого может заключаться в том, что в данных опытах компрессия в барокамере проводилась газовой смесью, содержащей 93% О2, поэтому при общем давлении в камере 5 АТА, парциальное давление кислорода составляло 4.65 АТА. При дыхании кислородом под таким давлением время появления судорог у крыс составляло также около 90 мин [21], а при 3 АТА О2 – около 3-х ч [22]. Кислородные судороги сопровождались в наших опытах снижением в головном мозге количества белка GS, определяемого иммуногистохимическим методом с использованием моноклональных антител (рис. 3–4).
Иммуногистохимическая идентификация глутаминсинтетазы в мозге крыс контрольной группы показала, что данный фермент локализуется преимущественно в астроцитах. Интенсивность иммуноцитохимической реакции на GS оказалась неоднородной как в пределах одной структуры, так и в разных отделах головного мозга. Причина такой неоднородности остается до конца неясной, но можно допустить, что распределение астроцитов также гетерогенно и зависит от метаболической активности мозговых структур. Отсюда не трудно понять, почему интенсивность окрашивания астроцитов в поясной коре мозга несколько больше, чем в гиппокампе, учитывая высокий уровень окислительного метаболизма в корковых структурах. Одна из возможных причин неравномерного распределения GluS+ клеток может быть связана с гетерогенным распределением глутаматергических нейронов в мозге. Подтверждением тому является наибольшая интенсивность окрашивания GS в области СА1 гиппокампа, где присутствует высокая глутаматергическая активность [23].
Снижение интенсивности иммуноцитохимической реакции астроцитов крыс на GS после гипероксии позволяет предположить, что гипербарический кислород ингибирует синтез этого фермента, что в конечном итоге может сказаться и на его активности. Существуют лишь единичные работы, в которых показано снижение активности GS в ткани мозга после экспозиции крыс в гипербарическом кислороде при давлении 5 АТА [5] и недостоверные изменения активности фермента под давлением кислорода 3 АТА [24]. Доказательством снижения ферментативной активности GS могут служить данные о снижении глутамина в мозге как следствие угнетения его синтеза при ГБО2. Однако целенаправленные измерения глутамина в условиях ГБО2 не проводились и лишь в одной работе показано уменьшение его содержания в мозге после кислородных судорог [25].
Убедительных доказательств изменения активности GS в гипербарической кислородной среде пока не получено, тем не менее существуют, по меньшей мере, три группы косвенных данных, свидетельствующих в пользу ингибирования ферментативной активности GS в экстремальной гипероксии. К первой группе следует отнести выявленное в настоящей работе уменьшение количества GS в виде снижения интенсивности ее окрашивания в астроцитах, что может свидетельствовать об угнетении активности фермента гипербарическим кислородом, принимая во внимание, что количество или масса фермента и его активность находятся в прямой зависимости [8]. Более того, показано, что интенсивность иммуноцитохимической реакции коррелирует с активностью фермента, измеряемой стандартными биохимическими методами [26, 27]. Вторая группа данных свидетельствует о том, что ферментативная активность GS в мозге снижается при многих заболеваниях, включая шизофрению, эпилепсию и болезнь Альцгеймера, при этом потеря активности GS при указанных патологиях сопровождается повышением концентрации внеклеточного глутамата, приводящего к гиперактивации нейронов [10–12].
И, наконец, третья группа данных свидетельствует о снижении активности GS с последующим развитием судорог после ее ингибирования экзогенными препаратами. В частности, метионинсульфоксимин вызывает необратимое ингибирование GS в головном мозге, при этом токсической дозой препарата является 150–180 мг/кг, вследствие введения которой у животных возникают судороги без дополнительных воздействий [28]. В наших исследованиях мы также использовали MSO, причем его введение за 6 ч до кислородной экспозиции в дозе 50 мг/кг вызывало уменьшение времени развития судорог почти в 2 раза, а в дозе 100 мг/кг – в 8 раз по отношению к латентному периоду развития кислородных судорог у животных, которым препарат не вводился. Известно, что в дозе 100 мг/кг MSO на 70% ингибирует активность GS через 6–8 ч после внутрибрюшинного введения [28].
Несмотря на ключевую роль GS в регуляции возбуждающих медиаторных процессов в ЦНС механизмы, которые регулируют ее активность, мало изучены. Показано, что GS фосфорилируется по остатку треонина 301 (T301) в активном сайте фермента с помощью cAMP-зависимой протеинкиназы (PKA). Повышенное фосфорилирование T301 было выявлено у мышей на модели эпилепсии и сопровождалось снижением активности фермента и резким снижением синтеза глутамина [29]. Кроме того, было показано, что белок GS чрезвычайно чувствителен к окислительному стрессу. Исследования ткани мозга пациентов с болезнью Альцгеймера демонстрировали повышение содержания маркеров окислительного стресса и снижение активности GS [30].
Другие данные свидетельствуют об участии нитрозативного стресса в изменении активности GS. Крысы с судорогами, вызванными введением каинатной кислоты, демонстрировали высокую активность NO-синтазы, повышенное образование оксида азота и снижение активности GS в мозге [31]. Оксид азота ковалентно связывается с GS и подавляет активность фермента, модифицируя его нитрозилированием или нитрованием [32]. Индукция судорог у крыс введением пентилентетразола также приводит к нитрованию GS в головном мозге с последующим снижением активности фермента [29]. В этой связи можно предположить, что одной из причин развития кислородных судорог является ингибирование GS путем S-нитрозилирования входящего в ее состав цистеина. Такая возможность была экспериментально доказана [33]. Кроме того, уже известно S-нитрозилирование глутаматдекабоксилазы, приводящее к ингибированию данного фермента и снижению синтеза ГАМК в мозге в условиях гипероксии [6].
Совместное действие кислорода под давлением и MSO, независимо от его концентрации, в наших экспериментах приводило к аддитивному просудорожному эффекту. Такой эффект двух токсических агентов может свидетельствовать о возможности их однонаправленного влияния на ферментативную активность глутаминсинтетазы. Известно, что MSO препятствует образованию активных комплексов с АТФ, что затрудняет ферментативную деятельность GS по превращению глутамата в глутамин, а ингибирование синтеза глутамина сопровождается накоплением в межклеточной среде глутамата, являющегося драйвером развития судорожного процесса [30]. Механизм ингибирования GS связан с SH-группами в молекуле GS [33], а поскольку кислород под давлением повреждает тиоловые группы цистеина глутаматдекарбоксилазы [6], нельзя исключать аналогичного механизма инактивации GS при экстремальной гипероксии.
Список литературы
Demchenko IT, Piantadosi CA (2006) Nitric oxide amplifies the excitatory to inhibitory neurotransmitter imbalance accelerating oxygen seizures. Undersea Hyperb Med 33(3): 169–174.
D'Agostino DP, Putnam RW, Dean JB (2007) Superoxide (*O2–) production in CA1 neurons of rat hippocampal slices exposed to graded levels of oxygen. J Neurophysiol 98(2): 1030–1041. https://doi.org/10.1152/jn.01003.2006
Wood JD, Watson WJ (1962) Protective action of gamma-aminobutyric acid against oxygen toxicity. Nature 195: 296. https://doi.org/10.1038/195296a0
Mialon P, Gibey R, Bigot JC, Barthelemy L (1992) Changes in striatal and cortical amino acid and ammonia levels of rat brain after one hyperbaric oxygen-induced seizure. Aviat Space Environ Med 63(4): 287–291.
Гершенович ЗС, Кричевская АА, Колоушек Я (1963) Действие кислорода под давлением на активность глутаминсинтетазы в мозгу крыс. Биохимия 28(2): 303–307. [Gershenovich ZS, Krichevskaya AA, Koloushek Ya (1963) Effect of hyperbaric oxygen on the activity of glutamine synthetase in the brain of rats. Biochemistry 28(2): 303–307. (In Russ)].
Gasier HG, Demchenko IT, Tatro LG, Piantadosi CA (2017) S-nitrosylation of GAD65 is implicated in decreased GAD activity and oxygen-induced seizures. Neurosci Lett 653: 283–287. https://doi.org/10.1016/j.neulet.2017.05.067
Newman EA (2003) New roles for astrocytes: regulation of synaptic transmission. Trends Neurosci 26: 536–542. https://doi.org/10.1016/S0166-2236(03)00237-6
Martinez-Hernandez A, Bell KP, Norenberg MD (1977) Glutamine synthetase: glial localization in brain. Science 195: 1365–1368. https://doi.org/10.1126/science.14400
Norenberg MD (1979) Distribution of glutamine synthetase in the rat central nervous system. J Histochem Cytochem 27: 756–762. https://doi.org/10.1177/27.3.39099
Robinson SR (2001) Changes in the cellular distribution of glutamine synthetase in Alzheimer’s disease. J Neurosci Res 66: 972–980. https://doi.org/10.1002/jnr.10057
Eid T, Tu N, Lee TS, Lai JC (2013) Regulation of astrocyte glutamine synthetase in epilepsy. Neurochem Int 63(7): 670–681. https://doi.org/10.1016/j.neuint.2013.06.008
Boksha IS, Tereshkina EB, Savushkina OK, Prokhorova TA, Vorobyeva EA, Burbaeva GSh (2018) Comparative Studies of Glutamine Synthetase Levels in the Brains of Patients with Schizophrenia and Mentally Healthy People. Neurochem J 12(1): 95–101. https://doi.org/10.1134/S1819712418010026
Dutuit M, Didier-Bazes M, Vergnes M, Mutin M, Conjard A, Akaoka H, Belin MF, Touret M (2000) Specific alteration in the expression of glial fibrillary acidic protein, glutamate dehydrogenase, and glutamine synthetase in rats with genetic absence epilepsy. Glia 32: 15–24. https://doi.org/10.1002/1098-1136(200010)32:1<15::aid-glia20>3.0.co;2-#
Korzhevskii DE, Sukhorukova EG, Kirik OV, Grigorev IP (2015) Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur J Histochem 59(3): 233–237. https://doi.org/10.4081/ejh.2015.2530
Racine RJ (1972) Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clin Neurophysiol 32(3): 281–294. https://doi.org/10.1016/0013-4694(72)90177-0
Varghese F, Bukhari AB, Malhotra R, De A (2014) IHC Profiler: an open source plugin for the quantitative evaluation and automated scoring of immunohistochemistry images of human tissue samples. PLoS One 9(5): e96801. https://doi.org/10.1371/journal.pone.0096801
Строев СА, Глущенко ТС, Тюлькова ЕИ, Миеттинен МТ, Самойлов МО (2018) Многократная умеренная гипобарическая гипоксия индуцирует экспрессию тиоредоксина-1 в гиппокампе и неокортексе крыс. Нейрохимия 35(1): 23–33. [Stroev SA, Glushchenko TS, Tyul’kova EI, Miettinen MT, Samoilov MO (2018) Multiple mild hypobaric hypoxia induces expression of thioredoxin-1 in the hippocampus and neocortex of rats. Neurochemistry 35(1): 23–33. (In Russ)]. https://doi.org/10.7868/S1027813318010144
Vetrovoy OV, Tyulkova EI, Stratilov VA, Baranova KA, Samoilov MO (2020) The pattern of DNA and histone H3 methylation in rat brain in response to severe hypobaric hypoxia and hypoxic postconditioning. Cell and Tissue Biol 14(1): 36–42. https://doi.org/10.1134/S1990519X20010101
RStudio Team (2020) RStudio: Integrated Development for R. RStudio. PBC. Boston. MA.
Moskvin AN, Platonova TPh, Zhilyaev SYu, Alekseeva OS, Nikitina ER, Demchenko IT (2020) Blockade of γ-Aminobutyric Acid Transporters in Brain Synapses Protects Against Hyperbaric Oxygen-Induced Convulsions. Neurosci Behav Physiol 50(4): 505–510. https://doi.org/10.1007/s11055-020-00930-1
Clark JM, Lambertsen CJ, Gelfand R, Troxel AB (2006) Optimization of oxygen tolerance extension in rats by intermittent exposure. J Appl Physiol 100(3): 869–879. https://doi.org/10.1152/japplphysiol.00047.2005
Demchenko IT, Welty-Wolf KE, Allen BW, Piantadosi CA (2007) Similar but not the same: normobaric and hyperbaric pulmonary oxygen toxicity, the role of nitric oxide. Am J Physiol Lung Cell Mol Physiol 293(1): L229–L238. https://doi.org/10.1152/ajplung.00450.2006
Hertz L, Zielke HR (2004) Astrocytic control of glutamatergic activity: astrocytes as stars of the show. Trends Neurosci 27(12): 735–743. https://doi.org/10.1016/j.tins.2004.10.008
Savilov PN, Yakovlev VN (2016) Effect of Liver Damage and Hyperbaric Oxygenation on Glutamine Synthetase of Hepatocytes. Bull Exp Biol Med 60(3): 295–297. https://doi.org/10.1007/s10517-016-3154-3
Schatz RA, Lal H (1980) Protection against hyperbaric oxygen toxicity by pargyline, succinic acid and ascorbic acid: Role of brain GABA and brain ammonia. Brain Res Bull 5(3): 781–788. https://doi.org/10.1016/0361-9230(80)90130-6
Berl S (1966) Glutamine synthetase. Determination of its distribution in brain during development. Biochemistry 3: 916–922. https://doi.org/10.1021/bi00867a016
Vogel WH, Heginbothom SD, Boehme DH (1975) Glutamic acid decarboxylase, glutamine synthetase and glutamic acid dehydrogenase in various areas of human brain. Brain Res 88: 131–135. https://doi.org/10.1016/0006-8993(75)90960-9
Manning JM, Moore S, Rowe WB, Meister A (1969) Identification of L-methionine S-sulfoximine as the diastereoisomer of L-methionine SR-sulfoximine that inhibits glutamine synthetase. Biochemistry 8(6): 2681–2685. https://doi.org/10.1021/bi00834a066
Bidmon HJ, Gorg B, Palomero-Gallagher N, Schleicher A, Haussinger D, Speckmann EJ, Zilles K (2008) Glutamine synthetase becomes nitrated and its activity is reduced during repetitive seizure activity in the pentylentetrazole model of epilepsy. Epilepsia 49(10): 1733–1748. https://doi.org/10.1111/j.1528-1167.2008.01642.x
Eid T, Thomas MJ, Spencer DD, Runden-Pran E, Lai JC, Malthankar GV, Kim JH, Danbolt NC, Ottersen OP, de Lanerolle NC (2004) Loss of glutamine synthetase in the human epileptogenic hippocampus: possible mechanism for raised extracellular glutamate in mesial temporal lobe epilepsy. Lancet 363: 28–37. https://doi.org/10.1016/s0140-6736(03)15166-5
Swamy M, Yusof WR, Sirajudeen KN, Mustapha Z, Govindasamy C (2011) Decreased glutamine synthetase, increased citrulline-nitric oxide cycle activities, and oxidative stress in different regions of brain in epilepsy rat model. J Physiol Biochem 67: 105–113. https://doi.org/10.1007/s13105-010-0054-2
Kosenko E, Llansola M, Montoliu C, Monfort P, Rodrigo R, Hernandez-Viadel M, Erceg S, Sanchez-Perez AM, Felipo V (2003) Glutamine synthetase activity and glutamine content in brain: modulation by NMDA receptors and nitric oxide. Neurochem Int 43: 493–499. https://doi.org/10.1016/s0197-0186(03)00039-1
Raju K, Doulias PT, Evans P, Krizman EN, Jackson JG, Horyn O, Daikhin Y, Nissim I, Yudkoff M, Nissim I, Sharp KA, Robinson MB, Ischiropoulos H (2015) Regulation of brain glutamate metabolism by nitric oxide and S-nitrosylation. Sci Signal 8(384): ra68. https://doi.org/10.1126/scisignal.aaa4312
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова