Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1379-1390
Тест-система для контроля генетической чистоты трансгенных линий мышей, экспрессирующих биосенсоры хлора и водорода
Ю. Н. Давидюк 1, *, А. Х. Юсупова 2, Е. О. Петухова 1, 2, П. Д. Брежестовский 2, 3, **
1 Институт фундаментальной медицины и биологии,
Казанский (Приволжский) федеральный университет
Казань, Россия
2 Институт нейронаук, Казанский государственный медицинский университет
Казань, Россия
3 Institut de Neurosciences des Systemes, Aix-Marseille University, INSERM, INS
Marseille, France
* E-mail: davi.djuk@mail.ru
** E-mail: pbreges@gmail.com
Поступила в редакцию 07.07.2022
После доработки 12.09.2022
Принята к публикации 13.09.2022
- EDN: YXEHYK
- DOI: 10.31857/S086981392210003X
Аннотация
Модели с генетическими манипуляциями животных получили широкое применение в разных областях медицины и биологических исследованиях. В последние десятилетия были созданы тысячи генетически модифицированных трансгенных моделей мышей, и их производство ускоряется. Поэтому важной проблемой является поддержание и контроль генетической чистоты линий. В наших исследованиях используются линии трансгенных мышей, экспрессирующих в нейронах генетически кодируемые зонды для неинвазивной регистрации ионов хлора (“Cl-Sensor”) и одновременной регистрации хлора и водорода (“ClopHensor”). Для поддержания чистоты этих линий нами разработана тест-система для генотипирования трансгенных мышей. Подход характеризуется высокой достоверностью результатов и может быть использован для проведения дальнейшего контроля за генетической чистотой этих линий, а также контроля линий животных с незначительно различающимися участками аминокислотных последовательностей.
В последние десятилетия в рамках исследований в области фотофармакологии и оптосенсорики все шире применяются модели на основе генетически модифицированных линий млекопитающих, в частности лабораторных мышей [1–3]. При этом важной проблемой является поддержание и контроль генетической чистоты линий, так как на нее могут влиять ряд факторов [4]. Генетически модифицированные мыши могут изменять функцию гена путем сверхэкспрессии, элиминации или модификации генного продукта [5, 6]. В частности, было показано, что мутационный процесс в отдельных линиях мышей может приводить к делециям, инсерциям или локальным мутациям, вследствие чего аллели могут не только утратить свои функции, но и приобрести гипоморфный или гиперморфный характер [7]. Также нельзя исключать вероятность случайного скрещивания особей, содержащих различные гены, вследствие чего перед проведением исследований необходимо убедиться в чистоте популяции [4, 8, 9]. Кроме того, необходимо учитывать человеческий фактор при поддержании линий лабораторных животных, который может приводить к смешению линий и появлению гибридного потомства [10]. Поэтому в лабораторной практике применяется ряд методов генотипирования особей поддерживаемых линий [11, 12]. Так, для идентификации и контроля генетической чистоты линий мышей предложены методы ПЦР-анализа и секвенирования коротких тандемных повторяющихся последовательностей [4, 9], ПЦР-анализа и Саузерн-блоттинга геномной ДНК [6, 13], флуоресцентной микроскопии [14].
Таким образом, постоянный контроль генетической чистоты является необходимой процедурой при проведении исследований с использованием трансгенных линий мышей [4, 6]. В наших исследованиях используются созданные ранее линии трансгенных мышей, экспрессирующих в нейронах генетически кодируемые зонды для неинвазивной регистрации ионов хлора (“Cl-Sensor”) [15, 20, 22, 23] и одновременной регистрации хлора и водорода (“ClopHensor”) [15, 16]. Эти зонды созданы на базе производных зеленого флуоресцентного белка и имеют пересекающиеся спектральные характеристики, а также незначительно различающиеся участки аминокислотных последовательностей [17]. В процессе работы произошло смешивание этих линий и возникла задача их надежного разделения. Поэтому целью исследования была разработка тест-системы для генотипирования используемых линий, обеспечивающей высокую достоверность результатов. Поскольку до настоящего времени тест-системы для генотипирования данных линий разработаны не были, наша тест-система является первой, предназначенной для решения поставленной задачи, что придает исследованию особую ценность.
Современные технологии генной инженерии позволяют манипулировать геномами животных, обеспечивая платформу для создания все более сложных способов моделирования болезней, а также биосенсорных систем для контроля многих биологических компонент. За последние десятилетия были созданы тысячи генетически модифицированных трансгенных линий мышей [8]. Этот процесс требует все более тщательного контроля поддержания чистоты создаваемых линий животных. Предлагаемая нами тест-система является одним из простых и эффективных подходов которые могут быть использованы для поддержания линий трансгенных животных экспрессирующих генетически кодируемые биосенсоры.
МЕТОДЫ ИССЛЕДОВАНИЯ
Трансгенные линии мышей, экспрессирующих “Cl-Sensor” и “ClopHensor”
Биологическим материалом для ПЦР-исследования служили трансгенные мыши в возрасте от 2 мес. до 1 года линий “Cl-Sensor” и “ClopHensor”, различающиеся последовательностью конструкта, встроенного в локус ROSA26 6-й хромосомы мышиного генома [42] и экспрессирующегося в нейронах (рис. 1).
Рис. 1.
Схема генетических конструктов экспрессированных в нейронах трансгенных мышей: a – Cl-Sensor; b – ClopHensor. Стрелками указана локализация сайтов отжига праймеров (без соблюдения масштаба). Последовательности сайтов отжига обратных праймеров выделены красным шрифтом.
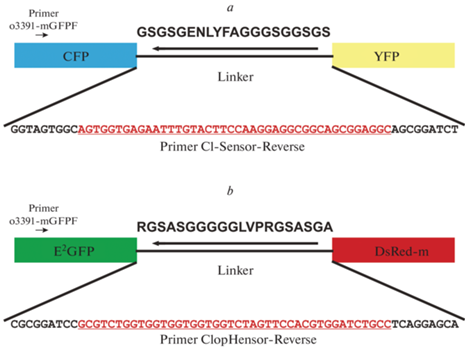
Cl–-Sensor – это генетически сконструированный белок, состоящий из цианового флуоресцентного белка (CFP) и желтого флуоресцентного белка (YFP), соединенных гибким линкером из 20 аминокислот (рис. 1a). CFP является референтным белком, а YFP – сенсором хлора, флуоресценция которого уменьшается при повышении концентрации этого аниона. Три мутации в последовательности YFP придают ему высокую чувствительность к хлору (IC50 ≈ 30 мМ), что позволяет проводить измерения в физиологическом диапазоне внутриклеточных концентраций аниона [20].
ClopHensor состоит из модифицированного зеленого флуоресцентного белка E2GFP и красного флуоресцентного белка DsRed-m, соединенных гибким линкером, отличающимся по аминокислотному составу от используемого в Cl–-Sensor (рис. 1b). В данной конструкции E2GFP является сенсором хлора, а DsRed-m – референтным белком, применяемым для ратиометрических измерений pH и концентрации ионов хлора в цитоплазме [17, 21].
Регистрация хлор-специфичного сигнала осуществляется путем расчета отношения интенсивности эмиссии при облучении сенсора светом с длиной волны 458 нм (изобестическая точка, в которой пересекаются спектры возбуждения при различных значениях рН) к интенсивности эмиссии при облучении светом с длиной волны более 560 нм (референтному диапазону красного флуоресцентного белка). Наличие изобестической точки рН при 458 нм обеспечивает одновременную регистрацию двух ионов (Cl– и H+).
Спектр возбуждения ClopHensor имеет два заметных пика с максимумами около 515 и 560 нм, соответствующие E2GFP и DsRed-m [17]. В целом, спектральные изменения ClopHensor идеально подходят для ратиометрической работы в трех диапазонах длин волн возбуждения: ≈458, 490–510 и 560–590 нм.
Линии мышей были получены с использованием нейронального промотора Thy1, который стимулирует устойчивую экспрессию в различных типах нейронов центральной нервной системы [24–26], следуя процедурам, которые описаны ранее [15, 16]. Для получения линий мышей, экспрессирующих Cl-Sensor и ClopHensor использовали штамм лабораторных мышей C57BL/6.
Все процедуры с животными одобрены локальным этическим комитетом Казанского государственного медицинского университета (№ 10; 20.12.2016). Животные содержались при естественном освещении и температуре воздуха 22 ± 2°C с постоянным доступом к комбинированному корму и воде.
ПЦР анализ смешанной популяции трансгенных мышей
Для выделения ДНК использовали фрагменты ушей и хвостов длиной 3–5 мм, которые хранили при температуре –20°С. Выделение общей ДНК проводили с использованием набора реагентов “QIAamp DNA MiniKit” (Qiagen, Германия) согласно рекомендациям производителя. Определение концентрации выделенной ДНК проводили с помощью бескюветного спектрофотометра NanoDropND-1000 (ThermoFisherScientific, США).
Для проведения генотипирования особей был использован метод ПЦР с электрофоретической детекцией продуктов амплификации. В качестве прямого праймера был использован праймер o3391-mGFPF [16] и рассчитаны последовательности обратных праймеров для ПЦР, соответствующие линкерным участкам генетических конструктов (табл. 1).
Таблица 1.
Последовательности праймеров для проведения генотипирования трансгенных мышей линий “Cl-Sensor” и “ClopHensor” методом ПЦР
| Шифр праймера | Нуклеотидная последовательность, 5' → 3' | Длина, нуклеотиды |
|---|---|---|
| o3391-mGFPF | ccctgaagttcatctgcacc | 20 |
| Cl-Sensor-Reverse | gcctccgctgccgcctccttggaagtacaaattctcaccact | 42 |
| ClopHensor-Reverse | ggcagatccacgtggaactagaccaccaccaccaccagacgc | 42 |
ПЦР проводили с использованием реакционной смеси “ScreenMix” (Евроген, Россия) на термоциклере С1000 (Bio-Rad, США). Для проведения ПЦР готовили реакционную смесь объемом 10 мкл состава: 5× ScreenMix – 2.0 мкл, прямой праймер (20 мкМ) – 0.1 мкл; обратный праймер (20 мкМ) – 0.1 мкл, препарат ДНК (7–20 нг) – 0.3 мкл; H2O – 7.5 мкл.
После ряда этапов оптимизации ПЦР-амплификацию проводили по следующей программе: 1) 94°С – 2 мин; 2) 35 циклов: 94°С – 30 с; 55°С – 30 с; 72°С – 45 с; 3) 72°С – 5 мин; 4) 10°С – ∞.
Продукты ПЦР-амплификации разделяли методом гель-электрофореза в 1.0%‑ном агарозном геле с использованием электрофорезной горизонтальной системы Sub-Cell GT Cell (Bio-Rad, США) и документировали с помощью системы мультиплексной визуализации GelDoc XR+ (Bio-Rad, США).
Приготовление переживающих срезов мозга и их визуализация
Анестезированных изофлураном мышей декапитировали, головной мозг извлекали и помещали в ледяной раствор с высоким содержанием калия следующего состава: 120 мM K-глюконат, 10 мM HEPES-acid, 15 мM Na-глюконат, 0.2 мM EGTA и 4 мM NaCl (pH 7.2, 290–300 мОсм/л). По истечении одной минуты выделяли большие полушария головного мозга и монтировали для приготовления сагиттальных срезов (350 мкм) на моторизованном виброслайсере NVSLM (World Precision Instruments, США). Приготовление срезов осуществляли в ледяном растворе с высоким содержанием калия. Готовые срезы помещали на 20 мин в инкубационную камеру с раствором искусственной цереброспинальной жидкости (ACSF) с повышенным содержанием магния (в мМ): NaCl – 126; KCl 3.5; NaH2PO4 – 1.2; глюкоза 10; NaHCO3 – 25; MgCl2 – 10; CaCl2 – 0.5 (pH 7.3–7.4 при постоянной оксигенации карбогеном; 290–300 мОсм/л, комнатная температура), после чего в течение как минимум часа инкубировали в нормальном ACSF (в мМ): NaCl – 126; KCl – 3.5; NaH2PO4 – 1.2; глюкоза – 10; NaHCO3 – 25; MgCl2 – 1.3; CaCl2 – 2 (pH 7.3–7.4 при постоянной оксигенации карбогеном; 290–300 мОсм/л, комнатная температура).
Срезы визуализировали при помощи прямого флуоресцентного микроскопа Olympus BX51WI, оборудованного водно-иммерсионными объективами ×10 и ×60, видеокамерой iXon Life 897 EMCCD (Andor, Oxford Instruments, Великобритания), четырехканальным светодиодным источником света (LED4D001, Thorlabs, США), 4-канальным драйвером для светодиодов (DC4100, Thorlabs, США) и набором четырехполосных фильтров (Chroma, Foothill Ranch, США). Управление компонентами установки осуществляли при помощи программного обеспечения Micro-Manager [18] или DriverLed (Казанский государственный медицинский университет, Казань). Эмиссию флуоресцентных белков в составе сенсоров индуцировали путем облучения светом с длинами волн 455, 505 и 590 нм. Экспозиция съемки при получении изображений составляла от 30 до 500 мс.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Разделение линий с помощью ПЦР-анализа
Всего были выделены ДНК от 227 особей трансгенных мышей. Концентрация выделенной ДНК составила 25–77 нг/мкл. Для всех выделенных ДНК была проведена ПЦР-амплификация целевого участка генома с целью генотипирования особей трансгенных мышей.
В результате ПЦР-амплификации были получены продукты длиной приблизительно 650–700 пар нуклеотидов (пн), что близко к ожидаемой длине 644 и 638 пн для “Cl-Sensor” и “ClopHensor” соответственно. Примеры результатов разделения продуктов ПЦР-амплификации участков ДНК некоторых особей трансгенных мышей представлены на рис. 2 и 3.
Рис. 2.
Электрофореграмма результатов разделения с использованием детекции ПЦР-продуктов методом гель-электрофореза: а-2–а-24 – номера образцов, C+ – положительный контроль, C– – отрицательный контроль, М – маркер длин фрагментов ДНК (GeneRuler 1 kb DNA Ladder (“Thermo Fisher Scientific”, США)).
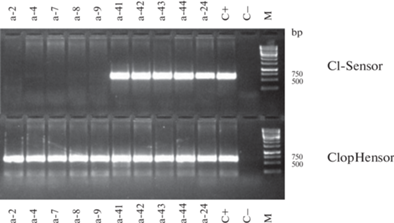
Рис. 3.
Электрофореграмма результатов разделения с использованием детекции ПЦР-продуктов методом гель-электрофореза: а-93–а-116 – номера образцов, C+ – положительный контроль, C– – отрицательный контроль, М – маркер длин фрагментов ДНК (GeneRuler 1 kb DNA Ladder (“Thermo Fisher Scientific”, США)).
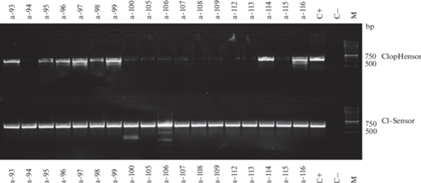
ПЦР-продукт, соответствующий ожидаемому для генетически чистой линии “ClopHensor”, образовался у образцов а-2, а-4, а-7, а-8, а-9. У образцов а-41, а-42, а-43, а-44, а-24 образовались ПЦР-продукты, соответствующие линиям “ClopHensor” и “Cl-Sensor”, т.е. эти особи являются носителями гибридных геномов (рис. 2).
ПЦР-продукт, соответствующий ожидаемому для генетически чистой линии “Cl-Sensor”, образовался у образцов а-100, а-105 – а-109, а-112, а-113, а-115. У образцов а-96, а-95 – а-99, а-114, а-116 образовались ПЦР-продукты, соответствующие линиям “ClopHensor” и “Cl-Sensor”, т.е. эти особи являются носителями гибридных геномов (рис. 3).
Проверка надежности разделения линий трансгенных мышей
Для дополнительной проверки надежности результатов генотипирования линий было использовано два подхода: (i) рандомное секвенирование ПЦР-продуктов и (ii) визуализация флуоресцентных сигналов в срезах мозга.
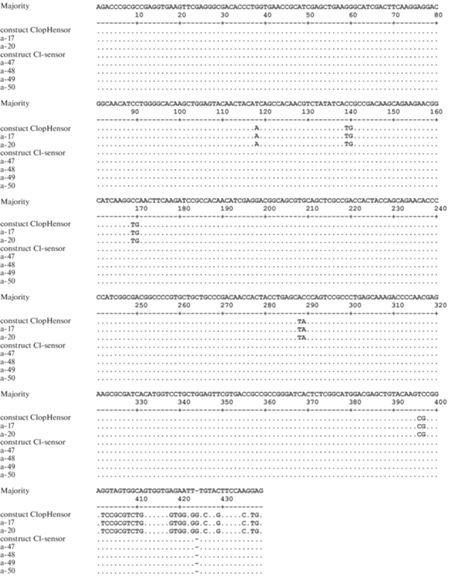
Для валидации результатов генотипирования в Междисциплинарном центре протеомных исследований КФУ на секвенаторе ABI PRISM 310 с использованием набора реагентов “Big Dye Terminator 3.1 sequencing kit” (ABI, США) было проведено рандомное секвенирование по Сэнгеру ПЦР-продуктов, полученных от 6 особей, идентифицированных, как относящихся к линиям “Cl-Sensor” и “ClopHensor”. Для секвенирования были использованы праймеры o3391-mGFPF и o3392-mGFPR [16]. Результаты, полученные методом секвенирования, во всех случаях совпали с результатами генотипирования методом ПЦР-анализа (рис. 4).
Рис. 4.
Нуклеотидные последовательности секвенированного участка генома мышей линий “Cl-Sensor” и “ClopHensor” и соответствующих генетических конструктов: a-17, a-20, a-47, a-48, a-49, a-50 – образцы.
Также с применением методов флуоресцентной микроскопии была проведена визуализация экспрессии сенсоров в нейронах срезов гиппокампа мышей генотипированных особей. Принципиальным отличием линий мышей, экспрессирующих “ClopHensor”, является наличие белка DsRed-m, светящегося в красном диапазоне длин волн, в то время как при более коротких длинах волн флуоресцентные сигналы пересекаются. Поэтому проводилась регистрация хлор- и pH-специфичных сигналов, появляющихся при последовательном облучении срезов возбуждающим светом со следующими длинами волны: 590, 505 и 455 нм [19]. На рис. 5 представлены микрофотографии переживающих срезов мозга мыши линии “C-lopHensor” на уровне CA1 зоны гиппокампа. Сенсор визуализируется на всех трех каналах.
Рис. 5.
Микрофотографии переживающих срезов мозга на уровне CA1 зоны гиппокампа, полученных от мыши, экспрессирующей ClopHensor (возраст – 6 дней) и мыши, экспрессирующей Cl-Sensor (возраст – 5 мес.). Эмиссию регистрировали при облучении препаратов возбуждающим светом со следующими длинами волны: 455, 505 и 590 нм. У мышей, экспрессирующих Cl-Sensor, отсутствует специфичная для ClopHensor эмиссия в красной части спектра. Масштабная линейка – 25 мкм.
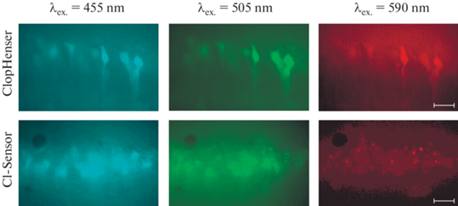
Поскольку Cl-Sensor, состоящий из цианового флуоресцентного белка и модифицированного желтого флуоресцентного белка, не обладает эмиссией в красной области спектра, чистота трансгенной линии “Cl-Sensor” была подтверждена отсутствием флуоресцентного сигнала при возбуждении волнами света длиной 590 нм и одновременным наличием флуоресценции на каналах 505 и 455 нм (рис. 5).
Следовательно, мыши, идентифицированные по результатам генотипирования как относящиеся к линиям “Cl-Sensor” или “ClopHensor”, продемонстрировали соответствующие спектры флуоресценции в нейронах головного мозга.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Главной платформой для моделирования заболеваний человека в биомедицинских исследованиях являются грызуны, прежде всего трансгенные мыши [28, 30, 32]. Благодаря секвенированию генома этого вида животных, появилась возможность создавать линии трансгенных мышей со встроенными или удаленными генетически белками, или другими генетически кодируемыми молекулами [2, 27, 31]. Были созданы тысячи генетически модифицированных трансгенных линий мышей, в частности экспрессирующих конструкции, основанные на разных вариантах зеленого флуоресцентного белка [29, 36–38] и биосенсоры [15, 16, 33, 34].
Разведение и содержание генетически модифицированных мышей требует точного и тщательного контроля генетической чистоты линий. Особые условия содержания могут быть важны, в зависимости от характера мутаций. Например, мышей с ослабленным иммунитетом необходимо содержать в строгих условиях, свободных от специфических патогенов, предпочтительно в барьерном помещении [39]. Неожиданные проблемы с разведением и поддержанием чистоты линий животных могут возникнуть несмотря на все усилия по созданию подходящих и специфичных условий разведения и содержания. Диагностировать проблему сложно, так как она, вероятно, является результатом сочетания ряда факторов, таких как мутационные/трансгенные эффекты, факторы окружающей среды, острые или хронические заболевания [40].
Часто генетическим фоном выбора для содержания генетически модифицированных мышей является C57BL/6. Тем не менее, может быть необходимо или даже предпочтительно поддерживать трансгенную линию на другом гибридном фоне, чтобы облегчить проблемы размножения или справиться с поддержанием популяции.
Как указывалось, ряд спонтанных процессов в геноме трансгенных особей, а также обстоятельства, связанные с человеческим фактором, могут приводить к появлению в популяции особей с геномом, отличающимся от гомозиготного генома исходных линий. Поэтому постоянный контроль за генетической чистотой линий является абсолютно необходимым. Проведение такого контроля представляется особенно важным в случае одновременного поддержания линий, содержащими близкие генетические конструкции. Поэтому важной задачей является выбор метода генотипирования, позволяющего быстро и надежно различать особей с близкими, но разными генотипами. При этом желательно также, чтобы метод отличался простотой и дешевизной.
В настоящее время для генотипирования однонуклеотидных полиморфизмов широко используется метод аллель-специфичной ПЦР (АС-ПЦР), позволяющий различать аллели гена, отличающиеся на один нуклеотид, и дающий возможность легкого определения гомо- и гетерозигот. Ранее этот метод был использован нами для определения генотипа по мутации 1911A > G в гене TRPV1 человека [41]. Поскольку основной сложностью задачи нашего исследования было различение гомо- и гетерозиготных особей, то для генотипирования особей линий “Cl-Sensor” и “ClopHensor” был выбран метод ПЦР в его модификации, аналогичной АС-ПЦР. Выбор метода был связан, в первую очередь, с его эффективностью и достоверностью результатов генотипирования. Немаловажными преимуществами выбранного метода является также относительная дешевизна реагентов и оборудования, достаточно высокая производительность, быстрота определения и отсутствие необходимости в высокой квалификации персонала.
Для проведения ПЦР нами были рассчитаны последовательности обратных праймеров, соответствующие нуклеотидной последовательности линкерных участков генетических конструктов “Cl-Sensor” и “ClopHensor” (рис. 1 и табл. 1). Значение идентичности нуклеотидной последовательности линкеров этих конструктов составило 56%, что позволило достичь достаточной специфичности при проведении ПЦР, подтвержденной результатами секвенирования (рис. 4).
Основным недостатком выбранного метода является возможное получение ложноположительных результатов ПЦР. Для уменьшения их количества и достижения в перспективе 100%-ной специфичности ПЦР было проведено несколько этапов оптимизации реакции, в ходе которых были подобраны оптимальные температура отжига и количество циклов амплификации, позволяющие достичь достаточной достоверности результатов. Тем не менее, в ходе дальнейшей оптимизации мы планируем достичь полного исключения ложноположительных результатов тестирования.
Таким образом, разработанная тест-система обеспечила достаточную достоверность результатов генотипирования и может быть использована как для разделения особей трансгенных мышей линий “Cl-Sensor” и “ClopHensor” и их гибридов, так и для проведения генетического контроля при поддержании этих линий. Вероятно, аналоги разработанной тест-системы могут быть использованы и для выполнения таких же задач для других линий трансгенных мышей с малоразличающимися по нуклеотидной последовательности генетическими конструктами.
ЗАКЛЮЧЕНИЕ
Разработанная тест-система для генотипирования трансгенных мышей линий “Cl-Sensor” и “ClopHensor” характеризуется высокой достоверностью результатов и может быть использована для проведения дальнейшего контроля за генетической чистотой линий, а также контроля линий животных с участками, незначительно различающимися по нуклеотидной последовательности.
Список литературы
Asrican B, Augustine GJ, Berglund K, Chen S, Chow N, Deisseroth K, Feng G, Gloss B, Hira R, Hoffmann C, Kasai H (2013) Next-generation transgenic mice for optogenetic analysis of neural circuits. Front Neural Circuits 7: 160. https://doi.org/10.3389/fncir.2013.00160
Ting JT, Feng G (2013) Development of transgenic animals for optogenetic manipulation of mammalian nervous system function: progress and prospects for behavioral neuroscience. Behav Brain Res 255: 3–18. https://doi.org/10.1016/j.bbr.2013.02.037
Partridge JG (2015) Utilizing GCaMP transgenic mice to monitor endogenous Gq/11-coupled receptors. Front Pharmacol 6: 42. https://doi.org/10.3389/fphar.2015.00042
Almeida JL, Dakic A, Kindig K, Kone M, Letham DLD, Langdon S, Peat R, Holding-Pillai J, Hall EM, Ladd M, Shaffer MD, Berg H, Li J, Wigger G, Lund S, Steffen CR, Fransway BB, Geraghty B, Natoli M, Bauer B, Gollin SM, Lewis DW, Reid Y (2019) Interlaboratory study to validate a STR profiling method for intraspecies identification of mouse cell lines. PLoS One 14(6): e0218412. https://doi.org/10.1371/journal.pone.0218412
Silva AJ, Simpson EM, Takahashi JS, Lipp HP, Nakanishi S, Wehner JM, Giese KP, Tully T, Abel T, Chapman PF, Fox K (1997) Mutant mice and neuroscience: recommendations concerning genetic background. Neuron 19(4): 755–759. https://doi.org/10.1016/S0896-6273(00)80958-7
Haruyama N, Cho A, Kulkarni AB (2009) Overview: engineering transgenic constructs and mice. Current Protocol Cell Biol 42: 19.10.1–19.10.9. https://doi.org/10.1002/0471143030.cb1910s42
Benavides F, Rülicke T, Prins J-B, Bussell J, Scavizzi F, Cinelli P, Herault Y, Wedekind D (2020) Genetic quality assurance and genetic monitoring of laboratory mice and rats: FELASA Working Group Report 54(2): 135–148. https://doi.org/10.1177/0023677219867719
Linder CC (2003) Mouse nomenclature and maintenance of genetically engineered mice. Compar Med 53(2): 119–125.
Almeida JL, Hill CR, Cole KD (2014) Mouse cell line authentication. Cytotechnology 66: 133–147. https://doi.org/10.1007/s10616-013-9545-7
Lusis AJ, Yu J, Wang SS (2007) The Problem of Passenger Genes in Transgenic Mice. Am Heart Associat 27: 2100–2103. https://doi.org/10.1161/ATVBAHA.107.147918
Dennis MB (2002) Welfare issues of genetically modified animals. ILAR J 43(2): 100–109. https://doi.org/10.1093/ilar.43.2.100
Wolfer DP, Crusio WE and Lipp HP (2002) Knockout mice: simple solutions to the problems of genetic background and flanking genes. Trends Neurosci 25(7): 336–340. https://doi.org/10.1016/S0166-2236(02)02192-6
Costinean S, Zanesi N, Pekarsky Y, Tili E, Volinia S, Heerema N, Croce CM (2006) Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in Eμ-miR155 transgenic mice. Proc Natl Acad Sci U S A 103(18): 7024–7029. https://doi.org/10.1073/pnas.0602266103
Takada T, Awaji T, Itoh K, Takahashi R, Shibui A, Yoshida K, Sugano S, Tsujimoto G (1997) Selective production of transgenic mice using green fluorescent protein as a marker. Nature Biotechnol 15(5): 458–461. https://doi.org/10.1038/nbt0597-458
Batti L, Mukhtarov M, Audero E, Ivanov A, Paolicelli RC, Zurborg S, Gross C, Bregestovski P, Heppenstall PA (2013) Transgenic mouse lines for non-invasive ratiometric monitoring of intracellular chloride. Front Mol Neurosci 6: 11. https://doi.org/10.3389/fnmol.2013.00011
Diuba AV, Samigullin DV, Kaszas A, Zonfrillo F, Malkov A, Petukhova E, Casini A, Arosio D, Esclapez M, Gross CT, Bregestovski P (2020) CLARITY analysis of the Cl/pH sensor expression in the brain of transgenic mice. Neuroscience 439: 181–194. https://doi.org/10.1016/j.neuroscience.2019.07.010
Bregestovski P, Arosio D (2011) Green Fluorescent Protein-Based Chloride Ion Sensors for In Vivo Imaging. In: Jung G (eds) Fluorescent Proteins II. Springer Series on Fluorescence 12 Springer Berlin Heidelberg. https://doi.org/10.1007/4243_2011_27
Edelstein AD, Tsuchida MA, Amodaj N, Pinkard H, Vale RD (2014) Advanced methods of microscope control using μManager software. J Biol Methods 1(2): 1–10. https://doi.org/10.14440/jbm.2014.36
Ponomareva D, Petukhova E, Bregestovski P (2021) Simultaneous Monitoring of pH and Chloride (Cl-) in Brain Slices of Transgenic Mice. Int J Mol Sci 22(24): 13601. https://doi.org/10.3390/ijms222413601
Markova O, Mukhtarov M, Real E, Jacob Y, Bregestovski P (2008) Genetically encoded chloride indicator with improved sensitivity. J Neurosci Methods 170(1): 67–76. https://doi.org/10.1016/j.jneumeth.2007.12.016
Arosio D, Ricci F, Marchetti L, Gualdani R, Albertazzi L, Beltram F (2010) Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nature Methods 7(7): 516–518. https://doi.org/10.1038/nmeth.1471
Mukhtarov M, Markova O, Real E, Jacob Y, Buldakova S and Bregestovski P (2008) Monitoring of chloride and activity of glycine receptor channels using genetically encoded fluorescent sensors. Philosoph Transact Royal Soc A: Mathemat Physical Engineer Sci 366(1880): 3445–3462. https://doi.org/10.1098/rsta.2008.0133
Waseem T, Mukhtarov M, Buldakova S, Medina I, Bregestovski P (2010) Genetically encoded Cl-Sensor as a tool for monitoring of Cl-dependent processes in small neuronal compartments. J Neurosci Methods 193(1): 14–23. https://doi.org/10.1016/j.jneumeth.2010.08.002
Caroni P (1997) Overexpression of growth-associated proteins in the neurons of adult transgenic mice. J Neurosci Methods 71(1): 3–9. https://doi.org/10.1016/S0165-0270(96)00121-5
Arenkiel BR, Peca J, Davison IG, Feliciano C, Deisseroth K, Augustine GJ, Ehlers MD, Feng G (2007) In vivo light-induced activation of neural circuitry in transgenic mice expressing channelrhodopsin-2. Neuron 54(2): 205–218. https://doi.org/10.1016/j.neuron.2007.03.005
Berglund K, Schleich W, Wang H, Feng G, Hall WC, Kuner T, Augustine GJ (2008) Imaging synaptic inhibition throughout the brain via genetically targeted Clomeleon. Brain Cell Biol 36: 101–118. https://doi.org/10.1007/s11068-008-9031-x
Bradley A (2002) Mining the mouse genome. Nature 420: 512–514. https://doi.org/10.1038/420512a
Zhang Z, Carriero N, Gerstein M (2004) Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends Genetics 20(2): 62–67. https://doi.org/10.1016/j.tig.2003.12.005
Feng G, Mellor RH, Bernstein M, Keller-Peck C, Nguyen QT, Wallace M, Nerbonne JM, Lichtman JW, Sanes JR (2000) Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron 28(1): 41–51. https://doi.org/10.1016/S0896-6273(00)00084-2
Bryan KJ, Lee HG, Perry G, Smith MA, Casadesus G (2011) Transgenic mouse models of Alzheimer’s disease: behavioral testing and considerations. Front Neurosci 2(1).
Yang XW, Gong S (2005) An overview on the generation of BAC transgenic mice for neuroscience research. Current Protocols Neurosci 31(1): 5–20. https://doi.org/10.1002/0471142301.ns0520s31
Navabpour S, Kwapis JL, Jarome TJ (2020) A neuroscientist’s guide to transgenic mice and other genetic tools. Neurosci Biobehav Rev 108: 732–748. https://doi.org/10.1016/j.neubiorev.2019.12.013
Kamioka Y, Sumiyama K, Mizuno R, Sakai Y, Hirata E, Kiyokawa E, Matsuda M (2012) Live imaging of protein kinase activities in transgenic mice expressing FRET biosensors. Cell Struct Funct 37(1): 65–73. https://doi.org/10.1247/csf.11045
Halls ML, Canals M (2018) Genetically encoded FRET biosensors to illuminate compartmentalised GPCR signalling. Trends Pharmacol Sci 39(2): 148–157. https://doi.org/10.1016/j.tips.2017.09.005
Gong B, Kielar C, Morton AJ (2012) Temporal separation of aggregation and ubiquitination during early inclusion formation in transgenic mice carrying the Huntington’s disease mutation. PloS One 7(7): e41450. https://doi.org/10.1371/journal.pone.0041450
Vázquez-Chona FR, Clark AM, Levine EM (2009) Rlbp1 promoter drives robust Müller glial GFP expression in transgenic mice. Invest Ophthalmol Visual Sci 50(8): 3996–4003. https://doi.org/10.1167/iovs.08-3189
Bridge KE, Berg N, Adalbert R, Babetto E, Dias T, Spillantini MG, Ribchester RR, Coleman MP (2009) Late onset distal axonal swelling in YFP-H transgenic mice. Neurobiol Aging 30(2): 309–321. https://doi.org/10.1016/j.neurobiolaging.2007.06.002
Taylor-Clark TE, Wu KY, Thompson JA, Yang K, Bahia PK, Ajmo JM (2015) Thy1. 2 YFP-16 transgenic mouse labels a subset of large-diameter sensory neurons that lack TRPV1 expression. PLoS One 10(3): e0119538. https://doi.org/10.1371/journal.pone.0119538
Mombaerts P, Iacomini J, Johnson RS, Herrup K, Tonegawa S, Papaioannou VE (1992) RAG-1-deficient mice have no mature B and T lymphocytes. Cell 68(5): 869–877. https://doi.org/10.1016/0092-8674(92)90030-G
Suckow MA, Danneman P, Brayton C (2001) The laboratory mouse. CRC Press Inc 1(1). https://doi.org/10.1201/9780849376276
Yakubova A, Davidyuk Y, Tohka J, Khayrutdinova O, Kudryavtsev I, Nurkhametova D, Kamshilin A, Giniatullin R, Rizvanov A (2021) Searching for Predictors of Migraine Chronification: a Pilot Study of 1911A > G Polymorphism of TRPV1 Gene in Episodic Versus Chronic Migraine. J Mol Neurosci 71: 618–624. https://doi.org/10.1007/s12031-020-01683-9
Casola S (2010). Mouse models for miRNA expression: the ROSA26 locus. In: MicroRNAs and the Immune System. Humana Press. Totowa. 145–163. https://doi.org/10.1007/978-1-60761-811-9_10
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


