Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1365-1378
Сравнительное исследование поведения в водном лабиринте Морриса крыс линии Wistar, длительно потребляющих этанол, и крыс-гетерозигот по нокауту гена дофаминового транспортера DAT
Е. В. Филатова 1, *, Г. Е. Громова 1, М. В. Дорофейкова 1, И. В. Антонова 1, А. Ю. Егоров 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: filena17@gmail.com
Поступила в редакцию 30.06.2022
После доработки 26.08.2022
Принята к публикации 13.09.2022
- EDN: NAFXUK
- DOI: 10.31857/S0869813922100065
Аннотация
Нарушения в работе дофаминергической (ДА) системы лежат в основе большого числа патологий. Перспективной моделью для исследований является модель умеренного повышения активности ДА системы: крысы DAT-HET, гетерозиготные по нокауту гену дофаминового транспортера. Они отличаются большей подвижностью и когнитивными нарушениями, которые позволяют рассматривать их как возможную модель таких патологий, как синдром дефицита внимания и гиперактивности. Известно, что хроническое потребление этанола приводит к истощению дофамина, в частности в стриатуме. Мы предположили, что хронически потребляющие этанол крысы могут служить моделью умеренной гиподофаминергии, в противовес крысам гетерозиготам по нокауту гена дофаминового транспортера. Целью работы было исследование влияния такой модуляции ДА системы на обучение и выполнение задачи пространственной навигации в водном лабиринте Морриса. Обнаружено снижение уровня дофамина по сравнению с гетерозиготами только у крыс с более высоким уровнем предпочтения этанола. Крысы DAT-HET в условиях лабиринта Морриса значимо больше, чем крысы других групп проявляли непродуктивную стратегию тигмотаксиса, что приводило к более позднему обучению. Возможно, наблюдаемые нарушения в обучении пространственной задачи связано с их повышенной реакцией на стресс, проявляемой, в частности, высоким уровнем дефекации в бассейне. Крысы с хроническим воздействием этанола демонстрируют более поздний, по сравнению с контролем, целенаправленный поиск платформы, что выражается в меньшем времени, проведенном в целевом секторе в начале обучения каждой новой задаче. Исследование позволяет сделать вывод, что разнонаправленная умеренная модуляция активности ДА системы, вызванная различными факторами, не приводит к фатальным нарушениям выполнения задач пространственной навигации в водном лабиринте Морриса, однако снижает когнитивную гибкость, выражаемую в более длительном периоде использования непродуктивных стратегий.
Известно, что дофаминергическиая (ДА) система играет важную роль в обучении и реализации поведения, в том числе, связанным с пространственной навигацией [1]. Перспективной моделью изучения нарушений работы ДА системы являются животные с нокаутом гена транспортера дофамина [2]. У гетерозиготных особей наблюдается уменьшение экспрессии функционального белка-переносчика дофамина примерно на 50% по сравнению с обычными животными. Крысы гомозиготы и гетерозиготы показывают повышенный уровень базального внеклеточного DA в стриатуме, с 8- и 3-кратным увеличением над крысами дикого типа. При этом, в отличие от гомозиготных особей, у гетерозигот не наблюдается снижения уровня внутриклеточного дофамина [3]. Крысы гетерозиготы представляют собой модель умеренного повышения активности ДА системы и отличаются повышенной подвижностью и снижением ряда когнитивных функций [4].
Одной из важных структур, участвующих в обработке пространственной информации, является стриатум [5]. В фармакологических экспериментах показано, что неостриатальный дофамин модулирует как эгоцентрическую, так и аллоценрическую навигацию [6]. Предполагается, что стриатум участвует в интеграции как пространственной информации, так и информации, связанной с вознаграждением, которая, в свою очередь, влияет на произвольные двигательные выходные структуры для достижения точного навигационного поведения [7].
Многочисленные исследования посвящены роли катехоламинов в формировании алкогольной зависимости [8]. Известно, что острое воздействие этанола приводит к повышенному выбросу дофамина в стриатуме [9, 10]. Показано, что острое воздействие влияет только на выброс дофамина, но не на его клиренс [11]. Причем, разницы в эффектах острого этанола на высвобождение DA в стриатуме не обнаружено между мышами дикого типа и мышами с нокаутом гена переносчика DA, что позволило предположить об отсутствии прямого воздействия этанола на DAT [12]. При хроническом же потреблении в ответ на повышение уровня внеклеточного дофамина возрастает его обратный захват [13]. Также показано, что хроническое потребление алкоголя приводит к истощению тканевого уровня дофамина [14].
Мы предположили, что хронически потребляющие этанол крысы могут служить моделью умеренной гиподофаминергии, в противовес крысам гетерозиготам по нокауту гена дофаминового транспортера. Целью работы было исследование влияния такой модуляции дофаминергической системы на обучение и выполнение задачи пространственной навигации в водном лабиринте Морриса.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные
Исследование проводилось на 34 половозрелых крысах самцах в 3 экспериментальных группах. 1-я группа – крысы гетерозиготы DAT-HET (n = 14), предоставленные Институтом трансляционной биомедицины Санкт-Петербургского государственного университета. DAT-HET крысы получены путем скрещивания крыс гомозигот по дофаминовому транспортеру (DAT-KO) с аутбредными животными. В свою очередь, крысы DAT-KO созданы в SAGE Labs на основе аутбредных крыс линии Вистар Хан с использованием методики “цинковых пальцев” редактирования генома. Модификация гена Slc6a3 приводит к отсутствию функционального DAT у этих крыс [3]. 2-я группа – крысы линии Wistar, подвергнутые длительной хронической алкоголизации (n = 10) и 3-я группа – крысы линии Wistar, контрольные животные, не получавшие алкоголь (n = 10). На начало эксперимента крысы были в возрасте 3 мес. с массой тела 352.1 ± 5.8 г – 1-я группа; 251 ± 5.9 г – 2-я группа и 279.2 ± 7.3 г – 3-я группа. В конце эксперимента масса тела крыс DAT-HET составляла 415 ± 7.1 г, масса животных, подвергнутых алкоголизации 389.9 ± 7.3 г и контрольных особей 419.2 ± 9.7 г.
Животные всех трех экспериментальных групп содержались в одном помещении по 4–5 особей в клетках размером 545 × 395 × 200 мм на подстилках из древесных опилок, в стандартных условиях окружающей среды при относительной влажности 60–70% и температуре 23 ± 2°C. Комната содержания освещалась 12-часовым циклом искусственного освещения. У всех животных был неограниченный доступ к воде и пище (сухой гранулированный комбинированный корм для грызунов). Все поведенческие тесты и манипуляции с животными осуществлялись в светлую фазу с 09.00–18.00. Экспериментальные процедуры осуществлялись с соблюдением биоэтических норм в соответствии с протоколом обращения с лабораторными животными, утвержденным биоэтическим комитетом Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН и основанном на директиве Европейского Сообщества по гуманному обращению с экспериментальными животными.
Схема эксперимента
В начале эксперимента всех крыс взвешивали и подвергали поведенческому тестированию в тесте “Приподнятый крестообразный лабиринт”. Далее, в течение 3 мес. проводили хроническую алкоголизацию крыс группы 2 в режиме прерывистой алкоголизации свободного выбора. Для оценки уровня предпочтения этанола использовался тест “Двустаканная проба” каждый месяц эксперимента. Через 3 мес. крыс всех групп повторно тестировали в тесте “Приподнятый крестообразный лабиринт”. Далее животных всех групп обучали выполнять задачи поиска платформы в водном лабиринте Морриса. После декапитации животных, из левой и правой половины мозга крыс выделяли прилежащее ядро, в котором методом высокоэффективной жидкостной хроматографии определяли содержание ДА.
Процедура алкоголизации
Формирование предпочтения этанола проводили модифицированным методом прерывистой алкоголизации со свободным выбором [15], где животные группы 2, помимо поилки с водой, также имели доступ к поилке с 20%-ным раствором этанола все дни недели, кроме понедельника и четверга, когда имели доступ только к воде. Для оценки уровня предпочтения этанола использовали суточный “Двустаканный тест”. Тест проводился в привычной клетке, одновременно для всех трех групп крыс, для этого в клетку помещался сепаратор, разделяющий ее на три отсека. В каждый отсек помещались две бутылки: одна с водой, другая с 15%-ным раствором спирта. Фиксировали количество выпитого из каждой бутылки за сутки.
Поведенческие тесты
Для оценки уровня тревоги использовали тест “Приподнятый крестообразный лабиринт”, который представляет из себя поднятый над уровнем пола на 1 м крест с центральной областью 10 × 10 см и четырьмя рукавами, где каждый рукав имеет длину 50 и ширину 10 см. При этом два рукава открытые, а два других закрытые, с высокими боковыми стенками. Животное помещалось в центр креста и в течение 3 мин фиксировалась длительность пребывания в центре лабиринта, в открытых и закрытых рукавах лабиринта, а также длина пройденного пути в разных отсеках.
Способность к пространственной навигации и формирование пространственной памяти у крыс изучали в водном лабиринте Морриса [16]. Лабиринт представляет из себя круглый бассейн диаметром 1.5 м, заполненный водой комфортной температуры (T = 23 ± 1°С). На внутренних стенках бассейна, на равном расстоянии друг от друга, размещены четыре ориентира в виде черных геометрических фигур. Животным было предоставлено две задачи. Первая задача заключалась в поиске видимой платформы, которая располагалась над поверхностью прозрачной воды в одном из секторов бассейна (4 попытки/день в течение 2 дней). Вторая задача заключалась в поиске невидимой платформы, помещенной на 1.5 см ниже уровня непрозрачной воды (с добавлением сухого молока) и расположенной в том же месте, где и в первой задаче (4 попытки/день в течение 3 дней). Проводилась видеозапись поведения животных с последующим анализом трека. Животное запускалось каждый раз из разных точек бассейна. Погружение животного осуществлялось лицом к бортику бассейна. Оба экспериментальных дня первой задачи и первые два дня второй задачи точки старта располагались на уровне геометрических ориентиров. На третий день тестирования точки старта располагались в новых для животного позициях между геометрическими знаками. Если животное не достигало платформы самостоятельно в течение 60 с, то экспериментатор помогал ей подняться на платформу. После каждого заплыва крысы продолжали находиться на платформе 15 с, после чего снимались экспериментатором, вытирались и возвращались в клетку. Самостоятельное достижение платформы считалось критерием успешности выполнения. Фиксировали число ошибочных реализаций, когда животному помогли, кроме того, анализировали время, проведенное животным у стенок бассейна, число актов дефекации в воде, а также, в случаях самостоятельного достижения платформы, анализировали время, затраченное животным для выполнения задания. Бассейн условно разделен на 4 равных сектора воображаемыми линиями, соединяющими геометрические ориентиры на стенках. Сектор, в котором располагалается платформа, рассматривается как целевой сектор. Анализировали долю времени, проведенного животным в секторе расположения платформы.
Биохимический анализ
Анализ содержания моноаминов был проведен в лаборатории нейрохимии Института экспериментальной медицины (Санкт-Петербург) методом высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ-ЭД). Образцы ткани гомогенизировали в 0.1 М хлорной кислоте и центрифугировали при 10 000 g и 40°С в течение 30 мин. На анализ брали 20 мкл образца. ВЭЖХ проводили в изократических условиях с использованием обращенно-фазовой колонки (длина алкильной цепи C18) с последующей электрохимической детекцией. Количественное определение уровня дофамина (dopamine, DA) проводилось с применением метода внешнего стандарта. Состав подвижной фазы: 75 мМ фосфатный буфер, содержащий 2 мМ лимонной кислоты (pH 4.6), 0.1 мМ октансульфоновой кислоты и 15%-ный ацетонитрил (V/V). Электрохимическая детекция осуществлялась стеклоуглеродным электродом при 700 мВ. Количество моноаминов в образце выражали в нг/мг белка, затем нормировали на контрольную группу и выражали в % относительно контрольной группы; ошибку пересчитывали как ошибку частного.
Статистический анализ
Результаты экспериментов обрабатывали с помощью программы Statistica 7.0 (StatSoft-Russia). Для оценки нормальности распределения данных использовали критерий Шапиро–Уилка. При анализе поведенческих параметров сравнение между группами проводили с использованием One-Way ANOVA. В случае обнаружения статистически значимых различий проводилось post hoc сравнение LSD test. Так как не во всех группах данные нейрохимических параметров соответствовали нормальности, для анализа использовали непараметрический тест Краскела–Уоллиса с post-hoc тестом Данна. Для оценки успешности выполнения поведенческого теста в пределах каждой группы использовали критерий Хи-квадрат. Различия полученных результатов считались статистически достоверными при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
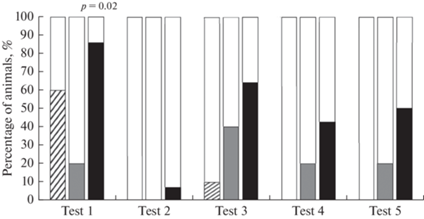
Анализ успешности выполнения задачи показал, что среди контрольных животных в первом тестировании наблюдается 60% животных, которым хотя бы в одной из 4 реализаций потребовалась помощь экспериментатора в поиске платформы (рис. 1). Незначительный процент таких животных среди контроля наблюдается также в начале обучения новой задаче со скрытой платформой (тест 3). В группе животных с хроническим воздействием алкоголя в четырех тестах (1-, 3-, 4- и 5-й тесты) наблюдается от 20 до 40% таких животных, без выраженной динамики при обучении второй задаче – поиску скрытой платформы. В среднем за все тесты наибольший процент не справившихся хотя бы с одной реализацией теста наблюдается в группе DAT-HET крыс, причем, в первый день обучения их значимо больше, чем справившихся.
Рис. 1.
Доля животных, хотя бы в одной из четырех реализаций каждого теста не нашедших платформу (%). Тест 1–2 – открытая платформа, Тест 3–5 – скрытая платформа. Штриховка – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Значимость отличий (p < 0.05) указана по критерию Хи-квадрат.
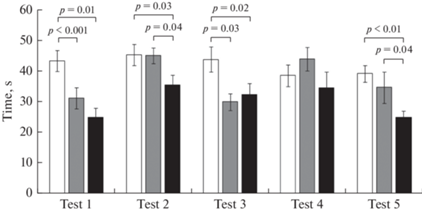
Анализ времени достижения платформы показал значимые отличия между крысами DAT-HET и контрольной группой в первый день обучения с открытой платформой (тест 1) и между крысами DAT-HET и крысами, получавшими алкоголь во второй день обучения поиску скрытой платформы (тест 4) (рис. 2). Итоговое тестирование не показало существенных различий между группами.
Рис. 2.
Время достижения платформы (c) среди животных, справившихся с задачей. Тест 1–2 – открытая платформа, Тест 3–5 – скрытая платформа. Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.

Анализ времени, проведенном животным в целевом секторе, показал, что крысы, подверженные хроническому воздействию этанола, справлялись хуже контрольной группы только в первые дни обучения новым задачам (тест 1 и тест 3). В итоговых тестах с открытой и закрытой платформой они справлялись значимо лучше, чем гетерозиготы (рис. 3). Крысы группы DAT-HET проводили меньше всего времени в целевом секторе и имели значимое отличие от контроля по этому параметру в 4 из 5 тестов (тесты 1, 2, 3 и 5).
Рис. 3.
Доля времени, проведенного в целевом квадрате (%). Тест 1–2 – открытая платформа, Тест 3–5 – скрытая платформа. Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.
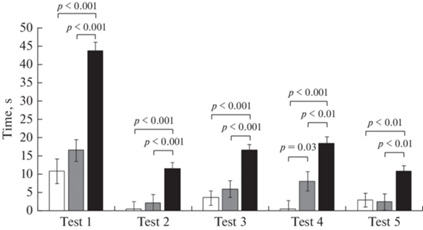
Наблюдения за животными в лабиринте Морриса показали, что они используют разные стратегии поведения. Среди них есть как продуктивные стратегии, такие как целенаправленный поиск по внешним ориентирам, когда животное ищет платформу в непосредственной близости от нее, или же случайный поиск, когда животное использует разнообразные траектории, охватывающие всю площадь бассейна, так и непродуктивные, когда животное не ищет платформу, а просто дрейфует в воде или пытается выбраться из бассейна и плавает непосредственно вдоль стенок, касаясь их лапами. На рис. 4 показано время, проведенное животными возле стенок бассейна. Было обнаружено, что крысы группы DAT-HET склонны проявлять непродуктивный тигмотаксис и значимо отличаются этим от других групп.
Рис. 4.
Время плавания вдоль стен (тигмотаксис) (с). Тест 1–2 – открытая платформа, Тест 3–5 – скрытая платформа. Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.
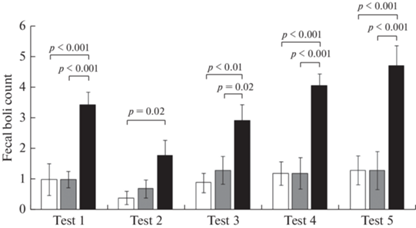
Также для оценки уровня тревоги и реакции на стресс, сопровождающий поиск платформы в бассейне, был проведен анализ числа болюсов, оставляемых животным в воде в процессе плавания (рис. 5). Крысы группы DAT-HET демонстрируют существенно более высокий уровень дефекации по сравнению с крысами других групп.
Рис. 5.
Количество болюсов (шт.) при обучении в лабиринте Морриса. Тест 1–2 – открытая платформа, Тест 3–5 – скрытая платформа. Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.
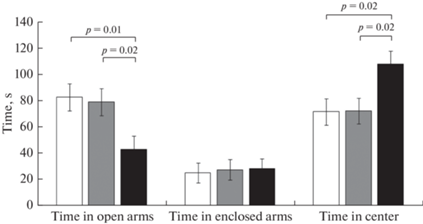
Анализ времени, проведенного в разных отсеках приподнятого крестообразного лабиринта при тестировании перед обучением в водном лабиринте Морриса, показал что крысы DAT-HET отдают большее предпочтение пребыванию в центре лабиринта и проводят меньше времени в открытых рукавах, отличаясь при этом от крыс других групп (рис. 6).
Рис. 6.
Время, проведенное в разных отсеках приподнятого крестообразного лабиринта (с). Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.
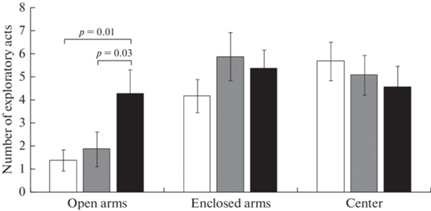
Анализ исследовательской активности, проявляемой в приподнятом крестообразном лабиринте, оценивали по сумме вертикальных стоек и заглядываний вниз в разных отсеках лабиринта. Обнаружено, что несмотря на меньшее время, проводимое в открытых рукавах лабиринта, гетерозиготы проявляют в них больше исследовательской активности (рис. 7).
Рис. 7.
Количество актов исследовательской активности в разных отсеках приподнятого крестообразного лабиринта (шт.). Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. Указана значимость отличий (p < 0.05) post hoc LSD Fisher test.
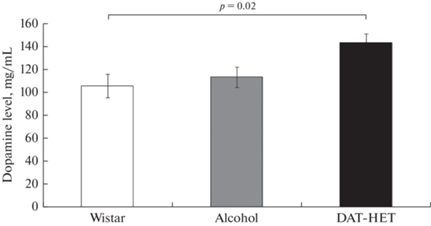
Анализ уровня дофамина в тканях прилежащего ядра показал значимо более высокий уровень у крыс группы DAT-HET по сравнению с контролем (p = 0.02) и тенденцию к превышению по сравнению с получающими алкоголь крысами (p = 0.07) (рис. 8).
Рис. 8.
Уровень дофамина в тканях прилежащего ядра (мг/мл). Белый столбик – крысы линии Wistar, серый столбик – крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. При обнаружении различий между группами приведены значения критерия Краскела–Уоллиса и соответствующий уровень значимости.
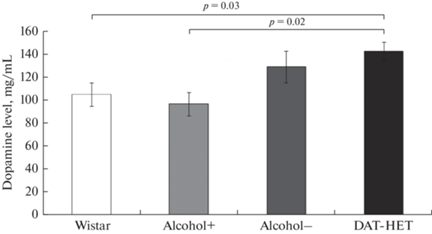
Крысы, получающие этанол в процессе эксперимента, были разделены на две группы по количеству потребленного спирта в последней двустаканной суточной пробе – условно многопьющие (n = 5) и малопьющие (n = 5) животные, потреблявшие больше и меньше 2 г/кг этанола. Уровень дофамина в прилежащем ядре значимо отличался у гетерозигот от контроля и от многопьющих крыс и не отличался от малопьющих (рис. 9).
Рис. 9.
Уровень дофамина (мг/мл) с учетом разделения на много и малопьющих крыс. Белый столбик – крысы линии Wistar, светло серый столбик – многопьющие крысы линии Wistar с хроническим воздействием этанола, темно-серый столбик – малопьющие крысы линии Wistar с хроническим воздействием этанола, черный столбик – крысы DАТ-HET. Приведены средние значения ± ошибка среднего. При обнаружении различий между группами приведены значения критерия Краскела–Уоллиса и соответствующий уровень значимости.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что у крыс гомозигот по нокауту гена дофаминового транспортера DAT-KO наблюдается значительное увеличение уровня внеклеточного дофамина в стриатуме и снижение его содержания в тканях. При этом у гетерозигот более умеренное увеличение внеклеточного дофамина не сопровождается снижением его в тканях по сравнению с контролем [3]. В нашем эксперименте было обнаружено превышение уровня дофамина в тканях прилежащего ядра у крыс DAT-HET по сравнению с контролем и по сравнению с многопьющими крысами из группы животных, подвергнутых хронической алкоголизации. Известно влияние различных факторов на уровень дофамина, включая генетические, половые и возрастные отличия [17–19]. Так, исследование уровня стриатного дофамина у мышей гетерозигот по гену транспортера дофамина DAT(+/–) и их контроля – мышей дикого типа DAT(+/+) в различных возрастных периодах показало снижение уровня дофамина с возрастом только у животных дикого типа, в отличие от гетерозигот [19]. Можно предположить, что обнаруженное нами преобладание связано с возрастным снижением уровня дофамина у контрольных крыс.
Показано, что экспрессия DAT в прилежащем ядре участвует в регуляции как потребления и предпочтения этанола [20], так и приобретения и извлечения контекстуальной памяти, связанной с этанолом [21]. При этом блокада DAT может снизить подкрепляющие свойства этанола [21]. Показана связь низкого уровня дофамина в стриатуме с высоким уровнем потребления алкоголя [22]. При этом предполагается, что сниженный уровень дофамина в стриатных областях может быть как причиной, так и следствием чрезмерного потребление этанола [23]. В нашем эксперименте обнаружено, что только многопьющие животные имели значимые отличия от гетерозигот в уровне дофамина. По-видимому, только животных, склонных к повышенному потреблению этанола в условиях длительного спаивания, можно рассматривать как модель умеренной гиподофаминергии. В экспериментах с поражением прилежащего ядра иботеновой кислотой было показано, что пространственное обучение поиску скрытой платформы в водном лабиринте Морриса нарушается, но не отменяется. Предполагается роль прилежащего ядра в реорганизации поведения в связи с внешними изменениями [24]. В нашем эксперименте крысы гетерозиготы также успешно обучились обеим задачам: поиску видимой и поиску скрытой платформы. Однако по ряду параметров их поведение отличалось от других групп. Существенным отличием было время, проведенное у стенок бассейна, когда животное пытается выбраться из него, скребя лапами по стенкам и перемещаясь по периметру, а также доля времени, проведенного в целевом секторе. Эти параметры связаны между собой и отражают непродуктивную стратегию поведения, используемую крысами-гетерозиготами. Исследования роли дофаминового транспортера показали, что он участвует в регуляции активности оси гипоталамус–гипофиз–кора надпочечников как на центральном, так и на периферическом уровне. Крысы-самки DAT(–/–) демонстрируют глубокие нарушения регуляции гипофизарного гомеостаза и аномальные вегетативные реакции, в то время как у самок крыс DAT(+/–) обнаруживают незначительные изменения гипофизарных гомеостатических механизмов, которые приводят к повышенной уязвимости к стрессу у самок крыс с частичной делецией DAT [25]. Обучение в водном лабиринте Морриса сопровождается стрессом. Помимо выраженного тигмотаксиса, свидетельством их реакции является существенно более высокий уровень дефекации в бассейне по сравнению с крысами других групп. Сравнительный анализ поведения крыс разных групп в приподнятом крестообразном лабиринте показал неоднозначно трактуемые результаты. Крысы гетерозиготы существенно меньше времени проводили в открытых рукавах лабиринта, но в то же время значительно больше времени находились в центре креста, который также является открытым пространством. В работе Гайнетдинова и соавт. [4] было показано, что крысы DAT-HET в приподнятом крестообразном лабиринте характеризуются повышенной исследовательской активностью и пониженной тревожностью, что выражается в более длительном пребывании в открытых рукавах и меньшим временем нахождения в закрытых рукавах лабиринта. Другая работа также подтвердила более низкий уровень тревожности у гетерозиготных крыс, проявляемый в более длительном их пребывании в светлой камере [26]. Наши данные обнаруживают повышенную исследовательскую активность только в открытых рукавах лабиринта и более длительное пребывание в центре, но сниженную тревожность у гетерозигот не подтверждают. В комплексе с повышенной дефекацией в бассейне это скорее свидетельствует о повышенной реактивности на стресс у этих животных. Мы предполагаем, что именно эта повышенная чувствительность к стрессирующему фактору водного погружения удлиняет период адаптации и препятствует их когнитивному функционированию, замедляя процесс обучения пространственной задаче.
Крысы, хронически получающие алкоголь, не показали разницы в поведенческих параметрах для много- и малопьющих особей. Возможно, это связано с недостаточным количеством животных в таких подгруппах для анализа поведения. В основных параметрах обучения, таких как процент животных, совершающих ошибки, и время достижения платформы, пьющие крысы не отличались от контроля. Однако обнаружено, что в начале обучения каждой новой задаче – как поиску видимой, так и поиску скрытой платформы, пьющие крысы значимо меньше времени проводили в целевом секторе, с выравниванием этого параметра в последующих сессиях. Можно предположить, что это связано с определенной когнитивной ригидностью данных особей. Снижение когнитивной гибкости обнаруживается во многих экспериментах, исследующих влияние хронического потребления алкоголя [27, 28].
В целом исследование позволяет сделать вывод, что разнонаправленная умеренная модуляция активности ДА системы, вызванная различными факторами, не приводит к фатальным нарушениям выполнения задач пространственной навигации, однако влияет на включение собственно механизмов обучения, затрудняя его начало в случае c хроническим употреблением алкоголя, и замедляет весь процесс обучения у крыс DAT-HET в связи с их повышенным эмоциональным ответом на стрессирующий фактор.
Список литературы
Retailleau A, Boraud T (2014) The Michelin red guide of the brain: role of dopamine in goal-oriented navigation. Front Syst Neurosci 8: 32. https://doi.org/10.3389/fnsys.2014.00032
Efimova EV, Gainetdinov RR, Budygin EA, Sotnikova TD (2016) Dopamine transporter mutant animals: a translational perspective. J Neurogenet 30(1): 5–15. https://doi.org/10.3109/01677063.2016.1144751
Leo D, Sukhanov I, Zoratto F, Illiano P, Caffino L, Sanna F, Messa G, Emanuele M, Esposito A, Dorofeikova M, Budygin EA, Mus L, Efimova EV, Niello M, Espinoza S, Sotnikova TD, Hoener MC, Laviola G, Fumagalli F, Adriani W, Gainetdinov RR (2018) Pronounced Hyperactivity, Cognitive Dysfunctions, and BDNF Dysregulation in Dopamine Transporter Knock-out Rats. J Neurosci 38(8): 1959–1972. https://doi.org/10.1523/JNEUROSCI.1931-17.2018
Gainetdinov AR, Fesenko ZS, Khismatullina ZR (2020) Behavioural Changes in Heterozygous Rats by Gene Knockout of the Dopamine Transporter (DAT). J Biomed 16 (1): 82–88. https://doi.org/10.33647/2074-5982-16-1-82-88
Penner MR, Mizumori SJ (2012) Neural systems analysis of decision making during goal-directed navigation. Prog Neurobiol 96(1): 96–135. https://doi.org/10.1016/j.pneurobio.2011.08.01021964237
Braun AA, Graham DL, Schaefer TL, Vorhees CV, Williams MT (2012) Dorsal striatal dopamine depletion impairs both allocentric and egocentric navigation in rats. Neurobiol Learn Mem 97(4): 402–408. https://doi.org/10.1016/j.nlm.2012.03.004
Lavoie AM, Mizumori SJ (1994) Spatial, movement- and reward-sensitive discharge by medial ventral striatum neurons of rats. Brain Res 638: 157–168. https://doi.org/10.1016/0006-8993(94)90645-9
Grinevich VP, Krupitsky EM, Gainetdinov RR, Budygin EA (2021) Linking Ethanol-Addictive Behaviors With Brain Catecholamines: Release Pattern Matters. Front Behav Neurosci 15: 795030.https://doi.org/10.3389/fnbeh.2021.79503034975429
Mcbride WJ, Murphy JM, Lumeng L, Li TK (1990) Serotonin, Dopamine and Gaba Involvement in Alcohol Drinking of Selectively Bred Rats. Alcohol 7: 199–205.
Howard EC, Schier CJ, Wetzel JS, Duvauchelle CL, Gonzales RA (2008) The shell of the nucleus accumbens has a higher dopamine response compared with the core after non-contingent intravenous ethanol administration. Neuroscience 154(3): 1042–1053. https://doi.org/10.1016/j.neuroscience.2008.04.014
Budygin EA, Mathews TA, Lapa GB, Jones SR (2005) Local effects of acute ethanol on dopamine neurotransmission in the ventral striatum in C57BL/6 mice. Eur J Pharmacol 523(1–3): 40–45. Epub 2005 Oct 14. https://doi.org/10.1016/j.ejphar.2005.09.00616226738
Mathews TA, John CE, Lapa GB, Budygin EA, Jones SR (2006) No role of the dopamine transporter in acute ethanol effects on striatal dopamine dynamics. Synapse 60(4): 288–294. https://doi.org/10.1002/syn.2030116786536
Carroll MR, Rodd ZA, Murphy JM, Simon JR (2006) Chronic ethanol consumption increases dopamine uptake in the nucleus accumbens of high alcohol drinking rats. Alcohol 40(2):103–109. https://doi.org/10.1016/j.alcohol.2006.10.003
Rothblat DS, Rubin E, Schneider JS (2001) Effects of chronic alcohol ingestion on the mesostriatal dopamine system in the rat. Neurosci Lett 300: 63–66. https://doi.org/10.1007/s00213-007-0812-1
Simms JA, Steensland P, Medina B, Abernathy KE, Chandler LJ, Wise R, Bartlett SE (2008) Intermittent access to 20% ethanol induces high ethanol consumption in Long-Evans and Wistar rats. Alcoholism Clin Exp Res 32(10): 1816–1823. https://doi.org/10.1111/j.1530-0277.2008.00753.x
Morris RGM (1981) Spatial localization does not require the presence of local cues. Learn and Motivat 12(2): 239–260.https://doi.org/10.1016/0023-9690(81)90020-5
Walker QD, Ray R, Kuhn CM (2006) Sex differences in neurochemical effects of dopaminergic drugs in rat striatum. Neuropsychopharmacology 31(6): 1193–1202. https://doi.org/10.1038/sj.npp.1300915
Haile CN, Kosten TA (2001) Differential effects of D1- and D2-like compounds on cocaine self-administration in Lewis and Fischer 344 inbred rats. J Pharmacol Exp Ther 299(2): 509–518.
Dluzen DE, Ji J, McDermott JL (2010) Age-related changes in nigrostriatal dopaminergic function in heterozygous mutant dopamine transporter knock-out mice. Neurosci Lett 476(2): 66–69. https://doi.org/10.1016/j.neulet.2010.04.004
Bahi A, Dreyer JL (2019) No effect of sex on ethanol intake and preference after dopamine transporter (DAT) knockdown in adult mice. Psychopharmacology (Berl) 236(4): 1349–1365. https://doi.org/10.1007/s00213-018-5144-9
Bahi A (2020) Dopamine transporter gene expression within the nucleus accumbens plays important role in the acquisition and reinstatement of ethanol-seeking behavior in mice. Behav Brain Res 381: 112475. https://doi.org/10.1016/j.bbr.2020.112475
Strother WN, Lumeng L, Li TK, McBride WJ (2005) Dopamine and serotonin content in select brain regions of weanling and adult alcohol drinking rat lines. Pharmacol Biochem Behav 80(2): 229–237. https://doi.org/10.1016/j.pbb.2004.11.003
Kashem MA, Ahmed S, Sarker R, Ahmed EU, Hargreaves GA, McGregor IS (2012) Long-term daily access to alcohol alters dopamine-related synthesis and signaling proteins in the rat striatum. Neurochem Int 61(8): 1280–1288. https://doi.org/10.1016/j.neuint.2012.08.013
Annett LE, McGregor A, Robbins TW (1989) The effects of ibotenic acid lesions of the nucleus accumbens on spatial learning and extinction in the rat. Behav Brain Res 31(3): 231–242. https://doi.org/10.1016/0166-4328(89)90005-3
Illiano P, Bigford GE, Gainetdinov RR, Pardo M (2020) Rats Lacking Dopamine Transporter Display Increased Vulnerability and Aberrant Autonomic Response to Acute Stress. Biomolecules 10(6): 842. https://doi.org/10.3390/biom10060842
Adinolfi A, Zelli S, Leo D, Carbone C, Mus L, Illiano P, Alleva E, Gainetdinov RR, Adriani W (2019) Behavioral characterization of DAT-KO rats and evidence of asocial-like phenotypes in DAT-HET rats: The potential involvement of norepinephrine system. Behav Brain Res 359: 516–527. https://doi.org/10.1016/j.bbr.2018.11.028
Santín LJ, Rubio S, Begega A, Arias JL (2000) Effects of chronic alcohol consumption on spatial reference and working memory tasks. Alcohol 20(2): 149–159. https://doi.org/10.1016/s0741-8329(99)00070-1
Matthews DB, Scaletty S, Trapp S, Kastner A, Schneider AM, Schreiber A, Rossmann G (2022) Chronic Intermittent Ethanol Administration during Adolescence Produces Sex Dependent Impairments in Behavioral Flexibility and Survivability. Brain Sci 12(5): 606. https://doi.org/10.3390/brainsci12050606
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


