Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1393-1409
Физиологические аспекты применения аналогов гонадотропин-рилизинг-гормона в акушерско-гинекологической клинике и эксперименте
И. В. Майбородин 1, 2, *, А. К. Пичигина 1, В. И. Майбородина 1, Е. Л. Лушникова 1
1 Институт молекулярной патологии и патоморфологии, Федеральный исследовательский центр фундаментальной и трансляционной медицины Министерства науки
и высшего образования РФ
Новосибирск, Россия
2 Институт химической биологии и фундаментальной медицины
Сибирского отделения Российской академии наук
Новосибирск, Россия
* E-mail: imai@mail.ru
Поступила в редакцию 04.06.2022
После доработки 15.09.2022
Принята к публикации 16.09.2022
- EDN: KYMASO
- DOI: 10.31857/S0869813922110061
Аннотация
Проведен поиск литературы для изучения работ, посвященных результатам применения агонистов гонадотропин-рилизинг-гормона (ГнРГ) в акушерско-гинекологической клинике и эксперименте. Рассмотрены физиологические аспекты влияния ГнРГ на яичники и матку как в норме, так и при некоторых патологических состояниях. Сделано заключение, что агонисты ГнРГ при длительном применении подавляют овуляцию и вызывают состояние, сходное с менопаузой. Инфузия агониста ГнРГ является простым методом подавления продукции лютеинизирующего и фолликулостимулирующего гормонов, а также развития фолликулов. При этом в яичниках подавляется функциональная активность гранулезных клеток через супрессию синтеза ДНК и индукцию апоптоза с одновременной стимуляцией дифференцировки клеток в преовуляторных фолликулах. Такое состояние является обратимым, сохраняется фертильность. За счет быстрой инволюции матки после применения аналогов ГнРГ возможны задержка или даже остановка прогрессирования миомы с исчезновением ее симптомов. На фоне гипотрофии матки эндометрий соответствует атрофическому или покоящемуся пролиферативному типу. Вместе с этим есть прямо противоположные данные о том, что длительное использование ГнРГ способствует гиперплазии эндометрия и эндометриту. Препараты ГнРГ успешно применяют для лечения доброкачественных и онкологических процессов в яичниках и матке, а также для воздействия на метастазы. Но существуют и исследования, показывающие, что прямой эффект ГнРГ на опухоли мало выражен. Высказываются опасения, что гонадотропины могут даже стимулировать развитие рака яичников, воздействуя на определенные рецепторы. Большинство ученых сообщает о хорошей протективной способности агонистов ГнРГ в условиях химиотерапии, но также имеются данные о слабой эффективности или вообще отсутствии защитного действия препаратов данной группы. В любом случае противоречивость публикаций по каждому из аспектов эффекта ГнРГ свидетельствует о его малой изученности, целесообразности продолжения не только прикладных, но и фундаментальных исследований.
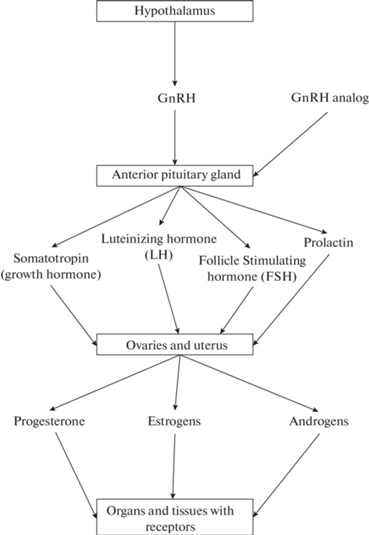
Гонадотропин-рилизинг-гормон (ГнРГ) – гипоталамический декапептид, опосредующий синтез и высвобождение гипофизарного лютеинизирующего гормона (ЛГ). Подобные полипептиды действуют, главным образом, на переднюю часть гипофиза, вызывая кратковременное быстрое увеличение выброса ЛГ, пролактина, соматотропного и фолликулостимулирующего (ФСГ) гормонов. К концу 1980-х годов суперактивные аналоги ГнРГ и соответствующие депо-препараты стали широко доступными и использовались для медицинской гипофизэктомии (подавления секреции ЛГ и ФСГ), что приводило к подавлению функции половых желез у обоих полов. Эта стратегия обратимой медицинской кастрации была успешно внедрена в лечение различных заболеваний, зависящих от половых гормонов, включая рак предстательной железы и пременопаузальный рак молочной железы, а также эндометриоз и миому матки. Отмена эстрогенов из-за обратимой медикаментозной кастрации с помощью агонистов ГнРГ также применялась в качестве консервативного лечения раннего рака эндометрия и его предраковых состояний у молодых женщин, желающих сохранить свою фертильность [1].
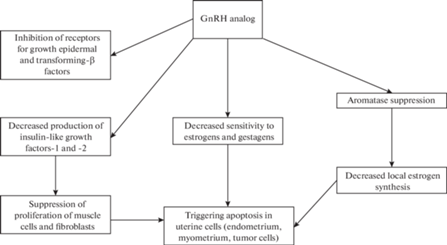
Однако когда агонисты ГнРГ вводят длительно в высоких супрафизиологических дозах, становится очевидным парадоксальный эффект чрезмерной стимуляции гипофиза. Метаболические механизмы включают в себя десенсибилизацию гипофиза к ГнРГ, подавление рецепторов ГнРГ в клетках-мишенях, резкое падение объема выделяемого ЛГ, нарушение механизмов физиологической обратной связи, при этом снижается высвобождение гонадотропина. У растущих самок крыс (30–40 сут) при использовании аналогов ГнРГ были обнаружены задержка открытия влагалища и ингибирование изменений массы яичников и матки. Эти эффекты используются для разработки методов контрацепции, лечения эндометриоза, преждевременного полового созревания и во время подготовки к процедуре экстракорпорального оплодотворения (ЭКО). Агонисты ГнРГ достоверно вызывают ановуляцию и открывают перспективу обратимой псевдоменопаузы, по существу, лишенной побочных эффектов. Аналоги ГнРГ оказывают существенное влияние на лечение различных эстрогензависимых гинекологических заболеваний (рис. 1, 2) [2–11].
Кроме того, аналоги ГнРГ применяют для лечения широкого спектра онкологических процессов, связанных с половыми гормонами, включая распространенный рак яичников (рис. 1). Причем, эффект подавления яичников в процессе лечения онкологических и гинекологических заболеваний агонистами ГнРГ является обратимым [2–6].
У детей с преждевременным половым созреванием лейпрорелин (ежемесячные внутримышечные или подкожные инъекции лейпрорелина длительного действия с 3.75 до 15 мг) снижает среднюю скорость роста и выраженность признаков полового созревания, а также увеличивает прогнозируемый рост взрослого по сравнению с исходными измерениями. Хотя влияние на конечный рост взрослого человека предсказывается на основе имеющихся данных и требует подтверждения в долгосрочных последующих исследованиях, отсутствие эффективных альтернатив делает аналоги ГнРГ терапией первой линии для детей с этим редким заболеванием [3].
Кроме того, агонист ГнРГ (MR-409) в дозе 5 или 10 мкг/мышь/день при подкожном инъецировании значительно снижает летальность, тяжесть ишемического инсульта и выраженность атрофии гиппокампа, а также улучшает восстановление неврологических функций у животных при транзиторной окклюзии средней мозговой артерии в эксперименте. Препарат может стимулировать эндогенный нейрогенез и улучшать потерю нейропластичности при экспериментальном инсульте. MR-409 также усиливает пролиферацию и ингибирует апоптоз нейральных стволовых клеток в условиях ограничения – реперфузии кислорода и глюкозы [12]. Агонисты ГнРГ также оказывают благотворное воздействие на животных с моделированием ишемической и неишемической сердечной недостаточности, в том числе при хронической болезни почек [13].
Очень интересны появившиеся в последнее время сообщения, что и агонисты, и антагонисты ГнРГ обладают выраженным противовоспалительным эффектом. Препараты из группы антагонистов подавляют образование инфильтратов в легких крыс при пневмонии. Результаты исследований ex vivo показали, что аналоги и антагонисты ГнРГ ингибируют продукцию провоспалительных и окислительных факторов, индуцированную липополисахаридом, в изолированных образцах толстой кишки мыши. In vivo обе группы препаратов также способны снижать реакцию на ноцицептивный стимул в тесте с горячей пластиной, отмечено снижение чувствительности к острым и стойким воспалительным стимулам у самцов мышей в формалиновом тесте и модели колита, вызванного декстрансульфатом натрия: ослабляются клинические симптомы, признаки гистопатологического повреждения и присутствие провоспалительных и окислительных маркеров в образцах толстой кишки. Причем антагонисты ГнРГ обладают более выраженными противовоспалительными свойствами [14, 15].
Активация рецептора ГнРГ, который обнаружен в ганглиозных клетках сетчатки взрослых крыс, может быть связана с сохранением этих клеточных элементов при воспалении. После повреждения зрительного нерва подкожное введение агониста ГнРГ MR-409 или антагониста MIA-602 способствовало выживанию ганглиозных клеток сетчатки, что может быть связано с аддитивным эффектом на активацию макрофагов [16].
Для обобщения результатов исследований влияния ГнРГ на органы репродуктивной системы у женщин и самок экспериментальных животных проведен поиск литературы в базах данных “PubMed” и “PubMed Health” (www.ncbi.nlm.nih.gov). В обзор не включены данные по клиническому и экспериментальному лечению эндометриоза, применению ГнРГ для ЭКО и повышения вероятности наступления беременности. Также не учитывали результаты работ по искусственному осеменению в ветеринарии, повышению фертильности и синхронизация овуляторного цикла.
ВЛИЯНИЕ АГОНИСТОВ ГОНАДОТРОПИН-РИЛИЗИНГ-ГОРМОНА НА ЯИЧНИКИ ЖЕНЩИН И САМОК ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Применение агониста ГнРГ бусерелина для индукции состояния обратимого гипогонадотрофизма перед введением экзогенных гонадотропинов является многообещающей стратегией в лечении бесплодия, связанного с синдромом поликистозных яичников и другими состояниями с лежащей в основе дисфункцией этих органов; такой подход также явно повышает эффективность программ ЭКО. Первоначальные исследования предполагают потенциальную полезность ГнРГ в качестве женского контрацептива при периодическом применении в сочетании с прогестагеном. Бусерелин представляет собой первую линию лечения преждевременного полового созревания [2].
Высокоактивный аналог ГнРГ (НОЕ766) вводили здоровым женщинам в двойном слепом исследовании. Каждая женщина получала с 1-го по 14-й день менструального цикла, согласно плану рандомизации, 10 мкг препарата или плацебо. Овуляция была подавлена в течение по крайней мере двух нед. у всех субъектов, получавших ГнРГ. Первоначально очень выраженное высвобождение ЛГ, измеренное через 4 ч после инъекции, уменьшилось в течение 3 дней примерно на 50% и оставалось на этом уровне в течение оставшейся части эксперимента, в то время как первоначально высокий ответ на ФСГ был практически полностью отменен во время дальнейшего лечения. У 3 из 5 женщин, получавших аналог ГнРГ, концентрация эстрадиола в сыворотке была сильно снижена, у остальных 2 – незначительно. В течение 5 дней после прекращения лечения гипофиз восстановил способность нормально реагировать на ГнРГ. Авторы делают вывод о нарушении созревания фолликулов в результате изменения физиологической секреции гонадотропина под действием НОЕ766 [17]. Подобные результаты выявлены и при введении ГнРГ животным [15].
Кисспептины (kisspeptins) являются наиболее мощными нейротрансмиттерами, стимулирующими высвобождение ГнРГ. У мелких жвачных животных кисспептины или их аналоги индуцировали всплеск выброса ЛГ с последующей овуляцией, в то время как у лошадей этот трансмиттер только увеличивал уровни ЛГ в плазме, но не индуцировал овуляцию [19].
Яванские макаки (Macaca fascicularis) были разделены на группы в соответствии с проводимой процедурой стимуляции яичников (агонист или антагонист ГнРГ). В обеих группах рост и созревание ооцитов индуцировали введением ФСГ и хорионического гонадотропина человека. Получены данные, что процедура, включающая антагонист ГнРГ, имеет некоторые преимущества для указанного вида животных по сравнению с контролируемой стимуляцией на фоне применения аналога ГнРГ [20].
Изучали прямое действие агониста ГнРГ бусерелина и антагониста ГнРГ цетрореликса на пролиферацию и дифференцировку клеток в фолликулах яичника крыс. Преовуляторные фолликулы получали от незрелых крыс и инкубировали in vitro в присутствии или отсутствие хорионического гонадотропина человека (ХГЧ) (10 МЕ/мл), бусерелина (10–9–10–6 М) или цетрореликса (10–9–10–6 М) в течение 12 ч. Бусерелин индуцировал мейотическое созревание яйцеклеток в фолликулах в зависимости от дозы, а также значительно стимулировал выработку простагландина Е2 (ПГЕ2) и прогестерона фолликулами, но не выработку эстрадиола. Гранулезные клетки получали из преовуляторных фолликулов и культивировали в течение 5 дней. И бусерелин, и цетрореликс ингибировали пролиферацию таких клеток в зависимости от дозы в диапазоне 10–10–10–5 М, причем цетрореликс индуцировал большее ингибирование митотической активности, чем бусерелин. Электрофоретический анализ геномной ДНК, выделенной из гранулезных клеток, обработанных аналогом ГнРГ в концентрации 10–6 М, выявил фрагменты ДНК олигонуклеосомальной длины, характерные для апоптоза. Результаты демонстрируют, что как агонист, так и антагонист ГнРГ ингибируют пролиферацию клеток гранулезы посредством апоптоза, причем агонист ГнРГ, наряду с этим, стимулирует дифференцировку клеток в преовуляторном фолликуле [21].
Были проведены два эксперимента на взрослых самках крыс для изучения влияния длительного применения агонистов ГнРГ на количество и распределение по размеру фолликулов яичника. Введение продолжалось в течение 52 дней в первом эксперименте и в течение 229 дней во втором. Каждый шестнадцатый срез одного яичника каждой крысы исследовали на световом микроскопе, совмещенном с компьютерной системой анализа изображений BioQuant. Затем контрольных животных и крыс после воздействия ГнРГ спаривали с известными самцами-селекционерами и оценивали количество и нормальность потомства. У крыс, получавших агонист ГнРГ, общее количество фолликулов, количество и процент фолликулов диаметром менее 35 мкм был значительно выше, а количество и процент фолликулов диаметром больше 50 мкм – значительно ниже, чем в контрольной группе. Количество забеременевших крыс и крысят в помете существенно не отличалось между опытными и контрольными животными. Агонисты ГнРГ ингибируют физиологический процесс рекрутирования и потери фолликулов, но фертильность сохраняется даже после длительного введения агонистов ГнРГ [22].
ГнРГ экспрессируется в яичнике и модулирует дифференцирование его клеток. Гранулезные клетки получали от незрелых крыс и культивировали в среде DMEM/F12, содержащей комбинации ФСГ, эстрадиола и трансформирующего фактора роста-бета (TGF-бета) как в присутствии, так и без ГнРГ. Аналог ГнРГ, лейпролид, в концентрации до 5 × 10–11 М вызывал дозозависимое ингибирование включения 3H-тимидина в клетки, культивируемые в присутствии ФСГ (20 нг/мл) и TGF-бета (2.5 нг/мл). Аналогичным образом полное ингибирование гормонально-стимулированного синтеза ДНК наблюдали с другим аналогом ГнРГ (бусерелин, 1.58 ± 0.22 × 10–10 М) и нативным ГнРГ (1.4 ± 0.3 × 10–6 М). Конкурентный антагонист ГнРГ (антид) использовали для нейтрализации эффектов агонистов ГнРГ. Антид в дозе 10–8 М может предотвращать ингибирование синтеза ДНК, вызванное 10–7 М лейпролида. То есть ГнРГ может играть роль в регуляции пролиферации гранулезных клеток крысы во время развития фолликула [23].
ГнРГ модулирует дифференцирование клеток яичников различных видов животных. Было изучено прямое влияние агониста ГнРГ на частоту апоптоза и активность стероидогенеза в клетках гранулезы яичников свиньи и человека. Клетки были получены от 6-месячных свиней, а также от женщин после ЭКО и культивированы в минимальной необходимой среде (MEM) с добавлением 5% эмбриональной бычьей сыворотки в течение 24 ч. ГнРГ бусерелин добавляли в MEM в различных концентрациях (0.5; 50; 500 пг/мл и 5 нг/мл). Ядра клеток гранулезы были исследованы методами флуоресцентной микроскопии после окрашивания Hoechst 33258. ГнРГ непосредственно увеличивал частоту апоптоза в клетках гранулезного типа. Концентрация ГнРГ при его клиническом использовании оказалась намного выше, чем концентрация, вызывающая апоптоз в культивируемых клетках гранулезы [24].
Проанализировано влияние аналога ГнРГ (10–9 M) на пролиферацию, апоптоз и дифференцирование культивируемых гранулезных клеток свиньи, полученных из фолликулов яичника на разных стадиях развития. Число клеточных элементов гранулезы, культивируемых в присутствии агониста ГнРГ и положительных по ядерному антигену пролиферирующих клеток, было ниже по сравнению с клетками, выращиваемыми в отсутствие препарата. Однако частота апоптоза была выше, а секреция эстрадиола и прогестерона культивируемыми клеточными элементами – ниже в присутствии агониста ГнРГ. Ингибирующее действие препарата на пролиферацию было заметно в культивируемых клетках гранулезы только из малых и средних, но не из крупных фолликулов. Напротив, антипролиферативный эффект агониста ГнРГ на секрецию эстрадиола и прогестерона был отмечен в культивируемых клетках, полученных только из крупных фолликулов. Однако стимулирующее действие агониста ГнРГ на апоптоз было одинаковым, независимо от стадий развития фолликулов. Эти результаты демонстрируют, что агонист ГнРГ оказывает различные воздействия на клетки гранулезы в течение роста фолликулов. Препарат подавляет пролиферацию клеточных элементов в незрелых фолликулах и стероидогенез – в зрелых, параллельно усиливается апоптоз гранулезных клеток независимо от стадий фолликулогенеза [25].
Овуляция не происходила ни в одном перфузированном препарате яичников кроликов, обработанных бусерелином или ацетатом лейпролида (102–104 нг/мл), в отсутствие гонадотропина. Агонисты ГнРГ обуславливают возобновление мейоза в фолликулярных ооцитах дозозависимым образом. Кроме того, добавление ГнРГ к перфузату значительно увеличивало процент фолликулярных ооцитов, которые демонстрировали признаки дегенерации по сравнению с интактным контролем. Продуцирование ПГЕ2 и простагландина F2-альфа перфузированными яичниками кролика было значительно стимулировано применением ГнРГ, тогда как не было отмечено увеличения выработки прогестерона или эстрадиола. ГнРГ действует непосредственно в яичнике кролика, вызывая мейотическое созревание в фолликулярных ооцитах, одновременно усиливая их дегенерацию [26].
Преовуляторные фолликулы кролика культивировали in vitro с ХГЧ (102 нг/мл) или без него, с бусерелином (102–105 нг/мл) или лейпролидом (102–105 нг/мл) в течение 14 ч. Агонисты ГнРГ индуцировали возобновление мейоза в ооцитах внутри фолликулов в зависимости от дозы. Процент ооцитов, достигших разрушения зародышевого пузырька после обработки 105 нг/мл бусерелина (87.9 ± 6.3%) или 105 нг/мл лейпролида (86.0 ± 4.1%), существенно не отличался от контроля (87.3 ± 3.8%) после введения ХГЧ. Зрелые ооциты первоначально были обнаружены в течение 2 ч после воздействия агонистом ГнРГ. Агонисты ГнРГ значительно стимулировали продуцирование как ПГЕ2, так и F2-альфа преовуляторными фолликулами (p < 0.01), но уровни секретируемого простаноида существенно не различались при воздействии различными концентрациями агонистов ГнРГ. Мейотическое созревание фолликулярных ооцитов после воздействия агонистами ГнРГ началось на 2 ч раньше, чем продуцирование простагландина, было дозозависимым, но при этом увеличивалась дегенерация ооцитов. Выработка простагландинов, стимулируемая агонистами ГнРГ, может быть значительно снижена индометацином. Однако зрелость ооцитов в присутствии агониста ГнРГ вместе с индометацином существенно не отличалась от действия одного агониста ГнРГ. Одновременное добавление 104 нг/мл антагониста ГнРГ блокировало стимулирующее действие агониста ГнРГ на созревание ооцитов и выработку простагландинов зрелыми фолликулами, а также обращало вспять скорость дегенерации ооцитов. Частота нормального оплодотворения и раннего эмбрионального развития была значительно снижена в ооцитах, созревших с помощью ГнРГ, по сравнению с ооцитами, созревшими с помощью ХГЧ. То есть аналоги-агонисты ГнРГ индуцируют возобновление мейоза в ооцитах фолликулов в яичниках кроликов по механизму, отличному от стимуляции простагландинами. Ооциты, созревшие in vitro с помощью ГнРГ, не обязательно являются цитоплазматически зрелыми [27].
13 кроликам подкожно вводили имплантат с длительным высвобождением агониста ГнРГ деслорелина (4.7 мг) для изучения влияния на функцию яичника. Семи животным до наступления половой зрелости (группа 1) были внедрены имплантаты с медленным высвобождением ГнРГ в течение 273 дней. После подтверждения возобновления функции яичников источники препарата повторно имплантировали в возрасте 430 дней. Шести взрослым кроликам (>177 дней; группа 2) внедряли имплантаты деслорелина на срок в 273 дня. Функцию яичников до, во время и после лечения имплантатом оценивали посредством измерения уровня прогестерона в сыворотке периферической крови спустя 10 дней после контрольной инъекции короткодействующего ГнРГ (0.8 мкг бусерелина внутримышечно). Животных в 1-й группе подвергали овариогистерэктомии во время второго курса введения препарата, яичники исследовали гистологическими методами. В яичниках присутствовали неатретические и атретические фолликулы на разных стадиях развития, но без активного желтого тела. Овариогистерэктомию животным 2-й группы проводили через 2–12 мес. после удаления имплантата. Их яичники содержали фолликулы на разных стадиях развития и белые тела. Следовательно, обратимое подавление функций яичников может быть достигнуто у самок кроликов посредством применения имплантатов с медленным высвобождением ГнРГ, вводимых до или после полового созревания [28].
Таким образом, агонисты ГнРГ при длительном применении подавляют овуляцию и вызывают состояние, сходное с менопаузой, у женщин и самок животных. Инфузия агонистов ГнРГ является простым методом подавления продукции ЛГ и ФСГ, а также развития фолликулов. В яичниках ингибируются клетки гранулезы через супрессию синтеза ДНК и индукцию апоптоза с одновременной стимуляцией дифференцировки клеток в преовуляторных фолликулах (рис. 1). Такое состояние является обратимым, сохраняется фертильность, после прекращения лечения гипофиз очень быстро восстанавливает способность реагировать на этот рилизинг.
АГОНИСТЫ ГОНАДОТРОПИН-РИЛИЗИНГ-ГОРМОНА И МАТКА В КЛИНИКЕ И ЭКСПЕРИМЕНТЕ
Как уже упоминалось, аналоги ГнРГ используются для лечения широкого спектра заболеваний, обусловленных половыми гормонами, включая эндометриоз и преждевременное половое созревание [3]. При продолжительном применении они могут вызывать гипофизарную десенсибилизацию и/или снижение регуляции, что приводит к подавлению циркулирующих уровней гонадотропинов и половых гормонов.
У пациентов с миомой матки введение лейпрорелина или гозерелина уменьшает объем матки и симптомы, связанные с заболеванием, но, как и в случае других аналогов ГнРГ, эти эффекты исчезают после прекращения инъекций. В результате терапии у всех пациентов было достигнуто состояние, похожее на менопаузу, о чем свидетельствовали приливы, депрессия, сухость влагалища, атрофия эндометрия по гистероскопическим данным, соответствующие изменения гормональных показателей (ФСГ, ЛГ, эстрадиол). Препараты аналогов ГнРГ могут быть полезны для сокращения объема хирургической интервенции за счет уменьшения размеров миомы матки, хотя это не исключает полностью саму операцию [2, 3]. Лейпрорелин является эффективной альтернативой другим методам лечения женщин с эндометриозом, но рекомендуемая продолжительность его применения в данной клинической ситуации ограничена 6 месяцами, поскольку он снижает минеральную плотность костной ткани [3].
Самкам крыс линии Вистар при эструсе или диэструсе (по данным вагинальной цитологии) ежедневно подкожно вводили 20 мг ацетата бусерелина в течение 4, 8 или 12 дней. Крыс выводили из эксперимента через 24 ч или 5 дней после окончания курса. Контрольная группа животных получала растворитель препарата в течение 12 дней. Прогрессирующая гипотрофия тканей матки возникала во время наблюдения и сопровождалась эстрогенной гиперактивностью в течение 5 дней после окончания эксперимента. Цитология влагалища и гистология эндометрия выявили интенсивно вакуолизированную слизистую оболочку и железистый эпителий, границы кист и строма эндометрия были плотно инфильтрированы эозинофилами. Бусерелин, по-видимому, вызывает прогрессирующую блокаду секреции гонадотропина и важный эффект отдачи, причем усиленное высвобождение эстрогена проявляется уже в первом эстральном цикле после окончания введения [29].
В дополнение к внутриматочной антибиотикотерапии 30 коровам с послеродовым эндометритом вводили 20 мкг аналога ГнРГ бусерелина между 10 и 12 днями после родов, а затем 10 дней спустя, 500 мкг аналога простагландина F2-альфа, клопростенола. 40 контрольных животных лечили только введением антибиотиков в матку. Инволюция матки улучшилась после гормонального лечения: на 42-й день после родов завершение инволюции матки было обнаружено у 93.3% животных, получавших гормоны, и у 82.5% коров, получавших только антибиотик (р ≤ 0.05). Клиническое выздоровление составило 96.6% в экспериментальной и 82.5% в контрольной группе (р ≤ 0.05). Показатели первой беременности были значительно лучше у получавших гормональное лечение, чем у контрольных животных (51.7% против 36.4%, р ≤ 0.05). Однако значения общих показателей беременности и индекса осеменения не были значительно улучшены после применения ГнРГ и простагландина F2-альфа. Сделано заключение, что последовательное применение гормональных препаратов у коров с послеродовым эндометритом положительно влияло на функцию яичников и инволюцию матки, что привело к улучшению показателей фертильности [30].
8 макакам вводили ежедневно по 5 или 20 мкг аналога ГнРГ в течение, приблизительно, одного года для предотвращения овуляции. В последний день лечения (7 обезьян) или во время середины лютеиновой фазы первого цикла после лечения (1 животное) была выполнена лапаротомия. Размер матки был меньше (р < 0.01), чем в контроле с нормальным циклом (n = 6). Клиновидный фрагмент на полную толщину передней стенки матки иссекали и исследовали гистологически. У 5 обезьян, получавших агонист, эндометрий соответствовал атрофическому или покоящемуся пролиферативному типу, но у 2 животных варьировал от раннего пролиферативного до выраженного секреторного типов. Все изменения оказались только доброкачественными. У животного, изученного в лютеиновой фазе после прекращения лечения, был обнаружен нормальный секреторный эндометрий. Яичники от 2 животных после воздействия агонистом ГнРГ также были исследованы гистологическими методами, и было обнаружено, что они состоят из фолликулов на разных стадиях созревания. Наличие эндометриальной активности у 2 из 8 обезьян, получавших агонист ГнРГ, подчеркивает необходимость тщательной оценки эндометрия во время терапии, включающей повторное введение агонистов ГнРГ у пациентов женского пола [31].
Влияние антагонистов ГнРГ, используемых в протоколах ЭКО, на ремоделирование ткани эндометрия, имплантацию эмбриона и программирование ранней беременности до сих пор недостаточно изучено, что вызывает определенное беспокойство за течение беременности и исходы у младенцев после лечения антагонистом ГнРГ для ЭКО [32]. Недавно установлено, что ГнРГ и сплайс-вариант 1-го рецептора ГнРГ экспрессируются в децидуальных стромальных клетках человека, выделенных из децидуальных тканей беременных женщин на ранних сроках, перенесших хирургический аборт [33]. Показано, что агонист ГнРГ-II способствует клеточной подвижности стромальных клеток децидуального эндометрия человека посредством рецептора ГнРГ-Р и фосфорилирования внеклеточной регулируемой сигналом протеинкиназы 1/2 и JNK-зависимой активации MMP-2 и MMP, что оказывает сильное влияние на имплантацию эмбриона [32].
В результате длительного, до 2 лет несколькими циклами, введения ГнРГ у 5 из 7 кроликов наблюдали гиперплазию эндометрия и эндометрит. Гистопатологическое исследование 4 животных, кастрированных во время индуцированной псевдобеременности, не выявило признаков изменений матки. У двух животных, перенесших овариогистерэктомию, через 12 мес. после удаления имплантата диагностирован эндометрит. Развитие возрастной патологии матки невозможно предотвратить подавлением функций яичников посредством длительного использования препаратов ГнРГ [28].
ГнРГ экспрессируется в децидуальных стромальных клетках человека, выделенных из децидуальных тканей беременных женщин, перенесших хирургический аборт на ранних сроках. Обработка клеточных элементов стромы антагонистом ГнРГ (JMR-132) индуцировала апоптоз с увеличением активности каспаз-3 и -9 и снижала жизнеспособность клеток в зависимости от времени и дозы [32].
За счет быстрой инволюции матки после применения аналогов ГнРГ возможны задержка или даже остановка прогрессирования миомы с исчезновением ее симптомов, при этом кровоток в матке не меняется. На фоне гипотрофии матки, эндометрий соответствует атрофическому или покоящемуся пролиферативному типу (рис. 1). Вместе с этим есть прямо противоположные данные, свидетельствующие о том, что длительное использование ГнРГ способствует гиперплазии эндометрия и эндометриту, подавление функций яичников не предотвращает развитие возрастной патологии матки. В любом случае в процессе лечения ГнРГ необходим тщательный контроль состояния эндометрия. Также возможно введение агонистов ГнРГ для ускорения восстановления матки после родов, даже в условиях антибиотикотерапии эндометрита.
ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ АГОНИСТОВ ГОНАДОТРОПИН-РИЛИЗИНГ-ГОРМОНА
Рецепторы ЛГРГ экспрессируются примерно в 80% случаев рака эндометрия и яичников человека и составляют более 50% случаев рака молочной железы, включая тройной негативный рак молочной железы [34]. Кроме гипофиза и репродуктивных органов, никакие другие органы или гемопоэтические стволовые клетки не экспрессируют рецепторы ЛГРГ (ГнРГ). Таким образом, эти рецепторы можно рассматривать как идеальную мишень для персонализированного медицинского подхода в терапии рака.
Аналоги ГнРГ действуют на гормонозависимые опухоли и влияют на их рост. Некоторые препараты с длительным действием были эффективны при лечении опухолей яичников. Современные аналоги ГнРГ демонстрируют очень низкий эндокринный, но высокий противоопухолевый эффект как в экспериментах in vitro, так и in vivo. Меченные тритием производные ГнРГ выявляют специфические сайты связывания на линиях опухолевых клеток человека. Были синтезированы аналоги ГнРГ третьего поколения с эффективной селективной противоопухолевой активностью, которая не изменяет цикл яичников у крыс, но ингибирует образование колоний в клеточных линиях рака и обладает значительным антипролиферативным эффектом (рис. 1). Используя аналоги радиоактивно меченных пептидных гормонов, обнаружили, что линии опухолевых клеток человека и ксенотрансплантаты специфически связывают конъюгаты ГнРГ. Новые аналоги ГнРГ, действующие без какого-либо гормонального эффекта, могут представлять собой прорыв в исследовании противоопухолевых пептидов, оказывающих прямое влияние на опухолевые клетки [35].
Необходимо особо отметить данные литературы с описанием успешного лечения аналогами ГнРГ метастазов в легкие, кости и другие органы опухолей матки [36–38].
Количество клеток рака яичников человека (линия HRA) и поглощение ими 3Н-тимидина значительно возросли после добавления ФСГ, но эффект подавлялся бусерелином. Рецепторы к ФСГ и ГнРГ были идентифицированы в клетках HRA, и количество рецепторов было значительно снижено при обработке бусерелином [39]. Исследовали пролиферацию клеток линий HHUA (эндометриальная карцинома) в культуре низкой и высокой плотности в условиях применения агониста ГнРГ бусерелина. Препарат отрицательно влиял на формирование колоний в зависимости от дозы при низкой плотности клеток, но был неэффективен при высокой плотности клеточных элементов. Культуральная среда клеток HHUA ингибировала действие бусерелина. Эти результаты позволяют предположить, что клеточная линия в процессе культивирования секретирует некоторые вещества, которые регулируют пролиферацию клеток, и что эти вещества также могут изменять эффекты этого аналога ГнРГ [40].
В яичнике, имплантированном в селезенку овариэктомированной крысы, развивается лютеинизированная опухоль, растущая в ответ на гонадотропины. Бусерелин сдерживает рост опухоли, возможно, вследствие прямого ингибирующего влияния на клетки лютеомы. Клеточные элементы, полученные из экспериментальной лютеинизированной опухоли яичника, более чувствительны к эндокринному действию ГнРГ, чем интактные лютеиновые клетки. Трансформация клеток яичника в лютеому подразумевает приобретение новых характеристик в системе генерации рецепторов к ГнРГ [41].
Бусерелин in vitro индуцировал уменьшение количества клеток яичников, полученных от препубертатных крыс, и клеток лютеиноклеточной опухоли яичника в одинаковой степени. Хотя уровни базального апоптоза были выше в клетках яичников, чем в лютеиноклеточной опухоли, индуцированный бусерелином апоптоз был обнаружен только в клетках лютеомы после 48-часового воздействия [42].
Аналоги ГнРГ могут оказывать прямые противоопухолевые эффекты на клетки различных линий рака яичников. Бусерелин вызывал статистически значимое снижение роста клеток в двух из шести клеточных линий этого рака, но никакой зависимости от дозы не наблюдали. Лейпролид (агонист ГнРГ) приводил к значительному дозозависимому ингибированию роста всех шести клеточных линий, когда дозы были увеличены до супрафизиологического уровня, но продемонстрировал отсутствие значительного ингибирования в клинически приемлемых дозах. Антид (антагонист ГнРГ) в таких же дозах не влиял на рост опухоли. Анализ конкурентного взаимодействия не выявил специфического связывания изучаемых препаратов с любой из шести протестированных клеточных линий рака яичников [43].
Slotman с соавт. [44] наблюдали только небольшое прямое ингибирующее действие агониста ГнРГ бусерелина в высоких концентрациях на пролиферацию трех клеточных линий рака яичников человека. Авторы делают заключение о маловероятности того, что прямой противоопухолевый эффект является основным механизмом действия ГнРГ при лечении рака.
Вместе с этим имеются данные, что бусерелин не ингибирует рост DMBA-индуцированной аденокарциномы яичника у крыс, но гистологически в группе, получавшей бусерелин, наблюдали усиление некроза центральной части опухоли, уменьшение количества опухолевых клеток и пролиферацию соединительной ткани. Ежедневное введение in vivo бусерелина значительно подавляло высвобождение ФСГ, ЛГ и прогестерона по сравнению с контрольной группой. In vitro бусерелин подавлял ФСГ-индуцированную пролиферацию клеток DMBA [45].
В эксперименте были исследованы 18 случаев злокачественных новообразований яичников для определения возможной роли гонадотропинов в развитии опухоли. 12 случаев серозной цистаденокарциномы, 2 муцинозной цистаденокарциномы, 2 эндометриоидной карциномы, одна злокачественная опухоль Бреннера и одна опухоль желточного мешка были исследованы после имплантации под капсулу почек самок мышей для определения их реакции на бусерелин. Результаты показали, что в группе, получавшей аналог ГнРГ, размер ксенотрансплантатов увеличился (р < 0.05). Возможно, что гонадотропины играют определенную роль в стимулировании онкогенеза злокачественных новообразований яичников, связываясь со специфическими рецепторами [46].
Так как агонисты ГнРГ ингибируют функции яичников и вызывают инволюцию матки, эти препараты можно успешно применять для лечения доброкачественных и онкологических процессов в этих органов, а также для воздействия на метастазы (рис. 1). Но одновременно представлены результаты исследований, показывающие, что прямой эффект ГнРГ на опухоли мало выражен. Есть мнение, что гонадотропины могут даже стимулировать развитие рака яичников, воздействуя на определенные рецепторы.
ДЕЙСТВИЕ ПРЕПАРАТОВ ГОНАДОТРОПИН-РИЛИЗИНГ-ГОРМОНА НА РЕПРОДУКТИВНЫЕ ОРГАНЫ В УСЛОВИЯХ ХИМИОТЕРАПИИ
Чтобы исследовать механизм защитного действия агонистов ГнРГ против вызванного химиотерапией повреждения яичников, самкам крыс имплантировали 1 мг агониста ГнРГ (гранулы золадекса). Всем крысам имплантировали осмотические мининасосы, загруженные 3H-тимидином, за 48 ч до вывода из эксперимента в стадии диэструса. ГнРГ через 5 дней после имплантации гранул значительно снижал поглощение тритированного тимидина яичниками. Ауторадиография показала, что почти весь 3H-тимидин оказался в гранулезных клетках. Не исключено, что ГнРГ подавляет митотическую активность клеток яичников. Поскольку цитотоксические агенты преимущественно разрушают быстро делящиеся клетки, эти результаты могут представлять собой механизм защиты яичников при химиотерапии (рис. 1) [47].
Возможность снижения бусерелином овариотоксичности противоопухолевого препарата этопозида была изучена на самках крыс породы Вистар. Количественный анализ структурных и функциональных элементов яичников на серийных срезах всего органа показал, что через 3 мес. после комбинированного лечения этопозидом и бусерелином морфологическая картина овариальных желез не отличалась от таковой у интактных животных того же возраста, тогда как монотерапия этопозидом привела к более раннему развитию атрофических процессов. Через шесть месяцев после лечения количество двух- и многослойных фолликулов было значительно выше у крыс, получавших комбинированную терапию, по сравнению с животными после применения только этопозида [48].
В процессе проведения метаанализа результатов 13 рандомизированных контролируемых исследований по сравнительной оценке эффекта применения аналогов ГнРГ и химиотерапии (609 пациентов) с только химиотерапией (599 участников) были получены доказательства, хотя и низкого качества (по мнению самих авторов), о целесообразности использования агонистов ГнРГ до и/или во время химиотерапии для снижения риска первичной недостаточности яичников и увеличения вероятности спонтанной беременности в краткосрочной перспективе [49].
Однако в исследованиях Waxman с соавт. [50] бусерелин оказался неэффективным для сохранения фертильности при цитотоксической химиотерапии. 18 женщин были случайным образом распределены для получения аналога агониста ГнРГ до и во время цитотоксической химиотерапии при прогрессирующей болезни Ходжкина. Бусерелин назначали в однократном режиме 8 женщинам. Стандартный тест на ГнРГ проводили за 1 нед. до и в 1-й день каждого цикла химиотерапии. Используемая схема привела к первоначальному подавлению пиковых ответов ФСГ на ГнРГ, которое не поддерживалось все время наблюдения. При последующей оценке в течение 3 лет после завершения лечения у 4 из 8 пациентов женского пола после применения бусерелина и у 6 из 9 контрольных женщин была зарегистрирована аменорея.
Неэффективность аналогов ГнРГ во время химиотерапии для защиты яичников подтверждена Elgindy с соавт. [51] в обзоре большого количества данных с метаанализом. Сравнивали опубликованные рандомизированные контролируемые результаты исследований восстановления овариальных функций между группами пациентов женского пола после проведения химиотерапии в сочетании с агонистами ГнРГ и без этих препаратов. Сделано заключение, что включение в схему терапии аналогов ГнРГ является ненадежным методом сохранения фертильности.
Необходимо также отметить и работы, свидетельствующие о недостаточности доказательств для выводов об эффективности или отсутствии таковой в отношении защиты яичников при совместном применении агонистов ГнРГ с химиотерапевтическими препаратами. Авторы отмечают необходимость дальнейших исследований, которые, кроме всего прочего, должны учитывать частоту наступления беременности и изменение результативности противоопухолевой терапии [52].
Таким образом, при изучении результатов применения аналогов ГнРГ для защиты от повреждающих воздействий химиотерапии на органы репродуктивной системы существует определенная противоречивость. Идея такого использования связана опять же с подавлением активности клеток яичников и эндометрия, тогда как повреждающие факторы оказывают более сильное неблагоприятное влияние именно на пролиферативно и функционально активные клеточные элементы. Большинство ученых сообщает о хорошей протекции агонистов ГнРГ в условиях химиотерапии, но имеются данные о слабой эффективности или вообще отсутствии защитного действия препаратов данной группы.
ЗАКЛЮЧЕНИЕ
Можно сделать заключение, что основные исследования эффекта агонистов ГнРГ на репродуктивные органы женщин и самок экспериментальных животных были проведены еще в конце прошлого столетия. В настоящее время работы, в основном, посвящены изучению частных особенностей применения аналогов ГнРГ и результатам применения новых препаратов для лечения тех или иных патологических процессов. В многочисленных статьях отмечено, что агонисты ГнРГ при длительном применении подавляют овуляцию и вызывают состояние, сходное с менопаузой. Инфузия агониста ГнРГ является простым методом подавления продукции ЛГ и ФСГ, а также развития фолликулов. В яичниках происходит ингибиция клеток гранулезы через супрессию синтеза ДНК и индукцию апоптоза с одновременной стимуляцией дифференцировки клеток в преовуляторных фолликулах. Такое состояние является обратимым, сохраняется фертильность: после прекращения лечения гипофиз очень быстро восстанавливает способность реагировать на этот рилизинг. За счет быстрой инволюции матки после применения аналогов ГнРГ возможны задержка или даже остановка прогрессирования миомы с исчезновением ее симптомов, при этом кровоток в матке не меняется. На фоне гипотрофии матки эндометрий соответствует атрофическому или покоящемуся пролиферативному типу. Вместе с этим есть прямо противоположные данные о том, что длительное использование ГнРГ способствует гиперплазии эндометрия и эндометриту, а подавление функций яичников не предотвращает развитие возрастной патологии матки. В любом случае в процессе лечения ГнРГ необходим тщательный контроль состояния эндометрия. Также возможно введение агонистов ГнРГ для ускорения восстановления матки после родов даже в условиях антибиотикотерапии эндометрита. Препараты ГнРГ успешно применяют для лечения доброкачественных и онкологических процессов в яичниках и матке, а также для воздействия на метастазы. Вместе с этим представлены результаты исследований, показывающие, что прямой эффект ГнРГ на опухоли мало выражен, есть мнение, что гонадотропины могут даже стимулировать развитие рака яичников, воздействуя на определенные рецепторы. Большинство ученых сообщает о хорошей протективной способности агонистов ГнРГ в условиях химиотерапии, но имеются данные о слабой эффективности или вообще отсутствии защитного действия препаратов данной группы. В любом случае противоречивость публикаций по каждому из аспектов эффекта ГнРГ свидетельствует о его малой изученности, целесообразности продолжения не только прикладных, но и фундаментальных исследований.
Список литературы
Emons G, Gründker C (2021) The Role of Gonadotropin-Releasing Hormone (GnRH) in Endometrial Cancer. Cells 10(2): 292. https://doi.org/10.3390/cells10020292
Brogden RN, Buckley MM, Ward A (1990) Buserelin. A review of its pharmacodynamic and pharmacokinetic properties, and clinical profile. Drugs 39(3): 399–437. https://doi.org/10.2165/00003495-199039030-00007
Plosker GL, Brogden RN (1994) Leuprorelin. A review of its pharmacology and therapeutic use in prostatic cancer, endometriosis and other sex hormone-related disorders. Drugs 48(6): 930–967. https://doi.org/10.2165/00003495-199448060-00008
Sand E, Linninge C, Lozinska L, Egecioglu E, Roth B, Molin G, Weström B, Ekblad E, Ohlsson B (2015) Buserelin treatment to rats causes enteric neurodegeneration with moderate effects on CRF-immunoreactive neurons and Enterobacteriaceae in colon, and in acetylcholine-mediated permeability in ileum. BMC Res Notes 8: 824. https://doi.org/10.1186/s13104-015-1800-x
Ohlsson B (2016) Gonadotropin-Releasing Hormone and Its Physiological and Pathophysiological Roles in Relation to the Structure and Function of the Gastrointestinal Tract. Eur Surg Res 57(1–2): 22–33. https://doi.org/10.1159/000445717
Jönsson A, Sand E, Ekblad E, Ohlsson B (2016) Long‑term follow‑up of buserelin‑induced enteric neuropathy in rats. Mol Med Rep 13(4): 3507–3513. https://doi.org/10.3892/mmr.2016.4968
Ezoe K, Murata N, Yabuuchi A, Kobayashi T, Kato K (2019) Evaluation of uterine receptivity after gonadotropin releasing hormone agonist administration as an oocyte maturation trigger: a rodent model. Sci Rep 9(1): 12519. https://doi.org/10.1038/s41598-019-48918-3
Lopes TP, Padilla L, Bolarin A, Rodriguez-Martinez H, Roca J (2020) Weaned Sows with Small Ovarian Follicles Respond Poorly to the GnRH Agonist Buserelin. Animals (Basel) 10(11): 1979. https://doi.org/10.3390/ani10111979
Kaps M, Okada CTC, Gautier C, Aurich J, Scarlet D, Kuhl J, Aurich C (2021) Transient suppression of ovulatory ovarian function in pony mares after treatment with slow-release deslorelin implants. Domest Anim Endocrinol 74: 106505. https://doi.org/10.1016/j.domaniend.2020.106505
Abdulkhalikova D, Bokal EV, Stimpfel M, Ciglar P, Korosec S (2022) Reproductive Outcome After GnRH Agonist Triggering With Co-Administration of 1500 IU hCG on the Day of Oocyte Retrieval in High Responders: A Long-Term Retrospective Cohort Study. Front Endocrinol (Lausanne) 13: 826411. https://doi.org/10.3389/fendo.2022.826411
Kong J, Su F, Liu Y, Yang Y, Cao Y, Qiu J, Wang Y, Zhang L, Wang J, Cao X (2022) The pharmacokinetics of buserelin after intramuscular administration in pigs and cows. BMC Vet Res 18(1): 136. https://doi.org/10.1186/s12917-022-03237-0
Liu Y, Yang J, Che X, Huang J, Zhang X, Fu X, Cai J, Yao Y, Zhang H, Cai R, Su X (2021) Agonistic analog of growth hormone-releasing hormone promotes neurofunctional recovery and neural regeneration in ischemic stroke. Proc Natl Acad Sci U S A 118(47): e2109600118. https://doi.org/10.1073/pnas.2109600118
Rieger AC, Bagno LL, Salerno A, Florea V, Rodriguez J, Rosado M, Turner D, Dulce RA, Takeuchi LM, Kanashiro-Takeuchi RM, Buchwald P, Wanschel ACBA, Balkan W, Schulman IH, Schally AV, Hare JM (2021) Growth hormone-releasing hormone agonists ameliorate chronic kidney disease-induced heart failure with preserved ejection fraction. Proc Natl Acad Sci U S A 118(4): e2019835118. https://doi.org/10.1073/pnas.2019835118
Cai R, Zhang X, Wang H, Cui T, Halmos G, Sha W, He J, Popovics P, Vidaurre I, Zhang C, Mirsaeidi M, Schally AV (2022) Synthesis of potent antagonists of receptors for growth hormone-releasing hormone with antitumor and anti-inflammatory activity. Peptides 150: 170716. https://doi.org/10.1016/j.peptides.2021.170716
Recinella L, Chiavaroli A, Di Valerio V, Veschi S, Orlando G, Ferrante C, Gesmundo I, Granata R, Cai R, Sha W, Schally AV, Lattanzio R, Brunetti L, Leone S (2021) Protective effects of growth hormone-releasing hormone analogs in DSS-induced colitis in mice. Sci Rep 11(1): 2530. https://doi.org/10.1038/s41598-021-81778-4
Cen LP, Ng TK, Liang JJ, Xu C, Zhuang X, Liu YF, Chen SL, Xu Y, Yang Q, Yuan XL, Qin YJ, Chan SO, Chen H, Zhang M, Schally AV, Pang CP (2021) Agonist of growth hormone-releasing hormone enhances retinal ganglion cell protection induced by macrophages after optic nerve injury. Proc Natl Acad Sci U S A 118(28): e1920834118.https://doi.org/10.1073/pnas.1920834118
Baumann R, Kuhl H, Taubert HD, Sandow J (1980) Ovulation inhibition by daily i.m. administration of a highly active LH-RH analog (d-ser(TBU)6-LH-RH-(1-9)-nonapeptide-ethylamide). Contraception 21(2): 191–197. https://doi.org/10.1016/0010-7824(80)90131-6
Kaps M, Okada CTC, Gautier C, Aurich J, Scarlet D, Kuhl J, Aurich C (2021) Transient suppression of ovulatory ovarian function in pony mares after treatment with slow-release deslorelin implants. Domest Anim Endocrinol 74: 106505. https://doi.org/10.1016/j.domaniend.2020.106505
Fanelli D, Beltramo M, Conte G, Cerretini B, Lomet D, Rota A, Aucagne V, Camillo F, Panzani D (2022) The Kisspeptin analogue C6 induces ovulation in jennies. Theriogenology 189: 107–112. https://doi.org/10.1016/j.theriogenology.2022.06.014
Shimozawa N, Iwata T, Yasutomi Y (2022) A controlled ovarian stimulation procedure suitable for cynomolgus macaques. Exp Anim. Epub ahead of print.https://doi.org/10.1538/expanim.21-0198
Yano T, Yano N, Matsumi H, Morita Y, Tsutsumi O, Schally AV, Taketani Y (1997) Effect of luteinizing hormone-releasing hormone analogs on the rat ovarian follicle development. Horm Res 48 Suppl 3: 35–41. https://doi.org/10.1159/000191298
Ataya KM, Sakr W, Blacker CM, Mutchnick MG, Latif ZA (1989) Effect of GnRH agonists on the thymus in female rats. Acta Endocrinol (Copenh) 121(6): 833–840. https://doi.org/10.1530/acta.0.1210833
Saragüeta PE, Lanuza GM, Barañao JL (1997) Inhibitory effect of gonadotrophin-releasing hormone (GnRH) on rat granulosa cell deoxyribonucleic acid synthesis. Mol Reprod Dev 47(2): 170–174. https://doi.org/10.1002/(SICI)1098-2795(199706)47:2<170::AID-MRD7>3.0.CO;2-J
Zhao S, Saito H, Wang X, Saito T, Kaneko T, Hiroi M (2000) Effects of gonadotropin-releasing hormone agonist on the incidence of apoptosis in porcine and human granulosa cells. Gynecol Obstet Invest 49(1): 52–56. https://doi.org/10.1159/000010213
Takekida S, Deguchi J, Samoto T, Matsuo H, Maruo T (2000) Comparative analysis of the effects of gonadotropin-releasing hormone agonist on the proliferative activity, apoptosis, and steroidogenesis in cultured porcine granulosa cells at varying stages of follicular growth. Endocrine 12(1): 61–67. https://doi.org/10.1385/ENDO:12:1:61
Yoshimura Y, Nakamura Y, Yamada H, Nanno T, Ubukata Y, Ando M, Suzuki M (1991) Gonadotropin-releasing hormone agonists induce meiotic maturation and degeneration of oocytes in the in vitro perfused rabbit ovary. Fertil Steril 55(1): 177–183. https://doi.org/10.1016/s0015-0282(16)54079-5
Yoshimura Y, Nakamura Y, Ando M, Shiokawa S, Koyama N, Nanno T (1992) Direct effect of gonadotropin-releasing hormone agonists on the rabbit ovarian follicle. Fertil Steril 57(5): 1091–1097. https://doi.org/10.1016/s0015-0282(16)55029-8
Geyer A, Poth T, Otzdorff C, Daub L, Reese S, Braun J, Walter B (2016) Histopathologic examination of the genital tract in rabbits treated once or twice with a slow-release deslorelin implant for reversible suppression of ovarian function. Theriogenology 86(9): 2281–2289. https://doi.org/10.1016/j.theriogenology.2016.07.024
Trindade CR, Camargos AF, Pereira FE (2008) The effect of buserelin acetate on the uterus of adult rats: morphological aspects. Clin Exp Obstet Gynecol 35(3): 198–201.
Janowski T, Zduńczyk S, Mwaanga ES (2001) Combined gnRH and PGF2alpha application in cows with endometritis puerperalis treated with antibiotics. Reprod Domest Anim 36(5): 244–246. https://doi.org/10.1046/j.1439-0531.2001.00290.x
Kerr-Wilson RH, MacKenzie L, Fraser HM (1981) Effects of chronic LHRH agonist treatment on the endometrium and ovaries of the stumptailed macaque. Contraception 24(6): 647–655. https://doi.org/10.1016/0010-7824(81)90016-0
Wu HM, Chen LH, Schally AV, Huang HY, Soong YK, Leung PCK, Wang HS (2022) Impact of growth hormone-releasing hormone antagonist on decidual stromal cell growth and apoptosis in vitro. Biol Reprod 106(1): 145–154. https://doi.org/10.1093/biolre/ioab214
Wu HM, Chen LH, Schally AV, Huang HY, Soong YK, Leung PCK, Wang HS (2022) Impact of growth hormone-releasing hormone antagonist on decidual stromal cell growth and apoptosis in vitro. Biol Reprod 106(1): 145–154. https://doi.org/10.1093/biolre/ioab214
Engel J, Emons G, Pinski J, Schally AV (2012) AEZS-108: a targeted cytotoxic analog of LHRH for the treatment of cancers positive for LHRH receptors. Expert Opin Investig Drugs. 21(6): 891–899. https://doi.org/10.1517/13543784.2012.685128
Teplán I (2000) Peptides and antitumor activity. Development and investigation of some peptides with antitumor activity. Acta Biol Hung 51(1): 1–29.
Okamoto S, Komura M, Terao Y, Kurisaki-Arakawa A, Hayashi T, Saito T, Togo S, Shiokawa A, Mitani K, Kobayashi E, Kumasaka T, Takahashi K, Seyama K (2017) Pneumothorax caused by cystic and nodular lung metastases from a malignant uterine perivascular epithelioid cell tumor (PEComa). Respir Med Case Rep 22: 77–82. https://doi.org/10.1016/j.rmcr.2017.06.011
Yuan X, Sun Y, Jin Y, Xu L, Dai H, Wang J, Zhang Z, Chen X (2019) Multiple organ benign metastasizing leiomyoma: A case report and literature review. J Obstet Gynaecol Res 45(10): 2132–2136. https://doi.org/10.1111/jog.14066
Aoki K, Yamamoto T, Terauchi R, Mori T, Shirai T, Kitawaki J (2021) Benign metastasizing leiomyoma in femur and thigh with a history of uterine leiomyoma: A case report and literature review. J Obstet Gynaecol Res 47(2): 812–817. https://doi.org/10.1111/jog.14545
Ohtani K, Sakamoto H, Satoh K (1992) Stimulatory effects of follicular stimulating hormone on the proliferation of ovarian cancer cell line in vitro and in vivo. Nihon Sanka Fujinka Gakkai Zasshi 44(6): 717–724.
Enomoto M, Mori T, Park MK (2001) GnRH agonist Buserelin affects colony-forming efficiency of HHUA and Jurkat cells. Biochem Biophys Res Commun 289(5): 1180–1187. https://doi.org/10.1006/bbrc.2001.6131
Chamson-Reig A, Pignataro OP, Libertun C, Lux-Lantos VA (1999) Alterations in intracellular messengers mobilized by gonadotropin-releasing hormone in an experimental ovarian tumor. Endocrinology 140(8): 3573–3580. https://doi.org/10.1210/endo.140.8.6909
Sorianello EM, Fernandez MO, Catalano PN, Mongiat LA, Somoza GM, Libertun C, Lux-Lantos VA (2005) Differential gonadotropin releasing hormone (GnRH) expression, autoregulation and effects in two models of rat luteinized ovarian cells. Life Sci 77(17): 2141–2155. https://doi.org/10.1016/j.lfs.2005.03.018
Connor JP, Buller RE, Conn PM (1994) Effects of GnRH analogs on six ovarian cancer cell lines in culture. Gynecol Oncol 54(1): 80–86. https://doi.org/10.1006/gyno.1994.1170
Slotman BJ, Poels LG, Rao BR (1989) A direct LHRH-agonist action on cancer cells is unlikely to be the cause of response to LHRH-agonist treatment. Anticancer Res 9(1): 77–80.
Maruuchi T, Sugiyama T, Kataoka A, Nishida T, Yakushiji M (1998) Effects of a gonadotropin-releasing hormone agonist on rat ovarian adenocarcinoma cell lines in vitro and in vivo. Jpn J Cancer Res 89(9): 977–983. https://doi.org/10.1111/j.1349-7006.1998.tb00657.x
Ohtani K (1990) Effects of gonadotropin on the growth of malignant ovarian neoplasms assessed by subrenal capsule assay. Nihon Sanka Fujinka Gakkai Zasshi 42(6): 579–585.
Ataya KM, Palmer KC, Blacker CM, Moghissi KS, Mohammad SH (1988) Inhibition of rat ovarian [3H]thymidine uptake by luteinizing hormone-releasing hormone agonists: a possible mechanism for preventing damage by cytotoxic agents. Cancer Res 48(24 Pt 1: 7252–7256.
Borovskaya TG, Timina EA, Perova AV, Pakhomova AV, Shchemerova YA, Gol’dberg VE (2007) Pharmacological correction of etoposide ovariotoxicity. Bull Exp Biol Med 143(5): 614–616. https://doi.org/10.1007/s10517-007-0196-6
Senra JC, Roque M, Talim MCT, Reis FM, Tavares RLC (2018) Gonadotropin-releasing hormone agonists for ovarian protection during cancer chemotherapy: systematic review and meta-analysis. Ultrasound Obstet Gynecol 51(1): 77–86. https://doi.org/10.1002/uog.18934
Waxman JH, Ahmed R, Smith D, Wrigley PFM, Gregory W, Shalet S, Crowther D, Rees LH, Besser GM, Malpas JS, Lister TA (1987) Failure to preserve fertility in patients with Hodgkin’s disease. Cancer Chemother Pharmacol 19(2): 159–162. https://doi.org/10.1007/BF00254570
Chen H, Xiao L, Li J, Cui L, Huang W (2019) Adjuvant gonadotropin-releasing hormone analogues for the prevention of chemotherapy-induced premature ovarian failure in premenopausal women. Cochrane Database Syst Rev 3(3): CD008018. https://doi.org/10.1002/14651858.CD008018.pub3
Elgindy E, Sibai H, Abdelghani A, Mostafa M (2015) Protecting Ovaries During Chemotherapy Through Gonad Suppression: A Systematic Review and Meta-analysis. Obstet Gynecol 126(1): 187–195. https://doi.org/10.1097/AOG.000000000000090526241272
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова