Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1410-1425
Регуляция дыхания человека с помощью электрической стимуляции
Н. Д. Шандыбина 1, 2, *, М. В. Куропатенко 2, Т. Р. Мошонкина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: shandibinan@infran.ru
Поступила в редакцию 12.07.2022
После доработки 28.09.2022
Принята к публикации 29.09.2022
- EDN: RILRSX
- DOI: 10.31857/S0869813922110115
Аннотация
В обзоре рассмотрены современные методы электростимуляции, используемые для регуляции функции внешнего дыхания у человека, а именно абдоминальная функциональная стимуляция дыхательных мышц, стимуляция диафрагмы, стимуляция диафрагмального нерва, эпидуральная и чрескожная стимуляция спинного мозга. Для каждого из методов описаны физиологические основы их применения, приведены примеры использования в клинике, в том числе указаны параметры стимуляции и локализация электродов. Проанализирована целесообразность применения каждого из методов электростимуляции у пациентов с парезом дыхательной мускулатуры и особенности их применения в зависимости от уровня травмы спинного мозга, сохранности нервных волокон. Методу эпидуральной стимуляции спинного мозга уделено особое внимание, так как этот метод применяется в электрофизиологических исследованиях на животных моделях и дает знания о спинальных уровнях регуляции функции внешнего дыхания. В обзоре обоснован большой потенциал использования метода чрескожной электрической стимуляции спинного мозга как в фундаментальных исследованиях функции внешнего дыхания, так и в клинической практике.
Этот обзор задуман как анализ способов регуляции внешнего дыхания человека методами электрической стимуляции. В настоящее время электростимуляцию дыхания производят как инвазивными, так и неинвазивными методами [1]. К наиболее исследованным из них относятся инвазивная электростимуляция диафрагмального нерва и эпидуральная электростимуляция спинного мозга. Активацию дыхания возможно осуществлять методами абдоминальной функциональной электрической стимуляции (аФЭС) и чрескожной электростимуляции диафрагмы. Каждый из этих методов обладает своими ограничениями, достоинствами и недостатками. Разработанный в последнем десятилетии метод чрескожной стимуляции спинного мозга (ЧССМ) является перспективным методом регуляции дыхательной функции из-за его неинвазивности и возможности активировать несколько спинальных центров регуляции дыхания, что важно для полноценной регуляции акта дыхания.
Целью написания обзора был критический анализ частоты и обоснованности использования каждого из методов электростимуляции дыхания в клинической практике на основании работ, опубликованных в последнее десятилетие. Особое внимание уделено методам электростимуляции спинного мозга, в том числе новому методу чрескожной стимуляции спинного мозга, так как этот метод может одинаково успешно быть использован как в фундаментальных исследованиях функции внешнего дыхания, так и в клинической практике.
Настоящий обзор был проведен в соответствии с правилами PRISMA (Предпочтительные элементы отчетности для систематических обзоров и мета-анализов) [2]. Основной вопрос, на который был направлен этот обзор: “как влияет каждый из методов электрической стимуляции на дыхательную систему”. Систематический поиск литературы на русском и английском языках проводили среди публикаций, появившихся с мая 2012 г. по сентябрь 2022 г. в следующих электронных базах: Pubmed, Google Scholar, Scopus, Web of Science, RSCI. В обзор вошли исследования на животных моделях, здоровых добровольцах и пациентах с парезом дыхательной мускулатуры, также были проанализированы ретроспективные клинические исследования и обзоры литературы.
Чтобы выбрать статьи, соответствующие цели обзора, поиск проводили с использованием в качестве основных ключевых слов: “электрическая стимуляция” и “электростимуляция”, в качестве дополняющих терминов: “дыхательная система”, “дыхание”, “диафрагма”, “диафрагмальный нерв”, “мышцы вдоха”, “мышцы выдоха”, “чрескожная стимуляция”. Критериями включения в обзор клинических статей являлись представление рандомизированных и/или многоцентровых исследований. Для сравнения эффективности методов электростимуляции, длительности курса воздействия и фактора оценки сохранности достигнутого эффекта статьи отбирали по принципу наличия контрольной группы. Отдельно анализировали ретроспективные исследования, которые были проведены для оценки качества жизни пациентов с вживленными электростимуляторами диафрагмального нерва и пациентов, прошедших курс эпидуральной стимуляции спинного мозга. Методу эпидуральной стимуляции спинного мозга уделено большое внимание, так как этот метод применяется как в клинических задачах регуляции дыхательной системы при парезе дыхательных мышц, так и в электрофизиологических исследованиях топической локализации дыхательных интернейронов. Статьи, в которых приводились результаты по изучению топических эффектов эпидуральной стимуляции в моделях на животных, включали в обзор только в тех случаях, когда авторы декларировали соблюдение этических стандартов работы с лабораторными животными.
Части обзора представляют результаты, полученные при стимуляции разных структур, обеспечивающих функцию внешнего дыхания: дыхательные мышцы, нервы, иннервирующие эти мышцы, и спинномозговые дыхательные центры.
ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ ДЫХАТЕЛЬНЫХ МЫШЦ
Абдоминальная функциональная электростимуляция
Электростимуляция мышц много лет успешно применяется в качестве тренирующего и восстановительного метода, способствующего улучшению функционального состояния скелетной мускулатуры. Абдоминальную функциональную электростимуляцию (аФЭС) мышц применяют при нарушениях функционирования дыхательной системы различной этиологии и патогенеза: после травмы спинного мозга (ТСМ), при тетраплегии, парапарезе. Чрескожная аФЭС способна вызывать сокращения мышц брюшного пресса даже при их парезе после ТСМ [3]. Авторы показали, что у пациентов с тетраплегией в остром периоде после ТСМ курс аФЭС (20–40 мин в день, 5 раз в неделю в течение 4 нед., 30 Гц, 30–105 мА, длительность импульсов 100–500 мкс) уменьшил длительность искусственной вентиляции легких (ИВЛ) на 11 дней по сравнению с контрольной группой, пациенты которой не получали аФЭС.
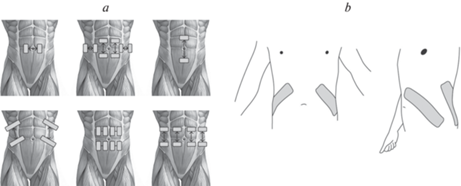
Долгое время при применении метода аФЭС отсутствовала стандартизация протокола наложения стимуляционных электродов. Одну пару или несколько пар анодов и катодов размещали в пределах одной или соседних мышц живота (рис. 1a). В исследовании с участием здоровых добровольцев были проанализированы эффекты, достигаемые при различных положениях электродов на стенке живота. Было продемонстрировано, что при постериолатеральном наложении пары анод–катод достигается максимальная активация экспираторной мускулатуры [4] (рис. 1b). Использовали электроды размером 4 × 18 или 4 × 14 см; диагонально располагая электроды такого размера, экспериментаторы при стимуляции одновременно активировали многие мышц живота.
Именно эта схема наложения стимуляционных электродов используется в современных исследованиях аФЭС. Например, Butler с соавт. обнаружили, что поверхностная стимуляция постериолатеральных мышц живота у пациентов с ТСМ на уровне сегмента Т6 или выше приводит к увеличению пикового и среднего потоков выдоха на 36 и 80% соответственно, увеличивает дыхательные объемы на 41%, а также уменьшает риск респираторных осложнений [5].
Анализ клинических исследований, проведенный в 2019 г., показал, что у пациентов с парезом дыхательной мускулатуры вследствие ТСМ при прохождении курса аФЭС длительностью от 6 недель облегчается самостоятельное дыхание, происходит очищение дыхательных путей, улучшается секреторная функция легких [6].
Таким образом, основная цель, для которой может быть использована аФЭС в клинике – это снижение риска респираторных осложнений, вызванных плохо отделяемым секретом в дыхательных путях при парезе дыхательной мускулатуры.
Чрескожная электростимуляция диафрагмы
Чрескожная электрическая диафрагмальная стимуляция (ЧЭДС) направлена на активацию и тренировку интактных мышечных волокон, вызывающих сокращение диафрагмы. Применение ЧЭДС предотвращает мышечную гипотрофию, в том числе у пациентов с нервно-мышечными заболеваниями и у пациентов, зависимых от ИВЛ [7, 8].
В ретроспективном исследовании анализировали медицинские документы пациентов, находившихся в реанимации вследствие ТСМ шейного отдела в 2007–2016 гг. [7]. Из 13 пациентов с трахеостомой 4 пациента получали 7-недельный курс ЧЭДС (30 Гц, 60 мА, длительность импульса 1 мс), 6 пациентов прошли по стандартному протоколу ИВЛ, остальные пациенты были исключены из анализа из-за неполноты данных или смерти. Электроды для ЧЭДС располагали билатерально по средней подмышечной линии между 6–7-ми и 7–8-ми ребрами и над мечевидным отростком. Курс ЧЭДС приводил к увеличению силы инспираторных мышц, сокращению количества дней в реанимации, снижению потребности в ИВЛ. Отсутствие потребности в ИВЛ было ключевым показателем, при котором завершался курс ЧЭДС; средняя продолжительность курса составила 47 сессий. Все 4 пациента были сняты с ИВЛ. Последнее наиболее актуально в ходе дыхательной реанимации.
ЧЭДС применяли также и у пациентов с COVID-19, находящихся в реанимации на ИВЛ (биполярные волны с частотой стимуляции 30 Гц, длительностью импульса 400 мкс и временем нарастания 0.7 с). Интенсивность ЧЭДС постепенно увеличивали до тех пор, пока не наблюдалось видимое сокращение мышц. Время и частота применения ЧЭДС – 30 мин в день, 5 дней в неделю. Во время каждого сеанса прямоугольные электроды помещались в парастернальную область рядом с мечевидным отростком в области 6-го и 7-го межреберий на одной линии со средней подмышечной линией. У лиц, находившихся на ИВЛ и получавших сеансы ЧЭДС, в конце исследования наблюдалось увеличение минутного объема на 0.64 (0.67–2.3) л, тогда как в группе пациентов только с ИВЛ минутный объем снизился на 1.2 (2.5–0.78) л. Различия были статистически значимыми (р = 0.01) [8].
По мнению Postma и соавт. протоколы ЧЭДС не стандартизированы, не выработаны рекомендации для лечения пациентов в критическом состоянии. Также выборки пациентов в исследованиях влияния ЧЭДС достаточно малы (n = 4–12) и не доказана сохранность воздействия в ретроспективных исследованиях [9].
ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ ДИАФРАГМАЛЬНОГО НЕРВА
Электростимуляция дыхания у пациентов с травмами и другими повреждениями шейного отдела спинного мозга, зависимых от ИВЛ, имеет долгую историю, насчитывающую более 2 столетий. ИВЛ сопровождается нефизиологическим повышением транспульмонального давления и нефизиологическим изменением плеврального давления во время вентиляции, поэтому при длительной ИВЛ вентиляционная способность легких снижается, в связи с чем применяются различные способы стимуляции нервов и мышц, участвующих в акте дыхания [10].
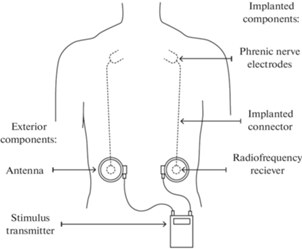
Инвазивная стимуляция диафрагмального нерва в области шеи и грудной клетки приводит к активации сокращений диафрагмы. Известно, что прямая электрическая стимуляция диафрагмального нерва вызывает синхронную активацию аксонов в электрическом поле, при которой генерируется ритмичный паттерн дыхания [11]. Этот метод считается безопасным и практичным способом обеспечения респираторной поддержки у зависимых от ИВЛ пациентов с травмой шейного отдела спинного мозга [12, 13]. С помощью эндоскопии имплантируемые электроды вводят на уровне 2-, 3- или 4-го межреберья (рис. 2), крепят к диафрагмальным нервам в направлении верхнего средостения и подключают к внешнему стимулятору [14]. Этот метод может быть использован на раннем этапе лечения для снижения необходимости использования ИВЛ в отделениях интенсивной терапии.
В ретроспективном исследовании, проведенном в 2011 г., показано, что после того, как 37 пациентам с повреждением спинного мозга на шейном уровне были имплантированы стимуляторы диафрагмального нерва, у 98% пациентов при стимуляции дыхательный объем стал на 15% больше дыхательного объема до стимуляции [16].
Недавно были проанализированы многочисленные доклинические и клинические исследования, направленные на восстановление произвольного дыхания у пациентов с ТСМ выше диафрагмальных ядер, и сделан вывод о возможности полного восстановления дыхания с использованием стимуляции диафрагмального нерва [17].
В исследовании 2018 г. показано, что у 5 из 92 пациентов с ТСМ, получавших электростимуляцию диафрагмального нерва, полностью восстановилась функция дыхания, причем двум из них смогли удалить стимуляторы [18]. В подгруппе лиц, которым проводили стимуляцию диафрагмального нерва в первый год после ТСМ, 73% пациентов успешно отключались от аппарата ИВЛ на 24 ч в сутки, а в подгруппе пациентов, которых стимулировали через 2 года после травмы, такой результат был достигнут в 51% случаев. Авторы пришли к выводу, что раннее использование диафрагмального стимулятора приводит к благоприятным исходам и улучшает качество жизни людей с дыхательной дисфункцией после ТСМ.
К ограничениям метода следует отнести следующие особенности. Стимуляция диафрагмального нерва подходит пациентам с ТСМ выше С4, поскольку в таком случае на уровне С3–С5 сохраняется целостность диафрагмального нерва [19]. У пациентов с тетраплегией, развившейся вследствие ТСМ, имплантация диафрагмального стимулятора для восстановления дыхательной функции невозможна из-за недостаточной функциональной активности диафрагмальных нервов [20]. Важно также учитывать тот факт, что при стимуляции диафрагмальных нервов инициируется вдох, но не инициируется выдох.
ЭЛЕКТРИЧЕСКАЯ СТИМУЛЯЦИЯ СПИННОГО МОЗГА
Большой интерес вызывают результаты исследований влияния электрической стимуляции спинного мозга (ССМ) на физиологические функции (кардиореспираторная, двигательная, выделительная) и возможность активно менять эти результаты, меняя место и параметры стимуляции. На данный момент накоплен большой опыт применения ССМ при лечении хронической неизлечимой боли разной этиологии [21, 22]. На тысячах пациентов по всему миру показано, что для лечения болевого синдрома шеи и верхних конечностей эффективен метод высокочастотной стимуляции (от 10 кГц) [23, 24], а низкочастотная ССМ (до 100 Гц) применяется при болях в нижних конечностях [25].
В последние 15 лет показано, что сочетание как инвазивной, так и неинвазивной электростимуляции спинного мозга с двигательными воздействиями эффективно для восстановления произвольных движений и самостоятельной ходьбы у пациентов, парализованных вследствие ТСМ [26–29]. Использование ССМ для двигательной реабилитации основано на доказанном эффекте активации спинальной локомоторной нейросети и пулов мотонейронов при стимуляции поясничного утолщения спинного мозга [30–32]. Неинвазивный метод ЧССМ в последние годы все чаще применяют для управления локомоцией [33].
Одним из преимуществ чрескожной стимуляции относительно эпидуральной ССМ является возможность оказания мультисегментарного воздействия на спинной мозг [34]. Недавно был разработан неинвазивный спинальный нейропротез, использующий это преимущество, активирующий сгибатели и разгибатели ног в зависимости от фаз шага, предназначенный для облегчения ходьбы при гемипарезе вследствие инсульта [35 ] . В нейропротезе проводится непрерывная ЧССМ центрального генератора шага на уровне позвонков Т11–Т12, чтобы облегчить локомоцию, дополнительно осуществляют непрерывную стимуляцию шейного генератора на уровне позвонков С5–С6 для активации движений рук, сопровождающих ходьбу, и увеличения возбудимости нисходящих путей. На фоне непрерывной активации центральных генераторов происходит фазозависимая стимуляция корешков спинного мозга на стороне пареза, на уровне позвонков Т11 для активации паретичных мышц-сгибателей во время фазы переноса и L1 для активации паретичных мышц-разгибателей в фазе опоры.
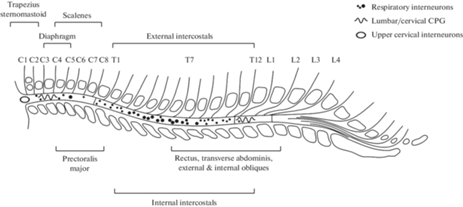
В спинном мозге локализована сеть дыхательных интернейронов, которая обеспечивает формирование дыхательного паттерна в эфферентный моторный выход, координирует активность дыхательных мышц, координирует дыхательные, локомоторные и постуральные движения [36] (рис. 3).
Дыхательный ритм, генерируемый в стволе головного мозга, передается на спинномозговые нейроны через бульбоспинальные премоторные нейроны. Верхние шейные интернейроны находятся в пределах сегментов C1–C2 и могут генерировать ритм дыхания. Шейные и поясничные центральные генераторы локомоторных паттернов могут воспроизводить ритмические паттерны, регистрируемые на дыхательных нервах. Дыхательные интернейроны модулируют бульбоспинальный ритм и координируют активность между моторными пулами. Интернейроны могут переключаться между задачами и, вполне вероятно, что классификация интернейронов не статична. Респираторные афференты и афференты мышц конечностей проецируются на спинномозговые мотонейроны и могут модифицировать генерацию дыхательных паттернов.
ЭПИДУРАЛЬНАЯ СТИМУЛЯЦИЯ СПИННОГО МОЗГА
Локализация электродов и частота ССМ являются критическими детерминантами результата эпидуральной ССМ. Метод эпидуральной стимуляции в исследованиях дыхательной системы, в первую очередь, использовался как единственный электрофизиологических метод детекции респираторных интернейронов (по потенциалу действия).
Эпидуральная стимуляция в моделях на животных
Большая часть работ, направленных на топическую диагностику респираторных эффектов эпидуральной стимуляции, проведена на животных моделях. Так, на крысах было показано, что активация шейных и грудных интернейронов связана с дыханием [37]. Было продемонстрировано, что у кошки проприоспинальные нейроны C1–C3 получают фазное возбуждение во время вдоха и торможение во время выдоха [38]. Нейроны из этой области проецируются в пределах моторного пула диафрагмы [39]. Интернейроны на уровне С3–С6 у децеребрированных кошек также активируются в зависимости от дыхательного цикла [40, 41]. У 35 кроликов на уровне С3–С6 в вентральных рогах дорсально и дорсо-медиально от диафрагмального моторного пула были зарегистрированы 63 интернейрона, из которых 54% инспираторные и 46% экспираторные [42]. Эти электрофизиологические результаты легли в основу дальнейших исследований, позволивших управлять актом дыхания у спинализированных собак. Так, высокочастотная стимуляция вентральной поверхности T2 сегмента спинного мозга (300 Гц, 0–6 мА, 0.2 мс) у 11 собак активировала локальные пулы диафрагмальных мотонейронов через спинномозговые пути, расположенные в латеральных канатиках, тогда как верхние шейные интернейроны оставались незадействованными [43]. Современные исследования на собаках (2017–2019 гг.) показали, что при стимуляции вентральных сегментов на уровне грудного отдела достигается эффект активации инспираторных мышц [44, 45], тогда как при стимуляции нижнегрудных и поясничного отделов достигается эффект активации экспираторных мышц [46–48].
Известно, что из-за схожей организации корково-спинномозговых путей приматов и респираторных бульбоспинномозговых путей грызунов последние могут быть также пригодны для изучения функционального восстановления дыхательных мышц после воспроизведения эффекта ТСМ (частичной или полной гемисекции) [49]. С помощью интраспинальной микростимуляции на уровне сегмента C3 (внутри диафрагмального моторного пула) как у интактных крыс, так и у крыс с ТСМ, можно напрямую успешно активировать мотонейроны диафрагмы [50]. Это позволяет реанимировать поврежденную диафрагму и модулировать ее активность для увеличения объема вдоха. У крыс при неполной ТСМ высокочастотная эпидуральная стимуляция на уровне С4 и T2 приводит к асинхронной активации дыхательных мотонейронов, что вызывает спонтанное дыхание [51].
Эпидуральная стимуляция в клинической практике
В исследованиях с участием пациентов с тетраплегией вследствие ТСМ было показано, что сочетанная стимуляция сегментов T9, T11 и L1 вызывает кашлевой акт за счет сокращения экспираторных мышц [52]. В ретроспективном исследовании продемонстрировано, что в течение 4.6 лет все пациенты продолжали регулярно использовать устройство эпидуральной стимуляции. В результате контрольные показатели качества жизни и респираторной функции оставались высокими: среднее значение максимального давления в дыхательных путях при дыхании, вызванном эпидуральной стимуляцией, удерживалось на уровне 108 ± 23 см H2O. При этом потребность в профессиональной помощи лиц, осуществляющих уход, заметно снизилась, что позволило пяти пациентам из девяти передвигаться самостоятельно [53].
Описан клинический случай, в котором пациенту (9 лет) с полным анатомическим прерыванием спинного мозга на уровне С2 в ходе малоинвазивной операции ввели в эпидуральное пространство электрод на уровне С2–С4 позвонков. Пациент находился все время под аппаратом ИВЛ, длительность эпизодов самостоятельного дыхания не превышала 2 мин. Процесс увеличения возможностей самостоятельного дыхания пациента осуществлялся в четыре последовательных этапа. Первый – разработка и реализация режимов электростимуляции, соответствующих дыхательным паттернам с частотой следования 12, 15 и 20 циклов в мин (10 Гц, длительность импульсов 2500 мкс); в течение этого этапа длительность эпизодов самостоятельного дыхания увеличилась. В течение второго периода (5 дней) способность пациента к самостоятельному дыханию выросла с 9 до 16.5 мин. На третьем этапе (4 нед.) электростимуляцию проводили 4 раза в день по 15 мин при самостоятельном дыхании пациента одновременно с аудиовизуальной поддержкой. В начале четвертого этапа пациенту имплантировали устройство для хронической электростимуляции. Через 6 мес. после выписки из стационара пациент продолжил самостоятельно дышать при одновременной стимуляции 3 раза в день по 20 мин [54].
В табл. 1 обобщены эффекты эпидуральной ССМ, полученные на децеребрированных животных моделях и в клинических исследованиях на пациентах с ТСМ. Доказано, что стимуляция шейного отдела (верхнешейного, среднешейного) ведет к активации диафрагмального дыхания, при сочетанной стимуляции нескольких уровней достигается эффект спонтанного дыхания, а стимуляция тораколюмбального отдела сопровождается активацией экспираторных мышц и инициирует кашлевой акт.
Таблица 1.
Эффекты со стороны дыхательной системы при эпидуральной стимуляции спинного мозга
| Сегмент спинного мозга | Параметры стимуляции | Выборка | Эффекты | № в списке литературы |
|---|---|---|---|---|
| Децеребрированные животные модели | ||||
| С2–С3 | Стимуляция премоторных аксонов одиночными импульсами, 1–91 мА, 0.2 мс | 22 крысы от неонатального до ювенильного возраста | Передача возбуждения проходит через ипсилатеральные нисходящие аксоны медуллярных диафрагмальных премоторных нейронов в любом возрасте | [55] |
| C7 | Стимуляция латеральных и вентральных канатиков одиночными импульсами, 5–50 мА, 0.2 мс | 18 крыс | Показана связь бульбоснипальных инспираторных нейронов вентральной группы с диафрагмальными мотонейронами | [56] |
| С4/T2 | Вентролатерально 300 Гц, 100–1000 мА, 60 с | 8 крыс/7 крыс | Стимуляция потенцирует диафрагмальную активность с небольшим влиянием на частоту вдоха | [51] |
| T4 | 50–100 мA, 0.2 мс | 6 кошек | Инспираторные верхнешейные нейроны получают возбуждение по восходящим путям при вдохе и ингибируются при выдохе | [38] |
| С8, T6 | Вентральная поверхность, 500 Гц, 1 мА | 4 собаки | Самое высокое отрицательное давление в дыхательных путях составило 47 ± 2 см H2O | [44] |
| T9, T11–12, L2 | Дорзальная поверхность, 500 Гц, 1 мА, 0.2 мс | 11 собак | Активация экспираторной мускулатуры (межреберные и наружные косые мышцы) | [48] |
| Клинические исследования у пациентов с травмой спинного мозга | ||||
| С2–С3 | 10 Гц, 2500 мкс | 1 пациент, 9 лет | Самостоятельное спонтанное дыхание | [54] |
| T9, T11, L1 | По срединной линии на дуральном мешке, 40 В, 53 Гц, 150– 200 мс | 10 пациентов | Кашлевой акт за счет сокращений экспираторной мускулатуры | [52, 53] |
В небольшом количестве клинических исследований показано, что регулярная ССМ сопровождается улучшением дыхательной функции, нормализацией секреторной функции легких и повышением качества жизни пациентов. Однако накопленных данных недостаточно, чтобы однозначно соотнести место стимуляции, параметры стимуляции и эффекты, которые оказывает инвазивная электростимуляциия спинного мозга на дыхание. Метод эпидуральной ССМ для регуляции дыхания не получил широкого применения в клинической практике, вероятно, в связи с рисками, связанными с хирургическим вмешательством, и недостаточностью данных об эффективности этого воздействия.
ЧРЕСКОЖНАЯ СТИМУЛЯЦИЯ СПИННОГО МОЗГА
В настоящее время исследования влияния ЧССМ на функцию внешнего дыхания проводятся, как правило, на здоровых добровольцах.
Миняевой с соавт. в исследовании с участием 10 здоровых добровольцев было показано, что динамические изменения параметров легочной вентиляции и газообмена при ЧССМ на уровне позвонков Т11–Т12, над сегментами спинного мозга, в которых локализован центральный шагательный генератор (рис. 3), связаны с вызываемыми стимуляцией шаговыми движениями [57].
В следующем исследовании с участием здоровых добровольцев получены данные о регуляции активности дыхательной мускулатуры с помощью ЧССМ (30 Гц, модулированные частотой 5 кГц). Испытуемые находились в положении полулежа, ЧССМ производили на уровне T12–L1 позвонков. Интенсивность ЧССМ подбирали индивидуально, ориентируясь на интенсивность одиночных монополярных импульсов длительностью 1 мс и частотой 1 импульс в 2–3 с, вызывавшую двигательный ответ в мышцах нижних конечностей. Рабочий диапазон токов составил 30–90 мА. Неинвазивная стимуляция в состоянии покоя вызвала достоверное уменьшение глубины дыхания на 0.10 ± 0.03 л за счет синхронного уменьшения продолжительности и скорости как вдоха, так и выдоха [58].
В исследовании 2020 г. пациенту 39 лет с тетраплегией, развившейся вследствие травмы ныряльщика на уровне C5, провели курс ЧССМ [59]. Перед курсом пациент сообщал о нарушении функции дыхания и снижении способности кашлять и отхаркивать мокроту, особенно в положении лежа. В течение двух недель высокочастотную стимуляцию (10 кГц) чередовали с низкочастотной (30 Гц), также чередовали локализацию электродов на уровне C3–C4, C5–C6 и T1–T2. В результате увеличился объем вдоха и выдоха и увеличилась громкость кашлевого акта с 80 дБ до 86 дБ.
Таким образом, показана принципиальная возможность использования метода ЧССМ для регуляции дыхания. Метод ЧССМ, не связанный с рисками хирургического вмешательства, является удобным инструментом для исследований роли центров спинного мозга в управлении внешним дыханием у человека. Актуальным остается вопрос, возможна ли регуляция активности моторных ядер дыхательных мышц и “дыхательного генератора”, локализованных в грудном и шейном отделах спинного мозга, с помощью ССМ [60].
Представляет интерес создание “дыхательного нейропротеза” по аналогии с неинвазивным спинальным нейропротезом, облегчающим ходьбу [35 ] . Используя метод ЧССМ, можно воздействовать на разные отделы спинного мозга и таким образом инициировать дыхание, усиливать активность диафрагмы, инспираторных и экспираторных мышц в соответствующие их активности фазы дыхательного цикла. Большинство сегментов спинного мозга иннервируют как инспираторные, так и экспираторные мышцы (рис. 3), однако можно надеяться, что, размещая электроды для ЧССМ в одном месте, можно получить разные эффекты на дыхание, используя разные параметры стимуляции. За многие годы использования ССМ для купирования боли показано, что основные параметры стимуляции (амплитуда, длительность импульса, частота) влияют на терапевтический эффект, так как от них зависит доставка электрического заряда в разные локусы спинного мозга [61–63].
Таким образом, сейчас ЧССМ является удобным инструментом для изучения функций спинного мозга в регуляции дыхания, в перспективе ЧССМ может стать доступным и эффективным методом восстановления дыхания у пациентов с парезом дыхательной мускулатуры.
ЗАКЛЮЧЕНИЕ
Среди всех методов электростимуляции, рассмотренных в обзоре, больше всего данных о стимуляции диафрагмального нерва, которую применяют в клинике для восстановления дыхания у пациентов с высокой тетраплегией, вызывающей паралич дыхания. Это метод с хорошо предсказуемым результатом, так как физиологический механизм эффекта известен. К тому же – это малоинвазивный метод. Одним из основных ограничений применения электростимуляции диафрагмального нерва является то, что он подходит только пациентам с ТСМ выше сегмента С4. Также серьезными недостатками этого метода является то, что он приводит к активации вдоха и не влияет на выдох, а также может вызывать утомление мышц, так как синхронно активирует все аксоны в электрическом поле. Электростимуляция дыхательных мышц применяется при нарушениях активности дыхательной системы разной этиологии, эти методы электростимуляции неинвазивны, однако они не стандартизированы, и поэтому их применяют редко. Очевидно, что изучение физиологии дыхательных мышц, связи активности диафрагмы, абдоминальных, межреберных дыхательных мышц с фазами дыхательного цикла являются перспективными направлениями исследований, так как эти знания позволят уточнить существующие клинические протоколы электростимуляции мышц для регуляции функцией внешнего дыхания.
ССМ имеет потенциальное преимущество перед стимуляцией мышц и диафрагмального нерва, основанное на том, что в спинном мозге находятся нейрональные структуры, контролирующие весь дыхательный цикл. Следовательно, стимулируя разные зоны спинного мозга, можно контролировать разные фазы дыхательного цикла и использовать этот метод при большом разнообразии причин, вызывающих нарушение дыхания. Исследования, проводимые на животных с использованием эпидуральной ССМ, демонстрируют это. В клинике эпидуральная ССМ применяется исключительно редко – опубликованы единичные клинические случаи с использованием этого метода. Очевидно, что серьезные риски осложнений, связанные с имплантацией системы для ССМ, тормозят применение эпидуральной стимуляции в клинике. Также очевидно, что современный уровень знаний о роли структур спинного мозга в регуляции дыхательного цикла еще недостаточен, чтобы пренебречь рисками ради предсказуемого результата, как это происходит в случае применения ССМ для купирования боли.
В последние несколько лет показана принципиальная возможность использования метода ЧССМ для регуляции дыхания. Этот неинвазивный метод имеет хорошие перспективы клинического использования для восстановления дыхательной функции у пациентов с нарушениями внешнего дыхания при разных патологиях, а также является удобным инструментом для исследований роли спинальных центров в управлении внешним дыханием у человека. Кроме того, технические особенности метода ЧССМ позволяют одновременно воздействовать на разные зоны спинного мозга. Таким образом, можно думать о дыхательном спинальном нейропротезе, который будет управлять функцией внешнего дыхания, модулируя активность дыхательных центров, усиливая сокращение инспираторных и экспираторных мышц в соответствующие их активности фазы дыхательного цикла. Мы связываем большие надежды с использованием метода ЧССМ для получения новых знаний о механизмах регуляции функции внешнего дыхания у человека.
Список литературы
Safonov VA, Tarasova NN (2010) Electrical Stimulation of Breathing. Human Physiol 36: 483–494.
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, Clarke M, Devereaux PJ, Kleijnen J, Moher D (2009) The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration J Clin Epidemiol 62(10): ppe1–e34. https://doi.org/10.1136/bmj.b2700
McCaughey EJ, Berry HR, McLean AN, Allan DB, Gollee H (2015) Abdominal functional electrical stimulation to assist ventilator weaning in acute tetraplegia: A cohort study. PLoS One10 (6): e0128589. https://doi.org/10.1371/journal.pone.0128589
Lim J, Gorman RB, Saboisky JP, Gandevia SC, Butler JE (2007) Optimal electrode placement for noninvasive electrical stimulation of human abdominal muscles. J Appl Physiol 102(4): 1612–1617. https://doi.org/10.1152/japplphysiol.00865.2006
Butler JE, Lim J, Gorman RB, Boswell-Ruys C, Saboisky JP, Lee BB, Gandevia SC (2011) Posterolateral surface electrical stimulation of abdominal expiratory muscles to enhance cough in spinal cord injury. Neurorehabil Neural Repair 25 158–167. https://doi.org/10.1177/1545968310378509
McCaughey EJ, Butler JE, McBain RA, Boswell-Ruys CL, Hudson AL, Gandevia SC, Lee BB (2019) Abdominal functional electrical stimulation to augment respiratory function in spinal cord injury. Top Spinal Cord Inj Rehabil 25(2): 105–111. https://doi.org/10.1310/sci2502-105
Duarte GL, Bethiol AL, Ratti LD, Franco G, Moreno R, Tonella RM, Falcão AL (2021) Transcutaneous electrical diaphragmatic stimulation reduces the duration of invasive mechanical ventilation in patients with cervical spinal cord injury: retrospective case series. Spinal Cord Series Cases 7(1): 1–6. https://doi.org/10.1038/s41394-021-00396-4
Hsin YF, Chen SH, Yu TJ, Huang CC, Chen YH (2022) Effects of transcutaneous electrical diaphragmatic stimulation on respiratory function in patients with prolonged mechanical ventilation. Ann Thorac Med 17(1): 14–20. https://doi.org/10.4103/atm.atm_158_21
Postma K, Haisma JA, Hopman MT, Bergen MP, Stam HJ, Bussmann JB (2014) Resistive inspiratory muscle training in people with spinal cord injury during inpatient rehabilitation: a randomized controlled trial. Phys Therapy 94: 1709–1719. https://doi.org/10.2522/ptj.20140079
Gattinoni L, Marini JJ, Collino F, Maiolo G, Rapetti F, Tonetti T, Vasques F, Quintel M (2017) The future of mechanical ventilation: lessons from the present and the past. Crit Care 21(1): 183. https://doi.org/10.1186/s13054-017-1750-x
Levy M, Mizrahi J, Susak Z (1990) Recruitment, force and fatigue characteristics of 768 quadriceps muscles of paraplegics isometrically activated by surface functional 769 electrical stimulation. J Engin 12: 150–156. https://doi.org/10.1016/0141-5425(90)90136-B
DiMarco AF (2001) Neural prostheses in the respiratory system. J Rehabil Res Develop 38: 601–607.
Glenn WW, Brouillette RT, Dentz B, Fodstad H, Hunt CE, Keens TG, Marsh HM, Pande S, Piepgras DG, Vanderlinden RG (1988) Fundamental considerations in pacing of the diaphragm for chronic ventilatory insufficiency. A multi-center study. Pacing Clin Electrophysiol 11: 2121–2127. https://doi.org/10.1111/j.1540-8159.1988.tb06360.x
Onders RP, Elmo M, Khansarinia S, Bowman B, Yee J, Road J, Bass B, Dunkin B, Ingvarsson PE, Oddsdóttir M (2009) Complete Worldwide Operative Experience in Laparoscopic Diaphragm Pacing: Results and Differences in Spinal Cord Injured Patients and Amyotrophic Lateral Sclerosis Patients. Surg Endoscopy 23: 1433–1440. https://doi.org/10.1007/s00464-008-0223-3
DiMarco AF (2009) Phrenic nerve stimulation in patients with spinal cord injury. Respirat Physiol Neurobiol 169(2): 200–209. https://doi.org/10.1016/j.resp.2009.09.008
Romero-Ganuza FJ, Gambarrutta-Malfatti C, Diez de la Lastra-Buigues E, Marín-Ruiz MÁ, Merlo-González VE, Sánchez-Aranzueque Pantoja AM, García-Moreno FJ, Mazaira-Álvarez J (2011) Diaphragmatic pacemaker as an alternative to mechanical ventilation in patients with cervical spinal injury. Med Intensiva (Engl Edition) 35: 13–21. https://doi.org/10.1016/j.medin.2010.10.003
Locke KC, Randelman ML, Hoh DJ, Zholudeva LV, Lane MA (2022) Respiratory plasticity following spinal cord injury. Neural Regen Res 17: 2141–2148. https://doi.org/10.4103/1673-5374.335839
Onders RP, Elmo M, Kaplan C, Schilz R, Katirji B, Tinkoff G (2018) Long-term experience with diaphragm pacing for traumatic spinal cord injury: early implantation should be considered. Surgery 164(4): 705–711. https://doi.org/10.1016/j.surg.2018.06.050
Son BC, Kim DR, Kim IS, Hong JT (2013) Phrenic nerve stimulation for diaphragm pacing in a quadriplegic patient. J Korean Neurosurg Soc 54(4): 359–362. https://doi.org/10.3340/jkns.2013.54.4.359
Vázquez RG, Sedes PR, Fariña MM, Marqués AM, Velasco MEF (2013) Respiratory Management in the Patient with Spinal Cord Injury. Biomed Res Int 2013:168757. https://doi.org/10.1155/2013/168757
Verrills P, Sinclair C, Barnard A (2016) A review of spinal cord stimulation systems for chronic pain. J Pain Res 9: 481. https://doi.org/10.2147/JPR.S108884
Pérez JT (2021) Spinal cord stimulation: beyond pain management. Neurología (Engl Edition). https://doi.org/10.1016/j.nrleng.2019.05.007
Stauss T, El Majdoub F, Sayed D, Surges G, Rosenberg WS, Kapural L, Bundschu R, Lalkhen A, Patel N, Gliner B, Subbaroyan J (2019) A multicenter real-world review of 10 kH z SCS outcomes for treatment of chronic trunk and/or limb pain. Ann Clin Translat Neurol 6: 496–507. https://doi.org/10.1002/acn3.720
Baranidharan G, Bretherton B, Montgomery C, Titterington J, Crowther T, Vannabouathong C, Inzana JA, Rotte A (2021) Pain Relief and Safety Outcomes with Cervical 10 kHz Spinal Cord Stimulation: Systematic Literature Review and Meta-analysis. Pain and Therapy 10: 849–874. https://doi.org/10.1007/s40122-021-00269-6
Kumar K, Taylor RS, Jacques L, Eldabe S, Meglio M, Molet J, Thomson S, O’Callaghan J, Eisenberg E, Milbouw G, Buchser E (2007) Spinal cord stimulation versus conventional medical management for neuropathic pain: a multicentre randomised controlled trial in patients with failed back surgery syndrome. Pain 132: 179–188. https://doi.org/10.1016/j.pain.2007.07.028
Medtronic Indications, Safety & Warnings for Spinal Cord Stimulation Medtronic (2018) Accessed April 4th, 2022.
Angeli CA, Edgerton VR, Gerasimenko YP, Harkema SJ (2014) Altering spinal cord excitability enables voluntary movements after chronic complete paralysis in humans. Brain 137:1394–1409. https://doi.org/10.1093/brain/awu038
Harkema S, Gerasimenko Y, Hodes J, Burdick J, Angeli C, Chen Y, Ferreira C, Willhite A, Rejc E, Grossman RG, Edgerton VR (2011) Effect of epidural stimulation of the lumbosacral spinal cord on voluntary movement, standing, and assisted stepping after motor complete paraplegia: a case study. Lancet 377: 1938–1947. https://doi.org/10.1016/S0140-6736(11)60547-3
Hachmann JT, Yousak A, Wallner JJ, Gad PN, Edgerton VR, Gorgey AS (2021) Epidural spinal cord stimulation as an intervention for motor recovery after motor complete spinal cord injury. J Neurophysiol 126(6): 1843–1859. https://doi.org/10.1152/jn.00020.2021
Gerasimenko YP, Lu DC, Modaber M, Zdunowski S, Gad P, Sayenko DG, Morikawa E, Haakana P, Ferguson AR, Roy RR, Edgerton VR (2015) Noninvasive reactivation of motor descending control after paralysis. J Neurotrauma 32: 1968–1980. https://doi.org/10.1089/neu.2015.4008
Gerasimenko Y, Gorodnichev R, Puhov A, Moshonkina T, Savochin A, Selionov V, Roy RR, Lu DC, Edgerton VR (2015) Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans. J Neurophysiol 113: 834–842. https://doi.org/10.1152/jn.00609.2014
Gorodnichev RM, Pivovarova EA, Pukhov A, Moiseev SA, Savokhin AA, Moshonkina TR, Shcherbakova NA, Kilimnik VA, Selionov VA, Kozlovskaia IB, Edgerton VR, Gerasimenko YP (2012) Transcutaneous electrical stimulation of the spinal cord: non-invasive tool for activation of locomotor circuitry in human. Human Physiol 38: 46–56.
Megia Garcia A, Serrano-Muñoz D, Taylor J, Avendaño-Coy J, Gómez-Soriano J (2020) Transcutaneous spinal cord stimulation and motor rehabilitation in spinal cord injury: a systematic review. Neurorehabil Neural Repair 34(1): 3–12. https://doi.org/10.1177/1545968319893298
Gerasimenko Y, Gorodnichev R, Puhov A, Moshonkina T, Savochin A, Selionov V, Roy RR, Lu DC, Edgerton VR (2015) Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans. J Neurophysiol 113(3): 834–842. https://doi.org/ 35. https://doi.org/10.1152/jn.00609.2014
Grishin AA, Bobrova EV, Reshetnikova VV, Moshonkina TR, Gerasimenko YP (2021) A system for detecting stepping cycle phases and spinal cord stimulation as a tool for controlling human locomotion. Biomed Engineer 54(5): 312–316.https://doi.org/10.1007/s10527-021-10029-7
Sunshine MD, Sutor TW, Fox EJ, Fuller DD (2020) Targeted activation of spinal respiratory neural circuits. Exp Neurol 328: 113256. https://doi.org/10.1016/j.expneurol.2020.113256
Lane MA, White TE, Coutts MA, Jones AL, Sandhu MS, Bloom DC, Bolser DC, Yates BJ, Fuller DD, Reier PJ (2008) Cervical prephrenic interneurons in the normal and lesioned spinal cord of the adult rat. J Compar Neurol 511(5): 692–709. https://doi.org/10.1002/cne.21864
Duffin J, Hoskin RW (1987) Intracellular recordings from upper cervical inspiratory neurons in the cat. Brain Res 435: 351–354. https://doi.org/10.1016/0006-8993(87)91623-4
Lipski J, Duffin J (1986) An electrophysiological investigation of propriospinal inspiratory neurons in the upper cervical cord of the cat. Exp Brain Res 61: 625–637. https://doi.org/10.1007/BF00237589
Bellingham MC, Lipski J (1990) Respiratory interneurons in the C5 segment of the spinal cord of the cat. Brain Res 533(1): 141–146. https://doi.org/10.1016/0006-8993(90)91807-S
Duffin J, Iscoe S (1996) The possible role of C5 segment inspiratory interneurons investigated by cross-correlation with phrenic motoneurons in decerebrate cats. Exp Brain Res 112(1): 35–40. https://doi.org/10.1007/BF00227175
Palisses R, Persegol L, Viala D (1989) Evidence for respiratory interneurones in the C3–C5 cervical spinal cord in the decorticate rabbit. Exp Brain Res 78(3): 624–632. https://doi.org/10.1007/BF00230250
DiMarco AF, Kowalski KE (2013) Spinal pathways mediating phrenic activation during high frequency spinal cord stimulation. Resp Physiol Neurobiol 186: 1–6. https://doi.org/10.1016/j.resp.2012.12.003
Kowalski KE, Romaniuk JR, Kirkwood PA, DiMarco AF (2019) Inspiratory muscle activation via ventral lower thoracic high-frequency spinal cord stimulation. J Appl Physiol (1985) 126: 977–983. https://doi.org/10.1152/japplphysiol.01054.2018
DiMarco AF, Kowalski KE (2013) Activation of inspiratory muscles via spinal cord stimulation. Respir Physiol Neurobiol 189: 438–449. https://doi.org/10.1016/j.resp.2013.06.001
DiMarco AF, Romaniuk JR, Kowalski KE, Supinski G (1999) Pattern of expiratory muscle activation during lower thoracic spinal cord stimulation. J Appl Physiol 86: 1881–1889. https://doi.org/10.1152/jappl.1999.86.6.1881
DiMarco AF, Kowalski KE (2008) Effects of chronic electrical stimulation on paralyzed expiratory muscles. J Appl Physiol 104(6): 1634–1640. https://doi.org/10.1152/japplphysiol.01321.2007
Kowalski KE, Romaniuk JR, Kowalski T, DiMarco AF (2017) Effects of expiratory muscle activation via high-frequency spinal cord stimulation. J Appl Physiol 123(6): 1525–1531. https://doi.org/10.1152/japplphysiol.00402.2017
Kastner A, Gauthier P (2008) Are rodents an appropriate pre-clinical model for treating spinal cord injury? Examples from the respiratory system. Exp Neurol 213(2): 249–256. https://doi.org/10.1016/j.expneurol.2008.07.008
Mercier LM, Gonzalez-Rothi EJ, Streeter KA, Posgai SS, Poirier AS, Fuller DD, Reier PJ, Baekey DM (2017) Intraspinal microstimulation and diaphragm activation after cervical spinal cord injury. J Neurophysiol 117: 767. https://doi.org/10.1152/jn.00721.2016
Gonzalez-Rothi EJ, Streeter KA, Hanna MH, Stamas AC, Reier PJ, Baekey DM, Fuller DD (2017) High-frequency epidural stimulation across the respiratory cycle evokes phrenic short-term potentiation after incomplete cervical spinal cord injury. J Neurophysiol 118(4): 2344–2357. https://doi.org/10.1152/jn.00913.2016
DiMarco AF, Kowalski KE, Geertman RT, Hromyak DR (2006) Spinal cord stimulation: a new method to produce an effective cough in patients with spinal cord injury. Am J Respir Crit Care Med 173: 1386–1389. https://doi.org/10.1164/rccm.200601-097CR
DiMarco AF, Kowalski KE, Hromyak DR, Geertman RT (2014) Long-term follow-up of spinal cord stimulation to restore cough in subjects with spinal cord injury. J Spinal Cord Med 37: 380–388. https://doi.org/10.1179/2045772313Y.0000000152
Ерохин АН, Кобызев АЕ, Сергеенко ОМ, Туровинина ЕФ (2020) Стимуляция диафрагмального нерва посредством модифицированного имплантируемого устройства в комплексе реабилитационных мероприятий после повреждения шейного отдела спинного мозга (случай из практики). Гений ортопедии 26: 89–94. [Erokhin AN, Kobizev AE, Sergeenko OM, Turovinina EF (2020) Phrenic nerve stimulation in complex rehabilitation for cervical spinal cord injury using modified implantable device (case report). Geniy Ortopedii 26(1): 89–94. (In Russ)]. https://doi.org/1018019/1028-4427-2020-26-1-89-94
Duffin J, Li YM (2006) Transmission of respiratory rhythm: midline-crossing connections at the level of the phrenic motor nucleus? Resp Physiol Neurobiol 153(2): 139–147. https://doi.org/10.1016/j.resp.2005.09.011
Tian GF, Duffin J (1996) Spinal connections of ventral-group bulbospinal inspiratory neurons studied with cross-correlation in the decerebrate rat. Exp Brain Res 111(2): 178–186. https://doi.org/10.1007/BF00227296
Minyaeva AV, Moiseev SA, Pukhov AM, Savokhin AA, Gerasimenko YP, Moshonkina TR (2017) Response of external inspiration to the movements induced by transcutaneous spinal cord stimulation. Human Physiol 43(5): 524–531. https://doi.org/10.1134/S0362119717050115
Moshonkina TR, Scherbakova NA, Moiseev SA, Minyaeva AV, Gerasimenko YP (2020) Regulation of respiration during electrical stimulation of the lumbar spinal cord in humans. Integrat Physiol 1: 108–115. https://doi.org/10.1016/j.mayocp.2017.04.011
Gad P, Kreydin E, Zhong H, Edgerton VR (2020) Spinal Networks and Spinal Cord Injury: A Tribute to Reggie Edgerton: Enabling respiratory control after severe chronic tetraplegia: an exploratory case study. J Neurophysiol 124(3): 774. https://doi.org/10.1152/jn.00320.2020
Del Negro CA, Funk GD, Feldman JL (2018) Breathing matters. Nat Rev Neurosci 19(6): 351–367. https://doi.org/10.1038/s41583-018-0003-6
Miller J, Eldabe S, Buchser E, Johanek LM, Guan Y, Linderoth B (2016) Parameters of spinal cord stimulation and their role in electrical charge delivery: a review. Neuromodulation: Technology at the Neural Interface 19(4): 373–384. https://doi.org/10.1111/ner.12438
Joosten EA, Franken G (2020) Spinal cord stimulation in chronic neuropathic pain: mechanisms of action, new locations, new paradigms. Pain 161(1): S104. https://doi.org/10.1097/j.pain.0000000000001854
Shandybina ND, Kuropatenko MV, Moshonkina TR (2022) Relevance of the transcutaneous spinal cord stimulation for regulation of the external respiration. Motor Control 122.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова