Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 12, стр. 1655-1667
Морфологические особенности иннервации эпикардиальной жировой ткани крысы в раннем постнатальном онтогенезе
Е. И. Чумасов 1, 2, *, Е. С. Петрова 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет ветеринарной медицины
Санкт-Петербург, Россия
* E-mail: iemmorphol@yandex.ru
Поступила в редакцию 08.10.2022
После доработки 04.11.2022
Принята к публикации 05.11.2022
- EDN: UNPFGU
- DOI: 10.31857/S0869813922120032
Аннотация
Цель исследования – изучение строения и иннервации эпикардиальной жировой ткани (ЭЖТ) аортально-пульмональной области сердца крысы на ранних стадиях развития и половозрелого возраста (1, 14 сут, 3–4 мес.). В работе использовали гистологические методы (окраска гематоксилином-эозином и толуидиновым синим), а также иммуногистохимические методы для выявления нервных структур (белка PGP 9.5, тирозингидроксилазы, синаптофизина). Изучен гистогенез и дифференцировка адипоцитов ЭЖТ. Установлено, что презумптивные закладки “жировых подушек” из бурой и белой жировой ткани сердца образуются из “эпителиальных телец”, расположенных в основании магистральных сосудов аортально-пульмональной области новорожденной крысы. По мнению авторов, именно эпителиоморфная ткань является камбиальной, служит источником для стволовых клеток жировой ткани. Белая жировая ткань, представленная кольцевидными адипоцитами, является ее производной, ответственной за синтез и накопление триглицеридов, составляющей основную часть жирового депо органа. Показано, что гистогенез обоих типов жировой ткани с первого дня рождения сопровождается васкулогенезом. Одновременно в жировой ткани формируются терминальные сплетения из катехоламинергических и холинергических варикозных аксонов, представляющие собой дистантные синаптические аппараты en passant. Установлена следующая закономерность: на ранних стадиях (Р1–Р14), в период дифференцировки жировых клеток, в ЭЖТ преобладают катехоламинергические постганглионарные симпатические терминальные аксоны. И наоборот, у половозрелых (3–4 мес.) животных отмечено выраженное снижение катехоламинергических и преобладание холинергических нервных волокон.
Актуальность исследования жировой ткани объясняется недостатком знаний об этиологии и патогенезе ожирения, одной из современных проблем нарушения метаболизма. Несмотря на то, что морфофункциональные особенности жировой ткани изучаются в течение многих лет, и результаты этих исследований обобщены в руководствах, монографиях и обзорных статьях [1–3], до сих пор неизвестны причины возникновения ожирения, механизмы развития жировой ткани, неясна роль нервной системы в процессе развития ожирения. Особый интерес жировая ткань представляет для современной регенеративной медицины, являясь одним из источников получения мезенхимных стволовых клеток. В связи с этим в настоящее время жировая ткань широко исследуется [4, 5].
В последние годы появляются работы, касающиеся нейротрофики жировой ткани, нейрогуморальной регуляции липидного обмена, органоспецифического значения жировой ткани, классификации и морфофункциональных особенностей адипоцитов, их развития и дифференцировки в фило- и онтогенезе. На основании топографических, морфологических и функциональных различий и организации тканевого и клеточного состава жировую ткань подразделяют на два подвида – белую и бурую (white adipose tissue and brown adipose tissue), а некоторые авторы выделяют промежуточную группу – “бежевых” адипоцитов (beige adipose tissue) [6–9].
Существует мнение, что человек рождается на свет с определенным количеством адипоцитов и клеток, способных при необходимости превратиться в них из преадипоцитов [3, 7]. С такими патологиями как ожирение, метаболический синдром, атеросклероз и сахарный диабет 2-го типа тесно связано развитие сердечно-сосудистых заболеваний. К факторам риска перечисленных заболеваний кроме ожирения можно отнести изменения в депо жировой ткани, локализованной в основании сердца, известной как эпикардиальная жировая ткань (ЭЖТ) [3, 10–12]. В околосердечной области определяют послойность расположения жировой ткани: снаружи находится перикардиальный слой, который может составлять до 40%, под ним – эпикардиальный слой, который по сути врастает в миокард без каких-либо четких границ [3]. В последнее время число экспериментальных и клинических наблюдений, доказывающих физиологическую и метаболическую значимость эпикардиальной жировой ткани, растет. ЭЖТ отличается от других жировых депо организма. Установлена экспрессия клетками жировой ткани различных цитокинов: нейротрофического фактора головного мозга (BDNF), интерлейкинов (IL-1, IL-6, IL-17), моноцитарного хемоаттрактант-белка (MCP-1), оментина, фактора некроза опухоли альфа (TNFα) [13]. Несмотря на активно разрабатываемые концептульно-теоретические и клинические аспекты проблемы, касающейся жировой ткани, наименее изученными остаются вопросы о строении, функциях, особенностях иннервации белой и бурой жировой тканей разных отделов организма. Большой интерес представляют вопросы нервной, иммунной и гормональной регуляции жировой ткани. Исследования жировых подушек подкожной жировой ткани и многих висцеральных органов (межлопаточной, периренальной, паховой и овариальной областей) продемонстрировали присутствие в них иммунореактивных нервных волокон к субстанции P, нейропептиду-Y (NPY), кальцитонин-ген-связанному пептиду (CGRP), тирозингидроксилазе, расположенных вокруг питающих артерий и в сопровождающих их нервных пучках [14, 15]. Следует отметить, что по сравнению с другими типами тканей вопросы эволюции и онтогенеза ЭЖТ животных и человека мало изучены. Требует углубленных исследований нервная регуляция липидного обмена на разных этапах онтогенеза, а также участие иннервации в гистогенетических процессах развивающихся в жировой ткани.
Цель настоящего исследования – изучение строения и иннервации ЭЖТ аортально-пульмональной области сердца крысы на разных этапах постнатального развития с применением нейроиммунохистохимических маркеров.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служили фрагменты жировой ткани околосердечной области крыс Вистар разного возраста: 1, 14 сут, 3–4 мес. (n = 20). При работе с животными соблюдали международные правила Европейского сообщества по гуманному обращению с экспериментальными животными. Исследование было одобрено Локальным этическим комитетом Института экспериментальной медицины (протокол № 2/22 от 06.04.2022). Материал фиксировали в растворе цинк-этанол-формальдегида в течение одних суток [16] и после обезвоживания в спиртах возрастающей концентрации и ксилоле заливали в парафин. Парафиновые срезы толщиной 5 мкм изготавливали на ротационном микротоме Pfm Rotary 3003 (PFM, Германия). На срезах проводили иммуногистохимические реакции для выявления трех нейральных маркеров. Ферментный маркер – белок тирозингидроксилазу (ТН) – использовали для идентификации катехоламинергических структур симпатической нервной системы. Белок PGP 9.5 применяли для выявления всех нервных аппаратов без учета их медиаторной принадлежности [17]. Для исследования тонких терминальных окончаний применяли синаптофизин (Syn) [18]. Для выявления белка PGP 9.5 использовали поликлональные кроличьи антитела в разведении 1 : 200 (Spring Bioscience, США); для выявления Syn применяли поликлональные кроличьи антитела в разведении производителя (MONOSAN, Нидерланды); для TH – поликлональные кроличьи антитела в разведении 1 : 1000 (Abcam, Великобритания). Первичные антитела в нужном разведении наносили на гистологические срезы после депарафинирования на 1 сут. В качестве вторичных реагентов использовали реактивы из набора Reveal Polyvalent HRP/DAB Detection System kit (SpringBioscience, США). Негативный контроль для иммуногистохимических реакций проводили путем нанесения на срезы вместо первичных антител их разбавителя (Dako, Дания). Часть срезов окрашивали толуидиновым синим и гематоксилином-эозином. Анализ гистологических препаратов осуществляли с помощью микроскопа Leica DM 750 (Leica, Германия) и цифровой камеры Leica ICC 50 (Leica, Германия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гистологический анализ сердца новорожденных крыс (Р1) показал, что ЭЖТ еще не сформирована и отсутствует. В области расположения корней магистральных артериальных и венозных сосудов сердца и бронхов располагаются округлой формы “эпителиальные тельца” размерами 150–200 мкм в диаметре. Они тесно прилежат к стенкам перечисленных магистральных кровеносных сосудов и воздухоносных путей и по строению сходны с железистой тканью (рис. 1а). Тельце состоит из глобул, в состав которых входят 4–8 клеток округлой, овальной или полигональной формы. Клетки имеют центрально расположенное гиперхромное ядро с одним–двумя ядрышками и большой объем цитоплазмы, заполненной микровезикулярными органеллами, которые наиболее четко выявляются на препаратах, окрашенных толуидиновым синим (рис. 1b). Анализ материала показал, что именно из клеток этих телец в постнатальном онтогенезе развиваются презумптивные элементы: преадипоциты и зрелые адипоциты белой и бурой жировых тканей. Вокруг телец и внутри, между глобулами, видны тонкие прослойки слабо развитой интерстициальной ткани. Сосуды в тельцах, как правило, не выявляются.
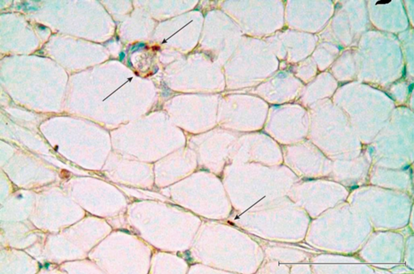
Рис. 1.
Эпителиальные тельца новорожденной крысы в аортально-пульмональной области сердца. a – общий вид, b – строение тельца; c – нервное сплетение в тельце. 1 – эпителиальное тельце; 2 – артерия; 3 – вена; 4 – трахея. Иммуногистохимическая реакция на белок PGP 9.5 (a, b) и тирозингидроксилазу (c), докраска толуидиновым синим (a, b). Масштабный отрезок равен 200 мкм (а), 50 мкм (b, c).

Вблизи телец видны ганглии, нервные стволики, а внутри – сплетения из пучков немиелинизированных нервных волокон (рис. 1a, b).
Иммуногистохимическое исследование с применением антител к белку PGP 9.5 показало, что на серийных срезах ЭЖТ крыс ранних сроков постнатального развития (Р1–Р14) вокруг и внутри эпителиальных телец, соседних органов (сосудов, бронхов, пучков миокардиоцитов) постоянно встречаются PGP 9.5+ и ТН+ фрагменты нервных стволиков, пучков и сплетений, а также PGP 9.5+ микроганглии и группы хромаффинных клеток. Особенно бросается в глаза обилие катехоламинергических структур в паренхиме самих телец. Так, ТН+ пучки симпатических нервных волокон и их тончайшие терминали варикозных аксонов прослеживаются между глобулами и их клетками (рис. 1c). В некоторых тельцах выявляются клетки с признаками преадипоцитов и адипоцитов. Трансформация клеток телец в адипоциты сопровождается изменением их формы, размеров, увеличением их числа, повышенной активностью, сопровождающейся формированием в цитоплазме везикулярных структур и различных размеров липидных вакуолей. В процессе дифференцировки из эпителиальных предшественников образуются две популяции жировых клеток: белые и бурые адипоциты, формируется белая и бурая жировая ткань.
Использование гистологических и иммуногистохимических методов исследования показало, что на 10–14-е сутки постнатального развития в формирующейся жировой ткани выявляются уже артериальные кровеносные сосуды: крупные, средние и мелкие артерии, артериолы и капилляры. Они окружены непрерывной плотной сетью терминальных тяжей варикозных аксонов, представляющих собой систему дистантных синапсов типа en passant. Сравнительный иммуногистохимический анализ показал, что в тончайших тяжах этого сплетения проходят как PGP 9.5+, так и ТН+ аксоны. В этот срок хорошо прослеживаются взаимоотношения нервных структур (ганглиев, пучков нервных волокон и терминальных сплетений) с питающими сосудами и клетками ЭЖТ. Иногда встречаются отдельные ганглиозные клеточные тяжи, следующие на значительном протяжении среди долек дифференцирующейся жировой ткани. При этом видно, как во многих участках нейроциты ганглия вплотную прилежат к разным типам жировых клеток – к бурым и белым адипоцитам (рис. 2а). По мере созревания ЭЖТ увеличивается число артериальных и венозных сосудов, возрастает плотность иннервации ткани (рис. 2b).
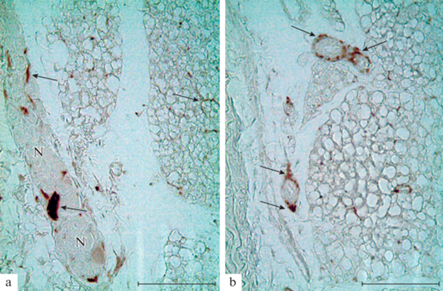
Рис. 2.
Тирозингидроксилаза-иммунопозитивные нервные структуры в парасимпатическом ганглии (а) и терминальные варикозные аксоны вокруг сосудов (b) в жировой ткани смешанного типа у крыс в возрасте 14 сут. N – нервные клетки в ганглии; фрагменты нервных пучков (стрелки). Иммуногистохимическая реакция на тирозингидроксилазу. Масштабный отрезок равен 50 мкм.
Морфологический анализ области основания сердца крысы в 3–4-месячном возрасте показал, что наиболее выраженная масса жировой ткани в сердце крысы сосредоточена в эпиперикардиальной области органа в виде трех “подушек”, локализующихся между магистральными сосудами: одна – между краниальной полой веной и аортой, вторая – между аортальным и легочным стволами, третья – на дорсальной стенке, в области впадения легочных вен в правое предсердие. У половозрелых крыс подушки ЭЖТ состоят из долек различного размера, в которых различается два вида тканей, состоящих из белых и бурых адипоцитов (рис. 3а, 4а). Адипоциты белой жировой ткани имеют крупные размеры, достигают в диаметре 50–75 мкм, практически весь объем этих клеток занимает липидная вакуоль, ядро смещено на периферию и имеет уплощенную форму. Белая жировая ткань в дольках, как правило, у взрослых крыс преобладает. В большинстве долек среди белой ткани постоянно встречаются скопления бурых адипоцитов. Бурые адипоциты – клетки округлой или кубической формы. Они легко отличаются по строению от белых адипоцитов и очень сходны по морфологии с клетками эпителиальных тел, мельче (15–20 мкм) адипоцитов белой жировой ткани, имеют сферической формы, центрально расположенное гиперхромное ядро с одним-двумя ядрышкамии и темноватую цитоплазму, в которой видны многочисленные микровезикулярные структуры. Среди них можно выделить клетки, находящиеся на различных стадиях дифференцировки: малодифференцированные преадипоциты, дифференцирующиеся и зрелые (белые и бурые) адипоциты. Между белыми и бурыми элементами встречаются также клетки переходной формы. Для них характерно наличие в цитоплазме кроме микровезикулярных структур также средних и относительно крупных размеров липидных вакуолей. ЭЖТ крыс в возрасте 3–4-х мес. богато васкуляризирована. В ее дольках видны артерии различного диаметра, артериолы и капилляры.
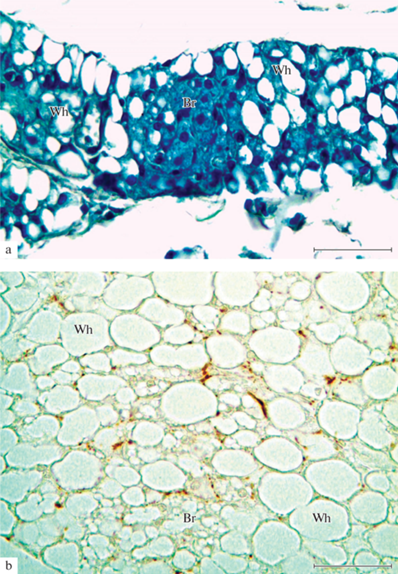
Рис. 3.
Фрагменты жировой ткани околосердечной области крысы в возрасте 3–4-х месяцев. а – белая и бурая жировая ткань; b – плотная терминальная сеть варикозных аксонов в смешанной жировой ткани. Br – бурая жировая ткань; Wh – белая жировая ткань. Окраска толуидиновым синим (а); иммуногистохимическая реакция на белок PGP 9.6 (b). Масштабный отрезок равен 50 мкм.
Применение иммуногистохимических маркеров показало, что ЭЖТ взрослых крыс хорошо иннервирована. В ее дольках можно видеть парасимпатические ганглии, группы хромаффинных клеток, синтезирующих катехоламины, нервные пучки и нервные сплетения из симпатических и парасимпатических безмиелиновых нервных волокон.
Входящие в дольки ЭЖТ артерии окружены PGP 9.5+ периваскулярной сетью из терминальных варикозных аксонов. Последние, по нашему мнению, представляют собой основную сеть дистантных синапсов типа en passant. Варикозные аксоны этой сети наблюдаются не только вокруг гладкомышечных клеток артериальных сосудов, но часто вокруг адипоцитов бурой и смешанной ЭЖТ (рис. 3b, 4).
Рис. 4.
Периваскулярные терминальные нервные сплетения и межклеточные окончания варикозных аксонов в смешанной ЭЖТ. А –артериола; V – венула; Wh – белая жировая ткань; * – бурые адипоциты. Иммуногистохимическая реакция на PGP 9.5. Масштабный отрезок равен 50 мкм.

Установлено, что в бурой и белой жировой ткани находятся терминальные нервные сплетения из проводников разной медиаторной природы: TH+ симпатических и PGP 9.5+ парасимпатических нервных волокон. Наиболее выраженная иннервация выявлена в бурой и смешанной ЭЖТ, в то время как в белой жировой ткани иннервация выражена очень слабо (рис. 5). На поперечных срезах среди массы белых адипоцитов можно встретить лишь единичные пучки и тяжи нервных волокон, располагающихся в адвентиции артерий и артериол. С помощью реакции на синаптофизин удалось выявить тончайшие Syn+ синаптические нервные окончания в составе периваскулярной сети, связанной с гладкомышечными клетками артериальной стенки сосудов, а также в виде свободно располагающихся между клетками белой и бурой ткани.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последние два десятилетия большое внимание исследователей уделяется вопросам происхождения, морфологии и иннервации белой и бурой жировой ткани. Выяснению этих вопросам посвящен ряд обзорных статей [3, 5, 8] и монография Афанасьева и Колодезниковой [1]. С помощью иммуногистохимической реакции установлено, что при экспериментальном снижении температуры окружающей среды в бурой жировой ткани увеличивается плотность иммунореактивных нервных сплетений ТН+, CGRP+, VIР+ нервных волокон [6], что более иннервированной является бурая жировая ткань [19]. Эти факты связывают с тем, что преадипоциты и адипоциты бурого жира ЭЖТ выполняют гормональную функцию – вырабатывают адипокины, влияющие на функционирование сердца [3]. Следует отметить, что сердце в свою очередь через паракринную сигнализацию секреторных миокардиоцитов правого предсердия оказывает влияние на ЭЖТ [3].
В нашем исследовании показано, что ЭЖТ хорошо васкуляризирована и иннервирована. У новорожденных, 14-суточных и взрослых половозрелых крыс с помощью применения нейроиммуногистохимических маркеров (белок PGP 9.5, TH и Syn) в исследованных жировых подушках основания сердца были выявлены парасимпатические микроганглии, одиночные нейроны, нервные стволики, пучки и терминали. Нервные аппараты различной медиаторной принадлежности выявлялись в презумптивной ЭЖТ крыс, начиная с первых суток постнатального развития, когда она была представлена еще эпителиальными тельцами, и далее, постоянно, на разных стадиях цито- и гистодифференцировки бурых и белых адипоцитов, бурой и белой жировых тканей.
На основании иммуногистохимического исследования показано, что на ранних этапах постнатального онтогенеза (Р1–Р14) в иннервации ЭЖТ существенную роль играют катехоламинергические (ТН-иммунореактивные) нервные волокна, а после периода полового созревания (3–4 мес.) наблюдается выраженное разрежение катехоламинергических нервных сплетений в тканях сердца и преобладание холинергических (PGP 9.5-иммунореактивных) нервных волокон [20]. Полученные данные согласуются также с мнением о двунаправленности взаимодействия нервной и нейроэндокринной регуляции липидного обмена со стороны как периферической, так и центральной нервной системы [21–23]. Согласно концепции авторов [21–23], нервная система и, в частности, ее симпатический отдел обеспечивает регуляцию процессов метаболизма липидов через гипоталамус. Chi с соавт. [15] показали, что взаимосвязь симпатической нервной системы с развивающимися жировыми клетками у мышей возникает довольно рано – в период Р6–Р28 постнатального развития. Нам удалось выявить ТН+ и PGP9.5+ нервные волокна и терминальные сплетения, начиная со стадии Р1, до периода половозрелости и, таким образом, подтвердить участие симпатической и парасимпатической нервной системы в регуляции бурых и белых адипоцитов.
Вопрос о развитии адипоцитов белой и бурой жировых тканей в процессе онтогенеза дискуссионен. По данным литературы, белые, бурые, а также переходные формы – “бежевые” адипоциты образуются еще до формирования жирового депо [8]. Основные депо бурых адипоцитов у грызунов находятся в “подушечках” межлопаточной, подмышечной, надпочечной и парааортальной жировой ткани. Некоторые авторы считают, что большинство бурых жировых клеток происходит из клеток-предшественников эмбриональной мезодермы, из тех же, что и субпопуляции белых адипоцитов [8]. Результаты нашего исследования показали, что обе ЭЖТ сердца (бурая и белая) крысы происходят из специализированных эпителиальных телец, являющихся, по нашему мнению, закладками мезодермального зародышевого листка, это согласуется с данными литературы. Интересно отметить, что клетки эпителиальных телец по морфологическим (гистологическим и электронномикроскопическим) признакам, форме, размерам и строению митохондрий сходны с секреторными клетками фетальной коры надпочечников [14, 24]. Полученные нами данные свидетельствуют о том, что в онтогенезе ЭЖТ может вырабатывать регуляторные биологически активные вещества, и т.о. подтверждается точка зрения, что жировые депо в организмах животных и человека кроме функций, связанных с липидным обменом, выполняют также функцию эндокринных органов [2].
В ходе исследования ЭЖТ в жировых депо “подушек” сердца нами выделены следующие клеточно-тканевые структуры, образующиеся из эпителиальных телец: эпителиоморфные преадипоциты и дифференцирующиеся адипоциты бурой ткани (в виде очаговых скоплении), кластеры из бурых и белых адипоцитов – смешанная тканевая структура, и высокодифференцированная белая жировая ткань из кольцевидных адипоцитов. Эмбриональное происхождение и морфология третьей популяции адипоцитов – “бежевых”, описанных в разных жировых депо животных, остается дискуссионным. Отмечают, что “бежевые” и бурые адипоциты могут происходить из различных клеточных линий. Предполагается, что “бежевые” клетки в подкожном депо происходят из белых зрелых адипоцитов путем трансдифференцирования или возникают de novo из клеток-предшественников [8, 25]. Афанасьев и Колодезникова [1] выделяют до семи типов клеток на разных стадиях дифференцировки, начиная от незрелого предшественника – “эпителиоморфной клетки”, и заканчивая терминальным периодом полной дегенерации адипоцита. На основании этих данных можно усомниться в трансдифференциации из белых адипоцитов бурых. Формирование бурой ткани в условиях эксперимента может объясняться наличием стволовых клеток-предшественников, которые, по-видимому, в течение всей жизни организма присутствуют в жировых депо человека и животных.
В наших предыдущих исследованиях для изучения иннервации сердца и других органов млекопитающих нередко применялся сравнительный анализ специальных нейроиммуногистохимических маркеров: белка PGP 9.5, ТН и Syn [9, 26]. В настоящей работе применение комплекса этих маркеров позволило установить, что белая и бурая ЭЖТ и ее артериальные сосуды богато иннервированы парасимпатическими и симпатическими нервными волокнами. Эти данные дополняют сведения о наличии в дольках межлопаточного бурого жира [19, 27] нервных волокон, имеющих разную пептидергическую природу (субстанция P, NPY, CGRP, SP). Их обнаружение, по мнению авторов, согласуется с гипотезой о сенсорной и трофической функциях перечисленных пептидов.
В настоящем исследовании установлено, что чередование и распределение нервных структур разной медиаторной природы в ЭЖТ заметно изменяется в течение онтогенеза животного. Эти факты могут свидетельствовать о функциональных изменениях липидного обмена в тканях сердца. Несмотря на то, что парасимпатические нервные структуры (холинергические ганглии, нервные пучки и сплетения) появляются в субэпикарде крысы раньше катехоламинергических или симпатических, роль постганглионарных симпатических нервных волокон имеет не менее существенное значение. В настоящей работе иннервация впервые нами обнаружена в “эпителиальных тельцах” на стадиях Р1–Р14. Показано, что уже на этих этапах онтогенеза TH+пучки катехоламинергических симпатических нервных волокон и их терминальные сплетения, состоящие из варикозных аксонов, присутствуют в тельцах. Наиболее иннервируемой в онтогенезе оказалась бурая жировая ткань. По нашему мнению, именно она является более чувствительной к нервной стимуляции в ответ на внешние и внутренние факторы раздражения.
ЗАКЛЮЧЕНИЕ
С помощью иммуногистохимических реакций на белок PGP 9.5, тирозингидроксилазу и синаптофизин в “подушках” и дольках белой и бурой жировых тканях основания сердца крысы на разных этапах онтогенеза выявлены различные катехоламинергические и холинергические нервные аппараты: ганглии, скопления хромаффинных клеток, нервные стволы, пучки сплетения, отдельные волокна, синаптические окончания. Установлено, что парасимпатические и симпатические постганглионарные нервные волокна проникают в дольки жировой ткани в составе ремаковских тяжей варикозных аксонов по артериальным сосудам, образуют терминальные синаптические сплетения типа en passant и участвуют в иннервации адипоцитов обоих типов ЭЖТ. Установлены важные различия в иннервации тканей. Тяжи терминальной синаптической сети симпатических и парасимпатических варикозных аксонов локализуются преимущественно в очагах бурой и смешанной жировой ткани, где находятся в тесной связи не только со стенкой артериальных сосудов, но и с бурыми адипоцитами. В белой жировой ткани тяжи варикозных аксонов выявляются в основном вокруг артериальных сосудов и практически отсутствуют между ее адипоцитами. Установленный нами факт наличия парасимпатических и симпатических нервных сплетений в ЭЖТ у новорожденных животных может свидетельствовать о важной роли автономной нервной системы в адипогенезе и липидном обмене, начиная с ранних сроков постнатального развития.
Список литературы
Афанасьев ЮИ, Колодезникова ЕД (1995) Бурая жировая ткань. Иркутск. ИГУ. [Afanas’ev YuI, Kolodeznikova ED (1995) Brown adipose tissue. Irkutsk. IGU. (In Russ)].
Дедов ИИ, Мельниченко ГА, Бутрова СА (2006) Жировая ткань как эндокринный орган. Ожирение и метаболизм 1: 7–13. [Dedov II, Melnichenko GA, Butrova SA (2006) Adipose tissue as an endocrine organ. Obesity and Metab 1: 7–13. (In Russ)].
Учасова ЕГ, Груздева ОВ, Дылева ЮА, Акбашева ОЕ (2018) Эпикардиальная жировая ткань: патофизиология и роль в развитии сердечно-сосудистых заболеваний. Бюл сибирск мед 17 (4): 254–263. [Uchasova EG, Gruzdeva OV, Dyleva Yu A, Akbasheva OE (2018) Epicardial adipose tissue: pathophysiology and role in the development of cardiovascular diseases. Bull Siber Med 17 (4): 254–263. (In Russ)]. https://doi.org:10.20538/1682-0363-2018-4-254-263
Красильникова TB, Симоненкова АВ, Карабицкая НЛ, Шапкова ЕА, Баранова ЕИ (2012) Особенности строения и функционирования жировой ткани в норме и при развитии ожирения. Ученые записки СПбГМУ им акад ИП Павлова 19(3): 99–107. [Krasilnikova EI, Simonenkova AV, Karabitzkaya NL, Shapkova EA, Baranova EI (2012) Features of the adipose tissue structure and functions in the norm and in obesity. Uchenye zapiski SPbGMU im akad IP Pavlova 19(3): 99–107. (In Russ)].
Титов ВН (2015) Функциональное различие висцеральных жировых клеток и подкожных адипоцитов. Клин мед 93 (2): 14–23. [Titov VN (2015) The functional difference between visceral fatty cells and subcutaneous adipoytes. Klin med 93 (2): 14–23. (In Russ)].
Bartness TJ, Ryu V (2015) Neural control of white, beige and brown adipocytes. Int J Obesity Suppl 5: S35.https://doi.org/10.1038/ijosup.2015.9
Mulya A, Kirwan JP (2016) Brown and Beige Adipose Tissue: Therapy for Obesity and Its Comorbidities? Endocrinol Metab Clin North Am 45(3): 605–621.https://doi.org/10.1016/j.ecl.2016
Harms M, Seale P (2013) Brown and beige fat: development, function and therapeutic potential. Nat Med 19(10): 1252–1263. https://doi.org/10.1038/nm.3361
Chumasov EI, Petrova ES, Korzhevskii DE (2022) Peculiarities of the Innervation of Epicardial Adipose Tissue in a Rat with Aging (Immunohistochemical Study). Advanc Gerontol 12(3): 310–316.https://doi.org/10.1134/S2079057022030055
Sacks HS, Fain JN (2007) Human epicardial adipose tissue: a review. Am Heart J 153(6): 907–917. https://doi.org/10.1016/j.ahj.2007.03.019
Iacobellis G, Willens HJ (2009) Echocardiographic epicardial fat: a review of research and clinical applications. J Am Soc Echocardiogr 22(12): 1311–1319.https://doi.org/10.1016/j.echo.2009.10.013
McKenney ML, Schultz KA, Boyd JH, Byrd JP, Alloosh M, Teague SD, Arce-Esquivel AA, Fain JN, Laughlin MH, Sacks HS, Sturek M (2014) Epicardial adipose excision slows the progression of porcine coronary atherosclerosis. J Cardiothorac Surg 9: 2.https://doi.org/10.1186/1749-8090-9-2
Payne GA, Kohr MC, Tune JD (2012) Epicardial perivascular adipose tissue as a therapeutic target in obesity-related coronary artery disease. Br J Pharmacol 165(3): 659–669.https://doi.org/10.1111/j.1476-5381.2011.01370.x
Giordano A, Morroni M, Santone G, Marchesi GF, Cinti S (1996) Tyrosine hydroxylase, neuropeptide Y, substance P, calcitonin gene-related peptide and vasoactive intestinal peptide in nerves of rat periovarian adipose tissue: an immunohistochemical and ultrastructural investigation. J Neurocytol 25(2): 125–136.https://doi.org/10.1007/BF02284791
Chi J, Lin Z, Barr W, Crane A, Zhu XG, Cohen P (2021) Early postnatal interactions between beige adipocytes and sympathetic neurites regulate innervation of subcutaneous fat. Elife10: e64693.https://doi.org/10.7554/eLife.64693
Grigorev IP, Korzhevskii DE (2018) Current technologies for fixation of biological material for immunohistochemical analysis (Review). Modern Technol Med 10(2): 156–165.https://doi.org/10.17691/stm2018.10.2.19
Коржевский ДЭ, Колос ЕА (2013) Белок PGP 9.5 и его использование в качестве функционального маркера в нейроморфологии. Мед акад журн 13 (4): 29–35. [Korzhevskii DE, Kolos EA (2013) Protein PGP 9.5 and its use as a functional marker in neuromorphology. Med Acad J 13(4): 29–35. (In Russ)].
Колос ЕА, Григорьев ИП, Коржевский ДЭ (2015) Маркер синаптических контактов – синаптофизин. Морфология147(1): 78–82. [Kolos EA., Grigoriyev IP, Korzhevskiy DE (2015) A synaptic marker synaptophysin. Morphologija 147 (1): 78–82. (In Russ)].
Norman D, Mukherjee S, Symons D, Jung RT, Lever JD (1988) Neuropeptides in interscapular and perirenal brown adipose tissue in the rat: a plurality of innervation J Neurocytol 17(3): 305–311.https://doi.org/10.1007/BF01187853
Чумасов ЕИ, Петрова ЕС, Коржевский ДЭ (2018) Развитие субэпикардиального нервного сплетения у крысы в постнатальном периоде. Морфология 154(4): 20–26. [Chumasov EI, Petrova ES, Korzhevskii DE (2018) Development of rat subepicardial nerve plexus in the postnatal period. Morphologija 157 (4): 20–26. (In Russ)].
Himms-Hagen J, Cui J, Lynn Sigurdson S (1990) Sympathetic and sensory nerves in control of growth of brown adipose tissue: Effects of denervation and of capsaicin. Neurochem Int 17(2): 271–279.https://doi.org/10.1016/0197-0186(90)90149-n
Geerling JJ, Boon MR, Kooijman S, Parlevliet ET, Havekes LM, Romijn JA, Meurs IM, Rensen PC (2014) Sympathetic nervous system control of triglyceride metabolism: novel concepts derived from recent studies. J Lipid Res 55(2): 180–189. https://doi.org/10.1194/jlr.R045013
Chi J, Wu Z, Choi CHJ, Nguyen L, Tegegne S, Ackerman SE, Crane A, Marchildon F, Tessier-Lavigne M, Cohen P (2018) Three-Dimensional adipose tissue imaging reveals regional variation in beige fat biogenesis and PRDM16-Dependent sympathetic neurite density. Cell Metab 27: 226–236. https://doi.org/10.1016/j.cmet.2017.12.011
Соколов ВИ, Чумасов ЕИ, Атагимов МЗ (2006) Гистогенез интерреналовой закладки надпочечника свиньи (Sus domestica). Морфология 129(3): 59–62. [Sokolov VI, Chumasov YeI, Atagimov MS (2006) The histogenesis of interrenal primordium of pig (Sus domestica) adrenal gland. Morphologija 129 (3): 59–62. (In Russ)].
Sanchez-Gurmaches JJ, Hung CM, Sparks CA, Tang Y, Li H, Guertin DA (2012) PTEN loss in the Myf5 lineage redistributes body fat and reveals subsets of white adipocytes that arise from Myf5 precursors. Cell Metab 16: 348–362. https://doi.org/10.1016/j.cmet.2012.08.003
Чумасов ЕИ, Колос ЕА, Петрова ЕС, Коржевский ДЭ (2020) Иммуногистохимия периферической нервной системы. СПб. СпецЛит. [Chumasov EI, Kolos EA, Petrova ES, Korzhevskij DE (2020) Immunohistochemistry of the peripheral nervous system. SPb. SpecLit. (In Russ)].
De Matteis R, Ricquier D, Cinti S (1998) TH-, NPY-, SP-, and CGRP-immunoreactive nerves in interscapular brown adipose tissue of adult rats acclimated at different temperatures: an immunohistochemical study. J Neurocytol 27(12): 877–886.https://doi.org/10.1023/a:1006996922657
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова